MAKALAH KIMIA ANALISIS I
Uji Pendahuluan dan Tata Nama Kation
Oleh:
Cecep Rudiana 0621.10.015 Diana Mekar Jayanti 0621.10.014 Esti Andarini 0621.10.009 Sartika Anggun Sari 0621.10.019
Yuniasari 0621.10.011
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS PAKUAN
BOGOR 2011
1
Uji Pendahuluan dan Tata Nama Kation
Analisis kualitatif atau disebut juga analisis jenis adalah penentuan macam atau jenis zat atau komponen-komponen bahan yang dianalisis. Dalam melakukan analisis, kita mempergunakan sifat-sifat zat atau bahan, baik sifat fisik maupun sifat kimianya. Misalnya, ada suatu sampel cairan dalam gelas kimia. Bila kita ingin tahu apa sampel cair itu maka kita lakukan analisis kualitatif terhadap sampel cairan itu. Caranya ialah dengan kita menentukan sifat fisik sampel tersebut, yaitu: warna, bau, indeks bias, titik didih, massa jenis, dan kelarutan. Begitu pula bila sampel berupa padatan, kita tentukan bagiamanakah warna, bau, warna nyala, titik leleh, bentuk kristal, dan kelarutannya. Skala Analisis Kualitatif, diantaranya:
1. Skala makro
Kuantitas zat yang dikerjakan 0,5 – 1 gr dan volume larutan yang diambil untuk analisa sekitar 20 ml.
2. Skala semimikro
Kuantitas zat yang dikerjakan 0,05 gr dan volume larutan yang diambil untuk analisa sekitar 1 ml.
3. Skala mikro
Kuantitas zat sekitar 0,01 gr.
Tahapan dalam melakukan suatu analisis adalah sebagai berikut: 1. Uji Organoleptik
Uji organoleptik atau uji indera atau uji sensori merupakan cara pengujian dengan menggunakan indera manusia sebagai alat utama untuk pengukuran daya penerimaan terhadap produk. Pengujian organoleptik mempunyai peranan penting dalam penerapan mutu. Pengujian organoleptik dapat memberikan indikasi kebusukan, kemunduran mutu dan kerusakan lainnya dari produk, meliputi: bentuk, warna, bau dan rasa dari senyawa/sampel. Dalam melakukan pengujian tersebut para peneliti menggunakan manusia sebagai obyek yang biasa dinamakan dengan panelis.
2. Uji pendahuluan
Hal ini meliputi pemeriksaan pendahuluan dengan uji kering, pemeriksaan hasil-hasil yang mudah menguap yang diperoleh dengan larutan Natrium hidroksida (untuk
2
amonium), dan dengan asam sulfat encer dan pekat (untuk radikal-radikal asam atau anion).
Tujuan dari uji pendahuluan bisa diperoleh data seperti keasaman, kelarutan, bentuk, rasa, bau dari sampel, dari data itu saja bisa ada dugaan senyawa yang dicari atau ada senyawa-senyawa yang tidak mungkin ada dalam sample. Contoh bila sampel berwarna putih, maka tidak mungkin terdapat kromat atau bikromat, atau senyawa lain yang memiliki warna, sehingga pencarian jadi lebih sempit. Kemudian cek apakah senyawa berbentuk Kristal atau tidak? Bila Kristal kemungkinan besar adalah garam, dari kelarutan bisa dicek senyawanya larut atau tidak. Sehingga dari uji pendahuluan ini arah pengujian bisa dipersempit.
3. Pemeriksaan kation/anion 4. Analisis lanjutan (jika perlu)
Uji Pendahuluan
Uji pendahuluan dapat dilakukan dengan reaksi kering maupun reaksi basah. Reaksi basah dilakukan dengan cara mereaksikan analit dengan suatu pereaksi tertentu. Sedangkan yang termasuk ke dalam reaksi kering adalah sebagai berikut:
1. Uji Pemanasan 2. Uji Pipa tiup 3. Uji nyala
4. Uji Spektroskopi 5. Uji Manik Fosfat
6. Uji Manik Natrium karbonat
Beberapa Metode Pemeriksaan pendahuluan yang dilakukan terhadap suatu cuplikan: 1. Uji Pendahuluan Terhadap Cuplikan Padat Non Logam
a. Penilikan Rupa
Uji Rupa, diamati apakah zat terdiri dari kristal ataukah amorf, bersifat magnetis, memiliki bau atau warna yang khas.
3
kuning CdS, As2S3, FeCl3
hijau Cr2O3, FeSO4.7H2O
biru garam-garam tembaga (II) berhidrat b. Pemanasan dalam Tabung Uji
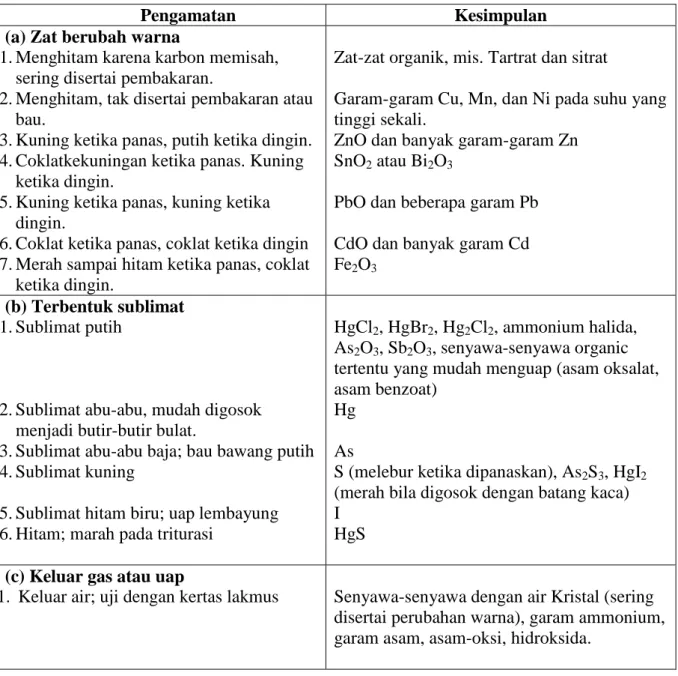
Uji Pemanasan, ditaruh 4-5 mg zat dalam tabung uji kering, panaskan dengan hati-hati, naikkan suhu dengan berangsur-angsur, dan diperhatikan setiap perubahan yang terjadi dengan seksama. Dapat terjadi sublimasi, pelelehan, atau penguraian yang disertai dengan perubahan warna. Selain itu dapat terjadi pembebasan gas yang dapat dikenali dari sifat-sifat khas tertentu.
Tabel Uji Pemanasan
Pengamatan Kesimpulan
(a) Zat berubah warna
1. Menghitam karena karbon memisah, sering disertai pembakaran.
2. Menghitam, tak disertai pembakaran atau bau.
3. Kuning ketika panas, putih ketika dingin. 4. Coklatkekuningan ketika panas. Kuning
ketika dingin.
5. Kuning ketika panas, kuning ketika dingin.
6. Coklat ketika panas, coklat ketika dingin 7. Merah sampai hitam ketika panas, coklat
ketika dingin.
Zat-zat organik, mis. Tartrat dan sitrat
Garam-garam Cu, Mn, dan Ni pada suhu yang tinggi sekali.
ZnO dan banyak garam-garam Zn SnO2 atau Bi2O3
PbO dan beberapa garam Pb CdO dan banyak garam Cd Fe2O3
(b) Terbentuk sublimat 1. Sublimat putih
2. Sublimat abu-abu, mudah digosok menjadi butir-butir bulat.
3. Sublimat abu-abu baja; bau bawang putih 4. Sublimat kuning
5. Sublimat hitam biru; uap lembayung 6. Hitam; marah pada triturasi
HgCl2, HgBr2, Hg2Cl2, ammonium halida,
As2O3, Sb2O3, senyawa-senyawa organic
tertentu yang mudah menguap (asam oksalat, asam benzoat)
Hg As
S (melebur ketika dipanaskan), As2S3, HgI2
(merah bila digosok dengan batang kaca) I
HgS (c) Keluar gas atau uap
1. Keluar air; uji dengan kertas lakmus Senyawa-senyawa dengan air Kristal (sering disertai perubahan warna), garam ammonium, garam asam, asam-oksi, hidroksida.
4
Air bersifat basa Air bersifat asam
2. Keluar oksigen (menyalakan lagi sebatang kayu bilang yang membara)
3. Dinitrogen oksida (menyalakan lagi kayu bilah yang membara), keluar uap
4. Asap coklat tua atau kemerahan (oksida-oksida nitrogen); bereaksi asam
5. Keluar karbon dioksida (mengeruhkan air kapur)
6. Keluar karbon monoksida (terbakar dengan nyala biru membentuk karbon dioksida); gas beracun
7. Keluar sianogen (terbakar dengan nyala lembayung dan bau khas); gas yang sangat beracun.
8. Keluar aseton (terbakar dengan nyala cemerlang)
9. Keluar ammonia (bau; merubah kertas lakmus merah menjadi biru; merubah kertas merkurium (I) nitrat menjadi hitam
10. Keluar fosfina (bau ikan; mudah terbakar); sangat beracun
11. Keluar SO2 (bau belerang yang
terbakar; mengubah kertas kalium dikromat menjadi hijau; menghilangkan warna larutan fuksin)
12. Keluar H2S (bau telur busuk; mengubah
kertas Pb(CH3COO)2 menjadi hitam
atau kertas Cd(CH3COO)2 menjadi
kuning)
13. Keluar klor (gas hijau kekuningan; memutihkan kertas lakmus; merubah kertas KI-kanji menjadi biru); sangat
Garam ammonium.
Garam dari asam kuat yang mudah terurai, juga asam-asam.
Nitrat, klorat, perklorat, bromat, iodat,
peroksida, garam-garam-per, dan
permanganate.
Amonium nitrat atau nitrat yang bercampur dengan suatu garam ammonium.
Nitrat atau nitrit dari logam berat
Karbonat, Hidrogen karbonat, oksalat, dan senyawa-senyawa organic.
Oksalat
Sianida dari logam-logam berat, mis. Dari Hg dan Ag; K3[Fe(CN)6]
Asetat
Garam ammonium; kompleks amina tertentu
Fosfit dan hipofosfit
Sulfit normal dan sulfit asam; tiosulfat, sulfat-sulfat tertentu
Sulfida asam; sulfide berhidrat
Klorida-klorida yang tak stabil, mis. Dan Cu, Au dan Pt; klorida=klorida yang disertai zat-zat pengoksid
5
beracun
14. Keluar brom (uap coklat kemerahan; bau menyesakkan nafas; mengubah kertas fluoresein menjadi merah) 15. Keluar iod (uap lembayung yang
mengembun menjadi kristal-kristal hitam)
Sumber-sumber yang serupa seperti untuk klor
Iod bebas dan iodide-iodida tertentu
c. Pewarnaan nyala
Bersihkan sebuah kawat platinum atau nichrome (sebuah alloy nikel-kromium) dengan mencelupkannya ke dalam asam hidroklorat pekat dan kemudian panaskan pada Bunsen. Ulangi prosedur ini sampai kawat tidak menimbulkan warna pada nyala api Bunsen.
Jika kawat telah bersih, basahi kembali dengan asam dan kemudian celupkan ke dalam sedikit bubuk padatan yang akan diuji sehingga ada beberapa bubuk padatan yang menempel pada kawat tersebut. Setelah itu pasang kembali kawat pada nyala Bunsen.
Jika warna nyala memudar, masukkan kembali kawat ke dalam asam dan pasang kembali pada nyala seolah-olah anda sedang membersihkannya. Dengan melakukan ini, anda akan sering melihat kilasan warna yang sangat singkat namun intensif.
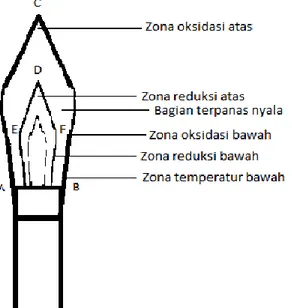
Uji nyala digunakan untuk mengidentifikasi keberadaan ion logam dalam jumlah yang relatif kecil pada sebuah senyawa. Tidak semua ion logam menghasilkan warna nyala. Untuk senyawa-senyawa Golongan 1, uji nyala biasanya merupakan cara yang paling mudah untuk mengidentifikasi logam mana yang terdapat dalam senyawa. Untuk logam-logam lain, biasanya ada metode mudah lainnya yang lebih dapat dipercaya – meski demikian uji nyala bisa memberikan petunjuk bermanfaat seperti metode mana yang akan dipakai. Berikut skema nyala pada bunsen:
6
Warna-warna yang ada pada tabel berikut hanya merupakan panduan. Hampir setiap orang yang melakukan uji nyala berbeda dalam mengamati dan menjelaskan warna yang terjadi. Sebagai contoh, beberapa orang menggunakan kata "merah" beberapa kali untuk menunjukkan beberapa warna yang bisa sangat berbeda satu sama lain. Disamping itu, ada juga yang menggunakan kata seperti "merah padam" atau "merah tua" atau "merah gelap", tapi tidak semua orang mengetahui perbedaan antara kata-kata yang dipakai untuk menunjukkan warna ini.
Tabel Uji Nyala
Logam Warna nyala
Li Merah
Na orange cemerlang terus menerus
K lilac (pink)
Rb merah (lembayung kemerah-merahan)
Cs biru lembayung
Ca orange-merah
Sr Merah
Ba hijau pucat
Cu biru-hijau (sering disertai percikan berwarna putih)
7
Tabel Uji Nyala dengan Kaca Kobalt
Pewarnaan nyala Pewarnaan nyala melalui kaca kobalt
Kesimpulan
Kuning keemasan Lembayung Merah bata
Merah tua agak keunguan Hijau kekuningan
Tak ada warna Merah tua agak keunguan
Hijau muda Ungu Hijau kebiruan Natrium Kalium Kalsium Strontium Barium
Tabel Uji reduksi dengan blok arang
Pengamatan Kesimpulan
1. Zat hancur menjadi serbuk 2. Zat terbakar dengan tiba-tiba
3. Zat melebur dan diserap oleh arang, atau membentuk manik cair
4. Zat tak dapat lebur, dan berpijar, atau membentuk kerak di atas arang
Garam-garam kristalin, mis. NaCl, KCl Nitrat, nitrit, klorat, perklorat, iodat, permanganat
Garam-garam alkali dan beberapa garam alkali tanah
Pakai uji (b) di bawah
Tabel Uji Pemijaran dengan Na2CO3 di atas arang
Pengamatan Kesimpulan
1. Putih, tak dapat lebur, dan berpijar ketika panas
2. Kerak tanpa logam: Putih, kuning ketika panas Putih, bau bawang putih Coklat
3. Kerak dengan logam Kerak putih; logam getas Kerak kuning; logam getas
Kerak kuning; logam dapat
ditempa; menodai kertas 4. Logam tanpa kerak
Partikel-partikel logam abu-abu yang tertarik oleh magnet
Manik-manik yang dapat ditempa
BaO, SrO, CaO, MgO (residu bersifat basa terhadap kertas lakmus), Al2O3, ZnO, SiO2
(residu tak basa terhadap kertas lakmus)
ZnO As2O3 CdO Sb Bi Pb Fe, Ni, Co
Ag dan Sn (putih), Cu (serpih-serpih merah), Au
8
Tabel Uji Pemijaran dengan Garam-Garam Co
Pengamatan Kesimpulan
1. Residu biru 2. Residu hijau
3. Residu merah jambu
Al2O3, fosfat, arsenat, silikat, borat
ZnO MgO
Warna nyala dihasilkan dari pergerakan elektron dalam ion-ion logam yang terdapat dalam senyawa. Sebagai contoh, sebuah ion natrium dalam keadaan tidak tereksitasi memiliki struktur 1s22s22p6. Jika dipanaskan, elektron-elektron akan mendapatkan energi dan bisa berpindah ke orbital kosong manapun pada level yang lebih tinggi, sebagai contoh, berpindah ke orbital 7s atau 6p atau 4d atau yang lainnya, tergantung pada berapa banyak energi yang diserap oleh elektron tertentu dari nyala.
Karena sekarang elektron-elektron berada pada level yang lebih tinggi dan lebih tidak stabil dari segi energi, maka elektron-elektron cenderung turun kembali ke level dimana sebelumnya mereka berada – tapi tidak musti sekaligus. Sebuah elektron yang telah tereksitasi dari level 2p ke sebuah orbital pada level 7 misalnya, bisa turun kembali ke level 2p sekaligus. Perpindahan ini akan melepaskan sejumlah energi yang dapat dilihat sebagai cahaya dengan warna tertentu.
Akan tetapi, elektron tersebut bisa turun sampai dua tingkat (atau lebih) dari tingkat sebelumnya. Misalnya pada awalnya di level 5 kemudian turun sampai ke level 2. Masing-masing perpindahan elektron ini melibatkan sejumlah energi tertentu yang dilepaskan sebagai energi cahaya, dan masing-masing memiliki warna tertentu. Sebagai akibat dari semua perpindahan elektron ini, sebuah spektrum garis yang berwarna akan dihasilkan. Warna yang anda lihat adalah kombinasi dari semua warna individual.
Besarnya lompatan/perpindahan elektron dari segi energi, bervariasi dari satu ion logam ke ion logam lainnya. Ini berarti bahwa setiap logam yang berbeda akan memiliki pola garis-garis spektra yang berbeda, sehingga warna nyala yang berbeda pula.
d. Reduksi pada Blok Arang
Oksida logam-logam yang kurang elektropositif (Mn, Zn, Cd, Fe, Co, Ni, Sn, Pb, Cu, Bi, Hg dan Ag) dapat direduksi oleh karbon menjadi logam bebas. Bila
9
hasil reaksi-pipa tiup berwarna kuning, mungkin disebabkan garam khromat atau senyawaan belerang.
Dipanaskan 3-4 mg zat dalam sebuah lubang kecil yang dicukilkan dalam sepotong blok arang dalam nyala pipa tiup. Dicampurkan 3-4 mg dengan Natrium karbonat anhidrat dengan volume dua kali volume zat. Ditaruh campuran ini dalam lubang dari sepotong arang dan dipanaskan dalam nyala reduksi pipa tiup.
e. Reaksi Manik Boraks
Berbagai senyawaan logam akan membentuk metaborat dengan boraks, yang berwarna khas. Warna tersebut akan terjadi dalam nyala api oksidasi atau nyala reduksi.
Kawat platina yang bersih dan ujungnya membentuk cincin kecil dipijarkan, lalu dimasukkan ke dalam serbuk boraks. Jika kemudian dipanaskan lagi dengan hati-hati, sehingga boraks yang menempel pada kawat itu akan mencair dan mulai berbuih.
Akhirnya terbentuk suatu “tetes” yang jernih. “tetes” yang membeku setelah didinginkan, disebut “mutiara boraks”. Mutiara panas dimasukkan ke dalam serbuk atau larutan contoh yang akan diuji, sehingga sedikit zat tersebut menempel padanya. Lalu dipijarkan dalam nyala oksidasi yaitu pada pinggir kerucut luar nyala-tak-berwarna.Dengan cara yang sama, dibuat pula “mutiara” yang dipijarkan dalam nyala reduksi, yaitu pada pinggir kerucut dalam. Warna-warna “mutiara” yang diperoleh diamati dalam keadaan panas dan dalam keadaan dingin. Yang terakhir adalah yang terpenting.
Tabel Uji Reaksi Manik Boraks
Nyala oksidasi Nyala reduksi Logam
1. Hijau ketika panas; biru ketika dingin
2. Coklat kekuningan atau merah ketika panas; kuning ketika dingin
3. Kuning tua ketika panas, hijau ketika dingin 4. Lembayung (kecubung)
ketika panas dan dingin 5. Biru, ketika panas dan
Tak berwarna ketika panas, merah tak tembus cahaya ketika dingin
Hijau, ketika panas dan dingin
Hijau, ketika panas dan dingin
Tak berwarna, ketika panas
Tembaga
Besi
Kromium Mangan Kobalt
10
dingin
6. coklat kemerahan ketika panas
dan dingin
Biru, ketika panas dan dingin Abu-abu atau hitam dan tak tembus cahaya ketika dingin
Nikel
f. Uji Terhadap ion Amonium
Dididihkan 0,1 gram zat dengan larutan Natrium hidroksida. Dilepaskan amonia, yang dideteksi dari bau dan terjadi perubahan terhadap kertas lakmus merah dan terhadap kertas saring yang direndam dalam larutan merkurium I nitrat (menunjukkan adanya garam amonium).
g. Reaksi oleh Asam sulfat encer
Reaksi oleh Asam sulfat encer, dicampurkan 0,1 gram zat dengan 2 ml Asam sulfat dalam tabung uji yang kecil dan diperhatikan apakah terjadi suatu reaksi dalam keadaan dingin. Dipanaskan perlahan-lahan dan diamati hasilnya.
Tabel Uji Reaksi oleh Asam sulfat encer
Pengamatan Kesimpulan
1. Gas yang tak berwarna dilepaskan dengan bergejolak; gas tak berbau dan menimbulkan kekeruhan bila dialirkan ke dalam air kapur.
2. Uap nitrosos dilepaskan; kenali dari warna coklat kemerahan, dan menjadikan kertas kanji-KI hitam kebiruan.
3. Gas hijau kekuningan dilepaskan; bau
menyesakkan; memerahkan lalu
memutihkan kertas lakmus; mengubah kertas kanji-KI menjadi biru; sangat beracun.
4. Bau asetilena; terbakar dengan nyala yang cemerlang, berasap.
5. Gas tak berwarna dilepaskan dengan bau yang menyesakkan; mengubah kertas saring yang dibasahi larutan kalium dikromat yang telah diasamkan, menjadi hijau; menghilangkan warna dari larutan fuksin.
6. Gas tak berwarna dilepaskan; member uji yang di atas terhadap SO2; belerang
mengendap dalam larutan.
7. Gas tak berwarna dilepaskan; bau telur busuk; menghitamkan kertas saring yang
CO2 dari karbonat atau hidrogen karbonat
(bikarbonat)
NO2 dari nitrit
Cl2 dari hipoklorit
C2H2 dari karbida
SO2 dari sulfit
SO2 dan S dari tiosulfat
11
dibasahi larutan PB(CH3COO)2; kertas
Cd(CH3COO)2 menjadi kuning.
8. Gas tak berwarna dilepaskan; member hasil positif pada uji-uji terhadap H2S di
atas; belerang diendapkan. 9. Bau cuka.
10. Gas tak berwarna dilepaskan; bau amandel pahit; sangat beracun.
11. Gas tak berwarna dilepaskan;
menyalakan lagi bilah kayu yang berpijar.
12. Gas tak berwarna dilepaskan; bau menusuk, seperti bau SO2; menghasilkan
kekeruhan bila dialirkan ke dalam air kapur.
13. Dengan mendidihkan, terbentuk larutan yang kunging dan dilepaskan SO2
(menghilangkan warna larutan fuksin).
H2S dan S dari polisulfida
CH3COOH dari asetat
HCN dari sianida atau dari heksasianoferat (III) dan heksasianoferat (II) yang larut O2 dari peroksida dan garam perokso dari
logam alkali dan alkali tanah CO2 dan sedikit HCNO dari sianat
SO2, dsb. Dari tiosianat
h. Reaksi oleh Asam sulfat pekat
Reaksi oleh Asam sulfat pekat, dicampurkan 0,1 gram dengan 1-2 ml Asam sulfat pekat, dan dipanaskan campuran dengan perlahan-lahan, diamati hasilnya.
Tabel Uji Reaksi oleh Asam sulfat pekat
Pengamatan Kesimpulan
1. Gas yang tak berwarna dilepaskan dengan bau menusuk dan yang berasap dalam udara; asap putih NH4Cl, ketika
menyentuh batang kaca yang dibasahi dengan larutan NH3 pekat; Cl2 dilepaskan
pada penambahan MnO2 produk
pengendapan (ini memutihkan kertas
lakmus; mengubah kertas-KI-kanji
menjadi biru).
2. Gas dilepaskan dengan bau menusuk, warna kemerahan, dan berasap dalam udara lembab; pada penambahan MnO2
produk pengendapan, makin bertambah banyak asap merah dengan bau brom (asap mewarnai kertas kanji yang basah mejadi merah jingga atau kertas fluoresein menjadi merah).
3. Dilepaskan uap lembayung, disertai asap asam yang menusuk, dan sering disertai SO2 dan bahkan H2S.
4. Dilepaskan uap coklat kemerahan (warna
HCl dari klorida
HBr dan Br2 dari bromida
HI dan I2 dari iodida
12
serupa dengan brom); dialirkan ke dalam air, diperoleh asam kromat dan asam
klorida, yang keduanya mudah
diidentifikasi (endapan kuning PbCrO4
dengan larutan NH3 berlebihan, larutan
Pb(CH3COO)2, dan CH3COOH; atau uji
„kromium pentoksida‟).
5. Dilepaskan uap asam yang menusuk, sering diwarnai coklat oleh NO2; warna
tergantung pada penambahan bubutan tembbaga (bila tak ada nitrit).
6. Gas kuning dilepaskan dalam keadaan dingin dengan bau yang khas; ledakan atau
bunyi gemertak ketika dipanaskan
(BAHAYA).
7. Gas hijau kekuningan dilepaskan; bau merangsang; memutihkan kertas lakmus; membuat kertas KI-kanji menjadi biru; sangat beracun.
8. Tabung tampak „berminyak‟ ketika dingin; ketika dipanaskan, dilepaskan gas berbau menusuk yang memakan kaca; bila batang kaca yang dibasahi air dimasukkan ke dalam uap, endapan seperti gelatin dari asam silikat mengendap padanya.
9. Uap ungu dilepaskan dengan ledakan (BAHAYA).
10. Gas tak berwarna dilepaskan; terbakar
dengan nyala biru; tak terjadi
pengarangan.
11. Gas tak berwarna dilepaskan; membuat air kapur menjadi keruh dan juga terbakar
dengan nyala biru; tak terjadi
penghitaman.
12. Gas tak berwarna dilepaskan; terbakar dengan nyala biru dan/atau mengeruhkan air kapur; ketika pemanasan dilanjutkan, dilepaskan SO2 dan residu dalam tabung.
(a) menjadi arang dengan cepat (bau gula yang terbakar).
(b) menjadi arang dengan lambat, disertai uap-uap yang merangsang.
13. Uang yang merangsang dilepaskan. 14. Bau cuka yang menusuk.
15. Asam diwarnai merah tua sedikit keunguan.
16. Asam diwarnai ungu kecoklatan.
17. Gas tak berwarna dilepaskan; menyalakan lagi batang bilah kayu yang berpijar. 18. Gas tak berwarna dilepaskan; terbakar
kromat
HNO2 dan NO2 dari nitrat
ClO2 dari klorat
Cl2 dari klorida, bila ada zat
pengoksid
HF dari flourida atau silikofluorida
Mn2O7 dari permanganat
CO dari format, oksalat, sianida, heksasianoferat (III) atau (II) CO dan CO2 dari oksalat
CO dan CO2 dan SO2 dat (a)
tartrat, (b) sitrat
Benzoat
CH3COOH dari asetat
Galat Tanat
O2 dari peroksida, beberapa garam
perokso atau kromat
13
dengan nyala biru, menghasilkan larutan yang biru tua.
19. Warna menjadi kuning ketika dingin; dengan dipanaskan terjadi reaksi yang keras, menghasilkan COS (terbakar dengan nyala biru), SO2 (menghilangkan
warna larutan fuksin, dsb.) dan S bebas. 20. Uap merah merah dari BR2 (mengubah
kertas fluoresein menjaid merah), dan juga dilepaskan O2.
dari heksasianokobalt(III) COS, SO2 dan S dari tiosianat
Br2 dan O2 dari bromat
i. Uji Terhadap Nitrat/Nitrit
Uji terhadap nitrat atau nitrit, ditambahkan 0,1 gram serbuk alumunium/debu zink/aliase Devarda yang telah dijadikan bubuk halus kepada larutan yang telah didinginkan dan dipanaskan campuran dengan perlahan-lahan.
j. Uji Borat
Buatlah pasta dari zat yang asli dengan Kalium fluorida dan asam sulfat pekat. Pegang sedikit pasta ini dalam lubang ose platina, dimasukkan ke dalam nyala Bunsen bagian luar pada dasar api. Nyala hijau yang disebabkan oleh Boron trifluorida menunjukkan adanya Borat. Barium dan tembaga tidak mengganggu bila diuji dengan metode ini. Cara lain adalah dengan menggunakan pipa kapiler.
Dimasukkan 0,1 gram zat ke dalam tabung uji, kemudian ditambahkan 1-2 ml asam sulfat pekat dengan cara ditetes. Ditambahkan 5-6 ml metanol ke dalam tabung setetes demi setetes. Kemudian dipasang ke pipa kapiler, lalu ditiup perlahan-lahan dan arahkan uap yang keluar dari pipa kapiler ke dalam nyala Bunsen yang tidak berwarna.
Jika Borat positif, maka ditunjukkan dengan nyala berwarna hijau yang khas dari Metil borat yang mudah menguap.
2. Uji Pendahuluan Terhadap Cuplikan Logam
0,5 gr zat diolah dengan 10 ml asam nitrat, dipanaskan perlahan-lahan sampai pengeluaran uap merah berhenti, diuapkan sampai hampir kering, ditambah air panaskan lalu disaring.
3. Uji Pendahuluan Terhadap Cuplikan Cairan a. Diamati warna dan bau
14
b. Uji reaksinya terhadap lakmus/indikator
c. Uapkan cairan sampai kering. Secara hati-hati cium uap yang keluar. Residu yang padat diselidiki seperti pengujian untuk zat padat dan bukan logam. d. Jika larutan bereaksi basa, harus dikerjakan uji-uji sebagai berikut:
Peroksida dan garam-perokso (misalnya H2O2 dan Na2BO3).
Hidroksida dan karbonat.
e. Jika larutan yang asli bersifat asam, maka dibuat pada volume tertentu menjadi basa dengan menggunakan larutan amonia dalam air sebelum diuapkan di atas penangas air. Ini akan mencegah hilangnya asam-asam yang mudah menguap, seperti asam klorida dan asam borat. Residu diselidiki.
4. Uji Pendahuluan Terhadap Zat-zat yang tidak larut
Zat yang tak larut adalah zat yang tak dapat dilarutkan oleh asam pekat atau air raja. Yang umum dijumpai dalam analisa : Senyawa perak-halogen (AgCl, AgBr, AgI), BaSO4, PbSO4 . Zat-zat yang tak dapat dilarutkan oleh asam-asam pekat (HCl/HNO3)
atau oleh aqua regia disebut sebagai zat-zat tak larut. Contoh zat-zat tak larut: AgCl, AgBr, AgI, AgCN, SrSO4, BaSO4, PbSO4, Al2O3, Cr2O3, Fe2O3, SnO2, SbO4, TiO4,
ThO2, WO3.xH2O, PbCrO4 yang telah dileburkan dan mineral-mineral tertentu
(CaF2/Fluorspar), FeCr2O4/Batu besi krom, Cu2[Fe(CN)6], Zn2[Fe(CN)6], dan berbagai
silikat, SnS2 (emas mosaik), C dan S silisida-silisida logam, karborundum.
Metode pengujiannya adalah sebagai berikut: a. Diperhatikan warna dan rupa
b. Diselidiki pengaruh dari panas
c. Dipanaskan dengan Natrium karbonat di atas arang d. Dipanaskan dengan Asam sulfat pekat
e. Dipanaskan di atas kawat platinum dalam zona reduksi dari nyala Bunsen f. Dipakai uji manik mikroskomik
g. Dipanaskan dengan Natrium karbonat dan Kalium nitrat h. Dididihkan dengan larutan Natrium hidroksida
i. Dipanaskan dengan Asam iodida pekat j. Diolah dengan larutan Amonium sulfida
15
Tata Nama Kation
Kation-kation dapat memiliki lebih dari satu nama. Cara pemberian nama suatu kation adalah dengan menggunakan nama logam dan diikuti oleh muatan ion yang dituliskan dengan angka Romawi di dalam tanda kurung. Cara lama pemberian nama suatu kation adalah menggunakan akhiran –o dan –i. Logam dengan bilangan oksidasi rendah diberi akhiran –o. Sementara, logam dengan bilangan oksidasi tinggi diberi akhiran –i. Berikut tabel lambang kation beserta penamaannya:
Kation
Penamaan Kation Penamaan Hg22+ Hg2+ Pb2+ Pb4+ Ag+ Bi 3+ Cu+ Cu2+ Cd 2+ As3+ As5+ Sb5+ Sn2+ Sn4+ Fe2+ Fe3+ Merkuro Merkuri Plumbo Plumbi Argento Bismut Kupro Kupri Kadmium Arsen (III) Arsen (V) Stanno Stanni Ferro Ferri Al3+ Cr3+ Cr6+ Ni2+ Co2+ Co3+ Mn2+ Mn3+ Zn2+ Ba2+ Sr2+ Ca2+ Mg2+ Na+ K+ Au+ Au3+ Kromo Kromi Kobalto Kobaltik Mangano Mangani Ion Zink Ion Barium Ion Stronsium Ion Calsium Ion Magnesium Ion Natrium Ion Kalium Auro Auri16