Jurnal dan Laporan Praktikum
Sintesis Kimia Organik
“
Sintesis Sabun
“
Departemen Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Univesitas Indonesia
Depok
2014 disusun oleh :
Fitriana Maharjanti ( 1106051276) Kelompok : 11
Rekan kerja : 1. Dwi Lestari 2. Iqbal Farhan E.
Judul percobaan : Pembuatan Sabun
Tanggal percobaan : 13 Maret 2014
Tujuan percobaan :
1. Mengetahui cara pembuatan sabun dari asam lemak
2. Mengetahui mekanisme reaksi dari reaksi pembuatan sabun 3. Mengetahui dan memahami prinsip dasar dari saponifikasi
Teori dasar :
Sabun merupan garam natrium atau kalium dari asam lemak rantai panjang. Asam lemak biasanya tersusun atas 12-18 atom karbon. Sumber dari asal lemak berasal dari lemak hewani dan nabati yang merupakan ester. Ester merupakan turunan dari asam karboksilat. Asam lemak memiliki berat molekul yang besar dan tersusun dari alkohol dan gliserol. Secara kimia, lemak dan minyak disebut trigliserida.
Sabun padat biasanya terdiri dari garam natrium dari asam lemak, sedangkan sabun cair terdiri dari garam kalium dari asam lemak. Sabun seperti natrium stearat terdiri dari bagian ujung non polar ( rantai hidrokarbon dari asam lemak) dan ujung lainnya polar ( ion karboksilat).
Na+
O O
-natrium stearat
Karena “like dissolves like”, ujung non polar dari sabun dapat melarutkan noda, dan ujung polarnya akan berdempet dengan air. Oleh karena itu, noda pada permukaan dapat dibersihkan dan tertinggal di air. Aksi dari sabun ini sebagai sebuah agen emulsifier, sebuah zat yang digunakan untuk menghilangkan suatu cairan ( molekul minyak ).
Non polar, larut dalam minyak
Perlakuan dari lemak atau minyak dengan basa kuat seperti NaOH dan KOH menyebabkan mereka terhidrolisis menjadi glyserol dan garam rantai panjang asam lemak.
H2C
Trigliserida basa kuat gliserol sabun
Asam lemak merupakan ester. Ester dapat dihidrolisis dengan penambahan basa kuat melalui reaksi yang dikenal dengan nama saponifikasi. Selain itu, dalam suasan asam, ester dapat terhidrolisis menjadi alkohol dan karboksilat.(Riswiyanto, 2009).
5. Erlenmeyer isap 6. Kertas saring 7. Kertas pH universal
a. Minyak sayur b. Etanol
c. NaOH 25% d. NaCl jenuh e. Aquades
Cara kerja dan data pengamatan :
No. Cara kerja Data pengamatan
1. Memasukkan 5,8 ml minyak sayur, 5 ml etanol dan 5 ml NaOH 25% kedalam erlenmeyer, diaduk hingga homogen.
Minyak sayur berwarna kuning bening
selama 20 menit
3. Didinginkan dalam bak es, dan ditambahkan 37,5 ml NaCl jenuh. Didiamkan sampai terbentuk endapan.
Terbentuk endapan berwarna kuning. Endapan tidak larut dalam NaCl jenuh.
4. Endapan disaring dengan buchner. Dipisahkan endapan dan filtratnya. Endapan dikeringkan, filtratnya diukur pH nya dengan kertas pH universal.
Endapan yang didapat seberat 7,78 gram.
pH filtrat 14.
Pengolahan data
- Volume minyak sayur : 5,8 ml
- Massa jenis minyak sayur : 0,92 gr/ml - Mr trigliserida : 890 gr/mol - Volume NaOH (25%) : 5ml
- Massa jenis NaOH : 1,03 gr/ml - Mr NaOH : 40 gr/mol - Massa jenis Na-stearat : 1,02 gr/ml - Mr Na-stearat : 306,47 gr/mol
Mol trigliserida =
=
M NaOH =
Persamaan reaksi yang terjadi :
H2C
HC
H2C O
O C
O
C17H35
O C
O
C17H35 C
O
C17H35 + 3 NaOH
H2C
HC
H2C OH
OH
C O
C17H35
OH NaO
+ 3
m : 0,0060 mol 32,1875 mol
r : 0,0060 mol 0,0180 mol 0,0060 mol 0,0180 mol
s : - 32,1695 mol 0,0060 mol 0,0180 mol
mol Na-stearat = 0,0180 mol
massa Na-stearat teoritis = mol x Mr = 0,0180 mol x 306,47 gr/mol = 5,5165 gr
massa Na-stearat percobaan = 7,78 gr
%KR =
= 41,03 %
%yield =
Pembahasan
dan sabun dengan penambahan basa kuat. Reaksi hidrolisis ester dengan basa kuat ini disebut saponifikasi, hal ini karena produk hidrolisis merupakan sabun.
Pada percobaan ini dicampurkan NaOH dengan minyak sayur dengan pelarut etanol. Minyak sayur merupakan trigliserida yang menjadi reagen utama penyumbang gugus karboksilat, sedang NaOH merupakan basa kuat yang akan menghidrolisis trigliserida menjadi gliserol dan sabun. Digunakan pelarut etanol untuk melarutkan campuran minyak dan NaOH. Dilakukan pemanasan sebagai katalis untuk mempercepat reaksi saponifikasi. Pemanasan dilalkukan pada penangas air dengan sedikit pengocokan. Pemansaan ini dapat meningkatkan energi kinetik dari partikel-partikel yang ada dalam larutan sehingga kemungkinan partikel untuk saling bertumbukan sangatlah besar, sehingga tumbukan efektif yang dihasilkan akan semakin banyak maka reaksi akan cepat berlangsung. Pemanasan dilakukan selama 20 menit. Setelah larutan larut sempurna dan homogen, larutan dialiri air terlebih dahulu sebelum dimasukkan dalam bak es. Tujuannya agar erlenmeyer tidak pecah karena perubahan suhu yang ekstrem. Larutan dimasukkan dalam bak es untuk mempercepat pengendapan sabun yang akan dihasilkan. Setelah beberapa waktu, endapan sabun mulai terbentuk, endapan yang dihasilkan berbentuk bongkahan dan berwarna kuning pucat. Berikut reaksi umum saponifikasi yang terjadi:
H2C
HC
H2C O
O C
O
C17H35
O C
O
C17H35 C
O
C17H35 + 3 NaOH
H2C
HC
H2C
OH OH
C O
C17H35
OH NaO
+ 3
Trigliserida basa kuat gliserol sabun
buchner. Endapan yang didapat mula-mula dicuci dengan aquades dingin, karena sabun yang dihasilkan sedikit larut dalam aquades dingin. Selain itu pencucian dengan aquades adalah melarutkan pengotor polar yang masih tertinggal dalam endapan. Filtrat hasil penyaringan dilakukan pengecekan pH dengan pH universal, didapatkan pH = 14. Hal ini menunjukkan bahwa sabun yang dihasilkan merupakan garam basa. Endapan yang didapat sebesar 7,78 gram dengan %KR = 41,03 % dan % yield= 141,03 %.
Dari besar %KR yang didapat, terjadi kesalahan dalam percobaan ini antara lain :
a. Kurang bersihnya pencucian alat-alat yang digunakan.
b. Kurang teliti praktikan dalam menimbang reagen yang akan digunakan. c. Reagen yang telah terkontaminasi oleh zat lain.
d. Kurang teliti praktikan pada pembacaan miniskus pada gelas ukur.
Kesimpulan
1. Sabun dapat disintesi dengan mereaksikan minyak(trigliserida) dengan basa kuat.
2. Reaksi saponifikasi adalah reaksi hidrolisis ester oleh basa kuat. 3. Etanol digunakan sebagai pelarut campuran minyak dan NaOH 4. Pemanasan dilakukan untuk mempercepat reaksi, atau sebagai katalis. 5. Digunakan NaCl jenuh untuk melarutkan gliserol sehingga didapatkan
endapan sabun murni.
6. Endapan yang didapat sebesar 7,78 gram dengan %KR= 41,03 % dan %yield= 141,03 %.
7. Endapan yang didapat merupakan garam basa.
Pertanyaan dan jawaban :
1. Kenapa dalam percobaan ini menggunakan campuran asam lemak trigliserida dengan NaOH bukan KOH?
Jawab : Hal ini karena bila digunakan basa KOH masa sabun yang terbentuk ada sabun dalam bentuk cair. K dan Na sama-sama logam alkali, namun K lebih elektropositif, maka dari itu K lebih suka membentuk ion-ion dalam larutan.
2. Bisakah fungsi etanol yang digunakan sebagai pelarut diganti dengan aseton dan n-heksana?
Jawab : Tidak. Produk hasil hidrolisis trigliserida dengan basa kuat adalah gliserol dan garam sabun, keduanya mempunyai kepolaran yang berbeda, maka digunakan etanol yang merupakan pelarut semipolar yang dapat melarutkan keduanya, jika digunakan aseton dan n-heksana yang merupakan pelarut non-polar, maka hanya yang kepolarannya sama yang dapat larut didalamnya.
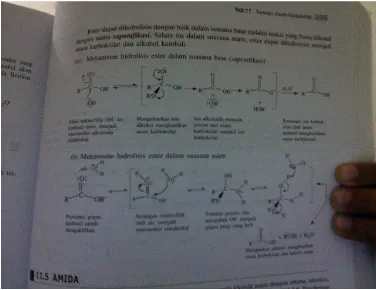
Jawab : asam lemak bila dihidrolisis dengan NaOH maka akan dihasilkan produk sabun dan gliserol, sedang pada HCl akan dihasilkan asam karboksilat dan alkohol. Hal ini karena NaOH merupakan reagen yang menyumbangkan nukleofil OH- yang akan menyerah C pada gugus karboksilat, sedangkan bila digunakan HCl, maka H+ hanya digunakan sebagai katalis.
Berikut gambar mekanisme reaksinya :
Gambar diambil dari buku Kimia Organik karangan Riswiyanto, 2009
Hidrolisis dengan HCl = hidrolisis dalam suasana asam, sedang hidrolisis dengan NaOH merupakan hidrolisis dalam suasana basa.
Daftar pustaka
Kusumadewi, Citra. 2013. Laporan Praktikum Biokimia “Lipid”. Depok : Departemen Kimia FMIPA UI
Nasution, M. Arfin F. 2013. Catatn Penting “Praktikum Sintesis Kimia Organik”. Depok : Departemen Kimia FMIPA UI
Riswiyanto. 2009. Kimia Organik. Jakarta : Erlangga
Material Safety Data Sheet
Natrium stearat
Formula molekul: CH3(CH2)16COONa
Keadaan fisik : padatan
Specific Gravity: 1.02 (Water = 1)
Mr : 306.47 g/mole
Titik Didih : -
Titik Leleh : Decomposes
Kelarutan : -
Stabilitas : stabil
Efek kronis pada manusia :Sangat berbahaya dalam kasus kontak mata (iritan), menelan. Berbahaya dalam kasus kontak kulit (iritan), inhalasi.sedikitberbahaya dalam kasus kontak kulit (permeator). Radang mata ditandai dengan kemerahan, berair, dan gatal-gatal.
Pertolongan pertama : Periksa dan lepaskan lensa kontak. Jangan gunakan salep mata.Cari bantuan medis.
NaCl Jenuh
Nama molekul : Sodium chloride
Keadaan fisik : padatan Nama lain : Salt; Sea Salt
Mr : 58.44 g/mole
Titik Didih : 1413°C (2575.4°F)
Titik Leleh : 801°C (1473.8°F) Kelarutan : larut dalam air
Stabilitas : stabil
Efek kronis pada manusia :Sedikit berbahaya dalam kasus kontak kulit (iritan), kontak mata (iritan), menelan,
NaOH
Formula molekul : NaOH
Keadaan fisik : cairan
Nama IUPAC : Natrium Hidroksida Nama lain : Soda kaustik
Mr : 1,03 g/cm 3
Titik Didih : 1388 ° C (2530,4 ° F)
Titik Leleh : 318 °C, 591 K, 604 °F
Kelarutan : larut dalam air dingin Stabilitas : stabil
Efek kronis pada manusia : Berbahaya dalam kasus kontak kulit (iritan), kontak mata (iritan), menelan, inhalasi.
Pertolongan pertama : Periksadan lepaskan jika adalensa kontak.Dalam kasus terjadi kontak, segera sirammatadengan banyak airsekurang-kurangnya 15 menit.Air dingindapat digunakan.Dapatkan perawatanmedis dengan segera.
Etanol
Formula molekul : C2H5OH
Keadaan fisik : liquid Mr : 1.32 g/cm3
Titik Didih : > 760C (168,80F)
Titik Leleh : -113,840C (-172,90F) Kelarutan : larut dalam air dingin
Stabilitas : stabil
Efek kronis pada manusia :Sangat berbahaya dalam kasus kontak kulit (korosif, iritan), kontak mata (iritan, korosif), menelan, inhalasi.