Pemanfaatan Zingiber officinale (Jahe) untuk Biosintesis Nanopartikel Perak
Ratih Ridhowati, Dr. Susiani Purbaningsih, DEA., & Dr.Ing. Cuk ImawanBiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia E-mail: [email protected]
Abstrak
Air rebusan jahe telah berhasil dimanfaatkan sebagai reduktor untuk biosintesis nanopartikel perak. Biosintesis dilakukan dengan mencampurkan air rebusan rimpang jahe dan larutan AgNO3
yang kemudian diinkubasi selama 24 jam. Karakterisasi larutan hasil reaksi dilakukan dengan kolorimetri dan spektroskopi UV-Vis. Variabel preparasi yang diteliti adalah varietas jahe yaitu jahe gajah, jahe merah, dan jahe emprit, fase pertumbuhan yaitu bagian aanakan dan indukan rimpang, preparasi bentuk simplisia yaitu bentuk irisan kering dan serbuk, perlakuan mekanik dengan pengadukan, dan penambahan asam askorbat. Hasil kolorimetri menunjukkan bahwa larutan berubah warna dari bening ke kuning kecokelatan yang sesuai dengan warna indikator larutan nanopartikel perak. Hasil spektrofotometri UV-Vis larutan mempunyai nilai absorbansi di panjang gelombang sekitar 420 nm yang bertepatan dengan nilai panjang gelombang
absorbansi nanopartikel perak, dengan demikian rimpang jahe dapat digunakan sebagai reduktor biosintesis nanopartikel perak. Di antara varietas jahe, jahe gajah menghasilkan nanopartikel perak yang paling baik, yaitu mempunyai nilai absorbansi 2,2 ± 0,4. Fase pertumbuhan yang baik
untuk biosntesis adalah penggunaan anakan rimpang sebagai bahan dasar simplisia. Bentuk simplisia iris kering lebih baik daripada bentuk serbuk. Perlakuan reaksi tanpa pengadukan selama proses reaksi menghasilkan kualitas nanopartikel perak yang lebih baik. Penambahan asam askorbat mempertinggi konsentrasi nanopartikel perak hasil reaksi.
Kata kunci : jahe, variabel proses, variabel simplisia, variabel tumbuhan.
Abstract
Infution water of ginger has been successfully used as a reductant for biosynthesis of silver nanoparticles. Biosynthesis made by mixing infution water of ginger rhizome and AgNO3 solution then incubated for 24 hours. Characterization of the resulting solution is performed by colorimetry of solution and UV-Vis spectrosphotometry. Preparation variables studied were varieties of ginger: gajah ginger, red ginger, and emprit ginger, growth phase: part of tillers and main rhizomes, form of simplicia: powder and slices dried, mechanical treatment by stirring solution, and ascorbic acid addition. The colorimetry results showed that solution changes from clear to yellow brownish that indicator of the silver nanoparticles solution. Spektrophotometry result showed that the solution has a value of absorbance at a wavelength of about 420 nm which coincides with the wavelength of the absorbance value of silver nanoparticles, thus the ginger rhizome can be used as a reductant biosynthesis of silver nanoparticles. Among the varieties of ginger, gajah ginger produce silver nanoparticles which were the best, which has an absorbance value of 2.2 ± 0.4. Based on characterization results, good preparation variable in this experiment
materials with sliced rhizome better than by powder, and treatment without stirring the solution during the reaction process to produce quality silver nanoparticles better. The addition of ascorbic acid can increase the silver nanoparticles product.
Keywords : ginger, plant preparation variable, plant variables, process variables.
PENDAHULUAN
Nanopartikel perak merupakan partikel perak berukuran 1-100 nm. Nanopartikel perak memiliki kelebihan dibandingkan dengan nanopartikel besi dan emas. Kelebihan nanopartikel perak yaitu stabil pada suhu tinggi (Duran dkk. 2007; Prathnaa dkk. 2011), dapat berperan sebagai konduktor sekaligus katalisator (Prathnaa dkk. 2011), serta dapat menghambat
pertumbuhan bakteri (Duran dkk. 2007; Thakkar dkk. 2010; Gopinath dkk. 2012), virus (Thakkar dkk. 2010), dan mikroorganisme eukariot (Krishnaraj dkk. 2010; Thakkar dkk. 2010). Produksi (sintesis) nanopartikel perak dalam skala industri masih menggunakan reduktor kimia seperti natrium borohidrit. Natrium borohidrit sukar diurai sehingga tidak ramah lingkungan (Sun & Luo 2005; Dong dkk. 2008). Oleh karena itu, perlu ada metode alternatif sintesis nanopartikel yang ramah lingkungan.
Sejak tahun 2000, para peneliti menemukan bahwa biosintesis dapat dijadikan metode alternatif untuk memproduksi nanopartikel perak. Biosintesis nanopartikel perak dapat
menggunakan jahe sebagai sumber reduktor (Kumar dkk. 2011; Singh dkk. 2011). Bagian tanaman jahe yang digunakan dalam biosintesis nanopartikel perak adalah bagian rimpang (Sathishkumar dkk. 2010; Singh dkk. 2011). Oleh sebab itu, penulis menggunakan bagian rimpang jahe sebagai sumber reduktor dalam biosintesis nanopartikel perak.
BAHAN dan METODE Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Fisiologi Tumbuhaan, Departemen Biologi,
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia (FMIPA UI), serta Lab.
Smart System Technology, Departemen Fisika, FMIPA UI selama 6 bulan.
Alat- alat yang akan digunakan dalam penelitian ialah timbangan analitik (Shimadzu LIBROR AEL- 200), spektrofotometer UV-VIS (GENESYS 10S UV-Vis), pemanas listrik dan pengaduk magnetik (IKAMAG RCT), mikropipet 1-5 ml (BOECO ), blender (PHILLIP), Erlenmeyer 500 ml, kuvet disposable 280 – 700 nm (Kartel ), botol vial 30 ml, cutter, kotak kayu, amplop berwarna coklat, dan kamera digital (Canon A2300).
Bahan
Bahan yang akan digunakan dalam penelitian meliputi rimpang jahe gajah, jahe emprit, jahe merah, kunyit, AgNO3 (Dhucefa Biochemie), aquabides, asam askorbat, dan kertas saring
Whatman no.1.
Biosintesis nanopartikel perak
Proses biosintesis nanopartikel perak dilakukan dengan mencampurkan 0,5 ml air
rebusan rimpang dan 5 ml AgNO3 1 mM dalam botol fial. Kemudian, segera larutan sampel itu
difoto lalu 1,5 ml larutan sampel dikaraktersasi dengan spektrofotometer UV-Vis. Selanjutnya, 1,5 ml larutan sampel itu dikembalikan ke botol fial. Setelah itu, larutan sampel diletakkan dalam kotak kayu tertutup pada suhu ruang 25 o C. Setelah 24 jam, sampel difoto dan
dikarakterisasi dengan spektrofotometer UV-Vis kembali.
Variabel yang diuji dalam percobaan biosintesis nanopartikel perak yaitu varietas jahe, vase pertumbuhan, preparasi simplisia, perlakuan mekanik, dan penambahan asam askorbat. Percobaan varietas jahe menggunakan tiga macan air rebusan yaitu air rebusan jahe varietas gajah, jahe varietas emprit, dan jahe varietas merah. Percobaan fase pertumbuhan rimpang jahe ini, air rebusan yang digunakan yaitu air rebusan jahe gajah bagian indukan dan anakan.
Percobaan variabel simplisia ini menggunakan dua macam air rebusan yaitu air rebusan serbuk dan irisan dari rimpang anakan jahe gajah. Percobaan perlakuan mekanik ini dan percobaan selanjutnya, menggunakan air rebusan dari irisan kering anakan rimpang jahe gajah. Percobaan perlakuan mekanik terdiri dari dua macam sampel yaitu sampel yang diberi perlakuan mekanik dengan cara diaduk menggunakan stirrer magnetik selama 2 jam dan sampel yang tidak diaduk. Percobaan asam askorbat terdiri dari tujuh sampel yaitu A,B,C,D,E,F, dan G. Sampel A
(kontrol) dibuat dengan menyampurkan 0,5 ml air rebusan dengan 5 ml larutan AgNO3 1mM.
8% dengan 5 ml larutan AgNO3 1mM. Sampel E, F, dan G masing-masing dibuat dengan
menyampurkan 0,5 ml asam askorbat 4%, 6%, 8% dengan 5 ml larutan AgNO3 1mM dan 0.5 ml
air rebusan jahe gajah iris kering. Sampel G dibuat dengan menyampurkan 5 ml larutan AgNO3
1mM dan 0.5 ml air rebusan jahe gajah iris kering. Selanjutnya, sampel difoto lalu 1,5 ml dari masing-masing sampel dikarakterisasi dengan spektrofotometer UV-Vis. Setelah itu, 1,5 ml sampel itu dikembalikan ke sampel masing-masing lalu diletakkan di dalam kotak kayu tertutup pada suhu 25o C.
Hasil Dan Pembahasan
Pengaruh Varietas jahe
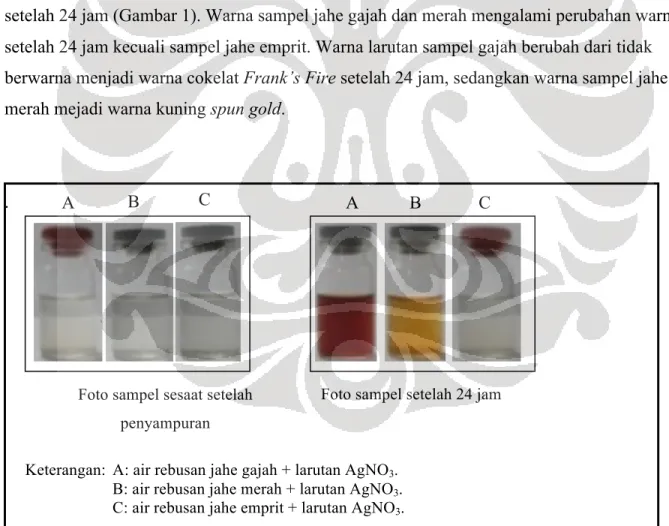
Hasil kolorimetri tiga sampel varietas jahe memperlihatkan perubahan warna sampel setelah 24 jam (Gambar 1). Warna sampel jahe gajah dan merah mengalami perubahan warna setelah 24 jam kecuali sampel jahe emprit. Warna larutan sampel gajah berubah dari tidak berwarna menjadi warna cokelat Frank’s Fire setelah 24 jam, sedangkan warna sampel jahe merah mejadi warna kuning spun gold.
.
Keterangan: A: air rebusan jahe gajah + larutan AgNO3.
B: air rebusan jahe merah + larutan AgNO3.
C: air rebusan jahe emprit + larutan AgNO3.
Gambar 1. Warna sampel jahe gajah, jahe merah, dan jahe emprit sesaat setelah percampuran dan perubahannya setelah 24 jam.
A B C A B C
Foto sampel setelah 24 jam Foto sampel sesaat setelah
penyampuran
Perubahan warna sampel tersebut dapat dijadikan indikator telah terbentuk nanopartikel perak (Gopinath dkk. 2012). Dengan demikian, sampel jahe gajah dan jahe merah diduga telah memproduksi nanopartikel perak. Sampel jahe emprit baru mengalami perubahan warna dari tidak berwarna menjadi kuning spun gold setelah 72 jam. Jadi, ketiga varietas jahe tersebut berpotensi untuk biosintesis nanopartikel perak.
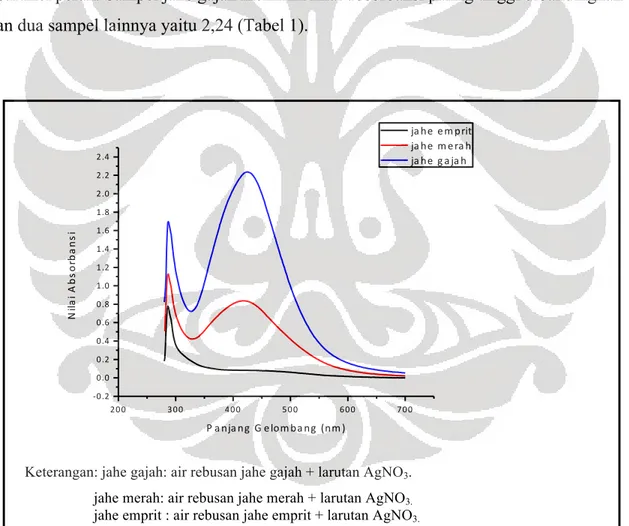
Data hasil spektrofotometri UV-Vis menunjukkan bahwa terdapat puncak absorbansi di antara panjang gelombang 400-500 nm (Gambar 2). Berdasarkan Baia & Simon (2007), puncak absorbansi yang terbentuk pada kisaran panjang gelombang 400 nm merupakan karakteristik dari nanopartikel perak. Sampel jahe gajah memiliki nilai absorbansi paling tinggi dibandingkan dengan dua sampel lainnya yaitu 2,24 (Tabel 1).
200 300 400 500 600 700 -‐0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 2.2 2.4 Ni la i A b so rb a n si P a nja ng G elom ba ng (nm )
ja he em prit ja he m era h ja he g a ja h
Keterangan: jahe gajah: air rebusan jahe gajah + larutan AgNO3. jahe merah: air rebusan jahe merah + larutan AgNO3. jahe emprit : air rebusan jahe emprit + larutan AgNO3.
Gambar 2. Grafik nilai absorbansi sampel jahe gajah, jahe merah, dan jahe emprit dengan spektrofotometer UV-Vis.
Tabel 1 Nilai absorbansi. λ max, dan FWHM dari sampel jahe gajah, jahe merah, dan jahe emprit.
Keterangan: sampel jahe gajah: air rebusan jahe gajah + larutan AgNO3. sampel jahe merah: air rebusan jahe merah + larutan AgNO3. sampel jahe emprit : air rebusan jahe emprit + larutan AgNO3.
Berdasarkan Owen (1996), semakin tinggi nilai absorbansi maka konsentrasi nanopartikel perak dalam sampel semakin tinggi. Dengan demikian, sampel jahe gajah diduga mengandung
nanopartikel perak dengan konsentrasi lebih tinggi daripada dua sampel lainnya. Nilai λ
maksimal tersebut dapat digunakan untuk memprediksi ukuran nanopartikel perak di dalamnya (Solomon dkk. 2007). Nilai λ max sampel jahe gajah dan merah hampir sama yaitu 429 nm dan 417 nm (Tabel 1). Nanopartikel perak dengan nilai λ max 429 dan 417 berukuran 40 nm -50 nm (Solomon dkk. 2007). Dengan demikian, sampel jahe gajah dan merah diduga mengandung nanopartikel perak berukuran 40- 50 nm. Nilai FWHM sampel jahe gajah dan merah hampir sama yaitu 164,6 dan 176,1(Tabel 1). Menurut Parashar dkk. (2009), nilai FWHM berbanding terbalik dengan tingkat homogenitas ukuran nanopartikel perak. Dengan demikian, sampel jahe gajah dan merah memiliki homogenitas ukuran nanopartikel yang hampir sama. Jadi, jahe berpotensi untuk biosintesis nanopartikel perak. Di antara tiga varietas jahe, jahe gajah dianggap paling potensial.
Pengaruh Fase Pertumbuhan Rimpang Jahe
Hasil kolorimetri dua sampel fase pertumbuhan rimpang jahe memperlihatkan perubahan warna sampel setelah 24 jam (Gambar 3). Warna sampel rimpang anakan berubah dari tidak berwarna menjadi cokelat Frank’s Fire sedangkan sampel rimpang indukan menjadi kuning spun gold. Berdasarkan Baia & Simon (2007), warna kuning dan cokelat merupakan warna indikator untuk larutan nanopartikel perak. Dengan demikian, kedua sampel tersebut diduga telah
menghasilkan nanopartikel perak. Berdasarkan percobaan Chhatre dkk. (2012), semakin cokelat warna sampel semakin tinggi konsentrasi nanopartikel perak yang dihasilkan. Dengan demikian,
No. Sampel Absorbansi λ max (nm) FWHM
1. Jahe gajah 2,24 ± 0,45 429 164,6 ± 13,10
2. Jahe merah 0,9 ± 0,52 417 176,1 ± 12,06
diduga sampel anakan memiliki konsentrasi nanopartikel perak yang lebih tinggi daripada sampel indukan.
Keterangan : A: Sampel anakan. B: Sampel indukan.
Sampel anakan: air rebusan jahe gajah anakan + larutan AgNO3.
Sampel indukan: air rebusan jahe gajah indukan + larutan AgNO3.
Gambar 3. Warna sampel anakan dan indukan rimpang jahe sesaat dan setelah 24 jam dengan spektrofotometer UV-Vis. 200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Ni la i A b so rb a n si P a nja ng G elom ba ng (nm ) J . g a ja h induka n J . g a ja h a na ka n Keterangan:
J. gajah anakan: air rebusan jahe gajah bagian anakan + larutan AgNO3. J. gajah indukan: air rebusan jahe gajah bagian indukan + larutan AgNO3.
A B A B
Foto sampel sesaat setelah penyampuran
Foto sampel setelah 24 jam
Gambar 4 Grafik nilai absorbansi sampel jahe gajah indukan dan anakan dengan spektrofotometer UV-Vis.
Nilai absorbansi sampel anakan lebih tinggi daripada indukan yaitu3,4 dan 2,49 (Gambar 4 dan Tabel 2). Nilai absorbansi sampel berbanding lurus dengan konsentrasi nanopartikel perak (Owen 1996). Dengan demikian, sampel anakan diduga memiliki konsentrasi nanopartikel perak lebih tinggi daripada sampel indukan dalam rentang waktu yang sama.
Tabel 2. Nilai absorbansi, λ max, dan FWHM dari sampel indukan dan anakan. No. Sampel Absorbansi λ max (nm) FWHM
1. Anakan 3,40 ± 0.93 420 140,8 ± 18,74 2. Indukan 2,49 ± 0.45 420 141,1 ± 11,07
Keterangan: Sampel indukan: air rebusan jahe gajah indukan + larutan AgNO3. Sampel anakan: air rebusan jahe gajah anakan + larutan AgNO3.
Sampel anakan dan indukan memiliki nilai λ maksimal 420 nm, sedangkan nilai FWHM masing-masing yaitu 140,8 dan 141,1 (Tabel2). Nilai λ maksimal dapat digunakan untuk memperkirakan ukuran (Solomon dkk. 2007) dan nilai FWHM untuk memperkirakan homogenitas ukuran nanopartikel perak (Parashar dkk. 2009). Berdasarkan Solomon dkk. (2007), sampel dengan λ
max 420 nm mengandung nanopartikel berukuran 30-40 nm. Kedua sampel tersebut mimiliki λ
max dan nilai FWHM relatif sama sehingga sampel anakan maupun indukan diduga memiliki ukuran dan homogenitas ukuran nanopartikel perak relatif sama. Jadi, rimpang jahe bagian anakan dianggap lebih potensial daripada bagian indukan untuk biosintesis nanopartikel perak.
Pengaruh Preparasi Simplisia
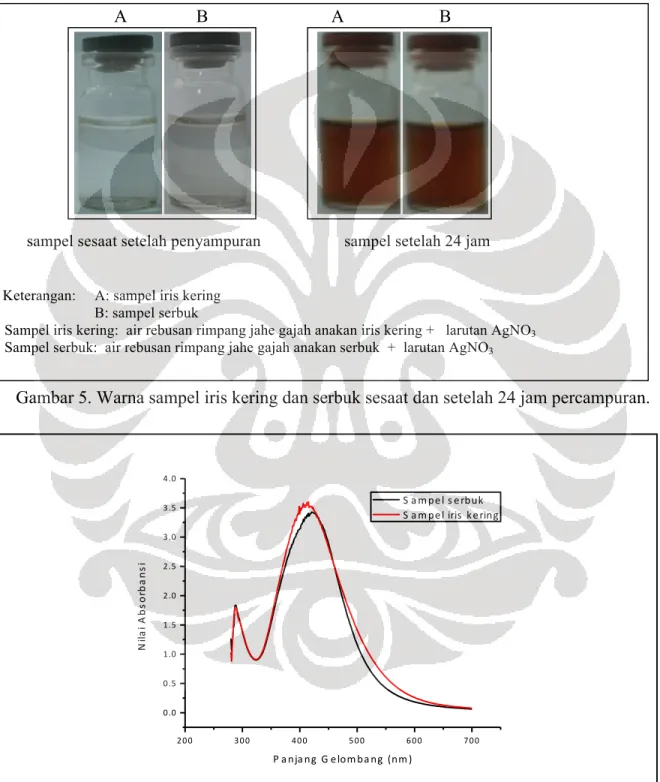
Foto sampel hasil kolorimetri memperlihatkan sampel iris kering dan serbuk mengalami perubahan warna sesuai dengan warna indikator nanopartikel perak yaitu warna cokelat
(Gopinath dkk. 2012: 71) (Gambar 5). Sampel iris kering warnanya berubah dari tidak berwarna menjadi cokelat Frank’s Fire, sedangkan sampel serbuk berwarna cokelat copper penny
(Gambar 5). Dengan demikian, diduga bahwa dalam sampel iris kering dan serbuk telah terbentuk nanopartikel perak setelah 24 jam.
sampel sesaat setelah penyampuran
Keterangan: A: sampel iris kering B: sampel serbuk
Sampel iris kering: air rebusan rimpang jahe gajah anakan iris kering + larutan AgNO3 Sampel serbuk: air rebusan rimpang jahe gajah anakan serbuk + larutan AgNO3
Gambar 5. Warna sampel iris kering dan serbuk sesaat dan setelah 24 jam percampuran.
200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Ni la i A b so rb a n si P a nja ng G elom ba ng (nm ) S a m pel s erbuk S a m pel iris kering
Keterangan: sampel iris kering: air rebusan jahe gajah anakan iris kering + larutan AgNO3. sampel iris kering: air rebusan jahe gajah anakan iris kering + larutan AgNO3.
A B A B
Gambar 6. Grafik nilai absorbansi sampel serbuk dan iris kering dengan spektrofotometer UV-Vis.
Tabel 3 Nilai absorbansi, λ max, dan FWHM dari sampel iris kering dan serbuk. No. Sampel Absorbansi λ max (nm) FWHM
1. Iris kering 3,61 ± 0,26 420 140,8 ± 11,33 2. Serbuk 2,06 ± 0,56 420 145,6 ± 13,44
Keterangan: Sampel iris kering: air rebusan jahe gajah anakan iris kering + larutan AgNO3. Sampel serbuk: air rebusan jahe gajah anakan serbuk + larutan AgNO3.
Nilai absorbansi, λ max, dan FWHM dari sampel iris kering dan serbuk digunakan sebagai parameter potensi kedua bentuk simplisia ini untuk biosintesis nanopartikel perak. Sampel anakan iris kering dan serbuk masing-masing memiliki absorbansi 3,61 dan 2,06 (Tabel 3). Nilai absorbansi sampel iris kering lebih tinggi daripada sampel serbuk. Nilai absorbansi yang lebih tinggi pada sampel iris kering disebabkan oleh konsentrasi nanopartikel perak yang lebih tinggi (Owen 1996). Dengan demikian, bentuk simplisia iris kering lebih efektif untuk biosintesis nanopartikel perak daripada bentuk serbuk. Sampel iris kering dan serbuk memiliki λ
maksimal yang sama yaitu 420 nm (Tabel 3). Panjang gelombang maksimal 400-500 nm merupakan karakteristik nanopartikel perak (Baia & Simon 2007: 577). Dengan demikian, sampel jahe anakan iris kering maupun serbuk telah memproduksi nanopartikel perak. Nilai λ
maksimal 420 nm selain digunakan sebagai indikator nanopartikel perak, dapat digunakan untuk memperkirakan ukuran nanopartikel. Berdasarkan Solomon dkk. (2007), nanopartikel perak dengan λ maksimal 420 nm berukuran 35-50 nm. Dengan demikian, diduga ukuran nanopartikel perak yang dihasilkan oleh kedua sampel yaitu 35-50 nm. Sampel iris kering dan serbuk masing-masing memiliki nilai FWHM 140,8 dan 145,6. Kedua sampel tersebut memiliki nilai FWHM yang hampir sama. Nilai FWHM sebanding dengan homogenitas ukuran nanopartikel perak (Parashar dkk. 2009) sehingga kedua sampel itu diduga memiliki homogenitas ukuran
nanopartikel yang hampir sama. Dengan demikian, bentuk simplisia jahe iris kering dianggap lebih potensial daripada bentuk serbuk.
Pengaruh Perlakuan Mekanik
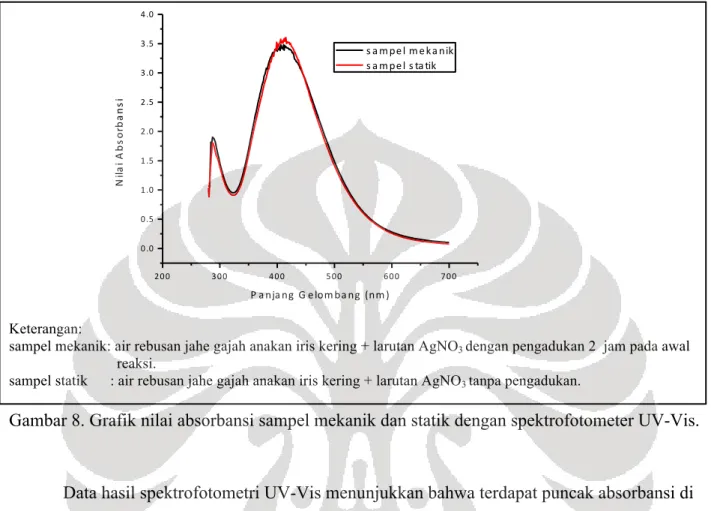
Foto hasil kolorimetri sampel mekanik dan statik memperlihatkan warna dari tidak berwarna menjadi cokelat copper penny setelah 24 jam (Gambar 7). Perubahan warna sampel menjadi cokelat merupakan indikator terbentuk nanopartikel perak (Gopinath dkk. 2012).
Dengan demikian, nanopartikel perak telah terbentuk pada kedua sampel tersebut setelah 24 jam.
Keterangan: A: Sampel mekanik. B: Sampel statik.
Sampel mekanik: air rebusan simplisia iris kering + larutan AgNO3 dengan pengadukan
selama 2 jam di awal reaksi.
Sampel statik : air rebusan simplisia iris kering + larutan AgNO3 tanpa pengadukan.
Gambar 7. Visualisasi warna sampel mekanik dan statik sesaat dan setelah 24 jam percampuran.
A B
Foto sampel sesaat setelah menyampuran
Foto sampel setelah 24 jam
200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Ni la i A b so rb a n si P a nja ng G elom ba ng (nm )
s a m pel m eka nik s a m pel s ta tik
Keterangan:
sampel mekanik: air rebusan jahe gajah anakan iris kering + larutan AgNO3 dengan pengadukan 2 jam pada awal reaksi.
sampel statik : air rebusan jahe gajah anakan iris kering + larutan AgNO3 tanpa pengadukan.
Gambar 8. Grafik nilai absorbansi sampel mekanik dan statik dengan spektrofotometer UV-Vis.
Data hasil spektrofotometri UV-Vis menunjukkan bahwa terdapat puncak absorbansi di antara panjang gelombang 400-500 nm pada sampel mekanik dan statik (Gambar 8). Puncak absorbansi yang terbentuk pada kisaran panjang gelombang 400 nm merupakan karakteristik dari nanopartikel perak (Baia & Simon 2007). Dengan demikian, nanopartikel perak telah terbentuk di dalam sampel mekanik dan statik.
Tabel 4. Nilai absorbansi, λ max, dan FWHM dari sampel mekanik dan statik. No. Sampel Absorbansi λ max (nm) FWHM
1. Mekanik 3,40 ± 0,93 420 142,2 ± 18,74 2. Statik 3,61 ± 0,26 420 140,8 ± 11,33
Keterangan: sampel mekanik: sampel dengan pengadukan selama 2 jam di awal reaksi. sampel statik: sampel dengan tanpa pengadukan.
Nilai absorbansi sampel mekanik dan statik masing-masing yaitu 3,4 dan 3,61 (Tabel 4). Berdasarkan Owen (1996), nilai absorbansi sebanding dengan konsentrasi nanopartikel perak
yang dihasilkan (Owen 1996). Dengan demikian, sampel statik diduga memiliki konsentrasi nanopartikel perak lebih tinggi daripada sampel mekanik. Sampel mekanik dan statik memiliki λ
maksimal 420 nm (Tabel 4). Solomon menyatakan bahwa ukuran nanopartikel dengan λ
maksimal 420 yaitu 35-50 nm. Dengan demikian, kedua sampel tersebut diduga telah memproduksi nanopartikel perak berukuran 35-50 nm. Sampel mekanik dan statik memiliki nilai FWHM masing-masing 142,2 dan 140,8. Kedua sampel tersebut memiliki nilai FWHM hampir sama. Berdasarkan Parashar dkk. (2009), nilai FWHM berpengaruh terhadap
homogenitas ukuran nanopartikel perak. Dengan demikian, sampel mekanik dan statik diduga memiliki homogenitas ukuran nanopartikel yang hampir sama. Jadi, perlakuan pengadukan tidak meningkatkan konsentrasi nanopartikel perak pada sampel yang diinkubasi selama 24 jam.
Pengaruh Penambahan Asam Askorbat
Hasil kolorimetri menunjukkan dari sampel A,B,C,D,E,F, dan G hanya sampel A,E,F, dan G yang mengalami perubahan warna setelah 24 jam inkubasi (Gambar 9). Sampel A (kontrol) mengalami perubahan warna dari bening menjadi kuning spun of gold, sedangkan sampel dari kelompok perlakuan air rebusan jahe sekaligus asam askorbat yaitu E,F, dan G warnanya menjadi cokelat Frank’s Fire. Berdasarkan Parashar dkk. (2009), perubahan warna sampel menjadi kuning hingga cokelatmerupakan indikator keberadaan nanopartikel perak sehingga sampel A,E,F, dan G diduga mengandung nanopartikel perak. Menurut Chhatre dkk. (2012), sampel berwarna cokelat memiliki konsentrasi nanopartikel perak lebih tinggi daripada sampel berwarna kuning. Dengan demikian, kelompok sampel dengan perlakuan air rebusan jahe sekaligus asam askorbat diduga memiliki konsentrasi nanopartikel perak lebih tinggi daripada sampel kontrol. Jadi, penambahan asam askorbat pada reaksi biosintesis dapat meningkatkan konsentrasi nanopartikel perak.
A B C D E F G
Foto sampel sesaat setelah percampuran
Foto sampel setelah 24 jam percampuran
Keterangan: Sampel A: air rebusan jahe + larutan AgNO3.
Sampel B: as. askorbat 4% + larutan AgNO3.
Sampel C: as. askorbat 6% + larutan AgNO3.
Sampel D: as. askorbat 8% + larutan AgNO3.
Sampel E: as. askorbat 4% + air rebusan jahe + larutan AgNO3.
Sampel F: as. askorbat 6% + air rebusan jahe + larutan AgNO3.
Sampel G: as. askorbat 8% + air rebusan jahe + larutan AgNO3.
Gambar 9. Warna sampel air rebusan jahe, asam askorbat berbagai konsentrasi, dan air rebusan jahe sekaligus asam askorbat berbagai konsentrasi seseat dan setelah 24 jam percampuran.
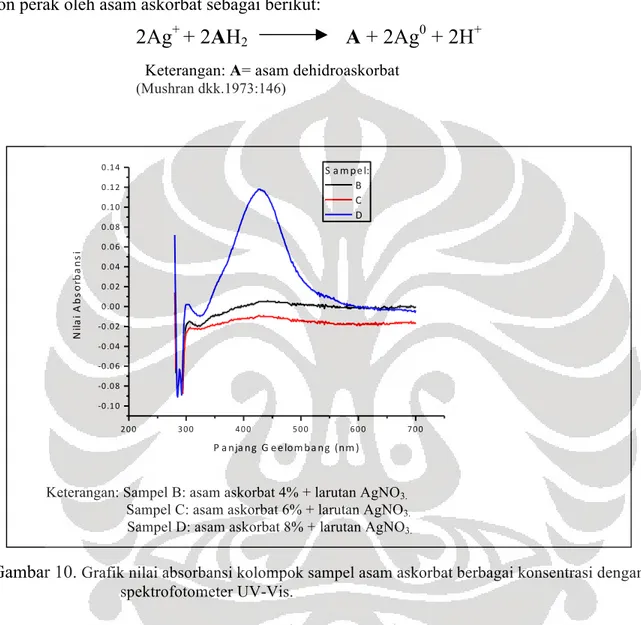
Berdasarkan hasil spektrofotometer UV-Vis, sampel A,D, E,F, dan G memiliki puncak absorbansi di sekitar panjang gelombang 400 nm (Gamabar 10 dan Gambar 11). Menurut
Solomon dkk. (2007), Puncak absorbansi yang terbentuk pada di sekitar panjang gelombang 400 nm merupakan indikator nanopartikel perak. Dengan demikian, sampel A,D, E,F, dan G diduga telah menghasilkan nanopartikel perak. Khusus untuk sampel D yaitu sampel dengan perlakuan asam askorbat 8%, berdasarkan hasil kolorimetri diduga tidak terbentuk nanopartikel perak karena belum ada perubanhan warna. Hal itu, kemungkinan terjadi akibat nanopartikel yang terbentuk sangat sedikit yang diketahui dari nilai absorbansinya yang sangat kecil yaitu 0,12
II
(Gambar 10). Keberhasilan asam askorbat sebagai reduktor dikuatkan oleh Mushran dkk. (1973) yang telah menggunakan asam askorbat untuk sintesis nanopartikel perak. Adapun reaksi reduksi ion perak oleh asam askorbat sebagai berikut:
2Ag
++ 2
A
H
2 A+ 2Ag
0+ 2H
+Keterangan: A= asam dehidroaskorbat
(Mushran dkk.1973:146) 200 300 400 500 600 700 -‐0.10 -‐0.08 -‐0.06 -‐0.04 -‐0.02 0.00 0.02 0.04 0.06 0.08 0.10 0.12 0.14 Ni la i A b so rb a n si P a nja ng G eelom ba ng (nm ) S a m pel: B C D Keterangan: Sampel B: asam askorbat 4% + larutan AgNO3.
Sampel C: asam askorbat 6% + larutan AgNO3. Sampel D: asam askorbat 8% + larutan AgNO3.
Gambar 10. Grafik nilai absorbansi kolompok sampel asam askorbat berbagai konsentrasi dengan spektrofotometer UV-Vis.
200 300 400 500 600 700 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Ni la i A b so rb a n si P a nja ng G elom ba ng (nm ) S a m pe: E F G A (kontrol) Keterangan:
Sampel A (kontrol): air rebusan rimpang jahe anakan iris kering + larutan AgNO3.
Sampel E: air rebusan rimpang jahe anakan iris kering + as. askorbat 4% + larutan AgNO3. Sampel F: air rebusan rimpang jahe anakan iris kering + as. askorbat 6% + larutan AgNO3. Sampel G: air rebusan rimpang jahe anakan iris kering + as. askorbat 8% + larutan AgNO3.
Gambar 11. Grafik nilai absorbansi sampel air rebusan, asam askorbat berbagai konsentrasi, dan air rebusan sekaligus asam askorbat berbagai konsentrasi dengan spektrofotometer UV-Vis.
Nilai absorbansi paling tinggi dari sampel A,B,C,D,E,F,dan G dimiliki oleh sampel A (kontrol) yaitu 3,4 (Tabel 9). Berdasarkan Owen (1996), nilai absorbansi sebanding dengan konsentrasi nanopartikel perak dalam sampel. Dengan demikian, sampel A(kontrol) diduga memiliki konsentrasi nanopartikel perak paling tinggi. Sampel dengan λ max 240 nm - 424 nm diduga mengandung nanopartikel berukuran 35-60 nm. Hal itu dikuatkan oleh Solomon dkk. (1996) yang menyatakan bahwa sampel yang memiliki λ max 240 nm - 424 nm memiliki nanopartikel perak berukuran 35-60 nm. Jadi dapat disimpulkan bahwa asam askorbat dapat digunakan sebagai reduktor. Berdasarkan hasil spektrofotometer UV-Vis, penambahan asam askorbat ke dalam campuran air rebusan jahe dan larutan AgNO3 tidak meningkat konsentrasi
Tabel 9. Nilai absorbansi, λ max, dan FWHM dari sampel air rebusan jahe, asam askorbat berbagai konsentrasi, dan air rebusan jahe sekaligus asam askorbat berbagai konsentrasi.
No. Sampel Absorbansi λ max (nm) FWHM
1. A 3,40 ± 0,93 420 142,2 ± 18,74 2. B - - - 3. C - - - 4. D - - - 5. E 1,7 ± 0,18 420 181,3 ± 26,22 6. F 1,83 ± 0,71 420 191 ± 27,07 7. G 2,62 ± 0,49 424 163,7 ± 16,16 Keterangan:
A: air rebusan jahe anakan iris kering + larutan AgNO3. B: as. askorbat 4% + larutan AgNO3.
C: as. askorbat 6% + larutan AgNO3. D: as. askorbat 8% + larutan AgNO3.
E: air rebusan jahe anakan iris kering + as.askorbat 4% + larutan AgNO3. F: air rebusan jahe anakan iris kering + as.askorbat 6% + larutan AgNO3. G: air rebusan jahe anakan iris kering + as.askorbat 8% + larutan AgNO3.
Nilai absorbansi dari sampel dengan penambahan asam askorbat setelah 24 jam reaksi lebih rendah dari sampel kontrol kemungkinan terjadi akibat agregrasi nanopartikel perak.
Penambahan asam askorbat selama 24 jam reaksi tidak memberikan pengaruh terhadap
konsentrasi nanopartikel perak, namun penambahan asam askorbat selama 1 jam pertama mampu meningkatkan konsentrasi nanopartikel perak. Hal itu terlihat dari perbandingan nilai absorbansi kontrol dan sampel dengan penambahan asam askorbat selama 1 jam pertama (Gambar 12).
200 300 400 500 600 700 -‐0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8 2.0 2.2 2.4 2.6 2.8 3.0 Ni la i A b so rb a n si P a nja ng G elom ba ng (nm ) S a mpel: kontrol
A s . a s korba t 4% A s . a s korba t 6% A s . a s korba t 8%
Keterangan:
sampel kontrol: air rebusan jahe gajah anakan iris kering + larutan AgNO3. sampel as.askorbat 4%: as.askorbat 4% + larutan AgNO3.
sampel as.askorbat 6%: as.askorbat 6% + larutan AgNO3. sampel as.askorbat 8%: as.askorbat 8% + larutan AgNO3.
Gambar 12. Grafik nilai absorbansi sampel air rebusan jahe dan asam askorbat berbagai konsentrasi setelah1 jam pertama dengan spektrofotometer UV-Vis.
Berdasarkan grafik nilai absorbansi di atas, nilai absorbansi nanopartikel perak meningkat seiring dengan penambahan konsentrasi asam askorbat (Gambar 12). Nilai absorbansi mencerminkan konsentrasi nanopartikel yang terbentuk (Owen 1996). Dengan demikian, selama 1 jam di awal reaksi, konsentrasi nanopartikel perak meningkat seiring dengan peningkatan konsentrasi asam askorbat. Jadi, penambahan asam askorbat dalam reaksi biosintesis menggunakan air rebusan jahe gajah iris kering dapat meningkatkan konsentrasi nanopartikel perak.
Daftar Referensi
Baia, L. & S. Simon. 2007. UV-VIS and TEM assesment of morphological features of silver nanoparticles from phosphat glass matrices. Modern Research and Educational Topics in
Chhatre, A., P. Solasa, S. Sakle, R. Thaokar, & A. Mehra. 2012. Color and Surface Plasmon Effects in Nanoparticle Systems: Case of Silver Nanoparticles Prepared by Microemulsion Route. Colloids and Surfaces A: Physicochem and Engineering Aspects404: 83-- 89. Dong, Q., H. Su, W. Cao, J. Han, D. Zhang, & Q. Guo. 2008. Biogenic synthesis of hierarchical
hybrid nanocomposites and patterning of silver nanoparticles. Material of Chemistry and Physic 110: 160--165.
Duran, N., P.D. Marcato, G.I.H. De Souza, O.L. Alves, & E. Esposito. 2009. Journal of Biomedicine Nanotechnology. dalam: Krishnaraj, C., E.G. Jagan, S. Rajasekar, S. Selvakumar, P.T. Kalaichelvan, & N. Mohan. 2010. Synthesis of Nanoparticles Using
Acalypha indica Leaf Extract and Its Antibacterial Activity Against Water Borne Pathogens.
Colloids and Surfaces B: Biointerfaces76: 50--56.
Gopinath, V., D.M. Ali, S. Priyadashini, N.M. Priyadharsshni, N. Thajuddind, & P. Velusamy. 2012. Biosynthesis of silver nanoparticles from Tribulus terrestris and its antimicrobial activity: a novel biological approach. Colloids and Surfaces B: Biointerfaces96: 69--74. Kumar, K.P., W. Paul, & C.P. Sharma. 2011. Green synthesis of gold nanoparticles with
Zingiber officinale extract: characterization and blood compatibility. Process Biochemistry
46: 2007--2013.
Mushran, S.P., C. Agrawal, R.M. Mehrotra, & R. Sanehi. 1973. Kinetics and Mechanism of Reduction of Silver([) by Ascorbic Acid. Journal of Colloids and Surfaces Dafton3: 1460--1461.
Owen.T. 1996. Fundamental of UV-Visible Spectroscopy. Agilent technology :viii +133 hlm.
Parashar, U.K., P.S. Saxena, & A. Srivastsva. 2009. Bioinspired synthesis of silver nanoparticles. Digest Journal of Nanomaterials and Biostructures4 : 159--166.
Perumal. S. 2012. Mono-and Multivalent Interaction Between Thiol and Amind Ligands with Noble Metal Nanoparticles. Dissertation Department of Biology, Chemistry, and
Pharmacy, Freie Universitat Berlin, Berlin: 154 hlm.
Phathna, T.C., N. Chandrasekaran, A.M. Raichur, & A. Mukherjee. 2011. Biomimetic synthesis of silver nanoparticles by Citrus limon ( Lemon ) aqueous extract and theoretical prediction of particle size. Colloids and Surfaces B: Biointerfaces82: 152--159.
Sathishkumar, M., K. Sneha, & Yeoung-Sang Yun. 2010. Immobilization of silver nanoparticles synthesized using Curcuma longa tuber powder and extract on cotton cloth for bactericidal activity. Bioresource Technoogy101: 7058--7965.
Singh, C., V. Sharma, P. Naik, V. Khandelwal, & H. Singh. 2011. A green biogenic approach for synthesis of gold and silver nanoparticles using Zingiber officinale. Digest Journal of
Nanomaterials and Biostuctures6: 535--542.
Solomon, S.D., M. Bahadory, A.V. Jeyarajasingam, A.R. Susan, & C. Boritz. 2007. Synthesis and study of silver nanoparticles. Journal of chemichal Education84: 322--325.
Sun, X. & Y. Luo. 2005. Preparation and size control of silver nanoparticles by a thermal method. Materials Letters59: 3847--3850.