LAPORAN RESMI PRAKTIKUM LAPORAN RESMI PRAKTIKUM FARMAKOLOGI EKSPERIMENTAL II FARMAKOLOGI EKSPERIMENTAL II
PERCOBAAN V PERCOBAAN V
RESEPTOR SEBAGAI TARGET AKSI OBAT (RESEPTOR HISTAMIN) RESEPTOR SEBAGAI TARGET AKSI OBAT (RESEPTOR HISTAMIN)
Disusun oleh : Disusun oleh :
Kelompok 2 Golongan AII Kelompok 2 Golongan AII Annisa
Annisa Nilamsari Nilamsari Utami Utami 14/362870/FA/114/362870/FA/100260026 Muhammad
Muhammad Faishal Faishal Mahdi Mahdi 14/362873/FA/114/362873/FA/100290029 Cinantya
Cinantya Talia Talia Paramita Paramita 14/362879/FA/114/362879/FA/100350035 Viska
Viska Fitrianingsih Fitrianingsih 14/362882/FA/114/362882/FA/100380038
Hari, Tangg
Hari, Tanggal Praktikum al Praktikum : Senin, : Senin, 21 No21 November 2vember 2016016 Dosen
Dosen Jaga Jaga : : --Asisten
Asisten Jaga Jaga : : Zulfa Zulfa Yunanto, Yunanto, Khalista Khalista Destiana, Destiana, David David AlexanderAlexander
LABORATORIUM FARMAKOLOGI DAN TOKSIKOLOGI LABORATORIUM FARMAKOLOGI DAN TOKSIKOLOGI
BAGIAN FARMAKOLOGI DAN FARMASI KLINIK BAGIAN FARMAKOLOGI DAN FARMASI KLINIK FAKULTAS FARMASI UNIVERSITAS GADJAH MADA FAKULTAS FARMASI UNIVERSITAS GADJAH MADA
YOGYAKARTA YOGYAKARTA
2016 2016
PERCOBAAN V
RESEPTOR SEBAGAI TARGET AKSI OBAT (RESEPTOR HISTAMIN)
I. TUJUAN
A. Mengenal dan menjelaskan mengenai reseptor histamin.
B. Mengenal, mempraktekkan, dan melaksanakan percobaan yang melibatkan reseptor histamin.
C. Menentukan nilai pD2 dari antihistamin.
II. DASAR TEORI
Obat merupakan bahan atau zat yang berasal dari tumbuhan, hewan, maupun zat kimia tertentu yang dapat digunakan untuk mengurangi rasa sakit, memperlambat proses penyakit dan atau menyembuhkan penyakit. Suatu obat bisa menghasilkan efek terapi atau berkhasiat jika dosis yang digunakan sesuai. Obat dapat menimbulkan efek umumnya dikarenakan interaksi obat dengan reseptor pada sel suatu organisme. Ikatan antara obat dengan reseptor umumnya berupa ikatan non-kovalen (ikatan ion, hidrogen, hidrofobik, van der Waals, dan jarang ikatan kovalen). Oleh karena itu, interaksi obat dan reseptor bersifat reversible.
Histamin atau 2-(4-imidozyl)ethylamine adalah amina yang secara biologis aktif memiliki efek patologis dan fisiologis melalui berbagai subtipe reseptor, dan sering dilepas secara lokal (Katzung, 2001).
Gambar 1. Struktur Molekul Histamin
Pada pH fisiologi, atom nitrogen amino dari rantai samping akan terprotonasi. Bentuk yang terjadi pada histamin adalah kation monovalen, yang membentuk ikatan hidrogen intramolekular antara gugus amino rantai samping dan nitrogen cincin imidazol. Histamin merupakan senyawa amin aktif secara biologis yang dijumpai di
berbagai jaringan, mempunyai efek fisiologis dan patologis yang kompleks dan biasanya dilepas setempat. Bersama dengan polipeptida endogen serta prostaglandin dan leukotrin disebut sebagai hormone local sesuai dengan sifat-sifatnya tersebut. Histamin dikeluarkan dari tempat pengikatan ion pada kompleks heparin-protein dalam sel mast, sebagai reaksi antigen-antibodi, bila terjadi rangsangan senyawa alergen.
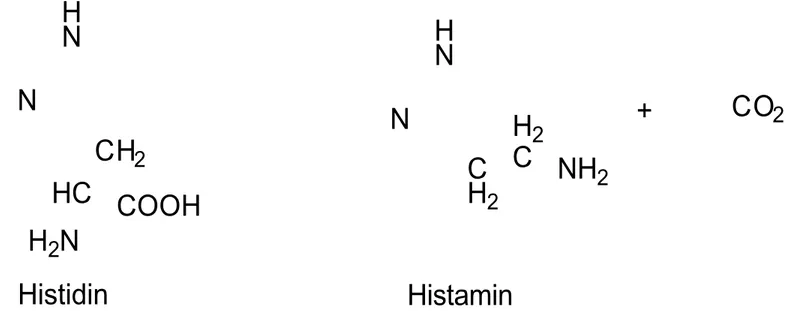
Histamin dibentuk dari dekarboksilasi asam amino L-histidin, yang terdapat pada jaringan dikatalisis oleh enzim histidin dekarboksilase. Piridoksal fosfat
diperlukan sebagai kofaktor. Setelah dibentuk, histamin segera disimpan atau langsung diinaktifkan. Inaktivasi histamin dapat melalui dua cara, yaitu jalur oksidasi dan N-metilasi. Tahapan pertama dalam inaktivasi histamin adalah perubahan menjadi metilhistamin dengan katalisator imidazol-N-metiltransferase, kemudian dioksidasi menjadi asam metilimidazolasetat dengan katalisator diamin oksidase. Cara kedua dalam metabolismenya ialah konversi histamin langsung ke asam imidazolasetat oleh diamin oksidase. N H N C H2 H2 C NH2 N H N CH2 HC COOH H2N + CO2 Histidin Histamin
Gambar 2. Reaksi dekarboksilasi dari Histidin menjadi Histamin
Sebagai bagian dari respon kekebalan terhadap patogen asing, histamin dihasilkan oleh basofil dan oleh sel mast yang ditemukan dalam jaringan ikat di sekitarnya. Histamin meningkatkan permeabilitas dari kapiler ke sel-sel darah putih dan beberapa protein, untuk memungkinkan mereka untuk terlibat patogen dalam jaringan
Reseptor histamin dapat dibedakan menjadi tiga yaitu : 1. Reseptor H1
Reseptor H1 tersebar pada otot polos, endotel dan otak. Interaksi histamin dengan
reseptor H1 menyebabkan kontraksi otot polos usus dan bronki, meningkatkan
permeabilitas vaskuler dan meningkatkan sekresi mukus, yang dihubungkan dengan peningkatan cGMP dalam sel. Interaksi dengan reseptor H1 juga menyebabkan
vasodilatasi arteri sehinga permeabel terhadap cairan dan plasma protein, yang menyebabkan sembab, pruritik, dermatitis dan urtikaria, dimana efek ini dapat diblok oleh antagonis H1.
2. Reseptor H2
Reseptor H2 tersebar pada mukosa lambung, otot jantung, sel mast dan otak.
Interaksi histamin dengan reseptor H2 dapat meningkatkan sekresi asam lambung
dan kecepatan kerja jantung. Produksi asam lambung disebabkan oleh penurunan cGMP dan peningkatan cAMP. Peningkatan sekresi asam lambung dapat menyebabkan tukak lambung yang efeknya dapat diblok dengan antagonis H2.
3. Reseptor H3
Reseptor H3 tersebar pada presinaptik otak, pleksus, mienterik, dan saraf lainnya,
tepatnya terletak pada ujung saraf histamin jaringan otak dan jaringan perifer, yang mengontrol sintesis dan pelepasan histamin, mediator alergi lain dan peradangan. Efek ini dapat diblok oleh antagonis H3.
Antihistamin adalah kelompok obat yang mencegah kerja histamin dalam tubuh. Histamin merupakan zat yang diproduksi oleh tubuh yang keluar sebagai reaksi terhadap rangsangan tertentu, misalkan pada reaksi alergi terhadap rangsangan benda asing. Antihistamin dibagi dalam dua kelompok, antihistamin 1 (AH1) dan antihistamin
2 (AH2). AH1 mencegah kerja histamin di kulit, saluran napas dan pembuluh darah
sehingga dapat dipakai untuk mencegah reaksi alergi dan mengurangi sesak napas pada asma. Contoh obat yang merupakan AH1 adalah difenhidramin HCl, klorfeniramin
maleat (CTM), dan siproheptadin HCl. AH2 digunakan untuk mencegah produksi asam
lambung berlebih sehingga banyak digunakan untuk mengobati sakit maag. Contoh obat yang merupakan AH2antara lain: ranitidin, simetidin, dan famotidin.
III. ALAT DAN BAHAN A. Alat
1. Organ bath
2. Amplifier dan recorder 3. Tranduser isotonik 4. Gelas ukur 25 mL 5. Cawan petri 6. Benang 7. Alat bedah 8. Papan fiksasi B. Bahan
1. Larutan Buffer Krebs
2. Larutan agonis histamin dengan kadar 2x10-5; 2x10-4; 2x10-3; 2x10-2; 2x10-1 3. Gas karbogen
C. Hewan Uji Marmut
IV. CARA KERJA
I. Preparasi Organ Trakea
Dikorbankan marmut dengan cara dislokasi tulang belakang (cervix)
Diletakkan marmut pada papan fiksasi
Dibedah bagian dada atas sampai bagian leher
Diambil trakea, diletakkan pada cawan petri yang berisi larutan buffer Krebs
dibersihkan dari lemak dan jaringan lain yang masih menempel
Setelah bersih, dipotong trakea dengan arah melintang untuk diambil cincin trakea (7 cincin dan 4 cincin)
Diikat organ yang telah dipreparasi pada organ bath
Diberi larutan buffer Krebs hingga terendam sempurna dan dialiri gas karbogen
Diatur kedudukan tuas pencatat sehingga bisa memberikan rekaman terbaik pada recorder (preload yang diberikan adalah 0,5 cm)
II. Uji Farmakologi
Setelah preparasi organ, dilakukan ekuilibrasi terhadap trakea sel ama 60 menit (dengan penggantian larutan buffer Krebs tiap 15 menit)
Dilakukan pengenalan agonis dengan konsentrasi yang men yebabkan ± 80% repon kontraksi maksimum, untuk histamin sebesar 2x10-3 M
Dicuci organ selama 60 menit dengan penggantian larutan buffer Krebs tia p 15 menit
Diukur kontaksi otot polos trakea terhadap berbagai peringkat dosis agonis histamin
III. Analisis Data
Data repon yang timbul pada masing-masing dosis terukur dalam satuan mm
Diubah ke nilai persen dari nilai respon maksimal
Hubungan antra % efek dan kadar dinyatakan dalam kurva dimana nilai presentase efek menjadi skala ordinat (sumbu Y) dan logaritma kadar obat menjadi skala
absis (sumbu X)
Ditentukan dosis dimana bisa menimbukan respon 50% dri respon maksimal yang mungkin bisa dihitung dengan menggunakan grafik tersebut di atas (plot dosis vs
Dihitung nilai negatif logaritma dari dosis (pD2), besaran ini memberikan
gambaran nilai afinitas agonis yang bersangkutan terhadap reseptor spesifiknya
V. HASIL DAN ANALISIS DATA A. Data Percobaan
Pemberian
ke-Konsentrasi kumulatif histamin dalam organ bath
(M) Tinggi grafik (mm) 1 1 x 10-7 2 2 3 x 10-7 8 3 1 x 10-6 16 4 3 x 10-6 24 5 1 x 10-5 48 6 3 x 10-5 48 7 1 x 10-4 48 8 3 x 10-4 48 9 1 x 10-3 48 B. Perhitungan 1. Perhitungan %Respon % = ×100% a. Pemberian ke-1 % = 2 48 ×100% = 4,17% b. Pemberian ke-2 % = 8 48 ×100% = 16,67% c. Pemberian ke-3 % = 16 48 ×100% = 33,33%
d. Pemberian ke-4 % = 24 48 ×100% = 50% e. Pemberian ke-5 % = 48 48 ×100% = 100% f. Pemberian ke-6 % = 48 48 ×100% = 100% g. Pemberian ke-7 % = 48 48 ×100% = 100% h. Pemberian ke-8 % = 48 48 ×100% = 100% i. Pemberian ke-9 % = 48 48 ×100% = 100%
2. Perhitungan Log Konsentrasi a. Pemberian ke-1 = 1 ×10− = 7 b. Pemberian ke-2 = 3 ×10− = 6,5229 c. Pemberian ke-3 = 1 ×10− = 6
d. Pemberian ke-4 = 3 ×10− = 5,5229 e. Pemberian ke-5 = 1 ×10− = 5 f. Pemberian ke-6 = 3 ×10− = 4,5229 g. Pemberian ke-7 = 1 ×10− = 4 h. Pemberian ke-8 = 3 ×10− = 3,5229 i. Pemberian ke-9 = 1 ×10− = 3
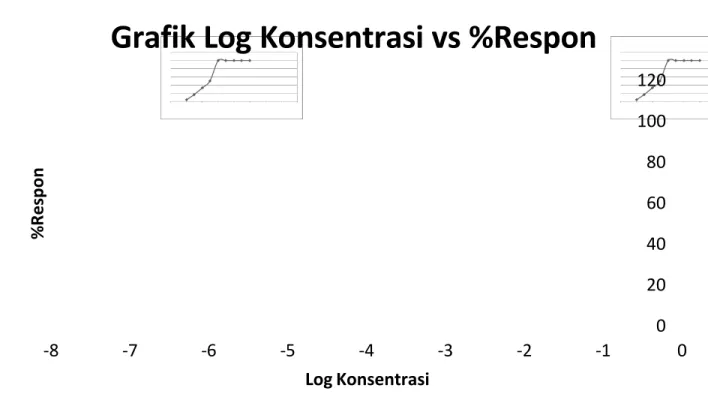
3. Log Konsentrasi vs %Respon
Pemberian ke Log Konsentrasi %Respon
1 -7 4,17% 2 -6,5229 16,67% 3 -6 33,33% 4 -5,5229 50% 5 -5 100% 6 -4,5229 100% 7 -4 100% 8 -3,5229 100% 9 -3 100%
Persamaan regresi: = 27,22 + 203,5 4. Perhitungan pD2
a. Log ED50 = Log konsentrasi saat %Respon 50
50 = 27,22 + 203,5 27,22 = 153,5 = 5,6392 b. pD2 = - log ED50 = 5,6392 VI. PEMBAHASAN
Praktikum ini bertujuan agar praktikan dapat mengaplikasikan pengetahuannya mengenai reseptor histamin dengan melaksanakan percobaan yang melibatkan reseptor histamin, serta menentukan nilai pD2 dari antihistamin.
Percobaan ini merupakan suatu uji farmakologi dengan organ terisolasi. Digunakan agonis reseptor histamin agar timbul respon biologis pada organ terisolasi tersebut. Uji dengan organ terisolasi mampu mengukur nilai intrinsik dari senyawa yang diuji.
Keuntungan dari penggunaan organ terisolasi untuk uji farmakologi antara lain: 1. Konsentrasi obat/ligan dalam jaringan dapat diketahui secara pasti
2. Kompleksitas pada hubungan stimulus dan efek bisa disederhanakan atau dikurangi
0 20 40 60 80 100 120 -8 -7 -6 -5 -4 -3 -2 -1 0 % R e s p o n Log Konsentrasi
3. Dimungkinkan untuk menghindari respon kompensasi dari efek sampai intensitas efek maksimal dan juga efek farmakokinetika (ADME) pada pemberian agonis tersebut bisa diabaikan.
Sementara kerugiannya adalah sebagai berikut:
1. Kerusakan jaringan organ pada saat reparasi dapat mempengaruhi hasil 2. Fungsi regulasi fisiologis hilang
3. Buffer yang tidak sesuai akan mempengaruhi hasil 4. Ekstrapolasi sulit diperhitungkan.
Organ yang diisolasi pada praktikum ini adalah trakea. Pada otot polos trakea, selain reseptor histamin H1, terdapat pula reseptor kolinergik, muskarinik, serta reseptor α, β1 dan β2 adrenergik. Reseptor -reseptor pada trakea ini bila dirangsang akan menimbulkan efek yang berlawanan satu sama lain. Efek tersebut dibagi menjadi dua golongan, yakni efek kontraksi (akibat aktivasi reseptor histamin H1, kolinergik muskarinik, dan reseptor α1 adrenergik ) dan efek relaksasi (akibat aktivasi reseptor β1 dan β2 adrenergik )
Langkah pertama dari praktikum ini adalah preparasi organ trakea dari hewan uji, Marmut dikorbankan dengan cara dislokasi tulang belakang kepala, setelah itu diletakkan pada papan fiksasi. Bagian leher dibedah hingga dada atas dan jaringan- jaringan yang menutupi trakea dibersihkan agar trakea dapat diambil. Trakea yang telah diambil kemudian dimasukkan dalam cawan berisi buffer Krebs. Trakea dibersihkan dari lemak dan jaringan lain yang masih menempel sehingga ketika diberi perlakuan histamin, interaksinya tidak akan terhambat sehingga hasil yang diperoleh valid. Setelah bersih, trakea dipotong untuk diambil satu cincin trakea, kemudian dipotong tulang rawannya sedemikian rupa sehingga didapatkan satu pita trakea. Kedua ujung potongan trakea diikat dengan benang steril yang terhubung dengan transducer isotonik.
Selanjutnya, trakea tersebut direndam dalam larutan buffer Krebs agar organ tersebut tetap hidup layaknya organ yang masih berada dalam tubuh makhluk hidup karena buffer dapat menjaga stabilitas pH organ. Buffer Krebs terdiri dari NaCl 6,870 g, KCl 0,420 g, MgSO4.2H2O 0,3370 g, NaH2PO4. 2H2O 0,200 g, NaHCO3 2,100 g, dan
glukosa 1,000 g; dibuat dengan mencampurkan dalam air, garam kecuali NaHCO3 dan
glukosa, yang dialiri gas karbogen (95% O2 dan 5% CO2) dengan suhu 370C. Larutan
merupakan media tumbuh bakteri dan penambahan NaHCO3 pada saat penyimpanan
dapat menyebabkan terjadinya endapan CaCO3. Preparasi larutan buffer Krebs
dilakukan oleh laboran karena keterbatasan waktu praktikum.
Organ dialiri gas karbogen agar sel-sel pada organ terisolasi tetap hidup walaupun telah dikeluarkan dari hewan uji. Tuas pencatat diatur kedudukannya sedemikian rupa sehingga bisa memberikan rekaman terbaik pada recorder .
Setelah preparasi selesai, dilakukan ekuilidasi terhadap organ selama 60 menit dengan penggantian larutan buffer Krebs tiap 15 menit. Hal ini dilakukan untuk mengadaptasikan organ dengan kondisi percobaan, dan sebagai evaluasi apakah organ masih hidup atau tidak; serta untuk mengetahui apakah di dalam organ trakea terdapat obat atau senyawa endogen yang dapat mempengaruhi fungsi trakea dengan cara melihat kestabilan respon yang terekam pada kimogram. Bila kimogram stabil, berarti tidak terdapat obat pada trakea sehingga diharapkan respon yang muncul adalah murni dari histamin yang diberikan. Setelah kimogram stabil, kemudian larutan buffer Krebs diganti dan diisi dengan yang baru.
Selanjutnya ditambahkan histamin eksogen kedalam organ bath dengan faktor kumulatif sebesar setengah log 10. Histamin eksogen ini dipersiapkan dengan melarutkan histamin serbuk dalam akuades dalam jumlah tertentu hingga kadarnya 2x10-1 M, kemudian diencerkan hingga didapatkan seri kadar histamin sebagaimana tercantum pada tabel di bawah ini.
Tabel 1. Penambahan agonis histamin selama rekaman kontraksi trakea No. Penambahan volume (ml) Konsentrasi histamin yang ditambahkan (M) Konsentrasi histamin kumulatif (M) 1. 0,100 2x10-5 10-7 2. 0,200 2x10-5 3x10-7 3. 0,070 2x10-4 10-6 4. 0,200 2x10-4 3x10-6 5. 0,070 2x10-3 10-5 6. 0,200 2x10-3 3x10-5 7. 0,070 2x10-2 10-4 8. 0,200 2x10-2 3x10-4 9. 0,070 2x10-1 10-3
Rekaman kontraksi trakea dilakukan dengan pemberian agonis pada berbagai konsentrasi. Agonis histamin dengan kadar dan volume tertentu sesuai ketentuan pada tabel ditambahkan kedalam organ bath berisi pita trakea menggunakan mikropipet melalui lubang bagian atas organ bath dan diusahakan tidak mengenai benang karena dapat mempengaruhi output rekaman pada kimogram.
Menurut teori, pemberian agonis histamin akan memberikan efek kontraksi pada trakea sesuai dengan konsentrasi histamin yang diberikan. Semakin besar konsentrasi histamin yang diberikan, akan semakin besar respon kontraksinya. Namun pada suatu titik respon kontraksi akan mencapai maksimum, yang berarti pemberian agonis dengan konsentrasi lebih tinggi tidak akan meningkatkan respon kontraksi.
Hasil percobaan menunjukkan bahwa efek maksimal diperoleh saat kadar histamin dalam organ bath adalah 10-5. Kadar obat yang menghasilkan efek sebesar 50% efek maksimum disebut (D)50%. Logaritma negatif dari (D)50% dinyatakan sebagai pD2 yang merupakan parameter afinitas (kemampuan suatu agonis untuk
membentuk kompleks dengan reseptornya ).
pD2= -log (D)50%
Data yang didapat berupa grafik yang dihasilkan alat pengukur respon, kemudian dicari tinggi puncak maksimum yang ditetapkan sebagai respon maksimum. Tinggi puncak tiap respon diukur dan dirasiokan dengan tinggi puncak maksimum sehingga
didapat persentase respon.
% respon kontraksi = (hs/hmax) x 100%
Keterangan:
hs : efek kontraksi kumulatif untuk setiap peringkat dosis
hmax: efek kontraksi maksimum dari data rekaman
Berikutnya, diplotkan – log [konsentrasi Histamin dalam organ bath] sebagai sumbu X dan % respon sebagai sumbu Y, sehingga diperoleh kurva hubungan antara – log konsentrasi vs % respon. Dari perhitungan didapatkan persamaan garis linear sebagai berikut:
y = 27,22x + 263,5
Jika kita ingin mencari kadar yang memberikan 50% respon maksimum, kita masukkan harga 50 sebagai X. Setelah dilakukan perhitungan didapatkan nilai ED50
serta pD2sebagai berikut:
pD2= 5,6392
Nilai pD2 tersebut menggambarkan afinitas agonis terhadap reseptor atau
kemampuan agonis histamin untuk berikatan dengan reseptor H1. Semakin tinggi nilai
pD2, maka afinitas agonis histamin terhadap reseptor H1 semakin tinggi, yang berarti
selektivitas reseptor H1terhadap agonis histamin juga semakin tinggi. Dapat dilihat pula
bahwa nilai pD2 berbanding terbalik dengan ED50. Semakin tinggi nilai pD2 maka
kemampuan agonis untuk berikatan dengan reseptor makin tinggi, sehingga respon akan semakin mudah untuk timbul, dengan demikian konsentrasi agonis histamin yang dibutuhkan untuk menghasilkan respon sebesar 50% dari respon maksimal semakin rendah. Dari hasil yang diperoleh dapat disimpulkan bahwa histamin terbukti memiliki efek bronkokonstriksi pada otot trakea.
VII. KESIMPULAN
1. Histamin memberikan efek bronkokontriksi pada otot trakea.
2. Nilai pD2yang menggambarkan afinitas suatu senyawa, berbanding terbal ik dengan
ED50nya.
3. Dalam praktikum ini tidak dilaksanakan pengujian dengan antihistamin.
VIII. DAFTAR PUSTAKA
Di Giuseppe, M., dkk., 2003, Nelson Biology 12, Thomson Canada Ltd., Toronto.
Katzung, B. G., 2001, Farmakologi Dasar dan Klinik, Edisi 8, Mc Graw-Hill Companies Inc, San Francisco.
Yogyakarta, 28 November 2016 Asisten,
( )
Praktikan,
Annisa Nilamsari Utami
Muhammad Faishal Mahdi
Cinantya Talia Paramita