LAPORAN
PRAKTIKUM PEMISAHAN DAN PENGUKURAN
PENENTUAN KADAR PARASETAMOL DAN
KAFEIN DENGAN TEKNIK HPLC
Diajukan untuk memenuhi mata kuliah Praktikum Pemisahan dan Pengukuran Dosen Pengampu :
Dra. Soja Siti Fatimah, M.Si
Disusun oleh :
Hesti Kusumaningtyas (1307031)
Ida Khoerunnisah (1302021)
Ikhlas Fathurohman (1301508)
Jurusan Pendidikan Kimia
Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam
UNIVERSITAS PENDIDIKAN INDONESIA
BANDUNG
Tanggal Praktikum : 17 Februari 2015 Judul Praktikum :
Penentuan Kadar Paracetamol dan Kafein dengan Menggunakan Metode HPLC (High Performance Liquid Chromatography)
1. Tujuan
1.1 Dapat memahami cara kerja instrumen HPLC
1.2 Dapat melakukan preparasi dengan tepat dan akurat , serta dapat mengikuti manual pengoperasian HPLC.
1.3 Dapat menentukan/menghitung kadar parasetamol dan kafein dalam sampel obat.
2. Tinjauan Pustaka
HPLC (High Performance Liquid Chromatography) merupakan tipe kromatografi elusi yang paling serbaguna dan digunakan secara luas. Teknih ini digunakan oleh para kimiawan untuk memisahkan dan menentukan spesi-spesi dalam berbagai bahan atau senyawa seperti senyawa organik, anorganik, maupun material biologis. Pada kromatografi cair, fasa gerak merupakan pelarut cair berisi sampel yang berupa campuran dari bahan-bahan terlarut. Jenis-jenis kromatografi cair kinerja tinggi (HPLC) biasanya dikelompokkan oleh mekanisme pemisahannya ataupun jenis
fasa diamnya. Pengelompokkan tersebut diantaranya:
a) Partisi atau Kromatografi Cair-Cair b) Adsorpsi atau kromatografi Padat-Cair c) Penukar Ion atau Kromatografi Ion
d) Size-Exclusion Chromatography (Kromatografi Eksklusi Ukuran) e) Kromatografi Afinitas
f) Kromatografi Kiral
Sedangkan pada elusi gradien, digunakan dua (atau kadang lebih) pelarut dalam suatu sistem yang memiliki perbedaan kepolaran yang besar / signifikan. Perbandingan dari kedua atau lebih pelarut ini divariasikan melalui cara yang telah ditentukan dengan program saat pemisahan berlangsung. Pengubahan perbandingan ini kadang dilakukan secara terus-menerus dan kadang secara bertahap. Elusi gradien seringkali meningkatkan efisiensi pemisahan, seperti halnya pemrograman suhu pada GC. Instrumen HPLC modern biasanya dilengkapi dengan katup yan berpotongan sehingga dapat memasukkan cairan dari dua atau lebih reservoir dengan perbandingan yang dapat divariasikan secara terus menerus.
(Skoog, 2004: 973-977)
Fasa gerak
Di dalam kromatografi cair komposisi dari solven atau rasa gerak adalah salah satu dari variabel yang mempengaruhi pemisahan. Terdapat variasi yang sangat luas pada solven yang digunakan untuk KCKT/HPLC, tetapi ada beberapa sifat umum yang sangat disukai, yaitu rasa gerak harus :
1. Murni, tidak terdapat kontaminan
2. Tdak bereaksi dengan wadah (packing)
3. Sesuai dengan defektor
4. Melarutkan sampel
5. Memiliki visikositas rendah
6. Bila diperlukan, memudahkan "sample recovery"
7. Diperdagangan dapat diperoleh denganharga murah (reasonable price)
Umumnya, semua solven yang sudah digunakan langsung dibuang karena prosedur pemumiannya kembali sangat membosankandan mahal biayanya. Dari semua persyaratan di atas, persyaratan 1) s/d 4) merupakan yang sangat penting.
akan menyebabkan gangguan yang besar di dalam detektor sehingga data yang diperoleh tidak dapat digunakan (the data may be useless). Menghilangkan gas (degassing) juga sangat baik bila menggunakan kolom yang sangat sensitif terhadap udara (contoh :kolom berikatan dengan NH2).
(Effendy De Lux Putra, 2004: 7-8)
Komponen-komponen alat dalam HPLC diantaranya ialah:
Reservoir (wadah pelarut / cairan)
Pompa
Sistem injeksi sampel
Kolom, terdiri dari
1. Kolom Analitik / Kolom Utama 2. Kolom Guard
3. Termostat
Detektor
Komputer (Pengolah data)
dihubungkan kepada katup berpotongan, dimana katup ini berfungsi untuk mengatur cairan-cairan yang masuk / dipompa kedalam kolom.
Pelarut dimasukkan ke kolom melalui pipa atau selang menggunakan pompa. Pelarut dipompa dari reservoir sehingga dapat membawa sampel menuju kolom. Pompa yang digunkan dalam HPLC hatus memenuhi kriteria sebagai berikut:
1) Harus memiliki aliran terkontrol yang ‘reproducible’
2) Harus menghasilkan aliran yang ‘pulse-free’ (bebas pulsa, tidak menghasilkan gelembung)
3) Hold-up volume (volume tampungan) kecil
(R.P. Budhiraja, 2004: 172)
Karena HPLC menggunakan tekanan yang cukup tinggi, mustahil sampel dapat diinjeksikan dengan cara yang sama seperti pada kromatografi gas. Maka dari itu, sampel dimasukkan melalui loop injector. Sampling loop dapat diganti dan tersedia pada volume 0,5 mikroliter sampai 2 mililiter. Pada posisi terisi, sampling loop terisolasi dari fasa gerak dan terbuka terhadap atmosfer. Sebuah syringe dengan kapasitas beberapa kali dari loop sampling digunakan untuk menempatkan sampel kedalam loop.
Kolom yang paling umum digunakan untuk HPLC dibuat dari stainless steel dengan diameter internal antara 2,1 mm dan 4,6 mm dengan panjang mulai dari sekitar 30 mm sampai 300 mm. kolom-kolom ini dipak dengan 3-10 mikrometer partikel-partikel silika berpori yang dapat berbentuk irregular atau spherical. Kolom ini berfungsi sebagai tempat pemisahan berlangsung.
mm dan harganya satu persepuluh dari kolom analitik. Hal ini dikarenakan kolom guard digunakan sebagai “tumbal” dan diganti secara berkala.
Selanjutnya sampel yang telah terpisahkan dibawa menuju detektor. Detektor ini berfungsi untuk memberikan sinyal sehingga data dapat diolah dan ditampilkan. Detektor-detektor yang dapat digunakan dalam HPLC diantaranya:
Detektor Spektroskopi (adsorpsi sinar UV)
Detektor elektrokimia
Selain itu, ada juga detektor yang menggunakan pengukuran pada perubahan index refraksi dari fasa gerak, namun kurang berguna untuk elusi gradien kecuali komponen-komponen fasa gerak memiliki index refraksi yang mirip.
(Harvey David, 2000: 578-585)
Keuntungan KCKT/HPLC
KCKT dapat dipandang sebagai pelengkap Kromatografi Gas (KG). Dalam banyak hal kedua teknik ini dapat digunakan untuk memperoleh efek pemisahan yang sama membaiknya. Bila derivatisasi diperlukan pada KG, namun pada KCKT zat-zat yang tidak diderivatisasi dapat dianalisis. Untuk zat-zat yang labil pada pemanasan atau tidak menguap, KCKT adalah pilihan utama. Namun demikian bukan berarti KCKT menggantikan KG, tetapi akan memainkan peranan yang lebih besar bagi para analis laboratorium. Derivatisasi juga menjadi populer pada KCKT karena teknik ini dapat digunakan untuk menambah sensitivitas detektor UV Visibel yang umumnya digunakan.
KCKT menawarkan beberapa keuntungan dibanding dengan kromatografi cair klasik, antara lain:
Resolusi : Berbeda dengan KG, Kromatografi Cair mempunyai dua rasa dimana interaksi selektif dapat terjadi. Pada KG, gas yang mengalir sedikit berinteraksi dengan zat padat; pemisahan terutama dicapai hanya dengan rasa diam.
Kemampuan zat padat berinteraksi secara selektif dengan fasa diam dan fasa gerak
pada KCKT memberikan parameter tambahan untuk mencapai pemisahan yang diinginkan.
Sensitivitas detektor: Detektor absorbsi UV yang biasa digunakan dalam KCKT dapat mendeteksi kadar dalam jumlah nanogram (10-9 gram) dari bermacam- macam zat. Detektor-detektor Fluoresensi dan Elektrokimia dapat mendeteksi jumlah sampai picogram(10-12 gram). Detektor-detektor seperti Spektrofotometer Massa, Indeks Refraksi, Radiometri, dll dapat juga digunakan dalam KCKT
Kolom yang dapat digunakan kembali: Berbeda dengan kolom kromatografi klasik, kolom KCKT dapat digunakan kembali (reusable) . Banyak analisis yang bisa dilakukan dengan kolom yang sma sebelum darijenis sampel yang diinjeksi, kebersihan dari solven dan jenis solven yang digunakan Ideal untuk zat bermolekul besar dan berionik :zat – zat yang tidak bisa dianalisis dengan KG karena volatilitas rendah , biasanya diderivatisasi untuk menganalisi spsesies ionik. KCKT dengan tipe eksklusi dan penukar ion ideal sekali untuk mengalissis zat –zat tersebut.
Mudah rekoveri sampel: Umumnya setektor yang digunakan dalam KCKT tidak menyebabkan destruktif(kerusakan) pada komponen sampel yang diperiksa, oleh karena itu komponen sampel tersebut dapat dengan mudah dikumpulkan setelah melewati detector.Solvennya dapat dihilangkan dengan menguapkan ksecuali untuk kromatografi penukarion memerlukan prosedur khusus.
(Effendy De Lux Putra, 2004: 8)
Oleh karena itu, maka pembandingaan dilakukan dengan menggunakan teknik kurva kalibrasi.
Parasetamol dan kafein pada umumnya terdapat bersama sama dalam satu tablet obat yang memiliki sifat kepolaran berbeda. Gugus kromofor yang dimilikinya menyebabkan senyawa ini dapat menyerap sinar UV. Karaktersitik senyawa ini memungkinkan analisis dengan teknik HPLC menggunakan kolom nonpolar seperti C-18 dan fasa gerak polar campuran beberapa pelarut.
(Tim Dosen Praktikum Pemisahan dan Pengukuran, 2015: 1)
Paracetamol
Paracetamol secara luas digunakan untuk obat yang diperuntukan sebagai penawar rasa sakit, demam(mengurangi temperature). Tindakan ini dikenal sebagai analgesik dan antipiretik. Paracetamol murni berbentuk kristal padat yang meleleh pada suhu 167-171
. Daya larut dalam air dingin adalah 1,43 g/100 cm3, tetapi jauh lebih larut dalam air
panas yakni 5 g/100 cm3 dan dalam etanol kelarutannya 14 g/100 cm3.
(Frank Ellis dkk, 2002: 1)
Alkaloid yang mempunyai lingkar purin (lingkar senyawa heterosiklik yang majemuk, yang merupakan kondensasi antara lingkar imidazol dan lingkar pirimidin). Dengan rumus molekul C5H10N4O2 yang terdapat dalam biji-biji kopi dan daun teh. Kristal
kafein berbentuk jarum-jarum berwarna putih, tidak berbau, dan berasa pahit. Kafein
yang tidak mengandung kristal mencair pada suhu 238 . Kafein larut dalam larutan pirol dan tetrahidrofuran. Kelarutan kafein dalam air berkurang degan adanya asam-asam organik.
(Damin Sumardjo, 2009: 447)
Asetonitril
Metil Sianida CH3CN, zat cair toksik, disediakan dari asetilena dan amonia atau oleh
dihidrasi asetamida, digunakan untuk melarutkan senyawa organik ataupun anorganik.
(Hadyana Pudjaatmaka, 2002: 76)
Isopropil Alkohol
Propil Alkohol mempunyai rumus CH3CH2CH2OH . Isopropil alkohol merupakan isomer propil alkohol dengan rumus (CH3)2CHOH. Banyak digunakan untuk membuat minyak wangi, pelitur dan sebagai pelarut.
Alat dan Bahan Praktikum 2.1 Alat Praktikum
Perangkat HPLC 1 set
Spatula 1 buah
Labu ukur 50 mL 1 buah
Labu ukur 10 mL 6 buah
Neraca analitik terkalibrasi 1 set
Corong pendek 1 buah
Pipet tetes 2 buah
Gelas kimia 50 mL 3 buah
Ultrasonic vibrator 1 set
Pipet Ukur 1 ml 1 buah
Pipet Ukur 2 ml 1 buah
Pipet Ukur 3 ml 1 buah
Pipet Ukur 4 ml 1 buah
Pipet Ukur 5 ml 1 buah
Pipet Ukur 6 ml 1 buah
Ball Filler 1 buah
Filter Membran Selulosa Nitrat 1 set
Botol Vial 2 buah
2.2 Bahan Praktikum
Parasetamol p.a 25 mg
Kafein 12,5 mg
Asetonitril 30 ml
KH2PO4 420 ml
Iso propil alkohol 30 ml
Metanol secukupnya
Sampel obat Bodrex 4,1 mg
Aquabides secukupnya
Membran PTFE/selulosa nitrat buah
Kertas saring 1 buah
3. Prosedur Kerja Praktikum
3.1Pembuatan fasa gerak (Pelarut).
Sebanyak 420 mL KH2PO4- 0,01 M, ditambahkan metanol 20 mL, ditambahkan
asetonitril 30 mL, ditambahkan isopropil alkohol 30 mL, disaring menggunakan membran whatman filter PTFE 0,2 μm, disonikasi selama 30 menit. (Larutan Fasa Gerak sudah tersedia)
3.2 Pembuatan larutan induk parasetamol
Ditimbang seksama sejumlah 25 mg Parasetamol p.a dan 12,5 mg kafein
p.a dimasukkan kedalam labu 50 mL
Tambahkan pelarut sebanyak 20 mL, disonikasi selama 15 menit,
diencerkan dengan pelarut hingga garis tanda batas..
Hitunglah konsentrasi larutan induk untuk parasetamol dan kafein
3.3 Pembuatan deret larutan standar parasetamol + kafein
Pipet larutan induk parasetamol dan kafein masing-masing sebanyak 1 ; 2 ; 3 ;
4 ;5 dan 6 mL, masukkan ke dalam labu ukur 10 mL.
Tambahkan pelarut(fasa gerak yang tersedia)hingga tanda batas
Lakukan sonikasi selama 5 menit.
Dilakukan degassing apabila masih terdapat gelembung dalam larutan
Injeksikan ke sistem HPLC dengan volume penyuntikan 20 μl
Selanjutnya dibuat kurva kalibrasi
3.4 Pembuatan larutan sampel obat bodrex
Menimbang 4,1 mg, dimasukkan kedalam labu ukur 10 mL, ditambahkan
pelarut(aquabides) hingga setengah volume labu ukur), disonikasi selama 5 menit,
Encerkan dengan pelarut(aquabides) hingga garis tanda, dikocok lalu disaring
menggunakan kertas saring
Dipindahkan ke dalam botol vial
Kemudian proses melakukan penyaringan kedua menggunakan membran
whatman PTFE 0,2 μm (filtrat pertama dibuang(digunaakan untuk membilas filter/injektor, kemudian ditampung filtrat selanjutnya).
Injeksikan sampel obat ke dalam HPLC.
3.5 Penyiapan Instrumen HPLC
Kondisi Analisis parasetamol dan kafein
Fasa gerak : KH2PO4 0,01 M 420mL, 20 ml metanol, 30 asetonitril 30 mL isopropil alkohol
Kolom (fasa diam) : C-18 (15 cm) Panjang gelombang : 215 nm
Laju alir : 1 mL/menit
Volume injeksi : 20 µL
Pastikan kabel penghubung listrik telah tersambung dengan benar.
Tekan tombol “ON” pada sakelar listrik.
Isi botol fasa gerak dengan volume yang memadai dan kosongkan botol
penampung.
Tekan tombol “ON” pada alat, berturut-turut untuk power, detektor dan
pompa.
Lakukan pemrograman alat dengan computer.Ikuti langkahnya sesuai instruksi
dalam komputer.
Pilihlah mode yang akan digunakan sesuai dengan parameter kondisi
instrumen.
Apabila respon kromatogram tidak muncul lagi, artinya alat telah
menunjukkan base line yang mendatar, maka instrumen siap digunakan.
Injeksikan berturut-turut larutan standar (mulai dari konsentrasi terendah), dan
terakhir larutan sampel
Cetak hasil pengukuran, catat kondisi percobaannya.
Setelah selesai digunakan, matikan pompa dengan menyoroti tanda pompa
dalam computer.
Tutup file sesuai petunjuk, lalu matikan computer.
Untuk mematikan, tekan tombol “Off” pada pompa, detector dan power secara
berurutan. Putuskan sambungan listrik.
3.6 Perhitungan hasil analisis
Hasil dan Analisis Data
Tabel Penimbangan 1 Tablet Obat Bodrex No Berat Setiap 1 Tablet Obat
Bodrex 1. 0,8321 g 2. 0,8530 g 3. 0,8407 g 4. 0,8326 g 5. 0,8350 g 6. 0,8315 g 7. 0,8418 g 8. 0,8568 g 9. 0,8321 g 10. 0,8427 g
Rata-rata
0,84016 g
Sampel Obat
Diduga zat yang terkandung
Waktu Retensi (menit)
Luas Area
Paracetamol 2.38
117052 88
Kafein 3.62
216412 8
Deret Standar Paracetamol
Konsentrasi (ppm)
Luas
Area Waktu Retensi (menit)
50
225210
6 2.38
5
150
620825
3 2.38
200
797907
2 2.38
250
100930
86 2.39
300
122615
50 2.38
Berdasarkan data hasil percobaan, luas area kandungan sampel yang diduga paracetamol (11705288), berada pada rentang deret standar paracetamol (10093086-12261550). Sehingga kadar paracetamol dapat dihitung menggunakan persamaan garis
y = 39646 x + 234188 Sehingga,
y = 39646 x + 234188 11705288 = 39646 x + 234188
x = 1170528839646-234188
x = 289,3381 ppm
= 2,8934 mg Bobot sampel = 4,1 mg
Berat Rata- rata penimbangan obat bodrex = 840,16 mg
Kadar mg Paracetamol dalam Hasil percobaan
mg/tablet
Deret Standar Kafein
Berdasarkan data hasil percobaan luas area kandungan sampel yang diduga kafein (2164128) berada di luar rentang deret standar kafein ( < 2164416), sehingga kadar kafein dalam sampel dihitung menggunakan perbandingan standar dengan sampel, yaitu konsentrasi dan luas areanya.
= LuasLuasAreaAreaStandarSampel
[Sampel] = 24,9967 ppm
Mg kafein = ppm V (L)
= 24,9967 ppm 0,01 L
= 0,2500 mg
Kadar mg Kafein dalam Hasil percobaan
komponen dalam sampel di antara dua fase, fase gerak dan fase diam. Fase gerak yang digunakan berupa campuran senyawa KH2PO4, methanol, asetonitril, dan isopropyl alkohol dengan perbandingan 42 : 2 : 2 : 3. Sedangkan fase diam yang digunakan adalah kolom C-18 yang bersifat non polar. Oleh karena itu percobaan kali ini menggunakan metode HPLC fase terbalik, karena fase gerak yang digunakan bersifat polar sedangkan fase diamnya bersifat non polar, dengan sistem elusi isokratik, artinya selama analisis digunakan fase gerak dengan perbandingan pelarut yang tetap.
Dalam preparasi sampel, sampel ditimbang kemudian dilarutkan menggunakan aquabidest. Digunakan aquabidest karena dalam analisis menggunakan HPLC diperlukan pelarut dengan kemurnian yang tinggi, sebab larutan sampel yang akan dianalisis jumlahnya sangat sedikit (sekitar 20µl) sehingga apabila digunakan pelarut dengan kemurnian kurang akan dapat mengganggu hasil pemisahan. Sebelum pengenceran sampel sampai 10 ml, dilakukan sonikasi terlebih dahulu agar semua komponen dalam sampel larut dan homogen. Setelah diencerkan sampai 10 ml secara kuantitatif, larutan sampel disaring sebanyak dua kali. Penyaringan pertama dilakukan menggunakan kertas saring kasar. Hal tersebut dilakukan karena dalam obat tidak hanya mengandung paracetamol dan kafein, namun terdapat zat penyusun lain yang belum larut seluruhnya yang masih berupa partikel-partikel padat dalam larutan. Selanjutnya filtrate disaring kembali menggunakan membran selulosa nitrat agar diperoleh larutan sampel murni tanpa ada partikel-partikel pengganggu /pengotor yang dapat mempengaruhi hasil pemisahan. Apabila langsung dilakukan penyaringan menggunakan membran selulosa nitrat, dikhawatirkan partikel-partikel yang tidak larut dalam larutan sampel akan menyumbat pori-pori membran sehingga penyaringan akan membutuhkan waktu yang lama. Sebelum ditampung, sebagian filtrat dibuang terlebih dahulu yang dimaksudkan untuk membilas membran agar dapat dipastikan tidak ada zat kontaminan dari membran yang dapat ikut tertampung.
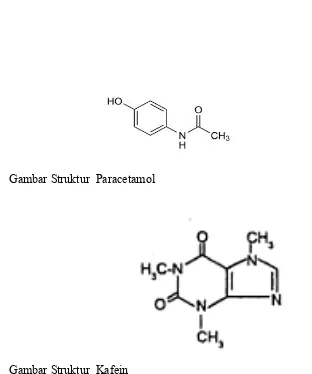
Gambar Struktur Paracetamol
Gambar Struktur Kafein
Dapat dilihat bahwa paracetamol memiliki gugus hidroksi (-OH) yang dapat membentuk ikatan hidrogen dengan air sehingga lebih mudah larut dalam air atau senyawa polar lainnya sedangkan kafein memiliki struktur yang relatif lebih non polar dibandingkan dengan paracetamol sehingga akan tertahan lebih lama di kolom yang sifatnya non polar.
dalam area deret standar maka digunakan perbandingan konsentrasi dan luas area deret standar dengan sampel.
Sebelum dilakukan pemisahan, instrument HPLC harus dikondisikan pada keadaan optimal agar hasil pemisahan yang didapatkan baik. Kemudian baik sampel maupun deret standar, sebelum diinjeksikan ke dalam HPLC perlu dilakukan degassing untuk menghilangkan gelembung udara karena gelembung udara dapat terkumpul di kepala pompa ataupun detektor sehingga akan mengganggu kondisi HPLC.
Berdasarkan data pengamatan, diperoleh kadar paracetamol dan kafein dalam sampel obat masing-masing sebesar 592,9070 mg/tablet dan 51,2293 mg/tablet. Hasil tersebut mendekati data kadar yang tercantum pada kemasan obat yaitu paracetamol sebanyak 600 mg/tablet dan kafein sebanyak 50 mg/tablet.
Kesalahan-kesalahan yang mungkin terjadi selama analisis pada percobaan ini di antaranya, masih terdapat sisa sampel yang telah ditimbang yang tidak ikut dilarutkan sehingga kadar yang diperoleh kurang akurat, masih terdapat gelembung setelah dilakukan penginjeksian, atau pengoperasian instrument yang kurang tepat sehingga mempengaruhi hasil kromatogram yang akan didapat.
Kesimpulan
Berdasarkan hasil percobaan yang telah dilakukan, diperoleh kadar paracetamol dan kafein dalam sampel obat masing-masing sebesar 592,9070 mg/tablet dan 51,2293 mg/tablet. Hasil tersebut mendekati kadar yang tercantum pada kemasan obat yaitu paracetamol sebanyak 600 mg/tablet dan kafein sebanyak 50 mg/tablet.
Daftar Pustaka
Budhiraja, R.P. (2004). Separation Chemistry. New Delhi: New Age International (p) Ltd. David, Haervey. (2000). Modern Analytical Chemistry. New York: McGraw-Hill
De Lux Putra, Effendy. (2004). Kromatografi Cair Kinerja Tinggi Dalam Bidang Farmasi Jurnal, hlm. 5-8.
Ellis, Frank dkk. (2002). Paracetamol-a curicullum resource. United Kingdom : Royal Society of Chemistry
Skoog, dkk. (2004). Fundamentals of Analytical Chemistry. USA: Thomson Brooks/Cole Sumardjo, Damin. (2009). Pengantar Kimia Buku Panduan Kuliah Mahasiswa
Kedokteran. Jakarta : EGC
Lampiran
Langkah Kerja & Tabel Pengamatan
No Langkah Kerja Data Pengamatan
1. -Fasa Gerak Sudah
disediakan
-Fasa Gerak : Cairan Tidak Berwarna 2. Pembuatan Larutan Induk Paracetamol & Kafein
-Paracetamol : Serbuk berwarna putih keruh
-Kafein : Serbuk berwarna putih keruh
-Fasa Gerak : Cairan tidak berwarna -Disonifikasi agar larutan menjadi homogen
-Larutan Induk
Paracetamol + kafein : Tidak berwarna
- Konsentrasi
Paracetamol : 500 ppm - Konsentrasi Kafein : 250 ppm
Pembuatan Fasa Gerak (Pelarut)
-diambil 420 mL KH2PO4 0,01 M pada gelas kimia
- ditambahkan Metanol 20 mL - ditambahkan Asetonitril 30 mL - ditambahkan Isopropil Alkohol 30 Ml
- disaring menggunakan membran whatman filter PTFE 0,2 m
- disonifikasi selama 30 menit
Fasa Gerak (Pelarut)
Paracetamol
- ditimbang sebanyak 12,5 mg Kafein
- ditimbang sebanyak 25 mg
Kafein + Paracetamol
- keduanya dimasukkan ke dalam labu ukur 50 mL
- ditambahkan pelarut (fasa gerak) - disonifikasi selama +/- 5 menit
- diencerkan dengan pelarut (fasa gerak) hingga tanda batas
Larutan Induk Kafein + Paracetamol
- disonifikasi selama 5 menit
- dihitung konsentrasi larutan induk paracetamol & kafein
3. Pembuatan Deret Larutan Standar Kafein & Paracetamol
-disonifikasi agar homogen
- didegasing dengan membuka tutup labu ukur,agar gelembung yg ada dapat hilang
- deret larutan standar = tidak berwarna
4. Pembuatan Larutan Sampel
-Obat Bodrex : Serbuk Berwarna jingga - Data Sampel Obat pada kemasan mengandung
paracetamol 800 mg dan kafein 50 mg
-Rata-rata berat penimbangan sampel obat = 0,84016 g -Berat Kertas Timbang = 0,1219 g
- Hasil penimbangan Kertas Timbang + Sampel Obat = 0,1260 g - Massa Obat = 0,0041 g/ 0,41 mg
- Pelarut = Aquabides
- Larutan sampel saat penambahan hingga setengah volume labu ukur = berwarna jingga - Larutan sampel saat ditanda bataskan = tidak berwarna
Deret Larutan Standar
Larutan Induk Kafein + Paracetamol
- dipipet sebanyak 1ml;2ml;3ml;4ml;5ml;6ml - dimasukkan masing-masing ke dalam labu ukur 10 ml
- ditambahkan pelarut (fasa gerak) hingga tanda batas
- disonifikasi selama 5 menit - didegasing
Serbuk Tablet Obat
- ditambahkan pelarut hingga setengah volume labu ukur
- disonifikasi selama 5 menit
- ditambahkan pelarut hingga tanda batas - dikocok
- disaring menggunakan kertas saring Labu Ukur 10 ml
- ditentukan berat rata-rata tablet obat - ditimbang sebanyak 4 mg
- dimasukkan ke dalam ukur 10 mL
Hasil Filtrat Kurva Kalibrasi
- diinjeksikan larutan sebnayak 20 L
- dibuat kurva kalibrasi
- ditampung dalam botol vial
- disaring menggunakan membran selulosa nitrat
- dimasukkan ke dalam ukur 10 mL
Hasil Filtrat ke-2
- 1ml filtrat dibuang (digunakan untuk membilas injeksi, botol vial)
- 1 ml berikutnya ditampung
-Kertas Saring = Berwarna Putih
-Membran Selulosa Nitrat = Berwarna Putih - Volume yg
5. Penyiapan Instrumen HPLC
Kondisi Analisis Paracetamol & Kafein Fasa Gerak
- KH2PO4 0,01 M 420ml - 20 ml metanol
- 30 ml asetonitril
- 30 ml Iso Propil Alkohol
Kolom (Fasa Diam)
- panjang 15 cm - C-18
- panjang gelombang 215 nm - laju alir 1 ml/menit
-Volume injeksi 20 L
Preparasi Sistem HPLC
- dipastikan kabel penghubung listrik telah tersambung dengan benar
- ditekan tombol “on” pada sakelar listrik - diisi botol fasa gerak dengan volume yang memadai dan kosongkan botol penampung
- ditekan tombol on pada alat, berturut-turut untuk power, detektor dan pompa
-dilakukan pemrograman alat dengan komputer, ikuti langkahnya sesuai instruksi dalam komputer -dipilih mode yg akan digunakan sesuai dengan parameter kondisi instrumen
- dialirkan fasa gerak
- apabila respon kromatogram tidak muncul lagi, artinya alat telah menunjukkan base line yang mendatar, maka instrumen siap digunakan - injeksikan berturut-turut larutan standar (mulai dari konsentrasi rendah) dan terakhir larutan sampel
- dicetak hasil pengukuran, catat kondisi percobaannya
- setelah selesai digunakan, dimatikan pompa dengan menyoroti tanda pompa dalam komputer - tutup file sesuai petunjuk, lalu matikan komputer - untuk mematikan, tekan tombol off pada pompa, detector dan power secara berurutan
-putuskan sambungan listrik
Perhitungan
Pembuatan Larutan Induk
Larutan Induk
Larutan Deret Standar Paracetamol
a. 1 ml larutan induk
ppm
b. 2 ml larutan induk
ppm
c. 3 ml larutan induk
ppm
d. 4 ml larutan induk
ppm
e. 5 ml larutan induk
ppm
f. 6 ml larutan induk
ppm
Larutan Deret Standar Kafein
a. 1 ml larutan induk
ppm
ppm
c. 3 ml larutan induk
ppm
d. 4 ml larutan induk
ppm
e. 5 ml larutan induk
ppm
f. 6 ml larutan induk
Lampiran Foto Selana Praktikum
1. Alat yang dibutuhkan selama praktikum
2. Pelarut/ Fasa Gerak
3. Pelarut/ Aquabides
4. Instrumen HPLC
5. Instrumen HPLC tampak samping
6. Penimbangan Sampel untuk membuat larutan Induk dan Larutan sampel
7. Sampel Obat Bodrex
9. Penambahan pelarut(aquabides/ fasa gerak)untuk membuat larutan induk, larutan sampel
10. Hasil pembuatan deret larutan standar 1 mL;2 mL; 3 mL;4 mL ; 5 mL ; 6 mL
11. Hail penambahan pelarut (aquabides) pada sampel obat, hingga setengah volume ukuran labu ukur
12. Proses Sonifikasi pada Ultrasonic Vibrator
13. Larutan Sampel Obat
15. Hasil Penyaringan menggunakan kertas saring
16. Penyaringan kedua menggunakan membran selulosa nitrat
17. Hasil penyaringan menggunakan membran selusosa nitrat
18. Penginkjeksian Deret larutan standar/ Larutan sampel
19. Deret Larutan Standar/ Larutan sampel siap diinjeksikan, sudah tidak terdapat gelembung dalam syringe.
20. Proses Penginjeksian