BAB II
TINJAUAN PUSTAKA
2.1 Protein
Nutrisi adalah senyawa kimia, makanan manusia membutuhkan lebih dari
40 nutrisi yang berbeda bagi kesehatannya. Nutrisi tersebut dibagi dalam lima kelompok utama yaitu protein, lemak, karbohidrat, vitamin, dan mineral. Manusia harus mendapatkan nutrien yang dibutuhkan tubuh, salah satunya protein yang memiliki peranan penting dalam pertumbuhan (Sibagariang, 2010).
Nama protein berasal dari kata Yunani protebos, yang artinya “yang pertama” atau “yang terpenting”. Molekul protein mengandung unsur-unsur C, H, O, dan unsur khusus yang terdapat di dalam protein dan tidak terdapat di dalam molekul karbohidrat dan lemak ialah nitrogen (N) (Sediaoetama, 2010). Protein juga dapat mengandung unsur sulfur, fosfor, dan unsur logam seperti seng, besi, dan tembaga (Roe, 1979).
Protein pada buah dan sayuran, sama seperti polisakarida, dibentuk dari senyawa-senyawa yang lebih sederhana yaitu asam amino, sama halnya dengan polisakarida yang selalu diikuti dengan senyawa monosakarida, asam amino dan senyawa nitrogen sederhana lain juga selalu muncul dan berhubungan dengan protein (Duckworth, 1966).
dikarenakan perbedaan pada komposisi asam amino, daya cerna, dan ketersediaan dari protein yang telah dicerna (Jeon dan Ikins, 1994). Agar dapat diserap, protein harus dipecah menjadi asam amino atau peptida kecil (produk hasil pencernaan protein yang tersusun dari dua atau tiga asam amino) (Eschleman, 1984).
2.1.1 Asam Amino
Protein tersusun atas unit-unit individual asam-asam amino. Setiap asam amino memiliki gugus amin (NH2) pada salah satu dari atom karbon pusat dan sisi lainnya merupakan gugus asam (COOH). Di dalam makanan ada 20 jenis asam amino yang berbeda, masing-masing memiliki struktur dasar yang sama, yang membedakan hanyalah gugus R pada salah satu sisinya (Forsythe, 1995). Jika R adalah hidrogen, maka asam amino tersebut adalah glisin, jika R adalah gugus metil (-CH3), maka asam amino tersebut adalah alanin (Wardlaw, dkk., 2004). Struktur dasar asam amino dapat dilihat pada Gambar 2.1.
H
NH2 -C- COOH R
Gambar 2.1 Struktur Dasar Asam Amino (Forysthe, 1995)
sehingga sistin dan tirosin harus dibentuk melalui asam amino esensial atau langsung diperoleh dalam makanan. Oleh karena itu, sistin dan tirosin disebut sebagai asam amino semi-esensial. Dalam beberapa status kesehatan seperti pada bayi atau orang dewasa dengan luka trauma, asam amino lain juga dapat digolongkan sebagai asam amino esensial (Wardlaw, dkk., 2004). Klasifikasi asam amino dapat dilihat pada tabel 2.1. berikut:
Tabel 2.1 Klasifikasi Asam Amino
Asam Amino Esensial Asam Amino Semi Esensial
Asam Amino Non-Esensial Histidin Isoleusin Leusin Lisin Metionin Fenilalanin Treonin Triptofan Valin Arginin Sistin Glutamin Glisin Prolin Tirosin Alanin Asparagin Asam aspartat Asam glutamat Serin
Sumber: Wardlaw, dkk. (2004).
2.1.2 Struktur Protein
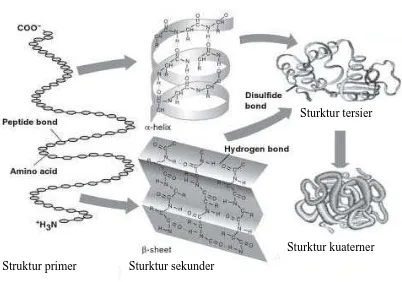
Di dalam gugus sisa molekul R, mungkin terdapat gugus reaktif lain yang dapat saling mengikat, seperti gugus karboksil pada asam amino yang bersifat asam, gugus amino pada asam amino yang bersifat basa, dan gugus sulfihidril (SH) pada asam amino sulfur (metionin, sistein). Gugus reaktif ini jika saling bereaksi membentuk struktur melilit seperti selenoid (perspiral). Gaya-gaya ikatan jenis kedua ini menimbulkan struktur sekunder pada molekul polipeptida, yang berbentuk gelang, cincin atau melilit seperti selenoid. Jadi setelah terjadi struktur primer dalam bentuk rantai panjang polipeptida, ikatan-ikatan sekunder menimbulkan struktur tambahan yang diberi nama struktur sekunder (Sediaoetama, 2010).
Disamping gaya sekunder, terdapat lagi gaya-gaya tersier yang disebabkan oleh gugus reaktif yang lebih lemah, yaitu gugus yang mengandung muatan listrik dan gaya tarik Vanderwaals. Gaya-gaya tingkat tiga ini dapat menyebabkan lagi tambahan bentuk stereometrik di dalam ruang, sehingga molekul polipeptida mendapat bentuk yang lebih kompleks lagi dalam ruang, misalnya bentuk global (bola), bentuk lonjong, dan bentuk stereometrik lainnya. Gaya-gaya terakhir ini disebut gaya tingkat tiga dan menyebabkan struktur protein tingkat tiga (Sediaoetama, 2010).
2.1.3 Denaturasi Protein
Denaturasi protein terjadi akibat perubahan pada struktur sekunder, tersier, dan kuaterner protein tanpa perubahan pada struktur primer. Denaturasi mengubah sifat-sifat dari protein seperti hilangnya aktivitas enzim. Kebanyakan protein makanan dikonsumsi dalam keadaan terdenaturasi. Denaturasi protein dapat diinginkan maupun tidak tergantung pada keadaannya. Denaturasi meningkatkan daya cerna dari suatu protein, terkadang pula membuat makanan menjadi lebih lezat (Ustunol, 2015). Denaturasi dapat terjadi secara parsial atau sempurna, dapat pula bersifat reversibel maupun irreversibel (Brown dan Rogers, 1981).
Menurut Brown dan Rogers (1981), penyebab denaturasi protein adalah sebagai berikut:
Sturktur Protein
Sturktur tersier
Sturktur kuaterner Sturktur sekunder
Struktur primer
1. Pemanasan. Kebanyakan protein globular mengalami denaturasi ketika dipanaskan pada suhu diatas 50-60°C. Contohnya, pendidihan atau penggorengan telur menyebabkan protein pada putih telur mengalami denaturasi dan membentuk massa yang tidak larut.
2. Perubahan pH yang drastis. Penambahan asam atau basa pekat pada larutan protein menyebabkan perubahan sifat rantai samping yang dapat terionisasi dan menganggu interaksi ion atau garam. Contohnya, dalam uji kimia tertentu penghilangan protein perlu dilakukan, hal ini dapat dilakukan dengan penambahan asam trikloroasetat (asam organik kuat) untuk mendenaturasi dan mengendapkan protein yang ada.
3. Deterjen. Penambahan natrium dodesilsulfat pada larutan protein dapat menyebabkan konformasi protein terbuka dan memaparkan rantai samping nonpolar protein. Rantai samping ini kemudian distabilkan oleh interaksi hidrofobik dengan rantai panjang hidrofobik dari deterjen.
4. Pelarut organik seperti alkohol, aseton atau eter. Pelarut-pelarut ini dapat menganggu ikatan hidrogen dari protein.
5. Perlakuan mekanis. Kebanyakan protein globular dalam larutan mengalami denaturasi ketika diaduk atau dikocok dengan kuat. Contohnya, pengocokan putih telur untuk membuat krim.
6. Urea dan guanidin hidroklorida. Pereaksi ini menyebabkan gangguan pada ikatan hidrogen dan interaksi hidrofobik protein.
2.1.4 Klasifikasi Protein
sederhana (simple protein), protein derivat (derivative protein), dan protein konjugasi (conjugated protein). Protein sederhana adalah protein yang bila dihidrolisis hanya menghasilkan asam-asam amino. Protein derivat merupakan produk antara (intermediate product) sebagai hasil hidrolisis parsial protein (albumosa, pepton, dan sebagainya) (Sediaoetama, 2010). Protein konjugasi adalah protein sederhana yang terikat dengan gugus lain yang bukan asam amino. Gugus tersebut dinamakan gugus prostetik contohnya nukleoprotein (kombinasi protein dengan asam nukleat dan mengandung 9-10% fosfat), lipoprotein (protein larut air yang berkonjugasi dengan lipid, seperti lesitin dan kolesterol), fosfoprotein (protein yang terikat melalui ikatan ester dengan asam fosfat seperti pada kasein dalam susu), metaloprotein (protein yang terikat dengan mineral, seperti feritin dan hemosiderin dimana mineralnya adalah zat besi, tembaga, dan seng). Bentuk protein konjugasi lain adalah hemoprotein dan flavoprotein (Almatsier, 2004).
mengandung asam amino esensial yang lengkap, tetapi beberapa diantaranya hanya sedikit, protein ini tidak dapat menjamin pertumbuhan, tetapi dapat mempertahankan kehidupan jaringan yang sudah ada, contohnya legumin dan gliadin (Suhardjo dan Kusharto, 1992).
Berdasarkan bentuknya, protein digolongkan menjadi protein bentuk serabut (fibrous) dan protein globular. Protein bentuk serabut terdiri atas beberapa rantai peptida berbentuk spiral yang terjalin satu sama lain sehingga menyerupai batang yang kaku. Karakteristik protein berbentuk serabut adalah rendahnya daya larut, mempunyai kekuatan mekanis yang tinggi, dan tahan terhadap enzim pencernaan. Protein ini terdapat dalam unsur-unsur struktur tubuh, contohnya kolagen, elastin, keratin, dan miosin. Protein globular adalah protein yang berbentuk bola dan terdapat dalam cairan jaringan tubuh. Protein ini larut dalam larutan garam dan asam encer, mudah berubah di bawah pengaruh suhu, konsentrasi garam serta mudah mengalami denaturasi, contohnya albumin, globulin, histon, dan protamin (Almatsier, 2004).
Menurut Sudarmadji, dkk. (1989), berdasarkan peranan protein dalam jasad hidup, berbagai jenis protein dapat dikelompokkan sebagai berikut:
sebagai senyawa antibodi yang melindungi tubuh dari serangan bakteri dan bahan asing lain.
2. Protein kontraksi, yaitu protein yang terdapat dalam jaringan otot dan sel kontraksi. Dalam otot terdapat protein aktin yang dalam keadaan kontraksi akan terikat dengan protein miosin menjadi aktomiosin.
3. Protein pernafasan, yaitu kelompok protein yang berperan mengangkut oksigen dari organ pernafasan ke jaringan-jaringan yang memerlukan oksigen contohnya hemoglobin.
4. Enzim, yaitu kelompok protein yang mengkatalisis reaksi-reaksi metabolisme jasad hidup.
5. Hormon, yaitu jenis protein yang dihasilkan oleh kelenjar-kelenjar endokrin yang kemudian diangkut oleh darah ke organ tubuh yang memerlukannya. 6. Protein persediaan makanan. Dalam jaringan hewan maupun tanaman,
terdapat protein tertentu yang ditimbun sebagai cadangan makanan. Pada hewan yang bertelur (ovopar) protein persediaan ini terdapat dalam telur atau pada mamalia berupa susu, sedangkan pada tanaman terdapat dalam biji. 7. Protein inti sel atau nukleoprotein merupakan jenis protein yang terpenting
dalam proses penerusan sifat-sifat keturunan yang terdapat dalam kromosom. 8. Senyawa musin dan mukoid, yaitu kelompok protein yang sangat kental dan
9. Kolagen, yaitu kelompok protein dalam jaringan pengikat misalnya dalam tulang, tulang rawan, urat ligamen otot, dan kulit.
10.Keratin, yaitu kelompok protein yang tidak dapat larut dan sulit mengalami hidrolisa misalnya dalam rambut, tanduk, kulit, dan kuku.
2.1.5 Sumber Protein
Protein dapat diperoleh baik dari sumber hewani maupun nabati. Pada umumnya, makanan asal hewani mengandung lebih banyak protein dibandingkan dengan makanan asal nabati, walaupun beberapa sayuran seperti kedelai mempunyai kandungan protein yang tinggi. Protein sayuran umumnya mempunyai nilai biologik (biological value = BV) lebih rendah dibandingkan protein hewani. Tetapi, dalam susunan makanan campuran, hal tersebut tidak terlalu serius lagi, dan pada umumnya, protein nabati lebih menguntungkan karena lebih murah dibandingkan dengan protein hewani. Protein nabati yang mempunyai BV tinggi telah digunakan selama beberapa tahun dan dengan demikian tidak biasa lagi dibedakan antara “protein kelas satu” asal hewani dan “protein kelas dua” asal nabati (Gaman dan Sherrington, 1981).
Sumber protein hewani dapat berbentuk daging dan organ dalam seperti hati, pankreas, ginjal, paru, jantung, dan jeroan. Susu dan telur termasuk pula sumber protein hewani berkualitas tinggi. Ikan, kerang-kerangan dan jenis udang merupakan kelompok sumber protein yang baik, karena mengandung sedikit lemak (Sediaoetama, 2010).
2.1.6 Fungsi Protein
Protein dalam makanan dibutuhkan untuk pertumbuhan, pemeliharaan dan perbaikan jaringan, sintesis enzim, pengangkutan zat gizi, dan sistem imun atau mekanisme pertahanan tubuh (Roe, 1979).
Protein diperlukan untuk pertumbuhan dan pemeliharan jaringan. Tubuh manusia selalu berada dalam keadaan dinamik dimana sel-sel secara terus menerus dipecah (katabolisme) dan diganti (anabolisme). Ketika jaringan protein dipecah, asam amino dilepaskan ke plasma dan digunakan kembali untuk membentuk dan memperbaiki jaringan (Eschleman, 1984).
Sebagai zat-zat pengatur, protein mengatur proses-proses metabolisme dalam bentuk enzim dan hormon. Proses metabolik (reaksi biokimiawi) diatur dan dilangsungkan atas pengaturan enzim, sedangkan aktivitas enzim diatur lagi oleh hormon, agar terjadi hubungan yang harmonis antara proses metabolisme yang satu dengan yang lain (Sediaoetama, 2010).
Protein memegang peranan esensial dalam mengangkut zat-zat gizi dari saluran cerna melalui dinding saluran cerna ke dalam darah, dari darah ke jaringan-jaringan, dan melalui membran sel ke dalam sel-sel. Alat angkut protein ini dapat bertindak secara khusus, misalnya, protein pengikat-retinol yang hanya mengangkut vitamin A, atau dapat mengangkut beberapa jenis zat gizi seperti mangan dan zat besi, yaitu transferin, atau mengangkut lipida dan bahan sejenis lipida yaitu lipoprotein. Bila kekurangan protein, menyebabkan gangguan pada absorpsi dan transportasi zat-zat gizi (Almatsier, 2004).
menghancurkan benda-benda asing yang masuk ke dalam tubuh seperti virus, bakteri, dan sel-sel asing lain. Protein mempunyai kemampuan untuk membedakan benda-benda yang menjadi anggota tubuh dengan benda-benda asing. Protein pertahanan tubuh sekarang dikenal dengan immunoglobulin (Ig) (Budiyanto, 2004).
Cairan tubuh terdapat di dalam tiga kompartemen: intraselular (di dalam sel), ekstraselular/ interselular (di antara sel), dan intravaskular (di dalam pembuluh darah). Kompartemen-kompartemen ini dipisahkan satu sama lain oleh membran sel. Distribusi cairan di dalam kompartemen-kompartemen ini harus dijaga dalam keadaan seimbang atau homeostatis. Keseimbangan ini diperoleh melalui sistem kompleks yang melibatkan protein dan elektrolit. Penumpukan cairan di dalam jaringan dinamakan edema dan merupakan tanda awal kekurangan protein (Almatsier, 2004).
Protein tubuh bertindak sebagai buffer, yaitu bereaksi dengan asam dan basa untuk menjaga pH pada taraf konstan. Sebagian besar jaringan tubuh berfungsi dalam keadaan pH netral atau sedikit alkali (pH 7,35-7,45) (Almatsier, 2004).
Sebagai sumber energi, protein ekivalen dengan karbohidrat, karena menghasilkan 4 kkal/g protein. Namun, protein sebagai sumber energi relatif lebih mahal, baik dalam harga maupun dalam jumlah energi yang dibutuhkan untuk metabolisme energi (Almatsier, 2004).
2.2 Non Protein Nitrogen
Dalam analisa bahan makanan dianggap bahwa semua nitrogen berasal dari protein merupakan suatu hal yang tidak benar. Unsur nitrogen ini di dalam makanan mungkin berasal pula dari ikatan organik lain yang bukan jenis protein, misalnya urea dan berbagai ikatan amino yang terdapat dalam jaringan tumbuhan. Nitrogen yang berasal dari ikatan yang bukan protein, disebut non protein nitrogen (NPN), sebagai lawan dari protein nitrogen (PN) (Sediaoetama, 2010).
Pentingnya senyawa non protein nitrogen dalam makanan baru diperhatikan beberapa tahun terakhir. Senyawa-senyawa ini termasuk asam amino, amin, amida, senyawa nitrogen kuarterner, purin, pirimidin, dan N-nitrosoamida. Senyawa-senyawa ini berperan dalam nilai gizi, rasa, warna (terutama pada produk panggangan), dan sifat-sifat penting makanan lainnya. Senyawa-senyawa ini menyediakan sumber gizi dan faktor pertumbuhan yang penting dalam pembuatan bir dan fermentasi (Pomeranz dan Meloan, 1987).
Komponen asam amino dari NPN terdapat dalam bentuk asam amino bebas atau peptida dengan berat molekul rendah yang dapat dipisahkan dengan filtrasi setelah dilakukan pengendapan protein dengan ATA, kalium ferrisianida, asam sulfosalisilat atau asetonitril (Jeon dan Ikins, 1994).
2.3 Pencernaan dan Metabolisme Protein
Di dalam rongga mulut, protein makanan belum mengalami proses pencernaan. Baru di dalam lambung terdapat enzim pepsin dan HCl yang bekerjasama memecah protein makanan menjadi metabolit antara tingkat polipeptida, yaitu peptide, albumosa, dan proteosa (Sediaoetama, 2010).
Pencernaan protein dilanjutkan di dalam usus halus oleh campuran enzim protease. Pankreas mengeluarkan cairan yang bersifat sedikit basa dan mengandung berbagai prekursor protease seperti tripsinogen, kimotripsinogen, prokarboksipeptidase, dan proelastase. Enzim-enzim ini menghidrolisis ikatan peptida tertentu. Sentuhan kimus terhadap mukosa usus halus merangsang dikeluarkannya enzim enterokinase yang mengubah tripsinogen tidak aktif menjadi tripsin aktif. Perubahan ini juga dilakukan oleh tripsin sendiri secara otokatalitik. Di samping itu tripsin dapat mengaktifkan enzim-enzim proteolitik lain berasal dari pankreas. Kimotripsinogen diubah menjadi beberapa jenis kimotripsin aktif yaitu prokarboksipeptidase dan proelastase diubah menjadi karboksipeptidase dan elastase aktif. Enzim-enzim pankreas ini memecah protein dari polipeptida menjadi peptida lebih pendek, yaitu tripeptida, dipeptida, dan sebagian menjadi asam amino. Mukosa usus halus juga mengeluarkan enzim-enzim protease yang menghidrolisis ikatan peptida. Sebagian besar enzim-enzim mukosa usus halus ini bekerja di dalam sel (Almatsier, 2004).
dipeptidase yang memecah dipeptida tertentu dan membutuhkan mineral Co++ atau Mn++ untuk pekerjaannya. Enzim-enzim proteolitik yang ada dalam lambung dan usus halus pada akhirnya dapat mencernakan sebagian besar protein makanan menjadi asam amino bebas (Almatsier, 2004).
Selanjutnya asam amino diabsorpsi, asam amino akan terdeposito di dalam hati atau otot di dalam kantong asam amino untuk dapat digunakan pada sintesis protein dalam tubuh. Setelah selesai makan, tubuh dalam kondisi anabolik. Ini berarti bahwa tubuh telah siap untuk sintesis protein. Materi genetik dalam tubuh yaitu Deoxyribo Nucleic Acid (DNA) menyediakan “blueprint” untuk sintesis protein. DNA menyediakan informasi asam amino mana yang diperlukan dan urutan protein apa yang harus disintesis. Selama seluruh asam amino tersedia di dalam kantungnya, sintesis protein akan terus berlangsung. Sangatlah penting bahwa semua asam amino tersedia dalam jumlah yang cukup ketika protein disintesis. Struktur dan fungsi dari setiap rantai protein tergantung pada urutan daripada asam-asam aminonya (Forsythe, 1995).
2.4 Penyakit Gizi yang Berhubungan dengan Protein 2.4.1 Akibat Kekurangan Protein
Kekurangan protein banyak terdapat pada masyarakat sosial ekonomi
Kwashiorkor dapat terjadi pada konsumsi energi yang cukup atau lebih. Gejalanya adalah pertumbuhan terhambat, otot-otot berkurang dan melemah, edema, muka bulat seperti bulan (moonface) dan gangguan psikomotor. Edema terutama pada perut, kaki, dan tangan merupakan cirri khas kwashiorkor dan kehadirannya erat berkaitan dengan albumin dalam serum. Anak apatis, tidak ada nafsu makan, tidak gembira, dan suka merengek. Kulit mengalami dipigmentasi, kering, bersisik, pecah-pecah, dan dermatosis. Luka sukar sembuh. Rambut mengalami dipigmentasi, menjadi lurus, kusam, halus, dan mudah rontok (rambut jagung). Hati membesar dan berlemak, sering disertai anemia dan xeroftalmia. Kwashiorkor pada orang dewasa jarang ditemukan (Almatsier, 2004).
Marasmus berasal dari kata Yunani yang berarti wasting/merusak. Marasmus adalah penyakit kelaparan dan terdapat banyak di antara kelompok sosial ekonomi rendah di sebagian besar negara sedang berkembang dan lebih banyak daripada kwashiorkor. Gejalanya adalah pertumbuhan terhambat, lemak di bawah kulit berkurang serta otot-otot berkurang dan melemah. Berat badan lebih banyak terpengaruh daripada ukuran kerangka, seperti panjang, lingkar kepala, dan lingkar dada. Berkurangnya otot dan lemak dapat diketahui dari pengukuran lingkar lengan, lipatan kulit daerah bisep, trisep, scapula, dan umbilikal. Anak apatis dan terlihat seperti sudah tua, tidak ada edema, tetapi seperti pada kwashiorkor kadang-kadang terjadi perubahan pada kulit, rambut, dan pembesaran hati (Almatsier, 2004).
lebih rentan terhadap serangan berbagai penyakit infeksi. Penyakit-penyakit infeksi yang sering dijumpai sebagai penyakit penyerta pada penderita KKP ialah: a. Penyakit infeksi saluran pernafasan, terutama bagian atas,
b. Penyakit infeksi saluran pencernaan, dengan gejala mencret-mencret dan c. Berbagai penyakit anak secara umum juga meningkat, baik dalam morbiditas
maupun dalam mortalitas.
Terapi untuk penderita defisiensi protein yang pertama harus ditanggulangi ialah gejala-gejala penyakit infeksi yang akut, seperti kejang-kejang, dehidrasi, dan diare. Bila gejala-gejala akut sudah mulai dikuasai, baru dilakukan terapi spesifik terhadap infeksinya, sambil menanggulangi kondisi KKP-nya (Sediaoetama, 2010).
2.4.2 Akibat Kelebihan Protein
Protein secara berlebihan tidak menguntungkan tubuh. Kelebihan asam
amino memberatkan ginjal dan hati yang harus memetabolisme dan mengeluarkan kelebihan nitrogen. Kelebihan protein akan menimbulkan asidosis, dehidrasi, diare, kenaikan amonia darah, kenaikan ureum darah, dan demam. Diet protein tinggi yang sering dianjurkan untuk menurunkan berat badan kurang beralasan. Kelebihan protein dapat menimbulkan masalah, terutama pada bayi (Almatsier, 2004).
2.5 Analisis Protein
2.5.1 Metode Kjeldahl
Sejak abad ke-19, metode Kjeldahl telah dikenal dan diterima secara universal sebagai metode untuk analisis protein dalam berbagai variasi produk makanan dan produk jadi (Rhee, 2005). Penetapan kadar protein dengan metode Kjeldahl merupakan metode tidak langsung yaitu melalui penetapan kadar N dalam bahan yang disebut protein kasar (Estiasih, dkk., 2012).
Prinsip metode Kjeldahl ini adalah senyawa-senyawa yang mengandung nitrogen tersebut mengalami oksidasi dan dikonversi menjadi ammonia dan bereaksi dengan asam pekat membentuk garam amonium. Kemudian ditambahkan basa untuk menetralisasi suasana reaksi dan kemudian didestilasi dengan asam dan dititrasi untuk mengatahui jumlah N yang dikonversi (Estiasih, dkk., 2012).
Tahapan kerja pada metode Kjeldahl dibagi tiga yaitu: a. Tahap Destruksi
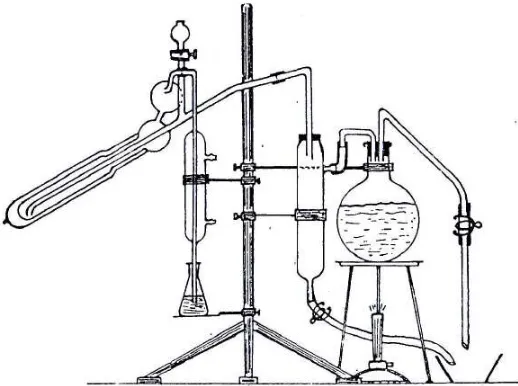
titik didih 3°C. Selain katalisator yang telah disebutkan tadi, kadang-kadang juga diberikan selenium. Selenium dapat mempercepat proses oksidasi karena zat tersebut selain menaikkan titik didih. Penggunaan selenium lebih reaktif dibandingkan merkuri dan kupri sulfat tetapi selenium mempunyai kelemahan yaitu karena sangat cepatnya oksidasi maka nitrogennya justru mungkin ikut hilang (Sudarmadji, dkk., 1989). Reaksi yang terjadi pada tahap dekstruksi adalah:
(CHON) + H2SO4 CO2 + H2O + (NH4)2SO4
Gambar 2.3 Alat Dekstruksi (Sudarmadji, dkk., 1989). b. Tahap Destilasi
Pada tahap destilasi, ammonium sulfat dipecah menjadi ammonia (NH3) dengan penambahan NaOH sampai alkalis dan dipanaskan. Agar selama destilasi tidak terjadi superheating ataupun pemercikan cairan atau timbulnya gelembung gas yang besar maka dapat ditambahkan logam zink (Zn). Ammonia yang dibebaskan selanjutnya akan ditangkap oleh larutan asam standar yang dipakai dalam jumlah berlebihan. Agar kontak antara asam dan ammonia lebih baik maka diusahakan ujung tabung destilasi tercelup sedalam mungkin dalam asam (Sudarmadji, dkk., 1989). Reaksi yang terjadi pada tahap destilasi adalah:
Gambar 2.4 Alat Destilasi (Ranganna, 1986).
c. Tahap Titrasi
Larutan asam pada penampung destilat yang dapat digunakan adalah larutan standar asam kuat seperti asam sulfat atau larutan asam borat. Jika dipakai larutan asam kuat standar maka titrasi yang dilakukan disebut titrasi kembali sedangkan jika dipakai larutan asam borat maka disebut titrasi tidak langsung (Kenkel, 2003).
Pada metode titrasi kembali, larutan asam standar yang berlebihan setelah bereaksi dengan ammonia dititrasi dengan larutan standar NaOH. Titrasi ini disebut titrasi kembali karena jumlah asam yang bereaksi dengan ammonia tersedia dalam keadaan berlebih sehingga melewati titik ekuivalen reaksi. Oleh karena itu, analis harus mengembalikan titik ekuivalen reaksi dengan titrasi menggunakan NaOH (Kenkel, 2003). Reaksi yang terjadi pada tahap titrasi adalah sebagai berikut:
H2SO4 + 2NaOH Na2SO4 + 2H2O
% N =ml NaOH (blanko – sampel)
berat sampel (g) x 1000 x N NaOH x 14,008 x 100%
Pada metode titrasi tidak langsung menggunakan asam borat, ammonia bereaksi dengan asam borat menghasilkan garam asam borat yang bersifat netral parsial. Garam tersebut dapat dititrasi dengan larutan asam standar. Jumlah larutan asam yang diperlukan adalah proporsional dengan jumlah ammonia yang bereaksi dengan asam borat. Titrasi ini disebut titrasi tidak langsung karena ammonia ditentukan, bukan dititrasi. Ammonia ditentukan secara tidak langsung dengan titrasi dari garam asam borat. Jika pada titrasi langsung, analit akan langsung bereaksi dengan pentiter. Konsentrasi asam borat pada penampung destilat tidak dimasukkan dalam perhitungan dan tidak perlu diketahui (Kenkel, 2003). Reaksi yang terjadi adalah sebagai berikut:
NH3 + H3BO3 H2BO3- + NH4+ H2BO3- + H+ H3BO3
Menurut Sudarmadji, dkk. (1989), kadar nitrogen dalam sampel dapat dihitung dengan rumus:
% N =ml HCl (sampel – blanko)
berat sampel (g) x 1000 x N NaOH x 14,008 x 100%
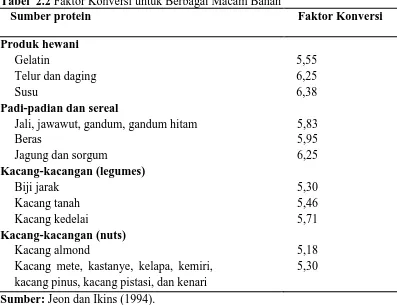
Tabel 2.2 Faktor Konversi untuk Berbagai Macam Bahan
Sumber protein Faktor Konversi
Produk hewani Gelatin
Telur dan daging Susu
5,55 6,25 6,38 Padi-padian dan sereal
Jali, jawawut, gandum, gandum hitam Beras
Jagung dan sorgum
5,83 5,95 6,25 Kacang-kacangan (legumes) Biji jarak Kacang tanah Kacang kedelai 5,30 5,46 5,71 Kacang-kacangan (nuts) Kacang almond
Kacang mete, kastanye, kelapa, kemiri, kacang pinus, kacang pistasi, dan kenari
5,18 5,30 Sumber: Jeon dan Ikins (1994).
Keuntungan menggunakan metode Kjeldahl ini adalah dapat diaplikasikan untuk semua jenis bahan pangan, tidak memerlukan biaya yang mahal untuk pengerjaannya, akurat dan merupakan metode umum untuk penentuan kandungan protein kasar, dapat dimodifikasi sesuai kuantitas protein yang dianalisis. Adapun kerugiannya adalah yang ditentukan adalah jumlah total nitrogen yang terdapat didalamnya bukan hanya nitrogen dari protein, waktu yang diperlukan relatif lebih lama (minimal 2 jam untuk menyelesaikannya), presisi yang lemah, pereaksi yang digunakan korosif (Chang, 1998).
2.5.2 Metode Spektrofotometri
1. Metode pengukuran langsung pada panjang gelombang 205 nm dan 280 nm Absorbansi pada panjang gelombang 205 nm dan 280 nm digunakan untuk menghitung konsentrasi protein dengan terlebih dahulu distandarisasi dengan protein standar. Metode ini dapat dengan mudah diaplikasikan dan sederhana, cocok untuk larutan protein yang telah dimurnikan. Penetapannya berdasarkan absorbansi sinar ultraviolet oleh asam amino triptopan, tirosin dan ikatan disulfida sistein yang menyerap kuat pada panjang gelombang tersebut, terutama panjang gelombang 280 nm (Simonian, 2005).
Keuntungan metode ini adalah waktu yang diperlukan untuk analisis cepat, memiliki sensitifitas yang baik, tidak ada gangguan dari ion ammonium dan garam-garam buffer, larutan sampel masih dapat digunakan untuk analisis lain selain analisis protein. Kerugian metode ini adalah asam nukleat juga memiliki absorbansi yang kuat pada panjang gelombang 280 nm, susunan asam amino aromatis dapat bervariasi untuk setiap sampel protein, larutan protein harus benar-benar jernih dan tidak berwarna ataupun keruh (Chang, 1998).
2. Metode pembentukan warna dengan pereaksi tertentu a. Pereaksi Biuret
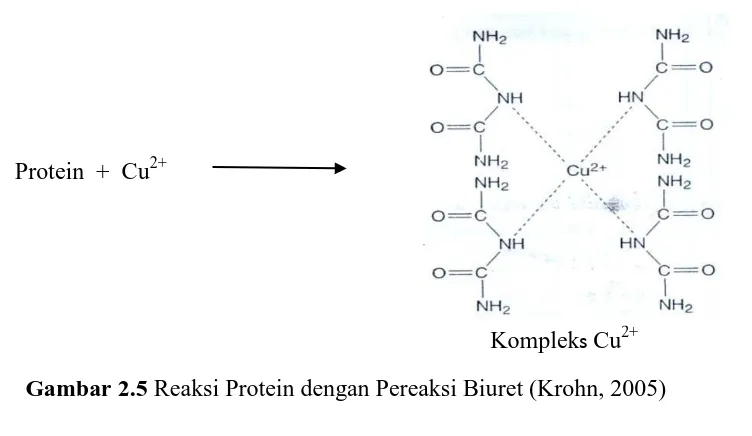
Prinsip penetapan protein metode Biuret adalah pada kondisi basa, Cu2+ membentuk kompleks dengan ikatan peptida (-CO-NH-) suatu protein menghasilkan warna ungu, sehingga kadar protein sampel dapat ditetapkan dengan spektrofotometer (Estiasih, dkk., 2012).
merupakan pilihan yang baik untuk analisis protein karena memiliki kemurnian yang tinggi, dan harganya tidak terlalu mahal. Selain itu, Bovine Gamma Globulin (BGG) juga merupakan pilihan yang baik bila akan digunakan untuk analisis kadar protein immunoglobulin dalam tubuh, karena BGG memberikan warna dan kurva yang sangat mirip dengan Immunoglobulin G (Ig G). Asam amino tunggal dan dipeptida tidak akan memberikan reaksi dengan Biuret, akan tetapi tripeptida dan polipeptida akan membentuk kompleks chelat. Satu ion Cu2+ akan bereaksi dengan empat sampai enam ikatan peptida (Krohn, 2005). Reaksi protein dengan pereaksi Biuret dapat dilihat pada Gambar 2.5.
Keuntungan dari metode ini adalah prosedur yang sederhana, tidak memerlukan biaya yang mahal, waktu yang digunakan relatif singkat, deviasi warna sangat sedikit bila dibandingkan dengan Lowry, Bradford dan metode turbidimetri sehingga absorpsi warnanya relatif stabil, sangat sedikit senyawa yang berinteraksi dengan pereaksi Biuret, dan tidak mendeteksi nitrogen dari sumber non-protein. Kerugiannya adalah kurang sensitif dibandingkan dengan Lowry, absorbansinya dapat dipengaruhi oleh asam empedu, konsentrasi garam
Protein + Cu2+
ammonium yang sangat tinggi, adanya variasi warna untuk beberapa protein tertentu, bila bahan mengandung lemak dan karbohidrat yang sangat tinggi dapat menyebabkan larutan menjadi buram sehingga tidak dapat ditembus cahaya UV, dan karena metode ini bukan merupakan metode absolut sehingga absorpsi warnanya perlu terlebih dahulu distandarisasi terhadap protein murni seperti Bovine Serum Albumin (BSA) (Chang, 1998).
b. Pereaksi Lowry
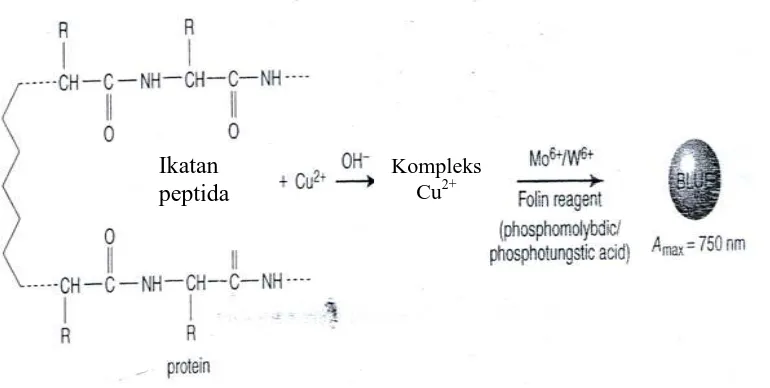
Pada tahun 1951, Oliver H. Lowry memperkenalkan penggunaan pereaksi ini yang merupakan perkembangan lebih lanjut dari Biuret. Metode ini diakui cukup sensitif untuk menentukan konsentrasi total protein (Krohn, 2005). Metode Lowry menggabungkan reaksi biuret dengan reduksi reagen Folin-Ciocalteau fenol (asam fosfomolibdat-fosfotungstat) oleh residu tirosin dan triptofan dalam protein. Warna kebiruan yang terbentuk dibaca pada panjang gelombang 750 nm (sensitivitas tinggi untuk konsentrasi protein tinggi) atau 500 nm (mempunyai sensitivitas rendah untuk konsentrasi protein tinggi) (Chang, 1998). Reaksi protein dengan pereaksi Lowry dapat dilihat pada Gambar 2.6.
Ikatan peptida
Keuntungan analisis dengan pereaksi ini adalah 50-100 kali lebih sensitif daripada metode biuret, 10-20 kali lebih sensitif daripada metode absorpsi UV pada 280 nm, kurang terganggu oleh turbiditas sampel, lebih spesifik daripada metode lainnya, sederhana, dapat diselesaikan dalam 1 – 1,5 jam. Kerugian analisis dengan pereaksi Lowry adalah variasi warnanya yang lebih banyak dibanding dengan pereaksi Biuret, warna yang terbentuk tidak secara tepat menggambarkan konsentrasi protein, reaksinya sangat dipengaruhi oleh senyawa pengganggu seperti glukosa, lemak, garam buffer fosfat, senyawa-senyawa yang mengandung amin, gula pereduksi, garam ammonium dalam konsentrasi tinggi dan senyawa sulfhidril (Chang, 1998).
c. Pereaksi Bradford
Pada tahun 1976, Marion Bradford memperkenalkan penggunaan pereaksi Coomassive Blue untuk penetapan secara kuantitatif konsentrasi total protein (Krohn, 2005). Coomasive Blue ini akan berikatan dengan protein, warna akan berubah dari kemerahan menjadi kebiruan, dan absorpsi maksimum dari warna akan berubah dari 465 nm menjadi 595 nm (Chang, 1998). Reaksi protein dengan pereaksi Bradford dapat dilihat pada Gambar 2.7.
Protein
Keuntungan analisis dengan pereaksi Bradford adalah cepat (reaksi hanya berlangsung selama 2 menit), reprodusibel, sensitif, tidak mengalami gangguan oleh ammonium sulfat, polifenol, karbohidrat atau kation-kation seperti K+, Na+, dan Mg2+. Kerugiannya adalah analisis ini terganggu oleh adanya deterjen nonionik dan ionik, kompleks warna-protein dapat bereaksi dengan kuvet kuarsa (harus menggunakan kuvet kaca atau plastik), warna berbeda tergantung pada jenis protein sehingga protein standar harus dipilih dengan hati-hati (Chang, 1998).
2.5.3 Metode Titrasi Formol
Larutan protein dinetralkan dengan basa (NaOH), kemudian ditambahkan formalin akan membentuk dimethilol. Dengan terbentuknya dimethilol ini berarti gugus aminonya sudah terikat dan tidak akan mempengaruhi reaksi antara asam (gugus karboksil) dengan basa NaOH sehingga akhir titrasi dapat diakhiri dengan tepat. Indikator yang digunakan adala fenolftalein, akhir titrasi bila tepat terjadi perubahan warna menjadi merah muda yang tidak hilang dalam 30 detik. Titrasi formol ini hanya tepat untuk menentukan suatu proses terjadinya pemecahan protein dan kurang tepat untuk penentuan protein (Sudarmadji, dkk., 1989).
2.5.4 Metode Dumas
Keuntungan metode ini adalah tidak memerlukan zat kimia berbahaya, analisis dapat diselesaikan dalam waktu 3 menit, instrumen otomatis terbaru dapat menganalisis 150 sampel secara bersamaan. Adapun kekurangan metode ini adalah membutuhkan instrumen analisis yang mahal, mengukur total nitrogen, bukan hanya mengukur nitrogen yang berasal dari protein (Chang, 1998).
2.6 Kelapa (Cocos nucifera L.)
Menurut Subrahmanyam (1995), dalam tata nama atau sistematika (taksonomi) tumbuh-tumbuhan, tanaman kelapa (Cocos nucifera) dimasukkan ke dalam klasifikasi sebagai berikut.
Kingdom : Plantae
Divisio : Spermatophyta Sub-divisio : Angiospermae Kelas : Monocotyledonae Ordo : Palmales
Familia : Palmae/ Arecaceae Genus : Cocos
Spesies : Cocos nucifera L.
yang sedang berkecambah, getah dari bunga hasil pembuahan (digunakan untuk produksi produk gula, alkohol, dan cuka), sabut kelapa, dan tunasnya (Wenkam, 1989).
Pertumbuhan buah kelapa terjadi melalui tiga fase, yaitu fase pertama, yakni fase pembesaran sabut, tempurung, dan lubang embrio, berlangsung selama 4-5 bulan. Pada fase ini, ruangan masih dipenuhi oleh air dan tempurung masih lunak. Fase kedua berlangsung selama dua bulan, yaitu fase penebalan tempurung, tetapi tempurung belum mengeras. Fase ketiga merupakan fase pembentukan putih lembaga atau endosperm, dimulai dari bagian pangkal buah menuju ke bagian ujung. Kemudian, pada bagian pangkal buah mulai terbentuk lembaga (embrio). Tempurung berangsur-angsur berubah menjadi coklat-hitam dari bagian pangkal ke arah ujung buah dan mulai mengeras. Pada tempurung di bagain pangkal buah juga mulai terbentuk tiga buah lubang ovule (Warisno, 2007).
Pada umur 9-10 bulan, buah telah mencapai ukuran yang maksimal, dengan bobot 3 kg – 4 kg dan berisi cairan sebanyak 0,3 – 0,4 liter. Pada saat mencapai tingkat kemasakan sempurna, yakni pada umur 11 – 12 bulan, berat buah turun menjadi rata-rata 1,5 kg – 2 kg per butir (kelapa genjah) dan 2 kg – 2,5 kg per butir (kelapa dalam). Selain itu, ruang dalam endosperm tidak lagi dipenuhi air. Demikian pula, kandungan nutrisi di dalam putih lembaga menjadi berbeda-beda. Kandungan nutrisi pada lapisan paling luar atau di dekat tempurung menjadi lebih banyak jika dibandingkan dengan lapisan paling dalam, karena lapisan paling luar ini lebih dahulu terbentuk (Warisno, 2007).
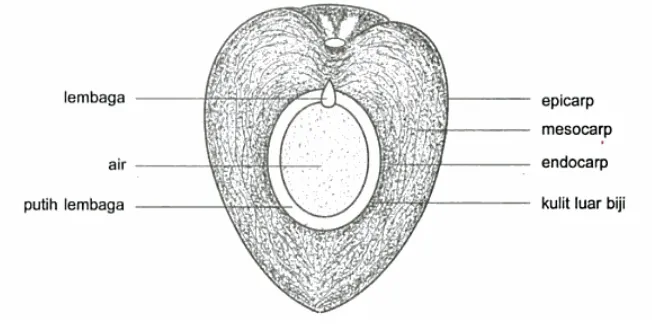
a. Epicarp (kulit luar), yang memiliki permukaan licin, tipis, dan agak keras. Epicarp ada yang berwarna hijau, kuning, jingga, serta coklat.
b. Mesocarp (kulit tengah atau sabut), merupakan bagian yang terdiri atas serabut dan daging buah. Bagian serabut terdiri atas jaringan-jaringan (sel-sel) serat yang keras dan di antara sel-sel tersebut terdapat jaringan yang lunak yang dikenal dengan nama sabut.
c. Endocarp (kulit dalam) atau biasa dikenal dengan nama tempurung atau batok. Tempurung merupakan lapisan yang keras karena banyak mengandung silikat (SiO3). Pada bagian pangkal tempurung terdapat bakal buah asal beruang tiga dan biasanya yang tumbuh satu buah, meskipun kadang-kadang muncul dua atau tiga kecambah. Kecambah akan muncul dari lubang yang memiliki ukuran paling besar dengan tutup lubang yang lunak.
d. Kulit luar biji, yaitu semua bagian yang berada di bagian dalam tempurung. e. Putih lembaga (endosperm), yaitu daging kelapa yang berwarna putih, lunak,
dan enak dimakan, serta banyak dimanfaatkan untuk memasak. Endosperm merupakan jaringan yang berasal dari inti lembaga yang dibuahi oleh sel kelamin jantan dan membelah diri. Jaringan ini berisi cadangan makanan bagi lembaga (sebelum lembaga dapat mencari makanan sendiri).
g. Lembaga atau embrio, yaitu titik tumbuh tanaman kelapa yang akan tumbuh menjadi calon tanaman kelapa. Lembaga yang sudah tumbuh namun masih kecil biasa disebut kentos, yang memiliki sifat sebagai penghubung antara calon tanaman dengan tempat cadangan makanan (endosperm). Kentos tersebut semakin lama akan semakin membesar, sesuai dengan pertumbuhan lembaganya, sedangkan putih lembaga semakin lunak, semakin berkurang, dan akhirnya habis terserap oleh kentos tersebut. Bersamaan dengan proses tersebut, lembaga akan tumbuh, bertunas, dan mengeluarkan daun.