LAPORAN PRAKTIKUM LABORATORIUM TEKNIK KIMIA DISTILASI BATCH
SEMESTER GENAP TAHUN AJARAN 2014
MODUL : DISTILASI BATCH
PEMBIMBING : Soerya Soelarso
Oleh : Hidniati Shafira 131411010 Imtihani Fauziah 131411011 Irfanty Widiastuti 131411012 Irma Nurfitriani 131411013 2 A- D3 Teknik Kimia Kelompok 3
PROGRAM STUDI DIPLOMA III TEKNIK KIMIA JURUSAN TEKNIK KIMIA
POLITEKNIK NEGERI BANDUNG 2014
PEMBUATAN : 26 November 2014
LAPORAN PRAKTIKUM LABORATORIUM TEKNIK KIMIA
Modul Praktikum : Distilasi Batch Nama Pembimbing : Soerya Soelarso Tanggal Praktek : 24 September 2014 Tanggal Penyerahan : 1 Oktober 2014
I. PENDAHULUAN I.1 Tujuan
» Memisahkan campuran biner air dan ethanol
» Membuat kurva kalibrasi antara indeks bias dengan fraksi mol
» Mengukur destilat (Xo) dan residu (Xw) dalam hal ini perubahan
konsentrasi terhadap
waktu
» Menghitung ethanol dalam sampel dengan menggunakan persamaan luas Rayleigh
I.2 Teori Dasar Destilasi
Distilasi adalah unit operasi yang sudah ratusan tahun diaplikasikan secara luas. Di sperempat abad pertama dari abad ke-20 ini, aplikasi unit distilasi berkembang pesat dari yang hanya terbatas pada upaya pemekatan alcohol kepada berbagai aplikasi di hampir seluruh industri kimia. Distilasi pada dasarnya adalah proses pemisahan suatu campuran menjadi dua atau lebih produk lewat eksploitasi perbedaan kemampuan menguap komponen-komponen dalam campuran. Operasi ini biasanya dilaksanakan dalam suatu klom baki (tray column) atau kolom dengan isian (packing column) untuk mendapatkan kontak antar fasa seintim mungkin sehingga diperoleh unjuk kerja pemisahan yang lebih baik.
Salah satu modus operasi distilasi adalah distilasi curah (batch distillation). Pada operasi ini, umpan dimasukkan hanya pada awal operasi, sedangkan produknya dikeluarkan secara kontinu. Operasi ini memiliki beberapa keuntungan :
1. Kapasitas operasi terlalu kecil jika dilaksanakan secara kontinu. Beberapa peralatan pendukung seperti pompa, tungku/boiler, perapian atau instrumentasi biasanya memiliki kapasitas atau ukuran minimum agar dapat digunakan pada skala industrial. Di bawah batas minimum tersebut, harga peralatan akan lebih mahal dan tingkat kesulitan operasinya akan semakin tinggi. 2. Karakteristik umpan maupun laju operasi berfluktuasi sehingga
jika dilaksanakan secara kontinu akan membutuhkan fasilitas pendukung yang mampu menangani fluktuasi tersebut. Fasilitas ini tentunya sulit diperoleh dan mahal harganya. Peralatan distilasi curah dapat dipandang memiliki fleksibilitas operasi dibandingkan peralatan distilasi kontinu. Hal ini merupakan salah satu alas an mengapa peralatan distilasi curah sangat cocok digunakan sebagai alat serbaguna untuk memperoleh kembali pelarut maupun digunakan pada pabrik skala pilot. Perangkat praktikum distilasi batch membawa para pengguna untuk mempelajari prinsip-prinsip dasar pemisahan dengan operasi distilasi, seperti kesetimbangan uap cair dan pemisahan lewat multi tahap kesetimbangan.
Perangkat ini dapat juga dimanfaatkan untuk mempelajari dasar-dasar penilaian untuk kerja kolom distilasi pacing dan mempelajari perpindahan massa dalam kolom distilasi packing.
Jenis-jenis Destilasi
Ada 6 jenis destilasi yang akan dibahas disini, yaitu destilasi sederhana, destilasi fraksionasi, destilasi uap, destilasi vakum, destilasi kering dan destilasi azeotropik.
1. Destilasi Sederhana
Pada destilasi sederhana, dasar pemisahannya adalah perbedaan titik didih yang jauh atau dengan salah satu komponen bersifat volatil. Jika campuran dipanaskan maka komponen yang titik didihnya lebih rendah akan menguap lebih dulu. Selain perbedaan titik didih, juga perbedaan kevolatilan, yaitu kecenderungan sebuah substansi untuk menjadi gas. Destilasi ini dilakukan pada tekanan atmosfer. Aplikasi destilasi sederhana digunakan untuk memisahkan campuran air dan alkohol.
2. Destilasi Fraksionasi
Fungsi destilasi fraksionasi adalah memisahkan komponen-komponen cair, dua atau lebih, dari suatu larutan berdasarkan perbedaan titik didihnya. Destilasi ini juga dapat digunakan untuk campuran dengan perbedaan titik didih kurang dari 20 °C dan bekerja pada tekanan atmosfer atau dengan tekanan rendah. Aplikasi dari destilasi jenis ini digunakan pada industri minyak mentah, untuk memisahkan komponen-komponen dalam minyak mentah.
Perbedaan destilasi fraksionasi dan destilasi sederhana adalah adanya kolom fraksionasi. Di kolom ini terjadi pemanasan secara bertahap dengan suhu yang berbeda-beda pada setiap platnya. Pemanasan yang berbeda-beda ini bertujuan untuk pemurnian destilat yang lebih dari plat-plat di bawahnya. Semakin ke atas, semakin tidak volatil cairannya.
3. Destilasi Azeotrop
Azeotrop adalah campuran dari dua atau lebih komponen yang memiliki titik didih yang konstan. Azeotrop dapat menjadi gangguan yang menyebabkan hasil destilasi menjadi tidak maksimal. Komposisi dari azeotrop tetap konstan dalam pemberian atau penambahan tekanan, akan tetapi ketika tekanan total berubah, kedua titik didih dan komposisi dari azeotrop berubah. Sebagai akibatnya, azeotrop bukanlah komponen tetap, yang komposisinya harus selalu konstan dalam interval suhu dan tekanan, tetapi lebih
ke campuran yang dihasilkan dari saling mempengaruhi dalam kekuatan intramolekuler dalam larutan. Azeotrop dapat didestilasi dengan menggunakan tambahan pelarut tertentu, misalnya penambahan benzena atau toluena untuk memisahkan air. Air dan pelarut akan ditangkap oleh penangkap Dean-Stark. Air akan tetap tinggal di dasar penangkap dan pelarut akan kembali ke campuran dan memisahkan air lagi. Campuran azeotrop merupakan penyimpangan dari hukum Raoult.
4. Destilasi Vakum
Destilasi vakum biasanya digunakan jika senyawa yang ingin didestilasi tidak stabil, dengan pengertian dapat terdekomposisi sebelum atau mendekati titik didihnya atau campuran yang memiliki titik didih di atas 150 °C. Metode destilasi ini tidak dapat digunakan pada pelarut dengan titik didih yang rendah jika kondensornya menggunakan air dingin, karena komponen yang menguap tidak dapat dikondensasi oleh air. Untuk mengurangi tekanan digunakan pompa vakum atau aspirator. Aspirator berfungsi sebagai penurun tekanan pada sistem destilasi ini.
5. Destilasi Uap
Destilasi uap digunakan pada campuran senyawa-senyawa yang memiliki titik didih mencapai 200 °C atau lebih. Distilasi uap dapat menguapkan senyawa-senyawa ini dengan suhu mendekati 100 °C dalam tekanan atmosfer dengan menggunakan uap atau air mendidih. Sifat yang fundamental dari distilasi uap adalah dapat mendestilasi campuran senyawa di bawah titik didih dari masing-masing senyawa campurannya. Selain itu destilasi uap dapat digunakan untuk campuran yang tidak larut dalam air di semua temperatur, tapi dapat didestilasi dengan air. Aplikasi dari destilasi uap adalah untuk mengekstrak beberapa produk alam seperti minyak eucalyptus dari eucalyptus, minyak sitrus dari lemon atau jeruk, dan untuk ekstraksi minyak parfum dari tumbuhan. Campuran dipanaskan melalui uap air yang dialirkan ke dalam
campuran dan mungkin ditambah juga dengan pemanasan. Uap dari campuran akan naik ke atas menuju ke kondensor dan akhirnya masuk ke labu destilat.
6. Destilasi kering
Destilasi kering merupakan destilasi yang dilakukan dengan cara memanaskan material padat untuk mendapatkan fase uap dan cairnya, biasanya digunakan untuk mengambil cairan bahan bakar dari kayu atau batu bara.
Distilasi Skala Industri
Umumnya proses distilasi dalam skala industri dilakukan dalam menara, oleh karena itu unit proses dari distilasi ini sering disebut sebagai menara distilasi (MD). Menara distilasi biasanya berukuran 2-5 meter dalam diameter dan tinggi berkisar antara 6-15 meter. Masukan dari menara distilasi biasanya berupa cair jenuh, yaitu cairan yang dengan berkurang tekanan sedikit saja sudah akan terbentuk uap dan memiliki dua arus keluaran, arus yang diatas adalah arus yang lebih volatil (mudah menguap) dan arus bawah yang terdiri dari komponen berat. Menara distilasi terbagi dalam 2 jenis kategori besar:
1. Menara Distilasi tipe Stagewise, menara ini terdiri dari banyak piringan yang memungkinkan kesetimbangan terbagi-bagi dalam setiap piringannya.
2. Menara Distilasi tipe Continous, yang terdiri dari pengemasan dan kesetimbangan cair-gasnya terjadi di sepanjangkolom menara.
Kesetimbangan Uap-Cair
Seperti telah disampaikan terdahulu, operasi distilasi mengekspoitasi perbedaan kemampuan menguap (volatillitas) komponen-komponen dalam campuran untuk melaksanakan proses pemisahan. Berkaitan dengan hal ini, dasar dasar keseimbangan
cair perlu dipahami terlebih dahulu. Berikut akan diulas secara singkat pokok-pokok penting tentang kesetimbangan uap-cair guna melandasi pemahaman tentang operasi distilasi.
1. Harga-K dan Volatillitas Relatif
Harga-K (K-Value) adalah ukuran tendensi suatu komponen untuk menguap. Jika harga-K suatu komponen tinggi, maka komponen tersebut cenderung untuk terkonsentrasi di fasa uap, sebaliknya jika harganya rendah, maka komponen cenderung untuk terkonsentrasi di fasa cair. Persamaan (1) di bawah ini menampilkan cara menyatakan harga-K.
Ki=yi
xi
Dengan yi adalah fraksi mol komponen i di fasa uap dan
xi adalah fraksi mol komponen i di fasa fasa cair.
Harga-K adalah fungsi dari temperatur, tekanan, dan komposisi. Dalam kesetimbangan, jika dua di antara variable-variabel tersebut telah ditetapkan, maka variable ketiga akan tertentu harganya.
Dengan demikian, harga-K dapat ditampilkan sebagai fungsi dari tekanan dan komposisi, temperature dan komposisi, atau tekanan dan temperatur.
Volatillitas relative (relative volatility) antara komponen i dan
j didefinisikan sebagai : ∝i , j=
Ki Kj
Dengan Ki adalah harga-K untuk komponen I dan Ki adalah harga-K untuk komponen j. Volatillitas relatif ini adalah ukuran kemudahan terpisahkan lewat eksploitasi perbedaan volatillitas. Menurut konsensus, volatillitas relative ditulis sebagai perbandingan harga-K dari komponen lebih mudah menguap (MVC
= more-volatile component) terhadap harga K komponen yang lebih sulit menguap.
Dengan demikian, harga α mendekati satu atau bahkan satu, maka kedua komponen sangat sulit bahkan tidak mungkin dipisahkan lewat operasi distilasi.
Sebagai contoh untuk sistem biner, misalkan suatu cairan yang dapat menguap terdiri dari dua komponen, A dan B. Cairan ini dididihkan sehingga terbentuk fasa uap dan fasa cair, maka fasa uap akan kaya dengan komponen yang lebih mudah menguap, misalkan A, sedangkan fasa cair akan diperkaya oleh komponen yang lebih sukar menguap, B. Berdasarkan persamaan (1) dan (2), volatillitas relative, αAB, dapat dinyatakan sebagai berikut : ∝AB= yA xA yB xB
Atau dapat dikembangkan menjadi :
yA= xA.∝AB 1+
(
∝AB−1)
xAJika persamaan (4) tersebut dialurkan terhadap sumbu x-y, maka akan diperoleh kurva kesetimbangan yang menampilkan hubungan fraksi mol komponen yang menampilkan hubungan fraksi mol komponen yang mudah menguap di fasa cair dan fasa uap yang dikenal sebagai diagram x-y. Perhatikan gambar (1). Garis bersudut 45° yang dapat diartikan semakin banyaknya komponen A di fasa uap pada saat kesetimbangan. Ini menandakan bahwa semakin besar harga αAB, semakin mudah A dan B dipisahkan lewat distilasi.
Gambar 1 Diagram x-y sistem biner A-B
2. Sistem Ideal dan Tak Ideal
Uraian terdahulu berlaku dengan baik untuk campuran-campuran yang mirip dengan campuran ideal.Yang dimaksud dengan campuran ideal adalah campuran yang perilaku fasa uapnya mematuhi Hukum Dalton dan perilaku fasa cairnya mengikuti Hukum Raoult. Hokum Dalton untuk gas ideal, seperti diperlihatkan pada persamaan (5), menyatakan bahwa tekanan parsial komponen dalam campuran, pi,
sama dengan fraksi mol komponen tersebut, yi , dikalikan tekanan
parsial komponen, pi , sama dengan fraksi mol komponen di fasa
cair, pis . Persamaan (6) menampilkan pernyataan ini.
pi=yi. P pi=xi. Pis
Dari persamaan (5) dan (6), harga-K untuk sistem ideal dapat dinyatakan sebagai berikut.
Ki=yi
xi= Pi
s
P
Pernyataan harga-K untuk system tak ideal tidak seringkas pernyataan untuk system ideal.Data kesetimbangan uap-cair umumnya diperoleh dari serangkaian hasil percobaan.Walaupun tidak
mudah, upaya penegakan persamaan-persamaan untuk mengevaluasi system tak ideal telah banyak dikembangakn dan bahkan telah diaplikasikan.Pustaka sepaerti walas (1984) dan Smith-van Ness (1987) dapat dipelajari untuk mendalami topik tersebut.
3. Diagram T-x-y
Proses-proses distilasi industrial seringkali diselenggarakan pada tekanan yang relative konstan. Untuk keperluan ini diagram fasa isobar (pada tekanan tertentu) paling baik untuk ditampilkan. Diagram yang menempatkan temperatur dan komposisi dalam ordinat dan absis ini dinamai diagram T-x-y. Bentuk umum diagram ini diperlihatkan dalam gambar 1 yang mewakili campuran dengan dua komponen A dan B berada dalam kesetimbangan uap-cairnya. Kurva ABC adalah titik-titik komposisi cairan jenuh, sedangkan kurva AEC adalah titik-titik komposisi untuk uap jenuh. Titik C mewakili titik didih komponen A murni dan Titik A mewakili titik didih komponen B murni.
Bayangkan suatu campuran berfasa cair titik G, bertemperatur T0
dan komposisinya X0, dipanaskan hingga mencapai temperatur T1 di
kurva ABC yang berarti campuran berada pada temperatur jenuhnya sedemikian hingga pemanasan lebih lanjut akan mengakibatkan terjadinya penguapan T1 dapat dianggap sebagai temperatur
terbentuknya uap pertama kali atau dinamai titik didih (bubble point) campuran cair dengan komposisi X0. Perhatikan bahwa uap yang
terbentuk memiliki komposisi tidak sama dengan x0 tetapi y0 (diperoleh
dari penarikan garis horizontal dari T1).
Pemanasan lebih lanjut mengakibatkan semakin banyak uap terbentuk dan sebagai konsekuensinya adalah perubahan komposisi terus menerus di fasa cair sampai tercapainya titik E. Pada temperatur ini, semua fasa cair telah berubah menjadi uap. Karena tidak ada massa hilang untuk keseluruhan sistem, komposisi uap yang diperoleh akan sama dengan komposisi cairan awal.
10
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
Penyuplaian panas berikutnya menghasilkan uap lewat jenuh seperti diwakili oleh titik F. Sekarang operasi dibalik.Mula-mula campuran fasa uap di titik F didinginkan dari temperatur T2 hingga mencapai titik E di kurva AEC.Di titik ini, uap berada dalam keadaan jenuh dan cairan mulai terbentuk.Titik ini kemudian dinamai titik embun (dew point).Pendinginan lebih lanjut menyebabkan fasa cair makin banyak terbentuk sampai tercapainya titik H yang mewakili titik jenuh fasa cair. Diagram T-x-y dengan demikian dapat dibagi menjadi tiga daerah :
1 Daerah di bawah kurva ABC yang mewakili subcooled liquid mixtures (cairan lewat jenuh),
2 Daerah di atas kurva AEC yang mwakili superheated vapor (uap lewat jenuh), dan
3 Daerah yang dibatasi kedua kurva tersebut yang mewakili system dua fasa dalam kesetimbangan. Operasi distilasi bekerja di daerah tempat terwujudnya kesetimbangan dua fasa, uap dan cair.
Gambar 2 Tipikal Diagram T-x-y
4.
Azeotrop dan Larutan Tak Campur
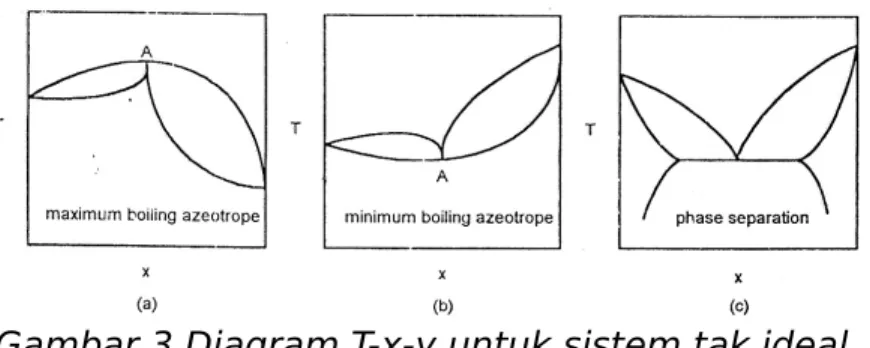
Gambar 2 adalah tipikal untuk sistem normal. Jika interaksi fisik dan kimiawi yang terjadi di dalam sistem sangat signifikan maka bentukan kurva T-x-y dan x-y akan mengalami penyimpangan yang berarti. Pada gambar 3 berbagai modifikasi, seperti distilasi ekstraktif, distilasi kukus, dsb, perlu dilakukan untuk memisahkan komponen-komponen dari system yang tak ideal ini.
11
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
Gambar 3 Diagram T-x-y untuk sistem tak ideal
Gambar 3a dan 3b mewakili sistem azeotrop yaitu sistem yang memiliki perilaku seperti zat murni di suatu komposisi tertentu.Lihat titik a dengan komposisi xa.Pada titik ini perubahan temperatur saat
penguapan terjadi tidak menyebabkan perbedaan komposisi di fasa uap dan cair.Gambar 3a mewakili sistem maximum boiling azeotrope, sedangkan gambar 3b mewakili sistem minimum boiling azeotrop.
Gambar 4 Diagram x-y untuk sistem tak ideal
Interaksi antar komponen yang sangat kuat memungkinkan terbentuknya dua fasa cairan yang ditunjukkan oleh daerah tak saling larut (immiscible region) dalam diagram fasa seperti tampak dalam gambar 3c. Diagram x-y untuk sistem-sistem ini dapat dilihat pada gambar 4.
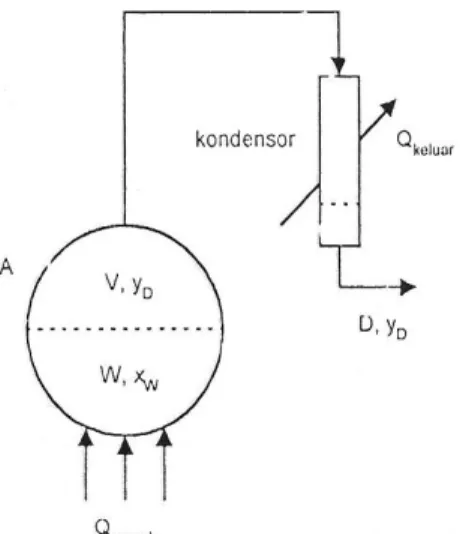
Destilasi Diferensial
Kasus distilasi batch (partaian) yang paling sederhana adalah operasi yang menggunakan peralatan seperti pada Gambar berikut ini.
12
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
Gambar 5 Distilasi Diferensial
Pada alat ini, cairan dalam labu dipanaskan sehingga sebagian cairan akan menguap dengan komposisi uap yD yang dianggap berada
dalam kesetimbangan dengan komposisi cairan yang ada di labu, xw.
Uap keluar labu menuju kondenser dan diembunkan secara total. Cairan yang keuar dari kondenser memiliki komposisi xD yang besarnya
sama dengan yD. Dalam hal ini, distilasi berlangsung satu tahap.
Uap yang keluar dari labu kaya akan komponen yang lebih sukar menguap (A), sedangkan cairan yang tertinggal kaya akan komponen yang lebih sukar menguap (B). Apabila hal ini berlangsung terus, maka komposisi di dalam cairan akan berubah; komponen A akan semakin sedikit dan komponen B akan semakin banyak. Hal ini juga berdampak pada komposisi uap yang dihasilkan. Jika komposisi komponen A di dalam cairan menurun, maka komposisi komponen A di dalam uap yang berada dalam kesetimbangan dengan cairan tadi juga akan menurun. Berdasarkan fakta tersebut dapat disimpulkan bahwa komposisi dalam operasi ini berubah terhadap waktu. Neraca massa proses distilasi diferensial dapat dinyatakan sbb :
−d
(
Wxw)
dt =(
−W d(
xw)
dt −xw dW dt)
=−D yD 13| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
K i m i a
Keterangan :D = laju alir distilat, mol/jam yD = komposisi distilat, fraksi mol
V = jumlah uap dalam labu W = jumlah cairan dalam labu
Bentuk integrasi persamaan di atas adalah sbb :
∫
0 x d x w(
yD−xW)
=∫
WD W dw WDimana x0 dan W0 masing-masing adalah komposisi dan berat
cairan di dalam labu mula-mula.Persamaan ini dikenal sebagai persamaan Rayleigh.
Jika operasi dilaksanakan pada tekanan tetap, perubahan temperature cairan dalam labu tidak terlalu besar, dan konstanta kesetimbangan uap-cair dapat dinyatakan sebagai : y = Kx, sehingga persamaan (9) dapat dengan mudah diselesaikan menjadi :
ln
(
W WD)
= 1 K −1ln(
x xD)
Untuk campuran biner, hubungan kesetimbangan dapat dinyatakan dengan koefisien volatillitas relative, α. Jika koefisien volatillitas relatif ini dapat dianggap tetap selama operasi, maka integrasi persamaan (5) adalah :
ln
(
WD W)
= 1 ∝−1[
ln(
xD x)
+∝ ln(
1−x 1−xD)
]
Rektifikasi dengan Refluks Konstan
Distilasi partaian menggunakan kolom rektifikasi yang ditempatkan di atas labu didihnya (reboiler) akan memberikan pemisahan yang lebih baik dari pada distilasi diferensial biasa, karena 14
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
kolom rektifikasi menyediakan terjadinya serangkaian tahap kesetimbangan. Dengan jumlah tahap kesetimbangan yang lebih banyak, komposisi komponen yang mudah menguap di fasa uap akan semakin besar atau dengan kata lain, pemisahan yang diperoleh akan lebih baik. Kolom rektifikasi dapat berupa kolom dengan piringan (plate) atau dengan isian (packing).
Di puncak kolom, sebagian cairan hasil kondensasi dikembalikan ke dalam kolom sebagai refluks agar pada kolom terjadi kontak antar fasa uap-cair.
Jika nisbah refluks dibuat tetap, maka komposisi cairan dalam reboiler dan distilat akan berubah terhadap waktu. Untuk saat tertentu, hubungan operasi dan kesetimbangan dalam kolom distilasi dapat digambarkan pada diagram McCabe-Thiele. Perhatikan gambar 6 berikut ini.
Gambar 6 Diagram McCabe-Thiele
Pada saat awal operasi (t=t0), komposisi cairan di dalam reboiler
dinyatakan dengan x0. Jika cairan yang mengalir melalui kolom tidak
terlalu besar dibandingkan dengan jumlah cairan di reboiler dan kolom memberikan dua tahap pemisahan teroritik, maka komposisi distilat awal adalah xD. Komposisi ini dapat diperoleh dengan membentuk
garis operasi dengan kemiringan L/V dan mengambil dua buah tahap kesetimbangan antara garis operasi dan garis kesetimbangan seperti yang ditunjukan pada gambar 3. Pada waktu tertentu setelah operasi (t=t1), komposisi cairan di dalam reboiler adalah xW dan komposisi
15
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
distilat adalah xD. Karena refluks dipertahankan tetap, maka L/V dan
tahap teoritik tetap.
Secara umum, persamaan garis operasi adalah sbb : untuk waktu ke-i,
yt=L
V x1+ Dx Di
Persamaan (12) jarang digunakan dalam praktek karena melibatkan besaran L dan V yaitu laju alir cairan dan uap yang mengalir di dalam kolom. Dengan mendefinisikan nisbah refluks, R, sebagian R = L/D, maka persamaan (12) dapat diubah menjadi :
yt= R
R+1xt+
xD ,i
R+1
Waktu yang diperlukan untuk distalasi curah menggunakan kolom rektifikasi dengan refluks konstan dapat dihitung melalui neraca massa total berdasarkan laju penguapan konstan, V, seperti ditunjukkan berikut ini :
Gambar 7 Distilasi dengan refluks total
Sistem Peralatan Kontrol
7 12
12 8 Blok-3 1
16
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
10 Blok-4
11 Blok-5 2
Keterangan : 1. Tombol alarm 2. Tombol start
3. Tombol heater OFF 4. Tombol heater ON 5. Tombol heater intermit 6. Tombol heater pemanasan 7. Tombol cooler ON
8. Tombol cooler CLOSED 9. Tombol ON-OFF
Blok 3 : Kontrol aliran cairan dan uap di dalam kolom Blok 4 : Kontrol laju alir distilat
Blok 5 : Kontrol laju alir cairan ke kolom
II. METODE PRAKTIKUM II.1 Alat dan Bahan
Alat
No Alat Spesifikasi Jumlah
1 2 3 Beaker Glass Piknometer Timbangan Analitik 2000 mL 1 1 1 Bahan 17
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
K i m i a
No Bahan Jumlah 1
2 Air SantanAquadest ± 8,5 Liter
‘’
II.2 Skema Kerja Rancangan Alat
Langkah Kerja
a. Bersihkan bagian – bagian dari sentrifuse dengan cara dicuci, kemudian keringkan
sebelum dipakai dalam percobaan.
b. Susun bagian-bagian dari peralatan sentrifuse sehingga siap pakai.
c. Siapkan santan 8,5 liter yang diperoleh dari 5 butir kelapa yang cukup tua. d. Siapkan air santan 4 buah masing-masing 2 liter.
e. Tutup lubang pada penampung centrifuge, kemudian tuangkan santan kedalam
penampung.
f. Letakkan beker plastik pada masing-masing keluaran, keluaran heavy liquid dan light
liquid.
g. Hidupkan peralatan pada kecepatan putaran yang ditentukan pembimbing. h. Tunggu ±5 menit, atau sampai sentrifuse terdengar stabil.
i. Buka lubang bejana sentrifuse dan tunggu sampai aliran pada masing-masing keluaran
berhenti menetes.
j. Catat suhu, rapat massa dan volume masing-masing keluaran.
18
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
k. Simpan light liquid fase untuk digabungkan dengan hasil light liquid yang diperoleh
dari run pada kecepatan putar yang lain.
l. Lakukan lagi prosedur a sampai j dengan 3 macam harga putaran berbeda. Besar
putaran ditentukan pembimbing.
m. Lakukan prosedur a sampai i untuk light liquid gabungan, kecepatan putar dipilih yang
tertinggi.
n. setelah selesai, bongkar alat dan bersihkan.
III. HASIL DAN PEMBAHASAN 3.1 Data Pengamatan
Densitas Etanol = 0,789 g/cm3
Densitas Air = 0,998 g/cm3
BM Etanol = 46 BM Air = 18
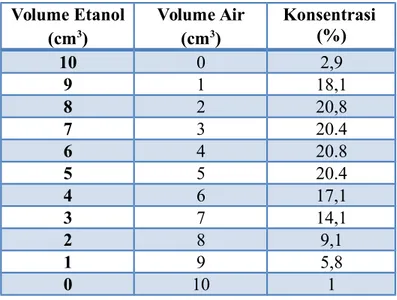
Tabel Data Pembuatan Kurva Kalibrasi
Volume Etanol (cm3) Volume Air (cm3) Konsentrasi (%) 10 0 2,9 9 1 18,1 8 2 20,8 7 3 20.4 6 4 20.8 5 5 20.4 4 6 17,1 3 7 14,1 2 8 9,1 1 9 5,8 0 10 1
Tabel Data Percobaan
Indeks Bias Sampel tetesan Pertama = 2,5 Indeks Bias Sampel Awal = 18,7
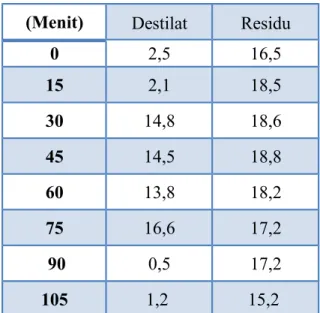
Tabel Data Pengamatan Percobaan
Waktu Konsentrasi (%)
19
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
(Menit) Destilat Residu 0 2,5 16,5 15 2,1 18,5 30 14,8 18,6 45 14,5 18,8 60 13,8 18,2 75 16,6 17,2 90 0,5 17,2 105 1,2 15,2 3.2 Pengolahan Data
Tabel . Perhitungan Kurva Kalibrasi
Volume Etanol (cm3) Volume Air (cm3) Massa Etanol (gram) Massa Air (gram) Mol Etanol Mol Air Fraksi Mol Etanol Konsentra si (%) 10 0 7,89 0 0,172 0 1 2,9 9 1 7,101 0,998 0,154 0,055 0,736 18,1 8 2 6,312 1,996 0,137 0,111 0,553 20,8 7 3 5,523 2,994 0,120 0,166 0,419 20.4 6 4 4,734 3,992 0,103 0,222 0,317 20.8 5 5 3,945 4,99 0,086 0,277 0,236 20.4 4 6 3,156 5,988 0,069 0,333 0,171 17,1 3 7 2,367 6,986 0,051 0,388 0,117 14,1 2 8 1,578 7,984 0,034 0,444 0,072 9,1 1 9 0,789 8,982 0,017 0,499 0,033 5,8 0 10 0 9,98 0 0,554 0 1
Massa Etanol dan Air di dapat dengan cara sebagai berikut :
Densitas () =
Massa(Gram) Volume
(
C m3)
Massa air (gram) = Densitas x Volume = 0,998 x 0
20
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
= 0 gram
Massa Etanol = Densitas x Volume = 0,789 x 10
= 7,89 gram
Mol Etanol dan Air di dapat dengan cara sebagai berikut :
Mol = Massa(gram) BeratMolekul(gram mol ) = 7,89 gram 46gram mol = 0,172
Fraksi Mol Etanol (X) di dapat dengan cara sebagai berikut :
Xetanol=
MolEtanol MolEtanol+MolAir
= 0,172+00,172
= 1
Kurva Kalibrasi Fraksi mol etanol (X) Terhadap Indeks Bias
Dari tabel 3. Perhitungan Kurva Kalibrasi di atas sehingga diperoleh kurva kalibrasi etanol sebagai berikut :
21
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
0 0.030.050.08 0.1 0.130.150.18 0.2 0 2 4 6 8 10 12 14 16 18 f(x) = 93.83x + 2.04 R² = 0.98
Fraksi mol etanol (X) Konsentrasi (%)
Perhitungan Kandungan Etanol dalam Residu (XW) dengan Menggunakan Persamaan
Raylaigh
Perhitungan Sampel Dengan Menggunakan Persamaan Rayleigh XD = fraksi etanol dalam distilat
XW = fraksi etanol dalam waste (residu)
Persamaan garis dari kurva kalibrasi adalah:
y = 93,831x + 2,0449
dengan y menunjukkan persentase kadar dan x menunjukkan fraksi etanol sehingga:
x = y −2,044993,831
Misal, untuk y destilat = 2,5
x = y −2,044993,831
x = 2,5−2,044993,831
x = 4,85 x 10-3
22
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
Tabel Perhitungan Xw dengan Menggunakan Persamaan Raylaigh Waktu Konsentrasi (%) XD Xw Xd - Xw 1 (Xd− Xw) Destilat Residu 0 2,5 16,5 4,85 x 10-3 0,1541 -0,1493 -6,6979 15 2,1 18,5 5,87 x 10-4 0,1754 -0,1748 -5,7208 30 14,8 18,6 0,1359 0,1764 -0,0405 -24,6913 45 14,5 18,8 0,1327 0,1786 -0,0459 -21,7865 60 13,8 18,2 0,1253 0,1722 -0,0469 -21,3219 75 16,6 17,2 0,1551 0,1615 -0,0064 -156,25 90 0,5 17,2 -0,0165 0,1615 -0,1780 -5,6180 105 1,2 15,2 - 0,009 0,1402 -0,1492 -6,7024 0.13 0.14 0.14 0.15 0.15 0.16 0.16 0.17 0.17 0.18 0.18 -180 -160 -140 -120 -100 -80 -60 -40 -20 0 Xw
Grafik hubungan antara Xw terhadap
3.3 Pembahasan
Pada praktikum kali ini, praktikan melakukan destilasi dengan umpan campuran etanol-air. Distilasi merupakan proses pemisahan larutan berdasarkan perbedaan titik
23
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
didihnya.Percobaan ini bertujuan untuk memisahkan campuran biner etanol dan air berdasarkan titik didihnya. Titik didih etanol adalah 78 oC sedangkan air memiliki titik
didih 100 oC pada tekanan 1 atmosfer.
Jenis distilasi yang dilakukan pada praktikum ini adalah distilasi batch, metode ini merupakan unit operasi kimia jenis perpindahan massa. Nilai refluk ratio pada percobaan ini adalah 6/3 nilai refluk ratio tersebut menyatakan perbandingan antara jumlah uap yang terkondensasi dan yang dikembalikan sebagai cairan yang masuk lagi ke dalam kolom dengan cairan yang diambil sebagai distilat, semakin besar perbandingan refluk berarti cairan yang dikembalikan akan semakin banyak. Cairan itu akan mengalami kontak ulang lebih lanjut dengan fasa uap menuju puncak kolom.
Pada praktikum ini campuran biner yang digunakan sebanyak 3 liter dengan perbandingan volume 1:1. Campuran biner di pisahkan dengan distilasi batch menggunakan kolom distilasi fraksionisasi. Campuran biner di panaskan dengan suhu pemanas yang digunakan adalah 90ºC sehingga suhu uapnya adalah 80ºC, hingga cairan mendidih kemudian etanol akan menguap dan terpisah dari air karena titik didihnya lebih rendah. Uap etanol dikondensasi menggunakan air dengan suhu 15o C dan menghasilkan
tetesan distilat pertama yang kemudian di ukur kadarnya dengan refraktometer. Distilat dan residu yang dihasilkan tiap 10 menit sekali diambil untuk sampel dan di ukur indeks bias untuk melihat perubahan konsentrasi etanol dalam distilat dari fraksi molnya.
Oleh karena itu dibuat kurva kalibrasi antara persentase kadar etanol dengan fraksi molnya. Kurva kalibrasi di buat dengan mengukur persentase kadar campuran etanol dan air dengan perbandingan yang sudah ditentukan. Kurva kalibrasi yang diperoleh terlihat pada grafik 1 dan diperoleh persamaan etanol dan air yaitu y = 93,831x
+ 2,0449.
Dalam percobaan didapatkan bahwa pemisahan tidak sepenuhnya terjadi. Di distilat masih terdapat kandungan air, begitu juga di residu masih terdapat kandungan etanol. Dari hasil diketahui bahwa semakin lama proses distilasi maka semakin besar
persentase kadar dari distilat yang cenderung mendekati persentase kadar etanol murni (100%). Pada residupun didapatkan bahwa semakin lama proses distilasi maka
24
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
persentase kadarnya semakin kecil yang cenderung mendekati persentase kadar air murni (100%).
Kemudian dari data yang digunakan untuk membuat kurva kalibrasi, dapat disimpulkan bahwa semakin sedikit kandungan etanolnya didalam campuran tersebut maka semakin kecil pula nilai persentase kadar pada alat refraktometer yang digunakan. Dari data pengamatan dan grafik Xd maupun Xw terhadap waktu, Xd maupun Xw seharusnya meningkat seiring berjalannya waktu. Ini dapat menjelaskan seberapa besar alkohol berhasil menjadi destilat. Namun bisa terlihat pada kurva Xw terhadap 1/Xd-Xw kami tidak membentuk garis linier dan tidak ada kekonstananan dalam kenaikan nilainya dan bahkan minus. Xd seharusnya meningkat karena kandungan alkohol berhasil dipisahkan untuk menjadi destilat maka dari itu fraksi molnya akan meningkat ditiap waktu, demikian pula dengan fraksi mol air yang ada sebagai residu. Namun dari data pengamatan setelah proses destilasi berlangsung persentase kadar bagi etanol ( destilat ) maupun air ( residu ) mengalami kenaikan yang tidak konstan, hal ini bisa terjadi karena kesalahan pengamatan dengan refraktometernya, etanol yang terkadung telah menguap sebagian sebelum diamati sempurna persentase kadarnya maupun ketidaktepatan penggunaan alat pegukur kadar sampel yang hanya tersedia untuk sampel berkadar sampai 21% saja sedangkan selogisnya yang kita yakini larutan sampel yang kita miliki setelah dilakukan destilasi memiliki kadar lebih dari 21%.
Karena adanya alkohol yang teruapkan ke udara dikarenakan tekanan yang sangat besar didalam reaktor akibat suhu yang terus meningkat maka akan mendorong tutup reaktor sehingga terbuka dengan sendirinya dan melepaskan uap – uap etanol. Juga dikarenakan suhu condensor yang harus terus dijaga rendah agar dapat mengondensasi uap etanol yang suhunya sangat tinggi tadi menjadi destilat mengakibatkan destilat etanol yang praktikan dapat selama 60 menit hanya ±100 ml. Jika diinginkan umpan terdestilasi semuanya maka akan dibutuhkan waktu yang lebih lama lagi.
IV. KESIMPULAN
V. Dari praktikum ini praktisi dapat menyimpulkan bahwa:
25
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
o Alkohol dan air dapat dipisahkan dengan metode destilasi yang berdasarkan titik
uapnya
o Fraksi alcohol akan lebih banyak pada bagian destilat.
o Semakin lama waktu proses maka fraksi alcohol akan menurun pada destilat. o Tetes pertama pada destilat merupakan titik maksimum fraksi alcohol
VI. VII. VIII. IX. X.
XI. LAMPIRAN FOTO HASIL PRAKTIKUM
XII. XIII. XIV. XV. XVI. XVII. XVIII. 26
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
K i m i a
Resid u Destil atXIX. XX. XXI. XXII. XXIII. XXIV. XXV. XXVI. XXVII. XXVIII.
XXIX. Daftar Pustaka
27
| L a p o r a n P r a k t i k u m L a b o r a t o r i u m Te k n i k
K i m i a
Keluaran residu Keluaran destilat Cooling water Heater Bernasconi, G, H. Gester, H. Hauser, H. Stauble, dan E. Schneiter. 1995. Teknologi Kimia. Bagian 2.DiterjemahkanolehDr. Ir. LiendaHandojo, M. Eng. Jakarta :PT Pradnya Paramita.
Geankoplis, C. J. 1993. Transport Processes And Unit Operation. Third Edition, pp 127-132. London : Prentice Hall International.
Henley, E.J., J.D., Equilibrium-Stage Separation Operations in Chemical Engineering, JohnWiley, New York, 1981, Chapter 3, 9..
Kister, H.Z. Distillation Design, Mc Graw-Hill, New York, 1992, Chapter 1, 5.
McCabe, Warren L, dkk. 1999. Operasi Teknik Kimia. Jilid 2. Edisi keempat. Diterjemahkan oleh: Ir. E.Jasjfi,M.Sc. Jakarta: Erlangga.
Mc. Cabe, Waren L,. Operasi Teknik Kimia. Jilid 1. Erlangga. Jakarta. 1999. Perry’s, “Chemical Engineering Handbook”, edisi 3, 1988.
Tim. 2004. Buku Petunjuk Praktikum Satuan Operasi : Distilasi. Jurusan Teknik Kimia. Bandung : Politeknik Negeri Bandung.
Walas, S.M., Phase Equilibria in Chemical Engineering, Butterworths Publishers, MA, 1984 Warren L., Mc Cabe, Julian C. Smith. Peter Harriott. 1990. Unit Operations of Chemical
Engineering. Fifth Edition. New York : Mc Graw Hill, Inc.
Warren L. , McCabe, Julian C. Smith, dan Peter Harriot. 1990. OperasiTeknik Kimia. Penerjemah : Ir. E. Jasafi, M.Sc. Jakarta : Erlangga.
28