Konversi Penisilin G Menjadi Asam 6-Aminopenisilanat (6-APA)
dengan Enzim Penisilin Asilase dalam Bioreaktor Curah
Ukan Sukandar dan Subagjo
Departemen Teknik Kimia, Fakultas Teknologi Industri, Institut Teknologi Bandung Jalan Ganesa 10 Bandung 40132
e-mail: usukandar@che.itb.ac.id Abstrak
Konversi penisilin G (Pen-G) menjadi asam 6-aminopenisilanat (6-APA) menggunakan enzim penisilin asilase terlarut telah dipelajari dalam sistem bioreaktor curah. Hasil integrasi persamaan laju reaksi telah digunakan untuk memperkirakan laju reaksi enzimatik hidrolisis Pen-G dengan enzim penisilin asilase terlarut dalam bioreaktor curah. Temperatur dan pH optimum kerja enzim penisilin asilase yang dihasilkan bakteri Escherichia coli ini masing-masing adalah 37oC dan 7,8. Pengaruh konsentrasi awal substrat pada konversi reaksi hidrolisis
Pen-G dengan enzim penisilin asilase terlarut dalam bioreaktor curah menunjukkan bahwa makin tinggi konsentrasi substrat, makin rendah laju reaksi.
Abstract
The conversion of penicillin G (Pen-G) to 6-aminopenicillanic acid (6-APA) using soluble penicillin acylase enzyme has been studied in a batch bioreactor system.The integrated form of the rate equation has been shown to predict satisfactorily the progress of the reaction of enzymatic hydrolysis Pen-G using soluble penicillin acylase enzyme in a batch bioreactor. Optimum temperature and pH of the penicillin acylase enzyme produced by Escherichia coli were 37oC and 7.8 respectively. The effect of initial substrate concentration on the conversion
progress for the free enzyme shows that the higher the substrate concentration, the lower the reaction rate was. 1. Pendahuluan
Penisilin asilase (penisilin amidohidrolase, EC 3.5.1.11) dari Escherichia coli merupakan enzim yang dapat mengkatalisis reaksi deasilasi penisilin G (Pen-G) menjadi asam 6-aminopenisilanat (6-APA) yang merupakan bahan baku untuk pembuatan penisilin semisintetik di industri.
Berdasarkan spesifisitas substratnya, penisilin asilase diklasifikasikan menjadi tiga kelompok: penisilin G asilase, penisilin V asilase, dan ampisilin asilase (Arroyo, 2003). Penisilin G asilase, umumnya dihasilkan oleh bakteri, merupakan jenis asilase yang mengkatalisis hidrolisis benzilpenisilin (Pen-G) lebih cepat daripada menghidrolisis fenoksimetilpenisilin (penisilin V, Pen-V). Sebaliknya, penisilin V asilase menghidrolisis Pen-V lebih cepat daripada menghidrolisis Pen-G, umumnya dihasilkan oleh fungi dan beberapa spesies bakteri dan ragi tertentu (Crueger dan Crueger, 1984; Vandamme dan Voets, 1974; Carrington, 1971). Sementara ampisilin asilase secara spesifik memiliki kemampuan untuk menghidrolisis ampisilin.
Hingga saat ini, 6-APA merupakan satu-satunya bahan baku untuk pembuatan penisilin semisintetik. Sebagai bahan baku utama untuk pembuatan berbagai macam penisilin semisintetik, 6-APA dapat dihasilkan melalui proses-proses: fermentasi, hidrolisis penisilin secara kimiawi, dan hidrolisis penisilin secara enzimatik. Oleh karena proses hidrolisis penisilin secara enzimatik merupakan cara produksi 6-APA yang paling mudah dilakukan dan paling menguntungkan (Crueger dan Crueger, 1984 ; Shewale dan Sivaraman, 1989 ; Carrington, 1971), cara ini pulalah yang sekarang dilaksanakan secara komersial. Pen-G atau Pen-V yang keduanya merupakan produk fermentasi dihidrolisis secara enzimatik dengan menggunakan enzim penisilin asilase. Biokonversi penisilin menjadi 6-APA merupakan reaksi kesetimbangan yang dipengaruhi pH larutan. Hidrolisis penisilin menjadi 6-APA berlangsung dengan baik pada rentang pH 7,5-8,5, sedang pada rentang pH 4,0-7,0 terjadi reaksi sintesis penisilin (Shewale dkk., 1990). Masih dalam kaitannya dengan pengaruh pH terhadap kesetimbangan reaksi, Svedas dkk.(1980) mengemukakan bahwa sintesis penisilin berjalan dengan cepat pada pH 5,0-6,0, sedang pada pH yang lebih besar dari 6,0 kesetimbangan reaksi bergeser kearah pembentukan 6-APA.
Laju reaksi hidrolisis penisilin oleh penisilin asilase telah diketahui dihambat oleh substrat dan produk reaksinya. Pada konsentrasi substrat yang tinggi, konversi penisilin menjadi 6-APA hanya mencapai 60-80%, bergantung pada pH reaksi dan konsentrasi substrat (Cole, 1969a). Menurut Erarslan dkk. (Erarslan dkk., 1991), konsentrasi penisilin G yang tinggi dapat menghambat laju reaksi secara uncompetitive. Kedua produk reaksinya,
6-APA dan asam fenil asetat (PAA), masing-masing telah terbukti menghambat laju reaksi secara non-kompetitif dan secara kompetitif.
2. Teori
Hidrolisis benzilpenisilin oleh enzim penisilin asilase, baik dalam bentuk enzim bebas maupun dalam bentuk enzim amobil, telah diketahui dihambat oleh substrat benzilpenisilin secara uncompetitive, oleh produk-produk reaksi, 6-APA secara nonkompetitif, dan PAA secara kompetitif (Erarslan dkk., 1991; Han dkk., 1981). Enzim penisilin asilase di dalam sel juga telah diketahui mengkatalisis hidrolisis dan sintesis senyawa-senyawa asilamino lain (Cole, 1969a) dan asilasi hidroksilamin untuk menghasilkan hidroksamat (Cole, 1969b).
Berdasarkan kenyataan tersebut, reaksi hidrolisis benzilpenisilin oleh enzim penisilin asilase dapat ditulis seperti disajikan pada Gambar 1.
Gambar 1 Skema reaksi hidrolisis benzilpenisilin
Pada Gambar 2, A menyatakan substrat (benzilpenisilin), P menyatakan produk 6-APA, Q menyatakan produk PAA, E menyatakan enzim penisilin asilase, k1, k3, k5 menyatakan konstanta laju reaksi maju, sementara
EA, EPQ, dan EQ menyatakan senyawa kompleks intermediet. Kompleks EQ mungkin saja mengalami isomerisasi tapi bentuk persamaan laju reaksi tetap tidak berubah. Reaksi tersebut dapat memiliki persamaan laju reaksi sebagaimana dinyatakan oleh persamaan (1).
f eq ia a a a ip iq ip iq ip
PQ
V
A
K
v
K
K
K PQ
AP
A
K
P
Q
K
K
K K
K
⎛
⎞
−
⎜
⎟
⎜
⎟
⎝
⎠
=
+
+
+
+
+
(1)Pada pH 8,0 harga Keq sangat besar sehingga bagian yang mengandung Keq dapat diabaikan. Inhibisi oleh
6-APA bersifat nonkompetitif dan hanya terjadi pada saat Kia = Ka atau ketika k3 « k2. Jika k4 sangat kecil
dibandingkan dengan k3, Kq (=[k4+k6]/k5) akan sama dengan Kiq (=k6/k5). Dengan demikian, jika efek inhibisi
substrat dimunculkan, persamaan (1) dapat ditulis kembali menjadi :
3 2
. .
a a a a aa ip iq ip iq ipk e A
v
K
K
K PQ
A
AP
A
K
P
Q
K
K
K
K K
K
=
+
+
+
+
+
+
(2)dengan e merupakan konsentrasi enzim total dan Kaa adalah konstanta inhibisi substrat.
Persamaan (2) digunakan ntuk memperkirakan kinetika bioreaktor curah. 3. Bioreaktor Curah
Bila hidrolisis benzilpenisilin oleh enzim penisilin asilase dapat dinyatakan oleh persamaan (2), yaitu dengan menganggap pengadukan sempurna, operasi isotermal, dan tidak terjadi kerusakan pada substrat maupun produk, hasil integrasi persamaan (2) dapat dipandang sebagai kinerja bioreaktor curah, dengan X yang merupakan bagian dari substrat yang terkonversi pada waktu t, sementara P = Q = A0X, yang dalam hal ini A0
menyatakan konsentrasi substrat awal. Bentuk integrasi dari persamaan (2) menjadi :
(
)
0 0 02 2 0 01
ln 1
1
2
2
a iq iq ip iq ip aa aaA
A
A
X
X
A X
K
X
A X
K
K
K K
K
K
K
⎡
⎤
⎡
⎤
−
−
⎢
+
+
+
⎥
+
⎢
+
−
⎥
⎢
⎥
⎢
⎥
⎣
⎦
⎣
⎦
0 0 3 0
. .
1
1
2
a ip iq ip iq ip iqA
A X
k E t
K A X
K
K
K K
K K
V
⎡
⎤
−
⎢
+
+
+
⎥
=
⎢
⎥
⎣
⎦
(3) dengan E konsentrasi total enzim di dalam bioreaktor dan V menyatakan volume bioreaktor4. Bahan dan Metode Percobaan
Sebagai substrat dalam proses reaksi hidrolisis yang dilakukan dalam percobaan ini digunakan penisilin G (benzilpenisilin) dalam bentuk garam natriumnya dari BDH. Substrat disediakan dalam bentuk larutan penisilin G dalam bufer fosfat 0,1 M. Untuk membuat larutan buffer fosfat digunakan NaH2PO4.H2O (Merck) dan
Na2HPO4.2H2O (Merck).
Pereaksi yang digunakan untuk penentuan 6-APA terdiri dari larutan buffer fosfat 0,5 M pH 6,8, larutan 2,4-pentandion (BDH) dan pereaksi Ehrlich yang merupakan campuran dari p-dimetilaminobenzaldehid (BDH), etanol 95 %, dan HCl. Pada pelaksanaan penentuan konsentrasi 6-APA ini digunakan kristal 6-APA yang diperoleh dari Sigma Chemical. Co., St. Louis, Mo. sebagai standar. Asam fenil asetat (PAA) yang digunakan untuk membuat campuran reaksi sintetik dalam percobaan tentang kajian pemisahan PAA dan 6-APA dari campuran hasil reaksinya juga merupakan produk Sigma.
Enzim penisilin asilase yang digunakan sebagai biokatalis dalam reaksi hidrolisis benzilpenisilin menjadi 6-APA dan PAA dibeli dari Sigma Chemical Co. Enzim ini berbentuk larutan dalam larutan bufer kalium fosfat pH 7,5. Enzim yang mempunyai nama lain penisilin amidase atau penisilin amidohidrolase EC 3.5.1.11 ini merupakan produk bakteri Escherichia coli. Menurut spesifikasi yang diberikan oleh Sigma, enzim penisilin asilase ini memiliki aktivitas katalitik minimum sebesar 10 units per milligram protein.
Keterangan :
CV1 : check valve, masukan substrat PG1 : pressure gauge, tangki nitrogen
CV2 : check valve, masukan basa PG2 : pressure gauge, output
EN : masukan enzim, inokulasi PG3 : pressure gauge, masukan substrat
F1 : filter, membran SV1 : solenoid valve, substrat
MV1 : manual valve, nitrogen SV2 : solenoid valve, basa
MV2 : manual valve, sampel SV3 : solenoid valve, nitrogen
E : elektroda P : elemen pemanas
R : rotameter
Diagram skematik rangkaian sistim bioreaktor yang digunakan selama percobaan ini ditampilkan oleh Gambar 2. Bioreaktor yang digunakan dalam percobaan ini dibuat dari flexiglass, merupakan jenis bioreaktor tangki yang diaduk dengan volume kerja 301,6 mL. Larutan enzim penisilin asilase disuntikan ke dalam reaktor melalui tempat yang dirancang husus untuk itu. Larutan reaksi di dalam reaktor membran diaduk dengan laju pengadukan tetap sebesar 200 rpm. Reaksi hidrolisis Pen-G menjadi 6-APA dan PAA ini dilaksanakan pada pH optimum 7,8 dan temperatur optimum 370 C
Konsentrasi 6-APA dalam larutannya ditentukan menurut metode yang dikemukakan oleh Kornfeld (1978). Ke dalam tabung reaksi yang berisi 2,6 mL larutan buffer natrium fosfat 0,5 M pH 6,8 ditambahkan 0,3 mL larutan yang mengandung 6-APA dan 0,1 mL 2,4-pentandion, kemudian dikocok. Setelah tabung direndam dalam air mendidih selama 20 menit, tabung didinginkan dengan merendamnya dalam air dan kemudian disimpan dalam air es. Selanjutnya, ke dalam campuran reaksi ditambahkan 1,5 mL pereaksi Ehrlich. Absorbans larutan ditentukan dengan menggunakan spektrofotometer Spectronic 20 Baussch & Lomb pada panjang gelombang 538 nm. Dari absorbans yang terbaca, konsentrasi 6-APA dalam larutan sampel dapat ditentukan dengan menggunakan kurva standar yang merupakan hubungan antara absorbans dengan konsentrasi larutan 6-APA standar. Pembuatan kurva standar dilakukan poada kondisi yang sama dengan kondisi penentuan sampel. Penisilin G ditentukan berdasarkan metode hidroksilamin dari Ford (1947). Pada prinsipnya , sampel yang mengandung cincin β-laktam akan bereaksi dengan hidroksilamin membentuk asam hidroksamat yang dengan adanya ion feri dalam larutan asam membentuk kompleks berwarna. Tiga mL larutan hidroksilamin yang merupakan campuran dari larutan A (5 M hidroksilamin HCl), larutan B (larutan 85,5 g NaOH dan 10,3 g Na-asetat dalam 500 mL aquadest), dan etanol 95 % dengan perbandingan 1 : 1 : 4 ditambahkan ke dalam tiap tabung reaksi yang berisi 3 mL sample dan dikocok. Setelah 3 menit, ke dalam campuran kemudian ditambahkan 1,5 mL larutan feri ammonium sulfat. Absorbans larutan ditentukan dengan menggunakan Spectronic 20 Bausch & Lomb pada panjang gelombang 515 nm.
Penentuan aktivitas enzim penisilin asilase dilakukan dengan cara menentukan banyaknya 6-APA yang dihasilkan dari reaksi hidrolisis Pen-G oleh enzim tersebut. Campuran reaksi terdiri dari substrat Pen-G 1 %, larutan buffer Na-fosfat 0,1 M pH 7,8 dan sejumlah tertentu enzim. Inkubasi campuran reaksi dilaksanakan pada 370C selama 1 jam. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang diperlukan untuk
menghasilkan 1 µmol 6-APA per jam pada pH 7,8 dan temperature 370C.
Penentuan protein enzim dilaksanakan berdasarkan metode yang dikemukakan oleh Lowry (1951). Ke dalam 1 mL sampel ditambahkan 5 mL reagen C yang merupakan campuran dari 2 % Na2CO3 dalam NaOH 0,10
N dan 0,5 % CuSO4 5 H2O dalam 1 % Na-tartrat, kemudian dikocok dengan baik dan biarkan selama 10 menit
pada temperatur ruang. Ke dalam campuran kemudian ditambahkan 0,5 mL reagen Folin-Ciocalteu fenol 1 N, dan setelah dikocok dan dibiarkan selama 30 menit pada temperatur ruang, campuran tersebut ditentukan absorbansnya dengan Spectronic 20 Bausch & Lomb pada panjang gelombang 750 nm.
5. Hasil dan Diskusi
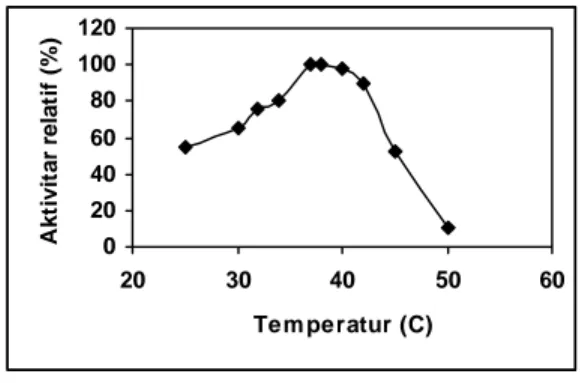
Reaksi enzimatik, seperti reaksi kimia pada umumnya, dipengaruhi oleh temperatur. Bila temperatur naik, laju reaksi yang dikatalisis oleh enzim juga meningkat. Peningkatan laju reaksi ini akan terus berlangsung seiring dengan kenaikan temperatur hingga mencapai laju reaksi maksimum, dan setelah itu, laju reaksi menurun kembali secara drastis. Temperatur tertentu yang mengakibatkan suatu reaksi kimia berlangsung dengan laju reaksi maksimum, disebut temperatur optimum. Dari hasil percobaan yang disajikan oleh Gambar 3, dapat dilihat bahwa temperatur optimum reaksi konversi Pen-G menjadi 6-APA berkisar pada temperatur 37-38oC.
0 20 40 60 80 100 120 20 30 40 50 60 Tem peratur (C) A k tivit ar r ela ti f ( % )
Gambar 3. Pengaruh temperatur pada aktivitas katalitik enzim penisilin asilase dari Escherichia coli
Umumnya, enzim hanya akti pada kisaran pH tertentu. Oleh karena itu, pH optimum untuk aktivitas enzim penisilin asilase perlu ditentukan. Dari hasil percobaan yang diperlihatkan oleh Gambar 4 dapat diketahui bahwa aktivitas spesifik maksimum enzim penisilin asilase yang digunakan pada percobaan ini terletak pada pH 7.8. Aktivitas spesifik enzim pada pH lainnya dinyatakan sebagai harga aktivitas relatif terhadap aktivitas spesifik tertinggi pada pH 7.8.
0 20 40 60 80 100 120 3 4 5 6 7 8 9 10 11 12 pH Akt iv itas r e la ti f (% )
Gambar 4. Pengaruh pH pada aktivitas katalitik enzim penisilin asilase dari Escherichia coli
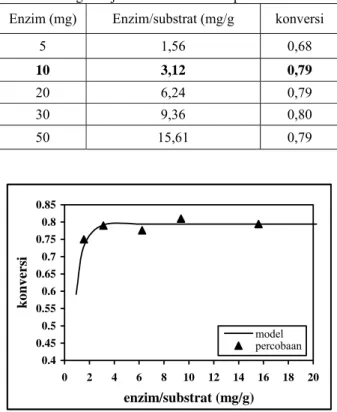
Perbandingan yang optimum antara jumlah enzim dan jumlah substrat merupakan hal yang sangat penting untuk efisiensi penggunaan enzim dalam setiap pelaksanaan reaksi enzimatik. Oleh karena itu, penelitian pengaruh perbandingan antara konsentrasi enzim penisilin asilase terhadap konsentrasi substrat Pen-G untuk memperoleh konversi maksimum merupakan salah satu bagian dari pekerjaan ini. Seperti dapat dilihat pada Tabel 1 dan Gambar 5, pada awalnya konversi reaksi hidrolisis Pen-G menjadi 6-APA dengan menggunakan enzim penisilin asilase terlarut meningkat sangat drastis dengan meningkatnya perbandingan konsentrasi enzim terhadap konsentrasi substrat, namun mulai dari nilai perbandingan enzim/substrat 3,12, peningkatan tersebut sudah tidak berarti lagi. Perbandingan enzim/substrat 3,12 merupakan nilai yang menunjukkan jumlah enzim terkecil yang memberikan konversi reaksi yang maksimum.
Tabel 1 Pengaruh jumlah enzim terhadap konversi reaksi Enzim (mg) Enzim/substrat (mg/g konversi
5 1,56 0,68 10 3,12 0,79 20 6,24 0,79 30 9,36 0,80 50 15,61 0,79 0.4 0.45 0.5 0.55 0.6 0.65 0.7 0.75 0.8 0.85 0 2 4 6 8 10 12 14 16 18 20 enzim/substrat (mg/g) konvers i model percobaan
Pen-G menjadi 6-APA dengan enzim penisilin asilase
Dari hasil penelitian optimasi jumlah enzim yang telah dilakukan diketahui bahwa makin tinggi perbandingan enzim/substrat, konversi reaksi maksimum makin cepat dicapai. Seperti dapat dilihat pada Gambar 6. konversi maksimum reaksi hidrolisis Pen-G dengan perbandingan enzim substrat 1,36; 3,12; 6,24; 9,36; dan 15,61 secara berturut-turut dicapai setelah: 14 jam untuk mencapai konversi 0,68, 8 jam untuk mencapai konversi 0,79, 5 jam untuk mencapai konversi 0,79, 4 jam untuk mencapai konversi 0,79, dan 2,5 jam untuk mencapai konversi 0,79. 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 0 4 8 12 16 20 24 28 32 waktu [jam] konv ers i 5 mg enzim 10 mg enzim 20 mg enzim 30 mg enzim 50 mg enzim
Gambar 6. Pengaruh perbandingan enzim/substrat pada konversi
Walaupun demikian, perbandingan enzim/substrat 6,24 atau enzim sebanyak 20 mg dalam 300 mL substrat pen-G 30 mM, telah dipilih sebagai konsentrasi enzim yang digunakan selama penelitian.
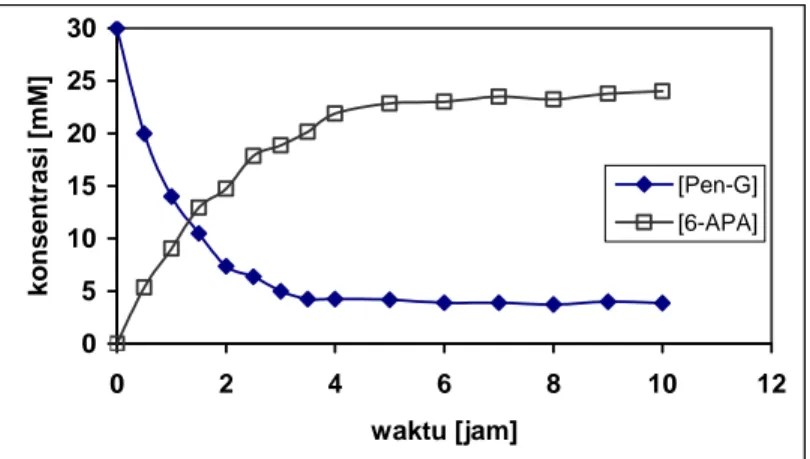
Perilaku konsentrasi substrat Pen-G dan produk 6-APA selama dilaksanakan reaksi hidrolisis dalam bioreaktor curah dapat diperhatikan pada Gambar7. Dari Gambar 7 terlihat bahwa konsentrasi produk 6-APA meningkat seiring dengan menurunnya konsentrasi substrat Pen-G. Konsentrasi 6-APA mencapai keadaan tunak setelah 6 jam. Meskipun reaksi hidrolisis Pen-G menjadi 6-APA merupakan jenis reaksi yang reversibel bergantung pada pH, konversi kesetimbangan Pen-G menjadi 6-APA menurut hasil percobaan adalah sekitar 85% pada temperatur 37oC dan pH 7,8. 0 5 10 15 20 25 30 0 2 4 6 8 10 12 waktu [jam] ko n s e n tr asi [ m M] [Pen-G] [6-APA]
Gambar 7. Produksi 6-APA dalam bioreaktor curah
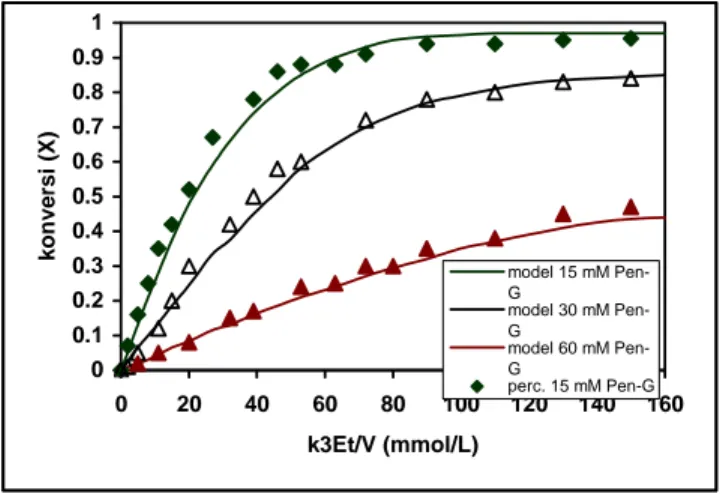
Pengaruh konsentrasi awal substrat Pen-G pada kemajuan reaksi dalam bioreaktor curah diperlihatkan oleh Gambar 8. Dari hasil ini dapat dikemukakan bahwa untuk harga k3E dan V tertentu, waktu yang diperlukan
untuk mencapai harga konversi (X) berbeda-beda. Makin tinggi konsentrasi substrat yang digunakan, untuk mencapai konversi yang sama menjadi semakin lama. Misalnya saja, koversi 95% dari reaksi dengan konsentrasi
substrat 15 mM, dicapai pada k3Et/V 120 mmol/L, sementara untuk mencapai konversi yang sama dengan
menggunakan substrat 30 mM diperlukan k3ET/V yang lebih besar.
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 0 20 40 60 80 100 120 140 160 k3Et/V (mmol/L) k onve rsi ( X ) model 15 mM Pen-G model 30 mM Pen-G model 60 mM Pen-G perc. 15 mM Pen-G
Gambar 8. Pengaruh konsentrasi awal substrat pada reaksi hidrolisis Pen-G dengan menggunakan enzim penisilin asilase.
Pada pelaksanaan percobaan ini digunakan harga-harga Ka, Kaa, Kip, dan Kiq hasil penelitian Balasingham
(1972) yang masing-masing besarnya 0,67 mM, 270 mM, 7,1 mM, dan 4,8 mM. Pada penelitian ini, persamaan (3) telah digunakan untuk memperkirakan kinetika reaksi hidrolisis Pen-G oleh enzim penisilin asilase dalam bioreaktor curah dengan menggunakan perangkat lunak MATLAB 6.5 dan Microsoft EXCEL yang dapat dijalankan pada komputer biasa.
6. Notasi ν : Laju reaksi hidrolisis Pen-G
f
V
: Laju reaksi hidrolisis Pen-G maksimumA : Substrat Pen-G
P : Produk 6-APA
Q : Produk PAA
EA, EPQ, EQ : Kompleks intermediet
1 6
k
− Konstanta laju reaksia
K
: Konstanta Michaelis-Menteneq
K
: Konstanta kesetimbangan reaksi hidrolisisip
K
: Konstanta inhibisi 6-APAiq
K
: Konstanta inhibisi PAA7. Daftar Pustaka
1. Arroyo, M., I. De la Mata, C. Acebal and M. P. Castillon (2003), Biotechnological Applications of Penicillin Acylases: State-of-the art, Appl. Microbiol. Biotechnol., 60, 507 – 514.
2. Balasingham, K., D. Warburton, D. Dunnill and M. D. Lilly (1972), The Isolation and Kinetics of Penicillin Amidase from E. Coli, Biochem. Biophys. Acta, 276, 250 – 256.
3. Crueger, W. and A. Crueger (1984), Biotechnology : A Textbook of Industrial Microbiology, Brock, T.D. (Ed.), Science Tech., Inc., Madison, USA, 178 – 180, 201 – 206.
4. Carrington, T. R. (1971), The Development of Commercial Processes for the Production of 6-Aminopenicillanic Acid (6-APA), Proc. R. Soc. Lond. B., 179, 321 – 333.
5. Cole, M. (1969a), Hydrolysis of Penicillins and Related Compounds by the Cell-Bound Penicillin Acylase of Escherichia coli, Biochem. J., 115, 733 – 739.
6. Cole, M. (1969b), Penicillins and Other Acylamino-Compounds Synthesized by Cell-Bound Penicillin Acylase of Echerichia coli, Biochem. J., 115, 747 – 756.
7. Erarslan, A., I. Terzi, A. Guray and E. Bermek (1991), Purification and Kinetics of Penicillin G Acylase from a Mutant Strain of Escherichia coli ATCC 11105, J. Chem. Tech. Biotechnol., 51, 27 – 40.
8. Ford, J. H. (1947), Hydroxylamine Method of Determining Penicillins, Ind. Eng. Chem., 19(12), 1004 - 1006
9. Han, M.H., B. L. Seong, B. H. Kim and T. I. Mheen (1981), Studies on Microbial Penicillin Amidase (III) : Purification and Kinetics Properties of Penicillin Amidase of Escherichia coli, Korean Biochem. J., 14, 223 – 242.
10. Kornfeld, J. M. (1978), A New Colorimetric Method for the Determination of 6-Aminopenicillanic Acid, Analytical Biochemistry, 86, 118 – 126.
11. Lowry, O. H., N. J. Rosebrough, A. L. Farr and R. J. Randall (1951), Protein Measurement with the Folin Phenol Reagent, J. Biol. Chem., 193, 265 – 275.
12. Shewale, J.G. and H. Sivaraman (1989), Penicillin Acylase : Enzyme Production and Its Applicationin the Manufacture of 6-APA, Process Biochem, August, 246 – 154.
13. Shewale, J. G., B. S. Deshpande, V. K. Sudhakaran and S. S. Ambedkar (1990), Penicillin Acylases : Applications and Potentials, Process Biochem., 25, 97 – 103.
14. Svedas, V. K, A. L. Margolin, I. L. Borisov and I. V. Berezin (1980), Kinetics of the Enzymatic Synthesis of Benzylpenicillin, Enzyme Microb. Technol., 2, 313 – 317.
15. Vandamme, E. J. and J. P. Voets (1974), Microbial Penicillin Acylases, Adv. Appl. Microbiol., 17, 311 – 369.