UJI SITOTOKSISITAS FRAKSI BUTANOL KULIT BATANG SRIKAYA (Annona Squamosa L.) TERHADAP SEL HeLa
SKRIPSI
Disusun untuk melengkapi syarat- syarat guna memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas 17 Agustus 1945 Jakarta
Disusun oleh: WAHYU SUGIYARTO
0843050024
FAKULTAS FARMASI
UNIVERSITAS 17 AGUSTUS 1945 JAKARTA
ii
LEMBAR PENGESAHAN Skripsi dengan judul
UJI SITOTOKSISITAS FRAKSI BUTANOL KULIT BATANG SRIKAYA (Annona squamosa L.) TERHADAP SEL HELA
Yang Dipersiapkan dan Disusun Oleh : Wahyu Sugiyarto
0843050024
Telah dipertahankan di hadapan tim penguji Pada tanggal : 26 Agustus 2013
Pembimbing : Penguji :
(Dra. Aprilita Rinayanti, M.Biomed., Apt) (Dr. Hasan Rachmat, M.DEA., Apt)
Utama Ketua
(Widayanti, S.Si., Apt) (Ema Dewanti, M.Si)
Pendamping Sekretaris
iii
KATA PENGANTAR
Alhamdulillah, segala puji dan syukur penulis panjatkan kehadirat Allah Tuhan seru sekalian alam, atas segala rahmat dan karunianya sehingga penulis dapat menyelesaikan penulisan skripsi ini yang berjudul “UJI SITOTOKSIK FRAKSI BUTANOL KULIT BATANG SRIKAYA (Annona squamosa L.) TERHADAP SEL HELA”. Shalawat serta salam semoga senantiasa tercurah kepada junjungan kita Nabi Muhammad S.A.W. Dengan penuh rasa kasih dan cinta, penulis mengucapkan terima kasih yang terdalam untuk seluruh keluargaku terutama Ibu tercinta serta istriku tersayang yang tidak pernah berhenti memberikan doa dan dukungan baik secara moril maupun materil sehingga penulis bisa menyelesaikan skripsi ini.
Dalam kesempatan ini, penulis juga ingin mengucapkan terima kasih yang sebesar-besarnya kepada yang terhormat : meluangkan waktunya dan mencurahkan segala perhatian, kesabaran dan waktunya kepada penulis selama penyusunan dan penulisan proposal skripsi ini.
iv
6. Ibu Elrade Rofaani,St. M.Sc., dan seluruh staf BPPT Serpong( Mas Fery, dan Bu Churi) terima kasih telah banyak membantu dan membimbing selama menjalani penelitian dengan penuh kesabaran.
7. Dessy, Marifatur, Abeth, Cory, Oz, dan Christine teman-teman kelompok penelitian yang sudah menjadi tim yang hebat.
8. Serta teman- teman angkatan 2008 terima kasih banyak untuk dukungan dan solidaritasnya.
9. Dan kakak - kakak senior, terima kasih untuk semua dukungan dan bantuan kalian.
Semoga Allah S.W.T membalas segala kebaikan dan bantuan yang telah di berikan kepada penulis. Sebagai manusia yang penuh dengan kekhilafan, Penulis sangat menyadari bahwa dalam penyusunan skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis dengan senang hati menerima kritik dan saran dari pembaca. Semoga hasil penelitian ini bermanfaat bagi penulis pada khususnya dan dunia kefarmasian pada umumnya , Amin.
Jakarta, 30 Agustus 2013
vi
1. Determinasi Dan Pengumpulan Kulit Batang Srikaya ... 19
2. Pembuatan Serbuk Kulit Batang Srikaya ... 19
3. Pembuatan Ekstrak Kulit Batang Srikaya ... 20
4. Pemeriksaan Karakteristik Ekstrak ... 21
5. Pembuatan Reagen ... 23
2. Pemeriksaan Karateristik Ekstrak ... 30
3. Penapisan Fitokimia ... 31
4. Hasil Uji Sitotoksik Dengan Metode MTT Terhadap Sel Hela ... 32
vii
BAB V KESIMPULAN DAN SARAN ... 42
A. Kesimpulan ... 42
B. Saran ... 42
DAFTAR PUSAKA ... 43
viii
DAFTAR TABEL
Halaman
Tabel I. Hasil Penapisan Fitokimia Fraksi Butanol Kulit Batang Srikaya ... 32 Tabel II. Persentase Sel Hidup Fraksi Butanol dari Annona squamosa L.Terhadap
Sel Kanker Serviks (sel HeLa) Setelah Diinkubasi 24 jam ... 33 Tabel III. Analisa Probit Fraksi Butanol Annona squamosa L. ... 33 Tabel IV. Persentase Sel Hidup Dengan Penambahan Doxorubisin (Kontrol
Positif) Setelah Diinkubasi 24 jam ... 34 Tabel V. Analisa Probit ( Log Konsentrasi Doxorubisin (Kontrol Positif) vs Probit
ix
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman Srikaya ( Annona squamosa L.) ... 47
Gambar 2. Oven ... 47
Gambar 3. Rotary evaporator ... 48
Gambar 4. Perhitungan kepadatan sel dengan haemocytometer... 48
Gambar 5. Morfologi sel Hela Sel ... 49
Gambar 6. Morfologi sel Hela dengan metode MTT... 50
Gambar 7. Plate Well dengan metode MTT ... 50
Gambar 8. Inkubator CO2 5% ... 51
Gambar 9. Mikroskop kamera(mikroskop interved)... 51
Gambar 10. Laminar air flow ... 52
Gambar 11. Tangki nitrogen cair ... 53
Gambar 12. ELISA Plate Reader ... 53
Gambar 13. Haemocytometer ... 54
Gambar 14. Fortect ... 54
Gambar 15. Sentrifuse ... 55
x
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Determinasi Kulit Batang Annona squamosa L. ... 56
Lampiran 2. Perhitungan Rendemen Fraksi Butanol Kulit Batang Annona squamosa L. ... 57
Lampiran 3.Hasil Susut Pengeringan Fraksi Butanol Kulit Batang Annona squamosa L. ... 57
Lampiran 4. Skema Kerja Ekstraksi Kulit Batang Annona squamosa L. ... 58
Lampiran 5. Perhitungan Kepadatan Sel... 59
Lampiran 6. Data Absorbansi Fraksi Butanol Annona squamosa L ... 60
Lampiran 7. Data Absorbansi Doxorubicin (Kontrol Positif)... 61
Lampiran 8. Tabel Probit ... 62
Lampiran 9. Perhitungan Sampel Uji dan Kontrol Positif ... 63
Lampiran 10. Perhitungan Persentase Sel Hidup Terhadap Konsentrasi Sampel Uji ... 67
Lampiran 11. Perhitungan persentase sel hidup (%) terhadap konsentrasi Doxorubisin ... 71
Lampiran 12. Perhitungan LC50 Sampel Uji ... 76
Lampiran 13. Uji Statistik Regresi Linear ... 77
xi
SURAT PERNYATAAN
Yang bertanda tangan di bawah ini menyatakan bahwa,
1. Karya tulis ilmiah saya, berupa skripsi adalah asli dan belum pernah diajukan untuk mendapatkan gelar akademik S1, baik di Universitas ini maupun di Universitas lain.
2. Karya tulis ini murni gagasan, rumusan dan penulisan saya sendiri tanpa bantuan pihak lain kecuali tim pembimbing.
3. Dalam karya tulis ilmiah ini tidak terdapat karya atau pendapat yang telah ditulis dan dipublikasikan orang lain kecuali tertulis dengan jelas dicantumkan sebagai acuan dalam naskah dengan disebutkan nama pengarang serta dicantunkan dalam daftar pustaka.
4. Pernyataan ini saya buat dengan sesungguhnya, apabila dikemudian hari terdapat penyimpangan dan ketidakbenaran dalam pernyataan ini, maka saya bersedia menerima sanksi akademik berupa pencabutan gelar yang telah diperoleh karena karya tulis ini dan sanksi lainnya sesuai peraturan perundang-undangan dan norma akademik yang berlaku di Universitas 17 Agustus 1945 Jakarta.
Jakarta, 30 Agustus 2013 Yang membuat pernyataan
xii ABSTRAK
[A] WAHYU SUGIYARTO (0843050024)
[B] UJI SITOTOKSISITAS FRAKSI BUTANOL KULIT BATANG SRIKAYA (Annona Squamosa L.) TERHADAP SEL HeLa
[C] Xii + 82 Halaman ; 2013; 5 Tabel; 16 Gambar; 14 Lampiran. Kata kunci : kulit batang, srikaya ( Anoona squamosa L.), butanol, sitotoksisitas, sel HeLa
[D] Banyak tanaman di sekitar kita yang sangat berpotensi untuk digunakan sebagai tanaman obat, salah satunya adalah srikaya (Annona squamosa L.) yang berasal dari family Annonaceae. Secara empiris, srikaya sering digunakan sebagai astringen, antiradang, anthelmetik, antifertilitas, zat pemicu pematangan bisul, dan anti tumor. Kandungan flavonoid yang terkandung dalam tanaman srikaya diduga memiliki khasiat sebagai antikanker. Hasil penelitian dengan metode Brine Shrimp Lethality Test menunjukkan bahwa ekstrak metanol kulit batang Annona squamosa L. Berefek toksik pada larva udang dengan nilai LC50 sebesar 6,53 μg/ml dan nilai LC50 sebesar 70,77 μg/ml terhadap sel T47D . Penelitian ini dilakukan untuk mengetahui lebih lanjut apakah fraksi buta nol kulit batang srikaya memiliki potensi sebagai anti kanker dengan menggunakan metode MTT pada kultur sel HeLa. Penelitian dimulai dengan cara simplisia dimaserasi dalam etanol 70% kemudian dilanjutkan dengan fraksinasi beringkat dengan heksan, etil asetat dan butanol, hingga didapat fraksi butanol. Sampel ekstrak dengan konsentarsi 400 µ g/ml, 200 µ g/ml, 100 µ g/ml, 50 µ g/ml , 25 µ g/ml dan 12,5 µ g/ml, diujikan pada media yang berisi sel Hela. Jumlah sel yang hidup dilihat berdasarkan nilai absorbansi dari warna yang terbentuk oleh reaksi reduksi garam tetrazolium MTT. Parameter penelitian adalah menentukan nilai LC50 dari hasil persamaan regresi antara log konsentrsai ekstrak vs probit kematian sel. Dari persamaan regresi linier yang diperoleh didapat harga LC50 sebesar 3372,87 µg/ml atau ≈ 3,37 mg/ml. Berdasarkan
analisis sitotoksisitas terhadap sel HeLa, dapat disimpulkan bahwa fraksi butanol kulit batang srikaya (Annona squamosa L.) kurang berpotensi terhadap sel kanker serviks.
[E] Daftar Pustaka : 46 buah (1987-2012) [F] Dra. Aprilita Rinayanti, M.Si, Apt.
1 BAB I PENDAHULUAN
A. Latar Belakang
Kanker merupakan suatu penyakit sel yang ditandai dengan hilangnya fungsi kontrol sel terhadap regulasi daur sel maupun fungsi homeostatis sel pada organisme multiseluler. Dengan kegagalan tersebut, sel tidak dapat berproliferasi secara normal. Akibatnya, sel akan berproliferasi terus-menerus sehingga menimbulkan pertumbuhan jaringan yang abnormal (Anonim, 2009).
Penyakit kanker masih menjadi masalah kesehatan dunia. Menurut data World Health Organization (WHO), setiap tahun jumlah penderita kanker di dunia berjumlah 625 juta orang dan dalam waktu 10 tahun diperkirakan 9 juta orang akan meninggal setiap tahun akibat kanker, dua pertiga dari pederita kanker di dunia berada di negara berkembang (Djajanegara dan Wahyudi, 2009).
Kanker serviks menduduki urutan tertinggi di negara berkembang dan urutan ke-10 di negara maju atau urutan ke 5 secara global. Menurut data Globocan 2008, terdapat 529.409 kasus baru kanker seviks dengan sekitar 274.883 kematian di dunia. Di Indonesia, terdapat 13.762 kasus baru dan kematian 7493 jiwa dalam setahun. Data dari 13 laboratorium patologi di Indonesia, memperlihatkan bahwa kanker serviks menduduki urutan pertama dari 10 kanker terbanyak (Soehartati et al, 2010).
2
Proses dimulai dengan lesi prakanker dan setelah bertahun-tahun baru menjadi kanker invasif (Soehartati et al, 2010).
Beberapa obat antikanker yang telah dikembangkan saat ini, antara lain berupa obat yang merangsang diferensiasi sel sehingga akan terjadi perubahan sifat dari sel kanker yang ganas menjadi sel jinak, obat yang dapat meningkatkan efektivitas radiasi dan obat yang mengubah respon imun sel kanker dengan sel sehat. Selain itu, telah banyak obat-obatan yang dikembangkan berdasarkan aktivitas molekuler dari sel kanker. Namun, obat-obatan tersebut mengalami permasalahan dalam hal resistensi dan toleransi obat serta selektivitas obat itu sendiri di samping dari berbagai efek samping yang dapat ditimbulkan . Berbagai penelitian juga telah dilakukan dalam rangka pemanfaatan senyawa alam untuk terapi kanker. Penelitian-penelitian tersebut masih terus dikembangkan untuk menemukan obat kanker yang optimal dalam terapi (Anonim, 2009).
Salah satu masalah yang mempersulit upaya pengobatan kanker adalah kondisi ekonomis sebagian besar masyarakat yang belum memadai. Mengingat mahalnya biaya pengobatan, perlu dicari alternatif dengan memanfaatkan tumbuhan obat disekitar kita atau istilah populernya, kembali ke alam (back to nature). Pengobatan tradisional sering dilakukan masyarakat karena biayanya murah, bahannya mudah didapat dan aman bagi tubuh serta memiliki efek samping yang relatif kecil dibandingkan dengan obat-obat moderen (Djajanegara dan Wahyudi, 2006).
3 berasal dari family Annonaceae.
Tanaman srikaya memiliki banyak kegunaan. Buah, daun, kulit pohon, sampai biji bisa digunakan untuk berbagai keperluan. Ini tidak hanya terjadi di satu negara tapi di berbagai penjuru dunia yang terdapat banyak tanaman srikaya. Di berbagai belahan dunia, daun srikaya dimanfaatkan untuk pengobatan tradaisional. Di Meksiko, misalnya digunakan untuk mengusir kutu rambut. Di India, daunnya ditumbuk lalu dihirupkan untuk memulihkan orang yang pingsan. Di Amerika Selatan, daunnya dijadikan teh untuk membantu pencernaan dan melawan flu (Soedarso, 2012).
Secara empiris, srikaya sering digunakan sebagai astringen, antiradang, anthelmetik, antifertilitas, zat pemicu pematangan bisul, dan anti tumor. Tanaman ini mengandung beberapa senyawa aktif, antara lain flavonoid, borneol, camphor, terpen, saponin, tannin, polifenol dan senyawa polipeptida (Djajanegara dan Wahyudi, 2006).
Kandungan flavonoid yang terkandung dalam tanaman srikaya diduga memiliki khasiat sebagai antikanker. Hasil penelitian sebelumnya melaporkan bahwa kandungan senyawa kimia dari tanaman dengan family Annonaceae memiliki potensi sebagai anti kanker. Pisutthanan et al. (2004) melakukan uji sitotoksik dengan metode Brine Shrimp Lethality Test menunjukkan bahwa ekstrak metanol kulit batang Annona squamosa L. Berefek toksik pada larva udang dengan nilai LC50sebesar 6,53 μg/ml. Fraksi semipolar ekstrak etanol kulit batang Srikaya ( Annona squamosa L.) mempunyai aktivitas sitotoksik yang poten
4
Hal ini yang membuat penulis tertarik meneliti srikaya ( Annona squamosa L.) pada fraksi polar butanol dengan menggunakan metode MTT pada media kultur sel HeLa. Kandungan flavonoid dari tanaman yang bersifat polar, diharapkan dapat tersari dengan pelarut butanol yang juga bersifat polar (Sjahid, 2008).
B. Rumusan Masalah
Apakah fraksi n-butanol ekstrak kulit batang Srikaya (Annona squamosa L.) mempunyai efek sitotoksik terhadap sel HeLa?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui daya sitotoksisitas (IC50) fraksi butanol kulit batang srikaya (Annona squamosa L. ) terhadap sel HeLa.
D. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai aktivitas daya sitotoksisitas fraksi butanol kulit batang srikaya (Annona squamosa L.) terhadap sel kanker dan semakin bertambahnya alternatif pengobatan kanker yang bersumber dari tanaman obat Indonesia.
E. Landasan Teori
5
sitotoksik dengan nilai LC50 7,6948 µg/ml untuk ekstrak etanol dan 4,5467 µg/ml untuk fraksi kloroform. Pisutthanan et al. (2004) melakukan uji sitotoksik ekstrak metanol kulit batang Annona squamosa L. dengan metode Brine Shrimp Lethality Test menyebabkan toksisitas pada larva udang dengan LC50 sebesar
6,53 μg/ml. Dari data ini akan diteliti mengenai daya sitotoksisitas ( LC50) dari fraksi butanol kulit batang srikaya (Annona squamosa L.).
F.Hipotesis
Fraksi butanol kulit batang Srikaya (Annona squamosa L.) berefek sitotoksis terhadap sel HeLa.
G. Keaslian Penelitian
Sampai saat ini penelitian untuk mengetahui konsentrasi daya sitotokisitas fraksi butanol kulit batang srikaya (Annona squamosa L.) terhadap sel HeLa belum pernah ada dan belum dilakukan dalam penelitian.
H. Tempat Penelitian
6 BAB II
TINJAUAN PUSTAKA
A. Uraian Tanaman
1. Taksonomi
Klasifikasi tanaman Srikaya ( Annona squamosa L. ) adalah sebagai berikut:
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Bangsa : Ranunculales Suku : Annonaceae Marga : Annona
Jenis : Annona squamosa L. (Syamsuhidayat, 1991) 2. Sinonim
Nama latin : Annona squamosa L.
7
Nama asing : Fan li chi (C), nona, serikaya (M), noinah (T), ates or atis (F), cachiman (A), saramulla, saramuya (Mx), anon (B), scopappel (B).
3. Morfologi Tanaman
Kulit pohon tipis berwarna keabu-abuan, getah kulitnya beracun. Batangnya (pada dahan) coklat muda, bagian dalamnya berwarna kuning muda dan agak pahit. Pada bagian ranting berwarna coklat dengan bintik coklat muda, lenti sel kecil, oval, berupa bercak bulat pada batang.
Daun tunggal, bertangkai, kaku, letaknya berseling. Helai daun berbentuk lonjong hingga jorong menyempit, ujung dan pangkal runcing, dasar lengkung, tepi rata, panjang 5-17 cm, lebar 2-7,5 cm, permukaan daun berwarna hijau, bagian bawah hijau kebiruan, sedikit berambut atau gundul. Rasanya pahit, sedikit dingin. Tangkai daun panjangnya 0,4-2,2 cm.
Bunganya bergerombol pendek menyamping dengan panjang sekitar 2.5 cm, sebanyak 2-4 kuntum bunga kuning kehijauan (berhadapan) pada tangkai kecil panjang berambut dengan panjang ± 2 cm, tumbuh pada ujung tangkai atau ketiak daun. Biji membujur di setiap karpel, halus, coklat tua hingga hitam, panjang 1,3-1,6 cm. Biji masak berwarna hitam mengkilap (Syamsuhidayat, 1991).
4. Kandungan Kimia
8
ncoanonin B, neo desasetilurarisin, neo retikulasin A, skuamosten A, asmisin, skuamosin, sanonasin, anonastatin, neoanonin). Juga ditemukan skuamosisnin A, skuamosin B, C, D, E, F, G, H, I, J, K, L, M, N; skuamostatin B, asam lemak, asam amino dan protein. Daun mengandung alkaloid tetrahidro isokuinolin, p-hidroksibenzil-6,7- dihidroksi-1,2,3,4-tetrahidroisokinolin (demetilkoklaurin = higenamin). Bunga mengandung asam kaur-1,6-ene-1,9-oat diinformasikan sebagai kornponen aktif bunga srikaya. Akarnya mengandung flavonoid, borneol, kamfer, terpen, alkaloid anonain, saponin, tanin, dan polifenol. Kulit kayu mengandung flavonoid, borneol, kamfer, terpen, dan alkaloid anonain. Buah muda mengandung tanin. (Anonim, 2006b).
5. Manfaat dan Kegunaan
Akar rasanya pahit, sifatnya dingin. Berkhasiat antiradang, antidepresi. Daun rasanya pahit, kelat, sifatnya sedikit dingin. Berkhasiat astringen, antiradang, peluruh cacing usus (antheimintik), serta mempercepat pemasakan bisul dan abses. Biji berkhasiat memacu enzim pencernaan, abortivum, anthelmintik, dan pembunuh serangga (insektisida). Kulit kayu berkhasiat astringen dan tonikum. Buah muda dan biji juga berkhasiat antiparasit ( Soedarso, 2012 ).
6. Ekologi dan Budidaya
9
srikaya dapat tumbuh setinggi 6,1 m apabila tidak dipangkas (Soedarso, 2012). Tanaman srikaya banyak dijumpai dan ditanam di Mexico Selatan, Hindia Barat, Bahama dan Bermuda. Penanaman yang lebih jarang di Florida Selatan, Jamaika, Puerto Rico, Barbados, dan diberbagai daerah kering North Quenslanad dan Australia. Budidaya paling besar terjadi di India (Soedarso, 2012).
B. Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut air. Simplisia yang diekstrak mengandung zat aktif yang dapat larut dan zat yang tidak dapat larut seperti serat,karbohidrat, protein, dan lain-lain. Senyawa aktif yang ada dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid, dan lain-lain. Struktur kimia yang berbeda akan mempengaruhi kelarutan serta stabilitas senyawa tersebut terhadap pemanasan, udara, cahaya, logam berat, dan derajat keasaman. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Anonim, 2000).
10 C. Metode
Teknik yang digunakan dalam ekstraksi dengan menggunakan pelarut dapat dilakukan dengan dua cara : (Anonim,2000)
1. Cara dingin a. Maserasi
Maserasi merupakan proses ekstraksi suatu senyawa, dari simplisia yang sudah dihaluskan kemudian direndam sampai meresap dan selnya melunak, sehingga zat-zat yang mudah larut akan terlarut (Anonim, 2000).
Maserasi biasanya dilaksanakan pada temperatur 15-20°C dengan waktu yang berbeda-beda tergantung pada sifat atau ciri campuran senyawa. Tetapi lamanya harus cukup supaya dapat memasuki semua rongga dari struktur senyawa dan melarutkan semua zat yang mudah larut, biasanya waktunya dalam 3 hari (Anonim, 2000). Secara teknologi termasuk ektraksi dengan prinsip pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinyu (terus-menerus) (Anonim, 2000).
b.Perkolasi
Perkolasi adalah proses ekstraksi dengan menggunakan perkolator. Bahan dalam serbuk dicampur dengan pelarut ekstraksi kemudian ditaburkan dalam perkolator, pelarut dialirkan melalui dinding perkolator dengan perlahan agar merata dari atas sampai ke bawah (Anonim, 2000).
2. Cara panas a. Refluks
11
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik, umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna (Anonim, 2000).
b.Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilaksanakan dengan alat khusus sehingga terjadi ekstraksi kontinyu dengan jumlah pearut relatif konstan dengan adanya pendingin balik (Anonim, 2000).
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan secara umum dilakukan pada temperatur 40-50°C (Anonim, 2000).
d. Infus
Infus adalah ekstraksi dengan pelarut cair pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih), temperatur terukur 96-98°C selama waktu tertentu (15-20 menit) (Anonim, 2000).
e. Dekok
12 C. Pelarut
Pelarut yang umumnya digunakan adalah air dan pelarut organik. Pelarut organik dibagi berdasarkan kepolarannya, antara lain n-heksan, petroleum eter (non polar), kloroform, etil asetat (semi polar), methanol, etanol, butanol (polar). Masing-masing kelompok senyawa kimia memiliki kelarutan yang berbeda, pelarut polar melarutkan senyawa yang polar dan pelarut non polar melarutkan senyawa yang non polar (Aulia, 2012).
D. Kanker
Kanker merupakan suatu penyakit sel yang ditandai dengan hilangnya fungsi kontrol sel terhadap regulasi daur sel maupun fungsi homeostatis sel pada organisme multiseluler. Dengan kegagalan tersebut, sel tidak dapat berproliferasi secara normal. Akibatnya, sel akan berproliferasi terus-menerus sehingga menimbulkan pertumbuhan jaringan yang abnormal (Anonim, 2009).
Pertumbuhan kanker merupakan sebuah proses mikroevolusioner yang dapat berlangsung selama beberapa bulan atau beberapa tahun. Proses pertumbuhan ini dinamakan karsinogenesis. Usaha penyembuhan penyakit kanker sangat sulit karena kompleksnya mekanisme molekuler yang menyertainya (Anonim, 2009).
E. Kanker Leher Rahim (Serviks)
13
merupakan pintu masuk ke arah rahim yang terletak antara rahim (uterus) dengan liang senggama (vagina). Kanker ini biasanya terjadi pada wanita yang telah berumur, tetapi bukti statistik menunjukan bahwa kanker leher rahim dapat juga menyerang wanita yang berumur antara 20 sampai 30 tahun (Anonim, 2007).
Sembilan puluh persen dari kanker serviks berasal dari sel skuamosa (pada jaringan epitel) yang melapisi serviks sedangkan 10% berasal dari sel kelenjar penghasil lendir pada saluran servikal yang menuju ke dalam rahim. Pada tahun 2008, kasus Kanker Leher Rahim masih menduduki peringkat pertama insidensi kanker di Indonesia. Menurut sumber yang didapat, wanita yang telah terserang kanker ini lebih dipicu lagi dengan kebiasaan mereka akan merokok (Anonim, 2007).
Penyebab paling utama kanker servik adalah anggota famili Papovirida yaitu HPV (Human Papiloma Virus) yang mempunyai diameter 55 µm dan virus ini ditularkan secara seksual. HPV memiliki kapsul isohedral yang telanjang dengan 72 kapsomer, serta mengandung DNA circular double stranded dengan panjang kira – kira 8000 pasang basa (Sjamsudin, 2001).
14
Faktor resiko kanker leher rahim (Anonim, 2008) : 1. Infeksi virus HPV (Human Papiloma Virus)
2. Penyakit menular seksual
3. Memulai aktifitas seksual pada usia yang sangat muda 4. Berganti-ganti pasangan seks
5. Pemakaian kontrasepsi
6. Pemakaian Dietilstilbestrol (DES) 7. Sering melahirkan
8. Penyakit yang menekan sistem imun 9. Merokok
10. Genetik
Untuk tumbuh menjadi kanker leher rahim dibutuhkan beberapa tahun sejak sel-sel leher rahim mengalami perubahan. Sel-sel leher rahim abnormal yang bukan merupakan sel kanker namun dapat berkembang menjadi kanker disebut dengan cervical intra-epithelial neoplasia (CIN). CIN juga disebut sebagai sel-sel prekanker yang jika tidak ditangani lebih lanjut akan berpotensi untuk berkembang menjadi kanker. Namun tidak semua wanita yang memiliki CIN akan menderita kanker. Keberadaan CIN identik dengan displasia (Anonim, 2008).
F. Mekanisme Anti Kanker
15
pada target molekul DNA, terbentuknya senyawa metabolit lainnya yang dapat menghambat pathways metabolisme, dan penghambatan proses proliferasi sel (Mulyadi, 1998).
Penelusuran mekanisme lainnya yang diharapkan dapat memperbaiki system sel kanker adalah menginduksi proses apoptosis. Apoptosis merupakan kematian sel yang terprogram. Apoptosis memiliki peran penting dalam menjaga keseimbangan ( homeostatis) perkembngan sel organism pada tingkat seluler. Meningkatnya apoptosis merupakan salah satu mekanisme kerja senyawa aktif yang berfungsi sebagai anti kanker (Mulyadi, 1998).
G. Sel HeLa
Kultur sel HeLa atau HeLa cell line merupakan continuous cell line yang diturunkan dari sel epitel kanker leher rahim (cervix) seorang wanita penderita kanker leher rahim bernama Henrietta Lacks yang meninggal akibat kanker pada tahun 1951. Kultur sel ini memiliki sifat semi melekatdan digunakan sebagai model sel kanker dan untuk mempelajari sinyal transduksi seluler. Sel HeLa ini cukup aman dan merupakan sel manusia yang umum digunakan untuk kepentingan kultur sel (Anonim, 2006a).
16
lipid diperlukan untuk pertumbuhan sel, dan mineral berfungsi sebagai kofaktor enzim (Freshney, 2000).
Sel HeLa adalah sel kanker leher rahim akibat infeksi Human Papillomavirus (HPV 18) sehingga mempunyai sifat yang berbeda dengan sel leher rahim normal. Sel kanker leher rahim yang diinfeksi HPV diketahui mengeekspresikan 2 onkogen, yaitu E6 dan E7. Protein E6 dan E7 terbukti dapat menyebabkan sifat imortal pada kultur primer keratinosit manusia, namun sel yang imortal ini tidak bersifat tumorigenik hingga suatu proses genetik terjadi. Jadi, viral onkogen tersebut tidak secara langsung menginduksi pembentukan tumor, tetapi menginduksi serangkaian proses yang pada akhirnya dapat menyebabkan sifat kanker (Goodwin dan DiMaio, 2000).
H. Kultur Sel
Kultur sel merupakan teknik yang biasa digunakan untuk perkembangbiakan sel yang berasal dari cell line di luar tubuh ( In Vitro ). Sedangkan kultur jaringan merupakan kultur tiga dimensi dari jaringan utuh atau sama seperti halnya in vivo (Mahardika, 2004).
17
Medium kultur yang sering dipakai dalam kultur sel myeloma atau hibridoma ialah RPMI 1640. Media ini mengandung garam-garam, asam amino, dan vitamin yang diperlukan sel untuk tumbuh. Serum juga diperlukan dalam pertumbuhan sel dan biasanya digunakan ialah Fetal Calf Serum (FCS). dan Fetal Bovine Serum (FBS) (Mahardika,2004).
18 BAB III
METODE PENELITIAN
A. Alat
Alat-alat yang digunakan dalam penelitian adalah tabung reaksi, erlemeyer, beaker glass, gelas ukur (Pyrex Iwaki Glass), botol kaca tertutup, timbangan analitik, timbangan kasar, vacum rotary evaporator (Buchi), alat destilasi, waterbath, box lampu UV, kertas label, kertas saring, Inkubator CO2 5% (Heraeus), sentrifuge (Sarvall MC 12 V), Laminar air flow BSL 2, mikropipet 20 µl, 200µl dan 1000 µl(Gilson), autoklaf (Hirayama), haemocytometer (Neubauer), Tips 100 µl dan 1000 µl, Tissue culture flask 25 cm (nunclon), tabung falcon 15 ml dan 50 ml, mikroskop inverted (Olympus CH-2), ELISA reader (SLT 240 ATC), mikroplate 96-well (Nunclon), tube sentrifuse (®Falcon), penyaring steril
berdiameter pori 0,2 μm steril (®Nalgene), tangki nitrogen cair (®Locator JR
Thermolyne), eppendorf steril 1,5 ml (plasti brand), timbangan elektrik (Sartorius), vortex, kamera digital, dan alat-alat praktikum penunjang yang lain.
B. Bahan 1. Kulit batang srikaya (Annona squamosa L.)
19 2. Sel Hela
Sel Hela didapat dari koleksi LAPTIAB, Serpong yang dirawat dan ditumbuhkan pada medium RPMI (Gibco) dengan FBS 10% (Gibco).
3. Pelarut, Reagen dan bahan kimia
Etanol 70%, Aquadest, MTT [3-(4,5-dimetiltiazol-2-il) - 2,5-difenil tetrazolium bromida] 5 mg/ml. Bahan lain yang digunakan yakni: media penumbuh RPMI (Rossewell Park Memorial Institute), PBS (Phosphate buffer Saline) pH7,4, pelarut dimetil sulfoksida (DMSO). Sodium Dodesil Sulfat (SDS) 10%, Fetal bovine serum (FBS) 10%, Natrium subkarbonat (NaHCO3) 2 g/l, HCl 0,1 N, trypan blue, dan trypsin EDTA 0,5%.
C. Prosedur Penelitian
1. Determinasi dan Pengumpulan Kulit Batang Srikaya (Annona squamosa L.)
Kulit batang srikaya diperoleh dari Balai Penelitian Tanaman Obat dan Aromatis (BALITRO). Kulit batang diambil dari batang bagian bawah tanaman sampai ke bagian cabang, dipisahkan dari batangnya kemudian dikumpulkan. Kulit batang kemudian dikeringkan dengan cara diangin-anginkan.
20
lampu bolham, selanjutnya dihaluskan hingga menjadi serbuk menggunakan mesin penggiling dan diayak sehingga didapat serbuk agak kasar.
3. Pembuatan Ekstrak Kulit Batang Srikaya (Annona squamosa L.)
Serbuk kering kulit batang srikaya dimasukkan ke dalam botol kaca tertutup rapat. Metode yang digunakan pada penelitian adalah cara ekstraksi langsung. Simplisia direndam dalam etanol 70%, kemudiaan simplisia dimaserasi selama 6 hari dan diganti pelarutnya setiap 2 hari. Setelah selesai dimaserasi lalu disaring dengan menggunakan kertas saring sampai diperoleh filtrat. Filtrat yang diperoleh ditambah aqua dest kemudian difraksinasi dengan heksan, hingga didapat fraksi heksan dan fraksi air. Fraksi air kemudian difraksinasi kembali dengan etil asetat hingga didapat fraksi etil asetat dan fraksi air. Kemudian fraksi air difraksinasi dengan butanol, hingga didapat fraksi butanol dan fraksi air. Fraksi dari butanol yang didapat dipekatkan dengan menggunakan rotary evaporator pada suhu 60ºC sampai diperoleh ekstrak butanol kental (Anonim, 2000).
4. Pemeriksaan Karakteristik Ekstrak a.Uji Organoleptis
Ekstrak diamati bau, rasa, warna. b. Perhitungan Rendemen
21
Ekstrak ditimbang secara seksama sebanyak 1 g dan dimasukkan ke dalam botol timbang dangkal bertutup yang sebelumnya telah dipanaskan pada suhu 105oC selama 30 menit dan telah ditara. Sebelum ditimbang, ekstrak diratakan dalam botol timbang, dengan menggoyangkan botol, hingga merupakan lapisan setebal 5 mm sampai 10 mm. Jika ekstrak yang diuji berupa ekstrak kental, ratakan dengan bantuan pengaduk. Kemudian dimasukkan ke dalam oven, dibuka tutupnya, dikeringkan pada suhu 105oC selama 30 menit hingga bobot tetap. Sebelum setiap pengeringan, dibiarkan botol dalam keadaan tertutup mendingin dalam eksikator hingga suhu kamar kemudian dikeringkan kembali pada suhu 105oC selama 30 menit hingga diperoleh bobot tetap (Anonim, 2000). 5. Identifikasi Kandungan Kimia
a. Minyak atsiri
Ekstrak diuapkan sampai kering, tambahkan alkohol, sebagian alkohol diuapkan dan sebagian lagi untuk identifikasi lemak. Jika berbau aromatis maka positif mengandung minyak atsiri (Tiwari, et.al., 2011).
b. Tanin
Ekstrak ditambah Feri klorida jika berubah menjadi warna biru kehijauan atau hijau tua maka dinyatakan mengandung tannin (Tiwari, et.al., 2011).
22
Ekstrak ditambahkan 5 ml asam klorida 10%, lalu ditambahkan Amonium hidroksida pekat dan disari dengan kloroform, dikocok. Lapisan kloroform yang berada dibagian bawah diambil lalu diuapkan hingga kering. Residu ditambahkan 2 ml HCl 2N, dikocok dan dibagi 3 bagian masing-masing bagian ditambahkan pereaksi yang berbeda-beda. Penambahan pereaksi Dragendorof akan memberikan endapan berwarna jingga, penambahan pereaksi Mayer akan memberikan endapan warna putih dan penambahan pereaksi Bouchardad akan memberikan endapan berwarna coklat yang semuanya menunjukan hasil positif terhadap alkaloid (Tiwari, et.al., 2011).
d. Gula pereduksi
Ekstrak ditambahkan 2 tetes larutan fehling A dan 2 tetes larutan fehling B, kemudian panaskan di atas waterbath akan terjadi endapan merah bata (Tiwari, et.al., 2011).
e. Kumarin
Ekstrak diuapkan sampai kering tambahkan air panas dan dinginkan. Setelah dingin dibagi menjadi 2 tabung, tabung 1 diberi Amonium hidroksida 10% dan tabung ke 2 sebagai pembanding. Lihat dibawah UV, jika terdapat fluoresensi kuning kehijauan berarti positif mengandung kumarin (Tiwari, et.al., 2011).
f. Emodol
23 g. Steroid
Ekstrak di uapkan sampai kering di tambahkan CH3COOH anhidrat di tambahkan CHCl3 ditambah H2SO4(p) melalui dinding tabung, steroid positif jika terdapat cincin warna hijau/ biru (Tiwari, et.al., 2011).
h. Terpenoid
Ekstrak di uapkan sampai kering di tambahkan CH3COOH anhidrat di tambahkan CHCl3 ditambah H2SO4(p) melalui dinding tabung, terpenoid positif jika terdapat cincin warna ungu-merah (Tiwari, et.al., 2011).
i . Saponin
Ekstrak dimasukkan ke dalam tabung reaksi dalam tabung reaksi. Di tambahkan 1 ml aquadest, kemudian dikocok dan didiamkan, jika terbentuk buih yang tidak menghilang selama 30 menit, maka positif mengandung saponin (Tiwari, et.al., 2011).
j. Flavonoid
Ekstrak ditambahkan HCl(p) berwarna merah, kemudian ditambahkan logam Mg, warna merah naik keatas positif mengandung flavonoid (Tiwari, et.al., 2011).
6. Pembuatan Reagen
a. Medium Kultur RPMI 1640
24
pada suhu 2°C dan dapat digunakan hingga 2 bulan (Freshney, 2000). b. Phosfat Buffer Saline (PBS)
Dinatrium hidrogen fosfat (Na2HPO4) ditimbang 2,16 g, kemudian
ditambahkan 0,20 g Kalium dihidrogen fosfat (KH2PO4), 8,00 g natrium klorida
(KCl) larutkan dalam aqua dest steril hingga 1 liter, kemudian disterilkan dengan autoklaf (Freshney, 2000).
c. Trypsin EDTA
Trypsin ditimbang 0,250 g dan ditambah larutan PBS hingga 1 liter aduk sampai larut. Setelah itu saring dengan penyaring bakteri dan simpan pada suhu -20°C (Freshney, 2000).
d. Trypan Blue 0,4%
Trypan Blue ditimbang 0,2 g kemudian ditambahkan 50 ml aqua dest aduk sampai larut (Freshney, 2000).
e. Sodium Dodesil Sulfat (SDS 1% )
SDS ditimbang 1 g tambahkan HCl 0,1 M kemudian dilarutkan dalam 100 ml aquadestilata aduk sampai larut (Freshney, 2000).
7. Penyiapan Sampel Uji dan Kontrol a) Penyiapan Sampel Uji
25
a) Konsentrasi 400 µg/ml diambil 120 µ l dari stok II dan di tambahkan 1380 µl RPMI 1640 (Konsentrasi I).
b) Konsentrasi 200 µg/ml diambil 750 µl dari KI dan di tambahkan 750 µl RPMI 1640 (Konsentrasi II).
c) Konsentrasi 100 µg/ml diambil 750 µl dari KII dan di tambahkan 750 µl RPMI 1640 (Konsentrasi III).
d) Konsentrasi 50 µg/ml diambil 750 µl dari KIII dan di tambahkan 750 µl RPMI 1640 (Konsentrasi IV).
e) Konsentrasi 25 µg/ml diambil 750 µl dari stok KIV dan di tambahkan 750 µl RPMI 1640 (Konsentrasi V).
f) Konsentrasi 12,5 µg/ml diambil 750 µl dari stok KV dan di tambahkan 750 µl RPMI 1640 (Konsentrasi VI).
b) Penyiapan Kontrol Positif
Doxorubisin yang digunakan sebagai kontrol positif, dibuat konsentrasi 10 ; 5 ; 2,5 ; 1,25 ; 0,625 ; 0,3125 µg/ml dari larutan induk yang berkonsentrasi 100 µg/ml.
8. Kultur Sel
a. Thawing Kultur Sel
26
pada suhu 37°C sampai dengan sel tumbuh dan menempel (Tim kultur BPPT, 2005).
b. Sub-Kultivasi
Sel yang telah dithawing selama 1 hari dicuci satu kali dengan 10ml PBS. Tuang cairan dalam flask setelah itu tambahkan 1,8 ml PBS dan 0,2 ml trypsin, kemudian diinkubasi selama 3 menit di inkubator CO2 5%. Setelah 3 menit lihat dibawah mikroskop untuk memastikan sel sudah tidak melekat lagi dalam dinding flask, kemudian tambahkan 1 ml medium kultur (RPMI 1640). Setelah itu keluarkan cairan dari dalam flask dan masukkan dalam tube sentrifuse kemudian disuspensikan. Setelah itu suspensi sel di sentrifuse dengan kecepatan 1500 rpm selama 5 menit.
Supernatan dituang sedangkan pellet disuspensikan dengan medium kultur (RPMI 1640) dan FBS 10% hingga 6 ml. Setelah itu suspensi sel dibagi menjadi dua bagian, kemudian masukkan ke dalam dua flask dan diinkubasi selama 2 hari pada suhu 37°C dalam inkubator CO2 5% (Tim kultur BPPT, 2005).
c. Perhitungan Kepadatan Sel
Sel Hela yang telah diinkubasi selama 2 hari dikeluarkan, kemudian diamati di bawah mikroskop jika kepadatan sel baik, maka dapat digunakan sedangkan jika tidak maka diinkubasi lagi hingga optimal. (Freshney, 2000).
27
kemudian disentrifuse dengan kecepatan 1500 rpm selama 15 menit. Supernatan dituang sedangkan pellet disuspensikan dengan menambahkan 1 ml medium kultur (RPMI 1640), (Tim kultur BPPT, 2005).
Setelah itu, sel dihitung dengan menggunakan hemacytometer, caranya ambil sebanyak 50 µl sel dan ditambahkan 450 µl RPMI 1640 kemudian masukkan campuran tersebut dalam cup. Lalu ambil 50 µl dari campuran tadi dan ditambahkan 50 µl trypan blue masukkan dalam setiap ujung bidang dari hemacytometer diletakkan di bawah mikroskop dan hitung semua sel yang terdapat dalam keempat bidang besar pada sudut-sudut seluruh permukaan yang dibagi (Tim kultur BPPT, 2005). Hitung sel yang menyinggung garis batas sebelah kiri dan atas. Sel yang menyinggung garis batas sebelah kanan dan bawah tidak dihitung. Jumlah sel yang diperoleh dari keempat bidang diambil nilai rata-ratanya, kemudian dikalikan dengan pengenceran sebesar 10 kali dan faktor koreksi dari hemacytometer 104. Jumlah sel per ml ialah rata-rata jumlah sel kali faktor pengenceran kemudian dikalikan 104.
Sel yang tidak dihitung diencerkan, caranya diambil volume yang sesuai untuk membuat konsentrasi sel sebanyak 50.000 sel/ml dengan penambahan RPMI 1640 dan FBS 10%. Banyaknya jumlah volume yang dibutuhkan untuk konsentrasi tersebut dapat dihitung dengan rumus : P1V1 = P2V2
28
9. Uji Sitotoksisitas Fraksi Butanol Kulit Batang Srikaya (Annona squamosa L.) Suspensi sel kanker serviks (HeLa) dengan kepadatan 5 x 104 sel/100 μL media didistribusikan ke dalam sumuran- sumuran pada 60-well plate dan diinkubasikan selama 24 jam. Setelah diinkubasi, ke dalam sumuran dimasukkan
100 μL larutan uji pada berbagai seri konsentrasi. Sebagai kontrol positif
ditambahkan 100 μL medium kultur, kemudian 100 μL Doksorubisin pada
berbagai seri konsentrasi ke dalam sumuran yang telah berisi 100 μL suspensi sel
kemudian diinkubasi selama 24 jam dalam inkubator dengan aliran 5% CO2 dan 95% O2. Pada akhir inkubasi, media kultur dibuang lalu ditambahkan 10 μL
larutan MTT (5 mg/mL PBS),dan medium diganti dengan 190 μL medium RPMI
1640. Kemudian sel diinkubasi selama 3-4 jam. Reaksi MTT dihentikan dengan penambahan reagen stopper SDS (100 μL) setiap sumuran. Microplate kemudian diinkubasi satu malam pada suhu kamar dan ruangan gelap. Sel yang hidup bereaksi dengan MTT membentuk warna ungu. Hasil pengujian dibaca dengan ELISA reader pada panjang gelombang 570 nm (Tim kultur BPPT, 2005).
10. Pengolahan Data
29
parametrik dengan uji Kruskal-Wallis pada tingkat kepercayaan 95%. Jika terdapat perbedaan yang signifikan dilanjutkan dengan uji Mann Whitney (Santoso,2001).
Persen sel hidup dihitung menggunakan rumus:
% Hidup = (Absorbansi sel dengan perlakuan - Absorbansi kontrol media) x 100% (Absorbansi kontrol media Sel - Absorbansi kontrol media)
30 BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A.Hasil
1. Determinasi Kulit Batang Srikaya
Determinasi kulit batang srikaya dilakukan di “Herbarium Bogoriense”, Bidang Botani Pusat Penelitian Biologi-LIPI Cibinong. Tujuan determinasi tanaman adalah untuk memastikan identitas tanaman yang diteliti agar terhindar dari kesalahan dalam pengambilan tanaman . Hasil identifikasi menunjukan bahwa kulit batang sriakya yang digunakan dalam penelitian benar merupakan Annona squamosa L. suku Annonaceae. Hasil determinasi dapat dilihat pada lampiran 1.
2. Pemeriksaan Karakteristik Ekstrak
Hasil ekstraksi simplisia Annona squamosa L. berupa ekstrak kental, berwarna coklat kehijauan, dengan bau khas aromatis. Dari hasil ekstraksi terhadap 1000 gram simplisia Annona squamosa L. kering diperoleh ekstrak kental sebeanyak 34 gram. Kemudian di dapat perhitungan hasil rendamen ekstrak sebesar 3,4 % dapat dilihat pada lampiran 2.
31
hilang termasuk dalam katagori ekstrak kering karena parameter ekstrak kering tidak melebihi dari kadar 5% (Voight, 1995).
3. Penapisan Fitokimia
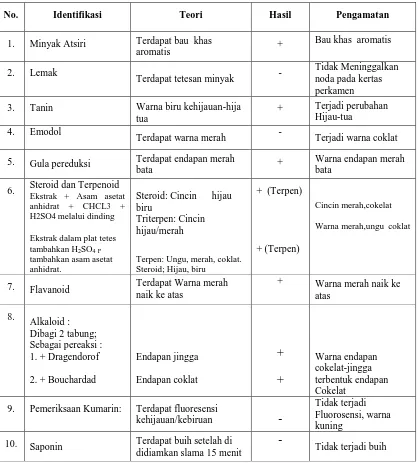
Tabel I. Hasil Penapisan Fitokimia Fraksi Butanol Kulit Batang Srikaya
No. Identifikasi Teori Hasil Pengamatan
1. Minyak Atsiri Terdapat bau khas 3. Tanin Warna biru kehijauan-hija
tua
+ Terjadi perubahan Hijau-tua
4. Emodol
Terdapat warna merah - Terjadi warna coklat 5. Gula pereduksi Terdapat endapan merah
bata +
7. Flavanoid Terdapat Warna merah naik ke atas
9. Pemeriksaan Kumarin: Terdapat fluoresensi
kehijauan/kebiruan -
Tidak terjadi Fluorosensi, warna kuning
10. Saponin Terdapat buih setelah di didiamkan slama 15 menit
-
32
Dari hasil penapisan fitokimia, diperoleh kandungan senyawa dari Annona squamosa L. terdapat kandungan minyak atsiri, tanin, terpenoid, dan flavonoid dan alkaloid.
4. Hasil Uji Sitotoksik Dengan Metode MTT Terhadap Sel HeLa
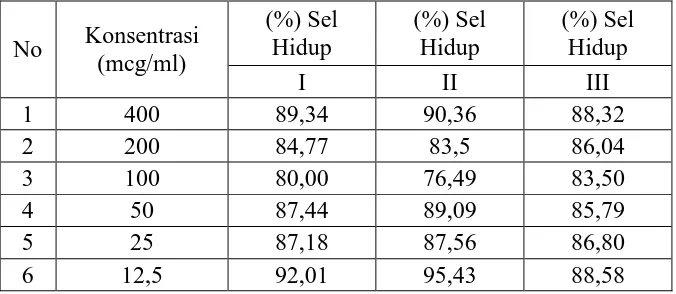
Hasil pengujian sitotoksik dengan metode MTT terhadap sel kanker serviks (sel HeLa) dengan fraksi butanol Annona squamosa L. dapat dilihat pada Tabel II berikut:
Tabel II. Persentase Sel Hidup Fraksi Butanol dari Annona squamosa L. Terhadap Sel Kanker Serviks (sel HeLa) Setelah Diinkubasi 24 jam
No Konsentrasi
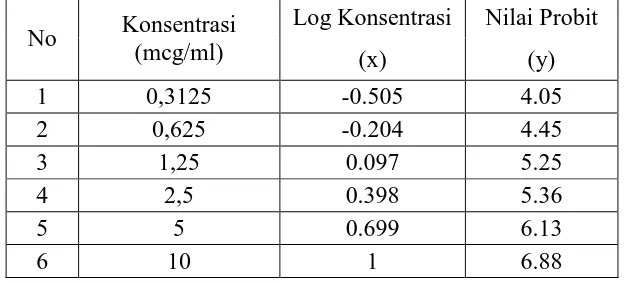
Tabel III. Analisa Probit Fraksi Butanol Annona squamosa L.
33
Berdasarkan data di atas, dilakukan perhitungan dengan analisa probit berdasarkan persamaan regresi linear antara log konsentrasi vs probit kematian sel. Persamaan regresi linier yang diperoleh dari data diatas adalah y = 0,57 x + 2,989. Dari persamaan regresi linier didapat harga LC50 sebesar 3372,87 µg/ml atau ≈ 3,37 mg/ml.
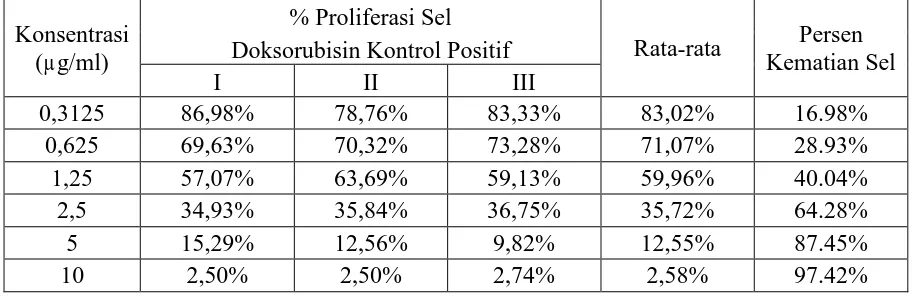
Tabel IV. Persentase Sel Hidup Dengan Penambahan Doxorubisin (Kontrol Positif) Setelah Diinkubasi 24 jam
Grafik Hubungan Log Konsentrasi Annona
squamosa vs Probit Kematian Sel
Series1
34
Tabel V. Analisa Probit ( Log Konsentrasi Doxorubisin (Kontrol Positif) vs Probit Kematian Sel)
Berdasarkan data di atas, dibuat grafik hubungan berdasarkan persamaan regresi linier antara log konsentrasi vs persentase sel hidup.
Doxorubisin dipilih sebagai kontrol positif untuk pembanding karena doxorubisin telah banyak digunakan dalam pengobatan kanker. Penggunaan kontrol positif berguna untuk mengevaluasi keberhasilan uji sitotoksisitas sebagai bukti terjadinya efek sitotoksik. Dari penelitian ini dapat dipastikan bahwa prosedur yang dilakukan dalam penelitian sudah tepat, terbukti dari hasil
y = 1,832x + 4,8999
Grafik Hubungan Log Konsentrasi Doxorubicin vs
Probit Kematian Sel
Series1
35
penelitian yang menunjukan bahwa Doxorubicin dapat menghambat proliferasi sel HeLa. Berdasarkan data di atas, dapat dibuat grafik hubungan berdasarkan persamaan regresi linier antara log konsentrasi Doxorubisin vs Persentase sel hidup. Persamaan regresi linier yang diperoleh adalah y = 1,832 x + 4,899 . Dari persamaan regresi linier tersebut diperoleh harga LC50 ≈ 1,135 µg/ml.
B. Pembahasan
36
bersifat polar, sehingga diharapkan mampu menarik sebagian besar senyawa yang terdapat dalam simplisia seperti flavonoid dan alkaloid.
Sel yang digunakan dalam penelitian ini adalah sel Hela. Pemilihan sel hela dalam penelitian ini karena merupakan salah satu jenis sel kanker yang banyak diderita di seluruh dunia. Sel ini sering digunakan dalam penelitian karena perkembangannya mudah dikontrol dan ditangani (Djajanegara dan Wahyudi, 2009). Media yang digunakan untuk mengkultur sel Hela adalah medium RPMI 1640, media ini mengandung hampir semua nutrisi yang diperlukan sel untuk hidup dan memperbanyak diri.
Kepadatan sel dihitung dengan haemocytometer karena pelaksanaanya cepat, mudah, dan tidak membutuhkan banyak alat (Freshney, 2000). Kepadatan sel yang diperlukan dalam penelitian ini sebesar 5 x 104 sel/100 μl (Gambar I). Penggunaan Tripan blue biasa digunakan untuk membedakan sel hidup dan sel mati. Sel yang mati akan berwarna biru karena sel yang mati akan rusak membran selnya sehingga warna biru tripan akan meresap ke dalam sel. Sel hidup tidak terwarnai, bulat dan relatif kecil dibandingkan dengan sel mati. Dalam beberapa hal penggunaan tripan blue dihindari karena menyebabkan lapangan pandang berwarna gelap sehingga sulit membedakan sel hidup dan sel mati. Pemaparan tripan blue yang lebih dari 15 menit juga akan mewarnai sel hidup (Anggrianti, 2008).
37
(tidak membelah, G0 ) dan secara permanen tidak membelah. Sel kanker yang sedang membelah terdapat dalam beberapa fase yaitu fase mitosis (M). Sintesis protein dan RNA berkurang secara tiba-tiba dan terjadi pembelahan menjadi dua sel. Setelah itu sel dapat memasuki interfase untuk kembali memasuki fase G1, saat sel berproliferasi atau memasuki fase istirahat (G0). Sel dalam fase G0 yang masih potensial untuk berproliferasi disebut sel klonogenik atau sel induk (stem cell). Jadi yang menambah jumlah sel kanker ialah sel yang dalam siklus proliferasi dan dalam fase G0 (Nafrialdi dan Gan, 2007). Sel perlakuan diinkubasi selama 24 jam karena dilihat dari jumlah sel yang hidup. Jumlah sel yang berkembang biak dengan berlipat ganda, menyebabkan jumlah sel meningkat secara eksponensial, berlangsung selama 24 jam, sehingga pertumbuhan sel sangat ideal dan pembelahan terjadi.
38
Sehingga jika intensitas warna ungu semakin besar, maka berarti jumlah sel hidup semakin banyak. Dan semakin banyak sel yang mati maka semakin sedikit kristal formazan yang terbentuk demikian pula sebaliknya (Anonim, 2010).
Banyaknya garam formazan yang terbentuk menggambarkan banyaknya sel yang hidup karena garam formazan terbentuk hanya oleh enzim mitokondria yang berkaitan dengan proses pernapasan sel. Sehingga sel yang mati tidak ikut terhitung karena tidak terjadi proses pernapasan (Ritmaleni, et.al., 2011). Sel Hela yang masih hidup terlihat seperti bentuk daun memanjang yang bergerombol serta melekat pada dasar sumuran. Sedangkan sel Hela yang mati akan berbentuk bulatan-bulatan tidak beraturan serta mengapung pada media. Setelah perlakuan dengan metode MTT (Gambar VI), akan terlihat kristal formazan yang menunjukkan sel Hela yang masih hidup (Ritmaleni, et.al., 2011).
Penambahan SDS 10 % sebanyak 100 µl pada setiap sumuran dimaksudkan untuk melisiskan sel sehingga MTT keluar atau sebagai reagen stopper (bersifat detergenik) yang akan melarutkan kristal berwarna ini (Anggrianti, 2008).
39
mati pada sampel media disebabkan karena proses normal, misalnya kepadatan sel yang terlalu rapat dan berkurangnya kandungan nutrisi dalam medium.
Parameter yang digunakan untuk mengevaluasi potensi sitotoksik pada senyawa yang terkandung dalam Annona squamosa L terhadap sel Hela adalah LC50 (Anonim, 2010). Hasil uji sitotoksisitas sel Hela (sel kanker servix) dengan metode MTT memperlihatkan bahwa absorbansi yang didapat pada ekstrak Annona squamosa L pada dosis 12,5, 25, 50, 100, 200, dan 400 μg/ml yang diinkubasi selama 24 jam menunjukkan hasil persentase hidup yang relatif sama pada setiap konsentrasi. Dari hasil perhitungan dengan regresi linear didapatkan harga LC50 Annona squamosa L yaitu 3372,87µg/ml atau ≈ 3,37 mg/ml, dan nilai koefisien korelasi (r) 0,899. Sebagai kontrol positif digunakan Doxorubisin dengan dosis 0.3125, 0,625, 1.25, 2.5, 5 dan 10 µg/ml menunjukkan nilai LC50
sebesar 1,135 µg/ml. Nilai LC50 Ekstrak Annona squamosa L lebih tinggi dibanding LC50 Doxorubisin menunjukkan bahwa Doxorubisin memiliki aktivitas
lebih tinggi dalam menghambat proliferasi sel Hela.
40
tunggal dibandingkan fraksi butanol Annona squamosa L. yang masih mengandung beberapa senyawa aktif selain flavonoid seperti minyak atsiri, tanin, terpenoid, dan alkaloid.
Doxorubicin merupakan senyawa antibiotik antrasiklin yang secara luas digunakan dalam kemoterapi berbagai jenis kanker. Secara umum, doxorubicin berinteraksi dengan berinterkalasi (menyisip) dalam DNA dan menghambat biosintesis makromolekul. (Smith et al., 2000).
Berbagai penelitian mengenai mekanisme kerja doxorubicin telah dilakukan. Antibiotik antrasiklin seperti doxorubicin memiliki mekanisme aksi sitotoksik melalui empat mekanisme yaitu penghambatan topoisomerase II, interkalasi DNA sehingga mengakibatkan penghambatan replikasi DNA dan RNA, pengikatan membran sel yang menyebabkan aliran dan transport ion, dan pembentukan radikal bebas semiquinon dan radikal bebas oksigen melalui proses yang tergantung besi dan proses reduktif yang diperantarai enzim (Bruton et al., 2005).
41
membran ke sel inti. Keempat, dengan menghambat aktivitas reseptor tirosin kinase. Karena aktivitas reseptor tirosin kinase yang meningkat berperan dalam pertumbuhan keganasan. Kelima, flavonoid berfungsi juga untuk mengurangi resistensi tumor terhadap agen kemoterapi (Demeule M et al, 2002).
Kekurang efektifan sampel uji dalam penelitian ini dapat disebabkan oleh beberapa faktor antara lain rendahnya senyawa-senyawa dalam ekstrak fraksi butanol kulit batang srikaya yang memiliki aktifitas antikanker termasuk senyawa flavonoid. Kemampuan sitotoksisitas yang tidak poten pada sel Hela dapat juga disebabkan oleh kandungan zat aktif di dalam kulit batang srikaya yang spesifik terhadap sel kanker tertentu, seperti pada hasil penelitian terhadap sel T47D yang mendapatkan nilai LC50 sebesar 70,77 µg/ml.
Efektivitas yang kurang poten dari fraksi butanol kulit batang srikaya juga diduga disebabkan oleh distribusi senyawa aktif yang kurang optimal pada kulit batang dibandingkan pada daun. Ditunjukkan oleh hasil uji sitotoksik ekstrak etanol daun srikaya dengan nilai LC50 sebesar 7,6948 µg/ml serta pada fraksi semi polar seperti kloroform dengan nilai LC50 4,5467 µg/ml (Djajanegara dan Wahyudi, 2009).
42 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Dari hasil evaluasi aktifitas sitotoksik fraksi butanol Annona squamosa L. Terhadap sel Hela ini menunjukkan presentase sel hidup yang cukup tinggi. Dari hasil perhitungan didapatkan nilai LC50 Annona squamosa L. yaitu ≈ 3372,87 μg/ml. Hasil ini menunjukkan bahwa fraksi butanol kulit batang srikaya ( Annona squamosa L.) kurang memiliki potensi sebagai anti kanker.
2. Nilai LC50 fraksi butanol Annona squamosa L. lebih besar dibandingkan dengan nilai LC50 ekstrak etanol daun srikaya dengan nilai LC50 sebesar 7,6948 µg/ml serta pada fraksi semi polar kloroform dengan nilai LC50 4,5467 µg/ml. Perbedaan nilai LC50 yang cukup jauh ini diduga karena distribusi senyawa aktif lebih banyak tersebar di daun.
B. Saran
1. Perlu dilakukan isolasi senyawa aktif dari tanaman srikaya (Annona squamosa L.) pada pengujian aktivitas sitotoksik sel kanker.
43
DAFTAR PUSTAKA
Abidin, Taufik.2007. Jurnal Patologi Anatomi kanker.http //www.scribd.com images.pixopix.multiplycontent.com. Diakses tgl 29 May 2012 pukul 14 : 30.
Andrijono, 2004, Sinopsis Kanker Ginekologi,divisi Onkologi, Departemen obstetri dan Ginakologi Fakultas kedokteran Universitas Indonesia. Jakarta.
Anggrianti, P., 2008. Uji Sitotoksik Ekstrak Etanol 70% Buah Kemukus (Piper cubeba L.) Terhadap Sel HeLa. Skripsi. Fakultas Farmasi Univesrsitas Muhammadiyah Surakarta. Surakarta.
Anonim,1995. Farmakope Indonesia Edisi IV. Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim,2000. Parameter Standart Umum Ekstrak Tumbuhan Obat, Direktorat jendral Pengawasan Obat dan makanan, Departemen Kesehatan RI, Jakarta,10-11.
Anonim, 2006a, Sel HeLa, http://www.ccrc.farmasi.ugm.ac.id.page id=1239Sel HeLa CCRC Farmasi UGM, http://www.ccrc.farmasi.ugm.ac.id (diakses pada tanggal 29 Mei 2012).
Anonim,2006b,Srikaya(AnnonasquamosaL.),http://www.ccrc.farmasi.ugm .ac.id page_id=228 CCRC Farmasi UGM, (diakses pada tanggal 29 Mei 2012).
Anonim,2007,Kanker:Pertumbuhan,TerapidanNanomedis,http://www.nan o.lipi.go.id/utama.cgi?artikel&1187593839, diakses 29 Mei 2012.
Anonim,2008,KankerLeherRahim(Serviks),http://www.ccrc.farmasi.ugm.a c.id/?page_id = 893, (diakses pada tanggal 29 Mei 2012)
Anonim,2009,EnsiklopediaKanker,http://www.ccrc.farmasi.ugm.ac.id/?pa ge_id=14 CCRC Farmasi UGM, (diakses pada tanggal 29 Mei 2012).
Anonim,2010. SOP Uji Sitotoksik Metode MTT. Cancer Chemoprevention Research Centre. Fakultas Farmasi Universitas Gajah Mada.
44
Aulia, Rizqa. 2012. Evaluasi Estrogenik Ekstrak Ethanol 80% Kulit Batang Pakettu (Ficus Superba Miq) Terhadap Sel T47D.
Bruton L., Lazo JS, Parker KL.2005. Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 11th Edition, McGrawHill, Lange.
Buhler, Miranda C. 2009 . Antioxidant activities of Flavonoids [online] . 2000 Nov [cited 2009 Oct 27] . Available from: http://lpi.oregonstate.edu/fwoo/ flavonoid.html
Demeule M et al.2002. Grean tea catechin as novel antitumor and antiangiogenic compounds. Curr. Med. Chem-Anti-Cancer Agent, p. 2:441-63.
Djajanegara, I., Prio Wahyudi., 2009. Pemakaian Sel HeLa dalam Uji Sitotoksisitas Fraksi Kloroform dan Etanol Ekstrak Daun Annona Squamosa . Jurnal Ilmu Kefarmasian Indonesia, April 2009, hal 7-11. Jakarta
Ebada, S.E., Edrada, R.U., Lin, W., and Proksch, P. 2008. Methods for isolation, purification and structural elucidation of bioa ctive secondary metabolites from marine invertebrates. Nature Protocols. 3(12): 1820–1831.
Freshney, R.I.,2000, Culture Of Animal Cells: A manual of basic Technique, Wiley-Liss Inc. New York.
Gale, D. Cahrette. Rencana Asuhan Keperawatan Onkologi, Jakarta : Penerbit Buku Kedokteran EGC.
Goodwin,E.C.,Di Maiao,D.,2000, Repression of human Papillomavirus Oncogenes in Hela Cervical Carcinoma Cells Causes The Orderly Reactivation of dormant Tumor suppressor Pathways,Biochemistry, Vol 97,No.23
Hanif, Cita. 2012. Uji Sitotoksik Fraksi Semi Polar Ekstrak Kulit Batang Srikaya Terhadap Sel T47D,Skripsi, Fakultas farmasi Universitas Muhammadiyah,Surakarta.
Heyne K, 1987. Tumbuhan Berguna Indonesia Jilid II, Badan Penelitian dan Pengembangan Kehutanan Republik Indonesia, Jakarta, Hal; 840-842
Kamuhabwa, A., Nshimo, C. & de Witte, P.2000.“Cytotoxicity of Some
Medicinal Plant Extracts Used in Tanzanian Tradisional Medicine”.J. Ethnopharmacol.70: 143-149
45
Muflihah, C.H., 2012, Uji sitotoksik Fraksi Semipolar Ekstrak Etanol Kulit Batang Srikaya (Annona squamosa L.) Terhadap Sel T47D.Skripsi, Fakultas Farmasi Universitas Muhammadyah Surakarta, Surakarta.
Mori, H., Niwa, K., Zheng, Q., Yamada, Y., Sakata, K. & Yoshimi, N. 2001. Cell proliferation in cancer prevention: effects of preventive agents on estrogen-related endometrial carcinogenesis model and on an in vitro model in human colorectal cells. Mut. Res. 480-481: 201-201
Nafrialdi dan Gan, Sulistia, 2007. Anti kanker, Farmakologi & Terapi, ed.V, Balai penerbit FKUI, Jakarta.735-736.
Ogata S, Miyake Y, Yamamoto K, Okumura K, Taguchi H. Apoptosis induced by the flavonoid from lemon fruit (citrus limon BURM. F.) and its metabolites in HL-60 cells. Biosci Biotechnol [serial online] 2000 May [cited 2009 Nov 21]; 64 (5):1075-8. Available from: http://www.ncbi.nlm
Pardhasaradhi, B V V., Madhurima, Reddy., Ali, A Mubarak., Kumari, A Leela., & Khar, Ashok., 2004, Antitumour activity of Annona squamosa seed extracts is through the generation of free radicals and induction of apoptosis, Indian Journal of Biochemistry & Biophysics, Vol. 41, 167-172.
Pisutthanan, S., Plianbangchang, P., Pisutthanan, N., Ruanruay, S., & Muanrit, O., 2004, Brine Shrimp Lethality Activity of Thai Medicinal Plants in the Family Meliaceae, Naresuan University Journal 2004, 12(2), 13-18.
Puji, et al., 2011. Uji Sitotoksisitas Dan Efek Ekstrak Spons Laut Aaptos suberitoides Terhadap Sel Kanker Serviks (HeLa) Secara In Vitro.
Ritmaleni, et al., 2011. Sintesis dan uji sitotoksisitas senyawa LR-2 pada sel kanker payudara T47D. Majalah Farmasi Indonesia, 22(1), 21 – 32.
Santoso S., 2001. SPSS : Mengolah Data Statistik Secara Profesional, ed. IV, PT. Elex Media Kompetindo,Jakarta.
Sjahid, Landyyun Rahmawan. 2018. Isolasi Dan Identifikasi Flavonoid Dari Daun Dewandaru (Eugenia uniflora L.),Skripsi, Fakultas farmasi Universitas Muhammadiyah, Surakarta.
Sjamsuddin, S., 2001, Pencegahan dan Deteksi Dini Kanker Serviks, Cermin Dunia Kedokteran, 133: 8-13
46
Soehartati, dkk., 2010, Pedoman Tatalaksana Kanker, Badan Penerbit FakultasKedokteran Universitas Indonesia, Jakarta.
Soedarso, 2012. Srikaya Buah Unik Pelindung Serangan Jantung. Stomata:Surabaya.
Sudarsono. Tumbuhan Obat II. Yohyakarta : Pusat Studi Obat Tradisional Universitas Gajah Mada ; 2002 Hal 9-12.
Syamsuhidayat, Sri Sugati, and Johnny Ria Hutapea, 1991, Inventaris Tanaman Obat Indonesia (I), Departemen Kesehatan RI, Jakarta.
Tim Kultur Sel BPPT. SOP Kultur Sel. Jakarta : 2005
Tiwari,P., Kumar, B., Kaur,M., Kaur,G., Kaur, H., 2011.Phytochemical screening and Extraction.Internationale Pharmacutica Sciecia.Jan-March 2011 Vol. 1. Issue.
Vizcaino F et al. The flavonoid quercetininduced apotosis and inhibits JNK activation in intimal vascular smooth muscle cells. Biochemical and Biophysical Research communications [serial online] 2006 June [cited 2009 Nov 21]; 346 (3):919-25. Available from: http://www.sciencedirect.com
Voight, R., 1995, Buku Pelajaran Teknologi Farmasi, Edisi ke-5, UGM press, Jogjakatra. 559-565.
47
DAFTAR GAMBAR
Gambar I. Tanaman Srikaya ( Annona squamosa L.)
48
Gambar III. Rotary evaporator
49
(A)
(a) (b)
(c) (d)
(e) (f)
Gambar V. Morfologi sel Hela Sel tanpa perlakuan(A), Sel dengan perlakuan
setelah diinkunbasi selama 24 jam (pada gambar a, b, c,d,e,f dengan konsentrasi
50
(a) (b)
Gambar VI. Morfologi sel Hela sebelum dengan metode MTT(a) dan sesudah dengan metode MTT(b).
(a) (b)
51
Gambar VIII. Inkubator CO2 5%
52
53
Gambar XI. Tangki nitrogen cair
54
Gambar XIII. Haemocytometer
55
Gambar XV. Sentrifuse
56 LAMPIRAN
57
Lampiran 2. Perhitungan Rendemen Fraksi Butanol Annona squamosa L.
Serbuk kulit batang srikaya = 1000 gram
Lampiran 3. Hasil Susut Pengeringan Fraksi Butanol Annona squamosa L. Rumus = Bobot sebelum dikeringkan – bobot setelah dikeringkan X 100% Bobot sebelum dikeringkan
Dari hasil percobaan didapat hasil sebagai berikut :
Tabel I. Tabel Perhitungan Susut Pengeringan
58
Lampiran 4. Skema Kerja Ekstraksi Kulit Batang Annona squamosa L.
Di
maserasi 3x dengan pelarut etanol 70%
Dikentalkan dengan rotary evaporator
Kulit batang srikaya 1 kg serbuk kering kulit batang srikaya
Sari Fraksi Etil Asetat Fraksi air
59 Lampiran 5. Perhitungan Kepadatan Sel
Jumlah sel yang terdapat di keempat bidang besar sebanyak 256 sel. Tiap satu bidang besar pada hemasitometer memiliki volume 10-4 ml, sehingga
Jumlah sel / ml = rata-rata jumlah sel x 104 x faktor pengenceran x 2 = 64 x 104 x 10 x 2
= 128 x 105 sel / ml
Untuk mengisi plate well 96 dengan tiap sumur 100 µl suspensi sel dengan kepadatan 5x 104 sel / ml, maka dibuat suspensi sel dengan rumus:
P1 x V1 = P2 x V2
128x 105 x V1 = 5x 104 sel/ml x 100 V1 = 0,38 µl
60
Lampiran 6. Data Absorbansi Fraksi Butanol Annona squamosa L.
Data Absorbansi Fraksi Butanol Annona squamosa Terhadap Sel Kanker HeLa Setelah Diinkubasi 24 jam.
No. Konsentrasi ( mcg/ml)
Absorbansi
I II III
1 400 0,419 0,411 0,39
2 200 0,402 0,392 0,374
3 100 0,392 0,362 0,451
4 50 0,414 0,401 0,385
5 25 0,405 0,408 0,384
6 12,5 0,412 0,439 0,371
Data Absorbansi Kontrol Media dan Kontrol Sel pada Sampel Absorbansi Kontrol Media
Rata-rata
Absorbansi Kontrol Sel Rata-rata
I II III I II III
61
Lampiran 7. Data Absorbansi Doxorubicin (Kontrol Positif)
Data absorbansi Doxorubicin (Kontrol Positif) Terhadap Sel Kanker Servix (Sel Hela) Setelah Diinkubasi 24 jam.
No. Konsentrasi (µg/ml)
Doxorubisin (kontrol +)
I II III
1 10 0,073 0,073 0,074
2 5 0,129 0,117 0,105
3 2,5 0,215 0,219 0,223
4 1,25 0,312 0,341 0,321
5 0,625 0,367 0,37 0,383
6 0,3125 0,443 0,407 0,427
Data Absorbansi Kontrol Media dan Kontrol Sel pada Doxorubisin. Absorbansi Kontrol media
pada Doxorubisin Rata-rata
Absorbansi Kontrol sel Rata-rata
I II III I II III
62 Lampiran 8. Tabel Probit
63
64 Pengenceran menjadi 100 μg/ml : V1. N1 = V2. N2
66 2,5
= 750 μl k3+ 750 μl m.k (K4)
5. Konsentrasi 0,625 μg/ml V1 = V2. N2 N1
= 0,625. 1,5 1,25
= 750 μl k4 + 750 μl m.k (K5)
6. Konsentrasi 0,325 μg/ml V1 = V2. N2 N1
= 0,325. 1,5 0,625
67
Lampiran 10. Perhitungan Persentase Sel Hidup (%) Terhadap Konsentrasi Sampel Uji
%SelHidup=(Absorbansi sel dengan perlakuan–Absorbansi kontrol media)x100% (Absorbansi kontrol media Sel - Absorbansi kontrol media)
A. Konsentrasi 12,5 μg/ml
Diketahui : Absorbansi kontrol media = 0,063 Absorbansi kontrol sel = 0,457 Absorbansi larutan sampel uji I = 0,412 Absorbansi larutan sampel uji II = 0,439
Persentase sel hidup(%) I = 0,412 - 0,063 x 100% 0,457 - 0,063
= 88,58 %
Persentase sel hidup (%) II = 0,439 - 0,063 x 100% 0,457 – 0,063
= 95,43%
Rata-rata persentase sel hidup (%) = 88,58% + 95,43%
2
= 92,01% B. Konsentrasi 25 μg/ml
68
Diketahui : Absorbansi kontrol media = 0,063 Absorbansi kontrol sel = 0,457
69
Absorbansi kontrol sel = 0,457 Absorbansi larutan sampel uji I = 0,392 Absorbansi larutan sampel uji II = 0,362 Persentase sel hidup(%) I = 0,392 - 0,063 x 100%
0,457 – 0,063 = 83,50%
Persentase sel hidup (%) II = 0,362- 0,063x 100% 0,457 – 0,063 = 76,49%
Rata-rata persentase sel hidup (%) = 83,50% + 76,49% 2 = 80,00%
E. Konsentrasi 200 μg/ml
Diketahui : Absorbansi kontrol media = 0,063 Absorbansi kontrol sel = 0,457 Absorbansi larutan sampel uji = 0,402 Absorbansi larutan sampel uji II = 0,392 Persentase sel hidup(%) I = 0,402 - 0,063 x 100%
0,457 – 0,063 = 86,04%
Persentase sel hidup (%) II = 0,392 - 0,063 x 100% 0,457 – 0,063