XIV 1 BAB XIV
DASAR BIOMOLEKULAR
Sasaran pembelajaran dari bab ini adalah mahasiswa mampu:
1. Mengetahui karakteristik beberapa senyawa biomolekul: asam amino dan protein, karbohidrat, lipida dan asam nukleat.
2. Mengetahui sifat kimia dan reaksi dari kelompok senyawa pada no 1 Pendahuluan
Biomolekular dimaksudkan adalah molekul molekul utama yang menunjang berlangsungnya kehidupan, baik sebagai pembentuk struktur sel, sumber energi, pengendalian metabolisme hormonal dan transformasi genetik. Sangat banyak molekul molekul organik yang berperan dalam kelangsungan kehidupan, namun tidak dikemukakan disini. Sebagai pengetahuan dasar maka secara singkat akan dikemukakan beberapa sifat kimia dari senyawa biomolular utama, seperti protein, karbohidrat, lipida dan asam nukleat. Kajian yang lebih mendalam mengenai biomolekular tersebut dapat dipelajari pada buku buku kimia organik dan biokimia. 14.1. Asam amino dan Protein
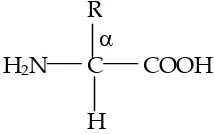
Asam amino adalah senyawa organik yang merupakan monomer (satuan pembentuk) protein. Asam amino mempunyai dua gugus fungsi yaitu gugus amino dan gugus karboksil yang terikat pada atom karbon yang sama. Atom karbon yang mengikat gugus amino adalah atom karbon α terhadap karboksil, karenanya dapat disebut asam α amino karboksilat. Rumus umum asam amino ditunjukkan sebagai berikut.
R α
H2N C COOH
H
Gambar 14.1 Asam α – amino karboksilat
Protein adalah salah satu makrobiomolekular yang berfungsi sebagai pembentuk struktur sel dari pada mahluk hidup termasuk manusia. Protein adalah polimer dari asam asam amino yang tersambung melalui ikatan peptida, oleh karenanya dapat juga disebut sebagai polipeptida. Hal yang menarik bahwa protein pada semua bentuk kehidupan (organisme) mengandung hanya 20 jenis asam amino, namun interkoneksinya menghasilkan ragam mahluk hidup yang tak terhingga banyaknya. Rumus dan nama 20 jenis asam asam amino pembentuk protein diberikan pada bagian berikutnya.
14.1.1 Tatanama Asam Amino
XIV 2
Nama biasa Nama sistematika Rumus struktur
Alanin (Ala) As. 2 amino propanoat
Valin (val) As. 2 amino 3 metil butanoat
Leusin (Leu) As.2 amino 4 metil Pentanoat
Isoleusin (Ile) As.2 amino 4 metil pentanoat
Prolin (Pro) As.Furano metanoat
Fenilalanin(fen) As. 2 amino 3 fenilpropanoat
Triptofan(Trip) As. 2 amino 3 (3 idolil) propanoat
Metionin(Met) As. 2 amino 4 (metil tio) butanoat
Glisin(Gli) As. 2 amino etanoat
Serin(Ser) As. 2 amino 3 hidroksi propanoat
Treonin(Tre) As. 2 amino 3 hidroksi butanoat
Sistein(Sis) As. 2 amino 3 merkapto propanoat
Tirosin(Tir) As.2 amino 3 (p hidroksi fenil) Propanoat
Aspargin(Asn) As.2 amino suksinat
Glutamin(Gln) As.2 amino glutaramat As.Aspartat As.2 amino suksinamat
XIV 3 (Asp)
As. Glutamat As.2 Glutarat (Glu)
Liain(Lis) As.2,6 diamino heksanoat
Arginin(Arg) As.2 amino 5 guanido valerat
Histidin(His) As. 2 amino 3 imidazol propanoat
Ganbar 14.2 Beberapa asam amino penyusun protein 14.1.2. Klasifikasi Asam Amino
Asam amino tersebut di atas dapat diklasifikasi menjadi 4 golongan berdasarkan relatif gugus R nya (R = gugus yang terikat pada atom C α pada asam amino).
a. Asam amino dengan gugus R non polar (tak mengutub)
Asam amino dengan gugus R non polar, adalah gugus yang mempunyai sedikit atau tidak mempunyai selisih muatan dari daerah yang satu ke daerah yang lain. Golongan ini terdiri dari lima asam amino yang mengandung gugus alifatik (alanin, leusin, isoleusin, valin dan prolin) dua dengan R aromatik (fenil alanin dan triptopan) dan satu mengandung atom sulfur (metionin). Pada umumnya golongan asam amino ini bersifat kurang atau tidak larut dalam air.
b. Asam amino dengan gugus R mengutub tak bermuatan
Golongan ini lebih mudah larut dalam air dari pada golongan yang tak mengutub, karena gugus R mengutup dapat membentuk ikatan hidrogen dengan molekul air. Termasuk golongan ini adalah serin, treonin dan tirosin yang kekutubannya disebabkan oleh adanya gugus hidroksil ( OH). Asparagin dan glutamin yang kekutubannya disebabkan oleh gugus amida ( CONH2) serta sistein
oleh gugus sulfidril ( SH).
Asparagin dan glutamin, masing masing merupakan bentuk senyawa amida dari asam aspartat dan asam glutamat dan mudah terhidrolisis oleh asam atau basa. Sistein yang mengandung gugus tiol dan tirosin yang mengandung gugus hidroksil fenol bersifat paling mengutub dalam golongan asam amino ini.
c. Asam amino dengan gugus R bermuatan negatif (Asam amino asam)
Golongan asam amino ini bermuatan negatif pada pH 6.0 7.0 dan terdiri dari asam aspartat dan asam glutamat yang masing masing mempunyai dua gugus karboksil ( COOH).
HO C – CH2 CH2 CH COOH O NH2
CH2(CH2) 3 CH COOH NH3 NH2
HN (CH2) 3 CH COOH H2N C=NH2 NH2
XIV 4
d. Asam amino dengan gugus R bermuatan positif (Asam amino basa)
Golongan asam amino ini bermuatan positif pada pH 7.0, terdiri dari lisin, histidin dan arginin.
14.1.3 Stereo Kimia Asam Amino
Semua asam amino yang didapat dari hasil hidrolisa protein, kecuali glisin, mempunyai sifat aktif optik yaitu dapat memutar bidang polarisasi cahaya bila diperiksa dengan polarimeter. Sifat optik aktif disebabkan oleh atom karbon yang asimetris, yaitu atom karbon yang mengikat empat gugus yang berlainan. Jumlah bentuk stereo isomer yang mungkin terjadai sama dengan 2n dimana n adalah jumlah atom karbon yang asimetris. Semua asam amino yang umum terdapat dalam protein kecuali glisin, mempunyai satu atom karbon asimetris, sedangkan tronina dan isoleusin masing masing mempunyai dua atom asimetris.
Glisin Alanin Isoleusin
Gambar 14.3 Asam amino glisin (tidak punya atom C assimetri) Asam amino Alanin, satu atom asimetri C Isoleusin dengan dua atom karbon asimetri C 14.1.4 Reaksi Asam Amino dan Pembentukan Protein
Gugus karboksil dan gugus amino asam amino memperlihatkan semua reaksi yang dapat diharapkan dari fungsi fungsi ini, misalnya pembentukan garam, pengesteran dan asilasi. Di samping itu gugus yang terdapat pada rantai samping (R) juga dapat memberikan reaksi khas asam amino. Beberapa reaksi asam amino yang umu digunakan anatara lain reaksi Ninhidrin, reaksi Sanger, reaksi Edman. Reaksi reaksi tersebut sangat berguna dalam analisis asam amino. Pengetahuan tentang hal itu dapat dibaca pada buku kimia organik dan biokimia.
Reaksi asam amino yang sangat penting adalah reaksi kondensasi antara asam asam amino membentuk protein. Interaksi asam asam amino membentuk protein melalui ikatan kovalen peptida, dalam hubungan ini maka protein disebut juga polipeptida. Ikatan peptida adalah ikatan antara gugus karboksil dari satu asam amino dengan gugus amino dari asam amino yang lain.
Bila gugus amino dan gugus hidroksil asam amino bergabung membentuk ikatan peptida, unsur asam aminonya dinamakan residu asam amino. Suatu peptida yang terdiri dari 2 residu asam amino disebut dipeptida, tiga residu asam amino tripeptida dan seterusnya. Bila peptida mengandung banyak (katakan lebih dari 10) residu asam amino, peptida itu dinamakan polipeptida, banyak hormon atau semua protein sederhana adalah polipeptida.
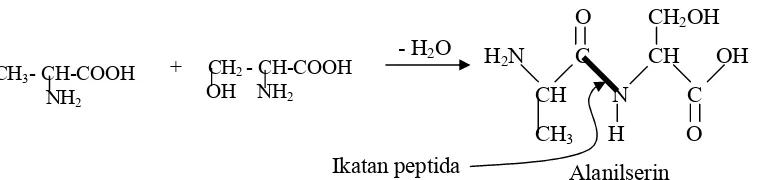
Jika protein protein hanya terhidrolisa sebahagian, maka polimer polimer yang lebih kecil yang terbentuk dari asam asam amino disebut peptida. Sebagai contoh salah satu hasil hidrolisis sebahagian dari sutra adalah glisil glisin, merupakan suatu bentuk amida dari dua asam amino glisin. Di bawah ini situnjukkan suatu dipeptida alanilserin yang terbentuk dari asam amino alanin dengan serin melalui ikatan peptida yang ditunjukkan dengan garis yang lebih tebal.
H CH COOH NH2
H CH3 C COOH NH2
*
CH3CH2CH CH COOH*
CH3 NH2*
*
*
XIV 5
Gambar 14.4 Suatu dipeptida alanilserin, terbentuk dari alanin dan serin Menurut perjanjian, struktur peptida selalu ditulis dengan residu asam amino N ujung (residu dengan gugus αamino bebas) di sebelah kiri dan dengan residu C ujung (residu dengan gugus αkarboksil bebas) di sebelah kanan. Perhatikan bahwa peptida ini mempunyai satu gugus αamino bebas dan satu gugus αkarboksil bebas, sehingga dengan demikian nama dari suatu peptida diambil dari suatu gabungan nama atau singkatan nama asam asam amino pembentuknya, yang dimulai dengan asam amino N ujung dan diakhiri dengan asam amino C ujung. Sebagai contoh (Gambar 14.4), suatu dipeptida yang terdiri dari alanin, serin diberi nama Alanilserin atau nama singkatnya adalah Ala ser.
Kalau makin panjang suatu rantai peptida, maka jumlah isomer isomer mungkin akan bertambah banyak pula. Oleh karena itu kurang lebih 8000 tripeptida yang mungkin terbentuk secara teori dari 20 macam asam amino.
Sejumlah peptida kecil ditemukan di dalam beberapa antibiotik seperti basitrisin yang merupakan suatu peptida dan terdapat pada semua sel hewan dan tumbuhan. Jenis peptida lain yang mempunyai arti yang khusus yaitu hormon oksitoksin dan vasopressin
14.2. Karbohidrat
Karbohidrat merupakan salah satu senyawa organik biomakromolekul alam yang banyak ditemukan dalam mahluk hidup terutama tanaman. Pada tanaman yang berklorofil, karbohidrat dibentuk melalui reaksi antara karbon dioksida dan molekul air dengan bantuan sinar matahari, disebut fotosintesis.
sinar
n CO2 + n H2O (CH2O)n + n O2
matahari
Pati adalah bentuk utama penyimpanan karbohidrat yang digunakan untuk sumber makanan atau energi, sedangkan sellulosa adalah komponen utama karbohidrat pada tanaman. Glukosa adalah karbohidrat sederhana yang paling banyak diperlukan dalam tubuh manusia. Dua macam karbohidrat, yaitu D ribosa dan 2 deoksiribosa adalah merupakan penyusun kerangka inti molekul genetik DNA dan RNA. Karbohidrat juga merupakan bagian penting dalam koenzim, antibiotika, tulang rawan, kulit kerang dan dinding sel bakteri.
CH3 CH COOH NH2
+ CH2 CH COOH OH NH2
O CH2OH
H2N C CH OH
CH N C CH3 H O
Alanilserin H2O
XIV 6 14.2.1 Penggolongan Karbohidrat
Karbohidrat merupakan persenyawaan antara karbon, hidrogen dan oksigen yang terbentuk di alam dengan rumus umum Cn(H2O)n. Melihat rumus empiris
tersebut, maka senyawa ini dapat diduga sebagai "hidrat dari karbon", sehingga disebut karbohidrat. Sejak tahun 1880 telah disadari bahwa gagasan "hidrat dari karbon" merupakan gagasan yang tidak tepat, karena ternyata ada beberapa senyawa yang mempunyai rumus empiris seperti itu, tetapi bukan karbohidrat. Misalnya asam asetat dapat ditulis sebagai C2(H2O)2 dan formaldehid dengan rumus CH2O, nyatanya
keduanya bukan karbohidrat. Dengan demikian suatu senyawa termasuk karbohidrat tidak hanya ditinjau dari rumus empirisnya saja, tetapi yang paling penting ialah rumus strukturnya.
Dari rumus struktur akan terlihat bahwa ada gugus fungsi penting yang terdapat pada molekul karbohidrat yaitu gugus fungsi karbonil (aldehid dan keton). Gugus gugus fungsi itulah yang menentukan sifat senyawa tersebut. Berdasarkan gugus yang ada pada molekul karbohidrat, maka senyawa tersebut dapat didefinisikan sebagai polihidroksialdehida dan polihidroksiketon.
Berdasarkan jumlah monomer pembentuk suatu karbohidrat maka dapat dibagi atas tiga golongan besar yaitu : monosakarida, oligosakarida dan polisakarida. Istilah sakarida berasal dari bahasa latin (saccharum = gula) dan mengacu pada rasa manis senyawa karbohidrat sederhana. Hasil hidrolisis ketiga kelas utama karbohidrat tersebut saling berkaitan :
H2O H2O
Polisakarida Oligosakarida monosakarida H+ H+
14.2.2 Monosakarida
Monosakarida adalah karbohidrat yang tak dapat dihidrolisis menjadi senyawa yang lebih sederhana. Jika didasarkan pada gugus fungsinya, maka monosakarida secara keseluruhan dibagi atas dua golongan besar, yaitu aldosa jika mengandung gugus aldehid dan ketosa jika mengandung gugus keton.
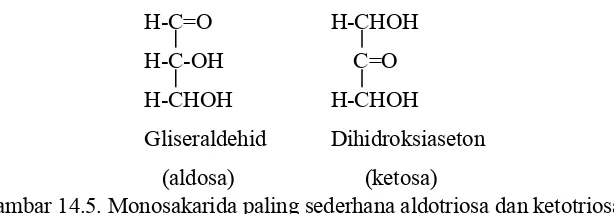
Gambar 14.5. Monosakarida paling sederhana aldotriosa dan ketotriosa
Gliseraldehid adalah aldosa yang paling sederhana dan dihidroksiaseton adalah ketosa yang paling sederhana pula. Aldosa atau ketosa lainnya dapat diturunkan dari gliseraldehida atau dihidroksiaseton dengan cara menambahkan atom karbon, masing masing membawa gugus hidroksil.
H C=O H C OH H CHOH Gliseraldehid (aldosa)
H CHOH C=O H CHOH
XIV 7
Aldosa Ketosa
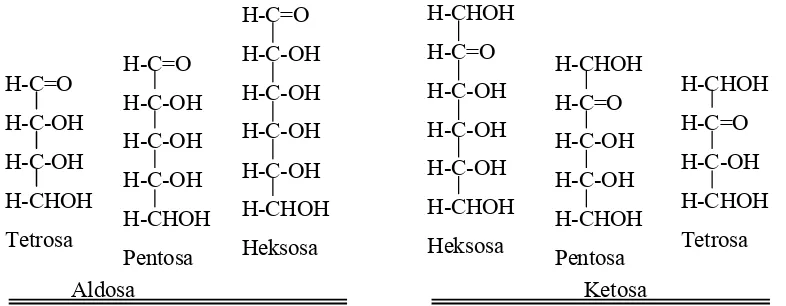
Gambar 14.6. Kelompok aldosa turunan dari gliseraldehid dan ketosa dihidroksiaseton Konfigurasi gliseraldehida dinyatakan sebagai D apabila gugus hidroksil pada atom karbon kiral terletak di sebelah kanan, dan L jika gugus hidroksil di sebelah kiri rumus proyeksi Fischer. Sistem ini juga berlaku untuk monosakarida lain dengan cara berikut. Jika atom karbon kiral yang terjauh dari gugus aldehida atau keton mempunyai konfigurasi seperti D gliseraldehida (hidroksil di sebelah kanan), maka senyawa itu adalah D monosakarida. Jika konfigurasi pada atom karbon terjauh mempunyai konfigurasi yang sama dengan L gliseraldehida (hidroksil di sebelah kiri), maka senyawa itu adalah L monosakarida.
14.7. D aldosa (OH) pada C*seblah kanan L aldosa (OH) pada C* seblah kiri 14.2.3. Cincin Piranosa dan Puranosa
Suatu monosakarida dalam bentuk hemiasetal cincin segi lima disebut furanosa. Furan berarti senyawa heterosiklik oksigen bercincin lima. Demikian pula piranosa berasal dari kata piran yang berarti senyawa heterosiklik oksigen bercincin segi enam.
Gambar 14.8 Heteroklik oksigen, piran cincin segi enam dan furan cincin segi lima Istilah piranosa dan furanosa seringkali digabung dengan nama monosakaridanya, misalnya, D glukopiranosa untuk cincin segi enam dari D glukosa, atau D fruktofuranosauntuk cincin segi lima dari fruktosa.
XIV 8 14.2.4 Rumus Haworth dan Rumus Konformasi
Dalam larutan air, hanya sekitar 0,02 % glukosa berada dalam bentuk aldehid rantai terbuka, sisanya berada dalam bentuk hemiasetal siklik.
α D Glukopiranosa Fischer
Gambar 14.9 Struktur α D glukopiranosa menurut proyeksi Fischer dan Haworth Meskipun proyeksi Fischer cocok untuk menunjukkan konformasi atom atom di sekeliling karbon karbon kiral suatu karbohidrat dalam rantai terbuka, proyeksi ini tidak sesuai untuk menyatakan suatu struktur siklik. Penggambaran struktur siklik dengan baik, dikembangkan dengan menggunakan rumus perspektif Haworth. Dengan rumus Haworth, akan terlihat bahwa gugus gugus yang terikat pada karbon karbon kiral benar benar berada dalam kedudukan cis dan trans terhadap yang lain pada cincin itu. Juga rumus Haworth menghilangkan ikatan ikatan melengkung yang terkesan dibuat buat pada oksigen cincin.
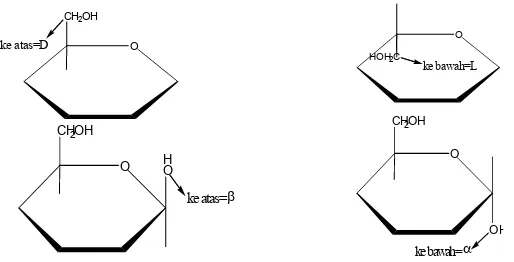
Menurut perjanjian, suatu rumus Haworth digambar dengan oksigen cincin berada pada sisi terjauh dari cincin, dan karbon anomerik berada di sebelah kanan. Gugus CH2OH ujung diletakkan di atas bidang cincin untuk deret D, dan di bawah
bidang cincin untuk deret L. Konfigurasi α bila gugus hidroksil (OH) terletak di bawah bidang dan β jika gugus hidroksil (OH) di atas bidang cincin.
Gambar 14.10. Struktur Haworth dari hemiasetal siklik, untuk monosakarida seri D dan L, konfigurasiα dan β
Perhatikan bahwa gugus yang berada di kanan dalam proyeksi Fischer akan terletak di bawah bidang pada rumus Haworth, dan gugus yang berada di kiri dalam proyeksi Fischer, akan terletak di atas bidang dalam rumus Haworth.
Rumus Haworth yang datar itu, belum cukup menggambarkan kestabilan cincin piranosa. Suatu piranosa, seperti sikloheksana dapat mengalami tekukan cincin agar mencapai keadaan yang stabil, keadaan ini dapat ditunjukkan oleh rumus konformasi.
O
1
2 3
4 5
Haworth
ke atas=D
ke bawah=L
β
ke atas=
XIV 9
Gambar 14.11 Hemiasetal siklik piranosa dalam rumus Haworth dan Konformasi Jika pada rumus Haworth gugus hidroksi (OH) terletak di bawah bidang, maka rumus konformasi gugus hidroksi (OH) tersebut juga terletak di bawah bidang. Begitupun sebaliknya, jika gugus hidroksi (OH) pada rumus Haworth terletak di atas bidang, maka pada rumus konformasi pun terletak di atas bidang. Sebagaimana lazimnya bahwa pada gugus gugus yang besar cenderung berada pada posisi ekuatorial.
14.2.5 Beberapa reaksi Penting Karbohidrat a. Oksidasi menjadi asam4asam aldonat dan aldarat
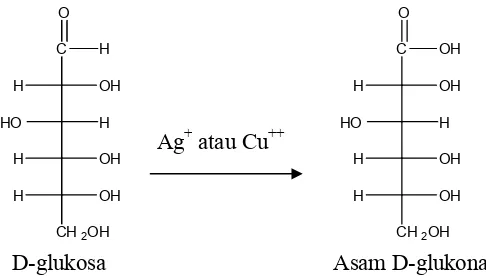
Gugus aldehid dapat dengan mudah mengalami oksidasi, demikian halnya dengan aldosa dapat dioksidasi menjadi asam aldonat dengan mudah sehingga dapat dilakukan oleh pereaksi pereaksi seperti Ag+ dan Cu2+. Oleh sebab itu, aldosa dapat memberikan uji positif dalam uji Tollens, Fehling dan Benedict. Juga oksidator ringan sekalipun, seperti larutan brom yang dibuffer sudah mampu mengoksidasi aldosa.
Gambar 14.12 Oksidasi glukosa menjadi asam aldonat
Pengoksidasi kuat seperti larutan asam nitrat dapat mengoksidasi gugus aldehida dan gugus hidroksi ujung (suatu alkohol primer) menjadi asam polihidroksidikarboksilat, yang dikenal sebagai asam asam aldarat.
D glukosa Asam D glukonat
Ag+ atau Cu++
XIV 10
Gambar 14.13 Oksidasi aldosa dengan asam nitrat menjadi D glukorat (suatu aldarat).
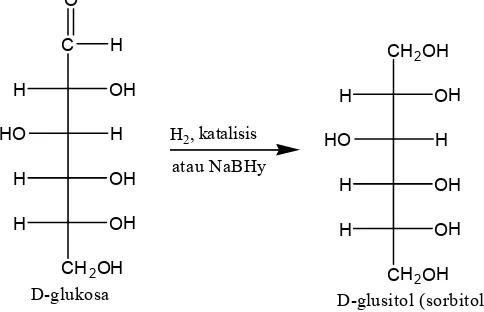
b. Reduksi menjadi alditol
Gugus aldehida dari aldosa dan gugus keto dari ketosa dapat direduks oleh berbagai zat pereduksi, seperti hidrogen katalitik atau suatu hidrida logam, menghasilkan polialkohol yang disebut alditol
Gambar 14. 14 Reduksi aldosa menjadi D glusitol
D glusitol alamiah telah diisolasi dari berbagai buah, lumut dan rumput laut. Molekul D glusitol digunakan sebagai pemanis makanan penderita diabetes.
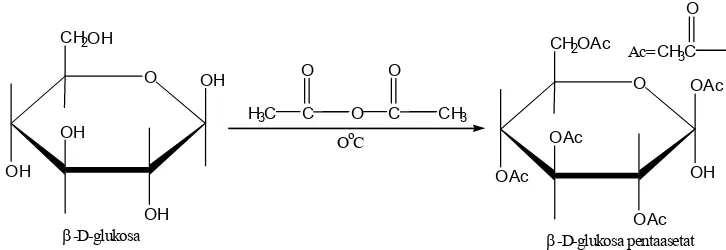
c. Esterifikasi
Gugus gugus hidroksi dalam karbohidrat bersifat seperti gugus hidroksi pada alkohol lain, dapat diesterifikasi. Misalnya dapat diubah menjadi ester melalui reaksi dengan turunan asam. Contoh, perubahan β D glukosa menjadi penta asetat dengan anhidrida asam.
HNO3
kalor
D glukosa asam D glukarat
H2, katalisis
atau NaBHy
XIV 11
Gambar 14.15 Esterifikasi β D glukosa dengan asetat anhidrat menjadi β D glukosa pentaasetat, dalam rumus Haworth dan konfirmasi.
d.Glukosidasi
Pengolahan lebih lanjut suatu hemiasetal dengan alkohol akan menghasilkan suatu asetal. Asetal monosakarida disebut glikosida.
Gambar 14.16 Reaksi β D glukosa (suatu hemiasetal) dengan metanol akan menghasilkan metil β D glikosida (suatu asetal)
Perhatikan bahwa hanya satu satunya gugus hidroksil anomerik yang digantikan oleh gugus OCH3. Asetal ini disebut glikosida, dan ikatan yang terbentuk
antara karbon anomerik dengan gugus OCH3 disebut ikatan glikosida. Penamaan
glokosida diturunkan dari nama monosakarida nya dengan mengubah akhiran a menjadi ida, sehingga glukosa menjadi glukosida, mannosa menjadi mannosida dan seterusnya.
14.2.6 Oligosakarida
Oligosakarida yang paling banyak ditemukan adalah disakarida. Disakarida adalah karbohidrat yang terbentuk dari dua satuan monosakarida., yang terikat antara satu dengan lainnya melalui ikatan glikosida dalam posisi 1,4 α (alfa) atau 1,4β (beta).
Dalam bagian ini akan diuraikan empat macam disakarida yang penting, yaitu maltosa, selobiosa, laktosa dan sukrosa.
a. Maltosa
Maltosa adalah disakarida yang diperoleh sebagai hasil hidrolisispati. Hidrolisis maltosa selanjutnya menghasilkan glukosa. Oleh karena itu, maltosa terdiri dari dua satuan glukosa, terikat antara satu dengan yang lain melalui ikatan α 1,4 glikosida.
OoC
Ac=
βD glukosa βD glukosa pentaasetat
+ CH3OH
H+
XIV 12
Maltosa
4 0 (α D galukopiranosil) D glukopiranosa)
Gambar 14.17. Maltosa, terbentuk dari ikatan α1,4 glikosida
Karbon anomerik dari unit glukosa yang kedua berbentuk hemiasetal yang dapat berada dalam kesetimbangan dengan aldehida rantai terbuka. Oleh karena itu, maltosa dapat mengalami oksidasi, sebagaimana gula reduksi yang telah dibahas terdahulu.
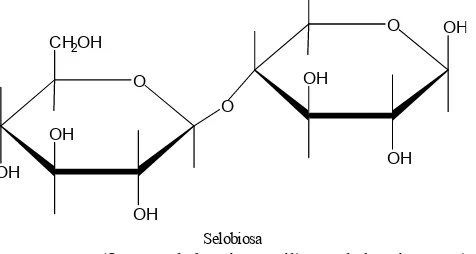
b. Selubiosa
Selubiosa adalah disakarida yang diperoleh dari hidrolisis parsial selulosa. Hidrolisis lebih lanjut dari selulosa menghasilkan D glukosa. Oleh karena itu, selubiosa merupakan perpaduan dua molekul D glukosa melalui ikatan β41,4 glikosida, jadi merupakan isomer maltosa.
4 0 (β D galukopiranosil) D glukopiranosa)
.Gambar 14.18. Selubiosa terbentuk dari ikatan β 1,4 glikosida c. Laktosa
Laktosa adalah gula utama yang terdapat dalam susu sapi dan manusia (4 8% laktosa). Hidrolisis laktosa menghasilkan D glukosa dan D galaktosa dalam jumlah yang sama. Karbon anomerik unit galaktosa mempunyai konfigurasi b pada atom C 1 yang dihubungkan dengan gugus hidroksil atom C 4 dari unit glukosa.
Laktosa
4 0 (β D galaktopiranosil) D glukopiranosa)
Gambar 14.19 Laktosa, terbentuk dari ikatan β 1,4 glikosida antara galaktosa dengan glukosa
XIV 13
Dalam metabolisme tubuh manusia yang normal, laktosa dihidrolisis secara enzimatis menjadi D galaktosa dan D glukosa, selanjutnya galaktosa tersebut diubah menjadi glukosa tidak berfungsi, sehingga akan mengakibatkan penyakit galaktosemia yang sering menyerang pada bayi dan dapat mengakibatkan kematian. Laktosa masih memiliki atom karbon anomerik hemiasetal yang dapat mereduksi pereaksi Fehling, Benedik dan Tollen. Oleh sebab itu masih tergolong sebagai gula pereduksi.
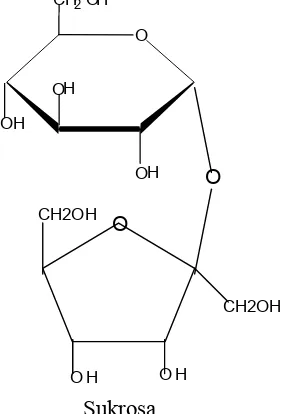
d. Sukrosa
Sukrosa lebih populer disebut gula pasir. Sukrosa terdapat pada semua tanaman yang mengalami fotosintesis dan berfungsi sebagai sumber energi. Gula ini diperoleh dari tanaman tebu dan bit, terdiri dari satu satuan glukosa dan satu satuan fruktosa. Ikatan antara unit glukosa dengan unit fruktosa melalui ikatan glikosida, dengan menggunakan atom karbon anomerik, yaitu atom C 1 dari unit glukosa terikat melalui oksigen ke atom C 2 pada unit fruktosa dan fruktosa merupakan bentuk furanosa.
Sukrosa
α D galaktopiranosil β D Fruktofuranosil
Gambar 14.20 Sukrosa, terbentuk dari ikatan 1,2 glikosida antara glukosa dengan fruktosa
Oleh karena karbon anomerik dari kedua unit sudah saling berikatan, sehingga setiap unit monosakarida tidak lagi memiliki gugus hemiasetal. Karena itu, sukrosa di dalam air tidak berada dalam kesetimbangan dengan suatu bentuk aldehida atau keton, sukrosa tidak menunjukkan mutarotasi dan bukanlah gula pereduksi atau disebut gula non reduksi, berbeda dengan monosakarida dan disakarida yang telah diuraikan sebelumnya.
Hidrolisis sukrosa oleh asam atau enzim invertase, menghasilkan campuran D glukosa dan D fruktosa disebut gula inversi. Invertase terdapat dalam ragi beberapa serangga terutama lebah madu. Karena adanya fruktosa bebas maka gula inversi lebih manis dari gula sukrosa. Suatu gula inversi sintetik disebut isomerase yang dibuat dengan isomerisasi enzimatik dari glukosa dalam sirup jagung, digunakan pada pembuatan es krim, minuman ringan dan permen.
14.2.7 Polisakarida
Polisakarida tersusun dari banyak unit monosakarida yang terikat antara satu dengan yang lain melalui ikatan glikosida. Hidrolisis total dari polisakarida
XIV 14
menghasilkan monosakarida. Dalam bagian ini akan diuraikan secara singkat tentang polisakarida selengkapnya dapat dibaca pada buku biokimia. Beberapa polisakarida yang terpenting, yaitu selulosa, pati (amilosa dan amilopektin), glikogen, kitin akan dikemukakan berikut ini.
a. Selulosa
Selulosa adalah polimer tak bercabang dari glukosa yang dihubungkan melalui ikatan 1,4 β glikosida 300 15000 unit D glukosa membentuk rantai lurus, terikat sebagai unit unit selulosa. Makromolekul selulosa dapat beragregasi membentuk fibril yang terikat melalui ikatan hidrogen antara gugus hidroksil pada rantai yang bersebelahan. Serat selulosa yang mempunyai kekuatan fisik yang tinggi terbentuk dari fibril fibril ini, tergulung seperti spiral dengan arah yang berlawanan menurut sumbu. Diperkirakan sekitar 1011 ton selulosa dibiosintesis tiap tahun, sekitar 50% karbon di alam ini terikat dalam bentuk selulosa, kayu mengandung sekitar 50%, kapas 90%, daun kering 20%.
Manusia tidak dapat mencerna selulosa, sekalipun dapat mencerna pati dan glikogen. Hal ini disebabkan karena adanya perbedaan stereokimia ikatan glikosida pada atom C 1 setiap unit glukosa. Sistem pencernaan manusia mengandung enzim yang dapat membantu mengkatalisis hidrolisis ikatan α glikosida, tetapi tidak mempunyai enzim yang diperlukan untuk menghidrolisis β glikosida. Namun banyak bakteri yang mempunyai β glukosidase dan dapat menghidrolisis selulosa. Rayap misalnya memiliki bakteri semacam ini dalam ususnya sehingga dapat hidup dengan memakan pokok kayu.
Selulosa tidak termasuk gula pereduksi, karena relatif tidak lagi memiliki atom karbon hemiasetal. Walaupun selulosa memiliki karbon hemiasetal pada ujung ranting, tetapi pengaruhnya tidaklah nyata, karena sangat kecil jika dibandingkan dengan molekulnya yang besar.
b. Pati
Pati merupakan polisakarida yang melimpah setelah selulosa. Berfungsi sebagai penyimpan energi. Pati banyak terdapat pada padi padian, kentang, jagung dan lain lain. Pati dapat dipisahkan menjadi dua komponen utama berdasarkan kelarutan bila dibubur dalam air panas. Sekitar 20% pati adalah amilosa (larut) dan 80% adalah amilopektin (tidak larut)
Amilosa, adalah polimer linier dari α D glukosa, sekitar 50 sampai 300 unit unit glukosa yang dihubungkan antara satu dengan lainnya melalui ikatan 1,4 α glikosida. Dalam larutan, rantai amilosa berbentuk heliks menyerupai kumparan, karena adanya ikatan dengan konfigurasi α pada setiap unit glukosa. Kumparan yang berbentuk tabung ini memungkinkan terbentuknya senyawa kompleks dengan molekul lain, terutama molekul molekul kecil yang dapat masuk ke dalam kumparannya. Warna biru tua yang ditimbulkan pada penambahan yodium pada pati adalah contoh pembentukan kompleks tersebut. Hidrolisis lengkap dari amilosa menghasilkan hanya D glukosa, hidrolisis parsial menghasilkan maltosa sebagai satu satunya disakarida.
XIV 15
akan menghasilkan maltosa dan isomaltosa. Isomaltosa tersebut berasal dari percabangan α 1,6. Campuran oligosakarida yang diperoleh dari hidrolisis parsial amilopektin, dikenal sebagai dekstrin yang dipergunakan sebagai lem, pasta dan kanji tekstil.
c. Glikogen
Glikogen adalah polisakarida yang berfungsi sebagai penyimpan glukosa dalam hewan (terutama dalam hati dan otot). Struktur glikogen mirip amilopektin, yaitu mengandung rantai glukosa yang terikat 1,4 α dengan percabangan 1,6 α. Molekul glikogen jauh lebih besar dan lebih bercabang dibanding amilopektin. Glikogen mempunyai bobot molekul tinggi, memiliki sekitar 100.000 unit glukosa, dengan percabangan terdapat pada setiap 8 12 unit glukosa. Glikogen dihasilkan jika glukosa diserap ke dalam darah dan diangkut ke hati, otot, lalu membentuk polimer dengan bantuan enzim. Glikogen membantu mempertahankan keseimbangan gula dalam tubuh, dengan jalan menyimpan kelebihan gula yang dicerna dari makanan dan mensuplainya ke dalam darah jika diperlukan.
d. Kitin
Kitin adalah polisakarida linier yang mengandung N asetil D glukosamin terikat. Hidrolisis kita menghasilkan 2 amino 2 deoksi D glukosa. Kitin banyak terikat dalam protein dan lipida, merupakan komponen utama dalam bangunan serangga.
14.3. Lipida
Lipid (Yunani, lipos=lemak) adalah sekelompok besar senyawa alam yang tak larut dalam air, tetapi larut dalam perut organik non polar seperti n heksan, kloroporm dan dietil eter. Sifat inilah yang membedakan lipid dari karbohidrat, protein, asam nukleat dan kebanyakan molekul hayati lainnya. Struktur molekul lipid sangat beragam, sehingga kita harus mengingat banyak gugus fungsi yang telah kita pelajari sebelumnya. Senyawa organik yang termasuk kelompok lipid adalah trigliserida, lilin, fosfolipid, glikolipid, steroid, terpen, prostaglandin.
14.3.1 Lilin
Lilin atau malam adalah sebagian dari kelompok lipid. Secara kimiawi, lilin merupakan ester dari alkohol berantai panjang dengan asam lemak berantai panjang. Panjang rantai hidrokarbon asam maupun alkohol pada lilin biasanya berkisar dari 10 sampai dengan 30 karbon. Bedanya dengan trigliserida adalah, bahwa alkohol pada lilin ialah alkohol monohidrat. Lilin adalah padatan mantap bertitik leleh rendah dapat ditemui pada tumbuhan dan hewan. Lilin lebah yang sebagian besar berupa mirisil palmiat, adalah ester dari milirisil alkohol dan asam palmitat. Lilin berguna untuk melindungi permukaan daun dari penguapan air dan serangan mikroba. Lilin juga melipisi kulit, rambut dan bulu unggas, sehingga tetap lentur dan kedap air.
O
CH3(CH2)14 C O (CH2)29CH3
14.21. Mirisil palmitat ester dari mirisil alkohol dengan asam palmitat.
XIV 16
glikol. Lilin tiruan ini sering digunakan dalam kosmetik dan bahan bahan baku industri.
14.3.2 Trigliserida
Trigliserida adalah triester dari asam lemak dan gliserol. Asam lemak adalah karboksilat berantai panjang, yang umumnya memiliki jumlah atom karbon genap, dan dapat memiliki satu atau lebih ikatan rangkap dua (tidak jenuh). Tabel 14.1 memuat daftar beberapa asam lemak dan sumbernya. Sifat fisik maupun sifat kimia dari trigliserida sangat ditentukan oleh jenis asam lemak pembentuknya. Tingkat kejenuhan dan ketidak jenuhan dari asam lemak menentukan titik leleh dari trigliserida yang dibentuknya. Asam lemak jenuh umumnya rantainya memanjang dan lebih teratur. Jika terdapat ikatan ganda dua cis dalam rantai asam lemak, maka rantainya akan membelok dan tidak teratur. Semakin banyak terdapat ikatan ganda dua dalam rantai asam lemak, semakin tidak teratur strukturnya dan semakin rendah titik lelehnya.
Tabel 14.1. Beberapa asam lemak jenuh dan tidak jenuh
4 CH3CH2CH2COOH Asam butirat Mentega 6 CH3(CH2)4COOH Asam kaproat Mentega 8 CH3(CH2)6COOH Asam kaprilat Minyak kelapa 10 CH3(CH2)8COOH Asam kaprat Minyak kelapa 12 CH3(CH2)10COOH Asam laurat Minyak sawit 14 CH3(CH2)12COOH Asam miristat Minyakbiji pala 16 CH3(CH2)14COOH Asam palmitat Minyak kelapa 18 CH3(CH2)16COOH Asam stearat Lemak hewan
16 CH3(CH2)5CH=CH(CH3)3COOH Asam palmitoleat Mentega 18 CH3(CH2)3CH=CH(CH2)3COOH Asam oleat Minyak zaitun 18 CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH Asam linoleat Minyak kedele 18 CH3CH2(CH CHCH2)3(CH3)6COOH Asamlinolenat Minyak biji
kapas
Trigliserida tergolong sebagai lipid sederhana, dan merupakan bentuk cadangan lemak dalam tubuh manusia. Persamaan umum pembentukan trigliserida adalah. Bila ketiga asam lemak yang menyusun trigliserida semua sama maka hasilnya
Gambar 14.22. Trigliserida, ester dari gliserol dan tiga asam lemak CH2
CH O
Trigliserida CH2OH
CH OH + CH2OH
R1 COOH
R2 COOH
R3 COOH
+ 3H2O
XIV 17
disebut trigliserida sederhana. Misalnya dari gliserol dan tiga molekul asam stearat akan diperoleh trigliserida sederhana yang disebut gliseril tristearat, atau tristearin.
Trigliserida sederhana jarang dijumpai, yang lebih lazim adalah trigliserida campuran, yakni triester dari asam lemak yang tak sejenis. Lemak hewan dan minyak nabati merupakan beberapa trigliserida campuran. Trigliserida campuran dalam lemak mentega misalnya, mengandung paling sedikit 14 macam asam karboksilat. Ukuran kuantitatif yang dapat digunakan untuk menyatakan banyaknya ikatan ester ialah bilangan penyabunan.
Lemak dan minyak dapat dibedakan berdasarkan pada titik lelehnya. pada suhu kamar lemak berwujud padat, sedangkan minyak berwujud cair. Titik leleh dari lemak dan minyak tergantung pada strukturnya, umumnya meningkat dengan bertambahnya jumlah atom karbon. Banyaknya ikatan ganda dua karbon karbon dalam komponen asam lemak juga sangat berpengaruh. Trigliserida yang mengandung banyak asam lemak tak jenuh, seperti asam olet dan linoleat akan berwujud minyak (cair), sedangkan trigliserida yang mengandung asam lemak jenuh berwujud padat (lemak), contohnya lemak sapi. Reaksi hidrogenasi mengubah minyak nabati menjadi lemak, misalnya pada industri margarin. Serbuk logam nikel (sebagai katalis) didispersikan ke dalam minyak panas selanjutnya diadisi dengan hidrogen sehingga ikatan ganda dua dari asam lemak tak jenuh 17oC) menghasilkan tristearin (titik leleh 55oC).
Gambar. 14.23 Hidrogenasi triolein (tak jenuh) menjadi tristearin (jenuh) Trigliserida dapat menjadi tengik dan menimbulkan bau dan cita rasa yang tak enak bila dibiarkan pada udara lembab. Lepasnya asam lemak yang mudah menguap akan menyebabkan bau tengik. Asam asam ini terbentuk melalui hidrolis ikatan ester atau oksidasi ikatan ganda dua. Hidrolisis lemak atau minyak sering dikatalis oleh enzim lipase yang ada di udara. Bau keringat timbul apabila lipase bakteri mengatalisis hindrolisis minyak dan lemak pada kulit. Ketengikan hidrolitik dapat dicegah atau ditunda dengan menyimpan bahan pangan dalam lemari pendingin. Ketengikan oksidatif, lebih banyak mengakibatkan ketengikan bahan pangan. Ikatan ganda dua dalam komponen asam lemak tak jenuh dari trigliserida terputus dan mem bentuk aldehid berbobot molekul rendah dan bau tak sedap. Aldehid kemudian dioksidasi menjadi asam lemak berbobot molekul rendah dengan bau yang tak enak. Ketengikan oksidatif memperpendek masa simpan biskuit dan makanan sejenisnya. Antioksidan adalah senyawa yang dapat menunda ketengikan oksidatif. Dua senyawa alami yang sering digunakan sebagai antioksidan ialah asam askorbat (vitamin C) dan αtokoferol (vitamin E).
Sebagaimana ester lainnya, trigliserida mudah dihidrolisis dengan bantuan asam atau basa. Hidrolisis minyak atau lemak dengan jalan mendidihkannya dalam
CH2
CH O
Triolein (minyak)
CH2
CH O
XIV 18
larutan natrium hidroksida, disebut penyabunan. Proses ini digunakan dalam pembuatan sabun dan reaksinya disebut reaksi saponifikasi. Sabun adalah garam logam alkali (Na, K, Li) dari asam lemak.
Gambar 14.24 Reaksi penyabunan stearin dengan sodium hidroksida
Gliserol adalah hasil samping yang penting dari reaksi tersebut di atas. Gliserol diperoleh dengan menguapkan lapisan air, sabun kasar kemudian dimurnikan dan diberi warna dan wewangian sesuai permintaan pasar.
14.3.3 Fosfolipid
Fosfolipid adalah lipid berupa ester asam posfat. Dalam membran sel terdapat dua jenis utama fofolifid, yaitu fosfogliserida dan sfingomyelin. Molekul fosfogliserida terbentuk dari asam lemak berantai panjang(14 sampai 24 karbon), gliserol dan asam fosfat. Ikatan ester fosfat terjadi pada satu gugus hidroksi sedangkan hidroksi lainya membentuk ester dengan dua asam lemak. Pada umumnya bagian ester fosfat tidak terdapat dalam keadaan bebas, melainkan membentuk senyawa yang lebih kompleks dengan fungsi fiologis tertentu. Contohnya ikatan ester fosfat (fosfotidat) dengan kolin menghasilkan fosfotidilkolin yang lebih dikenal sebagai lesitin yang berfungsi sebagai bahan pelumas sel syaraf dan otak.
Gambar 14.25 Pembentukan lesitin dari fosfotidat dengan kolin CH2
CH O
Tristearin (lemak)
CH2
CH + 3CH3(CH2)16C O Na O
NaOH
Gliserol
Garam (Sabun )
2
C C H
H
O
a o a d t +
C 2 C H 3
N H
Lesitin
+
HOCH2CH2N(CH3)3 CH2
CH
O
XIV 19 4.3.4. Glikolipid
Glikolipid ialah molekul lipid yang mengandung unit gula (karbohidrat) biasanya dari gula sederhana seperti glukosa atau galaktosa. Serebrosida adalah salah satu dari glikopid. yang tersusun atas satu sfingosin, asam lemak dan gula. Sere brosida terdapat milimpah dalam jaringan otak.
Gambar 14.26 Serebrosida suatu glikolipid 4.3.5 Steroid
Steroid adalah kelompok lipid yang banyak dijumpai dalam tumbuhan dan hewan. steroid tak tersabunkan, karena tak dapat dihidrolisis dalam media basa, berbeda dengan trigliserida dan lipid kompleks. Hubungan kesamaan steroid dengan lipid lainnya terletak pada kelarutannya, steroid tidak larut dalam air tetapi larut dalam pelarut organik. Beberapa senyawa steroid yang sangat penting dalam kelansungan hidup mahluk hidup, yaitu hormon, garam empedu, kolesterol dan sejenisnya. Steroid dianggap turunan dari fenanteren, dimana terdapat tiga cincin sikloheksana dan satu cincin siklopentana terpadu membentuk siklopentanahidropenantren yang merupakan kerangka inti dari senyawa steroid.
Gambar 14.27. Siklopentanoperhidrofenantren (kerangka inti steroid) Kolesterol adalah salah satu steroid yang mengandung gugus fungsi hidroksil. Kolesterol banyak terdapat dalam jaringan hewan,10% dari bobot kering otak adalah koleterol merupakan komponen utama batu empedu. Berbagai macam hormon merupakan kelompok steroi, misalnya hormon testosteron (hormon seks jantan), progesteron (hormon seks betina). Demikian juga banyak obat sintetik adalah turunan steroid, misalnya noretindron (kontraseptik), narankolan (anabolik).
Gambar 14.28 Kerangka molekul kolesterol
XIV 20 4.3.6 Terpen
Salah satu senyawa organik bahan alam yang banyak dijumpai dalam mahluk hidup terutama tumbuhan adalah kelompok terpen. Terpen yang lebih sederhana dikenal sebagai minyak atsiri. Kelompok senyawa ini banyak digunakan sebagai bahan baku farfun dan obat. Terpen terbentuk dari satuan satuan isopren yang terkondensasi membentuk senyawa terpen yang sederhana monoterpen hingga politerpen seperti karet alam. Isopren mempunyai jumlah atom C adalah 5 (lima) dan mempunyai struktur kimia adalah 2 menit 1,3 butadiena.
Tergantung dari banyaknya satuan isopren yang bergabung, maka terpen dikelompokkan atas :
a. monoterpen = dua satuan isopren b. seskuiterpen = tiga satuan isopren c. diterpen = empat satuan isopren d. triterpen = enam satuan isopren e. tetraterpen = delapan satuan isopren
Kebanyakan mono dan seskuiterpen terdapat dalam tumbuhan dan sebagian besar mempunyai ciri khas mnyak yang berbau khusus (banyak digunakan sebagai parfum). Molekul terpen yang terbentuk dari satuan satuan isopren dapat berupa rantai terbuka (asiklik) dan tertutup (siklik).
Dengan struktur yang hanya terdiri dari satuan isopren, monoterpen merupakan terpen yang paling sederhana, namun demikian monoterpen menunjukkan aneka ragam struktur. Beberapa contoh senyawa monoterpen dan sumbernya ditunjukkan di bawah ini.
Graniol Limonen mentol (dalam Mawar) (dlm.buah jeruk) (dlm. Mint)
Gambar. 14.30. Kerangka monoterpen asiklik dan monosiklik
Beberapa contoh terpen tingkat tinggi yang penting antara lain skualen dan lanosterol. Kedua senyawa ini merupakan zat antara dalam biosintesis steroid. Skualen terdapat dalam ragi, kecambah gandum dan minyak hati ikan hiu. Sedangkan lanosterol (suatu komponen lanolin) diperoleh dari lemak wool.
XIV 21
Wortel mengandung tertraterpen berwarna jingga yang disebut karoten. Karoten dapat diuraikan secara enzimatik mrnjadi dua satuan vitamin A yang berperan dalam indra penglihatan.
Gambar 14.31. Kerangka fitamin A, suatu ditrepen (empat isopren)
14.4. Asam Nukleat
Salah satu bidang penelitian modern yang paling menarik dewasa adalah mengenai asam nukleat (nucleic acid). Asam nukleat berperan sebagai pengemban kode genetik bagi mahluk hidup. Harapan para peneliti semakin besar ketika ditemukannya teknik rekayasa genetik. Dengan menggunakan teknik tersebut maka aspek genetika suatu mahkluk hidup dapat dimodifikasi. Tonggak kemajuan era bioteknologi yang muncul sebagai teknologi handal masa kini dan akan datang ditandai oleh penemuan penemuan di bidang rekayasa genetik, terutama kemajuan dibidang kloning gen.
Rekayasa genetik merupakan teknik pengubahan gen organisme dengan jalan manipulasi DNA. Rekayasa genetika dikenal pula sebagai teknik DNA rekombinan yang didefenisikan sebagai: Pembentukan rekombinan baru dari material yang dapat diturunkan dengan cara penyisipan suatu molekul asam nukleat yang dihasilkan di luar sel ke dalam suatu vektor, sehingga memungkinkan penggabungan dan selanjutnya berkembang dalam host yang baru. Proses tersebut dikenal juga sebagai
Gene Cloning, oleh karena organisme yang secara genetik terbentuk adalah identik
dan membawa seluruh potongan DNA yang telah disisipkan.
Sejak tahun 1978 telah ditemukan bahwa gen gen yang mengarahkan sintesis insulin manusia, telah diurai ke dalam DNA dari bakteri Escherichia coli, yang selanjutnya berkembang biak dan menjadi pabrik insulin, yang memproduksi insulin manusia. Hormon pertumbuhan manusia (HGH, Human Growth Hormone) juga telah diproduksi dengan teknik genetik. Pada hal sebelumnya, satu satunya sumber hormon ini adalah kelenjar lendir yang diambil dari mayat. Pada tahun 1980, ditemukan produksi zat anti virus oleh bakteri yang disebut interveron manusia. DNA juga dapat digunakan untuk melacak suatu penyakit keturunan maupun penyakit yang disebabkan oleh infeksi, juga dapat mendeteksi adanya mikroorganisme patogen dalam bahan pangan.
14.4.1 Struktur dan Fungsi Asam Nukleat
Asam nukleat adalah suatu makromolekul yang mempunyai fungsi esensial dalam kelangsungan hidup organisme. Asam nukleat terbentuk dari satuan satuan mononukleotida yang tersusun secara beraturan dalam untaian polimer nukleotida. Fungsi asam nukleat yang amat penting adalah, peranan asam nukleat dalam mekanisme molekular, yaitu menyimpan, mereplikasi dan mentranskripsi informasi genetika. Dalam sel asam nukleat juga berperan dalam hubungannya dengan metabolisme antara dan reaksi reaksi transformasi energi. Selain itu, ditemukan pula beberapa nukleotida yang berperan sebagai ko enzim, antara lain sebagai ko enzim
XIV 22
pembawa energi, perpindahan asam asetat, zat gula, senyawa amina dan biomolekul lainnya, juga sebagai ko enzim dalam oksidasi reduksi.
Nukleotida mengandung satu basa nitrogen, satu unit gula (pentosa), dan satu
gugus fosfat yang berikatan dengan gula. Jika satu basa nitrogen hanya berikatan
dengan unit gula saja tanpa adanya gugus fosfat, disebut nukleosida.
Di bawah ini akan dijelaskan struktur tiap tiap unit pembentuk nukleotida. 4.1.1. Struktur Karbohidrat
Ada dua macam asam nukleat DNA dan RNA. Perbedaan kedua asam nukleat tersebut terletak pada unit karbohidratnya. Karbohidrat yang terdapat pada asam nukleat di dalam inti sel adalah βD 2deoksiribosa, sehingga asam nukleatnya disebut
Deoksiribonucleic acid (DNA). Sedangkan gula yang terdapat pada asam nukleat
dalam sitoplasma adalah βD 2 ribosa dan asam nukleatnya dikenal dengan
Ribonucleic acid (RNA).
Gambar 14.32. Struktur unit karbohidrat 4.1.2. Struktur Basa Nitrogen
Ada empat macam basa nitrogen yang terdapat pada DNA, dua diantaranya merupakan derivat basa nitrogen purin yakni adenin dan guanindisingkat (A) dan (G), dan dua adalah derivat basa nitrogen pirimidin yakni sitosin (C) dan timin (T).
Dalam RNA juga dijumpai empat macam basa yaitu adenin, guanin, sitosin, dan urasil, masing masing disingkat (A), (G), (C), dan (U). Urasil derivat dari basa nitrogen pirimidin. Selain itu dikenal pula basa pirimidin lainnya yang tidak umum 5 metilsitosin dan 5 hidroksimetilsitosin. Basa purin lainnya yang tidak umum adalah 2 metiladenindan 1 metilguanin.
Selain komponen karbohidrat dan basa nitrogen, nukleotida juga disusun oleh komponen Pospat (H2PO4).
H – C– OH H – C– OH H – C– OH
CHO
CH2OH
atau
O H HO–CH2
H H H
OH OH
OH
βD 2 ribosa
H – C– OH H – C– OH H – C– OH
CHO
CH2OH
atau
O H HO–CH2
H H H
OH OH
OH
XIV 23
Gambar 14.33. Struktur beberapa senyawa purin dan pirimidin 14.2.3. Struktur Nukleosida
Nukleosida terbentuk akibat pengikatan secara kovalen antara unit karbohidrat dengan derivat basa nitrogen purin atau pirimidin. Pengikatan tersebut terjadi pada posisi C%1 karbohidrat dengan N%1 derivat basa pirimidin atau posisi N%9 derivat basa purin.
Nuklesida dapat diperoleh dari hasil hidrolisis nukleotida dengan jalan pelepasan gugus fosfat.
5 hidroksimetilsitosin
XIV 24
Gambar 14.34. Salah satu struktur Nukleosida 14.3.3. Struktur Nukleotida
Nukleotida (nukleosida fosfat) merupakan ester asam fosfat dari nukleosida. Asam fosfat terikat pada gugus hidroksil dari salah satu atom karbon dalam cincin pentosa. Nukleotida terdapat bebas di dalam sel, dan dapat terbentuk dari hidrolisis bertahap asam nukleat dengan enzim nuklease. Nukleotida juga terdiri dari dua golongan yakni ribonukleotida dan deoksiribonukleotida.
Gambar 14.35. Suatu Nukleotida
Bagian ester fosfat mempunyai fungsi sebagai jembatan pertautan antara nukleotida yang satu dengan nukleotida lainnya, dikenal sebagai fosfodiester. Pertautan itu terjadi antara gugus 5’%hidroksi dari suatu nukleotida dengan gugus
3’%hidroksil nukleotida berikutnya dalam rantai. Pertumbuhan rantai suatu
polinukleotida dimulai dari ujung molekul yang mempunyai ujung 5’ bebas, dan bergerak ke ujung molekul yang mempunyai gugus 3’ hidroksi bebas. Dapat dikatakan pertumbuhan rantai mengikuti pola dari 5’ ke 3’. Perhatikan bahwa meskipun dua dari empat oksigen yang melekat pada fosfor setiap jembatan diikat sebagai ester fosfat, dan satu oksigen dalam kondisi ikatan ganda dengan fosfor, namun masih terdapat satu oksigen yang bebas dapat melepaskan protonnya.
(9%β%D%ribofuranosiladenin – 5’%monofosfat) (AMP)
XIV 25
Banyaknya gugus yang dapat mengurai semacam ini, menandakan ciri keasaman yang tinggi pada DNA dan RNA.
14.3.4 Struktur Primer Polinukleotida DNA dan RNA
Asam nukleat merupakan polimer dari nukleotida. Unit unit nukleotida tersebut berhubungan satu sama lain melalui jembatan ester fosfat antara gugus hidroksil C%3’ pada nukleotida yang satu dengan gugus hidroksil C%5’ pada nukleotida yang lain. Karena jembatan ester fosfat antara dua nukelotida itu mengandung dua ikatan ester fosfat maka disebut dengan jembatan fosfodiester.