PENGARUH MASERAT LIDAH BUAYA (Aloe vera)
TERHADAP HISTOLOGI PANKREAS MENCIT
(Mus musculus Swiss Webster) JANTAN YANG DIINDUKSI ALOKSAN
SKRIPSI
Diajukan untuk Memenuhi Sebagian dari Syarat Memperoleh Gelar Sarjana Sains Program Studi Biologi
Oleh:
FIRSDA YUNITA
0901973
PROGRAM STUDI BIOLOGI
JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIKAN INDONESIA
LEMBAR PENGESAHAN
Pengaruh Maserat Lidah Buaya (Aloe vera) Terhadap Histologi Pankreas Mencit
(Mus musculus Swiss Webster) Jantan yang Diinduksi Aloksan
Oleh Firsda Yunita
0901973
DISETUJUI DAN DISAHKAN OLEH:
Pembimbing I
Dr. H. Saefudin, M.Si. NIP. 196307011988031003
Pembimbing II
Dra. Soesy Asiah Soesilawati, M. Si. NIP. 195904011983032002
Mengetahui,
Ketua Jurusan Pendidikan Biologi FPMIPA UPI
PENGARUH MASERAT LIDAH BUAYA (Aloe vera)
TERHADAP HISTOLOGI PANKREAS MENCIT
(Mus musculus Swiss Webster) JANTAN YANG DIINDUKSI ALOKSAN
Oleh:
FIRSDA YUNITA
0901973
Diajukan untuk Memenuhi Sebagian dari Syarat Memperoleh Gelar Sarjana Sains Program Studi Biologi
© Firsda Yunita 2014 Universitas Pendidikan Indonesia
Hak Cipta dilindungi undang-undang.
Pengaruh Maserat Lidah Buaya (Aloe vera) Terhadap Histologi Pankreas
Mencit (Mus musculus Swiss Webter) Jantan yang Diinduksi Aloksan
ABSTRAK
Penelitian dengan tujuan untuk mengetahui pengaruh maserat lidah buaya (Aloe vera) terhadap histologi pankreas mencit (Mus musculus) jantan yang diinduksi aloksan telah dilakukan. Aloksan disuntikan sebanyak 0.65 ml/100 gram BB secara intravena. Penelitian ini dilakukan dengan menggunakan 25 ekor mencit putih jantan dikelompokkan menjadi lima kelompok, setiap kelompok perlakuan kecuali kelompok kontrol netral diinduksi aloksan sebanyak 0.65 ml/100 gram BB dan diberi terapi dengan pemberian ekstrak daun Aloe vera sebanyak 0.70 gram/100 gram BB/hari, 1.05 gram/100 BB/hari, atau 1.40 gram/100 gram BB/hari. Mencit diberi perlakuan dengan pemberian oral maserat lidah buaya selama 30 hari. Pada hari ke-31 mencit dibedah dan diambil pankreas lalu dibuat preparat. Dihitung jumlah pulau Langerhans dan luas pulau Langerhans dalam satu preparat dengan tiga pengulangan. Hasil analisis data menunjukkan bahwa maserat Aloe vera dapat memperbaiki gambaran histologi pulau Langerhans yang diinduksi aloksan. Dosis Aloe vera 0.70 ml/100 gram BB/hari merupakan dosis efektif dalam memperbaiki gambaran histologi pulau Langerhans yang diinduksi aloksan. Berdasarkan hasil penelitian dapat disimpulkan bahwa maserat lidah buaya berpengaruh untuk memperbaiki pulau Langerhans pankreas mencit yang diinduksi aloksan.
Aloe vera Leaf Gel Macerate Effect to Male Mice (Mus musculus Swiss Webter)
Pancreatic Histology with Alloxan-Induced
ABSTRACT
Research with the aim to determine the Aloe vera maserat effect on the histology of the mice (Mus musculus) pancreatic with alloxan-induced male has been done. Alloxan was induced into mice body as much as 0,65 ml/100 g BW intravenously. This research was conducted using 25 male white mice were grouped into five groups, each treatment group except the neutral control group with alloxan-induced as much as 0.65 ml/100 g BW/day and were treated with Aloe vera leaf gel macerate as much 0.70 g/100 g BW/day, 1.05 g/100 g BW/day, or 1.40 g/100 g BW/day. Mice were treated with Aloe vera maserat oral administration for 30 days. On day 31, mice were dissected and pancreas were taken and made preparations. Calculated vast number of islands and islets of Langerhans in the preparations with three repetitions. The results of the data analysis showed that administration of Aloe vera maserat can fix pancreatic histology with alloxan-induced. Aloe vera dose of 0.70 ml/100 g body BW/day is an effective dose in improving pancreatic histology with alloxan-induced. Based on the results of this study concluded that administration of Aloe vera maserat effect can improve the mice islets of Langerhans of the pancreas with alloxan-induced.
DAFTAR ISI
Halaman
ABSTRAK ... i
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN A. Latar Belakang Masalah ... 1
B. Rumusan Masalah ... 2
C. Batasan Masalah ... 2
D. Tujuan ... 3
E. Manfaat Penelitian ... 3
F. Asumsi ... 3
G. Hipotesis ... 4
BAB II MASERAT LIDAH BUAYA, HISTOLOGI PANKREAS MENCIT JANTAN, DAN INDUKSI ALOKSAN A. Maserat Lidah Buaya ... 5
B. Histologi Pankreas Mencit Jantan ... 11
C. Induksi Aloksan ... 14
BAB III METODE PENELITIAN A. Jenis Penelitian ... 17
B. Desain Penelitian ... 17
C. Populasi dan Sampel ... 18
D. Waktu dan Lokasi Penelitian ... 18
1. Tahap Persiapan ... 19
a. Persiapan Alat dan Bahan ... 19
b. Persiapan Hewan Uji Coba (Mus musculus) ... 19
c. Pembuatan maserat Aloe vera ... 19
2. Tahap Pelaksanaan ... 20
a. Penginduksian aloksan ... 20
b. Pemberian maserat Aloe vera ... 20
3. Tahap pembuatan preparat histologi pankreas ... 21
a. Pengambilan Organ Pankreas ... 21
b. Pembuatan Preaparat Histologi ... 21
c. Pewarnaan Hematoxilin-Eosin ... 22
4. Pengamatan dan Analisis Data ... 23
5. Alur Penelitian ... 24
BAB IV HASIL DAN PEMBAHASAN A. Hasil Pengamatan ... 25
1. Jumlah Pulau Langerhans Pankreas Mencit ... 25
2. Luas Pulau Langerhans ... 27
3. Gambaran Histologi Pankreas Mencit ... 29
B. Pembahasan ... 33
BAB V KESIMPULAN DAN SARAN A. Kesimpulan ... 37
B. Saran ... 37
DAFTAR PUSTAKA ... 38
LAMPIRAN ... 44
DAFTAR TABEL
Tabel Halaman
2.1 Komponen-komponen dalam lidah buaya ...10
3.1 Pengaturan Randomisasi Mencit ...18
3.2 Hasil randomisasi mencit dan jenis perlakuan ... 18
4.1 Rata-Rata Jumlah Pulau Langerhans Preparat Pankreas
Mencit (1000x) ...26
4.2 Rata-Rata Luas Pulau Langerhans Preparat Pankreas Mencit
[image:9.595.117.507.189.638.2]DAFTAR GAMBAR
Gambar Halaman
2.1 Aloe vera (lidah buaya) yang dijadikan maserat ...7
2.2 Mencit (hewan uji coba) ... 11
2.3 Anatomi Tikus ...12
2.4 Histologi pankreas tikus ... 13
3.1 Bagan Alur Penelitian ... 24
4.1 Grafik Rerata Hasil Pengukuran Jumlah Pulau Langerhans Mencit (µ) ...27
4.2 Grafik Rerata Hasil Perhitungan Luas Pulau Langerhans Mencit (pulau). ...28
4.3 Perbandingan preparat pankreas kontrol normal dan kontrol positif ...29
4.4 Perbandingan preparat pankreas kontrol normal dan perlakuan I ...30
4.5 Perbandingan preparat pankreas kontrol normal dan perlakuan II ...30
4.6 Perbandingan preparat pankreas kontrol normal dan perlakuan III ...31
4.7 Perbandingan preparat pankreas kontrol positif dan perlakuan I ...31
4.8 Perbandingan preparat pankreas kontrol positif dan perlakuan II ...32
[image:10.595.119.507.183.673.2]DAFTAR LAMPIRAN
Lampiran Halaman
1 Data Jumlah dan Luas Pulau Langerhans Pankreas
Mencit Persatuan Luas Pandang ...44
1.1 Data Jumlah Pulau Langerhans Pankreas Mencit
Persatuan Luas Pandang ...44
1.2 Data Luas Pulau Langerhans Pankreas Mencit
Persatuan Luas Pandang ...45
2 Data Berat Badan Mencit selama Aklimatisasi ...46
3 Data Berat Badan Mencit selama Perlakuan ...48
4 Uji Statistika Hasil Pengukuran Jumlah Pulau
Langerhans Pankreas Mencit Setelah Diberi Perlakuan
Maserat Daun Aloe vera dengan Software SPSS 18 for
Windows ...50
4.1 Hasil Uji Normalitas Kolmogorov-Smirnov Jumlah
Pulau Langerhans Pankreas Mencit (Mus musculus)
Persatuan Luas Pandang ...50
4.2 Hasil Uji Homogenitas Levene Jumlah Pulau
Langerhans Pankreas Mencit (Mus musculus)
Persatuan Luas Pandang ...50
4.3 Hasil Uji Perbedaan Rata-rata (Kruskall-Wallis)
Jumlah Pulau Langerhans Pankreas Mencit (Mus
musculus) Persatuan Luas Pandang ...51
4.4 Hasil Uji Perbandingan Post Hoc Tukey Jumlah Pulau
Langerhans Pankreas Persatuan Luas Pandang Mencit
5 Uji Statistika Hasil Pengukuran Luas Pulau
Langerhans Mencit Setelah Diberi Perlakuan Maserat
Daun Aloe vera dengan Software SPSS 18 for
Windows ...52
5.1 Hasil Uji Normalitas Kolmogorov-Smirnov Pengukuran Luas Pulau Langerhans (Mus musculus) ...52
5.2 Hasil Uji Homogenitas Levene Pengukuran Luas Pulau Langerhans Mencit (Mus musculus) ...52
5.3 Hasil Uji Perbedaan Rata-rata (ANOVA) Pengukuran Luas Pulau Langerhans Mencit (Mus musculus) ...53
5.4 Hasil Uji Perbandingan Post Hoc Tukey Luas Pulau Langerhans Pankreas Persatuan Luas Pandang Mencit (Mus musculus) ...53
6 Uji Statistika Hasil Pengukuran Berat Badan Mencit Setelah Diberi Perlakuan Maserat Daun Aloe vera dengan Software SPSS 18 for Windows ... 54
6.1 Hasil Uji Normalitas Kolmogorov-Smirnov Pengukuran Berat Badan Mencit (Mus musculus) ...54
6.2 Hasil Uji Homogenitas Levene Pengukuran Berat Badan Mencit (Mus musculus) ...54
6.3 Hasil Uji Perbedaan Rata-rata (ANOVA) Pengukuran Berat Badan Mencit (Mus musculus) ...55
7.1 Daftar Alat yang Digunakan Dalam Penelitian ...56
7.2 Daftar Bahan yang Digunakan Dalam Penelitian ...57
8 Tabel Konversi Penghitungan Dosis Aloksan ...58
9 Gambar Kegiatan Penelitian ...59
[image:12.595.119.506.126.717.2]BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Kadar gula (glukosa) darah merupakan refleksi dari keadaan nutrisi, dan
fungsi endokrin. Suatu keadaan ketika kadar glukosa darah sangat tinggi melebihi
kadar normal disebut hiperglikemia. Hiperglikemia umumnya terjadi akibat
kegagalan sekresi insulin dan atau kerja insulin (El-Soud et al., 2007).
Hiperglikemia juga dapat disebabkan apabila sel beta dalam pulau Langerhans
tidak dapat menghasilkan insulin atau mengalami defisiensi insulin. Defisiensi
insulin menyebabkan gangguan proses biokimia dalam tubuh, yaitu penurunan
asupan glukosa ke dalam sel dan peningkatan pelepasan glukosa dari hati ke
dalam sirkulasi darah. Kondisi tersebut dapat menyebabkan tingginya kadar gula
darah pada tubuh, jika kondisi ini berlanjut maka tubuh akan menderita diabetes.
Penyakit metabolik seperti diabetes cenderung meningkat, dimana angka
mortalitas dan morbiditas cukup tinggi. Perlu dicari suatu obat alternatif dari
bahan alami yang mengandung bahan aktif yang berfungsi sebagai penurun kadar
glukosa darah dan dapat mempercepat regenerasi sel beta pankreas.
Tumbuhan yang mengandung flavonoid, glikosida, alkaloid, terpenoid,
dan keratenoid mempunyai efek sebagai anti-diabetes (Kim et al., 2006).
Obat-obatan dari bahan kimia memiliki efek tertentu seperti menyebabkan hipoglikemia
pada dosis yang lebih tinggi, kerusakan pada hati, asidosis laktat dan diare (Helal
et al., 2003). Hal ini dikarenakan efek samping obat-obatan dari bahan kimia yang
digunakan, sehingga ada kebutuhan untuk agen yang tidak menimbulkan efek
samping selama masa pengobatan. Penggunaan tanaman obat yang mempunyai
potensi anti-diabetes dalam pengobatan modern penderita DM dapat mengurangi
resiko efek samping pada penggunaan dalam waktu yang lama. Salah satu
tanaman obat yang dapat digunakan sebagai tanaman obat anti-diabetes adalah
Aloe vera (lidah buaya).
Penelitian ini diharapkan dapat menemukan pengaruh maserat lidah buaya
2
tersebut, maka penelitian dilakukan dengan menggunakan hewan uji mencit putih
jantan yang diinduksi aloksan monohidrat yang dimaksudkan untuk merusak
sel-sel beta pankreas. Keberhasilan dari agen anti-hiperglikemia ini perlu dibuktikan
secara empiris salah satunya melalui pengamatan terhadap pankreas, yang
merupakan organ penghasil insulin. Penelitian ini dilakukan dengan melihat
histologi organ pankreas.
B. Rumusan Masalah
Berdasarkan latar belakang di atas, maka permasalahan yang ada pada
tugas akhir ini adalah “Bagaimana pengaruh pemberian maserat lidah buaya (Aloe
vera) terhadap histologi pankreas mencit (Mus musculus Swiss Webster) jantan
yang diinduksi aloksan?”.
Dari rumusan masalah yang ada maka dapat diuraikan menjadi beberapa
pertanyaan penelitian. Pertanyaan penelitian yang diajukan ialah:
1. Apakah pengaruh dari pemberian maserat lidah buaya (Aloe vera) terhadap
histologi pankreas mencit (Mus musculus Swiss Webster) jantan yang
diinduksi aloksan?
2. Berapakah dosis efektif maserat lidah buaya (Aloe vera) dalam
mempengaruhi histologi pankreas mencit (Mus musculus Swiss Webster)
jantan yang diinduksi aloksan?
C. Batasan Masalah
Dalam penelitian eksperimental ini, agar tidak menyimpang dari tujuan
yang hendak dicapai, maka pembahasan masalah dibatasi pada hal-hal sebagai
berikut:
1. Hewan uji yang digunakan adalah mencit jantan (Mus musculus Swiss
Webster) usia empat bulan.
2. Sampel daun Aloe vera didapat dari tempat budidaya lidah buaya di daerah
Subang.
3
4. Parameter yang diteliti adalah jumlah pulau Lengerhans dan luas
pulau Langerhans pankreas mencit (Mus musculus Swiss Webster) jantan
pada setiap perlakuan.
5. Dosis aloksan yang digunakan adalah 0,65 ml/100 gram BB yang
diberikan sekali pada awal perlakuan (Nugrahani, 2008).
6. Dosis ekstak Aloe vera yang digunakan terdiri dari 3 dosis, yaitu 0,70 ml/
100 gram BB/ hari; 1,05 ml/ 100 gram BB/ hari; 1,40 ml/ 100 gram BB/
hari.
D. Tujuan Penilitian
Tujuan penelitian ini adalah untuk mengetahui pengaruh pemberian
maserat lidah buaya (Aloe vera) terhadap histologi pankreas mencit (Mus
musculus Swiss Webster) jantan yang diinduksi aloksan, khususnya terhadap
jumlah dan luas pulau Langerhans.
E. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat
mengenai pengaruh pemberian maserat lidah buaya (Aloe vera) terhadap histologi
pankreas mencit (Mus musculus Swiss Webster) jantan yang diinduksi aloksan
serta dapat dijadikan referensi untuk penelitian selanjutnya.
F. Asumsi
1. Senyawa toksin, diabetogenik (aloksan) dapat membuat degenerasi sel β
Langerhans pankreas sehingga mengakibatkan produksi insulin sangat
rendah atau berhenti sama sekali (Nugroho, 2006).
2. Sel β merupakan terbanyak dalam pulau Langerhans, kerusakan sel β
pulau Langerhans dalam jumlah besar ditandai dengan penurunan jumlah
dan luas pulau Langerhans (Vessal et al., 2003).
3. Aloe emodin, antrakuinon, dan turunan zat flavonoid lainnya yang
terkandung didalam Aloe vera merupakan zat anti-hiperglikemia
4
4. Senyawa aktif golongan polifenol dan antioksidan pada tanaman
mempunyai aktivitas antioksidan dan anti-diabetes (Widowati, 1997).
5. Pemberian agen anti-diabetes masih dapat merangsang kemampuan sel β
Langerhans pankreas untuk mensekresi insulin (Helal et al., 2003).
G. Hipotesis
Berdasarkan asumsi-asumsi yang disebutkan, maka hipotesis yang
diajukan pada penelitian ini adalah pemberian maserat daun Aloe vera
berpengaruh terhadap histologi pankreas mencit jantan (Mus musculus Swiss
BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian
Metode penelitian yang dilakukan termasuk ke dalam penelitian
eksperimental. Penelitian eksperimental adalah penelitian yang dilakukan dengan
pengadaan manipulasi terhadap objek penelitian serta adanya kontrol (Nazir,
2003).
B. Desain Penelitian
Desain yang digunakan dalam penelitian ini adalah Rancangan Acak
Lengkap (RAL), dimana terdapat kelompok perlakuan dan kontrol dengan faktor
lingkungan yang homogen (Nazir, 2003). Kelompok hewan uji terdiri dari lima
kelompok. Kelompok perlakuan pemberian maserat Aloe vera terdiri dari tiga
kelompok. Masing-masing kelas diberi perlakuan dengan pemberian maserat daun
Aloe vera 0,70 ml/100 gram BB/hari; 1,05 ml/100 gram BB/hari; 1,40 ml/100
gram BB/hari. Kemudian terdapat kontrol netral, kelompok ini terdiri dari
kelompok mencit yang tidak diberi perlakuan, lalu kontrol positif, tidak diberi
maserat Aloe vera namun diberi aloksan. Banyaknya pengulangan (replikasi) yang
dilakukan diperoleh dari Gomez & Gomez (1995) yaitu:
(T – 1) (r – 1) > 15 (5 – 1) (r – 1) > 15 4r – 4 > 15
r > 19/4 Keterangan: T = jumlah perlakuan
r > 5 r = jumlah replikasi
Berdasarkan perhitungan tersebut, maka jumlah pengulangan yang
dilakukan untuk setiap perlakuan ialah r > 5. pengulangan yang dibutuhkan pada
setiap kelompok sebanyak 5 kali atau 5 ekor mencit sehingga jumlah total mencit
yang digunakan sebanyak 25 ekor ditunjukkan dari hasil perhitungan diatas.
18
menunjukkan kelompok yang berbeda. Setelah itu, randomisasi dilakukan untuk
pengelompokan setiap mencit sehingga didapatkan kelompok mencit yang akan
menempati setiap kandang.
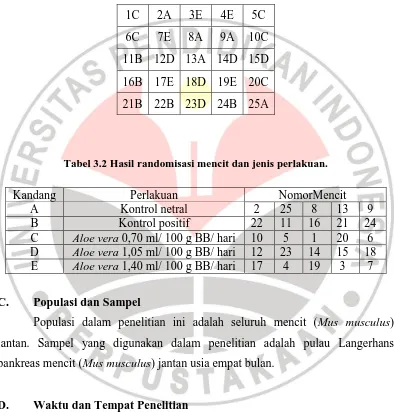
Tabel 3.1 Pengaturan Randomisasi Mencit.
1C 2A 3E 4E 5C
6C 7E 8A 9A 10C
11B 12D 13A 14D 15D
16B 17E 18D 19E 20C
[image:18.595.116.510.223.641.2]21B 22B 23D 24B 25A
Tabel 3.2 Hasil randomisasi mencit dan jenis perlakuan.
Kandang Perlakuan NomorMencit
A Kontrol netral 2 25 8 13 9
B Kontrol positif 22 11 16 21 24
C Aloe vera 0,70 ml/ 100 g BB/ hari 10 5 1 20 6 D Aloe vera 1,05 ml/ 100 g BB/ hari 12 23 14 15 18 E Aloe vera 1,40 ml/ 100 g BB/ hari 17 4 19 3 7
C. Populasi dan Sampel
Populasi dalam penelitian ini adalah seluruh mencit (Mus musculus)
jantan. Sampel yang digunakan dalam penelitian adalah pulau Langerhans
pankreas mencit (Mus musculus) jantan usia empat bulan.
D. Waktu dan Tempat Penelitian
Perlakuan dilakukan di kandang mencit pribadi di Geger Kalong,
Bandung. Pengamatan sampel dilakukan di Laboratorium Struktur Tumbuhan
Jurusan Pendidikan Biologi FPMIPA UPI Bandung. Waktu yang digunakan untuk
19
E. Prosedur Penelitian
1. Tahap Persiapan
a. Persiapan Alat dan Bahan
Alat dan bahan yang diperlukan dalam penelitian dipersiapkan. Daftar alat
dan bahan yang digunakan dalam penelitian yang digunakan terdapat pada
Lampiran 7.
b. Persiapan Hewan Uji Coba (Mus musculus)
Hewan yang digunakan adalah 25 ekor mencit (Mus musculus) jantan
albino dengan berat sekitar (20-30 gram). Mencit ini didapat pertama kali saat
berumur tiga bulan dan sebelum ke tahap perlakuan, seluruh hewan percobaan
diaklimatisasi selama 30 hari hingga usianya mencapai empat bulan.
Penimbangan berat badan dilakukan selama aklimatisasi dan selama perlakuan.
Dua puluh lima ekor mencit (Mus musculus) ini dipelihara dalam lima kandang
yang dipelihara di rumah di kawasan Geger Kalong. Kandang mencit terbuat dari
wadah plastik berukuran 28 cm x 30 cm x 12 cm. Wadah plastik diberi medium
tempat hidup mencit berupa serutan kayu. Bagian atas bak ditutupi ram kawat
untuk mencegah mencit keluar dari kandang. Kandang diberi tempat minum
mencit sebanyak satu buah setiap kandang. Keadaan selama aklimatisasi dan
perlakuan dikontrol pada kisaran lingkungan yang tetap dengan tujuan agar hewan
uji beradaptasi dengan kondisi yang akan ditempati selama percobaan. Selama
percobaan suhu ruangan berkisar antara 23oC-27oC. Makanan yang diberikan
adalah PC 551 sebanyak 5 gram/ekor mencit dan minum berupa air matang
dengan cara ad libitum. Pencahayaan dilakukan selama 12 jam/hari dari pukul
06.00 WIB hingga 18.00 WIB.
c. Pembuatan Maserat Lidah Buaya (Aloe vera)
Pembuatan maserat lidah buaya dilakukan dengan. Metode maserasi atau
perendaman (Pachanawan et al., 2008) dengan beberapa modifikasi. Pelarut yang
20
adalah daun lidah buaya yang berasal dari perkebunan lidah buaya di Subang,
Jawa Barat. Determinasi didasarkan pada buku klasifikasi Conqruist. Dilanjutkan
dengan pemilihan daun yang berdaging banyak.
Tanaman direndam pada pelarut dengan perbandingan 1:2 (w/v), pada
penelitian ini digunakan 500 gram potongan gel yang telah dianginkan selama 48
jam untuk menghilangkan eksudatnya dan dilarutkan dalam 1 L alkohol 70%.
Perendaman dilakukan selama 72 jam untuk melarutkan komponen bioaktifnya
kemudian dilakukan penyaringan bertahap untuk memisahkan larutan dengan
ampas potongan tanaman. Terakhir dilakukan evaporasi alkohol pada suhu ruang
untuk menghasilkan ekstrak dalam akuades. Hasil ekstrak akhir diuji
kandungannya dengan menggunakan GCMS OP-2010 Ultra yang dilakukan di
Laboratorium Kimia Analitik UPI Bandung.
2. Tahap Pelaksanaan
a. Penginduksian Aloksan
Aloksan merupakan derivat pirimidin sederhana yang merusak sel beta
pankreas sehingga menurunkan produksi insulin. Pada tahap pelaksanaan ini
dilakukan induksi pemberian aloksan untuk menciptakan keadaan hiperglikemik
pada mencit (Mus musculus). Aloksan yang didapatkan dalam bentuk serbuk 10
gram yang kemudian dilarutkan dengan akuades sebanyak 1 L. Dalam percobaan
ini mencit disuntikan aloksan sebanyak 0,65 ml/ 100 gram BB secara intravena
melalui ekor (Nugrahani, 2008). Hewan percobaan yang telah diadaptasi selama 1
minggu diinduksi dengan aloksan 0,65 ml/ 100 gram BB secara intravena melalui
ekornya. Pemberian aloksan dilakukan satu sekali lalu untuk melihat pengaruhnya
dilakukan optimasi selama 72 jam (Simanjuntak et al., 2002).
b. Pemberian Maserat Aloe vera
Pemberian maserat Aloe vera dilakukan selama 30 hari secara gavage, satu
kali dalam sehari. Tiap mencit dalam kelompok perlakuan diberi maserat Aloe
21
perlakuan. Jarum gavage digunakan pada saat pemberian maserat lidah buaya
terhadap hewan uji, dimana hewan percobaan dibagi 5 kelompok :
a. Kelompok I adalah kelompok kontrol netral yang tidak diberi induksi
apapun.
b. Kelompok II adalah kelompok kontrol positif yaitu hewan yang diberi
induksi aloksan namun tidak diberi maserat Aloe vera.
c. Kelompok III adalah kelompok hewan hasil induksi aloksan yang diberi
maserat lidah buaya dengan dosis 0,70 ml/ 100 gram BB/ hari
d. Kelompok IV adalah kelompok hewan hasil induksi aloksan yang diberi
maserat lidah buaya dengan dosis 1,05 ml/ 100 gram BB/ hari.
e. Kelompok V adalah kelompok hewan hasil induksi aloksan yang diberi
maserat lidah buaya dengan dosis 1,40 ml/ 100 gram BB/ hari.
Penggunaan tabel konversi Laurence & Bacharach (1964) digunakan
dalam penentuan dosis yang didasarkan pada penelitian yang pernah dilakukan
pada tikus putih dengan nilai konversi tikus putih 200 gram ke mencit 20 gram
senilai 0,14 (Lampiran 7).
3. Tahap Pembuatan Preparat Histologi Pankreas
a. Pengambilan Organ Pankreas
Pada akhir perlakuan (hari ke-30 pasca induksi aloksan dan maserat Aloe
vera) semua mencit dilakukan pembedahan dengan penyayatan pada kulit dan otot
abdominal hingga rongga perut terbuka. Selanjutnya dilakukan pengambilan
organ pankreas. Pankreas yang telah dipisahkan dari tubuh hewan dibersihkan
dengan larutan NaCl 0,9% lalu diukur panjang dan beratnya. Setelah itu, organ
pankreas difiksasi dengan formalin 10% sampai tahap pembuatan blok parafin.
b. Pembuatan Preparat Histologi
Pembuatan preparat histopatologi pada organ pankreas dilakukan
dengan prosedur sebagai berikut;
i. Fiksasi
22
ii. Dehidrasi
Pankreas yang sudah difiksasi dengan formalin dipindahkan kedalan
larutan alkohol bertingkat (60 %, 70 %, 80 %, 90 %, 96 %, alkohol absolut)
masing-masing selama 2 jam.
iii. Penjernihan
Setelah itu organ dimasukan kedalam larutan alkohol absolut yang
dicampur dengan xilol (1:1) selama 10 menit. Kemudian organ dipindahkan
kedalam xilol murni selama 15 menit.
iv. Penanaman
Organ yang sudah jernih dipindahkan kedalam campuran xilol parafin
lunak (1:1) lalu dimasukan kedalam oven dengan suhu 48oC selama 30 menit.
Setelah itu dipindahkan kedalam parafin lunak murni lalu dimasukan kembali
kedalam oven dengan suhu 48oC selama 1 jam. Lalu dipindahkan lagi kedalam
parafin keras dan dimasukan kedalam oven 58oC selama 1.5 jam. Setelah itu
dilakuakan embedding (penanaman organ di blok) dengan ukuran blok 2x1.
v. Penyayatan
Setelah pembuatan blok selesai diamkan blok parafin sampai keras dan
siap untuk disayat. Setelah itu masing-masing blok disayat dengan ketebalan 4
(empat) mikron dengan alat mikrotom, lalu lembaran-lembaran atau pita parafin
hasil penyayatan dilekatkan diatas object glass yang sudah diberi larutan Haupt
dan akuades dan dapat dilakukan pewarnaan.
c. Pewarnaan Hematoksilin Eosin
Pewarnaan yang akan dilakukan adalah pewarnaan hematoxylin-eosin.
Pewarnaan hematoksilin-eosin (HE) termasuk dalam jenis pewarnaan ganda
(double straining) karena dua jenis zat warna digunakan untuk pengamatan
struktur umum jaringan. Pada pewarnaan ganda umumnya pewarna yang
digunakan satu bersifat asam dan yang lain bersifat basa. Kekontrasan dan
pengenalan bagian tertentu dapat lebih cepat dan lebih jelas terlihat disebabkan
23
Tahapan yang dilakukan dalam pewarnaan HE dimulai dengan proses
deparafinisasi, yaitu penghilangan parafin dengan memasukkan preparat ke dalam
seri larutan xilol III, xilol II, dan xilol I. Kemudian dilanjutkan dengan proses
rehidrasi, yaitu dengan memasukkan preparat ke dalam seri larutan alkohol
absolut sampai alkohol 70% secara berurutan. Preparat diwarnai dengan pewarna
hematoksilin dilanjutkan dengan pencucian dalam akuades. Setelah itu preparat
diwarnai dengan eosin lalu preparat dimasukan kedalam alkohol bertingkat mulai
alkohol 70% sampai alkohol absolut setelah itu dilakukan penjernihan (clearing)
dengan xilol murni. Sediaan ditutup dengan cover glass (mounting) dan siap untuk
dilakukan pengamatan di bawah mikroskop.
4. Pengamatan dan Analisis Data
Parameter pengamatan adalah perubahan gambaran histologi pankreas
mencit secara kuantitatif, yaitu jumlah pulau Langerhans dan luas pulau
Langerhans. Penghitungan dilakukan dengan menggunakan mikroskop cahaya,
dan mikrometer serta didokumentasikan dengan pemotretan menggunakan digital
camera (Nikon Coolpix S4100). Penghitungan jumlah pulau Langerhans,
dilakukan pada tiga lapang pandang pada satu preparat pada perbesaran 1000x
yang berbeda secara acak pada setiap preparat jaringan. Penghitungan luas pulau
Langerhans dilakukan satu lapang pandang pada satu preparat pada perbesaran
1000x yang berbeda secara acak pada setiap preparat jaringan. Data yang
didapatkan diuji nilai normalitas, homogenitas dan signifikansinya.
Test of Normality (Kolmogorov-Smimov) digunakan untuk uji normalitas
dan Test of Homogenity of Variances (Levene Statistic) digunakan untuk uji
homogenitas. Data yang berdistribusi normal atau bervarian homogen dianalisis
secara statistik parametrik yaitu, analisis varian (ANOVA). Data yang memiliki
nilai signifikansi dibawah 0,5 pada uji ANOVA kemudian diuji lebih lanjut dengan
uji lanjut Post Hoc LSD untuk mengetahui data yang tidak memiliki perbedaan
signifikan terhadap data lainnya. Software PASW Statistics 18 digunakan untuk
24
5. Alur Penelitian
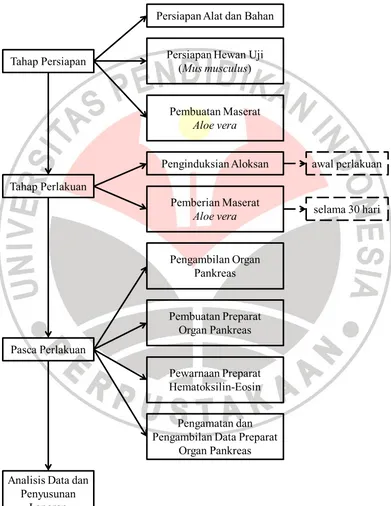
Urutan penjelasan mengenai prosedur penelitian yang akan dilakukan
[image:24.595.117.508.193.699.2]BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Hasil penelitian yang telah dilakukan menunjukkan bahwa pemberian
maserat Aloe vera dapat memperbaiki kerusakan pada pankreas yang disebabkan
oleh induksi aloksan. Perbaikan tersebut dilihat dari meningkatnya jumlah dan
luas pulau Langerhans pankreas mencit. Dosis maserat Aloe vera 0,70 ml/100
gram BB merupakan dosis efektif dalam perbaikan pulau Langerhans pankreas
mencit.
B. Saran
Penelitian perlu dilanjutkan dengan pewarnaan imunohistokima untuk
mengetahui korelasi lebih spesifik antara distribusi sel β pankreas dengan
perbaikan pulau Langerhans. Waktu pemberian maserat Aloe vera perlu ditambah
DAFTAR PUSTAKA
Ansel, H. C. (1989). Pengantar Bentuk Sediaan Farmasi. Jakarta: UI Press.
Banerjee, M. & Bhonde, R. R. (2003). Islet Generation From Intra Islet
Precursor Cells of Diabetic Pancreas: In Vitro Studies Depicting In Vivo
Differentiation. Jop,4(4), 137-145.
Baynes, J. W. & Dominiczak, M. H. (2005). Medical Biochemistry (2nd ed.).
China: Elsivier Mosby.
Bernard, C., Berthault, M. F., Saulnier, C., & Ktorza, A. (1999). Neogenesis vs.
Apoptosis as Main Components of Pancreatic β Cell Mass Changes in
Glucose-Infused Normal and Mildly Diabetic Adult Rats, FASEB Journal,
13:1195-1205.
Bloom, H., Briggs, L. H., & Cleverley, B. (1959). Physical Properties of
Anthraquinone and Its Derivatives. Part I. Infrared spectra. Journal of the
Chemical Society (Resumed), 33: 178-185.
Boorman, G. A., & Beth, W. G. (1999). Pathology of The Mouse. USA: Cache
River Press. Pp 191-193.
Butler, A. E., Janson, J., Bonner-Weir, S., Ritzel, R., Rizza, R. A., & Butler, P. C.
(2001). Cell Deficit and Increased Cell Apoptosis in Humans with Type 2
Diabetes. Diabetes, 32: 102-110.
Conqruist, A. (1981). An Integrated System of Classification of Flowering Plants.
New York: Columbia University Press.
Doxey. (1995). Platelet-Derived Growth Factor Levels in Wounds of Diabetic
Rat. Life Sciences, 1111-1123.
El-Soud, N. H., Khalil, M. Y., Hussein, J. S., Oraby, F., & Farrag, A. H. (2007).
Antidiabetic Effects of Fenugreek Alkaliod Extract in Streptozotocin
Induced Hyperglycemic Rats. Journal of Applied Sciences Research,
1073-1083.
Fit. (1983). Aloe vera: The Miracle Plant. Anderson World Books. Inc., Mountain
39
Furnawanthi, I. (2002). Khasiat dan Manfaat Lidah Buaya. Agro Media Pustaka.
Jakarta.
Ganiswarna. (1995). Farmakologi dan Terapi. Ed ke-4. Diterjemahkan oleh
Rianto Setiabudy, dkk. Jakarta: FKUI.
Gerritson M. E., Carley W. W., Ranges G. E., Shen C. P., & Phan S. A. (1995).
Flavonoids Inhibit Cytokine-Induced Endothelial Cell Adhesion Protein
Gene Expression. Am J Pathol, 147(2): 278-92.
Gomez K. A., & Gomez A. A. (1995). Statistical For Agricultural Research.
USA: John Wiley & Son. Inc.
Guyton A. C. (1997). Buku Ajar Fisiologi Kedokteran. Diterjemahkan oleh
Irawati Setiawan. Jakarta: EGC.
Guz, Y., Nasir, I., & Teitelman, G. (2001). Regeneration of Pancreatic β Cells
From Intra-Islet Precursor Cells in an Experimental Model of Diabetes.
Endocrinology, 142(11): 4956-4968.
Hamman, J. H. (2008). Composition and Applications of Aloe vera Leaf Gel.
Journal of Molecules, 13: 1599-1616.
Handa, S. S., Khanuja, S. P. S., Longo, G., & Rakesh, D. D. (2008). Extraction
Technologies for Medicinal and Aromatic Plants. Trieste: International
Centre for Science and High Technology.
Harborne, J. B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisa
Tetumbuhan. Bandung. ITB.
Helal, E. G., Hasan, M. H., Mustafa, A. M., & Al-Kamel, A. (2003). Effect of
Aloe vera Extract on Some Physiological Parameters in Diabetic Albino
Rats. The Egyptian Journal of Hospital Medicine, 53-61.
Henry, R. (1979). An Up Dated Review of Aloe vera. Cosm. and Toiletri, 94: 2-50
Heyne, K. (1987). Tumbuhan Berguna Indonesia. Jilid 1. Badan Litbang
Kehutanan (Penerjemah), Yayasan Sarana Wana Jaya. Jakarta.
Hii, C. S. T. & Howell, S. L. (1985). Effects of Flavonoids on Insulin Secretion
and 45Ca2+ Handling in Rat Islets of Langerhans. Journal of
40
Hu, Y., Xu, J., & Hu, Q. (2003). Evaluation of Antioxidant Potential of Aloe vera
(Aloe barbadensis Miller) extracts. Journal of Agricultural and Food
Chemistry, 51(26), 7788-7791.
IM Walde, S. S., Dohle, C., Schott-Ohly, P., & Gleichmann, H. (2002). Molecular
Target Structures in Alloxan Induced diabetes in mice. Life Sciences,
71(14), 1681-1694.
Irianto K. (2004). Struktur dan Fungsi Tubuh Manusia untuk Paramedis.
Bandung: Irama Widya.
Kalaivani, A., Umamaheswari, A., Vinayagam, A., & Kalaivani, K. (2008).
Anti-Hyperglycemic and Antioxidant Properties of Cassia Auriculataleaves and
Flowers on Alloxan Induced Diabetic Rats. Pharmacologyonline, 204-217.
Kim, J. S., Ju , J. B., Choi , C. W., & Kim, S. C. (2006). Hypoglycemic and
Antihyperlipidemic Effect of Four Korean Medicinal Plants in Alloxan
Induced Diabetic Rats. American Journal of Biochemistry and
Biotechnology, 154-160.
Klein, G., Kim, J., Himmeldirk, K., Cao, Y., & Chen, X. (2007). Antidiabetes and
Anti-obesity Activity of Lagerstroemia speciosa. Antidiabetic compounds
from banaba, 401–407.
Laurence, D. R. & Bennet, P. N. (1992). Clinical Pharmacology. Ed ke-7. New
York: Churcil Livingstone.
Laurence J., & Bacharach, M. (1964). Analytical Toxology. Philadelphia: CRC
Press.
Lienhard, G. E., Slot, J. W., James, D. E., & Mueckler, M. M. (1992). How Cells
Absorb Glucose. Scientific American, 86-91.
Malaisse, W. J., Lagae, F. M., Sener, A. & Pipeleers, D. G. (1982). Determinants
of The Selective Toxicity of Alloxan to The Pancreatic B Cell. Proc. Nad
Acad. Sci. USA 79 , 927-930.
Mukkamala, Ravindranath, Weiss, & Richard G. (1996). Physical Gelation of
Organic Fluids by Anthraquinone-Steroid-Based Molecules. Structural
41
Musthafa, Z. (2000). Peran Antioksidan dalam Penghambatan Aterosklerosis
pada Tikus Wistar Diabetes Melitus. Cermin Dunia Kedokteran, 32-33.
Moriwaki, K. (1994). Genetic in Wild Mice. Its Application to Biomedical
Research. Tokyo: Karger.
Morsy, E. M. (1991). The Final Technical Report of Aloe vera: Stabilization and
Processing for The Cosmetics Beverage and Food Industries. Aloe
Industry and Technology Institute. Phoenix. USA.
Nazir, Moh. (2003). Metode Penelitian. Ghalia Indonesia. Jakarta.
Nihlatussania, S. (2012). Keefektifan Insektisida Nabati dengan Dua Metode
Ekstraksi yang Berbeda. Bogor: IPB.
Nugrahani, A. R. (2008). Uji Penurunan Kadar Glukosa Darah Infusa Herba
Daun Sendok (Plantago mayor L.) pada Kelinci Jantan yang Dibebani
Glukosa. Surakarta. UMS.
Nugroho, A. E. (2006). Hewan Percobaan Diabetes Mellitus: Patologi Dan
Mekanisme Aksi Diabetogenik. Biodiversitas, 378-382.
Noor, A., Gunasekaran, S., Soosai Manickam, A., & Vijayalakshmi, M. A.
(2008). Antidiabetic Activity of Aloe vera and Histology of Organs in
Streptozotocin-Induced Diabetic Rats. Current science, 94(8), 1070-1076.
Nuraliev, I. U. N., & Avezov, G. A. (1992). The Efficacy of Quercetin in Alloxan
Diabetes. Eksperimental'naia i klinicheskaia farmakologiia, 55(1), 42.
Pachanawan A, Pumkhachorn P, & Rattanachaikunsopon P. (2008). Potential of
Psidium guajava Supplemented Fish Diets in Controlling Aeromonas
hydrophila Infection in Tilapia (Oreochromis niloticus). International
Journal of Pharma and Bio Sciences, 106: 419–424.
Pecere, T., Gazzola, M.V., Mucignat, C., Parolin, C., Vecchia, F.D., Cavaggioni,
A., Basso, G., Diaspro, A., Salvato, B., Carli, M. & Palu, G. (2000).
Aloe-emodin is a new type of anticancer agent with selective activity against
neuroectodermal tumor. Cancer Res, 60: 2800–2804.
Purwaningsih S., Salamah E., & Ayuningrat, E. (2008). Penapisan awal
komponen bioaktif dari kijing taiwan (Anadonta woodiana Lea.) sebagai
42
Ressang A. A. (1963). Patologi Khusus Veteriner. Denpasar: Bali Cattle Desease.
Rattan, S. I. S., Eskildsen-Helmond, Y. E. G., & Beedholm, R. (2004). Molecular
Mechanisms of Anti-Aging Hormetic Effects of Mild Heat Stress on
Human Cells. Biol Toxicol Med, 2(2): 105–16.
Runiana, E. D. (2009). Distribusi Sel Insulin Pankreas pada Tikus Hiperglikemia
yang Diberi Diet Tempe. Bogor: IPB.
Schloithe, Ann C., Woods. C. M., & Saccone, Gino T. P. (1995). An isolated rat
pancreas preparation for studying pancreatic spinal mechano sensitive
and chemosensitive afferent activity. Department of Surgery. Flinders
University. Adelaide, South Australia.
Scoebi, Ian N. (2007). Atlas of Diabetes Mellitus 3th. Informa. UK Ltd.
Setijono, M. M. (1985). Mencit (Mus musculus) Sebagai Hewan Percobaan.
Bogor: Institut Pertanian Bogor.
Sherwood, L. (2001). Fisiologi Manusia: Dari Sel ke Sistem. Ed ke-2.
Diterjemahkan: Brahn U. Jakarta: Penerbit Buku Kedokteran EGC.
Simanjuntak JW, Badjongga HT, Yulinah, & Andreanus AS. (2002). Pengaruh
Ekstrak Etanol Akar Pasak Bumi (Eurycoma longifolia jack) pada Organ
Reproduksi, Testosteron dan Perilaku Seksual Tikus Sprague Dawley
Jantan dan Mencit ddY Jantan. Sekolah Farmasi. Bandung. ITB.
Skinner, H. A. (1949). The Origin of Medical Term. The Williams and Wilkins.
Baltimore.
Slack, J. M. W. (1995). Developmental Biology of The Pancreas. ICRF
Developmental Biology Unit, Department of Zoology, Oxford University,
South Parks Road, UK.
Squires, J. E. (2003). Applied Animal Endocrinology. UK: CABI Publishing.
Szkudelski, T. (2001). The Mechanism of Alloxan and Streptozotocin Action in B
Cells of The Rat Pancreas. Physiological Research, 50(6), 537-546.
Tjokroprawiro, A. (2001). Diabetes Melitus, Klasifikasi, Diagnosa dan Terapi.
Gramedia Pustaka Utama.
43
Vesal, M., Zal, F., & Vaseei, M. (2003). Effects of Teucrium Polium on Oral
Glucose Tolerance Test, Regeneration of Pancreatic Islets and Activity of
Hepatic Glucokinase in Diabetic Rats. Archives of Iranian Medicine, 6(1):
35-39.
Voigt, R. (1994). Buku Pelajaran Teknologi Farmasi. Universitas Indonesia.
Jakarta.
Watkins D, Cooperstein SJ, & Lazarow. (2008). A. Effect of alloxan on
permeability of pancreatic islet tissue in vitro.
Widowati , W. (2008). Potensi Antioksidan Sebagai Antidiabetes. JKM, 1-11.
Widowati, L., Dzulkarnain, B., & Sa'roni. (1997). Tanaman Obat untuk Dibetes
Mellitus. Cermin Dunia Kedokteran, 53-60.
Winarto, A. (2007). Pengaruh Minyak Buah Merah (Pandanus conoideus Lam.) Terhadap Gambaran Sel β Pankreas dan Efek Hipoglikemik Glibenklamid pada Tikus Jantan galur wistar Diabetik. Fakultas Kedokteran Hewan.
Bogor: IPB.
Yagi, A. (1997). Isolation and Characterization of The Glycoprotein Fraction
with Aproliferation-Promoting Activity on Human and Hamster Cells