i
HASIL BELAJAR
Studi Kasus Pembelajaran Kimia Materi Pokok Termokimia Kelas XI IA Semester Gasal di SMA Muhammadiyah I Surakarta
Tahun Pelajaran 2010/2011
SKRIPSI
Oleh
ATIK PUJIRAHAYU K 3306013
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN UNIVERSITAS SEBELAS MARET
ii
HASIL BELAJAR
(Studi Kasus Pembelajaran Kimia Materi Pokok Termokimia Kelas XI IA Semester Gasal di SMA Muhammadiyah I Surakarta Tahun Ajaran 2010/2011)
Oleh:
ATIK PUJIRAHAYU K 3306013
Skripsi
Ditulis dan Diajukan untuk Memenuhi Syarat Mendapatkan Gelar Sarjana Pendidikan Program Studi Pendidikan Kimia Jurusan Pendidikan
Matematika dan Ilmu Pengetahuan Alam
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN UNIVERSITAS NEGERI SEBELAS MARET
iii Surakarta.
Persetujuan Pembimbing
Pembimbing I
Dr. rer.nat. Sri Mulyani M.Si NIP. 196509161991032003
Pembimbing II
iv
untuk memenuhi persyaratan mendapatkan gelar Sarjana Pendidikan.
Pada hari : Tanggal :
Tim Penguji Skripsi :
Nama Terang Tanda Tangan
Ketua : Dra. Tri Redjeki, M.S ...
Sekretaris : Prof. Dr. Ashadi ... Anggota I : Dr. rer.nat. Sri Mulyani, M.Si ...
Anggota II : Dra. Kus Sri Martini, M.Si ...
Disahkan oleh :
Fakultas Keguruan dan Ilmu Pendidikan Universitas Sebelas Maret
Dekan
v
CATATAN TERBIMBING UNTUK MENINGKATKAN KUALITAS PROSES DAN HASIL BELAJAR. (Studi Kasus Pembelajaran Kimia Materi Pokok Termokimia Kelas XI IA Semester Gasal di SMA Muhammadiyah I Surakarta Tahun Ajaran 2010/2011). Skripsi. Surakarta: Fakultas Keguruan dan Ilmu Pendidikan Universitas Sebelas Maret. Januari. 2011.
Tujuan dari penelitian ini adalah untuk mengetahui (1) apakah pembelajaran kooperatif Student Team Achievement Divisions disertai eksperimen dan catatan terbimbing dapat meningkatkan kualitas proses belajar siswa pada materi pokok termokimia, (2) apakah pembelajaran kooperatif Student Teams Achievement Divisions disertai eksperimen dan catatan terbimbing dapat meningkatkan hasil belajar siswa pada materi pokok termokimia.
Penelitian ini merupakan Penelitian Tindakan Kelas (Classroom Action Research) yang terdiri dari dua siklus. Setiap siklusnya terdapat empat tahapan yang terdiri dari perencanaan tindakan, pelaksanaan tindakan, observasi, dan refleksi. Subyek penelitian adalah siswa kelas XI-IA1 SMA Muhammadiyah 1
SurakartaTahun Ajaran 2010/2011. Data diperoleh melalui observasi, wawancara, angket, kajian dokumen, dan tes. Teknik analisis data yang digunakan adalah analisis deskriptif kualitatif.
vi
vii
EXPERIMENT AND GUIDED NOTE TAKING TO IMPROVE THE
QUALITY OF LEARNING PROCESS AND STUDENTS’
ACHIEVEMENT. (Study of Chemistry Learning in the Subject Matter of Thermochemistry of Class XI IA Semester 1 of SMA Muhammadiyah 1 Surakarta in Academic Year 2010/2011). Thesis. Surakarta: The Faculty of Teacher Training and Education of Sebelas Maret University. January. 2011.
The aims of the research are (1) to improve the quality of learning process of chemistry in the subject matter of thermochemistry by cooperative learning using Student Team Achievement Division method assisted by experiment and guided note taking, (2) to improve the student achievement of chemistry in the subject matter of thermochemistry by cooperative learning using Student Team Achievement Division method assisted by experiment and guided note taking.
The research was a Classroom Action Research that was held in two cycles. The implementation phase of the cycle, consist of planning, acting, observing, and reflecting. The research subject was the students of class XI-IA1
of SMA Muhammadiyah 1 Surakarta academic year 2010/2011. The data were obtained by observation, interview, quetionnaire, documentation, and test. We use descriptive qualitative technique to analize the data.
viii
ix
Kasih sayang Allah pasti datangnya, meski terasa nun jauh di sana, Ia akan tiba laksana
kerdipan mata bila sudah saatnya...
(Dr. Aidh Al-Qarni)
Suatu kehidupan yang penuh kesalahan tak hanya lebih berharga, namun juga lebih berguna
dibandingkan hidup tanpa melakukan apapun
(Alexander Graham Bell)
Setiap manusia memiliki skenario yang berbeda dalam kehidupan dan yang terpenting adalah
menjalani skenario itu sebaik mungkin
x
Bapak dan Ibuku tercinta terima kasih atas doa dan
motivasinya selama ini
Adikku yang memberikan semangat
Saudara seatapku di Vasatro
Kawan seperjuangan Chemistry Education 2006
xi dapat menyelesaikan skripsi ini.
Skripsi ini disusun untuk memenuhi sebagian persyaratan dalam mendapatkan Gelar Sarjana Pendidikan Kimia Jurusan Pendidikan Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta.
Penulis menyadari bahwa tanpa bantuan, saran, dorongan, dan perhatian dari berbagai pihak, skripsi ini tidak dapat diselesaikan dengan baik. Dalam kesempatan ini dengan segenap kerendahan hati perkenankan penulis menghaturkan terima kasih kepada:
1. Bapak Prof. Dr. H. M. Furqon Hidayatullah, M.Pd, selaku Dekan Fakultas Keguruan dan Ilmu Pendidikan, Universitas Sebelas Maret Surakarta yang telah memberikan izin penyusunan Skripsi.
2. Ibu Dra. Kus Sri Martini, M.Si, selaku Ketua Jurusan P.MIPA, yang telah menyetujui atas permohonan penyusunan skripsi ini sekaligus sebagai pembimbing II yang telah memberikan bimbingan, pengarahan, dorongan, dan perhatian sehingga memperlancar penulisan skripsi ini.
3. Ibu Dra. Tri Redjeki, M.S, selaku ketua Program Pendidikan Kimia yang telah memberikan pengarahan dan izin penyusunan skripsi ini sekaligus sebagai ketua penguji.
4. Prof. Dr. Ashadi selaku sekretaris penguji terima kasih atas kesediaan waktunya.
5. Dr. rer. nat. Sri Mulyani, M.Si, selaku pembimbing I yang telah memberikan bimbingan, pengarahan, dorongan, dan perhatian sehingga skripsi ini dapat terselesaikan.
6. Drs. J.S. Sukardjo, M.Si selaku Pembimbing Akademik yang telah mensuport dan memberikan perhatiannya selama ini.
xii
1
atas kerjasamanya.
10. Bapak dan Ibu tersayang yang senantiasa memberikan yang terbaik, kasih sayang, dan semangat bagi penulis.
11. Adikku “Adi” yang membuatku semangat.
12. Arista, Muyassaroh, Siska, Rosa, Siti, Kikie, Wulan, Susi, Sona, Ester, dan Sahabat-sahabatku di kimia 2006 untuk segala dukungan, persahabatan, dan bantuannya.
13. Keluarga seatapku di “Vasatro” yang senantiasa menjadi tempat berbagi. 14. Semua pihak yang telah membantu terlaksananya penelitian ini.
Penulis menyadari sepenuhnya skripsi yang telah dikerjakan ini masih jauh dari kesempurnaan maka penulis menerima kritik dan saran yang bersifat membangun demi kesempurnaan penulisan dimasa yang akan datang.
Akhirnya penulis berharap semoga karya ini bermanfaat bagi perkembangan ilmu pengetahuan.
Surakarta, Januari 2011
xiii
HALAMAN PENGAJUAN ... ii
HALAMAN PERSETUJUAN ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN ABSTRAK ... v
HALAMAN ABSTRACT ... vii
HALAMAN MOTTO ... ix
HALAMAN PERSEMBAHAN ... x
KATA PENGANTAR ... xi
DAFTAR ISI ... xiii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xix
BAB I. PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Identifikasi Masalah ... 3
C. Pembatasan Masalah ... 4
D. Perumusan Masalah... 5
E. Tujuan Penelitian ... 5
F. Manfaat Penelitian ... 6
BAB II. LANDASAN TEORI ... 8
A. Tinjauan Pustaka ... 8
1. Metode Pembelajaran ... 8
a. Pembelajaran Kooperatif ... 9
b. Metode Kooperatif STAD ... 12
2. Eksperimen Laboratorium ... 16
3. Catatan Terbimbing (Guided Note Taking)... 18
xiv
d. Jenis-Jenis Perubahan Entalpi Standar ( H) ... 25
e. Penentuan Entalpi Reaksi ... 28
f. Hukum Hess atau Hukum Penjumlahan Kalor ... 32
g. Energi Ikatan dan Entalpi Reaksi ... 35
5. Kualitas Proses Pembelajaran ... 40
6. Hasil Belajar ... 41
B. Kerangka Berpikir ... 41
C. Hipotesis Tindakan ... 44
BAB III. METODOLOGI PENELITIAN ... 45
A. Tempat dan Waktu Penelitian ... 45
1. Tempat Penelitian ... 45
2. Waktu Penelitian ... 45
B. Subjek dan Objek Penelitian ... 46
C. Metode Penelitian ... 46
D. Data dan Teknik Pengumpulan Data ... 47
1. Data Penelitian ... 47
2. Teknik Pengumpulan Data ... 47
a. Observasi ... 47
b. Wawancara ... 48
c. Angket ... 49
d. Kajian Dokumen ... 50
e. Metode Tes ... 50
E. Instrumen Penelitian ... 51
1. Instrumen Pembelajaran ... 51
a. Silabus ... 51
b. Rencana Pelaksanaan Pembelajaran ... 51
2. Instrumen Penilaian ... 51
xv
F. Analisis Data ... 61
G. Validitas Data ... 62
H. Prosedur Penelitian ... 63
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 69
A. Deskripsi Kondisi Awal ... 69
B. Deskripsi Hasil Siklus I ... 71
1. Perencanaan Tindakan ... 71
2. Pelaksanaan Tindakan ... 72
C. Deskripsi Hasil Siklus II ... 76
1. Perencanaan Tindakan ... 76
2. Pelaksanaan Tindakan ... 77
D. Hasil Pengamatan ... 77
E. Refleksi Tindakan ... 89
F. Pembahasan ... 93
BAB V. KESIMPULAN, IMPLIKASI DAN SARAN ... 98
A. Kesimpulan ... 98
B. Implikasi ... 98
C. Saran ... 99
DAFTAR PUSTAKA ... 100
LAMPIRAN ... 103
xvi
Tabel 2 Penghargaan Tim ... 14
Tabel 3 Kalor Pembentukan Standar ... 25
Tabel 4 Kalor Pembakaran Standar ... 26
Tabel 5 Alat dan Bahan ... 29
Tabel 6 Hasil Pengamatan ... 30
Tabel 7 Energi Ikatan Molekul Diatom ... 35
Tabel 8 Kalor Pembentukan Atom Gas ... 35
Tabel 9 Energi Ikatan Rata-Rata ... 36
Tabel 10 Energi Ikatan Disosiasi ... 37
Tabel 11 Alokasi Waktu Penelitian ... 45
Tabel 12 Teknik Penilaian Angket ... 50
Tabel 13 Ringkasan Hasil TryoutInstrumen Penelitian untuk Uji Validitas Soal pada Aspek Kognitif Siklus I ... 53
Tabel 14 Ringkasan Hasil TryoutInstrumen Penilaian untuk Uji Validitas Soal pada Aspek Kognitif Siklus II ... 53
Tabel 15 Ringkasan Hasil TryoutInstrumen Penelitian untuk Uji Reliabilitas Soal pada Aspek Kognitif Siklus I ... 54
Tabel 16 Ringkasan Hasil TryoutInstrumen Penelitian untuk Uji Reliabilitas Soal pada Aspek Kognitif Siklus II ... 54
Tabel 17 Ringkasan Hasil TryoutInstrumen Penelitian untuk Uji Taraf Kesukaran Soal pada Aspek Kognitif Siklus I ... 55
Tabel 18 Ringkasan Hasil TryoutInstrumen Penelitian untuk Uji Taraf Kesukaran Soal pada Aspek Kognitif Siklus II ... 55
Tabel 19 Ringkasan Hasil TryoutInstrumen Penelitian untuk Uji Daya Pembeda Soal pada Aspek Kognitif Siklus I ... 56
xvii
Tabel 23 Ringkasan Hasil Tryoutuntuk Validitas Soal pada Angket
Keaktifan ... 60 Tabel 24 Ringkasan Hasil Tryoutuntuk Reliabilitas Soal pada
Angket Keaktifan ... 60 Tabel 25 Ringkasan Hasil Tryoutuntuk Validitas Soal pada Angket
Balikan ... 61 Tabel 26 Ringkasan Hasil Tryoutuntuk Reliabilitas Soal pada
Angket Balikan ... 61 Tabel 27 Indikator Keberhasilan Proses Pembelajaran Siklus I dan
Siklus II ... 67 Tabel 28 Indikator Keberhasilan Hasil Pembelajaran Siklus I dan
Siklus II ... 68 Tabel 29 Hasil Observasi Keaktifan Siswa pada Proses Pembelajaran
Siklus I dan Siklus II ... 78 Tabel 30 Hasil Angket Keaktifan Siswa pada Proses Pembelajaran
Pra Siklus, Siklus I, dan Siklus II ... 79 Tabel 31 Hasil Tes Kognitif Siklus I dan Siklus II Materi Pokok
Termokimia Siswa Kelas XI-IA1 SMA Muhammadiyah 1
Surakarta Tahun Ajaran 2010/2011 ... 82 Tabel 32 Nilai Rata-Rata Kuis Siklus I dan Siklus II ... 84 Tabel 33 Capaian Persentase Aspek Afektif Siswa Siklus I dan Siklus II .. 86 Tabel 34 Ketercapaian Target Keberhasilan pada Siklus I dan Siklus II ... 87 Tabel 35 Hasil Tes Siklus I dan II Materi Pokok Termokimia Kelas XI-IA1
xviii
Gambar 2 Reaksi Endoterm ... 24
Gambar 3 Kalorimeter Sederhana ... 29
Gambar 4 Kalorimeter Bom ... 29
Gambar 5 Siklus Pembentukan CO2 ... 32
Gambar 6 Diagram Tingkat Energi ... 32
Gambar 7 Siklus Hubungan Kalor Reaksi ( Ho) dengan Hof ... 33
Gambar 8 Skema Kerangka Berpikir ... 43
Gambar 9 Skema Analisis Data ... 62
Gambar 10 Skema Triangulasi ... 63
Gambar 11 Skema Prosedur Pelaksanaan Menurut Kemmis dan Mc Taggart ... 66
Gambar 12 RewardKeaktifan untuk Individu yang Aktif ... 73
Gambar 13 Diagram Batang Persentase Keaktifan Pra Siklus-Siklus I-Siklus II ... 80
Gambar 14 Diagram Batang Peningkatan Keaktifan Siswa per Indikator ... 81
Gambar 15 Keaktifan Siswa dalam Kegiatan Pembelajaran ... 82
Gambar 16 Diagram Pie Aspek Ketuntasan Belajar Siswa Siklus I ... 83
Gambar 17 Diagram Pie Aspek Ketuntasan Belajar Ssiwa Siklus II ... 83
Gambar 18 Diagram Pie Penilaian Aspek Afektif Siswa pada Siklus I ... 85
Gambar 19 Diagram Pie Penilaian Aspek Afektif Siswa pada Siklus II….... 83
Gambar 20 Diagram Batang Peningkatan Aspek Afektif Siswa ... 84
Gambar 21 Diagram Batang Peningkatan Aspek Afektif Siswa Setiap Indikator ... 87
xix
Lampiran 1 Hasil Observasi Proses Pembelajaran Kondisi Awal ... 103
Lampiran 2 Ringkasan Hasil Wawancara Pra Siklus ... 109
Lampiran 3 Kesimpulan Angket Diagnosis Kesulitan Belajar ... 114
Lampiran 4 Silabus ... 116
Lampiran 5 RPP ... 118
Lampiran 6 Analisis Hasil Angket Keaktifan Kondisi Awal Siswa ... 126
Lampiran 7 Kisi-Kisi TryoutKognitif Siklus I ... 130
Lampiran 8 Soal Tryout Kognitif Siklus I ... 133
Lampiran 9 Kisi-Kisi TryoutKognitif Siklus II ... 144
Lampiran 10 Soal TryoutKognitif Siklus II ... 147
Lampiran 11 Kisi-kisi Tryout Angket Aspek Afektif ... 158
Lampiran 12 Soal Tryout Angket Aspek Afektif ... 159
Lampiran 13 Kisi-kisi Tryout Angket Keaktifan ... 161
Lampiran 14 Soal TryoutAngket Keaktifan ... 162
Lampiran 15 Indikator Respon Siswa Terhadap Pembelajaran ... 164
Lampiran 16 Soal TryoutAngket Balikan ... 165
Lampiran 17 Kisi-Kisi Soal Kognitif Siklus I ... 167
Lampiran 18 Soal Kognitif Siklus I ... 168
Lampiran 19 Lembar Jawab dan Kunci Jawaban Soal Kognitif Siklus I ... 176
Lampiran 20 Kisi-Kisi Soal Kognitif Siklus II ... 177
Lampiran 21 Soal Kognitif Siklus II ... 178
Lampiran 22 Lembar Jawab dan Kunci Jawaban Soal Kognitif Siklus II ... 186
Lampiran 23 Soal Angket Aspek Afektif ... 187
Lampiran 24 Pedoman Penskoran Angket Aspek Afektif ... 189
Lampiran 25 Soal Angket Keaktifan ... 192
Lampiran 26 Pedoman Penskoran Angket Keaktifan ... 194
Lampiran 27 Soal Angket Balikan ... 196
xx
Lampiran 33 Analisis TryoutAngket Aspek Afektif ... 214
Lampiran 34 Analisis Tryout Angket Keaktifan ... 218
Lampiran 35 Analisis TryoutAngket Balikan ... 221
Lampiran 36 Hasil Wawancara dengan Guru setelah Tindakan ... 223
Lampiran 37 Hasil Wawancara dengan Siswa setelah Tindakan ... 224
Lampiran 38 Hasil Observasi Keaktifan Siswa Siklus I ... 226
Lampiran 39 Ringkasan Skor Keaktifan Siklus I dan Kategorinya ... 232
Lampiran 40 Hasil Observasi Keaktifan Siswa Siklus II ... 234
Lampiran 41 Ringkasan Skor Keaktifan Siswa Siklus II dan Kategorinya ... 239
Lampiran 42 Daftar Kelompok Siklus I ... 241
Lampiran 43 Daftar Kelompok Siklus II ... 242
Lampiran 44 Daftar Hadir Siswa ... 243
Lampiran 45 Analisis Hasil Tes Kognitif Siklus I ... 244
Lampiran 46 Analisis Hasil Tes Kognitif Siklus II... 248
Lampiran 47 Analisis Hasil Angket Afektif Siklus I ... 252
Lampiran 48 Analisis Hasil Angket Afektif Siklus II... 256
Lampiran 49 Analisis Hasil Angket Keaktifan Siklus I ... 260
Lampiran 50 Analisis Hasil Angket Keaktifan Siklus II... 263
Lampiran 51 Analisis Hasil Angket Balikan... 267
Lampiran 52 Analisis Hasil Psikomotor ... ... 268
Lampiran 53 Daftar Nilai Kuis Siklus I ... ... 270
Lampiran 54 Daftar Nilai Kuis Siklus II ... 272
Lampiran 55 Catatan Terbimbing Siklus I ... ... 274
Lampiran 56 Lembar Diskusi Siklus I ... ... 278
Lampiran 57 Catatan Terbimbing Siklus II ... ... 283
Lampiran 58 Lembar Diskusi Siklus II... ... 286
xxi
Lampiran 64 Sertifikat Rekognisi Tim ... 306
Lampiran 65 Daftar Nilai Kognitif Siswa Tahun Lalu ... 307
Lampiran 66 Dokumentasi ... 308
1
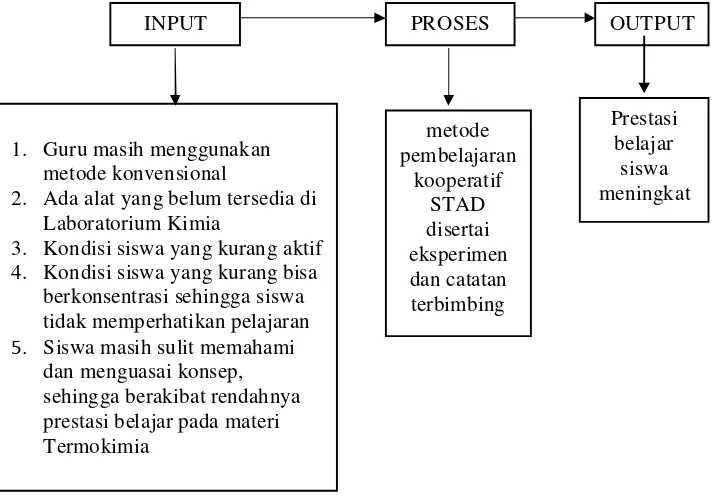
Sekolah Menengah Atas (SMA) Muhammadiyah 1 Surakarta, merupakan salah satu sekolah menengah atas swasta dengan status terakreditasi A di kota Surakarta. Sekolah ini terdiri dari 21 kelas. Kelas X, XI, dan XII masing-masing terdiri dari tujuh kelas. Kelas XI terdiri dari dua kelas ilmu alam dan lima kelas ilmu sosial. Berdasarkan pengamatan di kelas, khususnya kelas XI-IA1, angket
diagnosis kesulitan belajar kimia untuk siswa dan dari wawancara dengan guru kimia dan siswa di sekolah tersebut dapat diidentifikasi permasalahan-permasalahan yang ada. Ketika proses pembelajaran kimia sedang berlangsung dilakukan pengamatan oleh dua orang observer, dari hasil pengamatan diketahui bahwa terdapat beberapa siswa yang kurang bisa berkonsentrasi sehingga mereka mengantuk, melamun, dan bermain sendiri. Siswa masih kurang aktif dan harus ditunjuk terlebih dahulu oleh guru agar mau menjawab pertanyaan. Hasil selengkapnya dari pengamatan kondisi awal kegiatan pembelajaran siswa ini dapat dilihat pada lampiran 1.
Berdasarkan hasil angket diagnosis kesulitan belajar yang diisi oleh siswa juga dapat diidentifikasi beberapa permasalahan. Permasalahan tersebut antara lain banyak siswa yang menganggap bahwa kimia merupakan pelajaran yang sulit. Siswa juga menginginkan metode pembelajaran selain metode ceramah agar tidak merasa jenuh dan lebih menyenangkan dalam proses pembelajaran kimia. Hasil selengkapnya dari angket diagnosis kesulitan belajar siswa dapat dilihat pada lampiran 3.
5 orang siswa (16,13%) yang sudah mencapai ketuntasan sedangkan sisanya belum mencapai batas ketuntasan. Standar Ketuntasan Belajar Minimal (SKBM) yang dipakai untuk pembelajaran kimia adalah 64. Pada materi termokimia ini siswa banyak mengalami kesulitan khususnya pada penentuan reaksi.
Berdasarkan permasalahan tersebut, hal yang dapat dilakukan adalah dengan memperbaiki kualitas dan hasil belajar siswa. Hal ini dilakukan agar kualitas dan hasil belajar siswa menjadi lebih baik dari sebelumnya. Upaya ini dilakukan dengan menggunakan pembelajaran kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing pada materi pokok termokimia. Pembelajaran kooperatif adalah pendekatan pembelajaran yang berfokus pada penggunaan kelompok kecil siswa untuk bekerja sama dalam memaksimalkan kondisi belajar untuk mencapai tujuan belajar (Sugiyanto, 2008:35). Menurut Anita Lie (2008:28), manusia adalah makhluk sosial sehingga kerja sama menjadi sangat penting artinya bagi kelangsungan hidup. Tanpa kerja sama, tidak akan ada individu, keluarga, organisasi, atau sekolah. Kebanyakan pengajar mungkin enggan menerapkan sistem kerja sama di dalam kelas karena beberapa alasan misalnya dalam satu kelompok ada siswa yang tekun mengerjakan tugas dan ada siswa yang hanya ikut-ikutan. Selain itu, ada perasaan was-was pada anggota kelompok akan hilangnya karakteristik atau keunikan pribadi mereka karena harus menyesuaikan diri dengan kelompok. Pada pembelajaran kooperatif ini ada unsur-unsur dasar yang membedakannya dengan pembagian kelompok yang dilakukan asal-asalan.
kemampuan yang telah diajarkan oleh guru. Metode pembelajaran ini didalamnya terdapat interaksi antara siswa dengan guru dan siswa dengan siswa sehingga diharapkan metode ini juga dapat menghilangkan kejenuhan siswa.
Pembelajaran kooperatif tipe STAD ini kemudian disertai dengan eksperimen laboratorium. Dengan eksperimen ini maka siswa dapat mencari dan menemukan sendiri berbagai jawaban atas persoalan-persoalan yang dihadapinya dengan mengadakan percobaan sendiri. Teknik eksperimen ini akan memberikan aktivitas pengalaman siswa yang pada umumnya akan lebih baik daripada hanya mendengar dari pembicaraan atau hanya melihat. Pengalaman yang telah dialami biasanya akan lebih mudah untuk dipahami dan diingat.
Suatu mata pelajaran juga akan lebih mudah diterima oleh siswa jika siswa tersebut mampu berkonsentrasi ketika proses pembelajaran sedang berlangsung. Siswa yang tidak bisa berkonsentrasi biasanya memilih untuk tidur, melamun, atau bergurau dengan teman. Oleh karena itu diperlukan suatu strategi untuk membantu siswa agar dapat meningkatkan konsentrasi, upaya ini dilakukan dengan menggunakan catatan terbimbing. Dengan penggunaan catatan terbimbing ini diharapkan siswa dapat mendefinisikan, memahami, merumuskan, dan menyimpulkan suatu materi yang telah diajarkan.
Sebagai tindak lanjut dari permasalahan yang telah diuraikan di atas maka dilakukan penelitian tindakan kelas (classroom action research) di SMA Muhammadiyah 1 Surakarta dengan tujuan untuk memperbaiki proses pembelajaran sehingga diharapkan dapat meningkatkan kualitas proses pembelajaran dan hasil belajar. Berdasarkan hal tersebut, peneliti mengambil judul penelitian “Pembelajaran Kooperatif Student Team Achievement Divisions Disertai Eksperimen Dan Catatan Terbimbing Untuk Meningkatkan Kualitas Proses Dan Hasil Belajar”.
B. Identifikasi Masalah
1. Apakah pembelajaran kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing dapat meningkatkan kualitas proses belajar pada materi pokok termokimia?
2. Apakah pembelajaran kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing dapat meningkatkan kualitas hasil belajar pada materi pokok termokimia?
3. Apakah penerapan pembelajaran kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing dapat meningkatkan efektifitas strategi guru dalam membantu siswa belajar kimia? 4. Bagaimana penerapan pembelajaran kooperatif Student Team Achievement
Divisions (STAD) disertai eksperimen dan catatan terbimbing pada materi Termokimia?
C. Pembatasan Masalah
Agar permasalahan yang dikaji dalam penelitian ini memiliki arah dan tujuan yang pasti, maka penelitian ini dibatasi pada:
1. Subyek Penelitian
Subyek penelitian adalah siswa kelas XI-IA1 SMA Muhammadiyah 1
Surakarta semester 1 tahun pelajaran 2010/2011. 2. Metode Pembelajaran
Metode yang digunakan pada penelitian ini adalah metode pembelajaran kooperatif tipe Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing.
3. Materi Pelajaran
Materi pelajaran kimia yang digunakan pada penelitian ini adalah materi pokok termokimia.
4. Objek Penelitian
Objek pada penelitian ini meliputi:
b. Proses pembelajaran direncanakan dalam dua siklus yaitu siklus I dan siklus II. Jika pada siklus I belum memenuhi indikator keberhasilan yang direncanakan yaitu keaktifan siswa dicapai 68,33% dan prestasi belajar yang dicapai 50% maka dilanjutkan pada indikator keberhasilan siklus II yaitu keaktifan siswa dicapai 75,71% dan prestasi belajar yang dicapai pada siklus II 60% siswa tuntas.
c. Prestasi belajar siswa dibatasi pada aspek psikomotor, afektif, dan aspek kognitif. Penilaian aspek psikomotor berdasarkan observasi pada saat kegiatan eksperimen. Penilaian aspek afektif diperoleh dari hasil angket langsung. Sedangkan nilai aspek kognitif diperoleh dari hasil tes siklus I dan tes siklus II.
D. Perumusan Masalah
Berdasarkan identifikasi dan pembatasan masalah serta untuk memperjelas permasalahan, maka dirumuskan permasalahan sebagai berikut:
1. Apakah metode pembelajaran kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing dapat meningkatkan kualitas proses belajar siswa pada materi pokok termokimia?
2. Apakah metode pembelajaran kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing dapat meningkatkan hasil belajar siswa pada materi pokok termokimia?
E. Tujuan Penelitian
Sejalan dengan perumusan masalah yang telah dikemukakan, maka tujuan yang ingin dicapai pada penelitian ini sebagai berikut:
1. Meningkatkan kualitas proses belajar siswa pada materi pokok termokimia dengan menggunakan metode kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing.
F. Manfaat Penelitian
Penelitian ini diharapkan akan mampu memberikan manfaat sebagai berikut:
1. Bagi Siswa
a. Memberikan pengalaman secara nyata kepada siswa melalui pembelajaran kooperatif Student Team Achievement Divisions (STAD) disertai eksperimen dan catatan terbimbing untuk mengatasi kesulitan siswa pada materi pokok termokimia khususnya pada penentuan H reaksi.
b. Meningkatkan keaktifan siswa kelas XI-IA1 SMA Muhammadiyah 1
Surakarta dalam proses belajar.
c. Memberikan suasana baru dalam pembelajaran sehingga siswa lebih semangat dalam belajar.
2. Bagi Guru
a. Menyajikan sebuah alternatif bagi Guru untuk mengatasi masalah pembelajaran yang membutuhkan penyelesaian melalui penggunaan metode pembelajaran yang bervariasi.
b. Memberikan masukan bagi guru mengenai manfaat penerapan pembelajaran kooperatif Student Team Achievement Divisions (STAD) untuk mengatasi kesulitan siswa pada materi pokok termokimia dan meningkatkan keaktifan siswa dalam pembelajaran kimia.
c. Memperkaya khasanah pengetahuan guru mengenai berbagai alternatif strategi pembelajaran yang dapat digunakan.
3. Bagi Sekolah
a. Memberikan sumbangan kepada sekolah dalam rangka perbaikan proses pembelajaran.
b. Menjadi bahan pertimbangan dalam menyusun program peningkatan proses pembelajaran pada tahap berikutnya.
4. Bagi Peneliti
b. Mengembangkan wawasan dan pengalaman peneliti. c. Mengaplikasikan teori yang telah diperoleh.
5. Bagi Peneliti Lain
a. Hasil penelitian dapat dijadikan referensi bagi semua pihak yang akan melakukan penelitian sejenis untuk meningkatkan kualitas dan hasil belajar siswa dalam proses pembelajaran.
8
1. Metode Pembelajaran
Menurut Muhibbin Syah (2005: 201), metode secara harfiah berarti “cara”. Secara umum metode diartikan sebagai cara melakukan suatu kegiatan atau cara melakukan pekerjaan dengan menggunakan fakta dan konsep-konsep secara sistematis. Metode juga merupakan cara atau jalan yang harus dilalui untuk mencapai suatu tujuan tertentu (Slameto, 2010: 82). Nana Sudjana (1991: 22) mengatakan bahwa metode adalah cara atau teknik yang digunakan dalam mencapai tujuan. Sedangkan metode mengajar adalah suatu cara/jalan yang harus dilalui di dalam mengajar (Slameto, 2010: 65). Metode mengajar juga merupakan cara yang berisi prosedur baku untuk melaksanakan kegiatan kependidikan, khususnya kegiatan penyajian materi pelajaran kepada siswa (Tardif, 1989 dalam Muhibbin Syah, 2005: 201). Jadi dapat ditarik sebuah kesimpulan bahwa metode pembelajaran merupakan suatu cara yang disusun dan diterapkan dalam kegiatan belajar-mangajar untuk mencapai tujuan pembelajaran yang telah ditetapkan.
yang dapat digunakan oleh guru antara lain: ceramah, diskusi (discussion), praktik, bermain peran (role playing), pemecahan masalah (problem solving), inkuiri reflektif (inquiry reflective), penyampaian cerita (story telling), investigasi (investigation), kerja lapangan (field work). Dari beberapa metode ini dapat dipilih salah satu atau beberapa metode digabung bersamaan dalam pembelajaran. a. Pembelajaran Kooperatif
Manusia adalah mahluk sosial yang tidak bisa hidup tanpa bantuan orang lain. Oleh karena itu, kerja sama merupakan suatu kebutuhan yang penting agar kehidupan dapat terus berlangsung. Sejak awal, manusia telah mengalami proses pembelajaran baik secara individu maupun kelompok atau kooperatif. Di Indonesia, model pembelajaran individual belum diadopsi di jalur pendidikan formal, kecuali di Universitas Terbuka dengan sistem modulnya, di luar jalur pendidikan formal model ini dipakai pada paket belajar jarak jauh (distance learning) dan pusat-pusat studi bahasa asing (learning center atau self-access center) (Anita Lie, 2008: 26). Sebaliknya, model pembelajaran kooperatif lebih banyak diadopsi pada pendidikan-pendidikan formal.
Menurut Anita Lie (2008: 30), untuk mencapai hasil yang maksimal dalam pembelajaran kooperatif, terdapat lima unsur model pembelajaran gotong royong yang harus diterapkan sebagai berikut:
1). Saling Ketergantungan Positif
Dalam pembelajaran kooperatif, guru menciptakan suasana yang mendorong agar siswa merasa saling membutuhkan. Hubungan yang saling membutuhkan ini yang dimaksud dengan ketergantungan positif. Saling ketergantungan dapat dicapai melalui: a) saling ketergantungan mencapai tujuan, b) saling ketergantungan menyelesaikan tugas, c) saling ketergantungan bahan atau sumber, d) saling ketergantungan peran, dan e) saling ketergantungan hadiah.
2). Tanggung Jawab Perseorangan
Pada tugas dan pola penilaian yang dibuat menurut prosedur pembelajaran cooperative learning, setiap siswa akan merasa bertanggung jawab untuk melakukan yang terbaik. Persiapan dan penyusunan tugas dilakukan sedemikian rupa sehingga masing-masing anggota kelompok harus melaksanakan tanggung jawabnya sendiri agar tugas selanjutnya dalam kelompok bisa dilaksanakan. Kunci keberhasilan metode kerja kelompok adalah persiapan guru dalam penyusunan tugasnya.
3). Tatap Muka
Kegiatan interaksi ini akan membentuk sinergi yang menguntungkan bagi semua anggota. Hasil pemikiran beberapa kepala akan lebih kaya daripada hasil pemikiran dari satu kepala saja. Hasil kerja sama ini tentunya jauh lebih besar daripada jumlah hasil masing-masing anggota. Inti dari sinergi ini adalah menghargai perbedaan, memanfaatkan kelebihan, dan mengisi kekurangan masing-masing anggota.
4). Komunikasi Antaranggota
Keberhasilan suatu kelompok juga bergantung pada kesediaan para anggotanya untuk saling mendengarkan dan kemampuan mereka mengutarakan pendapat.
5). Evaluasi Proses Kelompok
Evaluasi proses kerja kelompok dan hasil kerja sama ini diperlukan agar selanjutnya bisa bekerja sama dengan lebih efektif. Waktu evaluasi ini tidak perlu diadakan setiap kali ada kerja kelompok, tetapi bisa diadakan selang beberapa waktu setelah beberapa kali pembelajar terlibat dalam kegiatan pembelajaran cooperative learning.
Keuntungan pembelajaran kooperatif menurut Sugiyanto (2008: 41) sebagai berikut:
1). Meningkatkan kepekaan dan kesetiakawanan sosial.
2). Memungkinkan para siswa saling belajar mengenai sikap, keterampilan, informasi, perilaku sosial, dan pandangan-pandangan.
3). Memudahkan siswa melakukan penyesuaian sosial.
4). Memungkinkan terbentuk dan berkembangnya nilai-nilai sosial dan komitmen.
5). Menghilangkan sifat mementingkan diri sendiri atau egois.
6). Membangun persahabatan yang dapat berlanjut hingga masa dewasa.
7). Berbagai keterampilan sosial yang diperlukan untuk memelihara hubungan saling membutuhkan dapat diajarkan dan dipraktekkan.
8). Meningkatkan rasa saling percaya kepada sesama manusia.
9). Meningkatkan kemampuan memandang masalah dan situasi dari berbagai perspektif.
10). Meningkatkan kesediaan menggunakan ide orang lain yang dirasakan lebih baik.
b. Metode KooperatifStudent Team Achievement Divisions (STAD)
Metode STAD ini dikembangkam oleh Robert Slavin dan kawan-kawannya dari universitas John Hopkins. STAD merupakan salah satu metode pembelajaran kooperatif yang paling sederhana, dan merupakan model yang paling baik untuk permulaan bagi guru yang baru menggunakan pendekatan kooperatif. Dalam pembelajaran STAD ini, para siswa nantinya akan dibagi dalam tim belajar yang berbeda-beda tingkat kemampuan, jenis kelamin, dan latar belakang etniknya (Slavin, 2008: 11).
Metode STAD telah digunakan pada berbagai mata pelajaran dan paling sesuai untuk mengajarkan bidang studi yang sudah terdefinisikan dengan jelas, seperti matematika, berhitung, dan studi terapan, penggunaan dan mekanika bahasa, geografi, dan kemampuan peta, dan konsep-konsep ilmu pengetahuan ilmiah. Seperti penelitian yang dilakukan oleh Adesoji dan Ibraheem (2009: 23) dalam jurnalnya yang berjudul Effect of Student Teams-Achievement Divisions Strategy and Mathematics Knowledge on Learning Outcomes in Chemical Kinetics disebutkan bahwa metode pembelajaran kooperatif STAD mempunyai pengaruh terhadap prestasi dan sikap siswa dan berpotensi untuk meningkatkan hasil pembelajaran.
The result that treatment has significant effect on students’ echievement and attitude towards chemical kinetics showed that the treatment condition in this study i.e. STAD cooperative learning strategy had the potentials to improve students’ learning outcome in secondary school chemistry.
Gagasan utama dari STAD adalah untuk memotivasi siswa supaya dapat saling mendukung dan membantu satu sama lain dalam menguasai kemampuan yang diajarkan oleh guru (Slavin, 2008: 12).
Menurut Slavin (2008: 143-146), STAD ini terdiri atas lima komponen utama yaitu presentasi kelas, tim, kuis, skor kemajuan individual, rekognisi tim. 1). Presentasi Kelas
hanyalah bahwa presentasi tersebut haruslah benar-benar berfokus pada unit STAD. Dengan cara ini, para siswa akan menyadari bahwa mereka harus benar-benar memberi perhatian penuh selama presentasi kelas, karena dengan demikian akan sangat membantu mereka mengerjakan kuis-kuis, dan skor kuis mereka menentukan skor tim mereka.
2). Tim
Tim terdiri dari empat atau lima siswa yang mewakili seluruh bagian dari kelas dalam hal kinerja akademik, jenis kelamin, ras, dan etnisitas. Fungsi utama dari tim ini adalah memastikan bahwa semua anggota tim benar-benar belajar, dan lebih khususnya lagi, adalah untuk mempersiapkan anggotanya untuk bisa mengerjakan kuis dengan baik. Setelah guru menyampaikan materinya, tim berkumpul untuk mempelajari lembar-kegiatan atau materi lainnya. Yang paling sering terjadi, pembelajaran itu melibatkan pembahasan masalah bersama, membandingkan jawaban, dan mengoreksi tiap kesalahan pemahaman apabila anggota tim ada yang membuat kesalahan. Tim adalah fitur yang penting dalam STAD. Pada tiap poinnya, yang ditekankan adalah membuat anggota tim melakukan yang terbaik untuk tim, dan tim pun harus melakukan yang terbaik untuk membantu tiap anggotanya.
3). Kuis
Setelah sekitar satu atau dua periode setelah guru memberikan presentasi dan sekitar satu atau dua dari kerja tim, para siswa akan mengerjakan kuis individual. Para siswa tidak diperbolehkan untuk saling membantu dalam mengerjakan kuis. Hasil dari kuis tersebut kemudian diberi skor. Sehingga, tiap siswa bertanggung jawab secara individual untuk memahami materinya.
4). Skor Kemajuan Individual
yang berasal dari rata-rata siswa pada kuis yang sama. Setelah siswa mendapatkan nilai, maka siswa berhak mendapatkan urutan tingkatan nilai dari skor kuis dan berusaha untuk melampaui skor dasar sehingga dapat mengumpulkan poin untuk tim mereka.
Para siswa mengumpulkan poin untuk tim mereka berdasarkan tingkat di mana skor kuis mereka (persentase yang benar) melampaui skor awal mereka: Tabel 1. Skor Kemajuan Individu
Skor Kuis Poin Kemajuan
Lebih dari 10 poin di bawah skor awal 10-1 poin di bawah skor awal
Skor awal sampai 10 poin di atas skor awal Lebih dari 10 poin di atas skor awal
Kertas jawaban sempurna (terlepas dari skor awal)
5
Skor perkembangan individu dan skor kelompok dihitung setelah dilakukan kuis. Tim akan mendapatkan sertifikat atau bentuk penghargaan yang lain apabila skor rata-rata mereka mencapai kriteria tertentu. Skor tim siswa dapat juga digunakan untuk menentukan dua puluh persen dari peringkat mereka. Tabel 2. Penghargaan Tim
Kriteria (Rata-rata Tim) Penghargaan
15
Dalam pelaksanaannya, metode pembelajaran kooperatif STAD mempunyai langkah-langkah sebagai berikut:
a. Tahap Penyajian Materi Pelajaran
1) Pendahuluan
Dalam pendahuluan guru menekankan pada apa yang akan dipelajari peserta didik (siswa) dan mengapa itu penting. Hal ini dilaksanakan untuk memotivasi siswa dalam mempelajari konsep yang telah diajarkan.
2) Pengembangan
a) Menentukan tujuan-tujuan yang akan dicapai
b) Pembelajaran kooperatif menekankan bahwa belajar adalah memahami makna dan bukan hafalan.
c) Memberikan penjelasan mengapa jawaban pertanyaan tersebut benar atau salah.
d) Beralih pada konsep yang lain jika siswa menguasai pokok masalahnya. 3) Praktek Terkendali
a) Menyuruh siswa mengerjakan soal atau pertanyaan yang diberikan. b) Memanggil siswa secara random untuk menyelesaikan soal. c) Pemberian tugas kelas.
b. Kegiatan Kelompok
Selama kegiatan kelompok masing-masing siswa bertugas mempelajari materi yang telah disajikan oleh guru dan membantu teman sekelompok untuk menguasai materi pelajaran tersebut. Guru memberikan lembar kegiatan dan kemudian siswa mengerjakannya secara mandiri dan selanjutnya saling mencocokkan jawabannya dengan teman sekelompoknya. Apabila diantara teman sekelompok tersebut ada yang kurang memahami, maka anggota kelompok yang lain membantunya.
Guru menekankan bahwa lembar kegiatan untuk dipelajari bukan untuk diisi atau diserahkan pada guru. Apabila siswa mempunyai suatu permasalahan, sebaiknya ditanyakan terlebih dahulu pada anggota kelompoknya kemudian kalau tidak mampu baru ditanyakan pada gurunya.
c. Kuis (individu)
mengetahui pemahaman materi setiap individu dan selanjutnya akan diberikan skor sesuai nilai kuis individu.
2. Eksperimen Laboratorium
Menurut Roestiyah (2008: 80), yang dimaksud dengan eksperimen adalah salah satu cara mengajar, dimana siswa melakukan percobaan tentang sesuatu hal; mengamati prosesnya serta menuliskan hasil percobaannya, kemudian hasil pengamatan itu disampaikan ke kelas dan dievaluasi oleh guru. Sedangkan menurut Syaiful Sagala (2009: 220-221), metode eksperimen adalah cara penyajian bahan pelajaran di mana siswa melakukan percobaan dengan mengalami untuk membuktikan sendiri sesuatu pertanyaan atau hipotesis yang dipelajari. Hal ini sesuai dengan penelitian yang dilakukan oleh Baser dan Durmus (2010: 54), dalam jurnalnya yang berjudul The Effectivenes of Computer Supported Versus Real Laboratory Inquiry Learning Environment on the Understanding of Direct Current Electricity among Pre-Service Elementary School Teachers yang mengungkapkan bahwa antara laboratorium virtual yang dalam pembelajarannya menggunakan simulasi komputer dibandingkan laboratorium real, ternyata siswa dalam kedua kelompok tersebut memiliki pemahaman konsep dengan level yang sama.
The result showed that computer supported inquiry and real laboratory inquiry teaching had the same effect on students’ understandings of concepts in direct current electricity.
Eksperimen dapat dilakukan di dalam laboratorium atau di luar laboratorium. Dalam proses belajar mengajar dengan metode eksperimen ini siswa diberi kesempatan untuk mengalami sendiri atau melakukan sendiri, mengikuti proses, mengamati suatu objek, menganalisis membuktikan, dan menarik kesimpulan sendiri tentang suatu objek, keadaan atau proses sesuatu. Peran guru untuk membuat kegiatan belajar ini menjadi faktor penentu berhasil atau gagalnya metode eksperimen ini.
a. Kebaikan-kebaikannya
percobaannya sendiri daripada hanya menerima kata guru atau buku saja; 2) dapat mengembangkan sikap untuk mengadakan studi eksploratoris tentang sains dan teknologi, suatu sikap dari seseorang ilmuwan; 3) metode ini didukung oleh asas-asas didaktik modern, antara lain: a) siswa belajar dengan mengalami atau mengamati sendiri suatu proses atau kejadian; b) siswa terhindar jauh dari verbalisme; c) memperkaya pengalaman dengan hal-hal yang bersifat objektif dan realistis; d) mengembangkan sikap berpikir ilmiah; dan e) hasil belajar akan tahan lama dan internalisasi.
b. Kelemahan-kelemahannya
Selain kebaikan tersebut, metode eksperimen mengandung beberapa kelemahan sebagai berikut: 1) pelaksanaan metode ini sering memerlukan berbagai fasilitas peralatan dan bahan yang tidak selalu mudah diperoleh dan murah; 2) setiap eksperimen tidak selalu memberikan hasil yang diharapkan karena mungkin ada faktor-faktor tertentu yang berada di luar jangkauan kemampuan dan pengendalian; dan 3) sangat menuntut penguasaan pengembangan materi, fasilitas peralatan dan bahan mutakhir. Sering terjadi siswa lebih dahulu mengenal dan menggunakan alat bahan tertentu daripada guru. c. Cara Mengatasi Kelemahan-Kelemahan Metode Eksperimen
3. Catatan Terbimbing (Guided Note Taking)
Dalam catatan terbimbing, pengajar menyiapkan suatu bagan atau skema atau yang lain yang dapat membantu peserta didik dalam membuat catatan-catatan ketika menyampaikan materi pelajaran. Ada banyak bentuk atau pola yang dapat dikerjakan untuk strategi ini, salah satunya dan yang paling sederhana adalah mengisi titik-titik. Langkah-langkahnya sebagai berikut: 1) memberikan peserta didik panduan yang berisi ringkasan poin-poin utama dari materi pelajaran yang akan disampaikan dengan metode ceramah; 2) mengosongkan sebagian dari poin-poin yang dianggap penting sehingga akan terdapat ruang-ruang kosong dalam panduan tersebut; 3) beberapa cara yang dapat dilakukan adalah:
memberikan suatu istilah dengan pengertiannya; mengosongkan istilah atau definisinya.
mengosongkan beberapa pernyataan jika poin-poin utamanya terdiri dari beberapa pernyataan.
menghilangkan beberapa kata kunci dari sebuah paragraf.
dapat juga dibuat bahan ajar (handout) yang tercantum di dalamnya sub-topik dari materi pelajaran. Beri tempat kosong yang cukup sehingga peserta didik dapat membuat catatan di dalamnya.
4) bagikan bahan ajar (handout) kepada peserta didik. Jelaskan bahwa dengan sengaja beberapa poin penting dalam handout sengaja dihilangkan dengan tujuan agar peserta didik tetap berkonsentrasi mendengarkan pelajaran yang akan sampaikan oleh guru; 5) setelah selesai menyampaikan materi, minta peserta didik untuk membacakan hasil catatannya; 6) memberikan klarifikasi (Hisyam Zaini dkk, 2008: 32-33).
meninggalkan kata-kata kunci dalam sebuah paragraf singkat kosong. 4) Membagikan handoutkepada peserta didik.
4. Termokimia a. Azas Kekekalan Energi
Azas kekekalan energi menyatakan bahwa energi dapat diubah dari satu bentuk ke bentuk lain, tetapi tidak dapat diciptakan atau dimusnahkan. Jadi, kalor yang menyertai suatu reaksi hanyalah perubahan bentuk energi. Azas kekekalan energi disebut juga hukum pertama termodinamika.
a) Sistem dan Lingkungan
Jika sepotong pita magnesium kita masukkan ke dalam larutan asam klorida, maka pita magnesium akan segera larut (bereaksi dengan HCl) disertai pembebasan kalor yang menyebabkan gelas kimia beserta isinya menjadi panas. Campuran pita magnesium dan larutan HCl itu kita sebut sistem, sedangkan gelas kimia serta udara sekitarnya kita sebut lingkungan. Jadi, sistem adalah bagian dari alam semesta yang menjadi pusat perhatian. Bagian lain dari asam semesta yang berinteraksi dengan sistem kita sebut lingkungan. Sistem kimia adalah campuran pereaksi yang sedang dipelajari.
Interaksi antara sistem dan lingkungan dapat berupa pertukaran materi dan/atau pertukaran energi. Berkaitan dengan itu, sistem dapat dibedakan atas sistem terbuka, sistem tertutup, dan sistem terisolasi. Pada sistem terbuka dapat mengalami pertukaran materi dan energi dengan lingkungan. Pada sistem tertutup antara sistem dan lingkungan tidak dapat terjadi pertukaran materi, tetapi dapat terjadi pertukaran energi. Pada sistem terisolasi, tidak terjadi pertukaran materi maupun energi dengan lingkungannya.
Transfer (pertukaran) energi antara sistem dan lingkungan dapat berupa kalor (q) atau bentuk-bentuk energi lainnya yang secara kolektif kita sebut kerja (w). Adanya transfer energi akan mengubah jumlah energi yang terkandung dalam sistem.
b) Energi Dalam
Jumlah energi yang dimiliki oleh suatu sistem disebut energi dalam (E). Nilai energi dalam suatu zat tergantung pada temperatur, tekanan, sifat kimia, dan jumlah zat. Nilai mutlak energi dalam tidak dapat ditentukan yang dapat dilakukan adalah mengukur perubahan energi dalam ( E). Nilai E tidak tergantung dari proses, tetapi ditentukan dari keadaan awal (Eawal) dan keadaan
akhir (Eakhir).
E = Eakhir – Eawal
Karena Eawaldan Eakhir adalah fungsi keadaan maka E juga merupakan
fungsi keadaan. Dalam suatu reaksi, jika ERmerupakan energi dalam dari pereaksi
(reaktan) dan Ep dari produk, perubahan energi dalam selama reaksi:
E = Ep- ER
Lebih lanjut, jika qr diserap oleh sistem pada tekanan konstan dan w
adalah kerja yang dilakukan oleh sistem, keduanya akan meningkatkan energi dalam sehingga jumlah energi dalam:
E = qp+ w
Persamaan tersebut merupakan persamaan matematis untuk Hukum Pertama Termodinamika. Jika kalor diserap pada volume konstan (dinyatakan sebagai qv),
w = 0 maka:
qv= E
c) Kerja
Kerja (w) mengacu pada perbedaan tekanan antara sistem dan lingkungan. Jika tekanan di dalam sistem lebih tinggi, dikatakan sistem melakukan kerja dan jika tekanan di dalam lingkungan lebih tinggi, dikatakan sistem menerima kerja. Hal tersebut dapat ditunjukkan bahwa jika P adalah tekanan luar dan V adalah perubahan volume di dalam sistem maka kerja = P
V.
Jika energi (kerja) meninggalkan sistem, diberi tanda negatif (-), sebaliknya, jika energi memasuki sistem diberi tanda positif (+). Jadi, dapat disimpulkan sebagai
berikut.
Sistem melakukan kerja, wbertanda negatif (-) Sistem menerima kerja, wbertanda positif (+) d) Kalor
Kalor adalah suatu bentuk energi yang ditransfer antara sistem dan lingkungan sebagai akibat adanya perbedaan temperatur. Kalor berpindah dari temperatur yang lebih tinggi ke temperatur yang lebih rendah.
Jika suatu sistem menyerap kalor maka temperatur sistem akan naik dan temperatur lingkungan akan turun, sedangkan jika suatu sistem melepas kalor maka akan terjadi hal sebaliknya. Oleh karena itu, perhitungan jumlah kalor yang dibutuhkan untuk mengubah temperatur suatu materi akan dipengaruhi oleh massa materi, perubahan temperatur, dan tetapan kalor jenis. Tetapan kalor jenis adalah tetapan jumlah kalor yang dibutuhkan untuk menaikkan temperatur sebesar 1oC dari 1 gram massa materi.
q = m xcx T Keterangan :
q : kalor yang dibutuhkan (joule) T : perubahan temperatur (oC atau K) m : massa zat (gram)
c : kalor jenis (Jg-1C-1 atau Jg-1K-1)
Jumlah kalor yang dibutuhkan untuk mengubah temperatur sistem sebesar 1oC dinamakan kapasitas kalor (C). Jika kapasitas kalor sistem diketahui maka perhitungan jumlah kalor yang dibutuhkan menjadi:
e) Hukum Kekekalan Energi
Hukum kekekalan energi (Hukum Pertama Termodinamika) menyatakan bahwa“energi tidak dapat diciptakan dan tidak dapat dimusnahkan, tetapi hanya dapat diubah dari bentuk energi yang satu ke bentuk energi yang lainnya”. Secara matematis Hukum Kekekalan Energi dinyatakan:
E = q + w
qdanwdapat bernilai positif dan negatif. Untuk menentukan nilai qdan w dapat digunakan konversi berikut:
qbernilai positif (+) jika sistem menyerap kalor (q > 0) qbernilai negatif (-) jika sistem melepaskan kalor (q<0) wbernilai positif (+) jika sistem menerima kerja (w>0) wbernilai negatif (-) jika sistem melakukan kerja (w<0) contoh:
1. Berapa perubahan energi dalam, E, jika sistem menyerap kalor 200 J dan melakukan kerja 75 J?
Penyelesaian
Sistem menyerap kalor –q = +200 J Sistem melakukan kerja –w = -75 J
E = q + w
= +200 J + (-75 J) = + 125 J
2. Hitunglah temperatur akhir yang dihasilkan jika 11 gram air pada temperatur 20oC menyerap kalor sejumlah 110 kal! (Kalor jenis air = 1 kal/goC).
Penyelesaian Q = m c T
110 kal = 11 gram x 1 kal/goC x (T2– 20oC)
(T2– 20oC) = 110 kal/11 gram x 1 kal/goC
T2 = 30 oC
b. Entalpi (H) dan Perubahan Entalpi H
Setiap yang terlibat dan dihasilkan dari reaksi kimia, serta semua senyawa yang ada di alam ini memiliki energi total yang dikandung semua zat disebut entalpi, diberi lambang H. Jadi, dapat dikatakan bahwa Entalpi (H) merupakan jumlah total dari semua bentuk energi yang dimiliki yang terdapat dalam suatu materi.
H = E + PV
Entalpi suatu zat tidak dapat diukur secara langsung, akan tetapi dapat diukur dengan menghitung perubahannya. Perubahan entalpi diberi lambang H.
H = H2 – H1
= (E2 + PV2) – (E1+ PV1)
= (E2 + E1) – P(V2 + V1)
Atau
H = E + P V
Menurut Hukum Kekekalan Energi qp = E – w
Namun jika kalor qp yang diserap oleh sistem digunakan untuk memperbesar energi dalam sistem, dan tekanan dibuat tetap maka:
w = -P V
(Tanda minus digunakan karena sistem melakukan kerja) qp= E + P V
Karena E + P V = H Makaqp= H
c. Reaksi Eksoterm dan Endoterm
Suatu reaksi kimia dapat menyebabkan entalpi sistem bertambah, yaitu dengan cara sistem menyerap energi dari lingkungan. Reaksi kimia yang dapat menyebabkan entalpi sistem bertambah disebut reaksi endoterm. Reaksi ini memiliki H bernilai positif ( H=+), sedangkan reaksi yang menyebabkan sistem kehilangan energi sehingga entalpi sistem berkurang disebut reaksi eksoterm dengan H bernilai negatif ( H=-).
Reaksi endoterm mengakibatkan energi lingkungan berkurang, karena energinya diserap oleh sistem. Energi yang diserap dalam bentuk kalor. Jika kalor lingkungan berkurang maka temperatur lingkungan akan bertambah rendah. Begitu juga sebaliknya, suatu reaksi eksoterm akan menyebabkan energi lingkungan dalam bentuk kalor bertambah dan terasa temperatur lingkungan akan lebih tinggi.
a) Reaksi Eksoterm
NaOH(s) + H2O(l) NaOH(aq) + H2O(l)
Jika sejumlah natrium hidroksida (NaOH) dilarutkan dalam air maka akan mengakibatkan kenaikan temperatur. Hal ini berarti kalor berpindah dari sistem ke lingkungan (membebaskan kalor).
energi H= -
Panas dilepaskan ke lingkungan Gambar 1. Reaksi Eksoterm b) Reaksi Endoterm
CaCO3(s) CaO(g) + CO2(g)
Penguraian batu gamping (CaCO3) menjadi CaO dan CO2 membutuhkan energi
panas dalam jumlah tertentu. Hal ini dapat diartikan bahwa reaksi melibatkan perpindahan panas dari lingkungan ke sistem. Jika suatu persamaan reaksi
sistem Lingkungan
dilengkapi dengan nilai perubahan entalpi ( H) maka persamaan reaksi ini disebut persamaan termokimia.
energi H= +
Panas diperoleh dari lingkungan Gambar 2. Reaksi Endoterm
c) Persamaan Termokimia
(a) Reaksi: C(s)+ O2(g) CO2(g) + 393,52 kJ
Reaksi ini adalah reaksi yang membebaskan kalor (reaksi eksoterm) dengan H = -393,52 kJ sehingga persamaan termokimia tersebut dapat diubah menjadi persamaan termokimia dengan menyertakan H sebagai berikut:
C(s) + O2(g) CO2(g) H = -393,52 kJ
Persamaan termokimia ini menunjukkan bahwa jika 1 mol C bereaksi dengan 1 mol O2, sistem melepaskan kalor ke lingkungan sebesar 393,52 kJ.
(b) Reaksi: N2(g) + 2O2(g) 2NO2(g) H = +66,4 kJ
Reaksi ini mempunyai H positif sehingga termasuk reaksi endoterm (sistem menyerap kalor). Persamaan termokimia ini dapat diubah menjadi persamaan termokimia dengan menyertakan kalor reaksi sebagai berikut.
N2(g) + 2O2(g) + 66,4 kJ 2NO2(g)
Persamaan termokimia ini menunjukkan bahwa jika 1 mol N2bereaksi
dengan 2 mol O2 membentuk 2 mol NO2, sistem menyerap kalor dari lingkungan
sebesar 66,4 kJ.
(Parning dkk, 2007:48) d. Jenis-Jenis Perubahan Entalpi Standar ( Ho)
Setiap materi memiliki energi yang terkandung di dalamnya seperti energi potensial dan energi kinetik. Jumlah keseluruhan energi yang dimiliki zat disebut kandungan kalor zat atau entalpi (H). Entalpi tidak mengalami perubahan selama tidak terjadi perpindahan energi dari zat tersebut. Perubahan kandungan
Lingkungan sistem
kalor selama proses penambahan atau pelepasan kalor dinyatakan sebagai perubahan entalpi ( H).
Besarnya perubahan entalpi sama dengan selisih jumlah entalpi hasil reaksi dengan jumlah entalpi pereaksi. Misalnya, pada peristiwa es mencair, perubahan entalpi dinyatakan sebagai selisih entalpi H2O(l) dengan entalpi H2O(s).
H = H H2O(l) – H H2O(s)
Beberapa jenis perubahan entalpi sebagai berikut: (1) Entalpi Pembentukan Standar ( Hof)
Perubahan entalpi pembentukan standar atau kalor pembentukan standar ( Hof) adalah perubahan entalpi ( H) dari suatu reaksi pembentukan 1 mol
zat dari unsur-unsurnya pada keadaan standar (298 K, 1 atm). Dari pengertian tersebut, kalor pembentukan standar dari CO2(g) sebesar -393,52 kJ mol-1,
berarti pada pembentukan 1 mol CO2 dari unsur C dan O2dilepaskan kalor
sebesar 393,52kJ. Persamaan termokimianya adalah C(s)+ O2(g) CO2(g) H = -393,52 kJ
Sebab CO bukan unsur melainkan senyawa. Tabel 3. Kalor Pembentukan Standar
Rumus Kimia
(2) Entalpi Penguraian Standar ( Hod)
Perubahan entalpi penguraian standar atau kalor penguraian standar ( Hod) adalah perubahan entalpi ( Hod) dari suatu reaksi penguraian 1 mol zat
1 mol zat menjadi unsur-unsurnya adalah kebalikan dari reaksi pembentukan 1 mol zat menjadi unsur-unsurnya sehingga diperoleh hubungan bahwa kalor penguraian standar ( Hod) adalah harga negatif dari kalor pembentukan standar
( Hof).
Contoh :
Kalor pembentukan standar ( Hof) dari CaCO3(s) adalah -1,207 kJ/mol, maka kalor
penguraian standar ( Hod) dari CaCO3(s) adalah 1,207 kJ/mol. Persamaan
termokimia dari penguraian CaCO3(s) adalah sebagai berikut:
CaCO3(s) Ca(s)+ C(s) + O2(g) H = 1,207 kJ
(3) Entalpi Pembakaran Standar ( Hoc)
Perubahan entalpi pembakaran standar atau kalor pembakaran standar ( Hoc) adalah perubahan entalpi ( H) dari suatu reaksi pembakaran 1 mol zat
(reaksi 1 mol zat dengan gas O2) pada keadaan standar (298 K, 1 atm).
Contoh :
Misalkan kalor pembakaran standar ( Hoc) dari metana (CH4) adalah
-802 kJ/mol, maka persamaan termokimianya adalah sebagai berikut: CH4(g) + 2O2(g) CO2(g) + 2H2O(g) H = -802 kJ
Persamaan termokimia pembakaran CH4 di atas menunjukkan bahwa untuk
mereaksikan 1 mol gas CH4dengan 2 mol gas O2menghasilkan 1 mol gas CO2
dan 2 mol gas H2O mempunyai H reaksi = -802 kJ. Berikut tabel kalor
pembakaran standar dari beberapa zat. Tabel 4. Kalor Pembakaran Standar
Contoh :
Pada pembakaran 0,5 gram belerang dalam suatu kalorimeter terjadi kenaikan temperatur dari 26oC menjadi 26,5oC
S8(s) + O 2(g) SO2(g)
Jika kapasitas kalor sebesar 10,85 kJ/goC maka tentukan perubahan entalpi pembakaran 32 gram belerang!
Penyelesaian Q = m c T
= 0,5 gram x 10,85 kJ/goC x 0,5 oC = 2,7125 kJ
Karena 32 gram S sama dengan 1 mol S maka perubahan entalpi pembakaran belerang:
H = 2,7125 kJ/1 mol = 2,7125 kJ mol-1
e. Penentuan Entalpi Reaksi a) Percobaan (Kalorimetri)
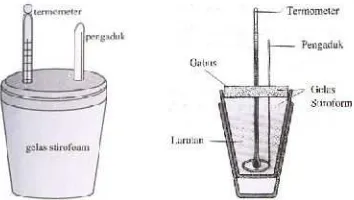
Umumnya, harga kalor reaksi yang tertera pada tabel diperoleh dari hasil eksperimen yang dilakukan secara kalorimetris. Penentuan kalor reaksi secara kalorimetris dilakukan dengan suatu alat yang disebut kalorimeter.
Kalorimeter merupakan sistem terisolasi (tidak ada pertukaran materi maupun energi dengan lingkungan di luar kalorimeter). Alat ini digunakan untuk mengukur perubahan kalor selama reaksi kimia (Keenan, Klenfelter, dan Wood, 1980: 474). Dengan demikian semua kalor yang dibebaskan oleh reaksi yang terjadi di dalam kalorimeter, tidak ada yang terbuang ke luar kalorimeter. Dengan mengukur kenaikan suhu di dalam kalorimeter, kita dapat menentukan jumlah kalor yang diserap oleh air serta perangkat kalorimeter berdasarkan rumus:
qlarutan = mc T dan
qkalorimeter =C T
m = massa air (larutan) di dalam kalorimeter c = kalor jenis air (larutan) di dalam kalorimeter C = kapasitas kalor dari kalorimeter
T= kenaikan suhu larutan (kalorimeter)
Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka kalor reaksi sama dengan kalor yang diserap oleh larutan dan kalorimeter, tetapi tandanya berbeda:
qreaksi= -(qlarutan + qkalorimeter)
Sedangkan kalorimeter yang biasa digunakan untuk menentuka kalor dari reaksi-reaksi pembakaran biasa digunakan kalorimeter bom. Kalorimeter bom terdiri dari sebuah bom (wadah tempat berlangsungnya reaksi pembakaran, biasanya terbuat dari bahan stainless steel) dan sejumlah air yang dibatasi dengan wadah kedap panas.
Kalorimeter sederhana dapat disusun dari dua buah gelas plastik. Plastik merupakan bahan nonkonduktor, sehingga jumlah kalor yang diserap atau yang berpindah ke lingkungan dapat diabaikan. Jika suatu reaksi dapat berlangsung secara eksoterm maka kalor sepenuhnya akan diserap oleh larutan di dalam gelas. Sebaliknya, jika reaksi yang berlangsung tergolong endoterm, maka kalor itu diserap dari larutan di dalam gelas. Jadi, kalor reaksi sama dengan jumlah kalor yang diserap oleh gelas dan lingkungan diabaikan.
qreaksi = -qlarutan
Dalam percobaan biasanya digunakan rumus berikut: m1 c (T1 – T3) = m2 c (T3 – T2) + C (T3 – T2)
Keterangan:
C = Kapasitas kalor kalorimeter c = kalor jenis air
m1= massa air panas
m2= massa air dingin
T1 = temperatur air panas
T2 = temperatur air dingin
Gambar 3. Kalorimeter Sederhana
Gambar 4. Kalorimeter Bom
Menentukan Perubahan Entalpi Standar ( HO) Reaksi Tabel 5. Alat dan Bahan
No Alat dan Bahan Ukuran / Konsentrasi Jumlah / Volume
1. 2. 3. 4. 5. 6.
Bejana plastik Silinder ukur Termometer Pengaduk kaca Larutan NaOH Larutan HCl
±200 cm3 50 cm3 0-50oC -1 M 1 M
1 2 1 1 50 cm3 50 cm3
Prosedur dan Pengamatan Percobaan
2. Ukur temperatur kedua larutan itu. Termometer harus dibersihkan dan dikeringkan sebelum dipindahkan dari satu larutan ke larutan yang lain. Jika kedua temperatur larutan berbeda, tentukan temperatur rata-rata (temperatur awal).
3. Tuangkan HCl ke dalam bejana plastik yang berisi larutan NaOH, aduk larutan dan perhatikan temperatur yang ditunjukkan oleh termometer. Temperatur akan naik dan selanjutnya turun. Catatlah temperatur itu (temperatur akhir). Tabel 6. Pengamatan
Temperatur Awal (T1) Temperatur Akhir (T2) Perbedaan Temperatur
( T=T2-T1) isinya naik dari 23,25oC menjadi 34,9oC. Tentukan entalpi pelarutan LiOH dalam air!
LiOH(s) Li+(aq) + OH-(aq) H = ?
Diketahui kalor jenis larutan = 4,2 Jg-1oC-1, dan kapasitas kalor kalorimeter = 11,7
Kalor tersebut dibebaskan pada pelarutan 7,5 gram LiOH.
Pada pelarutan 1 mol LiOH (24 g) akan dibebaskan kalor sebanyak x -6374 J = -20399,7 J mol-1
= -20,4 kJ mol-1 Jadi H pelarutan LiOH = -20,4 kJ mol-1
f. Hukum Hess atau Hukum Penjumlahan Kalor
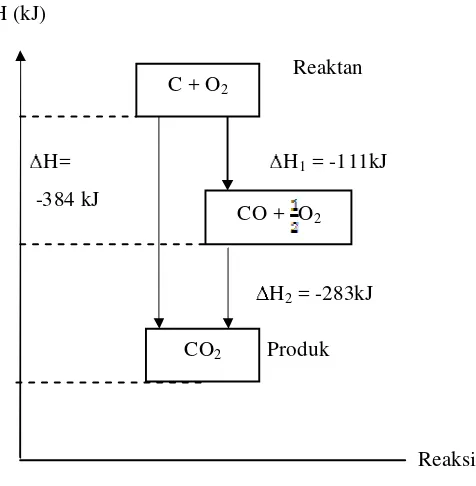
Pada penentuan kalor reaksi secara eksperimen, ada reaksi yang sulit ditentukan kalor reaksinya. Hal itu dapat kita lihat pada reaksi yang mempunyai tahapan-tahapan. Namun, pada tahun 1840 seorang ahli kimia berkebangsaan Rusia yang bernama G.H. Hess menyatakan suatu hukum termokimia yang dikenal dengan Hukum Hess. Versi modern hukum Hess adalah untuk suatu reaksi keseluruhan tertentu, perubahan entalpi selalu sama, tak peduli apakah reaksi itu dilaksanakan secara langsung ataukah secara tak langsung dan lewat tahap-tahap yang berlainan (Keenan, Klenfelter, dan Wood, 1980: 479).
Pada penentuan Ho dari pembentukan gas CO hasil pembakaran C dengan gas O2, reaksi pembentukan gas CO adalah bagian reaksi dari tahap tidak
langsung pada pembentukan gas CO2. Agar lebih jelas, perhatikan reaksi
pembentukan gas CO2 secara langsung dan tidak langsung sebagai berikut:
Reaksi langsung
C(s) + O2(g) CO2(g) H = -394 kJ
Reaksi tidak langsung
C(s) + O2(g) CO(g) H1 = x kJ
CO(g) + O2(g) CO2(g) H2 = -283 kJ
Menurut Hukum Hess:
H = H1 + H2
Reaksi ini dapat dibuat dalam siklus seperti pada gambar H=-394 kJ
H1 = x kJ H2 = -283 kJ
Gambar 5. Siklus pembentukan CO2
Pembentukan gas CO2 dari pembakaran C dengan O2 dapat dibuat
diagram tingkat energi sebagai berikut: H (kJ)
Reaktan
H= H1 = -111kJ
-384 kJ
H2 = -283kJ
Produk
Reaksi Gambar 6. Diagram tingkat energi
Misalkan suatu reaksi pembakaran gas CH4 oleh gas O2 menghasilkan
gas CO2 dan gas H2O, persamaannya dituliskan sebagai berikut:
CH4(g) + 2O2(g) CO2(g) + 2H2O(g) Ho= ...?
C + O2 CO2
CO + O2
C + O2
CO + O2
Besarnya Ho ini dapat ditentukan dari harga Hof zat-zat yang ada pada
persamaan reaksi. Zat-zat yang bereaksi sebelum menjadi zat produk dianggap terlebih dahulu mengalami penguraian menjadi unsur-unsurnya, lalu unsur-unsur tersebut membentuk zat produk. Hal ini dapat dijelaskan dalam siklus seperti pada gambar:
Ho
H1 + H2 H3 + H4
Gambar 7. Siklus hubungan kalor reaksi ( Ho) dengan Hof
H1 = HodCH4(g) = HofCH4(g)
H2 = 2 HodO2(g) = -2 Hof O2(g) = 0 ( Hofunsur bebas adalah nol)
H3 = HofCO2(g)
H4 = 2 HofH2O(g)
Menurut Hukum Hess
Ho = ( H1 + H2) + ( H3 + H4)
= [- HofCH4(g) - 2 HofO2(g)] + [ HofCO2(g) + 2 HofH2O(g)]
= [ HofCO2(g) + 2 HofH2O(g)] – [ HofCH4(g) + 0]
Secara umum
Ho= HofProduk - HofReaktan
Contoh 1:
Diketahui (1) S(s)+ O2(g) SO2(g) H = -296,8 kJ
(2) 2SO2(g) + O2(g) 2SO3(g) H = -197,8 kJ
Tentukanlah entalpi reaksi
(3) S(s) + 3/2 O2(g) SO3(g) H = ?
Jawab :
H reaksi (3) dapat diperoleh dengan menyusun dan menjumlahkan reaksi (1) dan (2). Reaksi (1) ditulis tetap sehingga belerang (S) berada di ruas kiri.
CH4(g)+ 2O2(g) CO2(g) + 2H2O(g)
Dalam hal ini, oksigen tidak dapat digunakan sebagai acuan karena oksigen juga ada dalam reaksi (2). Reaksi (2) juga ditulis tetap, sehingga SO3 berada
di ruas kanan.
S(s) + O2(g) SO2(g) H = -296,8 kJ
SO2(g) + O2(g) SO3(g) H = -98,9 kJ +
S(s) + O2(g) SO3(g) H = -395,7 kJ
Contoh 2:
Jika entalpi pembentukan CO2(g) = -393,5 kJ/mol, dan C3H8(g) = -104 kJ/mol,
tentukan energi yang dibebaskan pada pembakaran 1 mol C3H8!
Jawab:
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
Hr = Hof(produk) - Hof(pereaksi)
= [(3 x HofCO2)+(4 x HofH2O)] – [ HofC3H8 + (5 x HofCO2)]
= [(3 x (-393,5)) + (4 x (-242,0))] – [-104 + (5 x 0)] = [(-1.108,5) + (-968)] – [-104]
= -2.044,5 kJ/mol
g. Energi Ikatan dan Entalpi Reaksi 1). Energi Ikatan (E)
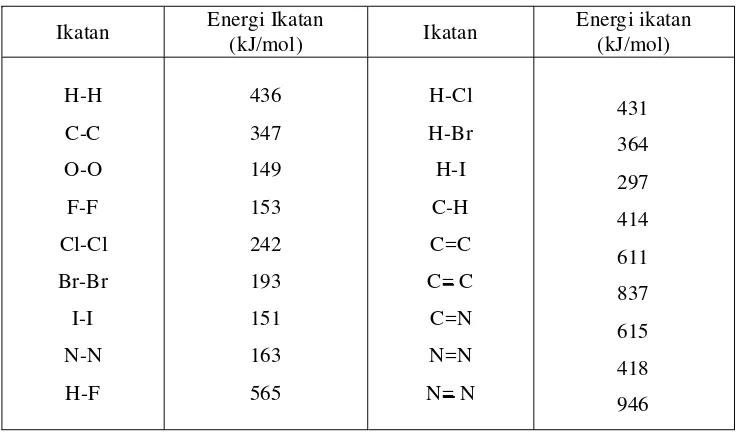
Energi ikatan adalah jumlah energi yang diperlukan untuk membentuk ikatan antaratom dalam senyawa yang besarnya sama dengan jumlah energi yang diperlukan untuk memutuskan ikatan antar atom dalam senyawa tersebut. Contohnya, gas Cl2 memiliki energi ikatan antaratom Cl, yaitu ikatan Cl-Cl
dengan gas O2 memiliki energi ikatan antaratom O, yaitu ikatan O=O.
Sesuai dengan penjelasan di atas, energi ikatan senyawa didefinisikan sebagai kalor reaksi ( Ho) dari reaksi endoterm penguraian 1 mol senyawa menjadi atom-atomnya ( Hod). Misalnya, energi ikatan dalam senyawa Cl2 dan O2
Cl2(g) 2Cl(g) Hod = 242,6 kJ
O2(g) 2O(g) Hod = 498,3 kJ
Berikut ini harga energi ikatan dari beberapa molekul diatom yang dinyatakan dalam harga Hod.
Tabel 7. Energi Ikatan Molekul Diatom
Molekul H atom dapat didefinisikan sebagai jumlah energi yang diperlukan untuk membentuk 1 mol atom gas dari unsurnya dalam keadaan standar (298K,1 atm). Entalpi pembentukan dari suatu unsur dalam keadaan standarnya pada 25oC diberi harga nol(Keenan, Klenfelter, dan Wood, 1980: 481). Beberapa harga kalor pembentukan atom dari molekul diatom dalam keadaan standar sebagai berikut: Tabel 8. Kalor Pembentukan Atom Gas
Atom Hof (kJ/mol) Atom HOf(kJ/mol)
NH3(g) 3H(g) + N(g) H = +1.172,7 kJ/mol
Dalam molekul NH3terdapat 3 ikatan N-H tersebut adalah sama sehingga
untuk memutuskan 1 ikatan N-H dibutuhkan energi kalor sebesar = 390,9 kJ ini merupakan energi ikatan rata-rata per mol ikatan N-H. Energi ikatan semacam ini disebut energi ikatan rata-rata. Energi ikatan rata-rata adalah energi rata-rata per ikatan yang diperlukan untuk mendisosiasikan 1 mol molekul menjadi atom-atom penyusunnya.
Tabel 9. Energi Ikatan Rata-Rata Ikatan Energi Ikatan
Hitunglah energi ikatan rata-rata C = O dalam CO2!
Jawab :
Misalkan energi ikatan CO2= x kJ