KARAKTERISASI DAN ISOLASI SENYAWA SAPONIN DARI EKSTRAK ETANOL DAUN SITUDUH LANGIT
(Erigeron sumatrensis Retz.)
SKRIPSI
OLEH:
LESTIANI LUBIS NIM 151524093
PROGRAM STUDI EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2017
KARAKTERISASI DAN ISOLASI SENYAWA SAPONIN DARI EKSTRAK ETANOL DAUN SITUDUH LANGIT
(Erigeron sumatrensis Retz.)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
LESTIANI LUBIS NIM 151524093
PROGRAM STUDI EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2017
PENGESAHAN SKRIPSI
KARAKTERISASI DAN ISOLASI SENYAWA SAPONIN DARI EKSTRAK ETANOL DAUN SITUDUH LANGIT
(Erigeron sumatrensis Retz.)
OLEH:
LESTIANI LUBIS NIM 151524093
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 28 November 2017 Disetujui Oleh:
Pembimbing I,
Dr. Marline Nainggolan, M.S., Apt.
NIP. 195709091985112001
Pembimbing II,
Prof. Dr. Ginda Haro, M.Sc., Apt.
NIP. 195108161980031002
Medan, Desember 2017 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Prof. Dr. Masfria, M.S., Apt.
NIP. 195707231986012001 Panitia Penguji,
Prof. Dr. rer. nat. Effendy Delux Putra, SU, Apt.
NIP. 195306191983031001
Dr. Marline Nainggolan, M.S., Apt.
NIP. 195709091985112001
Drs. Syafruddin, M.S., Apt.
NIDK 8889540017
Prof. Dr. Ginda Haro, M.Sc., Apt.
NIP. 195108161980031002
KATA PENGANTAR
Segala puji dan syukur bagi Allah SWT, Tuhan Yang Maha Esa pengayom segenap alam yang telah melimpahkan rahmat, karunia dan ridhoNya, sehingga sehingga penulis dapat menyelesaikan tugas akhir yang berjudul “Karakterisasi dan Isolasi Senyawa Saponin dari Ekstrak Etanol Daun Situduh Langit (Erigeron Sumatrensis Retz.)”. Bahan skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis menyampaikan terima kasih kepada Ibu Prof.
Dr. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi USU Medan yang telah memberikan bantuan dan fasilitas selama masa perkuliahan di Fakultas Farmasi USU Medan. Penulis juga mengucapkan terima kasih kepada Ibu Dr. Marline Nainggolan, M.S., Apt., dan Bapak Prof. Dr. Ginda Haro, M. Sc., Apt., yang telah membimbing dan memberikan petunjuk-petunjuk serta saran-saran selama penelitian hingga selesainya bahan skripsi ini, serta kepada Bapak Prof. Dr. rer.
nat. Effendy Delux Putra, SU, Apt., dan Bapak Drs. Syafruddin, M.S., Apt., selaku dosen penguji yang telah memberikan saran untuk menyepurnakan skripsi ini dan Ibu Yuandani, M.Si., Ph.D., Apt., selaku dosen penasehat akademik yang selalu memberikan bimbingan selama masa perkuliahan serta Bapak dan Ibu staf pengajar Fakultas Farmasi USU Medan yang telah mendidik selama perkuliahan.
Penulis juga tidak lupa mengucapkan terima kasih kepada Ayahanda Rinaldi Lubis dan Ibunda Suryati, Kakanda Duma Sari Lubis, Am. Keb, Fina Sarita Lubis S.Pd, Adinda Agung Agustian Lubis dan Khansa Zhafirah Lubis atas
segala do’a, kasih sayang serta dorongan moril maupun materil kepada penulis selama ini. Semoga kalian selalu dalam lindungan Allah SWT.
Penulis menyadari bahwa masih banyak kekurangan yang terdapat dalam skripsi ini. Penulis juga mengharapkan kritik dan saran yang membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya dalam bidang farmasi.
Medan, November 2017 Penulis,
Lestiani Lubis NIM 151524093
KARAKTERISASI DAN ISOLASI SENYAWA SAPONIN DARI EKSTRAK ETANOL DAUN SITUDUH LANGIT
(Erigeron sumatrensis Retz.) ABSTRAK
Tumbuhan situduh langit (Erigeron sumatrensis Retz.) biasa digunakan untuk obat sakit kepala, nyeri pegal linu, pengobatan sakit tenggorokan, gangguan perut, cacar, pengobatan jerawat dan gangguan kulit lainnya. Senyawa saponin merupakan salah satu kandungan kimia dari tumbuhan ini yang dapat diaplikasikan sebagai antimikroba, antijamur, obat hiperkolesterol, antitumor, antikanker dan antidiabetes. Tujuan penelitian ini untuk karakterisasi dan isolasi senyawa saponin dari ekstrak etanol daun situduh langit. Isolat saponin yang diperoleh dikarakterisasi dengan spektrofotometer ultraviolet (UV) dan inframerah (IR).
Serbuk simplisia dikarakterisasi dan skrining fitokimia kemudian diekstraksi dengan cara maserasi menggunakan pelarut etanol 80%. Maserat yang diperoleh dipekatkan dengan rotary evaporator (± 40°C), selanjutnya dihidrolisis dengan HCl 2N. Kemudian diekstraksi dengan kloroform, dianalisis dengan kromatografi lapis tipis (KLT) dan KLT preparatif menggunakan fase diam silika gel GF254 dan fase gerak yang sesuai. Isolat diuji kemurniannya dengan KLT satu arah dan dua arah kemudian dikarakterisasi menggunakan spektrofotometer UV dan IR.
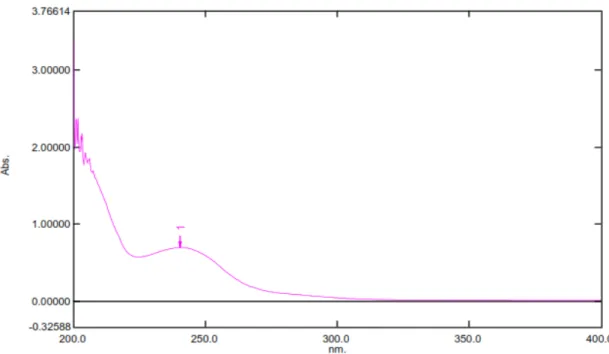
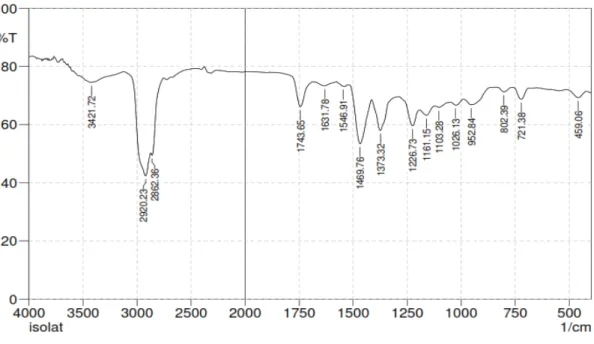
Hasil karakterisasi serbuk simplisia diperoleh kadar air 7 , 9 7 %, kadar sari larut air 10,43%, kadar sari larut etanol 10,52%, kadar abu total 4,29%, dan kadar abu tidak larut asam 0,93%. Hasil skrining fitokimia diperoleh senyawa triterpenoid/steroid, tanin, flavonoid, saponin dan glikosida. Isolat saponin hasil pemisahan dengan KLT diperoleh Rf= 0,88 berwarna ungu dengan pereaksi Liebermann- Burchard. Hasil analsis isolat saponin dengan spektrofotometri UV memberikan absorbansi maksimum pada panjang gelombang (λ) 240 nm yang menunjukkan adanya gugus kromofor dan hasil spektrometri IR diperoleh adanya gugus –OH, –CH, C=O dan gugus C-O.
Kata kunci : daun situduh langit, isolasi, saponin, KLT, spektrofotometer UV dan IR
CHARACTERIZATION AND ISOLATION SAPONIN COMPOUND FROM ETHANOL EXTRACT SITUDUH LANGIT LEAVE
(Erigeron sumtrensis Retz.)
ABSTRACT
Situduh langit (Erigeron sumtrensis Retz.) commonly used for headache, stiff, treatment of sore throats, stomach disorders, smallpox, treatment of acne and other skin disorders. Saponin is one of the chemical constituents in these plants that can be applied as antimicrobial, antifungal, hypercholesterolemia drugs, antitumor, anticancer and antidiabetic. The aim this of research was to characterize and isolation of saponin from ethanol extract situduh langit leaves. The isolat characterized by ultraviolet spectrophotometers (UV) and infrared spectrometer (IR).
The simplicia powder was characterized and phytochemical screened then extracted by maceration using ethanol 80%. The maserate was concentrated with rotary evaporator (± 40 ° C), then hydrolyzed with hydrocloric acid 2N. Then extracted with chloroform, then analyzed by thin layer chromatography (TLC) and separated by preparative TLC using silica gel GF254 stationary phase and corresponding mobile phase. Isolates tested purity by one way and two ways thin layer chromatography and characterized using ultraviolet spectrophotometers and infrared spectrometer.
The result of simplicia characterization was obtained by water content 7.97%, water soluble content 10.43%, ethanol soluble extract 10.52%, total ash value 4.29%, and acid insoluble ash 0.93%. Phytochemical screening showed that simplicia contains triterpenoid/steroid, tannin, flavonoid, saponin and glycoside.
The result of separation by TLC obtained saponin isolate Rf = 0.88 purple with Liebermann-Burchard. The saponin isolate was characterized by UV spectrophotometry and gave maximum absorption wavelengths at 240 nm to indicate the presence of chromophores and IR spectrometry indicate the presence of -OH, the CH-group, the C = O group and the C-O group.
Keywords: situduh langit leaves, isolation, saponin, TLC, UV and IR spectrophotometer
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Habitat ... 5
2.1.2 Morfologi ... 5
2.1.3 Nama umum ... 5
2.1.4 Sinonim ... 6
2.1.5 Klasifikasi tumbuhan ... 6
2.1.6 Kegunaan ... 6
2.1.7 Kandungan kimia ... 6
2.2 Uraian Kimia ... 7
2.2.1 Glikosida ... 7
2.2.2 Saponin ... 7
2.2.3 Flavonoid ... 9
2.2.4 Triterpenoid/Steroid ... 10
2.3 Metode Ekstraksi ... 10
2.4 Kromatografi ... 12
2.4.1 Kromatografi kolom ... 13
2.4.2 Kromatografi cair kinerja tinggi ... 13
2.4.3 Kromatografi gas ... 13
2.4.4 Kromatografi kertas ... 14
2.4.5 Kromatografi lapis tipis ... 14
2.4.5.1 Kromatografi lapis tipis preparatif ... 16
2.4.5.2 KLT dua arah ... 16
2.5 Spektrofotometri ... 17
2.5.1 Spektrofotometri ultraviolet (UV) ... 17
2.5.2 Spektrofotometri inframerah (IR) ... 19
BAB III METODE PENELITIAN ... 21
3.1 Lokasi Penelitian ... 21
3.2 Alat-Alat ... 21
3.3 Bahan-Bahan ... 21
3.4 Pembuatan Larutan Pereaksi ... 22
3.4.1 Larutan air-kloroform ... 22
3.4.2 Larutan kloralhidrat ... 22
3.4.3 Pereaksi asam klorida 2 N ... 22
3.4.4 Pereaksi asam sulfat 50% dalam metanol ... 22
3.4.5 Pereaksi asam nitrat 0,5 N ... 22
3.4.6 Pereaksi besi (III) klorida 1% ... 23
3.4.7 Pereaksi Bouchardat ... 23
3.4.8 Pereaksi Dragendorff ... 23
3.4.9 Pereaksi Liebermann-Burchard ... 23
3.4.10 Pereaksi Mayer ... 23
3.4.11 Pereaksi Molisch ... 23
3.4.12 Pereaksi natrium hidroksida 2 N ... 23
3.4.13 Pereaksi timbal (II) asetat 0,4 N ... 24
3.5 Pengambilan dan Pengolahan Sampel ... 24
3.5.1 Pengambilan sampel ... 24
3.5.2 Identifikasi tumbuhan ... 24
3.6 Pengolahan Sampel ... 24
3.7 Pemeriksaan Karakteristik Simplisia ... 25
3.7.1 Penetapan kadar air ... 25
3.7.2 Penetapan kadar sari larut dalam air ... 26
3.7.3 Penetapan kadar sari larut dalam etanol ... 26
3.7.4 Penetapan kadar abu total ... 26
3.7.5 Penetapan kadar abu yang tidak larut dalam asam ... 27
3.8 Skrining Fitokimia ... 27
3.8.1 Penentuan golongan alkaloida ... 27
3.8.2 Penentuan golongan glikosida ... 28
3.8.3 Penentuan golongan triterpenoida/steroida ... 28
3.8.4 Penentuan golongan flavonoida ... 29
3.8.5 Penentuan golongan tanin ... 29
3.9 Pembuatan Ekstrak Etanol Daun Situduh Langit (EDSL) ... 29
3.10 Analisis EDSL secara Kromatografi Lapis Tipis (KLT) ... 30
3.11 Pembuatan Fraksi Kloroform EDSL ... 30
3.12 Analisis Fraksi Kloroform secara KLT ... 31
3.13 Isolasi Senyawa Saponin secara KLT Preparatif ... 31
3.14 Uji Kemurnian Terhadap Isolat ... 32
3.14.1 Uji kromatografi lapis tipis satu arah ... 32
3.14.2 Uji kromatografi lapis tipis dua arah ... 32
3.15 Karakterisasi Isolat ... 32
3.15.1 Karakterisasi isolat dengan spektrofotometer ultraviolet ... 32
3.15.2 Karakterisasi isolat dengan spektrofotometer inframerah ... 34
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Identifikasi Sampel ... 35
4.2 Pemeriksaan Karakteristik ... 35
4.3 Hasil Skrining Fitokimia ... 36
4.4 Ekstraksi ... 37
4.5 Hasil Analisis EDSL secara Kromatografi Lapis Tipis ... 38
4.6 Fraksi Kloroform dari EDSL ... 38
4.7 Analisis Fraksi Secara KLT. ... 38
4.8 KLT Preparatif pada Fraksi Kloroform ... 39
4.9 Uji Kemurnian Isolat ... 39
4.10 Identifikasi Isolat dengan Spektrofotometer Ultraviolet (UV) dan Spektrometer Inframerah (IR) ... 40
BAB V KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
LAMPIRAN ... 46
DAFTAR TABEL
Tabel Halaman
4.1 Hasil karakterisasi simplisia daun situduh langit ... 35 4.2 Hasil skrining senyawa kimia simplisia daun situduh langit ... 37
DAFTAR GAMBAR
Gambar Halaman
4.1 Hasil identifikasi isolat senyawa saponin daun situduh langit (Erigeron sumstrensis Retz.) dengan spektrofotometer
ultraviolet (UV) ... 40
4.2 Hasil identifikasi isolat senyawa saponin daun situduh langit (Erigeron sumstrensis Retz.) dengan spektrometer inframerah
(IR) ... 41
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi tumbuhan situduh langit (Erigeron sumstrensis Retz.) ... 46 2 Gambar tumbuhan situduh langit (Erigeron sumstrensis Retz.) 47 3 Gambar daun segar dan kering situduh langit (Erigeron
sumstrensis Retz.) ... 48 4 Gambar serbuk simplisia daun situduh langit (Erigeron
sumstrensis Retz.) ... 49 5 Perhitungan karakteristisasi simplisia ... 50 6 Bagan pembuatan serbuk simplisia, karakterisasi simplisia dan
skrining fitokimia daun situduh langit (Erigeron sumstrensis
Retz.)... 51 7 Bagan pembuatan ekstrak etanol daun situduh langit (Erigeron
sumstrensis Retz.) (EDSL) ... 54 8 Bagan analisis EDSL secara Kromatografi Lapis Tipis (KLT) .. 55 9 Bagan pembuatan fraksi kloroform daun situduh langit
(Erigeron sumstrensis Retz.) ... 56 10 Bagan isolasi senyawa saponin dari fraksi klorofrom daun
situduh langit (Erigeron sumstrensis Retz.) ... 57 11 Kromatogram hasil KLT ekstrak etanol daun situduh langit
(Erigeron sumstrensis Retz.) ... 58 12 Harga Rf hasil KLT ekstrak etanol daun situduh langit
(Erigeron sumstrensis Retz.) ... 59 13 Kromatogram hasil KLT fraksi kloroform daun situduh
langit (Erigeron sumstrensis Retz.) ... 60
14 Harga Rf hasil KLT fraksi kloroform daun situduh langit
(Erigeron sumstrensis Retz.) ... 61 15 Kromatogram hasil KLT preparatif fraksi kloroform daun
situduh langit (Erigeron sumstrensis Retz.) ... 62 16 Kromatogram hasil KLT 1 arah isolat senyawa saponin daun
situduh langit (Erigeron sumstrensis Retz.) ... 63 17 Kromatogram hasil KLT 1 arah isolat senyawa saponin daun
situduh langit (Erigeron sumstrensis Retz.) ... 64 18 Kromatogram hasil KLT 1 arah isolat senyawa saponin daun
situduh langit (Erigeron sumstrensis Retz.) ... 65 19 Kromatogram hasil KLT 2 arah isolat senyawa saponin daun
situduh langit (Erigeron sumstrensis Retz.) ... 66
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia dikenal sebagai Negara pemilik hutan tropis terbesar di dunia, menempati urutan ke-3 setelah Brazil dan Zaire. Sekitar 250.000 spesies tumbuhan yang ada di dunia, diperkirakan 30.000 spesies terdapat di seluruh kepulauan yang ada di Indonesia. Keanekaragaman hayati tumbuhan tropis Indonesia merupakan sumber kekayaan yang berpotensi sangat besar untuk dikembangkan dalam penemuan senyawa-senyawa baru yaitu senyawa metabolit sekunder yang memiliki bioaktivitas dan efek terapeutik (Nurhidayah, dkk., 2008).
Salah satu tumbuhan yang berkhasiat sebagai obat adalah situduh langit atau jalantir (Erigeron sumatrensis Retz.). Secara tradisional beberapa spesies dari jenis erigeron memiliki efek farmakologi untuk pengobatan sakit tenggorokan, sakit kepala, gangguan perut, cacar, pengobatan jerawat dan gangguan kulit lainnya (Jack, 2008; Ragasa, et al., 2009; Shaha, et al., 2012). Pada masyarakat Simalungun, daun situduh langit digunakan untuk mengobati sariawan dan sakit gigi, karena pada daun mengandung saponin dan polifenol. Akar berkhasiat sebagai obat nyeri pegal linu dan sakit pinggang yang mengandung saponin dan flavonoid. Kulit batang mengandung alkaloid, flavonoid, dan polifenol. (Heyne, 1987; Tersono, 2008).
Saponin merupakan senyawa fitokimia yang mempunyai karakteristik berupa kemampuan membentuk busa dan mengandung aglikon polisiklik yang berikatan dengan satu atau lebih gula (Majinda, 2012). Berdasarkan aktivitas, saponin mampu mengemulsi lemak (Cheeke, 2001; Bogoriani, 2015). Saponin
dapat diaplikasikan sebagai antimikroba, antijamur, obat hiperkolesterol, antitumor, antikanker, antidiabetes dan lain sebagainya (Netala, et al., 2015; Garai, 2014).
Beberapa tahun terakhir ini senyawa saponin tertentu menjadi penting karena dapat diperoleh dari beberapa tumbuhan dengan hasil yang baik dan digunakan sebagai bahan baku untuk sintesis hormon steroid yang digunakan dalam bidang kesehatan (Robinson, 1995). Pencarian saponin dalam tumbuhan telah dirangsang oleh kebutuhan akan sumber sapogenin yang mudah diperoleh dan dapat diubah di laboratorium menjadi sterol hewan yang berkhasiat penting (misalnya kortison, estrogen kontraseptif dan lain-lain (Harborne, 1987).
Pemurnian saponin dapat dilakukan dengan dihidrolisis dahulu menjadi aglikonnya dengan mendidihkan beberapa jam dalam HCl 1-4 M, aglikon diekstraksi dengan pelarut sesuai kepolarannya dan dapat dimurnikan dengan kromatografi (Robinson, 1995).
. Kromatografi digunakan untuk mengisolasi senyawa murni pada skala miligram sampai skala gram (Hostettmann, 1995). Isolat hasil uji kromatografi digunakan untuk menelaah struktur, uji biologi, uji farmakologi, senyawa pembanding dan senyawa baku untuk penentuan kuantitatif (Gandjar dan Rohman, 2007).
Berdasarkan latar belakang di atas maka pada penelititan ini dilakukan isolasi senyawa saponin dari daun situduh langit (Erigeron sumatrensis Retz.) yang meliputi karakterisasi simplisia, skrining fitokimia, ekstraksi serbuk simplisia dan dilanjutkan dengan kromatografi lapis tipis (KLT) dengan berbagai variasi fase gerak dan dipisahkan dengan KLT preparatif. Isolat yang diperoleh dikarakterisasi dengan spektrofotometer ultraviolet (UV-Vis) dan spektrofotometer inframerah (IR).
1.2 Perumusan Masalah
Berdasarkan uraian diatas, maka rumusan penelitian ini adalah:
a. Apakah karakteristik simplisia daun situduh langit memenuhi persyaratan secara umum.
b. Apakah senyawa saponin pada daun tumbuhan situduh langit dapat dipisahkan secara KLT dan KLT preparatif.
c. Berapakah panjang gelombang UV maksimum dan gugus fungsi apa saja yang terdapat pada isolat saponin.
1.3 Hipotesis
Berdasarkan perumusan masalah diatas, maka hipotesis dari penelitian ini adalah:
a. Karakteristik simplisia daun situduh langit memenuhi persyaratan secara umum.
b. Senyawa saponin pada daun tumbuhan situduh langit dapat dipisahkan secara KLT dan KLT preparatif.
c. Isolat dapat diperoleh memiliki panjang gelombang UV maksimum antara 200-400 nm dan memiliki gugus fungsi –OH, C–H, C=C dan C–O. dan lain sebagainya.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah:
a. Untuk mengetahui karakteristik simplisia daun situduh langit memenuhi persyaratan mutu simplisia secara umumnya.
b. Untuk mengetahui apakah senyawa saponin pada daun tumbuhan situduh langit dapat dipisahkan secara KLT dan KLT preparatif.
c. Untuk mengetahui panjang gelombang UV maksimum dan gugus fungsi yang terdapat pada isolat yang diperoleh.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi mengenai karakteristik simplisia daun situduh langit, cara dan hasil isolasi saponin dari daun tumbuhan situduh langit.
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Habitat
Tumbuhan sitiduh langit (Erigeron sumatrensis Retz.) berasal dari Amerika tropis dan di Jawa ditemukan tumbuh mulai dari dataran rendah sampai
± 2650 m dpl (di atas permukaan laut), sering tumbuh sebagai tumbuhan penggangu yang tidak begitu merugikan terutama di daerah tidak begitu subur (Heyne, 1987).
2.1.2 Morfologi
Tumbuhan ini merupakan terna yang tegak dan bagian kaki berkayu, tinggi 0,3 m sampai 3,5 m di bagian bawah pada umumnya tidak bercabang, tetapi dibagian atas sering bercabang, batang memiliki rusuk-rusuk yang menyolok.
Daun tunggal berwarna hijau, bersilang, tepi bergerigi, ujung runcing, panjang 4-7 cm, lebar 1-2 cm, tangkai silindris, pertulangan menyirip. Tumbuhan ini memiliki bunga majemuk di ketiak daun, kelopak bentuk mangkok, hijau, benang sari panjang 4-5 mm, jumlah lima, kuning, tangkai putik silindris, panjang 3-4 mm, kuning, kepala putik bulat, kuning, mahkota halus, kuning pucat. Buah dari tumbuhan ini berbentuk bulat telur berwarna putih dan biji bulat telur, kecil berwarna putih. Akar tunggang berwarna putih kotor (Heyne, 1987)
2.1.3 Nama Umum
Di Indonesia, situduh langit dikenal dengan nama jabung, jalantir (Sunda), jabungan, jentik manis, sembungan (Jawa), kamandhin kerbhuy (Madura) (Heyne, 1987; Tersono, 2008).
2.1.4 Sinonim
Situduh langit memiliki beberapa sinonim yaitu, Erigeron linifolius Auct.
non Willd, Conyza angustifolia Thwait, Conyza sumatrensis (Retz.) E. Walker, (Heyne, 1987).
2.1.5 Klasifikasi tumbuhan Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Asterales Suku : Compositae Marga : Erigeron
Jenis : Erigeron sumatrensis Retz.
2.1.6 Kegunaan
Daun situduh langit berkhasiat sebagai obat sakit kepala (pusing) dan akarnya berkhasiat sebagai obat pegal linu. Untuk obat sakit kepala (pusing) dipakai ± 10 gram daun segar, dicuci dan ditumbuk halus, kemudian ditempelkan di dahi sebagai pilis. Di Bogor Heyne mendapatkan keterangan bahwa setelah akar diremas-remas dengan adas-pulasari dapat dioleskan pada pinggang untuk pengobatan penyakit pinggang tertentu (Heyne, 1987; Tersono, 2008).
2.1.7 Kandungan kimia
Daun dan akar mengandung saponin, di samping itu daunnya juga mengandung polifenol dan akarnya juga mengandung flavonoida. Kulit batangnya mengandung alkaloida, flavonoida dan polifenol (Tersono, 2008).
2.2 Uraian Kimia 2.2.1 Glikosida
Glikosida adalah senyawa organik yang bila dihidrolisis menghasilkan satu atau lebih gula yang disebut glikon dan bagian bukan gula yang disebut aglikon.
Gula yang paling sering dijumpai dalam glikosida adalah glukosa. Secara kimia dan fisiologi, glikosida alam cenderung dibedakan berdasarkan bagian aglikonnya (Robinson, 1995).
Hubungan ikatan antara aglikon dan glikon glikosida dapat dibedakan menjadi empat yaitu:
1. Tipe O-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom O, contoh: salicin.
2. Tipe S-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom S, contoh: sinigrin.
3. Tipe N-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom N, contoh: visin dan krotonosid
4. Tipe C-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom C, contoh: aloin (Farnsworth, 1966).
2.2.2 Saponin
Saponin adalah glikosida triterpenoid dan sterol (Harborne, 1987). Saponin mula-mula diberi nama demikian karena sifatnya menyerupai sabun (bahasa Latin sapo berarti sabun). Saponin merupakan senyawa aktif permukaan yang kuat, yang menimbulkan busa jika dikocok dalam air dan pada konsentrasi yang rendah sering menimbulkan hemolisis sel darah merah, dalam larutan yang sangat encer
saponin sangat beracun untuk ikan. Beberapa saponin bekerja sebagai antimikroba. Saponin merupakan senyawa berasa pahit dan mengakibatkan iritasi terhadap selaput lender (Robinson, 1995).
Pencarian saponin dalam tumbuhan telah dirangsang oleh kebutuhan akan sumber sapogenin yang mudah diperoleh dan dapat diubah dilaboratorium menjadi sterol hewan yang berkhasiat penting (misalnya kortison, estrogen kontraseptif, dan lain-lain). Pola glikosida saponin kadang-kadang rumit, banyak saponin yang mempunyai satuan gula sampai lima dan komponen yang umum ialah asam glukoronat (Harbone, 1987). Senyawa saponin secara umum dapat diidentifikasi dari warna yang dihasilkannya dengan pereaksi Liebermann- Burchard. Warna biru-hijau menunjukkan adanya senyawa saponin steroida, dan warna merah, merah muda, atau ungu menunjukkan adanya senyawa saponin triterpenoida (Farnsworth, 1966).
Saponin triterpenoida dan saponin steroida memiliki hubungan glikosidik pada atom C-3 dan memiliki asal usul biogenetika yang sama lewat asam mevalonat dan satuan-satuan isoprenoid. Kedua jenis saponin ini larut dalam air dan etanol tetapi tidak larut dalam eter. Aglikonnya diperoleh dengan hidrolisis dalam suasana asam atau enzim, dan tanpa gula ciri kelarutannya sama dengan ciri sterol lain (Gunawan dan Mulyani, 2004; Robinson 1995). Tipe aglikon senyawa saponin dapat dilihat pada gambar di bawah ini (Farnsworth, 1966):
Gambar 2.1 Sapogenin (Farnsworth, 1966)
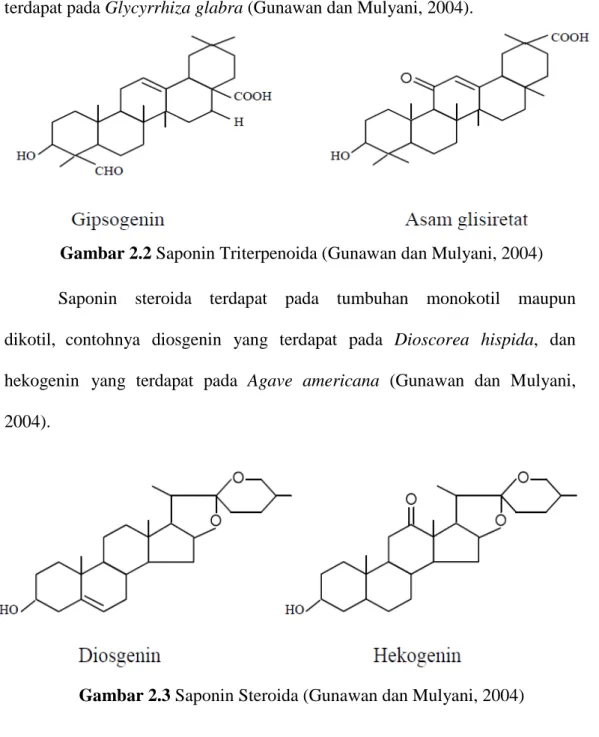
Saponin triterpenoida secara umum banyak terdapat pada tumbuhan dikotil seperti: gipsogenin terdapat pada Gypsophylla sp., dan asam glisiretat terdapat pada Glycyrrhiza glabra (Gunawan dan Mulyani, 2004).
Gambar 2.2 Saponin Triterpenoida (Gunawan dan Mulyani, 2004) Saponin steroida terdapat pada tumbuhan monokotil maupun dikotil, contohnya diosgenin yang terdapat pada Dioscorea hispida, dan hekogenin yang terdapat pada Agave americana (Gunawan dan Mulyani, 2004).
Gambar 2.3 Saponin Steroida (Gunawan dan Mulyani, 2004)
2.2.5 Flavonoid
Flavonoid merupakan salah satu metabolit sekunder. Keberadaannya dalam daun kemungkinan dipengaruhi oleh adanya proses fotosintetis sehingga daun muda belum terlalu banyak mengandung flavonoida (Markham, 1998). Senyawa
flavonoida mempunyai struktur C6-C3-C6. Tiap bagian C6 merupakan cincin benzena yang dihubungkan oleh atom C3 yang merupakan rantai alifatik (Sastrohamidjojo, 1995; Markham, 1998).
Flavonoida umumnya terdapat dalam tumbuhan terikat pada gula sebagai glikosida. Flavonoida terdapat dalam bentuk bebas maupun terikat sebagai glikosida. Glikosidanya larut dalam air dan etanol tapi tidak larut dalam pelarut organik, sedangkan geninnya (aglikon) tidak larut dalam air tetapi larut dalam pelarut-pelarut organik (Markham, 1998).
2.2.4 Triterpenoid/Steroid
Steroid adalah triterpen yang kerangka dasarnya sistem cincin siklopentana perhidrofenantren. Senyawa steroid dahulu dianggap sebagai senyawa satwa, yaitu sebagai hormon kelamin, asam empedu dan lain-lain. Salah satu estrogen hewan adalah esteron. Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintetis diturunkan dari hidrokarbon C30 asiklik, yaitu skualen. Senyawa ini berstruktur siklik yang relatif rumit, kebanyakan berupa alkohol, aldehida atau asam karboksilat. Mereka berupa senyawa tanpa warna, berbentuk kristal, seringkali bertitik leleh tinggi dan aktif optik. Triterpenoid dapat dibagi atas 4 golongan senyawa, yaitu triterpen sebenarnya, steroid, saponin dan glikosida jantung (Harborne, 1987).
2.3 Metode Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut tertentu. Proses ekstraksi akan menghasilkan ekstrak, berupa ekstrak kental, ekstrak padat maupun
ekstrak cair yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan. Beberapa metode ekstraksi dengan menggunakan pelarut menurut Depkes R.I. (2000) yaitu:
A. Cara dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan menggunakan alat perkolator dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak), terus-menerus sampai diperoleh perkolat.
B. Cara panas 1. Refluks
Refluks adalah proses penyarian simplisia dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Digesti
Digesti adalah proses penyarian simplisia dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur kamar, yaitu 40-50°C.
3. Sokletasi
Sokletasi adalah proses penyarian menggunakan pelarut yang selalu baru, yang umumnya dilakukan dengan menggunakan alat soklet sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
4. Infudasi
Infudasi adalah proses penyarian dengan pelarut air pada temperatur 90°C selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan pelarut air pada temperatur 90°C selama 30 menit.
2.4 Kromatografi
Kromatografi adalah suatu metode pemisahan berdasarkan perbedaan perpindahan dari komponen-komponen senyawa di antara dua fase yaitu fase diam (dapat berupa zat cair atau zat padat) dan fase gerak (dapat berupa gas atau zat cair). Karena fase bergerak dapat berupa zat cair atau gas maka semua ada empat macam sistem kromatografi. Keempat macam sistem kromatografi tersebut adalah :
1. Fase bergerak zat cair – fase tetap padat, dikenal dengan kromatografi serapan yang meliputi kromatografi lapis tipis dan kromatografi penukaran ion
2. Fase bergerak gas – fase tetap padat, meliputi kromatografi gas padat
3. Fase bergerak sat cair – fase tetap zat cair, dikenal dengan kromatografi
partisi, meliputi kromatografi kertas
4. Fase bergerak gas – fase tetap zat cair, meliputi kromatografi gas cair dan kromatografi kolom kapiler (Sastrohamidjojo, 1985).
Pemisahan dan pemurnian kandungan tumbuhan dilakukan dengan menggunakan salah satu atau gabungan dari beberapa teknik tersebut dan dapat digunakan pada skala mikro maupun makro (Harborne, 1987).
2.4.1 Kromatografi kolom
Kromatografi kolom merupakan bentuk dari kromatografi cair. Fase diam, baik bahan yang jerap (KCP) atau film zat cair pada penyangga (KCC), ditempatkan di dalam tabung kaca berbentuk silinder, pada bagian bawah tertutup dengan katup atau keran, dan fasae gerak dibiarkan mengalir ke bawah melaluinya karena gaya berat (Gritter, dkk., 1991).
2.4.2 Kromatografi cair kinerja tinggi
KCKT dilakukan baik sebagai metode cair-padat maupun sebagai metode cair-cair. Segi unik KCKT ialah dengan pemakaian salah satu jenih detektor yang sangat peka untuk menganalisis eluen dari kolom jika kita memisahkan linarut yang tidak berwarna atau yang konsestrasinya rendah (Gritter, dkk., 1991).
2.4.3 Kromatografi gas
Dalam kromatografi gas, fase gerak berupa gas lembam seperti helium, nitrogen, argon atau bahkan hidrogen yang digerakkan dengan tekanan melalui pipa yang berisi fase diam. Walaupun dikenal sebagai kromatografi gas padat, dengan fase diam berupa permukaan zat padat, kromatografi jenih ini tidak dipakai seluas kromatografi gas cair yang fase diamnya lapisan zat cair. Pada kromatografi gas, hal yang sangat penting ialah kelarutan, dimana kelarutan
berkaitan erat dengan suhu, maka pengendalian suhu yang tepat adalah keharusan (Gritter, dkk., 1991).
2.4.4 Kromatografi kertas
Pemisahan dengan kromatografi kertas biasa dikenal dengan analisa kapiler. Metode yang bersesuaian dengan kromatografi serapan, dimana salah satu zat padat dapat digunakna untuk menyokong fase tetap yaitu bubuk selulosa. Pada kromatografi kertas peralatan yang dipakai tidak perlu alat-alat yang teliti dan mahal. Senyawa yang terdeteksi pada kertas dapat segera diidentifikasi dengan cara memotong-motong kertas kemudian dilarutkan secara terpisah. Cara kerjanya mirip sdengan kromatografi lapis tipis (Sastrohamidjojo, 1985).
2.4.5 Kromatografi lapis tipis
Kromatografi lapis tipis (KLT) merupakan bentuk kromatografi planar, dimana fase diamnya berupa lapisan yang seragam pada permukaan bidang datar yang didukung oleh lempeng kaca, lempeng aluminium atau lempeng plastik (Gandjar dan Rohman, 2007). Campuran yang akan dipisah berupa larutan yang ditotolkan baik berupa bercak ataupun pita. Setelah plat atau lapisan dimasukkan ke dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama perambatan kapiler (pengembangan).
Selanjutnya senyawa yang tidak berwarna harus ditampakkan (Stahl, 1985).
a. Penyerap/fase diam KLT
Fase diam yang digunakan dalam KLT merupakan penyerap berukuran kecil dengan diameter partikel antara 10-30 µm. Semakin kecil ukuran rata-rata partikel fase diam dan semakin sempit kisaran ukuran fase diam, maka semakin
baik kinerja KLT. Penyerap yang paling sering digunakan adalah silika dan serbuk sellulosa (Gandjar dan Rohman, 2007).
b. Fase gerak pada KLT
Fase gerak yang digunakan pada KLT dapat dipilih dari pustaka, tetapi lebih sering dengan mencoba-coba. Biasanya fase gerak yang digunakan berisi dua campuran pelarut organik karena daya elusi campuran kedua pelarut ini dapat mudah diatur sedemikian rupa sehingga pemisahan dapat terjadi secara optimal.
Fase gerak yang digunakan harus memiliki tingkat kemurniaan yang tinggi sehingga dapat memberikan pemisahan yang baik (Gandjar dan Rohman, 2007).
c. Harga Rf
Rf atau faktor retardasi didefiniskan sebagai perbandingan antara jarak yang ditempuh solut dengan jarak yang ditempuh oleh fase gerak. Nilai Rf ini terkait dengan faktor perlambatan dan nilai ini bukanlah suatu nilai fisika absolut untuk suatu komponen, meskipun demikian dengan pengendalian kondisi KLT secara hati-hati, nilai Rf dapat digunakan sebagai cara kualitatif. Nilai maksimum Rf adalah 1 dan nilai minimumnya adalah 0 (Sastrohamidjojo, 1985).
Rf= Jarak yang ditempuh solut Jarak yang ditempuh fase gerak
Faktor yang mempengaruhi harga Rf yaitu struktur kimia dari senyawa yang dipisahkan, sifat dari penyerap dan derajat aktifitasnya, tebal dan keterataan dari lapisan penyerap, pelarut dan derajat kemurniannya, derajat kejenuhan uap pengembang dalam bejana, teknik percobaan, jumlah cuplikan yang digunakan, suhu dan kesetimbangan (Sastrohamidjojo, 1985).
2.4.5.1 Kromatografi lapis tipis preparatif
Kromatografi lapis tipis (KLT) preparatif merupakan salah satu metode pemisahan dengan menggunakan peralatan sederhana. Ketebalan penyerap yang sering dipakai adalah 0,5-2 mm. Plat kromatografi biasanya berukuran 20 x 20 cm. Pembatasan ketebalan lapisan dan ukuran plat sudah tentu mengurangi jumlah bahan yang dapat dipisahkan dengan KLT preparatif. Penyerap yang paling umum digunakan adalah silika gel. Penotolan cuplikan dilakukan dengan melarutkan cuplikan dalam sedikit pelarut. Cuplikan ditotolkan berupa pita dengan jarak sesempit mungkin karena pemisahan tergantung pada lebar pita. Penotolan dapat dilakukan dengan pipet tetapi lebih baik dengan penotol otomatis. Pengembangan plat KLT preparatif dilakukan dalam bejana kaca yang dapat menampung beberapa plat. Bejana dijaga tetap jenuh dengan pelarut pengembang dengan bantuan kertas saring yang diletakkan berdiri di sekeliling permukaan bagian dalam bejana (Hostettmann, 1995).
2.4.5.2 KLT dua arah
KLT dua arah atau KLT dua dimensi ini bertujuan untuk meningkatkan resolusi sampel ketika komponen-komponen solut mempunyai karakteristik kimia yang hampir sama, karena nilai Rf juga hampir sama, selain itu dua sistem fase gerak yang sangat berbeda dapat digunakan secara berurutan pada suatu campuran tertentu sehingga memungkinkan untuk melakukan pemisahan analit yang mempunyai tingkat polaritas yang hampir sama (Gandjar dan Rohman, 2007).
Cuplikan ditotolkan pada satu sudut lapisan yang berbentuk bujur sangkar dan dikembangkan dengan satu sistem pelarut sehingga campuran terpisah menurut jalur yang sejajar dengan salah satu sisi. Plat diangkat, dikeringkan, diputar 90 derajat, lalu diletakkan di dalam sistem pelarut yang kedua sehingga
bercak yang terpisah pada pengembangan pertama terdapat di sepanjang bagian bawah plat. Komponen yang terpisah (bercak) biasanya terdapat dimana saja pada lapisan (Gritter, dkk., 1991).
2.5 Spektrofotometri
2.5.1 Spektrofotometri ultraviolet (UV)
Prinsip spektrofotometri ultraviolet adalah interaksi terjadi antara energi yang berupa sinar monokromatis dari sumber sinar dengan materi yang berupa molekul. Prinsip kerja spektrofotometri ultraviolet berdasarkan hukum Lambert- Beer, bila cahaya/sinar monokromatis melalui suatu media (larutan), maka sebagian cahaya tersebut diserap, sebagian dipantulkan dan sebagian lagi dipancarkan (Dachriyanus, 2004).
Spektrofotometer UV-Vis pada umunya digunakan untuk:
1. Menentukan jenis kromofor, ikatan rangkap yang terkonyugasi dan auksokrom dari suatu senyawa organik.
2. Menjelaskan informasi dari struktur berdasarkan penjang gelombang maksimum suatu senyawa.
3. Mampu menganalisis senyawa organik secara kuantitatif dengan menggunakan hukum Lambert-Beer (Dachriyanus, 2004).
Spektrum ultraviolet adalah suatu gambaran yang menyatakan hubungan antara panjang gelombang atau frekuensi sinar UV terhadap intensitas serapan (absorbansi). Sinar ultraviolet mempunyai panjang gelombang antara 200-400 nm.
Serapan cahaya oleh molekul dalam daerah spektrum ultraviolet tergantung pada struktur elektronik dari molekul yang bersangkutan (Sastrohamidjojo, 1985).
Transisi-transisi elektronik yang terjadi diantara tingkat-tingkat energi di dalam suatu molekul ada 4, yaitu transisi sigma-sigma star (σ→σ*), transisi n-sigma star (n→σ*), transisi n-phi star (n→π*) dan transisi phi-phi star (π→π*) (Gandjar dan Rohman, 2007).
a. Transisi sigma-sigma star (σ→σ*)
Energi yang diperlukan untuk transisi ini besarnya sesuai dengan energi sinar yang frekuensinya terletak diantara UV vakum (kurang dari 180 nm), contoh metana yang hanya mempunyai jenis ikatan –C-H, mempunyai pita serapan elektron sigma pada panjang gelombang 125 nm.
b. Transisi non bonding electron (n)-sigma star (n→σ*)
Jenis transisi ini terjadi pada senyawa organik jenuh yang mengandung atom-atom yang memiliki elektron bukan ikatan (elektron n). Energi yang diperlukan untuk transisi ini lebih kecil dibanding transisi σ→σ*, sehingga sinar yang diserappun mempunyai panjang gelombang lebih panjang, yakni sekitar 150-250 nm.
c. Transisi n→π* dan transisi π→π*
Untuk memungkinkan terjadinya jenis transisi ini, maka molekul organik harus mempunyai gugus fungsional yang tidak jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan orbital phi yang diperlukan. Jenis transisi ini merupakan transisi yang paling cocok untuk analisis sebab sesuai dengan panjang gelombang antara 200-700 nm, dan panjang gelombang ini secara teknis dapat diaplikasikan pada spektrofotometer.
Perbedaan antara transisi n→π* dan transisi π→π* adalah:
n→π* π→π*
a. Absorbtivitas molar (ε) antara 10- 100 liter. cm-1.mol-1
b. Biasanya, pelarut yang polar menyebabkan pergesaran biru atau hypsochromic shift (pergeseran pita serapan ke arah panjang gelombang yang lebih pendek)
a. Absorbtivitas molar (ε) antara 1000-10.000 liter. cm-1. mol-1 b. Biasanya, pelarut yang polar
menyebabkan pergesaran merah atau bathchromic shift (pergeseran ke arah panjang gelombang yang lebih panjang)
2.5.2 Spektrofotometri inframerah
Spektrofotometri inframerah pada umumnya digunakan untuk:
1. Menentukan gugus fungsi suatu senyawa organik
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya.
Prinsip kerja spektrofotometri inframerah yaitu interaksi energi dengan suatu materi. Spektrofotometri inframerah berfokus pada radiasi elektromagnetik pada rentang frekuensi 4000-200 cm-1 (Khopkar, 1990). Bentuk spektrum inframerah yang dihasilkan berupa grafik yang menunjukkan persentase transmitan yang bervariasi pada setiap frekuensi radiasi inframerah. Satuan frekuensi yang digunakan pada garis horizontal yang dinyatakan dalam bilangan gelombang yang didefinisikan sebagai banyaknya gelombang dalam tiap satuan panjang.
Pengukuran pada spektrum inframerah dilakukan pada daerah cahaya inframerah tengah (mid-infrared) yaitu panjang gelombang 2,5-50 µm atau bilangan gelombang 4000-200 cm-1. Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul yang dapat menyebabkan pita dan absorbs sinar inframerah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi (Dachriyanus, 2004). Daerah spektra spektroskopi
inframerah dibagi dalam tiga kisaran yaitu inframerah dekat (12.500-4000 cm-1), inframerah tengah (4000-400 cm-1) dan inframerah jauh (400-100 cm-1). Daerah inframerah tengah merupakan daerah yang digunakan untuk penentuan gugus fungsi (Gandjar dan Rohman, 2007).
Menafsirkan sebuah spektrum inframerah tidak terdapat aturan yang pasti., tetapi terdapat beberapa syarat yang harus dipenuhi sebelum mencoba menafsirkan sebuah spektrum, yaitu:
1. Spektrum harus cukup terpisah dan mempunyai kuat puncak yang memadai.
2. Spektrum harus dibuat dari senyawa yang cukup murni.
3. Spektrofotometer harus dikalibrasi sehingga pita akan teramati pada kerapatan atau panjang gelombang yang semestinya. Kalibrasi yang betul dapat dilakukan dengan baku-baku yang dapat dipercaya, misalnya polisterna.
4. Metode penanganan cuplikan harus ditentukan., seperti pada penggunaan pelarut, maka macam dan konsentrasi pelarut serta tebal sel harus disebutkan juga (Silverstein, 1986).
Dua kawasan penting dalam pemeriksaan awal sebuah spektrum adalah daerah 4000 – 1300 cm-1 (2,5 – 7,7 µm) dan daerah 909 – 650 cm-1 (11,0 – 15,4 µm). Bagian kerapatan tinggi sebuah spektrum disebut sebagai daerah gugus fungsi. Kerapatan uluran khas bagi gugus-gugus fungsi yang penting seperti -OH, NH dan C=O terletak pada bagian itu. Ketiadaan serapan pada selang jejak gugus- gugus tertentu biasanya dapat digunakan sebagai bukti bahwa molekul itu tidak mempunyai gugus-gugus tersebut. Menafsirkan seperti itu harus dengan hati-hati, sebab suatu struktur tertentu yang khas dapat menyebabkan sebuah pita menjadi sangat lebar sehingga tidak terartikan (Silverstein, 1986).
BAB III
METODE PENELITIAN
Metode penelitian ini meliputi pengumpulan dan pembuatan simplisia, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, analisis ekstrak dengan kromatografi lapis tipis (KLT), isolasi senyawa saponin menggunakan KLT preparatif, uji kemurnian isolat dan karakterisasi isolat dengan spektrofotometri ultra violet (UV) dan spektrofotometri infra merah (IR).
3.1 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Fitokimia Fakultas Farmasi Universitas Sumatera Utara dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.2 Alat-Alat
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat kaca laboratorium, blender, mixture vibrator, neraca analitik, oven listrik, penangas air, penguap vakum putar (rotary evaporator), seperangkat alat kromatografi lapis tipis (Desaga), seperangkat alat penentuan kadar air (alat stahl), spektrofotometer infra merah (Shimadzu), spektrofotometer ultra violet (Shimadzu) dan tanur.
3.3 Bahan-Bahan
Bahan-bahan yang digunakan adalah daun situduh langit (Erigeron sumatrensis Retz.) dan bahan-bahan kimia berkualitas Merck yang digunakan
kecuali dinyatakan lain berkualitas pro analisis yaitu α-naftol, amil alkohol, amonia pekat, asam asetat anhidrida, asam klorida pekat, asam sulfat pekat, besi (III) klorida, bismut (III) nitrat, etilasetat, iodium, isopropanol, kalium iodida, kloroform, metanol, n- heksana, natrium hidroksida, natrium sulfat anhidrida, raksa (II) klorida, serbuk magnesium, timbal (II) asetat dan toluena. Air suling dan etanol hasil destilasi.
3.4 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi dibawah ini menurut Depkes R.I. (1995).
3.4.1 Larutan air-kloroform
Sebanyak 2,5 ml kloroform dikocok dengan 900 ml air suling, encerkan dengan air suling hingga 1000 ml.
3.4.2 Larutan kloralhidrat
Sebanyak 50 gram kloralhidrat ditimbang dan dilarutkan dalam 20 ml air suling.
3.4.3 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga 100 ml.
3.4.4 Pereaksi asam sulfat 50% dalam metanol
Sebanyak 5 ml asam sulfat pekat ditambahkan hati-hati kepada 5 ml metanol.
3.4.5 Pereaksi asam nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga 100 ml.
3.4.6 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml.
3.4.7 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling hingga 100 ml.
3.4.8 Pereaksi Dragendorff
Larutan bismut nitrat P 40% b/v dalam asam nitrat P sebanyak 20 ml dicampur dengan 50 ml kalium iodida P 54,4% b/v, didiamkan sampai memisah sempurna. Lalu diambil lapisan jernih dan diencerkan dengan air suling secukupnya hingga 100 ml.
3.4.9 Pereaksi Liebermann-Burchard
Sebanyak 5 ml asam asetat anhidrida dicampurkan dengan 5 ml asam sulfat 97%, kemudian ditambahkan tambahkan campuran tersebut ke dalam 50 ml etanol (Merck, 1978).
3.4.10 Pereaksi Mayer
Larutan raksa (II) klorida P 2,27% b/v sebanyak 60 ml dicampur dengan 10 ml larutan kalium iodida P 50% b/v, kemudian ditambahkan air suling secukupnya hingga 100 ml.
3.4.11 Pereaksi Molisch
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh volume 100 ml.
3.4.12 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida dilarutkan dalam air suling bebas
karbon dioksida hingga 100 ml.
3.4.13 Pereaksi timbal (II) asetat 0,4 N
Sebanyak 15,17 gram timbal (II) asetat dilarutkan dalam air suling bebas karbondioksida secukupnya hingga 100 ml.
3.5 Pengambilan dan Pengolahan Sampel 3.5.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif tanpa membandingkan tumbuhan yang sama dari daerah lain. Sampel yang digunakan dalam penelitian ini adalah daun situduh langit (Erigeron sumatrensis Retz.) segar yang diambil dari Desa Tanjung Mariah, Kecamatan Panei, Kabupaten Simalungun, Provinsi Sumatera Utara.
3.5.2 Identifikasi tumbuhan
Identifikasi daun tumbuhan situduh langit dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Pusat Penelitian dan Pengembangan Biologi-Bogor.
3.6 Pengolahan Sampel
Daun situduh langit (Erigeron sumatrensis Retz.) disortir dan dipisahkan antara ranting pohon dan daun, dibersihkan dari pengotor dengan air mengalir, ditiriskan dan dikeringkan. Simplisia dinyatakan kering bila diremas akan mudah hancur, kemudian simplisia dihaluskan atau dijadikan serbuk menggunakan blender dan ditimbang, selanjutnya disimpan dalam wadah bersih yang tertutup rapat dan di tempat yang sejuk. Bagan pengolahan sampel dapat dilihat pada Lampiran 6 halaman 53.
3.7 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi penetapan kadar air, kadar sari larut dalam air, kadar sari yang dalam etanol, kadar abu total, dan kadar abu yang tidak larut dalam asam.
3.7.1 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluena) (Depkes R.I., 1995).
Cara kerja:
1. Penjenuhan toluena
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam kemudian toluena didinginkan dengan cara didiamkan selama 30 menit dan volume air pada tabung penerima dibaca dengan 0,05 ml (Depkes R.I., 1995).
2. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu alas bulat yang berisi toluena tersebut, lalu dipanaskan hati-hati selama 15 menit hingga toluena mendidih. Kecepatan tetesan diatur lebih kurang 2 tetesan per detik, sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan hingga 4 tetes per detik hingga semua air terdestilasi. Bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin sampai suhu kamar. Setelah air dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa (Depkes R.I., 1995).
3.7.2 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml air-kloroform dalam labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam lalu disaring.
Sejumlah 20 ml filtrat diuapkan hingga kering dalam cawan penguap berdasar rata yang telah ditara. Sisa dipanaskan pada suhu 105˚C sampai bobot tetap. Kadar sari larut dalam air dihitung dengan persen terhadap bahan yang telah kering (Depkes R.I., 1995).
3.7.3 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml etanol 96% dalam labu bersumbat sambil dikocok selama 18 jam kemudian disaring cepat untuk menghindari penguapan etanol 96%. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap berdasar rata yang telah ditara dan sisanya dipanaskan pada suhu 1050C sampai bobot tetap. Kadar sari larut dalam etanol dihitung dalam persen terhadap bahan yang telah kering (Depkes R.I., 1995).
3.7.4 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan ke dalam cawan porselin yang telah dipijar dan ditara. Kurs dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 500-600˚C selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap.
Kadar abu dihitung terhadap bahan yang telah kering (Depkes R.I., 1995).
3.7.5 Penetapan kadar abu yang tidak larut dalam asam
Abu yang telah diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring (fast filter ashless) dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang kering (Depkes R.I., 1995).
3.8 Skrining Fitokimia
Pemeriksaan skrining fitokimia (uji pendahuluan) dilakukan berdasarkan metode dari Depkes R.I. (1995) dan Farnsworth (1966) yang meliputi senyawa alkaloid, glikosida, flavonoid, saponin, tannin dan triterpenoid/steroid.
3.8.1 Pemeriksaan alkaloida
Sebanyak 0,5 gram serbuk simplisia ditimbang menggunakan neraca analitik, kemudian ditambahkan 1 ml larutan HCl encer (HCl 2N) dan 9 ml air suling di dalam erlenmeyer, dipanaskan di atas penangas air selama 2 menit, kemudian didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk percobaan berikut:
a. Tiga tetes filtrat, ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan berwarna kuning.
b. Tiga tetes filtrat, ditambahkan 2 tetes pereaksi Bouchardat, akan terbentuk endapan berwarna jingga.
c. Tiga tetes filtrat, ditambahkan 2 tetes pereaksi Dragendorff akan terbentuk endapan berwarna kuning (Depkes R.I., 1995).
3.8.2 Pemeriksaan glikosida
Sebanyak 3 gram serbuk simplisia ditimbang, lalu disari dengan 30 ml campuran dari 7 bagian etanol 95% dan 3 bagian air suling. Direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran 2 bagian isopropanol dan 3 bagian kloroform, perlakuan ini dilakukan sebanyak 3 kali. Sari air dikumpulkan dan ditambahkan Na2SO4 anhidrat, disaring, kemudian diuapkan pada temperatur tidak lebih dari 50oC, sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut: 0,1 ml larutan percobaan dimasukkan dalam tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa ditambahkan 2 ml akuades dan 5 tetes larutan pereaksi Molish, lalu ditambahkan dengan hati-hati 2 ml asam sulfat pekat, terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya ikatan gula (glikon) (Depkes R.I., 1995).
3.8.3 Pemeriksaan triterpenoida/steroida
Sebanyak 1 gram serbuk simplisia dimaserasi dengan 20 ml n-heksan selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Burhard), diteteskan pada saat akan mereaksikan sampel uji. Apabila terbentuk warna biru atau biru hijau menunjukkan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1987).
3.8.4 Pemeriksaan flavonoida
Sebanyak 10 gram serbuk simplisia ditambah 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas. Ditambahkan 0,1 gram serbuk Mg, 1 ml asam klorida pekat dan 2 ml amil alkohol ke dalam 5 ml filtrat, dikocok dan dibiarkan memisah. Flavonoid positif jika pada lapisan amil alkohol terjadi warna merah kekuningan atau jingga (Farnsworth, 1966).
3.8.5 Pemeriksaan tanin
Sebanyak 0,5 gram serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.8.6 Pemeriksaan saponin
Sebanyak 0,5 gram serbuk simplisia dimasukkan ke dalam tabung reaksi, ditambahkan 10 ml air suling panas, didinginkan, kemudian dikocok kuat-kuat selama 10 detik. Saponin positif jika terbentuk busa yang stabil tidak kurang dari 10 menit setinggi 1 sampai 10 cm dan dengan penambahan 1 tetes asam klorida 2 N buih tidak hilang (Depkes R.I., 1995).
3.9 Pembuatan Ekstrak Etanol Daun Situduh Langit (EDSL)
Ekstraksi simplisia daun situduh langit dilakukan menurut Depkes RI, 2010.
Cara kerja:
Satu bagian serbuk kering simplisia dimasukkan ke dalam maserator, tambahkan 10 bagian etanol 80%. Rendam selama 6 jam pertama sambil sekali- sekali diaduk, kemudian diamkan selama 18 jam. Pisahkan maserat dengan cara
pengendapan. Ulangi proses penyarian sekurang-kurangnya dua kali dengan jenis dan jumlah pelarut yang sama. Hasil maserasi disaring, kemudian dipekatkan dengan alat penguap vakum putar pada suhu 50˚C sampai diperoleh ekstrak etanol daun situduh langit (EDSL) cukup kental dan dipekatkan diatas penangas air hingga menjadi kental. Bagan pembuatan ekstrak etanol daun situduh langit dapat dilihat pada Lampiran 7 halaman 54.
3.10 Analisis EDSL secara Kromatografi Lapis Tipis (KLT)
EDSL dianalisis secara KLT menggunakan fase diam plat pra lapis silika gel GF 254 dengan fase gerak yang bervariasi yaitu: n-heksana-etilasetat perbandingan 9:1, 8:2, 7:3, 6:4, dan 5:5, aseton-n-heksana perbandingan 4:1 dan 1:4. Hasil analisis KLT diidentifikasi menggunakan penampak bercak Liebermann-Burchard (Nugraha, 2016; Harborne, 1987).
Cara kerja:
EDSL ditotolkan pada plat lapis tipis silika gel GF 254 (yang telah diaktifkan), kemudian dimasukkan ke dalam chamber yang telah jenuh dengan uap fase gerak. Setelah pengembangan selesai plat dikeluarkan dan dikeringkan, plat disemprot dengan penampak bercak Liebermann-Burchard dan dipanaskan dalam oven pada suhu 110˚C selama 5 menit lalu diamati perubahan warna yang terjadi. Hasil yang terbaik digunakan untuk analisis fraksi kloroform secara KLT.
Bagan analisis dapat dilihat pada Lampiran 8 halaman 55.
3.11 Pembuatan Fraksi Kloroform EDSL
Pembuatan fraksi kloroform EDSL dilakukan menurut (Jurzysta, 1972;
Harbne, 1987).
Cara kerja:
EDSL direfluks menggunakan HCl 2N selama 4-6 jam, disaring kemudian filtrat diekstraksi dengan kloroform, didiamkan selama 12-18 jam. Diambil lapisan kloroform (lapisan bawah) kemudian diuapkan hingga pekat, diperoleh fraksi kloroform. Fraksi kloroform dianalsis dengan menggunakan KLT. Bagan pembuatan fraksi koloroform dapat dilihat pada Lampiran 9 halaman 56.
3.12 Analisis Fraksi Kloroform secara KLT
Fraksi kloroform dianalisis secara KLT menggunakan fase diam plat pra lapis silika gel GF 254 dengan fase gerak n-heksana-etilasetat perbandingan 6:4, 7:3, 8:2. Hasil analisis KLT diidentifikasi menggunakan penampak bercak Liebermann-Burchard (Nugraha, 2016; Harbone, 1987).
Cara kerja:
Fraksi ditotolkan pada plat lapis tipis silika gel GF 254 (yang telah diaktifkan), kemudian dimasukkan ke dalam chamber yang telah jenuh dengan uap fase gerak. Setelah pengembangan selesai plat dikeluarkan dan dikeringkan, plat disemprot dengan penampak bercak Liebermann-Burchard dan dipanaskan dalam oven pada suhu 110˚C selama 5 menit lalu diamati perubahan warna yang terjadi. Hasil yang terbaik digunakan untuk pemisahan KLT preparatif. Bagan analisis fraksi kloroform dapat dilihat pada Lampiran 10 halaman 57.
3.13 Isolasi Senyawa Saponin secara KLT Preparatif
Uji KLT preparatif fraksi kloroform sebagai fase diam plat pra lapis silika gel GF 254, fase gerak digunakan n-heksana-etilasetat (7:3) dan sebagai
penampak bercak digunakan pereaksi Liebermann- Burchard (Nugraha, 2016;
Harbone, 1987; Hostettmann, 1995), Cara kerja:
Fraksi kloroform ditotolkan berupa pita pada jarak 1,5 cm dari tepi bawah plat KLT berukuran 20x20 cm yang telah diaktifkan, kemudian dimasukkan ke dalam chamber yang telah jenuh dengan uap fase gerak, pengembang dibiarkan naik membawa komponen yang ada, setelah mencapai batas pengembangan plat dikeluarkan dari bejana lalu dikeringkan. Bagian tengah plat ditutup dengan kaca yang bersih sedangkan pada sisi kanan dan kiri plat (± 1 cm) disemprot dengan penampak bercak Liebermann- Burchard. Selanjutnya, silika pada bagian tengah plat yang sejajar dengan bercak noda yang diinginkan dikerok dan dikumpulkan. Silika yang dikumpulkan dielusi dengan metanol p.a., disaring kemudian pelarutnya diuapkan. Masing-masing silika yang diperoleh diuji kembali dengan KLT untuk mengetahui isolat pada Rf berapa yang menghasilkan noda tunggal. Bagan isolasi senyawa saponin secara KLT preparatif dapat dilihat pada Lampiran 10 halaman 57.
3.14 Uji Kemurnian Terhadap Isolat
3.14.1 Uji kromatografi lapis tipis satu arah
Uji kemurnian isolat secara satu arah dilakukan dengan KLT menggunakan fase gerak n-heksana-etilasetat (7:3), n-heksana-etilasetat (9:1) dan toluen-etil asetat (6:4), fase diam plat pra lapis silika gel GF 254 serta penampak bercak Liebermann-Burchard (Sastrohamidjojo, 1985 dan Stahl, 1985).
Cara kerja:
Isolat ditotolkan pada plat lapis tipis silika gel GF 254, lalu dimasukan ke dalam bejana yang telah jenuh. Setelah pengembangan selesai, plat dikeluarkan dan dikeringkan, plat disemprot dengan penampak bercak dan dipanaskan di oven pada suhu 110 oC selama 5 menit lalu diamati perubahan warna yang terjadi dan dihitung harga Rf-nya.
3.14.2 Uji kromatografi lapis tipis dua arah
Terhadap hasil isolasi dilakukan KLT 2 arah menggunakan fase gerak n- heksana-etilasetat (7:3) dan toluena-etilasetat (5:5) fase diam plat pra lapis silika gel GF 254 serta penampak bercak Liebermann-Burchard (Sastrohamidjojo, 1985;
Harbone, 1987).
Cara kerja :
Isolat ditotolkan pada plat pra lapis silika gel GF 254 ukuran 10x10 cm lalu dikembangkan memakai fase gerak I yaitu n-heksana-etilasetat (7:3), hingga mencapai batas pengembangan, kemudian plat dikeluarkan dari dalam chamber dan dikeringkan, setelah plat kering, dikembangkan kembali dengan arah yang berbeda 90oC memakai fase gerak II yaitu toluena-etilasetat (5:5) disemprot dengan memakai penampak bercak Liebermann-Burchard, setelah itu plat dipanaskan pada suhu 110oC selama 5 menit lalu diamati perubahan warna yang terjadi.
3.15 Karakterisasi Isolat
Karakterisasi isolat dengan spektrofotometer ultraviolet (UV) dan spektrofotometer inframerah (IR) dilakukan di Laboratorium Penelitian Fakultas Farmasi USU Medan.
3.15.1 Karakterisasi isolat dengan spektrofotometer ultraviolet (UV)
Isolat hasil isolasi dilarutkan dalam pelarut metanol, kemudian dimasukkan kedalam kuvet yang telah dibilas dengan metanol, selanjutnya absorbansi larutan sampel diukur pada panjang gelombang 200-400 nm (Khopkar, 1990).
3.15.2 Karakterisasi isolat dengan spektrofotometer inframerah (IR)
Karakterisasi isolat dengan spektrofotometer inframerah dilakukan dengan cara mencampurkan 1 mg isolat dengan 100 mg kalium bromida menggunakan alat mixture vibrator dan dimasukkan ke dalam spektrofotometer inframerah serta diukur pada bilangan gelombang 4000-500 cm-1 (Khopkar, 1990).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Hasil identifikasi tanaman dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor menyebutkan bahwa sampel adalah daun situduh langit suku Compositae jenis Erigeron sumtrensis Retz (Marline, 2017). Hasil identifikasi dapat dilihat pada Lampiran 1 halaman 46 dan Gambar tumbuhan situduh langit dapat dilihat pada Lampiran 2 halaman 47.
4.2 Pemeriksaan Karakteristik
Hasil karakterisasi simplisia daun situduh langit (Erigeron sumatrensis Retz.) meliputi penetapan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total dan kadar abu yang tidak larut asam. Hasil karakterisasi dapat dilihat pada Tabel 4.1 dan perhitungan karakterisasi dapat dilihat pada Lampiran 5 halaman 50.
Tabel 4.1 Hasil karakterisasi simplisia daun situduh langit
No. Karakteristik simplisia Hasil (%)
1. Kadar air 7,97 %
2. Kadar sari larut dalam etanol 10,52 %
3. Kadar sari larut dalam air 10,43 %
4. Kadar abu total 4,29 %
5. Kadar abu tidak larut dalam asam 0,93 %
Hasil penepatapan kadar air pada simplisia daun situduh langit yaitu 7,97
% yang menunjukkan kandungan air yang masih di dalam batasan minimal yang dapat ditolerir karena kandungan air yang tinggi menyebabkan ketidakstabilan ekstrak. Penetapan kadar air untuk memberi batasan atau rentang besarnya kandungan air di dalam simplisia, karena tingginya kandungan air dapat mempercepat pertumbuhan jamur (Ditjen POM R.I., 2000).
Kadar sari yang larut dalam etanol dengan bobot persen 10,43% dan kadar sari yang larut dalam air dengan bobot persen 10,52 %. Kadar sari larut air dan etanol merupakan pengujian untuk penetapan jumlah kandungan senyawa yang dapat larut dalam air dan kandungan senyawa yang larut dalam etanol (Ditjen POM R.I., 2000). Penetapan kadar sari larut air untuk mengetahui kadar senyawa yang bersifat polar dalam simplisia dan kadar sari larut etanol untuk mengetahui kadar senyawa yang bersifat polar dan non polar. Senyawa-senyawa yang dapat larut dalam air adalah glikosida, tanin, gula, enzim, zat warna dan asam organik.
Senyawa-senyawa yang larut dalam etanol adalah glikosida, flavonoid, steroid/triterpenoid, karotenoid dan dalam jumlah sedikit yang larut yaitu lemak (Depkes R.I., 1986).
Kadar abu total dengan bobot persen 4,29 % dan kadar abu tidak larut dalam asam dengan bobot persen 0,93 %. Penetapan kadar abu untuk mengetahui kandungan mineral internal yang terdapat di dalam simplisia yang diteliti, serta senyawa anorganik yang tersisa selama pembakaran. Kadar abu tidak larut asam untuk menentukan jumlah silika, khususnya pasir yang ada pada simplisia (WHO, 1998).
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia simplisia daun situduh langit dilakukan untuk mendapatkan informasi tentang golongan senyawa metabolit sekunder. Hasil dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining senyawa kimia simplisia daun situduh langit
No. Nama Senyawa Hasil
1. Triterpenoida/Steroida +
2. Alkaloida –
3. Tanin +
4. Flavonoida +
5. Saponin +
6. Glikosida +
Keterangan : (+) = mengandung golongan senyawa (–) = tidak mengandung golongan senyawa
Hasil skrining senyawa kimia pada serbuk simplisia daun situduh langit diperoleh senyawa flavonoida, saponin, glikosida dan triterpenoida/steroida.
Menurut Tersono (2008), pada bagian daun mengandung saponin dan polifenol.
Akar mengandung saponin dan flavonoid. Kulit batang mengandung alkaloid, flavonoid, dan polifenol. Menurut Farnsworth (1966), apabila memberikan warna merah, jingga ataupun kuning pada amil alkohol menunjukkan adanya flavonoida.
Senyawa saponin dianggap positif jika terdapat warna hijau biru untuk saponin steroid dan merah ungu untuk saponin triterpenoid.
4.4 Ekstraksi
Hasil ekstraksi simplisia daun situduh langit dengan pelarut etanol 80%
diperoleh EDSL sebanyak 125 g dari 1,5 kg simplisia. Persen rendemen diperoleh sebesar 8,33%. Penggunaan pelarut etanol 80% adalah untuk menarik semua senyawa metabolit sekunder pada daun.
4.5 Hasil Analisis EDSL secara Kromatografi Lapis Tipis
Hasil analisis EDSL secara KLT menggunakan fase diam silika gel GF 254 dan berbagai variasi fase gerak yaitu: n-heksana-etilasetat perbandingan 9:1, 8:2, 7:3, 6:4, dan 5:5, aseton-n-heksana perbandingan 4:1 dan 1:4 serta penampak bercak Liebermann-Burchard. Hasil yang terbaik terdapat pada fase gerak n- heksana-etilasetat dengan perbandingan 8:2, 7:3 dan 6:4 karena menghasilkan pemisahan noda yang paling baik dan banyak. Analisis kromatogram hasil KLT dapat dilihat pada Lampiran 11 halaman 58 dan harga Rf dapat dilihat pada Lampiran 12 halaman 59.
4.6 Fraksi Kloroform dari EDSL
Hasil fraksi kloroform diperoleh sebanyak 1,1 gram dari 2 gram EDSL.
Hidrolisis ekstrak etanol 80% dengan HCl 2N dengan tujuan untuk memutuskan ikatan gula dan non-gula kemudian disari dengan pelarut kloroform untuk mengektraksi senyawa saponin (Harborne, 1987).
4.7 Analisis Fraksi Kloroform Secara KLT
Hasil analisis KLT fraksi kloroform menggunakan fase diam silika gel GF 254 dan fase gerak n-heksana-etilasetat dengan berbagai variasi perbandingan ( 6:4, 7:3, 8:2) dan penampak bercak Liebermann-Burchard. Hasil yang terbaik terdapat pada fase gerak n-heksana-etilasetat dengan perbandingan 7:3 karena menghasilkan pemisahan noda yang paling baik dan banyak yaitu menghasilkan 8 noda (merah muda, ungu, merah mudsa, merah muda, biru, hijau