AKTIVITAS ANTIBAKTERI KOMBINASI EKSTRAK
ETANOL KULIT BUAH DELIMA (
Punica granatum
L.) DAN
SIPROFLOKSASIN TERHADAP
Pseudomonas aeruginosa
SENSITIF DAN MULTIRESISTEN ANTIBIOTIK
NASKAH PUBLIKASI
Oleh :
SANI FITRIATI
K 100 080 188
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH SURAKARTA
SURAKARTA
AKTIVITAS ANTIBAKTERI KOMBINASI EKSTRAK ETANOL KULIT BUAH DELIMA (Punica granatum L.) DAN SIPROFLOKSASIN TERHADAP Pseudomonas aeruginosa SENSITIF DAN MULTIRESISTEN
ANTIBIOTIK
ANTIBACTERIAL ACTIVITY OF THE COMBINATION ETHANOL EXTRACT OF POMEGRANATE PEEL (Punica granatum L.) AND CIPROFLOXACIN AGAINST Pseudomonas aeruginosa BACTERIA AND
MULTIRESISTANT ANTIBIOTIC
Sani Fitriati, Ratna Yuliani, dan Peni Indrayudha
Fakultas Farmasi, Universitas Muhammadiyah Surakarta Jl. A Yani Tromol Pos I, Pabelan Kartasura Surakarta 57102
ABSTRAK
Salah satu cara penanggulangan resistensi bakteri adalah kombinasi produk tanaman alam dengan antibiotik. Siprofloksasin merupakan antibiotik pilihan pertama untuk mengobati infeksi Pseudomonas aeruginosa. Kulit buah delima terbukti memiliki aktivitas antibakteri terhadap Pseudomonas aeruginosa. Penelitian ini bertujuan untuk mengetahui aktivitas antibakteri dan efek kombinasi ekstrak etanol kulit buah delima (Punica granatum L.) dengan antibiotik siprofloksasin terhadap Pseudomonas aeruginosa sensitif dan multiresisten antibiotik.
Kulit buah delima diekstrasi dengan metode maserasi menggunakan penyari etanol 96%. Uji aktivitas antibakteri dilakukan dengan metode difusi disk. Perbandingan kombinasi yang dilakukan yaitu 75:25 (7,5 µL ekstrak dan 2,5 µL siprofloksasin), 50:50 (5 µL ekstrak dan 5 µL siprofloksasin), dan 25:75 (2,5 µL ekstrak dan 7,5 µL siprofloksasin) pada kosentrasi ekstrak etanol kulit buah delima 3 mg/disk dan siprofloksasin 1,96 µg/disk. DMSO 100% digunakan sebagai kontrol negatif, ekstrak etanol kulit buah delima 3 mg/disk dan siprofloksasin 1,96 µg/disk digunakan sebagai kontrol positif. Pengamatan hasil dilakukan dengan mengukur besarnya diameter zona hambatan di sekitar disk.
Hasil penelitian menunjukkan bahwa kombinasi ekstrak etanol kulit buah delima dan siprofloksasin pada perbandingan 75:25; 50:50; dan 25:75 memiliki aktivitas antibakteri dan berefek antagonis terhadap Pseudomonas aeruginosa sensitif dan multiresisten antibiotik.
Kata kunci : Punica granatum L., siprofloksasin, Pseudomonas aeruginosa, kombinasi antibakteri.
ABSTRACT
by Pseudomonas aeruginosa. Pomegranate peel is proven having antibacterial activity against Pseudomonas aeruginosa. The purpose of this research is to investigate antibacterial activity and the effect combination of pomegranate peel (Punica granatum L.) extract with ciprofloxacin against sensitive and multiresistant Pseudomonas aeruginosa.
Pomegranate peel was extracted with maceration method by ethanol 96%. Antibacterial activity test was done by disc diffusion methode. The ratio of ethanol extract of pomegranate peel and ciprofloxacin were 75:25 (7,5 µL extract and 2,5 µL ciprofloxacin), 50:50 (5 µL extract and 5 µL ciprofloxacin), and 25:75 (2,5 µL extract and 7,5 µL ciprofloxacin). The concentration of ethanol extract of pomegranate peel was 3 mg/disc and ciprofloxacin was 1,96 µg/disc. DMSO 100% was used as negative control, and ethanol extract of pomegranate peel 3 mg/disc and ciprofloxacin 1,96 µg/disc was used as positive control. The observation of the results was done by measuring diameter of inhibition zone around disc.
The results of this observation show that the combination ethanol extract of pomegranate peel and ciprofloxacin in ratio of 75:25, 50:50, and 25:75 have antibacterial activity and antagonist effect against sensitive and multiresistant Pseudomonas aeruginosa.
Keywords: Punica granatum L., ciprofloxacin, Pseudomonas aeruginosa,
antibacterial combination.
PENDAHULUAN
Penyakit infeksi merupakan jenis penyakit yang paling banyak diderita oleh
penduduk negara berkembang, termasuk Indonesia (Radji, 2011). Penyakit ini
merupakan penyakit yang patogen atau agennya memiliki kemampuan untuk
masuk, bertahan, dan berkembang biak di dalam tubuh (Timmreck, 2005). Infeksi
salah satunya dapat disebabkan oleh bakteri, misalnya bakteri Pseudomonas
aeruginosa (Radji, 2011).
Pseudomonas aeruginosa sangat penting diperhatikan karena merupakan
bakteri utama dalam infeksi nosokomial. Bakteri ini menyebabkan beberapa
penyakit infeksi yaitu dermatitis, otitis eksterna, folikulitis, infeksi pada mata,
infeksi pada luka bakar, infeksi pada saluran napas bagian bawah, saluran kemih,
dan organ lain. Di bangsal luka bakar atau unit perawatan penyakit kanker,
prevalensi bakteri P. aeruginosa mencapai lebih dari 30% dari semua penyebab
Upaya penanggulangan penyakit infeksi dapat dilakukan dengan antibiotik
(Radji, 2011). Siprofloksasin merupakan salah satu obat antibiotik pilihan pertama
untuk penanganan terhadap infeksi P. aeruginosa (Goodman dan Gilman, 2008).
Hasil uji sensitivitas siprofloksasin menunjukkan bahwa rata-rata diameter zona
hambat P. aeruginosa (4,72 cm) lebih tinggi dibandingkan terhadap
Staphylococcus aureus (3,73 cm) dengan konsentrasi siprofloksasin sebesar 0,3%
(Ikonne and Odozor, 2009).
Semakin luasnya penggunaan antibiotik, menimbulkan masalah baru yaitu
meningkatnya resistensi bakteri terhadap antibiotik (Mardiastuti dkk., 2007).
Jombo et al. (2008) menyebutkan bahwa 100% isolat P. aeruginosa dari sampel
urin di UTH (University Teaching Hospital) Nigeria telah resisten terhadap
penisilin, kloksasilin, tetrasiklin, nitrofurantoin, dan asam nalidiksat.
Meningkatnya resistensi bakteri terhadap antibiotik yang telah ada, harus
diimbangi dengan penemuan obat baru. Hal ini mendorong untuk ditemukannya
produk alternatif pengganti yang lebih poten, murah, dan memiliki efek samping
yang lebih kecil sehingga resistensi bisa diatasi.
Salah satu alternatif untuk mengatasi masalah resistensi antibiotik yaitu
kombinasi produk tanaman alam dengan antibiotik (Jayaraman et al., 2010).
Penelitian Nweze dan Eze (2009) menyatakan bahwa kombinasi antara ekstrak
etanol daun Ocimum gratissimum L. dengan siprofloksasin memberikan hasil
sinergis dalam menghambat P. aeruginosa. Ekstrak etanol daun Ocimum
gratissimum L. menaikkan aktivitas antibiotik siprofloksasin memperlebar
diameter zona hambat yang awalnya 29 mm menjadi 35 mm.
Selain daun Ocimum gratissimum L., tanaman yang memiliki aktivitas
antibakteri terhadap P. aeruginosa yaitu delima (Punica granatum L.). Penelitian
Khan dan Hanee (2011) menunjukkan bahwa ekstrak etanol kulit buah delima
pada konsentrasi 500 mg/mL memiliki aktivitas antibakteri terhadap
P. aeruginosa dengan diameter zona hambat sebesar 25,5 mm. Senyawa yang
bertanggung jawab terhadap aktivitas antimikroba pada kulit buah delima yaitu
Berdasarkan hal tersebut, menarik untuk diteliti aktivitas antibakteri
kombinasi ekstrak etanol kulit buah delima (Punica granatum L.) dan
siprofloksasin terhadap bakteri Pseudomonas aeruginosa sensitif dan multiresisten
antibiotik dengan metode difusi.
METODOLOGI PENELITIAN Alat dan Bahan
Alat. Alat yang digunakan yaitu timbangan (Precisa), corong Buchner, rotary
evaporator (Heidolph), penangas air (Memmert), ose, glassware (Pyrex),
inkubator (Memmert), mikroskop (Olympus model CKX41), Laminar Air Flow
(LAF) (CV.Srikandi), autoklaf (My Life), oven (Memmert), cawan petri (Pyrex),
mikropipet (Socorex), spreader glass, vortek (Thermolyne Corporation), dan
shaker incubator (Exella 24 New Brunswick Scientific).
Bahan. Bahan yang digunakan yaitu kulit buah delima (Punica granatum L.) yang
diperoleh dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat
Tradisional (B2P2TOOT) Tawangmangu Karanganyar, etanol 96%, Pseudomonas
aeruginosa sensitif dan multiresisten antibiotikyang diperoleh dari Laboratorium
Biologi Farmasi Fakultas Farmasi UMS, cat Gram (A, B, C, dan D), media KIA
(Kligler Iron Agar) (Oxoid), media LIA (Lysine Iron Agar) (Oxoid), media MIO
(Motility Indole Ornithine) (Oxoid), antibiotik siprofloksasin infusion 2,0 mg/mL
(PT. Dexa Medica), sterilised water for injection (Otsuka), media Mueller Hinton
(MH) (Oxoid), media Brain Heart Infusion (BHI) (Oxoid), NaCl (Merck),
akuades, DMSO 100% (Merck), disk kosong, disk antibiotik (kloramfenikol,
eritromisin, tetrasiklin, siprofloksasin, dan ampisilin), alkohol, dan spiritus.
Jalannya penelitian
Determinasi Tanaman. Tahap pertama penelitian adalah melakukan determinasi
tanaman delima (Punica granatum L.) dengan menggunakan buku acuan Flora of
Java karangan Backer dan Van den Brink (1965) dan An Integrated System of
Classification of Flowering Plants karangan Cronquist, A. (1981). Determinasi
Penyiapan Bahan. Buah delima tersebut dikupas kulitnya, kemudian kulitnya
dicuci bersih dan dikeringkan di bawah sinar matahari dengan ditutupi kain hitam.
Kulit buah delima yang sudah kering, diserbuk dengan menggunakan blender
kemudian diayak.
Pembuatan Ekstrak Etanol Kulit Buah Delima.Metode penyarian yang digunakan
ialah maserasi. Simplisia kulit buah delima sebanyak 1500 gram direndam dengan
7 liter e t a n o l 9 6 % sampai terendam kira-kira di atas permukaan di dalam
wadah toples kaca yang ditutup rapat dan disimpan selama 3 hari terlindung dari
cahaya langsung sambil sesekali diaduk. Setelah itu, hasil penyarian disaring
dengan corong Buchner, kemudian dipekatkan dengan menggunakan rotary
evaporator pada suhu 60 . Selanjutnya, diuapkan di atas penangas air
hingga didapatkan ekstrak kental kulit buah delima.
Sterilisasi alat dan bahan. Alat-alat gelas berupa gelas ukur, tabung reaksi, cawan
petri dicuci bersih dan dikeringkan. Kemudian alat-alat dibungkus kertas, dan
disterilkan dengan oven pada suhu 170° C selama 1 jam. Alat dan bahan yang
tidak tahan pemanasan kering seperti media, akuades, blue tips, yellowtips, white
tips, dan eppendorfdisterilkan dengan autoklaf pada suhu 121°C selama 20 menit.
Pembuatan media. Media ditimbang dan dilarutkan dalam akuades. Banyaknya
media yang ditimbang untuk tiap liternya adalah sebagai berikut : media MH
38 gram, media BHI 37 gram, media KIA 55 gram, media LIA 34 gram, media
MIO 31 gram, dan NaCl 9 gram.
Pengecatan Gram. Koloni bakteri diambil 1 ujung mata ose steril dan diratakan
pada gelas obyek lalu dipanasi di atas nyala bunsen hingga kering, kemudian
ditetesi formalin 1% ditunggu 5 menit, dikeringkan lagi dan preparat siap dicat.
Preparat digenangi dengan cat Gram A selama 1-3 menit, kemudian cat dibuang
tanpa dicuci dengan air. Preparat selanjutnya digenangi cat Gram B selama
0,5–1 menit, setelah itu cat dibuang dan preparat dicuci dengan air. Preparat
kemudian ditetesi cat Gram C sampai warna cat tepat dilunturkan. Setelah itu
preparat digenangi cat Gram D selama 1–2 menit kemudian dicuci dan
dikeringkan dalam udara kamar. Preparat diperiksa di bawah mikroskop dengan
Uji Biokimiawi. Bakteri ditanam pada media KIA (Kligler Iron Agar), LIA
(Lysine Iron Agar), dan MIO (Motility Indole Ornithine), selanjutnya
diinkubasikan pada 37°C selama 18-24 jam.
Pembuatan suspensi bakteri. Bakteri dari stok bakteri diambil sebanyak dua
sampai tiga koloni dengan menggunakan ose, kemudian dimasukkan pada media
BHI single strength 5 mL dan diinkubasi menggunakan shaker incubator pada
suhu 37°C selama 2-5 jam. Bakteri kemudian disamakan konsentrasinya dengan
standar Mc Farland (108 CFU/mL) dengan cara manambahkan larutan salin hingga
didapat kekeruhan yang sama dengan standar Mc Farland.
Uji sensitivitas bakteri P. aeruginosa. Suspensi bakteri sebanyak 300 µL dengan
konsentrasi 108 CFU/mL diinokulasi pada cawan petri berisi media MH dan
beberapa disk antibiotik (kloramfenikol, ampisilin, tetrasiklin, eritromisin, dan
siprofloksasin) diletakkan di atasnya. Selanjutnya diinkubasi selama 18-24 jam
pada suhu 37°C. Kemudian diameter zona hambat pada tiap-tiap disk diukur dan
dibandingkan dengan standar resistensi bakteri terhadap masing-masing antibiotik.
Pembuatan seri konsentrasi ekstrak etanol kulit buah delima. Seri konsentrasi
ekstrak etanol kulit buah delima dibuat dengan mengambil ekstrak masing-masing
100 mg, 125 mg, dan 150 mg, kemudian dilarutkan dalam DMSO sampai 500 µL
sehingga seri konsentrasi masing-masing 20% (2 mg/disk), 25% (2,5 mg/disk),
dan 30% (3 mg/disk).
Pembuatan seri konsentrasi siprofloksasin. Larutan stok 0,2% siprofloksasin
diambil masing-masing 125 µL, 250 µL, dan 500 µL, kemudian dilarutkan dalam
akua proinjeksi sampai 1 mL sehingga seri konsentrasi masing-masing 0,025%
(1,96 µg/disk); 0,05% (3,75 µg/disk); dan 0,1% (7,85 µg/disk).
Seri perbandingan kombinasi ekstrak etanol kulit buah delima dan siprofloksasin.
Kombinasi ekstrak etanol kulit delima dan siprofloksasin yang diuji pada bakteri
P. aeruginosa sensitif dan multiresisten antibiotik dibuat dengan perbandingan
75:25; 50:50; dan 25:75 hingga volume total di dalam disk sebesar 10 µL.
Pengambilan ekstrak etanol kulit buah delima dan siprofloksasin berturut-turut
adalah 7,5 µL:2,5 µL (2,25 mg:0,49 µg); 5 µL:5 µL (1,5 mg:0,98 µg); dan
Uji aktivitas antibakteri metode difusi padat. Suspensi bakteri diambil sebanyak
300 µL dengan konsentrasi 108 CFU/mL diteteskan ke permukaan media MH
dalam cawan petri dan diratakan menggunakan spreader glass steril. Kemudian
tiga seri perbandingan konsentrasi kombinasi ekstrak etanol kulit delima dan
siproflokasasin, siprofloksasin (kontrol positif), ekstrak etanol kulit buah delima
(kontrol ekstrak), dan DMSO (kontrol pelarut) diambil sebanyak 10 µL dan
diteteskan pada disk kosong 6 mm, lalu setelah disk kering diletakkan di atas
media. Selanjutnya dipreinkubasi pada suhu kamar selama 30 menit. Setelah itu
diinkubasi pada temperatur 37°C selama 18-24 jam, kemudian dilakukan
pengamatan dengan menentukan diameter zona hambatnya.
HASIL PENELITIAN DAN PEMBAHASAN
Hasil Determinasi Tumbuhan. Determinasi bertujuan untuk menetapkan kebenaran
yang berkaitan dengan ciri-ciri morfologi secara makroskopis tanaman delima
(Punica granatum L.) terhadap kepustakaan, serta menghindari terjadinya
kekeliruan terhadap tanaman yang digunakan. Pustaka yang digunakan yaitu Flora
of Java karangan Backer dan van den Brink, 1965 dan An Integrated System of
Classification of Flowering Plants karangan Cronquist, A., 1981. Determinasi
dilakukan di Laboratorium Biologi Farmasi, Fakultas Farmasi UMS. Hasil dari
determinasi ini dapat disimpulkan bahwa tanaman yang digunakan dalam
penelitian ini benar spesies Punica granatum L.
Hasil Pembuatan Ekstrak Etanol Kulit Buah Delima. Kulit buah delima
diekstraksi dengan metode maserasi. Keuntungan dari metode maserasi yaitu
pengerjaan dan peralatan yang digunakan sederhana, tetapi metode ini memiliki
kerugian yaitu pengerjaannnya lama, butuh waktu beberapa hari untuk
mendapatkan ekstrak kental, dan penyariannya kurang sempurna (Depkes RI,
1986). Hasil ekstrak etanol kulit buah delima diperoleh rendemen sebesar 5,75%,
yaitu dari 1500 g serbuk kulit buah delima diperoleh 86,27 g ekstrak.
Identifikasi Bakteri. Identifikasi bakteri ini dilakukan dengan cara pengecatan
Gram dan uji biokimiawi. Pengecatan Gram bertujuan untuk mengetahui bakteri
bahwa bakteri P. aeruginosa sensitif dan multiresisten termasuk Gram negatif,
berwarna merah dan berbentuk batang yang menggerombol. Bakteri Gram negatif
mengandung kadar lipid tinggi yang larut dengan alkohol 96% (cat Gram C),
sehingga pori-pori dinding sel membesar. Warna ungu dan kompleks
kristal-yodium dari Cat Gram A dan B dilepaskan akibatnya bakteri menjadi tidak
berwarna. Sel akan menyerap zat warna kontras air fuksin atau safranin (cat Gram
D) yang menyebabkan bakteri Gram negatif berwarna merah (Radji, 2010).
Uji biokimiawi dilakukan untuk memastikan bahwa bakteri yang akan diuji
benar bakteri P. aeruginosa. Uji biokimiawi yang digunakan yaitu media KIA,
LIA, dan MIO. Identifikasi sifat biokimia terhadap bakteri P. aeruginosa sensitif
maupun multiresisten pada media KIA dihasilkan warna merah, hal ini
menunjukkan bakteri tidak memfermentasi glukosa maupun laktosa sehingga
media tetap bersifat alkali. Posisi media tidak terangkat dari dasar tabung dan
tidak terbentuknya warna hitam, hal ini berarti tidak terbentuk gas dan H2S. Pada
media LIA dihasilkan warna ungu, hal ini menunjukkan bakteri mengalami reaksi
dekarboksilasi lisin menghasilkan reaksi basa. Hasil uji pada media MIO juga
dihasilkan warna ungu, karena bakteri dapat mendekarboksilasi ornitin yang
menghasilkan reaksi basa. Selain itu juga di daerah tusukan membentuk adanya
kabut yang menyebar, sebab bakteri mempunyai sifat motil atau bergerak (John,
2012).
Hasil Uji Sensitivitas Bakteri. Uji sensitivitas bakteri P. aeruginosa multiresisten
terhadap beberapa antibiotik dilakukan untuk memastikan bahwa bakteri yang
digunakan benar bersifat multiresisten. Pengujian dilakukan dengan metode Kirby
Bauer atau difusi disk dengan lima macam antibiotik, yaitu siprofloksasin (CIP),
ampisilin (AMP), tetrasiklin (TE), kloramfenikol (C), dan eritromisin (E).
Hasil uji didasarkan pada pengukuran diameter zona hambatan di sekitar
disk antibiotik atau disebut zona radikal dan dibandingkan dengan standar
diameter antibiotik. Hasil yang diperoleh dari uji sensitivitas P. aeruginosa
sensitif dapat disimpulkan bahwa bakteri bersifat sensitif terhadap antibiotik
siprofloksasin, tetrasiklin, kloramfenikol, eritromisin, dan telah resisten terhadap
hasil bakteri telah resisten terhadap ampisilin dan eritromisin (Tabel 1). Sehingga
dapat disimpulkan bahwa bakteri P. aeruginosa multiresisten benar bersifat
multiresisten karena resisten terhadap 2 antibiotik. Bakteri telah resisten terhadap
ampisilin terjadi karena bakteri memiliki kemampuan untuk memproduksi β-laktamase yang akan menghidrolisis ikatan pada cincin β-laktam molekul ampisilin dan mengakibatkan inaktivasi antimikroba, sedangkan resistensi
terhadap eritromisin akibat mutasi pada target antibiotik (Pratiwi, 2008).
Tabel 1. Hasil uji sensitivitas bakteri P. sensitif dan P. aeruginosa multiresisten terhadap siprofloksasin (CIP), ampisilin (AMP), tetrasiklin (TE), kloramfenikol (C), dan eritromisin (E)
Uji Pendahuluan. Uji pendahuluan dilakukan untuk mengetahui besarnya
konsentrasi ekstrak etanol kulit buah delima dan konsentrasi antibiotik
siprofloksasin yang dapat menghambat pertumbuhan bakteri P. aeruginosa
sensitif dan multiresisten. Konsentrasi tersebut yang nantinya digunakan untuk
kombinasi ekstrak dengan antibiotik. Metode yang digunakan dalam uji ini yaitu
metode Kirby Bauer atau difusi disk. Hasil yang diamati adalah diameter zona
hambat yang jernih di sekitar disk setelah inkubasi 37°C selama 18-24jam.
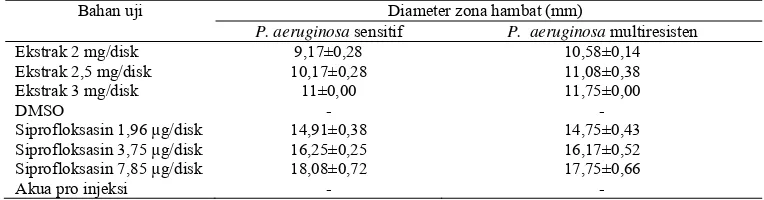
Tabel 2. Hasil uji pendahuluan aktivitas antibakteri ekstrak etanol kulit buah delima terhadap bakteri Pseudomonas aeruginosa sensitif (A) dan bakteri Pseudomonas aeruginosa multiresisten (B), dan uji pendahuluan siprofloksasin pada bakteri
Pseudomonas aeruginosa sensitif (C) dan Pseudomonas aeruginosa multiresisten (D)
Bahan uji Diameter zona hambat (mm)
P. aeruginosa sensitif P. aeruginosa multiresisten
Ekstrak 2 mg/disk 9,17±0,28 10,58±0,14
Ekstrak 2,5 mg/disk 10,17±0,28 11,08±0,38
Ekstrak 3 mg/disk 11±0,00 11,75±0,00
DMSO - -
Siprofloksasin 1,96 µg/disk 14,91±0,38 14,75±0,43
Siprofloksasin 3,75 µg/disk 16,25±0,25 16,17±0,52
Siprofloksasin 7,85 µg/disk 18,08±0,72 17,75±0,66
Akua pro injeksi - -
P. aeruginosa sensitif P. aeruginosa multiresisten Diameter
(irradikal) Resisten 8 Resisten
TE 30 µg ≤ 19 19,25 Sensitif 17,625 Intermediet
C 30 µg ≤ 18 18 Sensitif 15,375 Intermediet
Pada uji pendahuluan terhadap ekstrak etanol kulit buah delima digunakan
kontrol negatif DMSO 100%, sedangkan uji pendahuluan antibiotik siprofloksasin
kontrol negatifnya yaitu akua pro injeksi. Hasil dari uji ekstrak etanol kulit buah
delima pada konsentrasi 2 mg/disk; 2,5 mg/disk; dan 3 mg/disk terhadap
P. aeruginosa sensitif diperoleh rata-rata diameter zona hambat berturut-turut
9,17 mm; 10,17 mm; dan 11 mm. Sedangkan pada P. aeruginosa multiresisten
dengan konsentrasi yang sama diperoleh rata-rata diameter zona hambat
berturut-turut 10,58 mm; 11,08 mm; dan 11,75 mm.
Hasil uji antibiotik siprofloksasin dengan konsentrasi 1,96 µg/disk;
3,75 µg/disk; dan 7,85 µg/disk pada P. aeruginosa sensitif diperoleh rata-rata
diameter zona hambat berturut-turut 14,91 mm; 16,25 mm; dan 18,08 mm.
Sedangkan terhadap P. aeruginosa multiresisten menghasilkan rata-rata diameter
zona hambat sebesar 14,75 mm; 16,17 mm; dan 17,75 mm. Dari hasil tersebut
maka konsentrasi yang digunakan untuk uji kombinasi yaitu ekstrak etanol kulit
buah delima 3 mg/disk dan siprofloksasin 1,96 µg/disk, karena diameter zona
hambat yang diharapkan untuk uji kombinasi yaitu rentang antara 10-20 mm.
DMSO 100% dan akua pro injeksi tidak memiliki aktivitas antibakteri sehingga
tidak mempengaruhi hasil uji.
Uji Kombinasi Ekstrak Etanol Kulit Buah Delima dengan Antibiotik
Siprofloksasin. Uji kombinasi ekstrak etanol kulit buah delima dengan antibiotik
siprofloksasin bertujuan untuk mengetahui aktivitas antibakteri yang dihasilkan
setelah dikombinasikan. Hasil yang diperoleh dapat berefek sinergis atau
antagonis. Uji kombinasi dilakukan dengan menggunakan 3 perbandingan antara
ekstrak dan antibiotik yaitu 75:25; 50:50; dan 25:75 dengan total volume disk
10 µL.
Aktivitas antibakteri kombinasi pada perbandingan 75:25, 50:50, dan 25:75
pada P. aeruginosa sensitif dan multiresisten memberikan hasil rata-rata diameter
zona hambat lebih kecil dari pada kontrol positifnya yaitu ekstrak dan
siprofloksasin tunggal (Tabel 3), maka aktivitas antibakteri setelah
dikombinasikan bersifat antagonis. Hasil kontrol negatif yaitu DMSO tidak
mempengaruhi hasil uji. Penelitian yang dilakukan oleh Nweze dan Eze (2009)
yaitu kombinasi antara ekstrak etanol daun Ocimum gratissimum L. dengan
siprofloksasin memberikan hasil sinergis dalam menghambat Pseudomonas
aeruginosa. Hal ini ditunjukkan dengan kenaikan diameter zona hambat yang
sebelumnya 29 mm menjadi 35 mm. Ekstrak daun Ocimum gratissimum L.
dimungkinkan berpotensi sebagai efflux pump inhibitor (EPI) (Coutinho et al.,
2011) dengan cara menghambat siprofloksasin sehingga tertahan dan
konsentrasinya meningkat dalam sel bakteri. Selain itu Ocimum gratissimum L.
bersifat bakterisida (Oussou et al., 2008) dan siprofloksasin juga bersifat
bakterisida (Tambayong, 2002), sehingga didapatkan hasil sinergis karena
keduanya sama-sama sebagai agen bakterisida. Kombinasi dua obat agen
bakterisida cenderung bersifat sinergis (Goodman dan Gilman, 2008).
Tabel 3. Hasil uji aktivitas antibakteri kombinasi ekstrak etanol kulit buah delima dengan siprofloksasin pada Pseudomonas aeruginosa sensitif dan multiresisten
Bahan uji Diameter zona hambat (mm)
P. aeruginosasensitif P. aeruginosa multiresisten DMSO
Kombinasi ekstrak etanol kulit buah delima dan siprofloksasin terhadap
P. aeruginosa sensitifmaupun multiresisten pada penelitian ini menunjukkan efek
tidak sinergis atau antagonis, hal ini kemungkinan karena ekstrak delima
mekanisme kerjanya dapat sebagai agen bakteriostatik (Voss-Rech et al., 2011),
sedangkan siprofloksasin bersifat bakterisida (Tambayong, 2002). Antibakteri
yang bersifat bakteriostatik sering kali mengantagonis kerja antibakteri yang
bersifat bakterisid, karena antibakteri bakteriostatik bekerja menghambat
pembelahan sel dan sintesis protein, yang diperlukan untuk efek bakterisid
sebagian besar senyawa bakterisida (Goodman dan Gilman, 2008). Hasil
yaitu kombinasi ekstrak etanol daun Ocimum gratissimum L. dan septrin
memberikan hasil antagonis dalam menghambat P. aeruginosa. Hal tersebut
ditunjukkan dengan diameter zona hambat septrin sebesar 23 mm, sedangkan
ketika dikombinasikan dengan ekstrak etanol Ocimum gratissimum L. diameter
zona hambatnya menjadi 12 mm. Septrin yang bersifat bakteriostatik (The Leeds
Method of Menejement, 2008) mengantagonis kerja Ocimum gratissimum L. yang
bersifat bakterisida (Oussou et al., 2008).
Hasil kombinasi yang diperoleh menunjukkan semakin besar konsentrasi
siprofloksasin, maka semakin besar diameter zona hambatnya. Hal ini
dikarenakan siprofloksasin lebih poten dalam menghambat P. aeruginosa
dibandingkan ekstrak etanol kulit buah delima. Siprofloksasin merupakan
golongan floroquinolon yang mempunyai aktivitas antibakteri terhadap
P. aeruginosa. Antibiotik ini bekerja dengan menghambat enzim girase DNA atau
topoisomerase II, dengan cara menghambat replikasi DNA dan transkripsi
(Mansoor, 2009). Penelitian yang dilakukan oleh Machado et al. (2002)
menyatakan bahwa zat yang bertanggung jawab terhadap aktivitas antimikroba
pada kulit buah delima yaitu elagitanin punicalagin. Elagitanin punicalagin
termasuk dalam golongan senyawa tanin (Hernawan dan Setyawan, 2003), yang
mekanisme kerjanya mengkerutkan dinding sel atau membran sel sehingga
mengganggu permeabilitas sel itu sendiri. Akibat terganggunya permeabilitas, sel
tidak dapat melakukan aktivitas hidup sehingga partumbuhannya terhambat atau
bahkan mati (Ajizah, 2004). Selain itu mekanisme antibakteri dari elagitanin yaitu
mengikat protein, mengikat pada adhesin, menghambat enzim, mengikat substrat,
mengganggu kompleks dinding sel, merusak membran sel, dan metal ion
complexation (Cowan, 1999). Hasil antagonis pada penelitian ini juga
dimungkinkan karena mekanisme kerja yang berbeda antara ekstrak etanol kulit
buah delima dan siprofloksasin.
Hasil penelitian dimungkinkan dapat bersifat sinergis jika dikombinasikan
dengan antibiotik yang sifatnya sama dengan ekstrak etanol kulit buah delima
yaitu sebagai agen bakteriostatik, misalnya eritromisin. Selain itu juga kombinasi
memiliki mekanisme kerja yang sama dengan kandungan utama kulit buah delima
elagitanin punicalagin, yaitu mengganggu atau merusak dinding sel, misalnya
dikombinasikan dengan antibiotik golongan makrolida (eritromisin). Mekanisme
aksi yang sama dapat menjadikan efek sinergis, seperti halnya pada penelitian
Zhao et al. (2001) dengan mengkombinasi komponen epigallocatechin gallate
dan antibiotik β-laktam terhadap Methicillin-Resistant Staphylococcus aureus
menghasilkan efek sinergis. Keduanya memiliki mekanisme kerja yang sama,
yaitu menyerang peptidoglikan dalam dinding sel.
Kesimpulan
1. Kombinasi ekstrak etanol kulit buah delima 30% dan siprofloksasin 0,025%
pada perbandingan 75:25; 50:50; dan 25:75 memiliki aktivitas antibakteri
terhadap Pseudomonas aeruginosa sensitif dan multiresisten antibiotik.
2. Kombinasi ekstrak etanol kulit buah delima dan siprofloksasin menunjukan
efek antagonis dalam menghambat pertumbuhan Pseudomonas aeruginosa
sensitif dan multiresisten antibiotik.
Saran
1. Perlu dilakukan uji bioautografi untuk mengetahui senyawa dalam ekstrak
etanol kulit buah delima yang beraktivitas sebagai antibakteri.
2. Perlu dilakukan penelitian lain tentang uji aktivitas antibakteri kombinasi
ekstrak etanol kulit buah delima dengan antibiotik yang sifatnya sama dan
mempunyai mekanisme kerja yang sama, misalnya eritromisin.
DAFTAR ACUAN
Ajizah, A., 2004, Sensitivitas Salmonella typhimurium Terhadap Ekstrak Daun Psidium guajava L. Bioscientiae, 1 (1), 31-8.
Backer, C.A. & den Brink, R.C.B., 1965, Flora of Java: Spermatophytes only Volume I, N.V.P. Noordhoff-Groningen-The Netherlands, 259.
resistance in Staphylococcus aureus by Croton campestris A. and Ocimum gratissimum L., Biomedica, 31, 608-612.
Cowan, M. M., 1999, Plant Products as Antimicrobial Agents, American Society for Microbiology, 12 (4), 564–582.
Cronquist, A., 1981, An Integrated System of Classification of Flowering Plants, New York, Colombia University Press, 477.
Depkes RI, 1986, Sediaan Galenik, 6, Jakarta, Departemen Kesehatan Republik Indonesia.
Goodman & Gilman, 2008, Dasar Farmakologi Terapi, Volume 2, diterjemahkan oleh Tim Alih Bahasa Sekolah Farmasi ITB, 1126, 1133, 1137, Jakarta, Penerbit Buku Kedokteran EGC.
Hernawan, U. E. & Setyawan, A. D., 2003, Ellagitannin; biosynthesis, isolation, and biological activities, Biofarmasi, 1 (1), 25-38.
Ikonne, E. U. & Odozor, P. J., 2009, Comparative Efficacy of Topical Ciprofloxacin on Staphylococcus aureus and Pseudomonas aureginosa In Vitro, JNOA, 15 (8-15).
Jayaraman, P., Sakharkar, M. K., Lim, C. S., Tang, T. H., & Sakharkar, K.R., 2010, Activity and Interaction of Antibiotic and Phytochemical Combination Againts Pseudomonas aeruginosa, International Journal of Biological Sciences, 6 (6), 556-568.
John, 2012, Differential Media: KIA, LIA, and MIO, (online), (http://www.jlindquist.net/generalmicro/dfmultinf.html., diakses tanggal 14 Mei 2012).
Jombo, G. T. A., Jonah, P. & Ayeni, J. A., 2008, Multidrug Resistant Pseudomonas aeruginosa in Contemporary Medical Practice: Findings from Urinary Isolates at A Nigerian University Teaching Hospital, Nigerian Journal of Physiological Sciences, 23 (1-2), 105-109.
Machado, T. D., Leal, I. C. R., Amaral, A. C. F., dos Santos, K. R. N., da Silva, M. G. & Kuster, R. M., 2002, Antimicrobial ellagitannin of Punica granatum fruits, Journal of the Brazilian Chemical Society, 13, 606–610.
Mardiastuti, H. W., Karuniawati A., Kiranasari A., Ikaningsih, & Kadarsih R., 2007, Emerging Resistance Pathogen: Situasi Terkini di Asia, Eropa, Amerika Serikat, Timur Tengah dan Indonesia, Majalah Kedokteran Indonesia, 57 (3), 75-79.
Nweze, E. I. & Eze, E. E., 2009, Justification for the use of Ocimum gratissimum L. in herbal medicine and its interaction with disc antibiotics, BMC Complementary and Alternative Medicine, 9 (37).
Oussou, K. R., Yolou, S., Boti, J. B., Guessennd, K. N., Kanko, C., Ahibo, C. & Casanova, J., 2008, Etude Chimique et Activite Antdiarrheique des Huiles Essentielles de Deux Plantes Aromatiques de la Pharmacopee Ivoirienne, European Journal of Scientific Research, 24 (1), 94-103.
Pratiwi, S. T., 2008, Mikrobiologi Farmasi, 164, 168, 170, 190, Jakarta, Erlangga.
Radji, M., 2011, Buku Ajar Mikrobiologi Panduan Mahasiswa Farmasi dan Kedokteran, 68, 69, 99, 107, 201, 203-205, Jakarta, Penerbit Buku Kedokteran EGC.
Sukandar, E. Y., Andrajati, R., Sigit, J. I., Adnyana, I. K., Setiadi, A. A. P. & Kusnandar, 2009, Iso Farmakoterapi, 947, Jakarta, PT. ISFI Penerbitan.
Tambayong, J., 2002, Farmakologi Untuk Keperawatan, 143, Jakarta, Widya Medika.
The Leeds Method of Management, 2008, Intravenous antibiotics and
Pseudomonas aeruginosa, (online),
(http://www.cysticfibrosismedicine.com, diakses tanggal 6 juni 2012).
Tjay, T. H. & Rahardja, K., 2007, Obat-obat Penting, Edisi 6, 43, Jakarta, PT. Gramedia.
Timmreck, T. C., 2005, Epidemiologi Suatu Pengantar, Edisi 2, diterjemahkan oleh Fauziah, M., Apriningsih, Widyaastuti, Widyastuti, P., Sugiarti, M. & Ratnawati, 28, Jakarta, Penerbit Buku Kedokteran EGC.
Voss-Rech, D., Klein, C. S., Techio, V. H., Scheuermann, G. N., Rech, G. & Fiorentin, L., 2011, Antibacterial activity of vegetal extracts against serovars of Salmonella, Ciencia Rural, 41 (2), 314-320.