PENGARUH KONSENTRASI NaCl TERHADAP
PERKECAMBAHAN SPORA FUNGI MIKORIZA ARBUSKULA
TESIS
Oleh
ANDAYANI FITHRI TANJUNG
077030004/BIO
SE K O L A H P A SCA S A R JANASEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
MEDAN
2009
PENGARUH KONSENTRASI NaCl TERHADAP
PERKECAMBAHAN SPORA FUNGI MIKORIZA ARBUSKULA
TESIS
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Magister Sains dalam Program Studi Biologi pada Sekolah Pascasarjana
Universitas Sumatera Utara
Oleh
ANDAYANI FITHRI TANJUNG
077030004/BIO
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
MEDAN
2009
Judul Tesis : PENGARUH KONSENTRASI NaCl TERHADAP PERKECAMBAHAN SPORA FUNGI MIKORIZA ARBUSKULA
Nama Mahasiswa : Andayani Fithri Tanjung
Nomor Pokok : 077030004
Program Studi : Biologi/Mikrobiologi
Menyetujui Komisi Pembimbing
(Dr. Delvian, SP, MP) (Prof. Dr. Dwi Suryanto, M.Sc) Ketua Anggota
Ketua Program Studi
(Prof. Dr. Dwi Suryanto, M.Sc)
Direktur
(Prof. Dr. Ir. T. Chairun Nisa B, M.Sc)
Telah diuji pada
Tanggal : 10 September 2009
PANITIA PENGUJI TESIS
Ketua : Dr. Delvian, SP, MP
Anggota : 1. Prof. Dr. Dwi Suryanto, MSc 2. Prof. Dr. Erman Munir, MSc 3. Dr. Budi Utomo, SP, MP
ABSTRAK
Kajian tentang pengaruh salinitas terhadap perkecambahan spora fungi mikoriza arbuskula (FMA) masih sangat terbatas. Masalah salinitas menarik untuk dikaji lebih jauh karena terdapat fenomena yang menunjukkan hubungan antara mikoriza, pertumbuhan tanaman dan tanah salin. Keberadaan mikoriza sangat dipengaruhi salinitas tanah. Hipotesis penelitian adalah terjadi penghambatan perkecambahan spora FMA Gigaspora margarita dan Acaulospora tuberculata dan derajat infeksi (kolonisasi) FMA pada akar tanaman seiring dengan peningkatan konsentrasi NaCl. Penelitian menggunakan Rancangan Acak Lengkap (RAL) Faktorial dengan dua faktor yang diuji yaitu perbedaan konsentrasi larutan NaCl (S0
0%, S1 1%, S2 2%, S3 3%) dan spesies spora FMA Gigaspora margarita (M1) dan
Acaulospora tuberculata (M2) dengan kombinasi perlakuan sebanyak tiga ulangan
dan pengamatan selama 30 hari.
Hasil penelitian didapat bahwa FMA Gigaspora margarita yang diberi perlakuan NaCl memunculkan hifa rata-rata pada hari ke-14 (13.58) dan
berkecambah rata-rata 90% dengan rata-rata laju perkecambahan yaitu 7,46%/hari, tetapi FMA Acaulospora tuberculata tidak berkecambah dan tidak memunculkan hifa sampai hari ke 30 pengamatan. Fungi mikoriza arbuskula Gigaspora margarita yang ditumbuhkan di media pot kultur bersama-sama dengan tanaman inang mampu membentuk formasi hifa (kolonisasi) pada akar tanaman inang rata-rata 18,33%, sedangkan FMA Acaulospora tuberculata mampu membentuk formasi hifa
(kolonisasi) pada akar tanaman inang rata-rata 10,83%. Untuk itu dimasa yang akan datang perlu dilakukan penelitian yang lebih lama untuk mengamati hari mulai berkecambah spora FMA Acaulospora tuberculata serta lama masa dormansinya.
Kata kunci: Gigaspora margarita, Acaulospora tuberculata, salinitas, Perkecambahan, derajad infeksi (kolonisasi).
ABSTRACT
A study on effect of salinity to arbuscular mycorhiza fungus spore germination was limited. Distribution of mycorhiza was limited by salinity. Salinity effect the mycorhiza Gigaspora margarita and Acaulospora tuberculata spores by inhibiting their germination and decreasing infection. Analysis of Variance was used to know the effect of NaCl concentration (0%, 1%, 2%, 3%) to Gigaspora margarita and Acaulospora tuberculata. Observation was done for 30 days.
The result showed that Gigaspora margarita spore germinated in 14 days (13,58 days) of observation with the number of germination of 90% and germination rate of 7,46%/day. On the other hand, there was no spore germination of Acaulospora tuberculata ofter 30 days. Gigaspora margarita spore grown in culture with host plant could colonize the root by 18,33%, while Acaulospora tuberculata spore could colonize the root by 10,83%. Observation days should have to be added to know dormancy period and growth factor of Acaulospora tuberculata.
Keywords: Gigaspora margarita, Acaulospora tuberculata, Salinity, Germination, colonization.
KATA PENGANTAR
Syukur Alhamdulillah saya ucapkan ke hadirat Allah SWT yang telah memberikan rahmat dan karuniaNya sehingga saya dapat menyelesaikan penelitian tesis yang berjudul “Pengaruh Konsentrasi NaCl terhadap Perkecambahan
Spora Fungi Mikoriza Arbuskula”.
Pada kesempatan ini saya mengucapkan terima kasih kepada Bapak Dr. Delvian, SP, MP selaku Ketua Komisi Pembimbing dan kepada Bapak Prof. Dr. Dwi Suryanto, MSc, selaku Ketua Program Studi Biologi dan juga selaku Komisi Pembimbing.
Saya juga mengucapkan terima kasih kepada Kakanda dr. Hanip Fahri, MM, suami tercinta yang telah banyak membantu dan memberikan dorongan semangat kepada saya dan juga kepada Ayahanda Drs. H. Yahya Tanjung yang senantiasa mendoakan saya selalu dalam karunia Allah SWT serta anak-anak saya M. Fauzan Haffanda, Nada Rizki Hanifah dan Farid Ahsanul Fikri yang selalu menjadi sumber semangat bagi saya dalam menyelesaikan penulisan penelitian tesis ini.
Akhir kata saya tidak dapat membalas kebaikan itu semua. Semoga Allah SWT memberikan balasan kepada semua pihak atas kebaikan yang telah diberikan kepada saya. Semoga tulisan ini berguna bagi kita semua dan berharap kritik dan saran dari semua pihak.
Medan, September 2009 Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 08 Oktober 1972, sebagai anak pertama dari tiga bersaudara, dari pasangan Drs. H. Yahya Tanjung dan Dra. Hj Rahimah Lubis.
Tahun 1985 penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 060823 Medan, selanjutnya pada tahun 1988 menyelesaikan pendidikan Sekolah Menengah Pertama di SMP Negeri 13 Medan. Tahun 1991 Penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 2 Medan. Pendidikan sarjana ditempuh di jurusan Sosial Ekonomi Pertanian, Fakultas Pertanian UISU Medan lulus pada tahun 1995, kemudian penulis menempuh pendidikan sarjana Program Studi Biologi di Fakultas Keguruan Ilmu Pendidikan UISU Medan lulus pada tahun 2003. Kemudian penulis mendapatkan kesempatan untuk melanjutkan pendidikan ke Program Magister (S-2) Biologi di Sekolah Pascasarjana Universitas Sumatera Utara Medan, mulai tahun 2007 melalui Beasiswa Pemerintah Propinsi Sumatera Utara. Tahun 1999-2003 penulis bertugas sebagai guru bidang studi Agribisnis di Sekolah Pembangunan Pertanian (SPP) Perguruan Al Azhar Medan, tahun 2003-2006 penulis bertugas sebagai guru bidang studi Biologi di Sekolah Menengah Atas Perguruan Al Azhar Medan dan tahun 2006 sampai sekarang penulis bertugas sebagai guru bidang studi Biologi di Sekolah Menengah Atas Plus dan Akselerasi Perguruan Al Azhar Medan.
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT... ii
KATA PENGANTAR ... iii
RIWAYAT HIDUP... iv
DAFTAR ISI ... v
DAFTAR TABEL... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... ix I. PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Tujuan Penelitian ... 3 1.3. Hipotesis Penelitian ... 3 1.4. Kegunaan Penelitian ... 3
II. TINJAUAN PUSTAKA ... 4
2.1. Pengertian Fungi Mikoriza Arbuskula ... 4
2.2. Klasifikasi Fungi Mikoriza Arbuskula ... 5
2.3. Struktur dan Ekologi Fungi Mikoriza Arbuskula ... 6
2.4. Fungsi dan Kegunaan Mikoriza Bagi Tanaman ... 11
2.5. Faktor Lingkungan Mikoriza ... 12
2.6. Faktor Salinitas terhadap Perkecambahan Spora... 14
2.7. Faktor Salinitas terhadap Formasi FMA (Kolonisasi) pada Akar Tanaman Inang... 16
III. METODOLOGI PENELITIAN ... 20
3.1. Waktu dan Tempat ... 20
3.2. Bahan dan Alat ... 20
3.3. Metode Penelitian ... 21
3.4. Strerilisasi Alat dan Bahan ... 22
3.5. Uji Perkecambahan Spora ... 22
3.6 Uji Kolonisasi FMA pada Akar Tanaman Contoh Peureria javanicum... 25
IV. HASIL DAN PEMBAHASAN ... 28
4.1 Hasil... 28
V. KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR TABEL
Nomor Judul Halaman
1. Rata-rata Hari Mulai Berkecambah (Hari)... 28
2. Rata-rata Persentase Perkecambahan (%)... 29
3. Rata-rata Laju Perkecambahan (%/hari)... 30
DAFTAR GAMBAR
Nomor Judul Halaman
1. Struktur Mikoriza dalam Sel Akar, Hifa Terlihat Jelas
di dalamnya ………... 5 2. Filogeni Perkembangan dan Taksonomi Ordo
Glomeromycota... 6 3. Hifa FMA Mempenetrasi Sel Akar dan Membentuk
Percabangan Arbuskula yang Lebih Besar di mana Terjadi
Pertukaran Tempat Nutrient... 8 4. Penampang Longitudinal Akar yang Terinfeksi FMA……….. 10 5. Skema Aktivitas FMA yang Mungkin Dipengaruhi Oleh
Salinitas Tanah…………... 19 6. Spora Gigaspora margarita yang Sudah Memunculkan Hifa... 32 7. Spora Acaulospora tuberculata yang Belum Berkecambah
Hingga Hari Ke-30... 32 8. Hifa FMA membentuk formasi (kolonisasi) dalam sel akar
Pueraria javanica A. Hifa Internal B. Hifa Eksternal ... 35 9. Percabangan Lateral Hifa Spora Gigaspora margarita... 39
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Skematis Teknis Isolasi Spora FMA... 46 2. Skematis Teknis Sterilisasi Spora FMA... 48 3. Skematis Teknis Uji Kolonisasi FMA
pada Akar Tanaman Contoh (Pueraria javanica)... 49
4. Data Transformasi ( y+0,5) Hari Mulai Berkecambah... 50 5. Daftar Sidik Ragam Hari Mulai Berkecambah... 50 6. Data Transformasi y+0,5 Persentase Perkecambahan (%).... 51 7. Daftar Sidik Ragam Persentase Perkecambahan (%)... 51 8. Data Transformasi y+0,5 Laju Perkecambahan (%/hari)... 52 9. Daftar Sidik Ragam Laju Perkecambahan (%/hari)... 52 10. Data Transformasi y+0,5 Persentase Kolonisasi Akar (%).. 53 11. Daftar Sidik Ragam Persentase Kolonisasi Akar (%)... 53 12. Hifa FMA membentuk formasi (kolonisasi) dalam sel akar
Pueraria javanica ... 54 13. Ujung hifa FMA membentuk vesikula dalam sel akar
I. PENDAHULUAN
1.1. Latar Belakang
Mikoriza merupakan bentuk hubungan simbiosis mutualisme antara fungi dengan perakaran tanaman tingkat tinggi. Fungi mikoriza menguntungkan tanaman dalam banyak hal seperti suplai nutrien mineral inorganik, meningkatkan toleransi tanaman terhadap kekeringan, memberikan perlindungan terhadap patogen primer yang menyerang akar tanaman, memperbaiki kondisi-kondisi tanah yang buruk, mengatasi logam-logam berat yang berlebihan dengan immobilisasi logam dalam hifa jamur dan melindungi beberapa tanaman halofitik terhadap kehilangan hasil pada tanah yang salin (Dell, 2002).
Endomikoriza atau dikenal juga dengan fungi mikoriza arbuskula (FMA) dapat ditemukan hampir pada sebagian besar tanah dan pada umumnya tidak mempunyai inang spesifik. Namun tingkat populasi dan komposisi jenis sangat bervariasi dan dipengaruhi oleh karakteristik tanaman dan sejumlah faktor lingkungan seperti suhu, pH, kelembaban tanah, kandungan fosfor, nitrogen dan salinitas (Hetrick, 1984).
Kajian tentang pengaruh salinitas terhadap perkecambahan spora FMA masih sangat terbatas. Dari data yang tersedia menunjukkan terjadi penghambatan perkecambahan spora seiring dengan peningkatan konsentrasi NaCl (Juniper & Abbott, 1993). Masalah salinitas menarik untuk dikaji lebih jauh karena terdapat fenomena yang menunjukkan hubungan antara mikoriza, pertumbuhan tanaman dan
tanah salin. Keberadaan mikoriza sangat dipengaruhi salinitas tanah. Pada beberapa penelitian menunjukkan penurunan koloni FMA pada ujung akar tanaman dengan level salinitas yang berbeda seperti pada penelitian Al-Kariki (2000), Cantrell Linderman (2001), Gupta dan Krisnamurthy (1996), Hirrel (1981) dan Delvian (2003).
Pada sisi lain fungi mikoriza dapat membantu tanaman tumbuh baik pada kondisi cekaman salinitas. Hal ini dapat dilihat pada beberapa hasil penelitian seperti pada penelitian Gupta dan Krisnamurthy (1996), Al-Kariki (2000), Cantrell dan Linderman (2001) dan Delvian (2003) yang melihat peranan FMA dalam mengurangi pengaruh cekaman salinitas terhadap pertumbuhan tanaman.
Juniper dan Abbott (1993) menyatakan bahwa salinitas tanah mungkin mempengaruhi pertumbuhan dan aktivitas FMA melalui beberapa mekanisme, baik secara terpisah maupun interaktif dan mempengaruhi semua tahapan perkembangan mikoriza. Salah satu tahapan perkembangan mikoriza adalah perkecambahan. Tahapan ini adalah tahapan yang paling mudah untuk dipelajari. Penelitian ini mempelajari tahapan perkecambahan spora dan kolonisasi akar tanaman yang terinfeksi spora FMA saja, karena spora merupakan bagian dari mikoriza yang paling mudah dan memungkinkan untuk dilakukan isolasi. Pengamatan spora juga lebih mudah dibandingkan dengan pengamatan hifa. Kegiatan penelitian ini berhubungan dengan kemampuan berkecambah spora fungi mikoriza arbuskula terhadap cekaman salinitas, dilakukan dengan cara mengisolasi spora fungi mikoriza arbuskula (FMA) dan dikultur dengan kondisi salinitas (kadar garam) yang berbeda.
1.2. Tujuan Penelitian
Mengetahui pengaruh NaCl terhadap perkecambahan spora FMA Gigaspora
margarita dan Acaulospora tuberculata dan derajat infeksi (kolonisasi) FMA pada
akar tanaman.
1.3. Hipotesis Penelitian
Terjadi penghambatan perkecambahan spora FMA Gigaspora margarita dan
Acaulospora tuberculata dan derajad infeksi (kolonisasi) FMA pada akar tanaman
seiring dengan peningkatan konsentrasi NaCl.
1.4. Kegunaan Penelitian
1. Memberikan informasi mengenai pengaruh NaCl terhadap perkecambahan spora Gigaspora margarita dan Acaulospora tuberculata dan derajad infeksi (kolonisasi) FMA pada akar tanaman.
II. TINJAUAN PUSTAKA
2.1. Pengertian Fungi Mikoriza Arbuskula
Mikoriza secara botani merupakan suatu struktur (bentuk) sistem perakaran yang tertentu sebagai manifestasi adanya simbiosis, yang kebanyakan mutualistis, antara cendawan dan perakaran tumbuhan tingkat tinggi (Smith & Read, 1997). Endomikoriza merupakan suatu bentuk fungi yang banyak didapat pada jaringan dalam akar. Tipe fungi ini selalu ditemukan pada lapisan tanah yang subur dan memiliki karakteristik khas yang meliputi sebagai tempat penyimpanan dan transfer makanan antara jamur dan tumbuhan inangnya (Mayer et al, 2000).
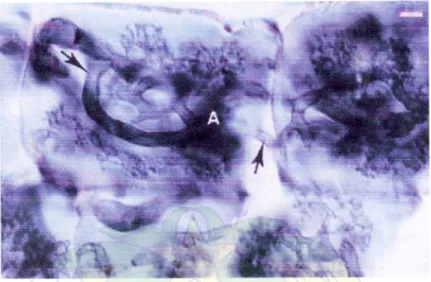
Fungi mikoriza terdapat dalam perakaran dari sebagian besar Angiospermae, Pteridophyta dan Bryophita. Fungi mikoriza arbuskula membentuk struktur karakteristik yang khusus yang disebut arbuskul dan vesikel. Arbuskul membantu dalam mentransfer nutrien (terutama fosfat) dari tanah ke sistem perakaran (Rao, 1994). Keberadaan FMA dalam sel akar dapat dilihat pada Gambar 1.
Hifa dari jamur ini menjalar sepanjang lapisan tanah dan menempel pada akar tanaman yang menimbulkan struktur khusus untuk merubah makanan. Keuntungan yang didapat dari hubungan antara jamur dan tanaman ini adalah terjadi ketersedian karbon untuk jamur dan penambahan penyerapan makanan tumbuhan terutama fosfor. Diperkirakan sekitar 70-90% spesies tumbuhan memiliki perakaran mikoriza (Anonimus, 2006).
Gambar 1. Struktur Mikoriza dalam Sel Akar, Hifa Terlihat Jelas di dalamnya (Native Plant Production, 2006)
Selama siklus hidupnya, simbion endomikoriza mempunyai perbedaan struktur hifa intraselular, menggelembung berbentuk oval atau globosa pada ujungnya disebut vesikula, sedangkan struktur intraseluler yang berbentuk seperti pohon kecil disebut arbuskula. Pada waktu yang bersamaan dan akar yang sama dapat diinfeksi oleh dua jenis endomikoriza yang berbeda. Hubungan tanaman inang dengan mikoriza merupakan hubungan mutualistik (saling menguntungkan) (Powell & Bagyaraj, 1989).
2.2. Klasifikasi Fungi Mikoriza Arbuskula
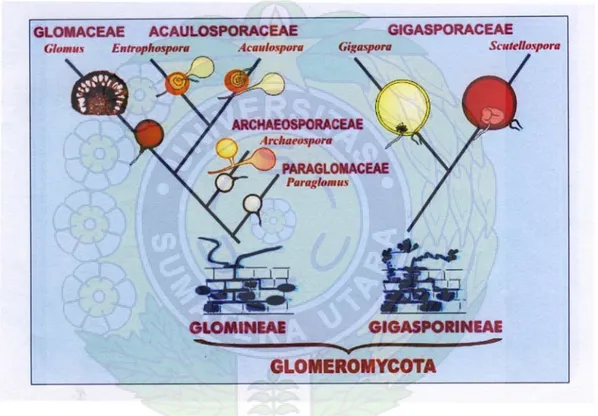
Fungi mikoriza arbuskula adalah salah satu tipe fungi mikoriza dan termasuk ke dalam golongan endomikoriza. Fungi mikoriza arbuskula termasuk ke dalam ordo Glomeromycota yang mempunyai 2 sub ordo, yaitu Gigasporineae dan Glominae dengan famili Gigasporaceae mempunyai 2 genus yaitu Gigaspora dan Scutelospora,
Glomamineae mempunyai 4 famili yaitu Glomaceae dengan genus Glomus, famili Acaulospora dengan genus Acaulospora dan Entrophospora, Paraglomaceae dengan genus Paraglomus dan Archaesoporaceae dengan Genus Archaeospora (INVAM, 2009). Filogeni perkembangan dan taksonomi ordo Glomeromycota dapat dilihat pada Gambar 2.
Gambar 2. Filogeni Perkembangan dan Taksonomi Ordo Glomeromycota (Sumber: INVAM, 2009)
2.3. Struktur dan Ekologi Fungi Mikoriza Arbuskula
Endomikoriza dicirikan oleh hifa yang intraseluler, yang dihasilkan oleh
kumparan atau langsung oleh penetrasi cabang hifa yang biasanya diketemukan dalam lapisan intermediate dari parenkim kortikal. Diameter berkisar antara 2 sampai
dengan 6 µm dengan pengecualian ada endofit yang lebih halus kurang dari 2 µm. Karena jamur menyebar dengan cara memperluas ruang interseluler dari tanaman inang, dinding jamur dapat kontak langsung dengan dinding sel tanaman inang dan sering kali pada lamela tengah. Bentuk luar ini menunjukkan bahwa jamur masuk dengan mekanisme enzimatik, sebagai contoh dengan menghasilkan hidrolase seperti pektinase (Bonfante & Fasolo, 1984).
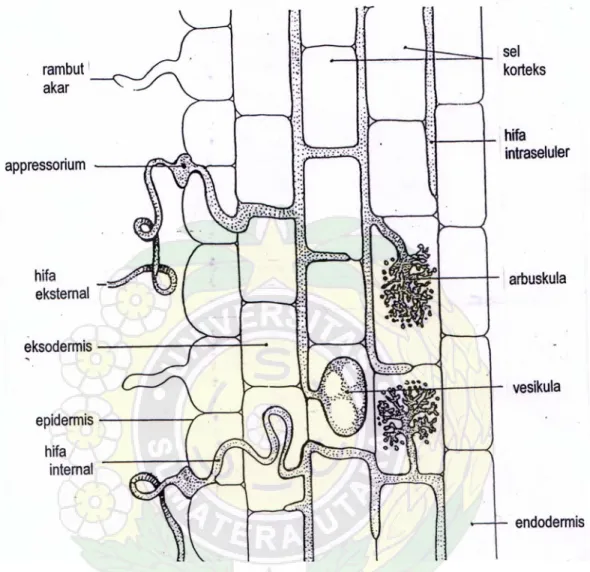
Pada lapisan-lapisan yang lebih dalam dari jaringan korteks hifa intraseluler membentuk percabangan yang kompleks yang bercabang seperti perdu yang disebut arbuskula. Arbuskula adalah struktur yang paling berarti dalam kompleks mikoriza vesikula arbuskular (MVA), khususnya dilihat dari fungsinya, dan arbuskula kelihatan merupakan tempat pertukaran metabolit antara jamur dan tanaman. Adanya arbuskula sangat penting untuk mengidentifikasi bahwa telah terjadi infeksi pada akar. Menurut penjelasan klasik cabang-cabang tersebut menggelembung pada ujung yang membentuk badan yang bulat disebut sporangiola yang menunjukkan fase-fase infeksi. Keseluruhan dari kompleks arbuskula sporangiola merupakan ujung yang melebar dalam sel dan diberi makan oleh tanaman inang. Batang arbuskular nampak bercabang dikotomi menimbulkan cabang yang makin mengecil (Bonfante & Fasolo, 1984).
Vesikula berbentuk globosa bila berasal dari menggelembungnya hifa dari jamur mikoriza. Vesikula ditemukan dalam akar dapat dalam bentuk interseluler atau ekstraseluler. Peran vesikula sebagai organ reproduktif seperti sporangi. Vesikula juga organ yang berfungsi sebagai penyimpan makanan (lemak) yang kemudian
diangkut ke dalam sel dan di sana pencernaan oleh sel berlangsung. Karena jumlahnya meningkat pada saat tua atau saat tanaman akan mati menunjukkan bahwa fungsinya sebagai organ istirahat (Bonfante & Fasolo, 1984). Vesikula menurut Abbott & Robson (1982), berbentuk globosa dan berasal dari menggelembungnya hifa internal dari FMA. Vesikula ditemukan baik di dalam maupun di luar lapisan kortek parenkim dan tidak semua FMA membentuk vesikula dalam akar inangnya, seperti Gigaspora dan Scutellospora vesikulanya ekstra-radikal dan tidak teratur. Banyak pendapat tentang fungsi dari vesikula ini, yaitu sebagai organ reproduktif atau organ yang berfungsi sebagai tempat penyimpanan makanan yang kemudian diangkut ke dalam sel tempat pencernaan oleh sel berlangsung. Pendapat lain menganggap vesikula sebagai organ istirahat, karena jumlahnya meningkat pada saat tanaman tua atau saat tanaman akan mati (Abbott & Robson, 1982; Bonfante & Fasolo, 1984). Hifa FMA membentuk arbuskula dalam sel akar (Gambar 3) yang berperan tempat pertukaran nutrisi dan karbon.
Menurut Abbott & Robson (1984), akar yang bermikoriza dapat meningkatkan kapasitas pengambilan hara karena waktu hidup akar yang dikolonisasi diperpanjang dan derajat percabangan serta diameter akar diperbesar, sehingga luas permukaan absorpsi akar diperluas (Gambar 4). Imas
et al (1989) menyatakan bahwa FMA dapat meningkatkan produksi hormon
pertumbuhan seperti auksin, sitokinin dan giberelin bagi tanaman inangnya. Auksin berfungsi memperlambat proses penuaan akar sehingga fungsi akar sebagai penyerap unsur hara dan air akan bertahan lebih lama.
Hetrick (1984) menyimpulkan bahwa kolonisasi akar dan produksi spora dipengaruhi oleh dua faktor, yaitu: spesies cendawan dan lingkungan. Menurut Abbott & Robson (1984), setiap spesies FMA mempunyai innate effectiveness atau kemempanan spesifik. Keefektifan (effectiveness) diartikan sebagai kemampuan FMA dalam meningkatkan pertumbuhan tanaman pada kondisi tanah yang kurang menguntungkan. Setidaknya ada empat faktor yang berhubungan dengan keefektifan dari suatu spesies FMA, yaitu: (a) kemampuan FMA untuk membentuk hifa yang ekstensif dan penyebaran hifa yang baik di dalam tanah, (b) kemampuan FMA untuk membentuk infeksi yang ekstensif pada seluruh sistem perakaran yang berkembang dari suatu tanaman, (c) kemampuan dari hifa FMA untuk menyerap fosfor dari larutan tanah, dan (d) umur dari mekanisme transpor sepanjang hifa ke dalam akar tanaman.
Gambar 4. Penampang Longitudinal Akar yang Terinfeksi FMA (Sumber: Brundrett et al, 1994)
Penyebaran mikoriza terjadi melalui penyebaran aktif miselia melalui tanah. Penyebaran FMA melalui tanah debu berpasir seperti fumigasi, dan tersebar melalui inokulasi atau ditanam dengan tanaman yang terinfeksi. Penyebaran seperti ini hanya bergerak sejauh 65 m dalam 150 tahun atau 0,43 m/tahun (Hetrick, 1984).
2.4. Fungsi dan Kegunaan Mikoriza Bagi Tanaman
Peranan mikoriza secara spesifik dalam membantu pertumbuhan tanaman antara lain membantu memperbaiki nutrisi tanaman dengan meningkatkan penyerapan fosfat, mengurangi kerusakan tanaman oleh serangan patogen (Bagyaraj, 1984). Fosfat adalah salah satu unsur hara esensial yang diperlukan dalam jumlah relatif banyak oleh tanaman, akan tetapi ketersediaannya terutama pada tanah-tanah masam menjadi terbatas, sehingga seringkali menjadi salah satu pembatas utama dalam peningkatan produktivitas tanaman. Keberadaan mikoriza sangat bermanfaat dalam penyerapan air dan unsur hara terutama fosfor (Smith & Read, 1997). Akar bermikoriza ternyata meningkatkan pula penyerapan seng dan sulfur dari dalam tanah lebih cepat daripada tanaman yang tidak bermikoriza.
Perbedaan kecepatan penyerapan itu mungkin sebagai refleksi perbedaan antara luas permukaan akar dan berat kering dari akar tanaman yang bermikoriza dan yang tidak bermikoriza. Perbedaan antara rata-rata penyerapan antar tanaman yang bermikoriza dan tidak bermikoriza lebih disebabkan karena perbedaan status fosfor dari dua jenis tanaman tersebut (Abbot & Robson, 1984).
Pada beberapa hasil penelitian terlihat peranan FMA dalam mengurangi cekaman salinitas terhadap pertumbuhan tanaman. FMA membantu pertumbuhan tanaman Arachis hypogaea cv. JL 24 (Gupta & Krisnamurthy, 1996), membantu penyerapan P, Zn, Cu dan Fe pada Lycopersicum esculentum Mill cv. Pello (Al-Karaki, 2000), membantu pertumbuhan dan penyerapan P Lactuca sativa dan Allium
cepa L (Cantrell & Linderman, 2001), membantu pertumbuhan tinggi tanaman
Leucaena lecocephala (Delvian, 2003).
Akar tanaman yang terbungkus oleh mikoriza menyebabkan akar tersebut terhindar dari serangan penyakit dan hama. Infeksi patogen terhambat, di samping itu mikoriza menggunakan semua kelebihan karbohidrat dan eksudat akar lainnya, sehingga tercipta lingkungan yang tidak cocok bagi pertumbuhan patogen. Di pihak lain fungi mikoriza ada yang dapat mematikan patogen. Biasanya tanaman yang memiliki sistem akar serabut dan rambut akar yang panjang kurang tergantung kepada infeksi mikoriza dibandingkan dengan tanaman yang memiliki akar yang relatif kasar dan rambut akar yang tipis (Abbot & Robson, 1984).
2.5. Faktor Lingkungan Mikoriza
Endomikoriza atau dikenal juga dengan FMA dapat ditemukan hampir pada sebagian besar tanah dan pada umumnya tidak mempunyai inang spesifik. Namun tingkat populasi dan komposisi jenis sangat bervariasi dan dipengaruhi oleh karakteristik tanaman dan sejumlah faktor lingkungan seperti suhu, pH, kelembaban tanah, kandungan fosfor dan nitrogen. Suhu terbaik untuk perkembangan FMA adalah pada suhu 30°C, tetapi untuk kolonisasi miselia yang terbaik adalah pada suhu 28- 34°C (Hetrick, 1984).
Informasi tentang pengaruh salinitas terhadap perkecambahan spora FMA masih sangat terbatas. Dari data yang tersedia menunjukkan terjadi penghambatan
perkecambahan spora seiring dengan peningkatan konsentrasi NaCl (Juniper & Abbott, 1993).
Untuk perkecambahan spora, pH optimum dapat berbeda-beda untuk masing-masing spesies FMA dan untuk lingkungan yang berbeda pula. Di dalam tanah kandungan nutrient yang lain sangat kecil pengaruhnya terhadap perkecambahan spora kecuali fosfor. Nilai pH optimum untuk perkecambahan spora tidak hanya tergantung pada spesies dari jamur tetapi juga kandungan nutrient di dalam tanah. Nilai pH dapat berpengaruh langsung terhadap aktivitas enzim yang berperan dalam perkecambahan spora. Nilai pH optimum untuk perkecambahan tampaknya bergantung pada adaptasi dari FMA terhadap lingkungan, misalnya terhadap suhu optimum dan juga tergantung kepada jenis FMA (Hetrick, 1984).
Biasanya pada tanah yang tidak diolah jumlah sporanya kurang bila dibandingkan dengan tanah olahan atau tanah berumput. Pada tanah yang diolah karena adanya pergantian akar dan kekeringan mengakibatkan seleksi FMA dan produksi spora. Pada tempat yang kurang diolah selalu ada tanaman yang bagian akarnya selalu tumbuh karena sepanjang tahun kandungan air tanah dan suhu memadai sehingga produksi spora pada tempat yang demikian tidak lagi diperlukan (Hetrick, 1984).
Ada tidaknya tanaman inang yang sesuai ternyata berpengaruh terhadap ada atau tidaknya koloni mikoriza dan produksi spora. Pengaruh tanaman bukan inang terhadap pembentukan mikoriza sudah dipelajari dengan hasil yang berbeda-beda. Hal ini mungkin disebabkan adanya eksudat beracun dari tanaman bukan inang
tersebut. Walaupun telah diketahui bahwa mikoriza mampu beradaptasi dengan berbagai tanaman, namun diketahui bahwa mikoriza memilih tanaman inang yang disukai dan yang tidak disukai. Namun belum ada laporan bahwa jenis mikoriza tertentu hanya bisa berasosiasi dengan tanaman inang tertentu (Hetrick, 1984).
2.6. Faktor Salinitas terhadap Perkecambahan Spora
Perkecambahan spora dari FMA bisa digambarkan terdiri dari empat fase
yaitu hidrasi, pengaktifan, pemunculan tabung germ dan pertumbuhan hifa. Pertama air memasuki spora, komponen-komponennya menjadi terhidrasi. Setelah hidrasi sebagian atau seluruh organel dan makro molekul lengkap, asam ribonukleat dan enzim menjadi aktif, yang menimbulkan aktivitas metabolis yang meningkat.
Dua hingga sepuluh hari setelah spora diaktifkan, tabung germ nampak dan diikuti oleh pertumbuhan hifa. Penundaan ataupun pencegahan seluruh atau sebagian fase perkecambahan spora oleh garam-garam yang terlarut dalam larutan tanah akan menunda atau menghindari pertumbuhan hifa, kolonisasi akar tanaman dan pembentukan simbiosis (Tommerup, 1984; Gazey et al, 1993). Perbedaan-perbedaan yang diamati antara pengaruh KCl dan NaCl dan pengaruh dari tiga larutan garam lainnya sebagian terjadi karena perbedaan dalam potensi osmotik. Jika perkecambahan diganggu karena penurunan dalam kemampuan spora untuk menyerap air dalam larutan-larutan dengan potensi osmotik rendah, maka bisa diharapkan bahwa spora-spora akan dihindari dari berkecambah dalam konsentrasi-konsentrasi larutan di atas tingkat kritis (Tommerup, 1984).
Jika pengaruh primer dari NaCl terhadap perkecambahan spora terjadi karena perubahan-perubahan dalam osmotik, dan demikian juga dengan potensi air dari substrat pertumbuhan, maka bisa diharapkan bahwa meningkatkan konsentrasi NaCl akan sama pengaruhnya dengan menurunkan potensi air dan lainnya. Hal ini barang kali bertumpu kepada asumsi simplistik (Brownell & Scheneider, 1985 dalam Juniper & Abbott, 1993) menyebabkan respon jamur terhadap matrik dan daya osmotik menjadi sama.
Dua studi telah mengamati pengaruh NaCl terhadap perkecambahan spora FMA. Juniper & Abbot (1991) telah menginkubasi spora Acaulospora laevis, A.
trappei, Scutellospora calospora dan Gigaspora decipiens dan Esteun (1991) dalam
Juniper & Abbot (1993) dari FMA dengan isolat-isolat spesies yang sama menunjukkan pada umumnya meningkatkan konsentrasi NaCl menunda perkecambahan dan menurunkan angka ekstensi hifa dari jamur dalam kedua studi. Garam dalam media pertumbuhan bisa memicu perubahan-perubahan bukan saja dalam panjang namun juga dalam sifat-sifat morfologis lainnya dari hifa. Konsentrasi yang tinggi dari CaCl2, KCl atau NaCl dalam media pertumbuhan jelas
memperpendek tabung germ dan menstimulasi percabangan lateral dari hifa
Gigaspora margarita, sedangkan dalam konsentrasi tinggi dari NaNO3 dan Na2SO4,
pertumbuhan tabung germ adalah normal (Hirrel, 1981). Dengan meningkatkan konsentrasi NaCl dalam larutan tanah akan mereduksi pertumbuhan dan meningkatkan diameter hifa yang diproduksi oleh spora Gigaspora decipiens namun tidak mempengaruhi hifa Scutellospora calospora (Juniper Abbott, 1992).
2.7. Faktor Salinitas terhadap Formasi FMA (Kolonisasi) pada Akar Tanaman Inang
Bila mendiskusikan formasi FMA, sering dianggap penting untuk membedakan antara infeksi primer yakni masuk pertama ke dalam akar oleh jamur, dan infeksi sekunder yang terjadi setelah hifa jamur bercabang dari daerah-daerah kolonisasi awal (Wilson, 1984 dalam Juniper & Abbott, 1993). Infeksi awal tergantung pada 1) perkecambahan spora ataupun propagul jamur lainnya; 2) Pertumbuhan hifa melalui tanah; dan 3) masuk ke dalam akar tanaman. Masing-masing dari tahap ini bisa merupakan langkah pembatas dalam formasi FMA (Bowen, 1987).
Infeksi sekunder dipengaruhi oleh fisiologi tanaman inang, karena kebanyakan energi untuk penyebaran hifa didapatkan dari fotosintat yang ditranslokasikan dari tanaman ke FMA, baik pada arbuskula ataupun melalui hifa internal. Pertimbangan pengaruh salinitas terhadap formasi FMA harus meliputi pengaruh salinitas terhadap tanaman inang. Tanaman-tanaman yang tumbuh dalam tanah salin berpengaruh terhadap dua stress fisiologis yang berbeda. Pertama efek racun dari ion-ion spesifik seperti sodium dan klorida yang lazim dalam tanah salin, yang mengganggu struktur enzim dan makromolekul lainnya, merusak organel sel, mengganggu fotosintesis dan respirasi, mengganggu sintesis protein dan memicu defisiensi ion (Epstein, 1972
dalam Juniper dan Abbott, 1993). Kedua, tanaman-tanaman yang diekspos ke potensi
osmotik rendah dari larutan tanah salin adalah beresiko kekeringan fisiologis karena mereka harus mempertahankan potensi internal yang masih lebih rendah untuk
menghindari pergerakan air oleh osmosis dari akar ke dalam tanah. Tanaman-tanaman bisa menyerap elektrolit untuk mempertahankan potensi osmotik internal yang rendah, namun ini bisa menimbulkan kelebihan ion yang mereduksi pertumbuhan tanaman (Greenway dan Munns, 1980).
Penurunan persentase kolonisasi FMA pada perakaran dengan adanya peningkatan salinitas tanah mungkin disebabkan oleh perubahan fisiologi tanaman yang mungkin akan mempengaruhi simbionnya secara langsung maupun tidak langsung. Tanaman yang tumbuh di tanah bergaram akan mengalami dua tekanan fisiologis yang berbeda. Pertama, pengaruh racun dari beberapa ion tertentu seperti sodium dan klorida, yang lazim terdapat dalam tanah bergaram, yang akan menghancurkan struktur enzim dan makromolekul lainnya, merusak organel sel, mengganggu fotosintesis dan respirasi, akan menghambat sintesis protein dan mendorong kekurangan ion (Marschner, 1995). Kedua, tanaman yang dihadapkan pada potensial osmotik yang rendah dari larutan tanah bergaram akan terkena resiko “kekeringan fisiologis” karena tanaman-tanaman tersebut harus mempertahankan potensial internal osmotik yang lebih rendah dalam rangka untuk mencegah pergerakan air akibat osmosis dari akar ke tanah. Tanaman mungkin akan menyerap ion untuk mempertahankan potensial osmotik internal yang rendah, namun hal ini akan menyebabkan kelebihan ion yang pada akhirnya mengakibatkan terjadinya penurunan pertumbuhan pada beberapa tanaman (Greenway dan Munns, 1980). Tingginya konsentrasi garam akan menyebabkan penurunan
permeabilitas akar terhadap air dan mengakibatkan penurunan laju masuknya air ke dalam tanaman (Marschner, 1995).
Hasil penelitian menunjukkan bahwa salinitas yang tinggi menyebabkan penurunan kandungan P pada Arachis hypogaea cv. JL 24 (Gupta dan Krisnamurthy, 1996), Lycopersicum esculentum Mill cv. Pello (Al-Kariki, 2000), dan Lactuca sativa (Ruiz-Lozano et al, 1996).
Keberadaan mikoriza sangat dipengaruhi salinitas tanah. Pada beberapa penelitian menunjukkan penurunan koloni FMA pada ujung akar tanaman dengan level salinitas yang berbeda pada Lycopersicum esculentum Mill cv. Pello (Al-Kariki, 2000), Lactuca sativa dan Allium cepa L (Cantrell dan Linderman, 2001), Arachis
hypogaea cv. JL 24 (Gupta dan Krisnamurthy, 1996), penurunan persentase
maksimum germinasi pada Gigaspora margarita (Hirrel, 1981), dan penurunan persentase hifa antara 6,66%-7,91% dengan meningkatnya salinitas 0 ppm menjadi 5000 ppm pada Leucaena lecocephala (Delvian, 2003).
Belum dapat ditentukan secara pasti apakah pengaruh NaCl terhadap perkecambahan spora FMA disebabkan oleh pengaruh osmotik atau toksisitas ion tertentu. Hirrel (1981) telah melakukan percobaan untuk mengidentifikasi pengaruh ion spesifik Na dan Cl dari NaCl, KCl,CaCl2, NaNO3, dan Na2SO4 terhadap
perkecambahan spora Gigaspora margarita, akan tetapi hasilnya masih kurang jelas. Setelah 12 hari spora mulai berkecambah dan membentuk banyak hifa dan sekelompok auxiliary cells. Perkecambahan dan pembentukan auxiliary cells tidak
(4988 ppm). Jika konsentrasi larutan meningkat maka persentase perkecambahan dan laju perkecambahan akan menurun, terutama pada larutan yang mengandung klorida dan auxiliary cells tidak terbentuk.
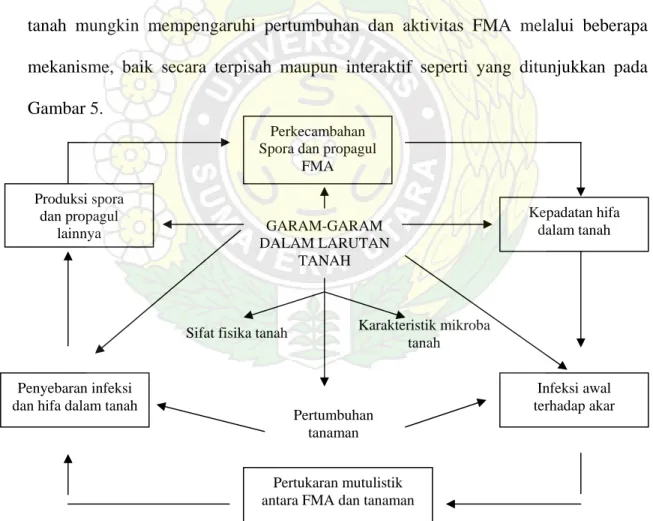
Pada umumnya penelitian lebih banyak mempertimbangkan pengaruh salinitas terhadap asosiasi tanaman dengan FMA akan mengidentifikasi pengaruh interaksi FMA dan salinitas tanah terhadap pertumbuhan tanaman daripada pengaruh salinitas terhadap pembentukan FMA. Juniper dan Abbott (1993) menyatakan, bahwa salinitas tanah mungkin mempengaruhi pertumbuhan dan aktivitas FMA melalui beberapa mekanisme, baik secara terpisah maupun interaktif seperti yang ditunjukkan pada Gambar 5. Produksi spora dan propagul lainnya Pertukaran mutulistik antara FMA dan tanaman
Kepadatan hifa dalam tanah
Penyebaran infeksi dan hifa dalam tanah
Infeksi awal terhadap akar GARAM-GARAM
DALAM LARUTAN TANAH
Sifat fisika tanah Karakteristik mikroba tanah Perkecambahan
Spora dan propagul FMA
Pertumbuhan tanaman
Gambar 5. Skema Aktivitas FMA yang Mungkin Dipengaruhi oleh Salinitas Tanah (Juniper & Abbot, 1993)
III. METODOLOGI PENELITIAN
3.1. Waktu dan Tempat
Percobaan ini dilakukan dari bulan April 2009 sampai Juni 2009 bertempat di Laboratorium Bioteknologi Kehutanan Departemen Kehutanan Fakultas Pertanian Universitas Sumatera Utara dan Laboratorium Biologi Tanah Departemen Ilmu Tanah Fakultas Pertanian Universitas Sumatera Utara.
3.2. Bahan dan Alat
Bahan-bahan penelitian:
Bahan yang digunakan dalam penelitian ini adalah spora fungi mikoriza arbuskular Gigaspora margarita dan Acaulospora tuberculata, akar tanaman contoh (Pueraria javanica), larutan NaCl, larutan KOH 10%, larutan HCl 2%, larutan Trypan blue 0,05%, larutan Lacto glycerol, pasir sungai, Aquades, kertas saring, bahan sterilisasi (chlorox), glukosa 60%.
Alat penelitian:
Alat yang digunakan dalam penelitian ini adalah cawan petri, pot kultur, pinset spora, rak kultur, mikroskop disecting, otoklaf, sentrifuse, pipet mikro, tabung reaksi kecil.
3.3. Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Faktorial dengan dua faktor yang diuji, yaitu:
a. Perbedaan konsentrasi larutan NaCl (S)
Tanpa pemberian NaCl (0%) sebagai kontrol (S0)
Pemberian NaCl sebanyak 1% (S1)
Pemberian NaCl sebanyak 2% (S2)
Pemberian NaCl sebanyak 3% (S3)
b. Spesies spora fungi mikoriza arbuskula (M)
FMA Gigaspora margarita (M1)
FMA Acaulospora tuberculata (M2)
Kombinasi Perlakuan:
S0M1 : Tanpa pemberian NaCl terhadap Gigaspora margarita.
S1M1 : Pemberian NaCl 1% terhadap Gigaspora margarita.
S2M1 : Pemberian NaCl 2% terhadap Gigaspora margarita.
S3M1 : Pemberian NaCl 3% terhadap Gigaspora margarita.
S0M2 : Tanpa pemberian NaCl terhadap Acaulospora tuberculata.
S1M2 : Pemberian NaCl 1% terhadap Acaulospora tuberculata
S2M2 : Pemberian NaCl 2% terhadap Acaulospora tuberculata
Masing-masing perlakuan dibuat sebanyak tiga ulangan. Pada penelitian dilakukan uji F, bila uji F menghasilkan perbedaan yang nyata maka dilakukan uji Duncan.
3.4. Sterilisasi Alat dan Bahan
Cawan petri, gelas ukur, tabung reaksi, erlenmeyer, pinset spora, pipet hisap, pasir sungai dicuci bersih. Seluruh alat yang sudah dicuci bersih dibungkus kertas HVS, dimasukkan ke dalam air mendidih pada suhu 121oC pada 1 atm selama 60 menit.
3.5. Uji Perkecambahan Spora Isolasi Spora
Teknik yang digunakan dalam mengisolasi spora FMA adalah teknik tuang-saring dari Pacioni (1992) dan dilanjutkan dengan teknik sentrifugasi dari Brundrett
et al, (1996). Prosedur kerja teknik tuang–saring ini, pertama adalah mencampurkan
mikofer sampel sebanyak 50 g dengan 200–300 ml air dan diaduk. Selanjutnya disaring dalam satu set saringan dengan ukuran 710 µm, 425 µm dan 45 µm secara berurutan dari atas ke bawah. Dari saringan bagian atas disemprot dengan air kran untuk memudahkan bahan saringan lolos. Kemudian saringan paling atas dilepas dan saringan kedua kembali disemprot dengan air kran. Setelah saringan kedua dilepas sejumlah mikofer sisa yang tertinggal pada saringan terbawah dipindahkan ke dalam tabung sentrifuse.
Ekstraksi spora teknik tuang–saring ini kemudian diikuti dengan teknik sentrifugasi dari Brundrett et al, (1996). Hasil saringan dalam tabung sentrifuse ditambahkan dengan glukosa 60% yang diletakkan pada bagian bawah dari larutan mikofer dengan menggunakan pipet. Tabung sentrifuse ditutup rapat dan disentrifuse dengan kecepatan 2500 rpm selama 3 menit. Selanjutnya larutan supernatan tersebut (yang mengandung spora) dituang ke dalam saringan 45 µm, dicuci dengan air mengalir (air kran) untuk menghilangkan glukosa. Selanjutnya spora-spora tersebut dituangkan ke dalam cawan petri dan siap digunakan untuk masuk pada tahap sterilisasi.
Sterilisasi Spora
Untuk kegiatan sterilisasi, spora yang diperoleh dari kegiatan isolasi spora dimasukkan ke dalam tabung reaksi kecil dan kemudian dimasukkan bahan sterilan (chlorox 5%) ke dalam tabung reaksi kecil tersebut dan disentrifugasi dengan 2000 rpm selama 2 menit. Setelah disentrifugasi sterilan yang terdapat di dalam tabung reaksi kecil disedot dengan pipet sampai habis dan kemudian dimasukkan larutan pembilas (aquades) ke dalam tabung reaksi kecil tersebut dan kemudian testube dikocok/digoyang dengan tangan dan setelah itu larutan pembilas (aquades) disedot. Kegiatan membilas spora dilakukan sebanyak 3 kali. Spora-spora yang telah disterilisasi diletakkan di cawan petri (wadah sementara) dan kemudian diletakkan ke dalam cawan petri perlakuan dan untuk seterusnya dilakukan pembuatan kultur.
Pembuatan Kultur
Cawan petri diberi label S0M1, S1M1, S2M1, S3M1, S0M2, S1M2, S2M2, S3M2,
dengan ulangan sebanyak 3 kali. Setiap cawan petri diberi pasir sungai masing-masing seberat 20 gram, dan dibagian permukaan pasir sungai diberi kertas saring. Spora FMA diletakkan masing-masing 5 spora Gigaspora margarita dan
Acaulospora tuberculata pada media yang sesuai label konsentrasi NaCl, dan
kemudian ditutup dengan bidang atas cawan petri. Pemberian NaCl dilakukan sedikit demi sedikit sampai alas kertas saring lembab/basah.
Pemeliharaan
Seluruh cawan petri yang telah diberi perlakuan dimasukkan ke dalam rak kultur selama 30 hari pada suhu kamar, tanpa cahaya.
Variabel Pengamatan
Variabel pengamatan yang dilakukan, yaitu:
a. Hari mulai berkecambah di mana dilakukan pengamatan spora pada cawan petri dan mencatat hari ke berapa masing-masing spora mulai berkecambah dengan menggunakan mikroskop dissecting. Spora berkecambah ditandai dengan adanya hifa kemudian menghitung rata-rata hari mulai berkecambah dari setiap cawan petri dengan rumus sebagai berikut:
X1 + X2 + X3 + ... + Xn
X =
n
Keterangan : X : rata-rata hari mulai berkecambah spora dalam 1 cawan petri X1 : hari mulai berkecambah data 1
X2 : hari mulai berkecambah data 2
X3 : hari mulai berkecambah data 3 Xn : hari mulai berkecambah data n n : banyaknya data
b. Persentase perkecambahan spora FMA dengan menggunakan rumus sebagai berikut:
Jumlah spora yang berkecambah
Persentase perkecambahan = x 100% Jumlah spora yang dikecambahkan
c. Laju perkecambahan diamati pada hari ke 1,2,3,4,5,6,7,8,...,30.
Pengamatan laju perkecambahan spora ini dihitung dengan menggunakan rumus yang sudah dimodifikasi dari Copeland (1977) dalam Kartasapoetra (2003). C.G = (100) (A1 + A2 +...+ An )
A1T1 + A2T2 +………+ AnTn
Keterangan:
A = Jumlah spora yang berkecambah pada hari tertentu
T = Waktu yang bersesuaian dengan A
n = Jumlah hari pada penilaian/perhitungan akhir. C.G = Koefisien berkecambah
3.6. Uji Kolonisasi FMA pada Akar Tanaman Contoh Pueraria javanica
Untuk pengamatan kolonisasi akar, langkah pertama yaitu dengan membuat kultur tanaman contoh dengan menumbuhkan tanaman contoh pada media
perkecambahan. Setelah tanaman contoh tumbuh dan berumur satu minggu kultur tanaman contoh tersebut diletakkan pada media pasir sungai di dalam pot-pot kecil yang telah diberi spora FMA Gigaspora margarita (M1) dan Acaulospora tuberculata
(M2) dan perlakuan NaCl (S0, S1, S2, S3) pada media yang sesuai label perlakuan
mikoriza dan konsentrasi NaCl yaitu label S0M1, S1M1, S2M1, S3M1, S0M2, S1M2,
S2M2, S3M2, dengan ulangan sebanyak 3 kali. Kultur tanaman contoh dipelihara dan
diberi perlakuan salinitas (kadar garam) satu kali dalam satu minggu sesuai konsentrasi perlakuan sampai tanaman berusia 6 minggu, selanjutnya akar tanaman contoh sudah dapat digunakan untuk pengamatan kolonisasi akar yang terinfeksi FMA.
Pengamatan kolonisasi FMA pada akar tanaman contoh dilakukan melalui
teknik pewarnaan akar. Metoda yang digunakan untuk pembersihan dan pewarnaan akar contoh adalah metoda dari Kormanik & McGraw (1982). Pertama yang dilakukan adalah memilih akar-akar tanaman contoh (Pueraria javanica) yang segar dan halus dengan diameter 0,5-2,0 mm (Rajapakse & Miller Jr., 1992) kemudian dicuci dengan air mengalir (air kran) hingga bersih.
Akar tanaman contoh dimasukkan ke dalam larutan KOH 10% selama lebih kurang 24 jam sampai akar tanaman contoh tersebut berwarna putih atau pucat yang bertujuan untuk mengeluarkan semua isi sitoplasma dari sel akar sehingga akan memudahkan pengamatan struktur infeksi FMA. Larutan KOH kemudian dibuang dan akar tanaman contoh dicuci pada air mengalir (air kran) selama 5-10 menit. Selanjutnya akar contoh direndam dalam larutan HCl 2% dan diinapkan selama satu
malam. Larutan HCl 2% kemudian dibuang dengan mengalirkannya secara perlahan-lahan. Selanjutnya akar tanaman contoh direndam dalam larutan Trypan blue 0,05%. Kemudian larutan Trypan blue dibuang dan diganti dengan larutan lacto glycerol untuk proses destaining (pengurangan warna). Selanjutnya kegiatan pengamatan siap untuk dilakukan.
Penghitungan persentase kolonisasi akar menggunakan metoda panjang akar terkolonisasi (Giovannetti & Mosse, 1980). Potongan-potongan akar tanaman contoh yang telah diwarnai dengan panjang ± 1 cm sebanyak 10 potongan akar diambil secara acak dan disusun pada kaca preparat, untuk setiap tanaman contoh dibuat dua preparat akar tanaman contoh. Potongan-potongan akar tanaman contoh pada kaca preparat diamati untuk setiap bidang pandang. Bidang pandang yang menunjukkan tanda-tanda kolonisasi (terdapat hifa dan atau arbuskula dan atau vesikula) diberi tanda positif (+), sedangkan yang tidak terdapat tanda-tanda kolonisasi diberi tanda negatif (-).
Derajat/persentase kolonisasi akar dihitung dengan menggunakan rumus: % kolonisasi akar =
∑
∑
+ n keseluruha pandang bidang da ber pandang bidang _ _ ) _( tan _ _ x 100%IV. HASIL DAN PEMBAHASAN 4.1. Hasil
Hari Mulai Berkecambah (hari)
Hasil analisis statistik terhadap hari mulai berkecambah menunjukkan bahwa perlakuan mikoriza berpengaruh sangat nyata, tetapi pemberian NaCl dan interaksi NaCl terhadap mikoriza berpengaruh tidak nyata terhadap hari mulai berkecambah. Uji beda rataan antar perlakuan dapat dilihat pada Tabel 1. Data dan analisis sidik ragam hari mulai berkecambah dapat dilihat pada Lampiran 4–5.
Tabel 1. Rata-rata Hari Mulai Berkecambah (Hari) Perlakuan Salinitas Spesies FMA 0%(S0) 1%(S1) 2%(S2) 3%(S3) Rataan Gigaspora margarita (M1) 13.33 (13.00) 13.33 (13,00) 13.00 14.67 (15,00) 13.58 (14,00) A Acaulospora tuberculata (M2) 0.00 0.00 0.00 0.00 0.00 B Rataan 6.67 6.67 6.50 7.33
Keterangan: Angka yang diikuti oleh huruf yang tidak sama menunjukkan pengaruh berbeda sangat nyata
Dari Tabel 1 dapat diketahui bahwa pemberian NaCl pada taraf 3% menunjukkan waktu perkecambahan terlama, tetapi perkecambahan tercepat pada perlakuan 2%, 0% dan 1%. Perlakuan mikoriza FMA Gigaspora margarita (M1)
menunjukkan waktu perkecambahan tercepat dan berbeda sangat nyata dengan perlakuan mikoriza FMA Acaulospora tuberculata. Perlakuan kombinasi S2M1 yaitu
Persentase Perkecambahan (%)
Hasil analisis statistik terhadap persentase perkecambahan menunjukkan bahwa perlakuan mikoriza berpengaruh sangat nyata, tetapi pemberian NaCl dan interaksi NaCl dan mikoriza berpengaruh tidak nyata terhadap persentase perkecambahan. Uji beda rataan antar perlakuan dapat dilihat pada Tabel 2. Data dan analisis sidik ragam persentase perkecambahan dapat dilihat pada Lampiran 6–7.
Tabel 2. Rata-rata Persentase Perkecambahan (%) Perlakuan Salinitas Spesies FMA 0%(S0) 1%(S1) 2%(S2) 3%(S3) Rataan Gigaspora margarita (M1) 100.00 93.33 86.67 80.00 90.00 A Acaulospora tuberculata (M2) 0.00 0.00 0.00 0.00 0.00 B Rataan 50.00 46.67 43.33 40.00
Keterangan: Angka yang diikuti oleh huruf yang tidak sama menunjukkan pengaruh berbeda sangat nyata
Dari Tabel 2 dapat diketahui bahwa pemberian NaCl pada taraf 0% menunjukkan persentase perkecambahan tertinggi, tetapi persentase perkecambahan yang terendah pada perlakuan 3%. Perlakuan mikoriza FMA Gigaspora margarita (M1) menunjukkan persentase perkecambahan tertinggi dan berbeda sangat nyata
dengan perlakuan mikoriza FMA Acaulospora tuberculata. Perlakuan kombinasi S0M1 yaitu 100% menunjukkan persentase perkecambahan tertinggi.
Laju Perkecambahan (%/hari)
Hasil analisis statistik terhadap laju perkecambahan menunjukkan bahwa perlakuan mikoriza berpengaruh sangat nyata, tetapi pemberian NaCl dan interaksi NaCl dan mikoriza berpengaruh tidak nyata terhadap laju perkecambahan. Uji beda rataan antar perlakuan dapat dilihat pada Tabel 3. Data dan analisis sidik ragam laju perkecambahan dapat dilihat pada Lampiran 8–9.
Tabel 3. Rata-rata Laju Perkecambahan (%/hari) Perlakuan Salinitas Spesies FMA 0%(S0) 1%(S1) 2%(S2) 3%(S3) Rataan Gigaspora margarita (M1) 7.47 7.57 7.94 6.84 7.46 A Acaulospora tuberculata (M2) 0.00 0.00 0.00 0.00 0.00 B Rataan 3.74 3.78 3.97 3.42
Keterangan: Angka yang diikuti oleh huruf yang tidak sama menunjukkan pengaruh berbeda sangat nyata
Dari Tabel 3 dapat diketahui bahwa pemberian NaCl pada taraf 2% menunjukkan laju perkecambahan tercepat, tetapi laju perkecambahan terendah pada perlakuan 3%. Perlakuan mikoriza FMA Gigaspora margarita (M1) menunjukkan
laju perkecambahan tercepat dan berbeda sangat nyata dengan perlakuan mikoriza FMA Acaulospora tuberculata. Perlakuan kombinasi S2M1 menunjukkan laju
perkecambahan tercepat.
Persentase Kolonisasi FMA pada Akar Tanaman Contoh Pueraria javanica
Hasil analisis statistik terhadap persentase kolonisasi akar menunjukkan bahwa perlakuan NaCl berpengaruh sangat nyata, tetapi pemberian mikoriza dan
interaksi NaCl dan mikoriza berpengaruh tidak nyata terhadap persentase kolonisasi akar. Uji beda rataan antar perlakuan dapat dilihat pada Tabel 4. Data dan analisis sidik ragam persentase kolonisasi akar dapat dilihat pada Lampiran 10-11.
Tabel 4. Rata-rata Persentase Kolonisasi Akar (%) Perlakuan Salinitas Spesies FMA 0%(S0) 1%(S1) 2%(S2) 3%(S3) Rataan Gigaspora margarita (M1) 55.00 11.00 4.00 3.33 18.33 Acaulospora tuberculata (M2) 33.67 6.33 2.67 0.67 10.83 Rataan 44.33 A 8.67 B 3.33 C 2.00 C
Keterangan: Angka yang diikuti oleh huruf yang tidak sama menunjukkan pengaruh berbeda sangat nyata
Dari Tabel 4 dapat diketahui bahwa pemberian NaCl pada taraf 0% menunjukkan persentase kolonisasi akar tertinggi dan berbeda sangat nyata terhadap perlakuan 1%, 2% dan 3%, antar perlakuan 1% terhadap 2%dan 3% juga berbeda
sangat nyata, tetapi antar 2% dan 3% berbeda tidak nyata. Perlakuan mikoriza FMA
Gigaspora margarita (M1) menunjukkan persentase kolonisasi akar tertinggi, tetapi
berbeda tidak nyata dengan perlakuan mikoriza FMA Acaulospora tuberculata (M2).
Perlakuan kombinasi S0M1 menunjukkan persentase kolonisasi akar tertinggi, tetapi
kolonisasi akar yang terendah pada perlakuan S3M2.
4.2. Pembahasan
Pada hasil penelitian ini rata-rata hari mulai berkecambah (hari) akibat
Acaulospora tuberculata sampai hari ke - 30 belum berkecambah. Contoh spora yang
berkecambah dan tidak berkecambah disajikan pada Gambar 6 dan 7.
hifa
Gambar 6. Spora Gigaspora margarita yang Sudah Memunculkan Hifa
Gambar 7. Spora Acaulospora tuberculata Belum Berkecambah Hingga Hari ke - 30
Hal ini mungkin dikarenakan Acaulospora tuberculata memiliki masa dormansi yang lebih dari 30 hari. Tommerup (1983) dalam Gazey, et al (1993) melihat perbedaan yang mencolok antar FMA dalam kebutuhan mereka untuk transisi dari dormansi ke fase perkecambahan di bawah kondisi-kondisi yang cocok. Belum
diketahui apakah jamur yang berhubungan secara taksonomi sama secara fungsional.
Acaulospora laevis Gerd dan A. trappe memiliki dormansi 6 bulan sedangkan yang
lain dengan genera yang berbeda adalah lebih singkat. Sebuah eksperimen yang mengamati perkecambahan dan pertumbuhan hifa dari spora setelah penyimpanan menunjukkan bahwa Acaulospora longular juga memiliki periode dormansi. Kejadian dormansi dalam spesies lain pada FMA Acaulospora belum diamati dan belum diketahui apakah dormansi panjang merupakan karakteristik umum dari genus
Acaulospora atau apakah itu spesifik spesies (Douds & Schenck, 1991 dalam Juniper
& Abbot, 1993). Selain itu juga mungkin dikarenakan Acaulospora tuberculata tidak dirangsang oleh eksudat-eksudat akar.
Hasil penelitian tersebut berbeda dengan hasil yang didapat jika dikultur bersama-sama dengan tanaman inang di mana terdapat perbedaan hasil pada FMA
Acaulospora tuberculata yang ditumbuhkan di media pasir yang menggunakan kertas
saring dengan yang ditumbuhkan di perakaran tanaman inang Pueraria javanica dimana yang ditumbuhkan di perakaran tanaman inang Pueraria javanica mampu berkecambah membentuk kolonisasi FMA di dalam sel akar. Hal itu sesuai dengan pendapat Bowen (1987) yang menyatakan bahwa hasil yang didapatkan dari berbagai eksperimen dengan menggunakan spora yang diinkubasi dalam media buatan belum tentu menunjukkan respon yang terjadi dalam tanah. Ada tidaknya tanaman inang ternyata berpengaruh terhadap ada atau tidaknya koloni mikoriza dan produksi spora (Hetrick, 1984).
Melin (1963) dalam Imas, et al (1988) yang mempelajari metabolisme akar terhadap pembentukan jamur mikoriza pada potongan-potongan akar Pinus sylvestris yang dalam hasil studinya berkesimpulan bahwa akar-akar pinus dapat mengeluarkan satu atau lebih metabolit yang dapat merangsang pertumbuhan mikoriza yaitu faktor M, yang pada prinsipnya mengungkapkan bahwa suatu zat yang rumit, faktor M, terlibat dalam pembentukan mikoriza. Selain itu juga menurut Bjorkman (1942)
dalam Imas, et al (1988), adanya teori karbohidrat yang mempengaruhi pembentukan
mikoriza. Pembentukan mikoriza sangat tergantung kepada tersedianya karbohidrat-karbohidrat sederhana yang berlebihan di dalam akar tumbuhan.
Pada beberapa FMA pertumbuhan tabung germ dari spora yang berkecambah bisa distimulasi dengan cara didekatkan dengan akar tanaman (Moose & Hepper, 1975 dalam Juniper & Abbott, 1993) dan oleh eksudat akar tanaman (Graham, 1972
dalam Juniper & Abbott, 1993). Perkecambahan FMA di media pasir dengan
menggunakan kertas saring tidak distimulasi oleh akar dan eksudat-eksudat akar sehingga perkecambahan terhambat sedangkan di media pot kultur dengan diberi tanaman inang distimulasi oleh eksudat-eksudat akar sehingga dapat membentuk hifa dan membentuk formasi hifa (kolonisasi) pada akar tanaman. Contoh formasi hifa dalam sel akar Pueraria javanica disajikan pada Gambar 8.
B A
Gambar 8. Hifa FMA Membentuk Formasi (Kolonisasi) dalam Sel Akar
Pueraria javanica, A. Hifa internal B. Hifa eksternal
Hasil yang diperoleh terlihat adanya penurunan persentase kolonisasi FMA pada akar tanaman seiring dengan meningkatnya salinitas tanah. Penurunan kolonisasi FMA sebesar 51,67% pada kolonisasi FMA Gigaspora
margarita (M1) dan menurun sebesar 33% pada Acaulospora tuberculata (M2).
Hal ini disebabkan oleh perubahan fisiologi tanaman yang akan mempengaruhi simbionnya secara langsung maupun tidak langsung. Tanaman yang tumbuh di tanah bergaram akan mengalami dua tekanan fisiologis yang berbeda. Pertama, pengaruh racun dari beberapa ion tertentu seperti sodium dan klorida, yang lazim terdapat dalam tanah bergaram, yang akan menghancurkan struktur enzim dan makromolekul lainnya, merusak organel sel, mengganggu fotosintesis dan respirasi, akan menghambat sintesis protein dan mendorong kekurangan
ion (Marschner, 1995). Kedua, tanaman yang dihadapkan pada potensial osmotik yang rendah dari larutan tanah bergaram akan terkena resiko “kekeringan fisiologi” karena tanaman-tanaman tersebut harus mempertahankan potensial internal osmotik yang lebih rendah dalam rangka untuk mencegah pergerakan air akibat osmosis dari akar ke tanah. Tanaman mungkin akan menyerap ion untuk mempertahankan potensial osmotik internal yang rendah, namun hal ini akan menyebabkan kelebihan ion yang pada akhirnya mengakibatkan terjadinya penurunan pertumbuhan pada beberapa tanaman (Greenway dan Munns, 1980). Tingginya konsentrasi garam akan menyebabkan penurunan permeabilitas akar terhadap air dan mengakibatkan penurunan laju masuknya air ke dalam tanaman (Marschner, 1995).
Selain itu proses fotosintesis tanaman akan terganggu pada kondisi salinitas yang tinggi, di mana pada umumnya fotosintesis tanaman non halofit akan menurun dengan meningkatnya salinitas. Hal ini terjadi karena adanya perubahan konsentrasi osmotik dari cairan daun, potensial air dan pembukaan stomata (Gale, et al, 1967). Sementara itu simbiosis FMA dan perkembangannya sangat tergantung pada nutrisi karbohidrat hasil fotosintesis tanaman inang, sehingga perubahan ketersediaan produk fotosintesis akan mempengaruhi pembentukan dan perkembangan serta fungsi FMA (Thomson et al, 1990). Beberapa peneliti telah melakukan penelitian tentang pengaruh potensial air terhadap perkecambahan spora dan pertumbuhan hifa FMA seperti Koske (1991) dalam penelitiannya menunjukkan bahwa rendahnya potensial air lebih
bersifat menunda daripada menurunkan perkecambahan. Tommerup (1984) menyatakan bahwa ketersediaan air tanah dapat mengubah durasi setiap fase perkecambahan spora Acaulospora laevis dan G. caledonium dan juga mengubah jumlah perkecambahan dalam setiap waktu. Penelitian-penelitian di atas menunjukkan bahwa rendahnya potensial air adalah pembatas yang sangat penting dalam perkecambahan spora.
Pfeiffer & Bloss (1988) telah melaporkan dalam sebuah studi tentang pengaruh salinitas terhadap intensitas kolonisasi dan pembentukan vesikula dan arbuskula dengan melakukan penelitian pengaruh NaCl terhadap keberadaan struktur dan kolonisasi akar oleh G. Intraradices. Penelitian dilakukan dengan perlakuan tanpa NaCl menghasilkan 8,1% hifa, 54,4% arbuskula, 32,0% vesikula, kosong 5,6% dan total persentase kolonisasi 51,7%, tetapi perlakuan penambahan 750 mg NaCl per kg tanah menghasilkan 14,8% hifa, 37,7% arbuskula, 10,6% vesikula, kosong 36,9% dan total persentase kolonisasi 33,4%. Salinitas menurunkan proses pembentukan arbuskula dan vesikula FMA namun tidak mereduksi pertumbuhan hifa pada akar. Intensitas kolonisasi bisa menurun dengan peningkatan NaCl (Juniper & Abbott, 1992). Penundaan atau penghambatan semua atau salah satu fase perkecambahan spora akibat tingginya konsentrasi garam terlarut dalam larutan tanah akan menunda atau mencegah pertumbuhan hifa. Pada akhirnya akan menunda atau mencegah pula kolonisasi akar tanaman dan pembentukan simbiosis (Juniper & Abbott, 1993). Hasil penelitian pada persentase perkecambahan spora FMA Gigaspora
peningkatan salinitas dari 0% ke 3%. Hal ini memperlihatkan bahwa dengan peningkatan konsentrasi NaCl menunda pertumbuhan hifa. Tommerup (1984) dalam Gazey et al (1993) dalam studinya mengemukakan bahwa perkecambahan spora FMA dapat dibagi ke dalam empat fase yaitu hidrasi, aktivasi, pertumbuhan saluran kecambah dan pertumbuhan hifa. Pada fase pertama, air masuk ke dalam spora sehingga komponen dalam spora menjadi terhidrasi. Setelah hidrasi sebagian atau seluruh organel dan makromolekul menjadi utuh, asam ribonukleat dan enzim menjadi aktif sehingga terjadi peningkatan aktivitas metabolisme. Dua hingga sepuluh hari setelah spora diaktifkan, tabung germ nampak dan diikuti oleh pertumbuhan hifa. Penundaan ataupun pencegahan seluruh atau sebagian fase perkecambahan spora oleh garam-garam yang terlarut dalam larutan tanah akan menunda pertumbuhan hifa, kolonisasi akar tanaman dan pembentukan simbiosis. Jika pengaruh primer dari NaCl terhadap perkecambahan spora terjadi karena perubahan-perubahan dalam osmotik, dan demikian juga dengan potensi air dari substrat pertumbuhan, maka bisa dipastikan bahwa meningkatkan konsentrasi NaCl akan sama pengaruhnya dengan menurunkan potensi air dan lainnya.
Garam dalam media pertumbuhan bisa memicu perubahan-perubahan bukan saja dalam panjang namun juga dalam sifat-sifat morfologis lainnya dari hifa. Konsentrasi yang tinggi dari CaCl2, KCl atau NaCl dalam media pertumbuhan jelas
memperpendek tabung germ dan menstimulasi percabangan lateral dari hifa
Gigaspora margarita (Hirrel 1981). Contoh percabangan lateral dari hifa Gigaspora
hifa
Gambar 9. Percabangan Lateral Hifa Spora Gigaspora margarita
Hirel (1981) dalam penelitiannya melaporkan terjadinya pemulihan kemampuan berkecambah dari spora-spora FMA setelah masa inkubasi yang diperpanjang, akan tetapi karena hifa yang terbentuk masih berumur sangat muda sehingga kurang ekstensif dalam larutan dengan konsentrasi tinggi. Dengan demikian pertumbuhan hifa lebih dipengaruhi oleh potensial air daripada perkecambahan spora. Hasil penelitian diperoleh laju perkecambahan tercepat terdapat pada FMA
Gigaspora margarita (M1) pada perlakuan salinitas 2% dan laju perkecambahan
terlama pada perlakuan 3%, sementara pada FMA Acaulospora tuberculata sampai hari ke 30 belum berkecambah. Rendahnya laju perkecambahan pada Gigaspora
margarita (M1) dengan perlakuan 0% dibanding dengan laju perkecambahan pada
Gigaspora margarita (M1) pada perlakuan salinitas 2% yang masih belum
berkecambah sebesar 13,33% dan salinitas 1% yang masih belum berkecambah sebesar 6,67% (dapat dilihat pada Tabel 2) hingga hari ke 30 sehingga memunculkan angka laju yang lebih tinggi dibanding Gigaspora margarita (M1) pada perlakuan
salinitas 0%. Hal ini menunjukkan adanya pengaruh pada pemberian NaCl yang semakin meningkat akan menunda munculnya hifa. Penelitian Juniper & Abbot (1993) menunjukkan laju pertumbuhan hifa Acaulospora trappei, Scutellospora
calospora dan Gigaspora decipiens menurun secara diferensial dengan bertambahnya
konsentrasi NaCl dalam media tumbuh. Tommerup (1984) melaporkan bahwa pertumbuhan hifa Acaulospora laevis dan Glomus caledonium memerlukan banyak air dan menurun dalam kondisi ketersediaan air yang rendah. Perkecambahan spora beberapa jenis FMA akan tertunda pada saat potensial air substrat rendah dan akan terhambat pada potensial air sangat rendah. Pengaruhnya hampir serupa pada kontrol osmotik dari potensial air dan mungkin berhubungan dengan kemampuan spora untuk menyerap dan mendapatkan kembali air dari substrat agar menjadi atau tetap dalam keadaan terhidrasi. Jadi pengaruh utama NaCl terhadap perkecambahan spora adalah karena daya osmotik bukan karena toksisitas ion sodium maupun klorida (Tommerup, 1984).
V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian dapat disimpulkan bahwa:
1. Penambahan NaCl menyebabkan penurunan perkecambahan spora dalam kultur cawan petri.
2. Spora Gigaspora margarita mempunyai daya adaptasi terhadap cekaman salinitas yang lebih baik dari pada Acaulospora tuberculata.
3. Dalam kultur pot Gigaspora margarita dan Acaulospora tuberculata mampu beradaptasi terhadap kondisi cekaman salinitas akan tetapi peningkatan salinitas menurunkan presentase kolonisasi mikoriza pada akar tanaman inang
5.2. Saran
Untuk mendapatkan pertumbuhan tanaman yang lebih baik pada kondisi cekaman salinitas, penggunaan Gigaspora margarita lebih baik dari pada
Acaulospora tuberculata. Jika dilakukan penelitian terkait perkecambahan
Acaulospora tuberculata sebaiknya digunakan waktu yang lebih lama untuk
DAFTAR PUSTAKA
Abbott LK & Robson AD. 1984. The Effect of mycorrhizae on plant growth; Powell CL & Bagyaraj DJ. (Eds). Vesicular-arbuscular mycorrhiza. CRC Press. Inc. Boca Raton. Florida. Hal. 113-130.
Abbott LK & Robson AD. 1982. The Role of VA mycorrhizae fungi in agriculture and the selection of fungi for inoculation. Aust. J. Agric. Res. 33: 389-395. Al-Kariki GN. 2000. Growth of mycorrhizal tomato and mineral acquisition under
salt stress. Mycorrhiza. 10: 51-54.
Anonimus. 2006. The Use of Michorriza In Native Plant Production.University of Washington. USA.
Bagyaraj DJ. 1984. Biological Interaksi With VA Michorrizal Fungi; Powell CL & Bagyaraj DJ. (Eds). Vesicular-arbuscular mycorrhiza. CRC Press. Inc. Boca Raton. Florida.
Dell B. 2006. Role of Mycorrhizal Fungi in Ecosystems. Vol.1(1). School of Biological Sciences and Biotechnology. Murdock University. Perth. Western Australia 6150.
Bonfante-Fosolo P. 1984. Anatomy and morphology of vesicular-arbuscular mycorrhizae; Powell CL & Bagyaraj DJ. (Eds). Vesicular-Arbuscular Mycorrhiza. CRC Press. Inc. Boca Raton. Florida. Hal. 6-33.
Bowen, G. 1987. The Biology and Physiologi Of Infection and Its Development. In Safir GR (ed) Ecophysiology Of VA Mycorhizal Plantns. CRC Press, Boca Raton.
Cantrell IC & Linderman RG. 2001. Preinoculation of lettuce and onion with VA mycorrhizal fungi reduces deleterious effects of soil salinity. Plant and Soil. 233: 269-281.
Delvian, 2003. Keanekaragaman Cendawan mikoriza Arbuskula (CMA) di Hutan Pantai dan potensi Pemanfaatannya (Studi Kasus di Hutan Cagar Alam Leuweung Sancang Kabupaten Garut, Jawa Barat). Disertasi. Program Pasca Sarjana IPB. Bogor.
Dixon RK, Rao MV dan Garg VK. 1993. Salt stress affects in vitro growth and in situ symbiosis of ectomycorrhizal fungi. Mycorrhiza. 3: 63-68.
Gazey C, Abbott LK & Robson AD. 1993. VA mycorrhizal spores from three species of Acaulospora: germination, longevity and hyphal growth. Mycol. Res. 97 (7): 785-790.
Gale J, Kohl HC dan Hagan RM. 1967. Changes in water balance and photosynthesis on onion, bean and cotton plants under saline conditions. Physiologia. 20 : 408-420.
Greenway H dan Munns R. 1980. Mechanism of Salt Tolerance In Non-Halophytes. Annu. Rev. Plant Physiol. 31: 149-190.
Gupta R & Krisnamurthy KV. 1996. Response of mycorrhizal and nonmycorrhizal
Arachis hypogaea to NaCl and acid stress. Mycorrhiza. 6: 145-149.
Hetrick BAD. 1984. Ecology of Vesicular-Arbuscular Mycorrhiza Fungi; Powell CL & Bagyaraj DJ. (Eds). Vesicular-Arbuscular Mycorrhiza. CRC Press. Inc. Boca Raton. Florida. Hal. 6-33.
Hirrel MC. 1981. The Effect of Sodium and Chloride Salts On The Germination of
Gigaspora margarita. Mycologia. 73: 610-617.
INVAM. 2009. International culture collection of (vesicular) arbuscular mycorrhizal fungi. http://invam.caf.wvu.edu/Myco-info/Taxonomy/classification.htm. [17 Agustus 2009].
Imas T, Hadioetomo RS, Gunawan AW, dan Setiadi Y. 1989. Mikrobiologi Tanah II. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan
Tinggi. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor. Bogor. Hal. 145.
Juniper S & Abbott LK. 1993. Vesicular-Arbuscular Mycorrhizas and Soil Salinity. Mycorrhiza. 4: 45-57.
Koske RE. 1981. Gigaspora gigantea; observations on spore germination of a VA mycorrhizal fungus. Mycologia.
Mier. M. Raina, Ian L Pepper, Charles P Gerba. 2000. Environmental Microbiology. Academic Press. California. USA.