5 BAB II
LANDASAN TEORI
A. TINJAUAN PUSTAKA
1. Anggrek Bulan (Phalaenopsis amabilis (L.) Blume) a. Klasifikasi Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Asparagales Famili : Orchidaceae Genus : Phalaenopsis
Spesies : Phalaenopsis amabilis (L.) Blume
(Simpson, 2008; Backer dan Bakhuizen, 1968). b. Nama Ilmiah dan Nama Daerah
Kata Phalaenopsis berasal dari bahasa Yunani, yaitu phalaenos yang dapat diartikan “ngengat” atau “kupu-kupu” dan opsis yang artinya “bentuk” atau “penampakan”. Phalaenopsis amabilis (L.) Blume memiliki basionim Epidendrum amabile L. (Pridgean et al., 2014) dan memiliki beberapa sinonim, diantaranya adalah Phalaenopsis grandiflora Lindl. dan Phalaenopsis gloriosa Rchb. (Comber, 1990). Anggrek ini memiliki berbagai sebutan di Indonesia, diantaranya anggrek menur (Sunda), anggrek wulan
(Jawa dan Bali), anggrek terbang (Maluku) dan sebutan yang paling banyak digunakan adalah anggrek bulan (Suryowinoto, 1984).
c. Morfologi 1. Akar
Akar anggrek bulan berbentuk bulat memanjang, tebal, bercabang, berwarna putih dan hijau di bagian ujungnya. Akar tanaman anggrek bulan terdiri dari dua macam, yaitu akar lekat dan akar udara (Rukmana, 2008). 2. Batang
Anggrek bulan termasuk tanaman dengan pertumbuhan batang monopodial, yaitu memiliki satu titik pertumbuhan batang secara vertikal dengan hanya satu batang utama (Iswanto, 2005). Ukuran batang sangat pendek, bahkan nyaris tidak tampak. Di sepanjang batang selalu muncul akar-akar udara (Rukmana, 2008).
3. Daun
Anggrek bulan memiliki tipe daun tunggal dengan susunan daun bertumpangan dan berderet dalam dua baris yang rapat berhadapan (Gambar 1). Jumlahnya sekitar 2-7 helai, berbentuk elips memanjang dengan bagian ujung agak melebar. Panjang daun 15-35 cm dan lebarnya 7-12 cm. Warna daun yang dimiliki anggrek bulan beragam, yaitu hijau tua, hijau muda, hijau keungu-unguan, dan hijau kemerah-merahan dengan tekstur tebal dan berdaging (Rukmana, 2008).
Gambar 1. Phalaenopsis amabilis (L.) Blume (Dokumentasi pribadi, 2016). 4. Bunga
Bunga anggrek bulan tersusun dalam tandan dan kadang-kadang bercabang dengan panjang karangan bunga mencapai 50 cm yang tumbuh menjuntai. Setiap tangkai mendukung 10-12 kuntum bunga dengan waktu mekarnya ±1 bulan. Bunganya indah berwarna putih berdiameter 7-8,5 cm, saat mekar bentuknya membulat penuh sehingga tampak seperti bulan dan karenanya anggrek ini sering disebut anggrek bulan (Iswanto, 2005).
Menurut Sandra (2001) bunga memiliki 4 bagian utama, yaitu sepal (kelopak bunga), petal (mahkota bunga), benang sari dan putik. Warna kelopak dan tajuk bunganya putih bersih mirip dengan warna mahkota bunga. Daun mahkota lebih besar 3 kali dari daun kelopaknya, berbentuk sudip. Bibir (labellum) dengan cuping samping tegak, pada bagian tepi depannya berwarna kuning, dekat bagian pangkal bergaris-garis merah, cuping tengah menyegitiga, bagian pangkal berwarna kuning dan lainnya
berwarna putih. Ujungnya seperti benang berwarna kuning (Sulistiarini dan Mahyar, 2003).
Gambar 2. Ginostemium (Ranwild, 2012).
Gambar 2 menunjukkan pada bagian tengah bunga anggrek terdapat tugu bunga atau ginostemium, yaitu suatu struktur tempat menyatunya organ reproduksi jantan (androsium) dan betina (ginosium). Di atas ginostemium terdapat kepala sari atau anther cap, tempat berkumpulnya serbuk sari atau polen. Polen yang berkumpul dalam satu kelompok disebut pollinia. Di bawah kepala sari terdapat rongga stigma, tempat menempelnya stamen ketika proses penyerbukan (Yusnita dan Handayani, 2011).
2. Reproduksi Anggrek
Menurut Iswanto (2010), reproduksi anggrek dapat dilakukan dengan dua cara, yaitu vegetatif dan generatif. Reproduksi secara vegetatif dapat dilakukan dengan cara, yaitu pemisahan rumpun atau anakan, stek batang, dan kultur in vitro.
Reproduksi secara generatif dengan cara pembentukan biji. Biji terbentuk sebagai hasil dari penyerbukan atau polinasi, baik secara alami atau penyerbukan yang dibantu oleh manusia. Anggrek dapat memproduksi biji yang berlimpah tiap buahnya. Dalam satu buah anggrek dapat memproduksi paling banyak 4.000.000 biji dan paling sedikit 20-50 biji (Arditti dan Ghani, 2000).
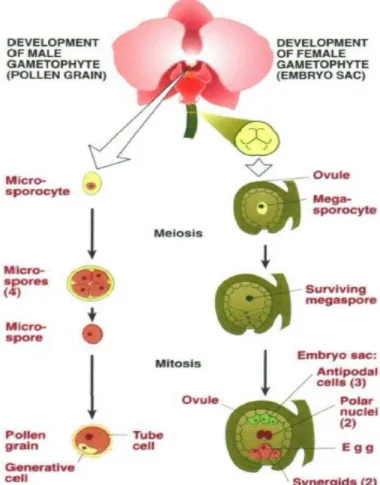
Menurut Yu dan Goh (2001), biji dan buah anggrek terbentuk melalui serangkaian peristiwa yang diawali oleh terjadinya penyerbukan. Setelah mengalami penyerbukan, hiasan bunga akan layu dan terjadi degenerasi pigmen warna dan terjadi perkembangan gamet betina yang ditunjuk pada Gambar 3. Pada anggrek, pembentukan gamet jantan akan terlebih dahulu terjadi sebelum pembentukan gamet betina, karena program pembentukan gamet betina dipengaruhi oleh keberhasilan peristiwa penyerbukan. Perkembangan gamet betina akan diikuti pembentukan buah.
Nadeau et al. (1996) menjelaskan 3-12 hari setelah penyerbukan (HSP) akan dimulai beberapa kali pembelahan sel pada tepi plasenta yang ada pada bagian dalam ovarium. Pembelahan sel tersebut akhirnya membentuk primordia ovulum. Umur 12-50 HSP sitoplasma memenuhi lapisan epidermis dan hipodermis primordia ovulum. Sel pada lapisan hipodermis akan berkembang membentuk sel archespora yang akan menjadi megasporosit.
Gambar 3. Mikrogametogenesis dan Megagametogenesis pada anggrek (Nadeau et al., 1996).
Zhang dan O’neill (1993) menyatakan selama masa perkembangan ovulum, tabung polen tumbuh memanjang di daerah dinding ovarium. Peristiwa ini akan menyebabkan bertambahnya ukuran ovarium dan ukuran buah. Integumen dalam dan luar akan terinisiasi oleh pembelahan sel periklinal daerah ujung primordia. Hal ini akan diikuti dengan perkembangan yang asimetris dan menyebabkan ovulum bertipe anatrop (Nadeau et al., 1996). Kemudian integumen dalam akan mengalami degenerasi dan mati pada tahap perkembangan
embrio sedangkan integumen luar akan berkembang menjadi mantel biji (Lee et al., 2007).
Umur 50-65 HSP, megasporosit mengalami pembelahan meiosis yang akan menghasilkan 4 megaspora dengan 3 megaspora mengalami degenerasi dan 1 megaspora yang fungsional dan berada di daerah khalaza (Nadeau et al., 1996). Menurut Mayer et al. (2011) megaspora fungsional akan mengalami pembelahan mitosis membentuk kantung embrio binukleat (inti ganda). Dua inti hasil pembelahan mitosis akan bergerak ke arah kutub yang berlawanan karena adanya dorongan oleh vakuola yang ada di tengah. Kedua inti tersebut akan melakukan pembelahan mitosis sebanyak 2 kali menghasilkan 8 inti. Masing-masing dari daerah khalaza dan mikrofil akan bergerak ke tengah membentuk 2 inti polar dan lainnya, yaitu 3 antipodal di daerah khalaza, 2 sinergid dan 1 sel telur di daerah mikrofil. Kemudian merujuk pada gambar 2 akan terjadi fertilisasi oleh polen.
Menurut Lee et al. (2007), pada 65-70 HSP setelah beberapa kali pembelahan mitosis yang akhirnya menghasilkan 8 inti, akan terjadi fertilisasi ganda, yaitu pada sebuah tabung polen terdapat 2 sperma. Fertilisasi ganda ini akan menghasilkan kompleks khalaza yang tidak mengalami perkembangan dan 1 sel zigot yang berkembang menjadi embrio. Pada tanaman Angiospermae yang lain, kompleks khalaza akan berkembang menjadi endosperma sebagai cadangan makanan. Oleh sebab itu, pada kondisi alami biji anggrek tidak dapat berkecambah tanpa bantuan mikoriza. Zigot akan mengalami pembelahan pertama yang menghasilkan 2 sel asimetris dengan sel basal di dekat mikrofil
yang berukuran lebih besar dibanding sel apikal dekat khalaza. Sel apikal dan sel basal akan mengalami pembelahan yang lebih lanjut menjadi 4 inti sel baru yang tegak lurus. Sel basal membelah secara vertikal. Dua sel pada daerah apikal akan menjadi embrio dan 2 sel basal akan menjadi suspensor. Dua sel basal akan membelah 2 kali menghasilkan 8 sel suspensor. Sel suspensor akan mengalami elongasi ke arah mikrofil dan khalaza sehingga mengelilingi kantung embrio. Sel suspensor akan hilang ketika masa pendewasaan biji.
Integumen luar akan mengalami elongasi sehingga menambah ukuran buah anggrek. Integumen dalam mulai terdegenerasi dan menyebabkan integumen luar membentuk mantel biji (testa) yang memiliki 2 lapisan. Lapisan pertama mengalami penebalan sedangkan lapisan kedua merupakan lapisan tipis (Mayer et al., 2011).
Selama masa perkembangan embrio, cadangan makanan tidak terbentuk, namun ketika sel berhenti mengalami pembelahan cadangan makanan terkumpul di sekitar inti sel dan akan hilang ketika biji berkembang menuju dewasa karena vakuola menghilang. Ketika biji dewasa, protein dan pati akan terbentuk di sekitar sitoplasma sebagai cadangan makanan utama, akan tetapi jumlahnya sangat sedikit (Lee et al., 2007).
Umur 70-120 HSP merupakan masa pendewasaan buah. Biji pada buah yang mulai dewasa akan terpisah dari plasenta. Buah kemudian akan mencapai ukuran maksimalnya dan endokarpium akan terlignifikasi. Buah akan mulai membuka untuk melepaskan biji anggrek (Mayer et al., 2011).
Biji anggrek secara alami sulit berkecambah karena ukurannya yang kecil, ringan, dan tidak memiliki cadangan makanan. Biji anggrek memperoleh cadangan makanan dengan melakukan simbiosis dengan sejenis jamur yang hidup di dalam akar yang disebut mikoriza (Suryowinoto, 1984). Kebutuhan anggrek akan simbion tersebut dapat diatasi dengan cara mengkulturkan biji anggrek pada media tanam yang sesuai dan terkontrol dalam keadaan vitrous, yang dikenal dengan kultur in vitro (Gunawan, 1988).
3. Teknik Kultur In Vitro a. Pengertian
Kultur in vitro didefinisikan sebagai suatu teknik menumbuh kembangkan bagian tanaman baik berupa bagian jaringan atau organ pada media dengan kondisi aseptik di dalam botol (vitrous) yang dicirikan oleh kondisi kultur yang terkendali. Kondisi tersebut mencakup suhu, larutan dan gas lingkungan yang tepat, dan ketersediaan nutrisi yang cukup (Akin-Idowu et al., 2009).
Prinsip dasar dari teknik ini adalah teori totipotensi yang menyatakan bahwa di dalam masing-masing sel tumbuhan mengandung informasi genetik dan atau sarana fisiologis tertentu yang mampu membentuk tanaman lengkap bila ditempatkan dalam lingkungan yang sesuai (Wetherell, 1982).
Kultur in vitro dilakukan dengan mengambil bagian tanaman muda yang jaringannya masih aktif membelah dan kemudian dikulturkan di laboratorium dengan menggunakan media tanam agar-agar bernutrisi seperti Murashige Skoog (MS), Vacin and Went (VW), dan Knudson C (KC) secara aseptik dan terkontrol. Pada umumnya perbanyakan dengan cara kultur in vitro sangat disukai karena anakan anggrek akan lebih cepat diperoleh dan sifat-sifatnya akan sama dengan indukannya (Parnata, 2005).
Kultur in vitro mencakup semua teknik kultur sel dan jaringan yang meliputi perbanyakan, pengamatan, dan manipulasi genetik tanaman tanpa melibatkan siklus seksual (Nasir, 2002). Kultur in vitro telah dimulai sejak tahun 1902, ketika Haberlandt berteori bahwa sel-sel dapat dikembangbiakan. Namun hingga akhir 1930 belum ada peneliti yang mampu menunjukkan keberhasilan dalam teknik ini (Arditti, 2008).
Aplikasi kultur in vitro pada awalnya ialah untuk propagasi tanaman. Selanjutnya penggunaan kultur in vitro lebih berkembang lagi yaitu untuk menghasilkan tanaman yang bebas penyakit, koleksi plasma nutfah, memperbaiki sifat genetika tanaman, produksi, dan ekstraksi zat-zat kimia yang bermanfaat dari sel-sel yang dikulturkan (George dan Sherrington, 1984). Pada tahun 1970 mulai dilakukan pada tanaman pangan utama, tanaman hias populer dan skala produksi besar. Sebagian besar tanaman telah banyak dikultur secara in vitro dan 50-75% diantaranya merupakan tanaman hias (Altman dan Loberant, 1998).
Perkembangan kultur in vitro anggrek tidak dapat lepas dari kultur biji anggrek. Kultur in vitro biji anggrek diawali sekitar tahun 1911-1915 oleh J. Charlesworth bersama J. Ramsbottom, dan di tempat terpisah oleh H. Burgeff. Charlesworth tertarik untuk mengembangkan perkecambahan biji anggrek secara in vitro melibatkan mikoriza setelah membaca tulisan dari N. Bernard tentang mikoriza dan perkecambahan biji anggrek. Charlesworth bersama ahli fungi, J. Ramsbottom berhasil melakukan perkecambahan simbiotik biji anggrek secara in vitro. Sedangkan Burgeff mengembangkan metode isolasi dan kultur endofit dalam perkecambahan simbiotik biji anggrek. Burgeff memiliki kesimpulan yang salah tentang mikoriza pada anggrek, menurutnya mikoriza anggrek berbeda dengan fungi (Yam dan Arditti, 2009).
Selanjutnya pada tahun 1922, Lewis Knudson berhasil membuktikan biji anggrek dapat dikecambahkan tanpa bantuan mikoriza, yaitu dengan cara mengkulturkan biji pada media agar secara in vitro setelah ia membaca data penelitian dari Bernard dan Burgeff. Knudson berasumsi bahwa produk yang dihasilkan dari dekomposisi zat pati atau senyawa nitrogen oleh mikoriza yang merangsang terjadinya perkecambahan biji (Kull dan Arditti, 2002). Selama penelitian kultur asimbiotik biji anggrek, Knudson membuat formula media untuk perkecambahan, yaitu media Knudson A (KA), media Knudson B (KB), dan media Knudson C (KC). Mula-mula Knudson menggunakan ekstrak
gambut dan rimpang Canna sebagai media kultur biji. Biji yang dikultur pada media ekstrak gambut gagal tumbuh dan pada media ekstrak rimpang Canna berhasil membentuk protokorm. Lalu Knudson mencoba menggunakan ekstrak rebusan wortel dan buah bit untuk media. Biji yang dikultur dari kedua media berhasil membentuk protokorm. Penemuan ini meyakinkannya bahwa biji anggrek dapat berkecambah secara asimbiotik (Yam dan Arditti, 2009).
Penelitian Knudson selanjutnya menggunakan media tanpa gula dan dengan tambahan gula 1%. Pada media media tanpa gula gagal berkecambah sedangkan media dengan tambahan gula, biji berhasil berkecambah setelah 7 bulan dan membentuk protokorm. Ini mungkin merupakan media Knudson A. Knudson menambahkan gula tebu sebagai komponen pada formula media Knudson B. Jika saja Knudson menggunakan gula bit pada formula medianya, kemungkinan penelitiannya akan kurang berhasil karena meskipun gula bit merupakan sukrosa, beberapa penelitian melaporkan gula bit kurang baik untuk perkecambahan biji. Kemudian Knudson menyadari bahwa formula media KB miliknya kurang cocok pada semua jenis anggrek, karena pada media KB unsur mikro yang dibutuhkan oleh kebanyakan tanaman sangat sedikit. Knudson kemudian menambahkan unsur besi (Fe) dan mangan (Mn). Knudson menyebutnya sebagai larutan Knudson C yang dapat memberikan hasil
yang lebih baik dibanding media KB. Metode Knudson berhasil membuka pengembangan bioteknologi modern kultur in vitro (Kull dan Arditti, 2002). b. Eksplan
Pada umumnya eksplan yang digunakan pada kultur in vitro dapat berasal dari semua bagian tanaman, namun sel-sel yang telah mengalami diferensiasi lebih sulit untuk ditumbuhkan dibanding sel-sel yang masih muda atau sel-sel meristematik. Besar kecilnya eksplan akan mempengaruhi banyaknya tunas yang dihasilkan dan juga mempengaruhi kemampuan daya tahan dari eksplan (Conger, 1980). Bagian tanaman yang digunakan sebagai eksplan sebaiknya merupakan bagian yang mempunyai sel aktif membelah, berasal dari tanaman induk yang sehat dan berkualitas tinggi. Meskipun pada prinsipnya semua sel dapat ditumbuhkan, tetapi sebaiknya eksplan dipilih dari bagian tanaman yang masih muda, yaitu daun muda, ujung akar, ujung batang, keping biji atau tunas (Ambarwati, 1992).
Pertumbuhan dan perkembangan dalam kultur in vitro sangat dipengaruhi oleh keadaan jaringan tanaman yang digunakan sebagai eksplan. Salah satu faktor yang sangat mempengaruhi pertumbuhan dan morfogenesis eksplan dalam kultur in vitro adalah genotip tanaman asal eksplan diisolasi. Hasil kultur menunjukkan bahwa respon masing-masing eksplan tanaman sangat bervariasi tergantung dari spesies, bahkan varietas tanaman asal eksplan tersebut. Pengaruh genotip ini umumnya berhubungan erat dengan
faktor-faktor lain yang mempengaruhi pertumbuhan eksplan, seperti kebutuhan nutrisi, zat pengatur tumbuh, dan lingkungan kultur (Yusnita, 2004).
Eksplan yang berasal dari lapangan mengandung debu, kotoran, dan berbagai kontaminan hidup pada permukaannya. Sterilisasi bahan tanaman harus dilakukan (Gunawan, 1988). Menurut Mariska dan Sukmadjaja (2003) sterilisasi eksplan merupakan bagian yang paling sulit dalam proses produksi bibit melalui kultur iin vitro. Sterilisasi biasanya dilakukan dalam beberapa tahap. Menurut Gunawan (1988) sterilisasi dimulai dengan pencucian dan pembuangan bagian-bagian yang kotor dan mati dengan air steril kemudian perendaman dalam larutan aseptik.
Sandra (2003) menyatakan bahwa setiap bagian anggrek yang masih hidup bisa digunakan sebagai eksplan. Bagian-bagian tanaman anggrek yang bisa dijadikan eksplan seperti biji, tunas pucuk, meristem pucuk dan lateral, meristem akar, jaringan muda (daun muda, tangkai bunga muda, atau bunga muda), jaringan dewasa, dan jaringan tua. Bagian yang sering digunakan sebagai eksplan adalah bagian meristem atau bagian anggrek yang masih muda karena bagian ini masih aktif melakukan pembelahan sel dibandingkan jaringan tanaman yang lebih dewasa. Pada Yamazaki dan Miyoshi (2006) menyatakan bahwa biji dari buah berumur 70 HSP memiliki persentase perkecambahan paling tinggi sebesar 39,8% dibanding biji dari buah yang mengalami perkembangan lebih lanjut dengan persentase kurang dari 1% pada Cephalanthera falcata. Mweetwa
et al. (2008) melakukan kultur biji pada Phalaenopsis amabilis dan memperoleh data bahwa biji dengan umur 120 HSP memiliki persentase perkecambahan sebesar 61% lebih tinggi dibanding biji berumur 140 HSP yang tidak berkecambah.
c. Media Tanam
Keberhasilan kultur in vitro sangat ditentukan oleh media tanam yang digunakan. Media kultur in vitro harus mengandung bahan-bahan penting, yaitu garam-garam anorganik, senyawa-senyawa organik, dan senyawa organik komplek. Garam-garam anorganik menyediakan unsur-unsur hara makro (N, P, K, Ca, Mg, dan S) dan unsur-unsur mikro (Fe, Mn, Zn, B, Cu, dan Co). Senyawa organik yang sering ditambahkan adalah vitamin, ZPT, dan senyawa organik alami seperti sari buah tomat, sari buah jeruk, air kelapa, dan sari buah pisang (Gunawan, 1988).
Media tanam yang memenuhi syarat adalah media yang mengandung unsur hara makro dan unsur hara mikro, vitamin, zat pengatur tumbuh, dan gula dalam kadar dan perbandingan tertentu. Dari sekian banyak jenis media dasar dalam kultur in vitro, media Murashige Skoog (MS) merupakan media yang sering digunakan karena komposisi media MS sesuai pada banyak jenis tanaman (Zulkarnain, 2009).
Komposisi media yang digunakan dalam kultur in vitro dapat berbeda jenis bahan kimia atau konsentrasinya. Perbedaan komposisi
media dapat mengakibatkan perbedaan arah pertumbuhan dan perkembangan eksplan yang ditumbuhkan secara in vitro (Marlina, 2004).
Perkecambahan in vitro sangat tergantung pada jenis media yang digunakan. Beberapa contoh media yang sering digunakan untuk perkecambahan in vitro adalah Vacin dan Went (VW), Murashige Skoog (MS) dan Knudson C (KC) (Teixeira da Silva, 2013). Snow (1985) menunjukkan keberhasilan perkecambahan biji in vitro menggunakan media Knudson C pada sedikitnya 16 genus anggrek. Kultur biji secara in vitro dapat menghasilkan anakan yang tidak seragam dengan induknya, sehingga teknik ini efektif untuk perbanyakan variasi genetik dan konservasi dari anggrek yang langka dan terancam punah.
B. Kerangka Pemikiran
Anggrek bulan (Phalaenopsis amabilis (L.) Blume) merupakan salah satu primadona tanaman hias yang banyak diminati. Perkecambahan biji anggrek bulan secara alami memiliki keberhasilan yang rendah. Oleh karena itu, seiring perkembangan teknologi perkecambahan biji anggrek dilakukan dengan teknik kultur in vitro yang memanfaatkan biji sebagai eksplan. Mweetwa et al. (2008) berhasil melakukan kultur in vitro menggunakan biji yang berasal dari buah anggrek bulan paling muda berumur 90 HSP.
Mengacu pada teori totipotensi dan tentang pemilihan eksplan yang cenderung berasal dari organ belum dewasa karena masih memiliki karakter meristematis
sehingga perlu adanya studi lanjut tentang penggunaan buah muda anggrek bulan (Phalaenopsis amabilis (L.) Blume.) dengan variasi umur untuk dijadikan sebagai eksplan. Metode ini diharapkan dapat memberikan terobosan baru pada teknik kultur in vitro dengan menghasilkan informasi tentang penggunaan eksplan yang baik untuk teknik ini. Kerangka pemikiran dari penelitian ini dapat dilihat pada Gambar 4 berikut ini:
Gambar 4. Diagram Alir Kerangka Pemikiran Produksi anggrek bulan
Anggrek bulan menjadi primadona tanaman hias
Teknik perbanyakan dengan kultur secara in vitro membutuhkan waktu yang singkat dan harapan hidup
tinggi Perbanyakan dengan
perkecambahan biji secara konvensional membutuhkan
waktu yang lama dan harapan hidup yang rendah
Menggunakan variasi umur buah muda sebagai eksplan
Produk kultur in vitro yang lebih optimal
C. Hipotesis
Hipotesis yang dapat diajukan pada penelitian ini adalah sebagai berikut: 1. Penggunaan eksplan buah anggrek bulan pada umur buah lebih muda akan
menentukan keberhasilan perbanyakan melalui kultur in vitro.
2. Tingkat perkembangan buah anggrek bulan pada awal perkembangan akan memiliki tingkat keberhasilan yang lebih baik dibandingkan buah pada akhir tingkat perkembangan.