Laporan Praktikum Hari/Tanggal : Rabu/ 09 Maret 2016
Biokimia Waktu: 13.00- 17.00 WIB
PJP : Ukhradiya M. Safira P, Msi Asisten : Bayu Cakra Buana
Rizki Rinda Sari
PROTEIN 1
Kelompok 4, P-1 Dwiky Ramadhan J3P115009 Ratu Nurendah J3P115015 Andri J3P115025Anggita Dwi Candra J3P115027 Febby Rhoma Safitry J3P115029
PROGRAM KEAHLIAN PARAMEDIK VETERINER DIREKTORAT PROGRAM DIPLOMA
INSTITUT PERTANIAN BOGOR 2016
PENDAHULUAN
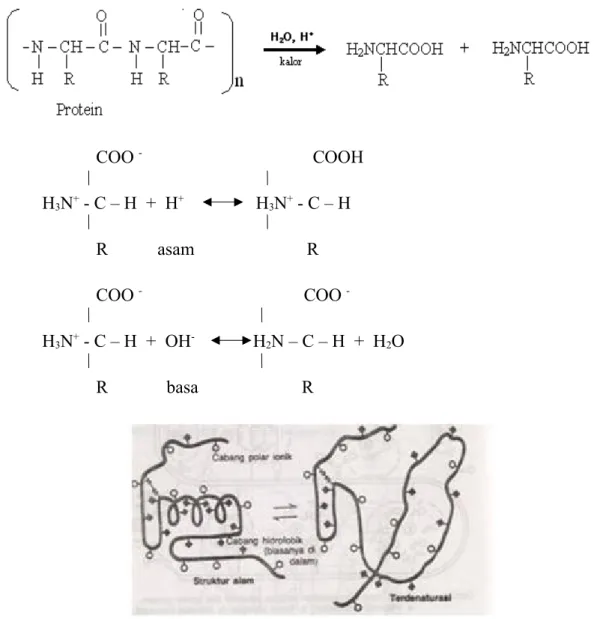
Protein adalah sekelompok senyawa organik yang nyaris keseluruhannya terdiri atas karbon, hidrogen, oksigen, dan nitrogen. Protein biasanya suatu polimer yang tersusun atas banyak subunit (monomer) yang dikenal sebagai asam amino. Asam amino yang biasanya ditemukan dalam protein menunjukkan struktur sebagai berikut (Fried dan Hademenos, 2006).
Pembagian tingkat organisasi struktur protein ada empat kelas yakni struktur primer, struktur sekunder, dan struktur tersier. Sedangkan klasifikasi protein dibagi berdasarkan sifat biologisnya, berdasarkan sifat kelarutannya dan gugus prostetiknya (Katili, 2009).
Pada struktur primer ini ikatan antar asam amino hanya ikatan peptida (ikatan kovalen). Struktur ini dapat digambarkan sebagai rumus bangun yang biasa ditulis untuk senyawa organik. Pada ikatan ini tidak terdapat ikatan atau kekuatan lain yang menghubungkan asam amino dengan satu dan lainnya. Pada struktrur sekunder dimana rantai asam amino bukan hanya dihubungkan oleh ikatan peptida tetapi juga diperkuat oleh ikatan hidrogen. Karena ikatan peptida adalah planar maka dalam satu molekul protein dapat berotasi hanya Ca-N dan Ca-C terhadap sumbu (struktur primer), sehingga memungkinkan suatu protein yang disebut a-heliks.
Struktur tersier terbentuk karena terjadinya pelipatan (folding) rantai a-heliks, konformasi b, maupun gulungan rambang suatu polipeptida, membentuk protein globular, yang struktur tiga dimensinya lebih rumit daripada protein serabut. Struktur kuartener terbentuk dari beberapa bentuk tersier dan bisa terdiri dari promoter yang sama atau yang berlainan. Agregasi dari banyak polipeptida dapat membentuk sebuah protein tunggal yang fungsional (Patong, dkk., 2012).
Albumin merupakan segala jenis protein monomer yang bisa larut dalam air dan juga dalam larutan garam. Dalam tubuh manusia, albumin diproduksi di dalam hati oleh reticulum endoplasma. Bentuknya disebut proalbumin,proalbumin biasanya akan diiris oleh badan golgi , kemudian disekresi hingga mampu memenuhi sebanyak 60% dari total serum darah. Kandu ngan molekulalbumin terdiri dari 584 asam amino yang tanpa karbohidrat dengan total molek ul 65KD.
Denaturasi protein merupakan suatu proses dimana terjadi perubahan atau modifikasi terhadap konformasi protein, lebih tepatnya terjadi pada struktur tersier maupun kuartener dari protein. Pada struktur tersier protein misalnya, terdapat empat jenis interaksi pada rantai samping seperti ikatan hidrogen, jembatan garam, ikatan disulfida, interaksi non polar pada bagian non hidrofobik. Adapun penyebab dari denaturasi protein bisa berbagai macam, antara lain panas, alkohol, asam-basa, maupun logam berat.
Ciri-ciri suatu protein yang mengalami denaturasi bisa dilihat dari berbagai hal. Salah satunya adalah dari perubahan struktur fisiknya, protein yang terdenaturasi biasanya mengalami pembukaan lipatan pada bagian-bagian tertentu. Selain itu, panas dapat mengacaukan ikatan hidrogen dari protein namun tidak akan mengganggu ikatan kovalennya. Selain oleh panas, asam dan basa juga dapat membuat protein terdenaturasi. Setelah mengikuti praktikum ini, diharapkan mahasiswa dapat menunjukkan sifat dan struktur asam
amino dan protein melalui uji-uji kualitatif. Selain itu juga mahasiswa dapat mempelajari beberapa reaksi uji terhadap asam amino dan protein.
BAHAN dan METODE
Alat dan Bahan
Alat – alat yang digunakan ialah Bunsen, tabung reaksi, pipet tetes, pipet mohr, bulf, penangas air, gegep, sudip, kertas saring, rak tabung reaksi, stopwatch,
Bahan – bahan yang digunakan ialah larutan albumin, larutan HgCl2 2%, Pb- asetat 5%, AgNO3 5%, (NH4 )2 SO4, pereaksi millon, pereaksi biuret, aquades, HCl 0,1 M, NaOH 0,1 M, buffer asetat ph 4,7, etanol 95%,
Metode Kerja
Uji pengendapan oleh logam, kedalam 1,5 ml albumin ditambahkan 3 tetes larutan HgCl2 2%, kemudian percobaan tersebut diulangi dengan menggunakan larutan Pb – asetat 5% dan AgNO3 5%.
Uji pengendapan oleh garam, sebanyak 5 ml protein dijenuhkan dengan menggunakan (NH4)2SO4 yang ditambahkan sedikit demi sedikit, kemudian larutan diaduk hingga jenuh dan disaring. Kelarutan endapan diuji dengan menggunakan air, endapan diuji dengan pereaksi millon dan filtrate diuji dengan menggunakan biuret.
Uji koagulasi, kedalam 5 ml larutan protein ditambahkan 1 tetes asam asetat 1M, kemudian tabung dididihkan selama 5 menit. Endapan didasar tabung diambil dengan menggunakan sudip / batang pengaduk. Kelarutan endapan diuji dengan menggunakan air dan endapan diuji dengan pereaksi millon.
Uji pengendapan oleh alcohol, disiapkan 3 tabung reaksi, tabung 1 berisi larutan albumin + HCl 0,1 M + etanol 95%, tabung 2 berisi larutan albumin + NaOH 0,1 M + etanol 95%, tabung 3 berisi larutan albumin + buffer asetat ph 4,7 + etanol 95%. Diamati reaksi yang terjadi.
Uji denaturasi protein, disiapkan 3 tabung reaksi, tabung 1 berisi larutan albumin + HCl 0,1 M, tabung 2 berisi larutan albumin + NaOH 0,1 M, tabung 3 berisi larutan albumin + buffer asetat ph 4,7. Kemudian ketiga tabung tersebut dididihkan selama 15 menit, setelah itu didiamkan di suhu kamar. Untuk tabung 1& 2 ditambahkan dengan buffer asetat ph 4,7 sebanyak 5 ml.
HASIL dan PEMBAHASAN
Tabel 1. Pengendapan Protein oleh Logam
Uji Hasil Gambar
Albumin + HgCl2 2% ++
Albumin + Pb-Asetat +
Albumin + AgNO3 5% +++
Keterangan : - tidak mengendap + mengendap sedikit ++ mengendap banyak
+++ mengendap sangat banyak
Prinsip uji pengendapan oleh logam yaitu pembentukan senyawa tak larut antara protein dan logam berat berupa endapan logam proteinat. Ikatan yang terbentuk amat kuat dan akan memutuskan jembatan garam, sehingga protein mengalami denaturasi. Secara bersama gugus – COOH dan gugus –NH2 yang terdapat dalam protein dapat bereaksi dengan ion logam berat. Ion- ion yang dapat membentuk endapan logam proteinat antara lain Ag, Ca, Zn, Hg, Fe, Cu, Co, Mn,dan Pb. Selain gugus – COOH dan gugus – NH2, gugus – R pada molekul asam amino tertentu dapat pula mengadakan reaksi dengan ion atau senyawa lain. Gugus sulfihidril (-SH) pada molekul sistein akan bereaksi dengan ion Ag+ atau Hg++ .
Menurut Sumardjo (2006), produk denaturasi disebut protein terkoagulasi yang tidak larut dalam air tetapi larut dalam larutan basa kuat dan asam mineral kuat karena terhidrolisis menjadi bagian-bagian yang lebih sederhana. Jumlah endapan yang dihasilkan dipengaruhi oleh kereaktifan logam berat yang ditambahkan. Logam Hg lebih reaktif daripada logam Pb karena merupakan logam transisi pada sistem periodik. Faktor lain yang juga memengaruhi banyaknya endapan adalah konsentrasi garam-garam anorganik yang tinggi dalam larutan protein.
Berdasarkan hasil percobaan pengendapan oleh logam, endapan proteinat terjadi karena albumin yang terkoagulasi setelah ditambahkan AgNO3, HgCl, dan Pb-asetat. Larutan AgNO3 menghasilkan paling banyak endapan sedangkan larutan yang paling sedikit menghasilkan endapan adalah Pb-asetat. Urutan banyaknya endapan yang terbentuk menurut
hasil percobaan adalah AgNO3, kemudian HgCl, dan yang paling sedikit adalah Pb-asetat. Meskipun konsentrasi garam HgCl lebih kecil dibandingkan Pb-asetat tetapi jumlah endapan proteinat HgCl lebih banyak dibanding Pb-asetat karena pengaruh perbedaan kereaktifan dari logam tersebut.
NH3- NH3+ NH3+ R CH COO Hg3+ R CH COO Hg COO CH R
NH2+ NH
3+ NH3+ R CH COO- Pb2+ R CH COO Pb COO CH R
Gambar 2. Struktur pengendapan protein oleh logam Tabel 2. Pengendapan Protein oleh Garam
Uji Hasil Gambar
Penambahan garam Mengendap
Millon
-Kelarutan dalam air Larut
Biuret +
Keterangan : - tidak mengasilkan pengendapan protein + menghasilkan pengendapan protein
Prinsip percobaan pengendapan oleh garam adalah pembentukan senyawa tak larut, antara larutan protein dengan garam ammonium sulfat. Biasanya dalam air murni, protein sukar larut. Dengan adanya penambahan garam, kelarutan protein akan meningkat. Hal ini disebabkan oleh ion anorganik yang terhidrasi sempurna akan mengikat permukaan protein dan mencegah penggabungan (agregasi) molekul protein, proses ini disebut salting in. Pada konsentrasi garam yang tinggi, garam akan lebih cenderung mengikat air dan menyebabkan agregasi sehingga molekul protein mengalami presipitasi, peristiwa ini disebut salting out.
Pada percobaan pengendapan protein dengan garam ini, endapan yang dihasilkan dibagi dua kemudian direaksikan masing-masing dengan air dan reagen millon. Dan untuk filtratnya di reaksikan dengan uji biuret. Ketika endapan dilarutkan dalam aquades, endapan tersebut kembali terlarut. Hal ini sesuai dengan sifat alamiah endapan protein yang larut dalam air. Sedangkan ketika endapan diuji dengan reagen millon, mula-mula tidak terjadi perubahan, tetapi setelah dipanaskan, endapan tetap berwarna putih. Hal ini menunjukkan uji negatif terhadap uji millon. Seharusnya endapan berubah menjadi warna merah yang menandakan hasil positif terhadap uji pengendapan garam. Hal ini berarti endapan tersebut masih mengandung asam amino. Asam amino yang terkandung adalah asam amino tirosin, karena terbentuknya endapan merah setelah ditambahkan reagen millon dan dipanaskan. Setelah dilakukan penyaringan. Selanjutnya filtrat yang dihasilkan ditambahkan dengan larutan CuSO4. Setelah ditambahkan dengan larutan CuSO4, filtrat menunjukkan positif terhadap uji biuret yang ditandai dengan terbentuknya lauran biru muda setelah filtrat ditambahkan reagen biuret.
Hal ini berarti ada sebagian protein yang mengendap setelah ditambahkan garam. Proses pengendapan oleh garam di ini disebut juga peristiwa “salting out” merupakan pengendapan protein karena terjadi persaingan antara garam dan protein yang mengikat air. Dengan demikian, tidak cukup banyak air yag terikat pada protein sehingga gaya tarik-menarik antara molekul protein lebih menonjol dibandingkan tarik-tarik-menarik antara air dan protein. Dalam kondisi seperti ini, protein akan mengendap.
O O
[ - NHCHC – NHCHC - NH2Cl + COOH + NH2CHCOOH R R R R
Gambar 2. Struktur pengendapan protein oleh garam Tabel 3. Uji Koagulasi
Uji Hasil Gambar
Setelah dididihkan Mengendap
Hkalor2O,H+
Kelarutan dalam air Larut
Biuret +
Keterangan : - tidak mengasilkan pengendapan protein + menghasilkan pengendapan protein
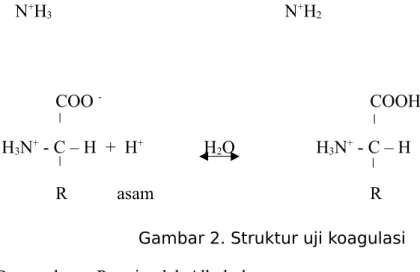
Selanjutnya pada uji koagulasi, larutan Protein ditambahkan larutan asam asetat yang kemudian dipanaskan sehingga dapat menghasilkan endapan protein. Penambahan asam ke dalam larutan protein menyebabkan ion-ion H+ dari asam akan terikat pada gugus-gugus yang bermuatan negatif sehingga terjadi perubahan pengutuban dari molekul protein. Perubahan pengutuban ini menyebabkan perubahan konformasi dari protein atau rusaknya struktur tersier atau struktur kwartener protein sehingga protein mengalami koagulasi.
Pada percobaan ini dilakukan penambahan asam asetat ke dalam larutan protein. Ketika larutan protein ditambahkan dengan larutan asam asetat, tidak terjadi perubahan. Namun setelah dipanaskan terbentuk gumpalan-gumpalan putih yang menunjukkan protein telah terkoagulasi.
Terjadinya koagulasi disebabkan karena ion H+ dari CH3COOH terikat pada gugus negatif pada protein. Ketika ion H+ dari asam asetat masuk ke dalam larutan, akan mempengaruhi keseimbangan dan pengkutuban muatan dari molekul protein. Perubahan pengkutuban ini menyebabkan rusaknya konformasi alamiah protein seperti struktur tersier dan struktur kwartener protein. Rusaknya konformasi alamiah protein menyebabkan terganggunya stabilitas dari larutan protein, sehingga larutan protein mengalami koagulasi. Percobaan uji koagulasi ini juga menghasilkan endapan protein setelah dipanaskan. Endapan ini juga di bagi menjadi dua yang kemudian di tambahkan air (aquadest) dan reagen Biuret.
Dengan Air (H2O)
H H
R – C – COO- H
N+H 3 N+H2 COO - COOH H3N+ - C – H + H+ H2O H3N+ - C – H R asam R
Gambar 2. Struktur uji koagulasi Tabel 4. Pengendapan Protein oleh Alkohol
Larutan Hasil Gambar
Albumin+alkohol+Buffer asetat pH 4,7 +++ Albumin+alkohol+NaOH 0,1 M -Albumin+alkohol+HCl 0,1 M ++
Keterangan : + Terdapat sedikit endapan protein ++ Terdapat endapan protein
+++ Terdapat banyak endapan protein
- Menyatakan bahan tidak mengandung endapan protein
Pada percobaan uji pengendapan oleh alkohol yang bertujuan untuk mengetahui pengaruh alkohol terhadap larutan protein. Dan berfungsi juga untuk menurunkan konstanta dielektrik pada larutan sehingga gaya tarik-menarik antar molekul jadi semakin kuat. Kemudian alkohol akan mengkondisikan gugus positif pada asam amino untuk bereaksi
dengan gugus negatif yang ada dalam larutan, sehingga pada suasana tertentu mampu membentuk endapan. Albumin yang ditambah larutan penyangga Buffer Asetat pH 4,7 paling banyak menghasilkan endapan, hal ini terjadi karena pH tersebut merupakan titik isoelektrik protein sehingga endapan yang terbentuk merupakan jumlah yang paling maksimal. Albumin yang ditambahkan HCl juga menghasilkan endapan, namun dengan kuantitas yang lebih sedikit, ini terjadi karena gugus positif pada protein berikatan dengan gugus Cl- dan gugus negatif yang ada pada larutan sehingga terbentuk endapan pada suasana asam. Sebaliknya, protein tidak terendapkan oleh alkohol pada suasana basa (NaOH) karena pH nya terlampau jauh dari titik isoelektrik protein. Protein juga disebut ampoter karena pada ujung rantai protein terdapat gugus asam amino dan karboksilat, sehingga mudah larut tetapi susah larut dalam lemak.
1. Reaksi dengan HCl 0,1 M dan dilanjutkan dengan alkohol
2. Reaksi dengan NaOH 0,1 M dan dilanjutkan dengan alkohol
3. Reaksi dengan Buffer Asetat pH 4,7 dan dilanjutkan alkohol
Gambar 2. Struktur pengendapan protein oleh alkohol Tabel 5. Uji Denaturasi Protein
Larutan Hasil Gambar
Albumin + etanol + HCl
0,1 M
-Albumin + etanol +NaOH 0,1 M
Albumin + etanol + buffer
asetat pH 4,7
-Keterangan : - Tidak mengendap + Ada endapan ++ Banyak endapan
Denaturasi adalah suatu keadaan dimana telah terjadi perubahan struktur protein yang mencakup perubahan bentuk dan lipatan molekul, tanpa memutus atau merusak ikatan antar asam amino dalam struktur primer protein. Denaturasi terjadi karena terpecahnya ikatan hidrogen, interaksi hidrofobik, ikatan garam dan terbentuknya lipatan molekul protein. Denaturasi tidak cukup kuat untuk memutus ikatan peptida,dimana struktur primer protein tetap sama setelah proses denaturasi. Protein akan terdenaturasi atau mengendap bila berada pada titik isolistriknya, yaitu pH dimana jumlah muatan positif sama dengna jumlah muatan negatifnya.
Dalam percobaan uji denaturasi protein yang dilakukan pada 3 larutan yaitu larutan albumin yang ditambahkan dengan HCl, NaOH, dan buffer asetat pH 4,7, menunjukkan hasil yaitu pada larutan albumin dengan tambahan NaOH menghasilkan hasil positif sedangkan 2 larutan lainnya menunjukkan hasil negatif. Pengendapan pada larutan albumin + NaOH (tabung 2) ini terjadi setelah dilakukan pemanasan selama 15 menit. Selama pemanasan larutan membentuk endapan, hal ini dikarenakan panas dapat mengacaukan ikatan hydrogen dan interaksi hidrofobik non-polar. Hal ini dapat terjadi karena suhu tinggi dapat meningkatkan energi kinetic dan menyebabkan molekul penyusun bergerak sangat cepat sehingga mengacaukan ikatan molekut tersebut. Pemanasan juga akan menyebabkan kemampuan protein mengikat air menjadi berkurang, disebabkan karena ikatan non-kovalennya terputus akan tetapi tidak memutus ikatan peptida.
Setelah pemanasan larutan ditambahkan dengan buffer asetat ph 4,7 dan hasil terakhir menunjukkan larutan berwarna coklat dan terdapat endapan. Didalam literature endapan yang dihasilnya harusnya berwarna putih susu akan tetapi didalam percobaan berwarna coklat, hal ini dikarena NaOH yang digunakan merupakan NaOH lama sehingga gosong pada saat pemanasan.
Pada larutan albumin + HCl (tabung 1) dan larutan albumin + buffer asetat ph 4,7 (tabung 3) uji denaturasi menunjukkan hasil yang negative atau tidak ada endapan. Selama proses pemanasan kedua larutan tersebut tidak menunjukkan reaksi apapun, kedua tabung tersebut tetap berwarna bening dan tidak terdapat endapan. Pada saat tabung 1 ditambahkan larutan buffer asetat ph 4,7 tetap tidak menunjukkan perubahan, warna larutan tetap bening dan tidak ada endapan seperti penampakan awal. Hal ini dapat terjadi dikarenakan kemungkinan larutan yang dibuat terlalu encer. Akan tetapi hasil yang didapat berbeda dari literature, harusnya larutan albumin + HCl (tabung 1) menghasilkan endapan setelah ditetesi buffer asetat ph 4,7 dikarenakan pada ph tersebut merupakan titik isolistriknya.
Reaksi protein dengan HCl yang di lanjutkan dengan pemanasan selama 15 menit membuat protein terdenaturasi
COO - COOH H3N+ - C – H + H+ H3N+ - C – H R asam R COO - COO -H3N+ - C – H + OH- H2N – C – H + H2O R basa R
SIMPULAN
Pada uji protein 2 dapat dihasilkan dari beberapa pengujian, seperti pengendapan protein oleh logam, pengendapan protein oleh garam, uji koagulasi, pengendapan protein oleh alkohol, dan uji denaturasi protein. Pada pengendapan oleh logam, endapan proteinat terjadi karena albumin yang terkoagulasi setelah ditambahkan AgNO3, HgCl, dan Pb-asetat. Pada pengendapan dengan garam, endapan terbentuk disebabkan ion garam lebih mudah untuk mengikat air (hidrasi) dibandingkan dengan molekul protein. Sehingga molekul protein kalah bersaing dalam hal mengikat air, akibatnya kelarutan protein dalam air berkurang dan protein membentuk endapan. Koagulasi dapat terjadi bila larutan protein berada pada titik isoelektriknya. Ion-ion logam berat yang masuk ke dalam tubuh akan bereaksi dengan sebagian protein, sehingga menyebabkan terjadinya koagulasi (penggumpalan).
Pada pengendapan oleh alkohol akan menurunkan konstanta dielektrik pada larutan sehingga gaya tarik-menarik antar molekul jadi semakin kuat, sehingga pada suasana tertentu mampu membentuk endapan. Denaturasi terjadi karena terpecahnya ikatan hidrogen, interaksi hidrofobik, ikatan garam dan terbentuknya lipatan molekul protein.
DAFTAR PUSTAKA
Fried, G. H. dan Hademenos, G. J., 2006, Schaum’s Outlines Biologi Edisi Kedua. Jakarta(ID): Penerbit Eralangga.
Fukuda, H., Kondo, A., dan Noda, H. (2001) : Biodiesel Fuel Production by Transesterification Oil, Journal Bioscience and Bioengineering, 92, 416.
Katili, A. S., 2009, Struktur dan Fungsi Protein Kolagen (online), (http://ejurnal.ung.ac.id/index.php/JPI/article/view/587), Jurnal Penelitian, Vol : 2 (5), Hal:19-29,Universitas Negeri Gorontalo, Gorontalo.
Lehninger. 1982. Dasar-Dasar Biokimia Jilid 1. Jakarta (ID): Erlangga.
Ophart CE. 2003. Virtual Chembook. [Internet]. [diunduh : 2009 November 10]. Tersedia pada: http://www.elmhurst.edu/~chm/vchembook/
Poedjiyadi, Anna. 2006. Dasar – Dasar Biokimia. Jakarta (ID) : UI- Press
Patong, A.R., dkk., 2012, Biokimia Dasar. Makassar (ID): Lembah Harapan Press.
Samadi, 2012, Konsep Ideal Protein (Asam Amino) Fokus pada Ternak Ayam Pedaging
(online), (http://jurnal.unsyiah.ac.id/agripet/article/view/202), Jurnal Penelitian, Vol: 12
(2), Hal : 42-48,Universitas Syiah Kuala, Banda Aceh.
Sumardjo D. 2009. Pengantar Kimia Buku Panduan kuliah Mahasiswa jurusan kimia . Jakarta (ID): Bumi Aksara.