BAB II
TINJAUAN PUSTAKA
2.1. Sindroma metabolik
2.1.1 Defenisi sindroma metabolik
Sindroma metabolik merupakan gangguan metabolik yang berhubungan dengan peningkatan resiko menderita diabetes melitus tipe 2 dan penyakit kardiovaskular (Novotny et al, 2014). Gejala klinis umumnya berupa sindroma resistensi insulin, toleransi glukosa terganggu atau diabetes melitus, dislipidemia, obesitas sentral, dan hipertensi.
Defenisi sindroma metabolik menurut WHO tahun 1999 adalah diabetes atau gangguan gula darah puasa atau gangguan toleransi glukosa atau resistensi insulin, ditambah 2 dari keadaan obesitas, dislipidemia, hipertensi, dan miroalbuminuria. Defenisi ini dimodifikasi oleh European Group for the Study of Insulin Resistance (EGIR) dengan tidak mengikutsertakan diabetes sebagai kriteria sindroma metabolik. Sedangkan menurut National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults Treatment Panel II (NCEP ATP III) tahun 2001, sindroma metabolik adalah sekelompok kelainan metabolik baik lipid maupun non lipid yang memenuhi 3 dari 5 kriteria berikut yaitu obesitas sentral, dislipidemia aterogenik (peningkatan kadar trigliserida dan penurunan kadar High Density
Lipoprotein), hipertensi dan kelainan kadar gula darah plasma. Defenisi terbaru menurut The International Diabetes Foundation (IDF) tahun 2005, sindroma metabolik adalah kumpulan faktor resiko yang terdiri atas diabetes dan prediabetes, obesitas abdominal, dislipidemia dan hipertensi (Cameron et al, 2004; Grundy et al, 2005).
2.1.2 Kriteria diagnosa sindroma metabolik
Berdasarkan kriteria WHO, harus terdapat gangguan metabolisme glukosa atau insulin, gangguan tolereansi glukosa, atau toleransi glukosa normal dengan resistensi insulin. Diagnosa sindroma metabolik merupakan diabetes tipe 2, toleransi glukosa terganggu, atau resistensi insulin , ditambah 2 dari 5 komponen berikut : (1) BMI > 30 kg/m2 atau rasio pinggang-pinggul > 0,9 (pria) atau > 0,85 (wanita); (2) dislipidemia dengan peningkatan trigliserida (≥ 1,7 mmol/L atau ≥ 150 mg/dL) dan atau (3) penurunan HDL (pada pria < 0,9 mmol/L atau < 35 mg/dL, pada wanita < 1,0 mmol/L atau < 39 mg/dL ); (4) hipertensi, yang diterapi atau ≥ 160 mmHg yang tida k diterapi; (5) mikroalbuminuria (kecepatan ekresi urin rata-rata ≥ 20 µg/min atau rasio albumin/kreatinin ≥ 20 mg/g).
Kriteria sindroma metabolik menurut NCEP memiliki paling sedikit 3 dari kriteria berikut ini : (1) kadar gula darah puasa 110-125 mg/dL; (2) lingkar pinggang pada pria > 40 inchi (101 cm) atau pada wanita > 35 inchi (88 cm); (3) trigliserida ≥ 150mg/dL; (4) HDL < 40 mg/dL pada pria atau < 50mg/dL pada wanita; (5) tekanan darah > 130/85 mmHg. Kriteria menurut NCEP tidak
menyertakan resistensi insulin, dan mendasarkan pada pengukuran kadar gula darah puasa.
Tabel 2.1. Kriteria diagnosa dan defenisi sindroma metabolik
NCEP ATP III WHO AACE
Kadar gula darah puasa 110-125 mg/dL
Diabetes tipe 2, toleransi glukosa terganggu, atau resistensi insulin
Kadar gula darah puasa 110-125 mg/dL atau 2 jam setelah 75 gr glucose challange > 140 mg/dL Lingkar pinggang >
40 inchi (pria), atau 35 inchi (wanita)
BMI > 30 kg/m2 atau rasio pinggang-pinggul > 0,9 (pria) atau > 0,85 (wanita)
BMI > 25 kg/m2 atau lingkar pinggang > 40 inchi (pria) atau > 30 inchi (wanita) Trigliserida ≥ 150 mg/dL Dislipidemia : trigliserida ≥ 150 mg/dL Trigliserida ≥ 150 mg/dL HDL < 40 mg/dL (pria), atau < 50 mg/dL (wanita) HDL < 35 mg/dL (pria), atau < 39 mg/dL (wanita) HDL < 40 mg/dL (pria), atau < 50 mg/dL (wanita) Tekanan darah ≥ 130/85 mmHg Hipertensi : dalam pengobatan atau tidak diterapi tekanan darah ≥ 160/90 mmHg
Mikroalbuminuria ≥ 20 µg/menit
Tekanan darah ≥ 130/85 mmHg
(Sumber : American Heart Journal. 2005;149:35)
Faktor resiko sindroma metabolik menurut American College of Endocrinology/ American Association of Clinical Endocrinology (ACE/AACE) berupa gejala klinis sebagai berikut : (1) toleransi glukosa terganggu dengan kadar gula darah puasa 110-125 mg/dL atau 2 jam setelah 75 gr glucose challange > 140 mg/dL; (2) overweight atau obesitas berupa obesitas abdominal dengan BMI > 25 kg/m2 atau lingkar pinggang > 40 inchi (pria) atau > 30 inchi (wanita); (3)
trigliserida yang tinggi ≥ 50 mg/dL, HDL yang rendah < 40 mg/dL (pria), atau < 50 (wanita), tekanan darah yang tinggi atau moderate ≥ 130/85 mmHg.
2.2 Dislipidemia
2.2.1 Defenisi dislipidemia
Dislipidemia pada sindroma metabolik dicirikan dengan peningkatan trigliserida, peningkatan VLDL dan penurunan HDL. Trias ini merupakan fenotif lipoprotein atherogenik. Pada Copenhagen Male Study, penelitian prospektif kardiovaskular pada 5249 pria dengan kombinasi trigliserida yang tinggi dan HDL yang rendah, dan dibandingkan dengan konsentrasi LDL sebagai faktor resiko penyakit jantung iskemik. Diperoleh hasil 11,4% dengan trigliserida tinggi dan LDL rendah; 8,2% dengan LDL tinggi; 17,5% dengan trigliserida tinggi, HDL rendah, dan LDL tinggi. Hal ini menunjukkan bahwa dislipidemia pada sindroma metabolik adalah merupakan faktor resiko penyakit jantung koroner (Miranda et al, 2005).
2.2.2 Patofisiologi dislipidemia
Adiposit melepaskan asam lemak bebas ke sirkulasi darah yang akan membawa ke hati dan otot. Di hati, asam lebak bebas dalam jumlah terbatas dioksidasi, dan sebagian besar direesterifikasi membentuk trigliserida. Oleh karenanya, asam lemak bebas dan trigliserida dibawa ke hati secara menetap. Jika proses ini terjadi berlebihan, maka hati akan menimbun trigliserida, suatu kondisi yang dikenal sebagai steatosis, atau lebih dikenal sebagai perlemakan hati (fatty
liver). Trigliserida juga dapat bertimbun di sel otot karena oksidasi yang tidak sempurna atau karena asam lemak yang berlebihan dibawa ke otot.
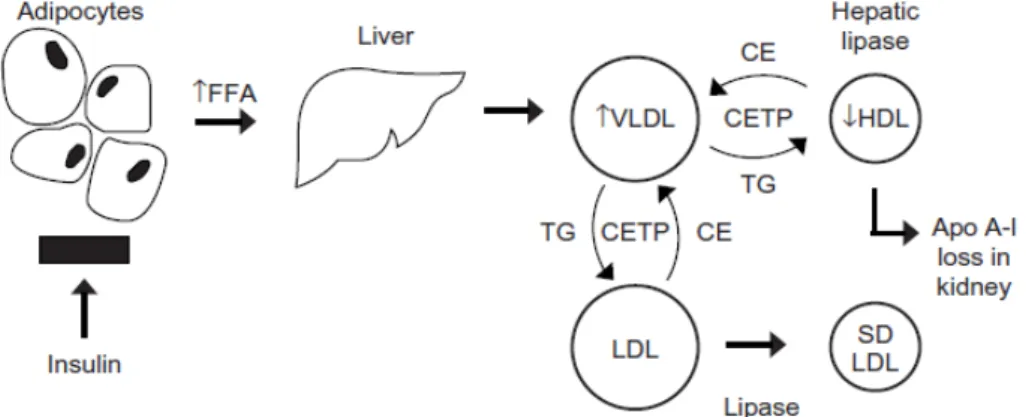
Gambar 2.1. Resistensi insulin dan dislipidemia (Sumber : American Heart Journal. 2005;149:41)
Dengan adanya resistensi insulin, lipolisis di adiposit bertambah, konsentrasi asam lemak bebas di plasma bertambah, dan banyak asam lemak bebas yang dibawa ke hati dan otot. Pada saat yang bersamaan, terjadi lipogenesis di hati oleh insulin. Peningkatan konsentrasi glukosa juga dapat meningkatkan sintesis trigliserida di hati dengan adanya rangka karbon untuk membentuk gliserol. Perubahan ini meningkatkan produksi VLDL oleh hati. Trigliserida dan apolipoprotein B (ApoB) yang berlebihan akan memasuki sirkulasi darah ketika produksi VLDL ditingkatkan.
VLDL-trigliserida ditukar dengan ester kolesterol di HDL oleh Cholesteryl Ester Transfer Protein (CETP). Setelah VLDL trigliserida dihidrolisis oleh LPL, kebanyakan dari ester kolesterol yang dibawa ke VLDL ini dikembalikan ke hati dalam bentuk partikel remnant. Adanya remnant dari ester kolesterol inilah yang
akan berakhir di dinding arteri, yang dikenal dengan efek proatherogenik. VLDL remnant yang dilipolisis oleh LPL ini akan menjadi LDL dengan densitas yang lebih kecil.
Akibat yang lain dari aktifitas CETP pada sindroma metabolik berhubungan dengan HDL dan LDL kaya trigliserida. Ketika kaya akan trigliserida, kedua lipoprotein ini akan dilipolisis oleh lipase hati. Setelah lipolisis, HDL dan LDL akan mengecil. HDL yang dilipolisis akan dihilangkan dengan cepat di sirkulasi darah, akibatnya terjadi pengurangan kadar kolesterol HDL dan apolipoprotein A1 (ApoA1). HDL dan ApoA1 merupakan anti atherogenik dengan cara mengangkut kembali kolesterol dan kemungkinan juga melalui mekanisme antioksidan. Adanya gangguan metabolik yang dimulai dengan peningkatan VLDL-trigliserida akan mengakibatkan bekurangnya HDL.
LDL-trigliserida akan dilipolisis menjadi lebih kecil. Walaupun semua LDL merupakan atherogenik, LDL dengan densitas lebih kecil lebih atherogenik. Untuk setiap LDL yang diberikan, LDL densitas yang kecil akan menyertakan sejumlah besar partikel dan juga ApoB. Bertambahnya asam lemak bebas yang dilepaskan dari adiposit, dan meningkatnya sintesis trigliserida di hati merupakan tahapan penting dalam pembentukan lipid yang abnormal dalam sindroma metabolik.
Beberapa penelitian terbaru saat ini menitikberatkan pada HDL dan pengangkutan kembali kolesterol dari jaringan. “Nascent HDL” atau pre-β-HDL merupakan ApoA1 yang sedikit lipid/susunan fosfolipid, yang disekresikan oleh
hati, tetapi dapat juga terbentuk di jaringan perifer dari HDL sferis. Jaringan perifer membawa kolesterol ke “nascent” HDL melalui ATP-binding cassette-A1 (ABC-A1) transport membran. Kolesterol diesterifikasi oleh lecithin-cholesterol acyltransferase, yang membantu pembentukan HDL sferis matur. Ester kolesterol pentransfer protein kemudian berfungsi untuk mentransfer ester kolesterol dari HDL ke VLDL dan LDL, yang kemudian menfasilitasi pengangkutan kembali ke hati (Miranda et al, 2005).
2.2.3 Metabolisme asam lemak bebas (Free fatty acid)
Dalam perannya menstimulasi pengambilan glukosa dari sel perifer, insulin menghalangi asam lemak bebas dilepaskan dari adiposit. Manifestasi awal dari resistensi insulin adalah ketidakmampuan menekan lipolisis di jaringan lemak. Asam lemak bebas yang berlebihan akan diangkut ke hati dan otot, menghambat pengambilan glukosa yang distimulasi insulin, yang akan memperparah hiperglikemia.
Walaupun asam lemak bebas penting peranannya dalam patofisiologi sindroma metabolik, pengukuran asam lemak bebas masih sukar diinterpretasikan, walaupun dalam penelitian klinis, karena efek dari diet dan aktivitas. Pada penelitian resistensi insulin kelompok Eropa, dengan memeriksa asam lemak bebas dalam 541 subyek yang normoglikemia, ditemukan adanya hubungan yang bermakna antara konsentrasi asam lemak bebas dengan kadar gula darah puasa, insulin puasa dan trigliserida puasa (Miranda et al, 2005).
2.3 Lipoprotein
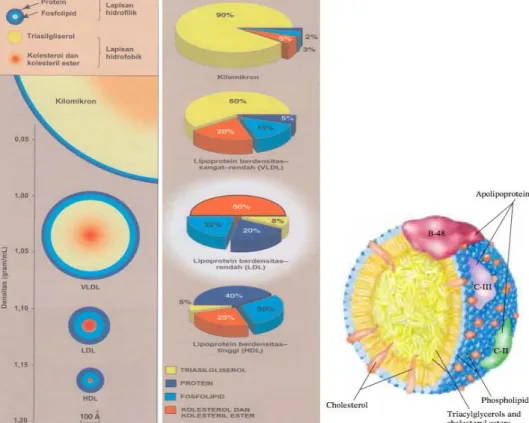
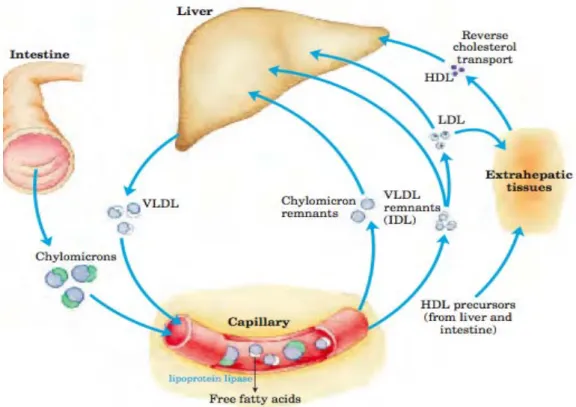
Lipoprotein merupakan kompleks makromolekul berbentuk sferis yang mengandung lipid dan protein spesifik (apolipoprotein atau apoprotein). Partikel lipoprotein meliputi kilomikron, lipoprotein berdensitas sangat rendah (VLDL), lipoprotein berdensitas rendah (LDL), dan lipoprotein berdensitas tinggi (HDL). Masing-masing partikel ini memiliki perbedaan komposisi lipid, protein, ukuran, densitasnya dan tempat asalnya.
Gambar 2.2. Ukuran, densitas, dan komposisi lipoprotein (Sumber : Lippincott’s Illustrated Reviews Biokimia. 2014; edisi 6)
Partikel lipoprotein secara konstan saling menukar lipid dengan apolipoprotein, akibatnya apolipoprotein dan kandungan lipid yang aktual pada setiap kelas partikel ini beravariasi. Fungsi lipoprotein adalah untuk menjaga agar komponen lipidnya tetap larut saat diangkut di dalam plasma, dan juga untuk menyediakan mekanisme yang efisien untuk mengangkut kandungan lipidnya ke (dan dari) jaringan. Pada manusia, sistem pengangkutannya kurang sempurna dibandingkan pada hewan, dan akibatnya, manusia mengalami penimbunan lipid secara bertahap (terutama kolesterol) di berbagai jaringan. Keadaan ini dapat membahayakan jika penimbunan lipid turut serta dalam proses pembentukan plak, sehingga mempersempit pembuluh darah (aterosklerosis).
Tabel 2.2. Komposisi lipid lipoprotein
CM VLDL LDL HDL Densitas (g/ml) < 0.94 0.94-1.006 1.006-1.063 1.063-1.210 Diameter (A) 6000-2000 600 250 70-120 Lipid total (wt%) 99 91 80 44 Trgliserida 85 55 10 6 Ester kolesterol 3 18 50 40 Kolesterol 2 7 11 7 Fosfolipid 8 20 29 46 (Sumber :
Lipoprotein terdiri atas inti lemak (mengandung trigliserida, kolesteril ester) yang dikelilingi oleh rangka apolipoprotein amfipatik, fosfolipid, dan kolesterol nonesterifikasi. Senyawa amfipatik ini diarahkan sehingga bagian yang polar akan terpajan dengan permukaan lipoprotein, sehingga membuat partikel ini
larut dalam air. Trigliserida dan kolesterol yang dibawa oleh lipoprotein diperoleh dari makanan (sumber eksogen) atau sintesis de novo (sumber endogen).
2.4 Apolipoprotein
2.4.1 Golongan apolipoprotein
Apolipoprotein yang terkait dengan partikel lipoprotein memiliki berbagai fungsi, seperti sebagai pengenal reseptor pada permukaan sel, dan berperan sebagai aktivator atau koenzim untuk enzim yang terlibat dalam metabolisme lipoprotein. Apolipoprotein dibagi berdasarkan struktur dan fungsinya menjadi lima golongan utama, A sampai E, dengan sebagian besar golongan yang memiliki sub-golongan.
Kilomikron merupakan partikel lipoprotein dengan densitas yang paling rendah dan berukuran paling besar, dan mengandung persentase lemak lipid paling tinggi dan persentase protein yang paling kecil. VLDL dan LDL memiliki rasio protein dan lipid yang lebih tinggi. Partikel HDL adalah partikel yang paling kecil dan padat.
Tabel 2.3. Apolipoprotein, berat molekul, lipoprotein dan fungsinya
Apoprotein Berat
Molekul
Lipoprotein Fungsi
ApoA1 28,100 HDL Aktivasi Lechitin cholesterol
acyltransferase (LCAT), struktural protein utama
ApoA2 17,400 HDL Meningkatkan aktivitas hepatic lipase ApoA4 46,000 CM
ApoA5 39,000 HDL Meningkatkan pengambilan trigliserida ApoB48 241,000 CM Terdiri dari ApoB100, mengurangi
reseptor LDL
ApoB100 512,000 LDL, VLDL Mengikat LDL reseptor ApoC1 7,600 VLDL, CM Mengaktifkan LCAT
ApoC2 8,900 VLDL, CM Mengaktifkan lipoprotein lipase ApoC3 8,700 VLDL, CM Menghambat lipoprotein lipase
ApoD 33,000 HDL Berhubungan dengan LCAT, terikat dengan progesteron
ApoE 34,000 HDL Sedikitnya 3 bentuk, terikat dengan reseptor LDL
Apo(a) 300,000-800,000
LDL, Lp(a) Dihubungkan oleh ikatan disulfida, dan sama dengan plasminogen
ApoH, J, L Belum diketahui
Apo M HDL Mengangkut spingosin-1 fosfat (Sumber :
Dalam pembentukan apolipoprotein dan lipid menjadi kilomikron (CM), diperlukan protein transfer trigliserida yang mengandung ApoB48 dengan lipid. Proses ini terjadi sebelum transisi dari retikulum endoplasma ke badan golgi, tempat partikel ini dikemas di dalam vesikel sekretorik. Partikel ini akan bersatu
http://lipidlibrary.aocs.org/Lipids/lipoprot/index.htm)
dengan membran plasma, melepaskan lipoprotein, dan kemudian akan masuk ke dalam sistem limfatik, dan akhirnya ke dalam darah.
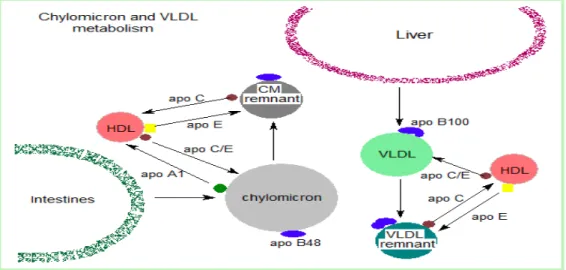
Partikel yang dilepaskan oleh sel mukosa usus disebut kilomikron yang nascent, karena fungsinya masih belum sempurna. Ketika mencapai plasma, partikel ini akan cepat mengalami modifikasi, menerima apolipoprotein E (yang dikenali oleh reseptor hepatik) dan apolipoprotein C (ApoC). Sumber apolipoprotein ini adalah HDL yang bersirkulasi. ApoC meliputi Apolipoprotein C2 (ApoC2) yang diperlukan untuk aktivasi LPL, yaitu enzim yang mendegradasi trigliserida yang terkandung dalam kilomikron dan VLDL serta terutama penting pada metabolisme HDL. LPL yang diaktivasi oleh ApoC2 pada partikel lipoprotein yang bersirkulasi, akan menghidrolisis trigliserida yang terkandung di dalam partikel ini untuk menghasilkan asam lemak dan gliserol. ApoA5 juga mengaktivitasi LPL untuk meregulasi trigliserida. ApoA5 dihubungkan dengan kilomikron, VLDL, HDL, tetapi tidak dengan LDL. Distribusi ApoA5 di lipoprotein sama dengan ApoC3, yang diperkirakan menghambat kerja dari LPL. Walaupun kerja ApoA5 dan ApoC3 berlawanan, mereka bekerja secara terpisah dalam mengatur kadar trigliserida (Garelnabi et al, 2013).
Asam lemak kemudian disimpan (oleh adiposa) atau digunakan untuk energi (oleh otot). Jika asam lemak tidak segera diambil oleh sel, asam lemak rantai panjang akan diangkut oleh albumin serum sampai proses pengambilannya benar-benar terjadi. Gliserol digunakan oleh hati, misalnya untuk sintesis lipid, glikolisis, atau glukoneogenesis.
Pada saat kilomikron bersirkulasi dan lebih dari sembilan puluh persen trigliserida di dalam intinya didegradasi oleh LPL, ukuran partikel akan berkurang dan densitasnya meningkat. Selain itu, ApoC (bukan apo E) akan dikembalikan ke HDL. Partikel yang tersisa, yang disebut “sisa (remnant)” yang dengan cepat akan dibuang dari sirkulasi oleh hati dengan membran sel yang mengandung reseptor lipoprotein yang mengenali apo E.
Gambar 2.3. Metabolisme kilomikron dan VLDL (Sumber : Lehninger’s Principles of Biochemistry. 2004; edisi 4)
Sisa kilomikron akan berikatan pada reseptor ini dan diambil oleh hepatosit melalui endositosis. Vesikel yang diendositosis kemudian bersatu dengan lisosom, dan apolipoprotein kolesteril ester, dan senyawa sisa lainnya akan didegradasi melalui hidrolisis, sehingga melepaskan asam amino, kolesterol bebas dan asam lemak. Reseptor ini kemudian didaur ulang.
jaringan perifer. Di jaringan perifer, trigliserida didegradasi oleh LPL. VLDL disekresi langsung ke dalam darah oleh hati sebagai partikel VLDL yang baru dibentuk (nascent) yang mengandung ApoB100. VLDL harus mengandung ApoC2 dan ApoE dari HDL yang bersirkulasi. Seperti kilomikron, ApoC2 diperlukan untuk aktivasi LPL. Selama VLDL berada di dalam sirkulasi, trigliserida akan didegradasi oleh LPL sehingga menyebabkan ukuran VLDL menjadi berkurang dan menjadi lebih padat. Komponen di permukaan, termasuk apolipoprotein C dan E, kembali ke HDL, tetapi partikel menahan ApoB100. Akhirnya, beberapa triasilgiserol akan dipindahkan dari VLDL ke HDL bersamaan dengan transfer kolesteril ester dari HDL ke VLDL. Pertukaran ini dilakukan melalui Cholesteryl Ester Transport Protein (CETP). Dengan modifikasi ini, VLDL diubah menjadi LDL di dalam plasma. Partikel yang berukuran sedang, yakni lipoprotein berdensitas sedang (IDL, intermediate-density-lipoproteins) atau sisa VLDL, ditemukan selama proses transisi ini. IDL juga dapat diambil oleh sel melalui endositosis. Terdapat tiga bentuk isomer ApoE, yaitu E2 (paling jarang), E3 (paling sering), dan E4.
Partikel LDL mengandung lebih sedikit trigliserida bila dibandingkan dengan pendahulunya (VLDL), dan memiliki konsentrasi kolesterol dan kolesteril ester yang tinggi. Fungsi utama partikel LDL adalah menyediakan kolesterol untuk jaringan perifer (atau mengembalikannya ke hati). Hal ini dapat dilakukan dengan cara berikatan pada reseptor LDL di permukaan membran sel yang mengenali ApoB100 (tetapi bukan ApoB48). Karena reseptor LDL juga berikatan dengan apo E, reseptor ini juga dikenal sebagai reseptor ApoB100/Apo E.
Mekanisme endositosis yang serupa dengan yang diperantarai oleh reseptor, digunakan dalam pengambilan dan degradasi selular sisa kilomikron dan IDL di hati.
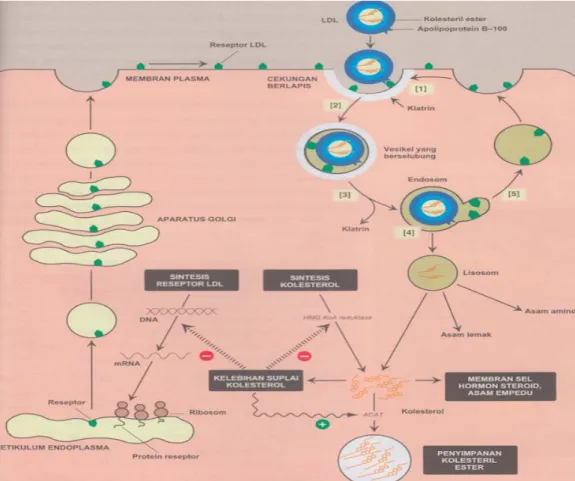
Reseptor LDL merupakan glikoprotein bermuatan negatif yang berkumpul di cekungan membran sel. Sisi cekungan dibagian dalam sel diselubungi dengan protein klatrin, yang menstabilkan bentuk cekungan. Setelah berikatan, kompleks reseptor-LDL diendositosis. Vesikel yang mengandung LDL dengan cepat kehilangan selubung klatrinnya dan bersatu dengan vesikel lain yang sama untuk membentuk vesikel yang lebih besar yang disebut dengan endosom. LDL terpisah dari reseptornya. Reseptor kemudian bermigrasi ke salah satu sisi endosom, sementara LDL tetap bebas di dalam lumen vesikel yang disebut dengan CURL (Compartment for Uncoupling of Receptors and Ligand).
Reseptor dapat didaur ulang, sementara sisa lipoprotein di dalam vesikel akan dipindahkan ke lisosom dan didegradasi oleh asam hidrolase lisosom, yang melepaskan kolesterol bebas, asam amino, asam lemak, dan fosfolipid. Senyawa ini dapat digunakan kembali oleh sel.
Gambar 2.4. Pengambilan ulang dan degradasi LDL dalam sel (Sumber : Lippincott’s Illustrated Reviews Biokimia. 2014; edisi 6)
Kolesterol yang berasal dari sisi kilomikron, IDL, dan LDL akan mempengaruhi kandungan kolesterol selular melalui beberapa cara. Pertama, HMG-KoA reduktase dihambat oleh kadar kolesterol yang tinggi, sehingga sintesis kolesterol de novo menurun. Kedua, sintesis protein reseptor LDL yang baru akan berkurang akibat penurunan ekspresi gen reseptor LDL sehingga membatasi masuknya LDL kolesterol selanjutnya ke dalam sel. Pengaturan gen reseptor LDL melibatkan unsur SRE dan SREBP-2 yang terlibat dalam regulasi gen HMG KoA reduktase. Keadaan ini memungkinkan pengaturan ekspresi protein yang terkoordinasi. Ketiga, jika kolesterol tidak dibutuhkan segera untuk
tujuan sinesis atau struktural, kolesterol akan diesterifikasi oleh Acyl CoA Cholesterol Acyltransferase (ACAT). ACAT akan memindahkan asam lemak dari derivat lemak asil KoA menjadi kolesterol sehingga menghasilkan kolesteril ester yang dapat disimpan di dalam sel. Aktivitas ACAT diperkuat dengan adanya peningkatan kolesterol di dalam sel.
Gambar 2.5. Metabolisme HDL dan kolesterol (Sumber : Lehninger’s Principles of Biochemistry. 2004; edisi 4)
HDL terdiri dari kelompok lipoprotein heterogen dengan proses metabolisme yang kompleks dan sampai sekarang belum sepenuhnya dipahami. Partikel HDL terbentuk dalam darah dengan penambahan lipid untuk ApoA1, sebuah apolipoprotein dibuat oleh hati dan usus, dan disekresi ke dalam darah. ApoA1 menyumbang sekitar 70% dari apolipoprotein di HDL. HDL mempunyai sejumlah fungsi yang penting, meliputi hal-hal berikut ini:
1. HDL merupakan tempat penyimpanan apolipoprotein. Partikel HDL berperan sebagai tempat penampungan ApoC2 yang bersirkulasi.
(apolipoprotein yang dipindahkan ke VLDL dan kilomikron yang diperantarai oleh reseptor).
2. HDL berperan dalam pengambilan kolesterol yang tidak teresterifikasi. HDL nascent merupakan partikel berbentuk cakram yang terutama mengandung fosfolipid (sebagian besar fosfatidilkolin) dan apolipoprotein A, C, dan E. HDL mengambil kolesterol dari jaringan nonhepatik (jaringan perifer) dan mengembalikannya kepada hati sebagai kolesteril ester. Partikel HDL adalah akseptor yang sangat baik untuk kolesterol yang tidak teresterifikasi.
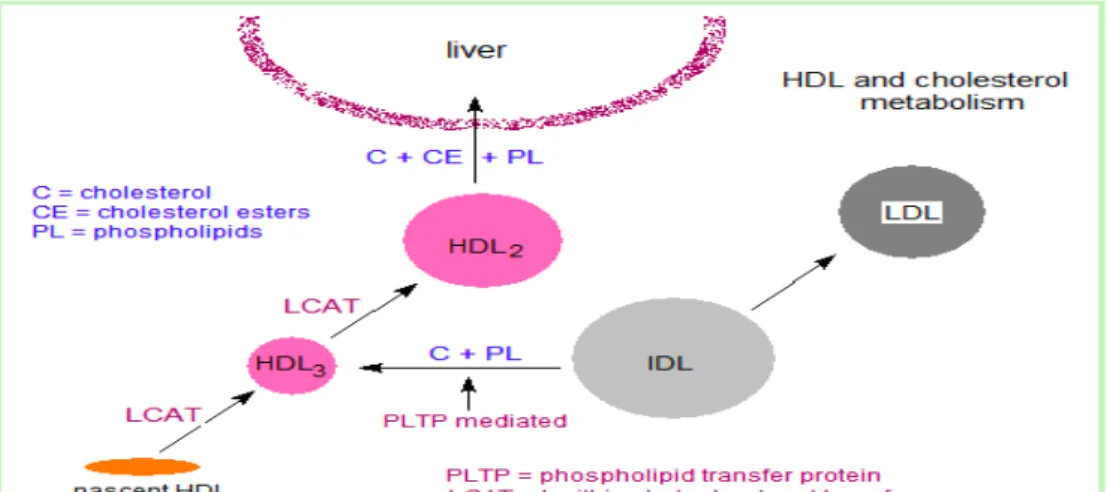
3. HDL berperan dalam esterifikasi kolesterol. Pada saat kolesterol diambil oleh HDL, kolesterol akan segera diesterifikasi oleh enzim plasma lesitin kolesterol asiltransferase (LCAT, yang juga dikenal sebagai PCAT, dengan “P” merupakan singkatan dari fosfatidilkolin yang merupakan sumber asam lemak) di dalam plasma. Enzim ini disintesis dan disekresi oleh hati. LCAT akan berikatan dengan HDL nascent, dan diaktivasi oleh apoA1. LCAT akan memindahkan asam lemak dari karbon 2 fosfatidilkolin ke kolesterol. Proses ini menghasilkan kolesteril ester hidrofobik, yang akan mengalami sekuestrasi di dalam inti HDL, dan lisofosfatidilkolin, yang berikatan dengan albumin. Ketika HDL nascent yang berbentuk cakram (diskoid) itu menimbun kolesteril ester, maka pertama-tama molekul HDL akan berubah bentuk menjadi bundar (sferis) yaitu HDL 3 yang miskin kolesteril ester dan akhirnya partikel HDL 2 yang kaya akan kolesteril ester dan membawa senyawa ester ini ke hati. CETP akan menggerakkan sebagian kolesteril
ester dari HDL ke VLDL untuk ditukar dengan trigliserida sehingga mengurangi inhibisi produk LCAT. Karena VLDL dikatabolisir menjadi LDL, maka kolesteril ester yang ditukarkan dengan trigliserida pada akhirnya akan diambil oleh hati.
4. HDL berperan dalam pembalikan transpor kolesterol: Proses pemindahan kolesterol yang selektif dari sel perifer ke HDL, dan dari HDL ke hati untuk sintesis asam empedu atau pembuangan melalui empedu, dan ke sel steroidogenik untuk mensintesis hormon, merupakan komponen kunci homeostatis kolesterol. Hal ini, sebagiannya, merupakan dasar untuk hubungan kebalikan antara kadar HDL plasma dan aterosklerosis, dan untuk menggambarkan HDL sebagai pembawa kolesterol “yang baik”. Pembalikan transpor kolesterol melibatkan pengeluaran kolesterol dari sel perifer ke HDL, esterifikasi kolesterol oleh LCAT, pengikatan kolesteril ester yang kaya HDL (HDL2) ke hati dan sel steroidogenik, pemindahan selektif kolesteril ester ke dalam sel, dan pelepasan HDL (HDL3) yang menghabiskan lipid (HDL3). Efluks (aliran keluar) kolesterol dari sel perifer diperantarai (dapat) sebagian, oleh protein pembawa. Pengambilan kolesteril ester oleh hati diperantarai oleh reseptor permukaan sel yaitu SR-B1 (scavenger receptor class B type 1) yang mengikat HDL. Partikel HDL sendiri tidak diambil, sebaliknya akan terdapat pengambilan kolesteril ester yang selektif dari partikel HDL. Enzim lipase hepatik dengan kemampuannya untuk menguraikan trigliserida dan fosfolipid, juga turut serta dalam proses konversi HDL2 menjadi HDL3.
Gambar 2.6. Lipoprotein dan pengangkutan lipid (Sumber : Lehninger’s Principles of Biochemistry. 2004; edisi 4)
2.4.3 Apolipoprotein A5
Apolipoprotein A5 merupakan apolipoprotein yang ditemukan oleh Pennacchio et al (2001), dan Van der Vliet et al, sebagai klaster gen yang baru selain ApoA1/ApoC3/ApoA4 di kromosom 11q23. Apolipoprotein ini merupakan protein yang baru kelas apolipoprotein A. ApoAV atau ApoA5 merupakan protein yang diskresikan di hepar dan terdapat di dalam serum manusia, dan digabungkan dengan partikel lipoprotein yang spesifik (Garelnabi et al, 2013; Li et al, 2010). ApoA5 dideteksi di VLDL, HDL dan kilomokron. Kadar serum ApoA5 di plasma darah lebih rendah dibandingkan apolipoprotein lainnya.
Gen ApoA5 terletak di 11q23 kromosom manusia, (Li et al, 2010) memiliki 4 ekson yang mengkode 366 asam amino, berdekatan dengan klaster gen ApoA1/C3/A4 (Song et al, 2013). Ekspresi ApoA5 diregulasi oleh peroxisome proliferator-activated receptor-α (PPAR-α), retinoic acid receptor –related orphan receptor-α (ROR-V) -1, 4 dan liver receptor ligands (LXR) yang akan
mengaktifkan faktor transkripsi (Maasz et al, 2007).
Sejak ditemukan ApoA5, dinyatakan bahwa ApoA5 sebagai kunci dalam pengaturan trigliserida (Garelnabi et al, 2013). Penelitian yang telah dilakukan sebelumnya menunjukkan bahwa gen ApoA5 lebih sering dihubungkan dengan trigliserida (Zaki et al, 2013). Telah diteliti bahwa ApoA5 transgenik manusia ke tikus telah menurunkan trigliserida dan pengambilan gen ApoA5 pada tikus telah meningkatkan kadar trigliserida (Li et al, 2010). Adenovirus-mediated yang mengekspresikan banyak ApoA5 dihubungkan dengan penurunan kadar trigliserida. Van der Vliet dan tim kerjanya menunjukkan bahwa tikus dengan ekspresi yang lebih dari ApoA5 adenoviral menunjukkan adanya pengurangan kadar trigliserida sebanyak 70% ketika dibandingkan dengan tikus liar. Penurunan kadar trigliserida ini dilengkapi dengan penurunan trigliserida di VLDL. Hasil ini mengindikasikan dengan kuat adanya hubungan terbalik antara ApoA5 dan kadar trigliserida, dan karenanya adanya kekurangan dari fungsi ApoA5 merupakan faktor resiko hipertrigliseridemia (Garelnabi et al, 2013).
ApoA5 memiliki efek awal terhadap trigliserida dengan memodulasi aktivitas lipoprotein lipase (LPL). ApoA5 dihubungkan dengan kilomikron,
VLDL, HDL, tetapi tidak dengan LDL. Distribusi ApoA5 di lipoprotein sama dengan ApoC3, yang diperkirakan menghambat kerja dari LPL. Walaupun kerja ApoA5 dan ApoC3 berlawanan, mereka bekerja secara terpisah dalam mengatur kadar trigliserida (Garelnabi et al, 2013).
Saat ini telah dikenal setidaknya 36 single-nucleotide polymorphism (SNPs) gen ApoA5. Minor alel beberapa SNPs di lokus gen ApoA5 manusia telah dinyatakan berhubungan secara signifikan dengan kadar trigliserida pada beberapa populasi, walaupun hasilnya tidak selalu konsisten pada beberapa etnis (Li et al, 2010). Polimorfisme -1131T>C gen ApoA5 telah diteliti pada populasi yang berbeda, dengan adanya efek terhadap kadar trigliserida. Alel -1131C telah ditemukan memiliki hubungan dengan peningkatan trigliserida pada beberapa populasi etnik dan dengan kondisi penyakit seperti penyakit jantung koroner dan stroke. Rata-rata peningkatan trigliserida yang dirangsang oleh gen ApoA5 pada anak-anak Kaukasian lebih rendah daripada anak-anak Asia (Zaki et al, 2013).
2.4.4 Mekanisme kerja apolipoprotein A5 mengatur trigliserida
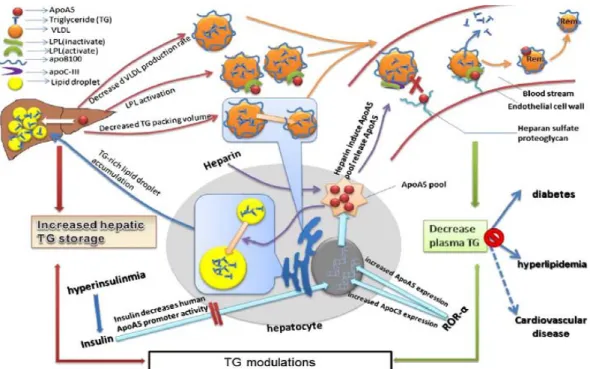
Sejak dari penemuan ApoA5, para peneliti telah berusaha menelaah mekanisme molekuler bagaimana ApoA5 mengatur trigliserida. Walaupun mekanisme kerja ApoA5 masih diperdebatkan, secara umum ada 2 teori yang menggambarkan bagaimana ApoA5 mengatur trigliserida : (1). ApoA5 meningkatkan katabolisme lipoprotein kaya trigliserida dengan LPL atau (2). ApoA5 menghambat produksi VLDL. Untuk mendukung teori pertama, Merked et al menegaskan bahwa reduksi trigliserida adalah hasil dari ApoA5 yang
meningkatkan kerja hidrolisis VLDL dan atau kilomikron oleh LPL. Dalam penelitian mereka, ditemukan bahwa ApoA5 tidak memiliki efek dalam kecepatan hidrolisis LPL ketika proteoglikan tidak ada. Ditemukan bahwa meningkatnya aktifitas LPL akan memperbaiki hipertrigliseridemia kembali ke normal pada tikus dengan defisiensi ApoA5, dan ekspresi yang berlebih dari ApoA5 hanya memberikan sedikit efek dalam mengatur kadar trigliserida ketika terjadi pengurangan LPL.
Teori oleh Weiberg et al (2003), menyatakan bahwa struktur kimia ApoA5 yang menyebabkan ApoA5 dapat mengatur kadar trigliserida. Hal ini disebabkan karena adanya perubahan kecepatan penggabungan dan sekresi partikel VLDL. Analisa kimia menunjukkan bahwa ApoA5 memiliki afinitas yang lebih tinggi, elastisitas yang lebih rendah, dan kinetik ikatan hidrofobik antar permukaan yang lebih rendah. Hal ini mendukung bahwa ApoA5 dapat menekan produksi VLDL.
Gambar 2.7. Peranan Apolipoprotein A5 dalam pengaturan trigliserida (Sumber : Clinical Biochemistry.2013;46:12)
Pada penelitian yang lain oleh Schaap et al (2004), muncul penemuan yang mendukung kedua teori sebelumnya. Tikus yang mendapat perlakuan transfer gen murin ApoA5 (Ad-ApoA5) melalui adenovirus menunjukkan reduksi dosis yang tergantung kecepatan produksi VLDL-trigliserida sebesar 29-37% tetapi tidak mempengaruhi penggabungan VLDL. Selain itu juga ditemukan penurunan dosis trigliserida sebesar 68-88% setelah pemberian lemak pada Ad-ApoA5 tikus yang mendapat perlakuan menunjukkan indikasi adanya stimulasi LPL oleh ApoA5 untuk menghilangkan lipoprotein kaya trigliserida. Terlebih lagi, tikus yang mendapat perlakuan Ad-ApoA5 dapat menghilangkan dengan cepat emulsi VLDL kaya dengan yang mirip trigliserida, yang dimasukkan secara intravena, dengan peningkatan pengambilan trigliserida derivat asam lemak. Semua ini mendukung
reduksi ApoA5 terhadap trigliserida dengan menghambat produksi VLDL dan stimulasi LPL yang diperantarai katabolisme lipoprotein.
2.4.5 Polimorfisme apolipoprotein A5
Variasi gen ApoA5 telah dilaporkan mempengaruhi parameter lipid. Sejumlah polimorfisme gen ApoA5 dinyatakan memiliki peranan dalam predisposisi hiperlipidemia (Zaki et al, 2013). Single nucleotide polymorphisms (SNPs) merupakan tipe variasi genetik yang paling umum. Hal ini merupakan sekuens DNA nukleotida tunggal yang berbeda antar spesies makhluk hidup atau pada pasangan kromosom suatu individu. Polimorfisme ApoA5 -1131T>C (rs662799) merupakan salah satu bentuk SNPs ApoA5 yang terletak pada area promotor.
Lokus ApoA1/ApoC3/ApoA4/ApoA5 merupakan lokus yang paling sering diteliti oleh genome-wide association studies (GWAS). Lokus tersebut berhubungan dengan kadar trigliserida, HDL, dan kolesterol total. Ada 3 haplotipe yang paling sering dihubungkan dengan gen ApoA5, yaitu APOA5*1, ApoA5*2, dan ApoA5*3. Termasuk di dalamnya 5 tipe SNPs ApoA5 yang lain, yaitu -1131T>C, c.-3A>G, c.56C>G (S19W), IVS3+476G>A, dan c.1259T>C. ApoA5*1 mewakili haplotipe alel yang sering dari kelima SNPs. Haploptipe kedua yaitu ApoA5*2, terdiri dari SNP alel yang sering (56C>G) dan 4 alel yang jarang (-1131T>C, -3A>G, IVS +476G>A, dan 1259TC). ApoA5*3 merupakan bentuk kebalikan dari ApoA5*2 yaitu SNP 56C>G sebagai alel yang jarang dan keempat alel lain (-1131T>C, -3A>G, IVS +476G>A, dan 1259TC) sebagai alel
yang sering ditemui. Frekuensi haplotipe ini pada populasi Kaukasian sebanyak 69% untuk ApoA5*1 dan 4% untuk ApoA5*2 dan ApoA5*3. Kepentingan klinis dan hubungan SNP, ApoA5*2 dan ApoA5*3 dengan metabolisme trigliserida, yaitu bahwa kedua alel yang jarang tersebut dinyatakan menaikkan kadar trigliserida. Perubahan dalam basa nukleotida terbukti menghasilkan perubahan dalam sekuens asam amino ApoA5 yang akhirnya akan mengarah pada modifikasi morfologi. Polimorfisme ApoA5 -1131T>C terletak pada area promotor yaitu sebelum promotor proksimal dan mempengaruhi transkripsi protein ApoA5 (Talmud et al, 2002). Hal ini akan mengurangi kecepatan translasi mRNA ApoA5, dan mengakibatkan penurunan kadar ApoA5 dalam plasma, yang pada akhirnya akan menyebabkan peningkatan kadar trigliserida (Zhao et al, 2010). Sehingga dinyatakan bahwa polimorfisme ApoA5 -1131T>C menyebabkan disfungsi atau pengurangan aktivitas protein ApoA5, sehingga fungsi dari produk ApoA5 akhir berubah, terjadi peningkatan kadar trigliserida (Garelnabi et al, 2013).
2.5 Kerangka Teori
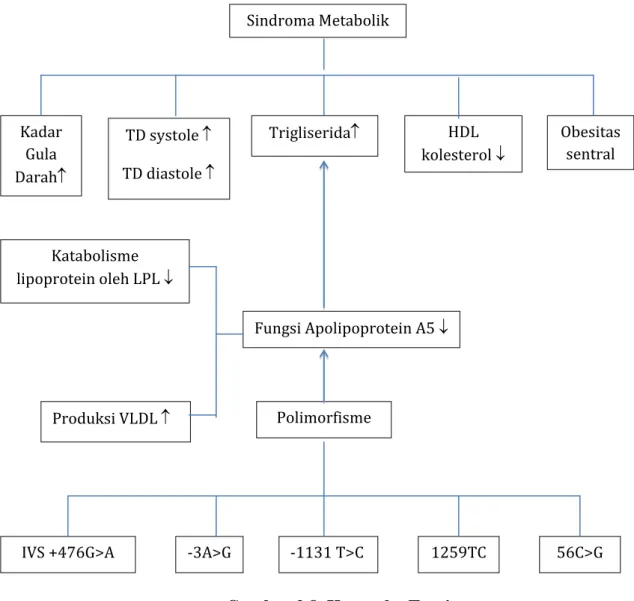
Gambar 2.8. Kerangka Teori Katabolisme lipoprotein oleh LPL ↓ Trigliserida↑ HDL kolesterol ↓ Obesitas sentral TD systole ↑ TD diastole ↑ Kadar Gula Darah↑ Sindroma Metabolik Fungsi Apolipoprotein A5 ↓ Produksi VLDL ↑ Polimorfisme