IDENTIFIKASI PROTOZOA PADA DARAH DAN SALURAN PENCERNAAN BIAWAK AIR (Varanus salvator)
Teks penuh
(2) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. IDENTIFIKASI PROTOZOA PADA DARAH DAN SALURAN PENCERNAAN BIAWAK AIR (Varanus salvator). Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Universitas Airlangga. oleh : AZIZAH BILQIS NURKARIMAH NIM 061511133234. Menyetujui Komisi Pembimbing. (Ratna Damayanti, drh., M. Kes.) Pembimbing Serta. (Dr. Mufasirin, drh., M. Si.) Pembimbing Utama. ii SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(3) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. PERNYATAAN. Dengan ini saya menyatakan bahwa dalam skripsi berjudul:. Identifikasi Protozoa pada Darah dan Saluran Pencernaan Biawak Air (Varanus salvator). Tidak pernah terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.. Surabaya, 14 Agustus 2019. Azizah Bilqis Nurkarimah NIM. 061511133234. iii SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(4) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. Telah dinilai pada Seminar Hasil Penelitian Tanggal : 7 Agustus 2019. KOMISI PENILAI SEMINAR HASIL PENELITIAN Ketua. : Prof. Dr. Lucia Tri Suwanti, drh., M.P.. Sekertaris. : Dr. Boedi Setiawan, drh., M.P.. Anggota. : Dr. Endang Suprihati, drh., M.S.. Pembimbing Utama : Dr. Mufasirin, drh., M.Si. Pembimbing Serta. : Ratna Damayanti, drh., M.Kes.. iv SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(5) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. Telah diuji pada Tanggal : 14 Agustus 2019. KOMISI PENILAI SKRIPSI Ketua. : Prof. Dr. Lucia Tri Suwanti, drh., M.P.. Sekertaris. : Dr. Boedi Setiawan, drh., M.P.. Anggota. : Dr. Endang Suprihati, drh., M.S.. Pembimbing Utama : Dr. Mufasirin, drh., M.Si. Pembimbing Serta. : Ratna Damayanti, drh., M.Kes.. Surabaya, 14 Agustus 2019 Fakultas Kedokteran Hewan Universitas Airlangga Dekan,. Prof. Dr. Pudji Srianto, drh., M. Kes NIP 195601051986011001. v SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(6) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. RINGKASAN. Azizah Bilqis Nurkarimah. Penelitian dengan judul “Identifikasi Protozoa pada Darah dan Saluran Pencernaan Biawak Air (Varanus Salvator)” di bawah bimbingan Dr. Mufasirin, drh., M. Si. selaku dosen pembimbing utama dan Ratna Damayanti, drh., M. Kes. selaku dosen pembimbing serta. Biawak air merupakan satwa liar yang mudah ditemukan di sekitar tempat tinggal manusia. Biawak diburu untuk memenuhi kebutuhan hidup manusia, seperti penggunaan kulit untuk kerajinan dan daging untuk dikonsumsi atau sebagai obat. Pemanfaatan biawak oleh manusia pada umumnya kurang diimbangi dengan tata cara pemeliharaan yang benar, sehingga risiko penyebaran parasit khususnya protozoa dapat terjadi terhadap reptil maupun pemelihara. Informasi mengenai protozoa pada darah dan biawak air di Indonesia masih sedikit dan terbatas dilaporkan. Tujuan penelitian ini adalah mengetahui jenis protozoa pada darah dan saluran pencernaan biawak air, sehingga hasil penelitian dapat dijadikan tambahan referensi untuk penelitian lebih lanjut mengenai potensi penyebaran penyakit parasitik yang bersifat zoonosis. Sampel dalam penelitian ini berupa darah dan feses dari 50 ekor biawak air yang diambil di tempat pemotongan biawak di Sidoarjo. Sampel darah diperiksa menggunakan metode ulas darah dengan pewarnaan Giemsa, sedangkan sampel feses diperiksa menggunakan tiga metode yaitu natif, apung sukrosa, dan modifikasi tahan asam. Pemeriksaan darah dicek menggunakan mikroskop perbesaran 1000x dan pemeriksaan feses perbesaran 400x. Sampel dianggap. vi SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(7) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. positif apabila dalam pengamatan mikroskop ditemukan parasit yang sesuai dengan karakteristik protozoa yang bersumber dari referensi ilmiah. Hasil penelitian dari 50 ekor biawak air yang diperiksa ditemukan 8 ekor positif protozoa, infeksi bersifat tunggal dengan rincian tujuh ekor terinfeksi Haemogregarina sp. dan satu ekor terinfeksi oleh Eimeria sp., sedangkan protozoa jenis lain tidak ditemukan. Kesimpulan dari penelitian ini adalah ditemukan jenis protozoa pada darah yaitu Haemogregarina sp. (14%) dan Eimeria sp. (2%) pada feses biawak air di pemotongan biawak Sidoarjo. Persentase total yang didapatkan sebesar 16% positif infeksi tunggal protozoa dari 50 ekor biawak air. Saran yang dapat diajukan adalah melakukan penelitian lebih lanjut menggunakan PCR dan sekuensing untuk mendapatkan hasil identifikasi yang lebih spesifik serta akurat, sampai subspesies atau strain.. vii SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(8) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. IDENTIFICATION PROTOZOA IN THE BLOOD AND DIGESTIVE TRACT ON WATER MONITOR LIZARD (Varanus salvator) Azizah Bilqis Nurkarimah ABSTRACT The aim of this research is to identify the type of protozoa in the blood and digestive tract on water monitor lizard (Varanus salvator) was captured in Sidoarjo, East Java. This research was taken on March until June 2019. This research used a non-experimental method through an observation study. The samples of this research were made in thin blood smear using Giemsa stain, while fecal examination using native method, sucrose flotation, and modified ZiehlNeelsen stain. As many as 50 water monitor lizard were used this research and examined at the Laboratory of Parasitology, Faculty of Veterinary Medicine Airlangga University. The results showed that two types of protozoa found were single infection. Observations on the blood was obtained Haemogregarina sp. (14%) and observations of feces obtained Eimeria sp. (2%). The conclusion of this research indicate that type of protozoa was Haemogregarina sp. and Eimeria sp. were found on water monitor lizard (Varanus salvator). Keywords: Eimeria sp., Haemogregarina sp., Varanus salvator, water monitor lizard.. viii SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(9) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. UCAPAN TERIMA KASIH. Alhamdulillah atas rahmat dan kehendak Allah SWT, penulis dapat melaksanakan penelitian dan menyelesaikan skripsi dengan judul Identifikasi Protozoa pada Darah dan Saluran Pencernaan Biawak Air (Varanus salvator). Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu setiap langkah dalam menyelesaikan penelitian dan penulisan skripsi ini, semoga keberkahan dan rahmat tercurah kepada mereka semua. Dengan kerendahan hati penulis sampaikan salam dan ucapan terima kasih kepada: Dekan Fakultas Kedokteran Hewan Universitas Airlangga Prof. Dr. Pudji Srianto, drh., M. Kes. atas kesempatan mengikuti pendidikan di Fakultas Kedokteran Hewan Universitas Airlangga. Dr. Mufasirin, drh., M. Si. selaku dosen pembimbing utama yang selalu memberi ilmu, nasehat, motivasi dan semangat yang diberikan kepada penulis selama menjadi mahasiswa di Fakultas Kedokteran Hewan Universitas Airlangga. Ibu Ratna Damayanti, drh., M. Kes. selaku dosen pembimbing serta yang selalu memberi ilmu, nasehat, motivasi dan semangat yang diberikan. Terima kasih kepada Prof. Dr. Lucia Tri Suwanti, drh., M.P. selaku ketua penguji, Dr. Boedi Setiawan, drh., M.P. selaku sekretaris penguji dan Dr. Endang Suprihati, drh., M.S. selaku anggota penguji atas ilmu, koreksi, dan waktu yang diberikan. Terima kasih kepada bapak Tri Bhawono Dadi, drh., M.Vet. selaku dosen wali atas doa dan nasihat yang diberikan.. ix SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(10) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. Seluruh staf pengajar Fakultas Kedokteran Hewan Universitas Airlangga atas wawasan keilmuan selama mengikuti pendidikan di Fakultas Kedokteran Hewan Universitas Airlangga. Terima kasih yang tak terhingga kepada kedua orang tua penulis, bapak Bambang Supriyantoro dan ibu Ida Nurcholis atas kasih sayang, dukungan, dan doanya. Terima kasih kepada kakak penulis, Moch. Mahbub Adinegoro atas perhatian, motivasi, dan semangatnya. Teman penelitian Andita Nurma, sahabat-sahabat saya, terima kasih menjadikan hari-hari saya penuh semangat selama pengerjaan skripsi. Seluruh teman kelas D dan teman angkatan 2015 atas persahabatan, doa dan semangatnya. Mas Ferli atas bantuannya di Laboratorium Departemen Parasitologi Veteriner FKH Unair. Mas Yoshi atas kesediaannya membantu menyediakan biawak air sebagai obyek penelitian. Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini, oleh karena itu penulis mengharapkan kritik dan saran untuk kesempurnaan skripsi ini. Semoga skripsi ini bermanfaat untuk kemajuan ilmu pengetahuan.. Surabaya, 8 Juni 2019. Penulis. x SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(11) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. DAFTAR ISI. Halaman HALAMAN PENGESAHAN ................................................................... ii HALAMAN PERNYATAAN .................................................................. iii KOMISI PENILAI SEMINAR HASIL PENELITIAN ............................. iv KOMISI PENILAI SKRIPSI .................................................................... v RINGKASAN ........................................................................................... vi ABSTRACT .............................................................................................. viii UCAPAN TERIMA KASIH ..................................................................... ix DAFTAR ISI ............................................................................................. xi DAFTAR TABEL ..................................................................................... xiii DAFTAR GAMBAR ................................................................................ xiv DAFTAR LAMPIRAN ............................................................................. xv SINGKATAN DAN ARTI LAMBANG .................................................. xv BAB 1 PENDAHULUAN ....................................................................... 1.1 Latar Belakang Penelitian...................................................... 1.2 Rumusan Masalah Penelitian ................................................ 1.3 Landasan Teori...................................................................... 1.4 Tujuan Penelitian... ............................................................... 1.5 Manfaat Hasil Penelitian ........................................................ 1 1 3 3 5 5. BAB 2 TINJAUAN PUSTAKA .............................................................. 2.1 Biawak Air ............................................................................ 2.1.1 Klasifikasi .................................................................. 2.1.2 Morfologi .................................................................. 2.1.3 Reproduksi ................................................................. 2.1.4 Habitat ........................................................................ 2.1.5 Nilai Ekonomi ............................................................ 2.1.6 Penyakit ..................................................................... 2.2 Protozoa ................................................................................ 2.2.1 Haemogregarina sp. ................................................. 2.2.2 Cryptosporidium sp. .................................................. 2.2.3 Eimeria sp. ................................................................. 6 6 6 7 8 9 9 10 12 13 15 17. BAB 3 MATERI DAN METODE .......................................................... 19 3.1 Rancangan Penelitian ........................................................... 19 3.2 Sampel Penelitian ................................................................. 19. xi SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(12) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 3.3 Tempat dan Waktu Penelitian .............................................. 3.4 Materi Penelitian .................................................................. 3.4.1 Bahan penelitian ........................................................ 3.4.2 Alat penelitian ............................................................ 3.5 Prosedur Penelitian .............................................................. 3.5.1 Metode pemeriksaan darah ........................................ 3.5.2 Metode pemeriksaan feses ......................................... 3.6 Analisis Data ......................................................................... 3.7 Kerangka Penelitian .............................................................. 19 19 19 20 20 20 21 22 23. BAB 4 HASIL PENELITIAN ................................................................ 24 4.1 Identifikasi protozoa pada darah dan saluran pencernaan biawak yang di peroleh dari tempat pemotongan biawak di Sidoarjo ………………………………………… 24 BAB 5 PEMBAHASAN ......................................................................... 28 BAB 6 KESIMPULAN DAN SARAN .................................................. 32 Daftar Pustaka ............................................................................................ 33. Lampiran ................................................................................................. 38. xii SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(13) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. DAFTAR TABEL Tabel 4.1. Halaman Hasil Pemeriksaan Protozoa pada Biawak Air ................................ 24. xiii SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(14) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. DAFTAR GAMBAR Gambar. Halaman. 2.1. Biawak air .................................................................................. 6. 2.2. Gambaran mikroskopis dari Haemogregarina sp. dengan perbesaran 2200x menggunakan pewarnaan Giemsa ............ 15. Gambaran mikroskopis dari ookista Cryptosporidium sp. dengan perbesaran 400x menggunakan pewarnaan modifikasi tahan asam ............................................................ 17. Morfologi ookista Eimeria sp. yang sudah bersporulasi dengan perbesaran 1600x ....................................................... 19. 3.1. Diagram alir ……………………………………. ...................... 23. 4.1. Haemogregarina sp. pada pemeriksaan mikroskopis perbesaran 1000x .................................................................... 25. 4.2. Hasil pengukuran Haemogregarina sp. ...................................... 26. 4.3. Eimeria sp. pada pemeriksaan mikroskopis perbesaran 400x …………………………………….. .............. 27. Hasil pengukuran Eimeria sp. .................................................... 27. 2.3. 2.4. 4.4. xiv SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(15) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. DAFTAR LAMPIRAN Lampiran. Halaman. 1. Data Jenis Protozoa pada Biawak Air .......................................... 39. xv SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(16) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. SINGKATAN DAN ARTI LAMBANG. AAZV. = American Association of Zoo Veterinarians. CITES. = The Convention on International Trade in Endangered Species of Wild Fauna and Flora. EDTA. = Ethylen Diamine Tetra Acetic Acid. et al.. = Et alii. sp.. = Spesies. xvi SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(17) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. BAB I PENDAHULUAN. 1.1. Latar Belakang Penelitian Biawak air (Varanus salvator) merupakan salah satu satwa endemik. Indonesia yang paling diminati sebagai peliharaan eksotik di dunia. Biawak air dapat ditemukan hampir di seluruh kepulauan Indonesia. Keberadaan biawak yang mudah ditemukan di alam bebas mendukung besarnya potensi eksploitasi oleh manusia. Biawak air di Indonesia umumnya digunakan sebagai hewan konsumsi dan bahan kerajinan. Pemelihara hewan kesayangan khususnya dari golongan reptil sebagian besar kurang memahami tata cara pemeliharaan yang benar (Dalton et al., 1995). Keadaan tersebut dapat menjadi faktor risiko terjadinya penyebaran parasit terhadap reptil maupun pemelihara. Beberapa faktor yang dapat menunjang hidup dan berkembangnya parasit antara lain makanan yang tidak sehat, lingkungan yang tercemar, dan perilaku hidup individu (Natadisastra dan Agoes, 2009). Salah satu parasit yang dapat menginfeksi reptil khususnya biawak adalah protozoa, baik yang menginfeksi darah maupun saluran pencernaan. Berdasarkan laporan yang didapatkan dari Hanafiah dkk. (2018), diduga terdapat banyak parasit yang dapat menginfeksi biawak air, namun belum ditemukan protozoa pada biawak air khususnya di Indonesia. Mader (1996) menemukan beberapa parasit khususnya protozoa pada darah dan saluran pencernaan reptil. Jenis protozoa yang dapat menginfeksi biawak antara lain, Cryptosporidium sp. (Prabayuda, 2017), Entamoeba invadens (Chia et al., 2009),. 1 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(18) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 2. Giardia sp. (Upton and Zien, 1997), Eimeria ramadanensis (Abdel-Aziz et al., 2019), dan Haemogregarina sp. (Cook et al., 2016). Beberapa protozoa yang ditemukan pada biawak bersifat zoonosis, sehingga dapat menyebabkan penyakit pada manusia seperti cryptosporidiosis dan giardiasis. Manusia memanfaatkan biawak untuk memenuhi kebutuhan hidup, seperti menggunakan kulit sebagai perhiasan, daging untuk konsumsi dan obat, serta untuk peliharaan (Shine et al., 1996). Interaksi antara manusia dengan biawak yang ditangkap liar memiliki potensi terjadinya penularan parasit yang zoonosis. Penularan zoonosis parasitik berkaitan erat dengan penerapan kebersihan dan sanitasi. Zoonosis parasitik pada umumnya tidak menimbulkan gejala klinis yang jelas, sehingga seringkali diabaikan. Infeksi parasit pada hewan juga umumnya tidak. menimbulkan. gejala. klinis. jika. masih. ringan,. walaupun. dapat. mengakibatkan kematian apabila sudah parah (Sopha, 2018). Penelitian tentang biawak dan agen penyebab penyakitnya masih jarang dilaporkan (Wilson, 2010), sehingga perlu dilakukan identifikasi parasit untuk mengetahui kemungkinan terjadinya penularan penyakit dari biawak air terhadap manusia. Pada penelitian ini akan dilakukan identifikasi terhadap protozoa pada darah dan saluran pencernaan biawak air yang didapat di Sidoarjo dengan pemeriksaan secara mikroskopik. Pemeriksaan ini dilakukan karena biawak air dapat digunakan sebagai model untuk mempelajari berbagai macam protozoa yang menyerang jenis bangsa varanidae yang lain. Selain itu, hasil penelitian ini juga dapat digunakan sebagai referensi potensi penyebaran penyakit parasitik pada biawak yang bersifat zoonosis.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(19) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 1.2. 3. Rumusan Masalah Berdasarkan uraian pada latar belakang, maka dapat ditarik rumusan. masalah jenis protozoa apa saja yang ditemukan pada darah dan saluran pencernaan biawak air (Varanus salvator)?. 1.3. Landasan Teori Penyakit pada biawak dapat diakibatkan oleh parasit internal diantaranya. protozoa, nematoda, dan trematoda (Ramadhan, 2011). Penyakit yang disebabkan protozoa dapat terjadi di lingkungan yang memiliki sanitasi buruk, kandang yang terlalu padat atau meminum air yang telah terkontaminasi oleh protozoa (Chia et al., 2009). Biawak air yang digunakan pada penelitian ini berasal dari tangkapan liar di alam bebas yang tidak memiliki pengendalian sanitasi lingkungan, sehingga memiliki risiko penyebaran parasit khususnya protozoa. Protozoa pada biawak yang berpotensi menular pada manusia adalah Cryptosporidium sp. dan Giardia sp. Penularan zoonosis oleh parasit antara lain terjadi melalui makanan (foodborne), udara (airborne), dan kontak langsung dengan hewan sakit (Yudhastuti,. 2012).. Carmena. (2010). melaporkan. bahwa. penyebaran. Cryptosporidium sp. dan Giardia sp. pada manusia terjadi melalui air (waterborne). Penularan Cryptosporidium sp. terjadi ketika ookista matang yang telah mengandung 4 sporozoit ikut tertelan bersama air minum atau sumber air yang telah terkontaminasi feses hospes yang terinfeksi atau dapat juga terhisap dari sekret saluran respirasi hospes terinfeksi. Setelah masuk ke dalam tubuh hospes ookista matang tersebut mengalami ekskistasi. Sporozoit dilepaskan dan. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(20) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 4. menginfeksi sel epitel pada saluran gastrointestinal dan dapat juga pada saluran pernapasan, yang kemudian disebut meront. Kemudian meront tersebut akan mengalami skizogoni atau merogoni dan menghasilkan merozoit yang memasuki sel lain. Perkembangan selanjutnya adalah gametogoni yang menghasilkan mikrogametosit (jantan) dan makrogametosit (betina) yang kemudian akan akan fertilisasi menghasilkan ookista yang mengandung 4 sporozoit. Ookista yang dihasilkan akan diekskresikan dari hospes bersama feses. Ookista yang diekskresikan tersebut akan menimbulkan infeksi secara langsung dan cepat melalui jalur fekal-oral (Smith, 2009). Ookista Cryptosporidium sp. merupakan stadium infektif yang banyak ditemukan pada feses manusia atau hewan yang terinfeksi (Roberts et al., 2005). Diagnosa cryptosporidiosis dapat dilakukan dengan mengidentifikasi ookista melalui pewarnaan asam pada feses, hasil regurgitasi atau biopsi saluran pencernaan (Kahn and Line, 2010). Menurut Carmena (2010), Giardia sp. dapat ditularkan ke manusia melalui beragam mekanisme terutama yang melibatkan air dan makanan. Penularan Giardia sp. terjadi ketika air dan makanan yang terkontaminasi oleh kista tertelan oleh hospes. Setelah sampai di awal bagian usus halus, kista akan mengalami ekskistasi dan mengeluarkan tropozoit. Tropozoit akan menyebar ke seluruh usus halus dan berkembang biak dengan membelah diri atau asexual. Hasil pembelahan dari tropozoit akan menghasilkan tropozoit-tropozoit yang siap menginfiltrasi mukosa usus dan sebagian yang lain akan membentuk kista yang akan dikeluarkan kembali bersama feses. Diagnosa giardiasis dapat dilakukan dengan pemeriksaan natif pada feses segar (Hardiansyah, 2014).. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(21) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 1.4. 5. Tujuan Penelitian Tujuan penelitian ini adalah untuk mengetahui jenis protozoa pada darah. dan saluran pencernaan biawak air (Varanus salvator).. 1.5. Manfaat Hasil Penelitian Penelitian ini diharapkan dapat memberikan dan melengkapi informasi. ilmiah tentang keberadaan protozoa yang menyerang biawak air dan memudahkan dalam melakukan penyelidikan lebih lanjut terhadap suatu penyakit. Dapat dijadikan sebagai data referensi maupun dokumentasi, dan memberikan pengetahuan tentang penyakit yang disebabkan oleh protozoa pada darah dan saluran perncernaan biawak air.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(22) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. BAB 2 TINJAUAN PUSTAKA. 2.1. Biawak Air. 2.1.1 Klasifikasi Biawak Air Menurut Banks (2004), klasifikasi biawak sebaga berikut : Kingdom. : Animalia. Filum. : Chordata. Subfilum. : Vertebrata. Kelas. : Reptilia. Ordo. : Squamata. Subordo. : Autarchoglossa. Famili. : Varanidae. Genus. : Varanus. Spesies. : Varanus salvator. Biawak ini ditemukan di hampir seluruh kepulauan di Indonesia (Bennett dan Sweet, 2010). Gambar biawak air dapat dilihat pada Gambar 2.1.. Gambar 2.1 Biawak air. Sumber: Koch et al. (2007).. 6 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(23) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 7. 2.1.2 Morfologi biawak air Biawak air adalah sebangsa reptil yang masuk ke dalam golongan kadal besar, famili Varanidae. Biawak air berasal dari Asia Selatan dan Tenggara, tersebar dari Sri Lanka dan India sampai Indochina, Semenanjung Malaya, dan berbagai pulau di Indonesia, yang tinggal di daerah dekat dengan air. Panjang maksimal biawak air yang pernah dilaporkan mencapai 3 meter, walaupun ukuran rata-rata usia dewasa yang sering ditemukan berukuran panjang 1,5 meter. Leher dan moncong biawak memiliki ukuran yang sangat panjang, posisi lubang hidung berada di ujung depan moncong. Ekor lateral terkompresi dan memiliki semacam taju pada dorsal. Sisik di bagian atas kepala relatif besar dan semakin ke belakang semakin kecil. Pada umumnya biawak air memiliki tubuh berwarna hitam dengan motif berbentuk bulatan bewarna kuning dan mata yang berwarna kuning. Motif kuning yang ada cenderung berkurang saat individu menjadi lebih tua (Steel, 1996). 2.1.3 Reproduksi pada biawak Biawak jantan memiliki sepasang hemipenis yang berbentuk seperti kantung, terletak di pangkal ekor dan menimbulkan tonjolan pada bagian ventral ekor. Walaupun mempunyai sepasang hemipenis, pada saat kopulasi hanya satu yang dimasukkan ke liang kloaka betina (Iyai dan Pattiselanno, 2006). Hemipenis tidak digunakan pada saat urinasi karena urin dikeluarkan langsung dari kloaka melalui ureter. Biawak betina memiliki sepasang oviduk dan ovarium. Ovarium terletak pada posisi yang sama dengan testes pada biawak jantan yaitu di dorsomedial rongga abdomen (Barten, 1996). Faktor penentu utama kematangan seksual pada biawak adalah ukuran. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(24) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 8. tubuh. Umur dianggap tidak terlalu berpengaruh pada kematangan seksual karena berbeda antara biawak di alam liar dan penangkaran. Umur kematangan seksual biawak di alam liar berkisar antara 3-4 tahun, sedangkan usia kematangan seksual biawak di penangkaran tidak dapat ditentukan karena dipengaruhi oleh perawatan dan pakan yang berbeda (Barten, 1996). Musim kawin pada biawak ditentukan oleh suhu, hujan dan ketersediaan pakan. Biawak jantan akan menjadi agresif dan menjaga teritorial ketika musim kawin. Frekuensi reproduksi biawak tergantung pada kondisi lingkungan dan nutrisi biawak tersebut. Biawak bersifat ovipar dan dapat menghasilkan telur lebih dari satu kali dalam setahun. Bila kopulasi terjadi sebelum ovulasi, sperma akan disimpan oleh betina. Hal ini menyebabkan reptil betina mampu untuk menghasilkan telur tanpa adanya kopulasi. Fertilisasi akan meningkat bila kopulasi terjadi saat berlangsungnya pembentukan telur (Barten, 1996). Gangguan reproduksi yang sering terjadi pada biawak adalah distokia, prolapsus oviduk, kloaka dan hemipenis. Prolapsus oviduk dan kloaka terjadi akibat oviposisi, namun banyak kasus yang terjadi akibat kesalahan penanganan distokia. Prolapsus hemipenis terjadi karena trauma setelah kopulasi dan mengalami inflamasi sehingga tidak dapat masuk kembali ke kloaka. Hemipenis dapat mengalami pendarahan dan bahkan nekrosis sehingga harus diamputasi. Prolapsus penis tidak mengganggu kemampuan reproduksi biawak karena memiliki dua hemipenis (DeNardo, 1996). 2.1.4 Habitat Habitat biawak diantaranya bakau, hutan hujan dan rawa dengan pakan yang terdiri atas siput, katak, ikan, serangga, burung, telur burung, dan telur reptil lain.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(25) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 9. Biawak adalah predator oportunistik sehingga dapat mengubah pola pakan berdasarkan ketersediaan pakan di habitat (Bennett, 2007). 2.1.5 Nilai ekonomi biawak Indonesia telah lama menjadi negara pengeskpor reptil, baik dalam bentuk reptil hidup maupun bentuk kulit. Reptil hidup diekspor untuk diambil daging atau bagian lain atau sebagai hewan peliharaan. Reptil hidup yang diambil dagingnya umumnya diekspor ke Cina, Hongkong dan Singapura, sedangkan reptil untuk hewan peliharaan lebih banyak diekspor ke Amerika Serikat (Mardiastuti dan Soehartono, 2003). Di beberapa daerah, daging biawak diolah menjadi bermacammacam hidangan. Konsumen daging biawak meningkat karena daging biawak enak dan bermanfaat untuk mengatasi asam urat. Daging biawak dipercaya dapat bertindak sebagai aphrodisiac dan memiliki khasiat untuk mengobati gatal-gatal, menghaluskan kulit serta mengobati luka bakar (Hulu, 2011). Selain daging, kulit biawak juga memiliki pasar yang baik. Perdagangan kulit biawak didominasi oleh satu jenis biawak yaitu biawak karena tersebar di seluruh Indonesia bagian barat meliputi Jawa, Sumatra dan Kalimantan. Jumlah ekspor kulit biawak lebih banyak dari jumlah ekspor kulit buaya yaitu rata-rata sebanyak 650.000 lembar per tahun sedangkan ekspor kulit buaya hanya 1.0003.500 lembar per tahun. Negara pembeli utama kulit biawak adalah Amerika Serikat, Jepang, Singapura, Meksiko dan Italia. Permasalahan utama ekspor reptil adalah belum adanya data jumlah populasi di alam untuk menentukan jumlah kuota, sehingga perdagangan sulit dilakukan berdasarkan ketentuan Konvensi CITES, dan kemungkinan menurunnya populasi beberapa spesies reptil komersial akibat banyak pemanenan dari alam (Mardiastuti dan Soehartono, 2003).. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(26) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 10. 2.1.6 Penyakit pada biawak Penyakit pada biawak meliputi penyakit yang umum terjadi pada reptil. Biawak dapat mengalami gangguan kesehatan atau penyakit pada sistem pernapasan, sistem pencernaan, sistem metabolisme, tulang, kulit dan sistem reproduksi (Wilson, 2010). Gangguan kesehatan pada sistem pernapasan biawak umumnya adalah pneumonia. Pneumonia dapat disebabkan oleh bakteri aerobik dan anaerobik, fungi, serta parasit dan terjadi akibat manajemen pemeliharaan yang kurang baik. Suhu dan kelembaban berpengaruh terhadap fungsi pernapasan dan sistem imun yang baik (Barten, 1996). Selain itu, nutrisi yang tidak seimbang terutama vitamin A dan protein yang kurang dapat mengakibatkan gangguan pernapasan. Defisiensi vitamin A mengakibatkan metaplasia pada epitel dan duktus kelenjar mukus saluran pernapasan (Murray, 1996). Beberapa spesies Varanus sp. dapat mengalami luka pada kulit yang disebabkan oleh gesekan hewan tersebut dengan kandang. Luka tersebut dapat terinfeksi. bakteri. atau. fungi. sehingga. diperlukan. pengobatan. dengan. menggunakan antibiotik sistemik (Wilson, 2010). Penyakit pada biawak juga dapat diakibatkan oleh parasit internal diantaranya protozoa, nematoda dan trematoda. Beberapa protozoa yang ditemukan pada saluran pencernaan biawak menyebabkan coccidiosis dan cryptosporidiosis. Coccidiosis pada reptil disebabkan oleh protozoa genus Eimeria, Isospora, dan Caryospora yang ditransmisikan melalui jalur fekal-oral, sedangkan cryptosporidiosis bersifat sangat virulen pada ular dan kadal yang juga ditransmisikan melalui jalur fekal-oral (Wilson, 2010). Cryptosporidium sp. menyebabkan penebalan mukosa usus, regurgitasi, diare, dan penurunan bobot. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(27) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. badan. Diagnosa infeksi. Cryptosporidium sp.. dapat. 11. dilakukan dengan. mengidentifikasi ookista melalui pewarnaan modifikasi tahan asam pada feses, hasil regurgitasi atau biopsi saluran pencernaan (Kahn and Line, 2010). Nematoda yang menginfeksi saluran pencernaan dan pernapasan reptil antara lain cacing gelang, cacing kait (Oswalsocruzia sp.), cacing kremi (Oxyurus sp.), cacing hati (Capillaria sp.), Strongyloides sp., dan cacing paru (Entomelas sp.) (Mader, 1996).. 2.2. Protozoa Protozoa merupakan organisme bersel tunggal, dimana pada beberapa. spesies mempunyai lebih dari satu nukleus (inti) pada bagian atau seluruh daur hidupnya. Protozoa merupakan eukaryotik dengan inti yang diselubungi oleh membran (selaput). Protozoa tersusun dari organela-organela yang berdiferensiasi (Levine, 1990). Protozoa memiliki ukuran mikroskopis dan bentuk tubuh yang bervariasi. Komponen dasar dari protozoa adalah inti dan sitoplasma. Inti protozoa mempunyai berbagai bentuk, ukuran dan struktur (Tampubolon, 2004). Komponen penting inti protozoa adalah membrana inti, kromatin, plastin dan nukleoplasma atau cairan inti. Secara struktural inti dibagi menjadi dua tipe yaitu, vesikuler dan kompak. Inti vesikuler terdiri dari membrana inti yang kadang-kadang sangat lembut tetapi jelas nukleoplasma, akromatin dan kromatin. Disamping itu badan intranuklear biasanya agak bulat, tersusun dari kromatin, nukleolus atau plasmasoma. Sebaliknya inti kompak mengandung banyak substansi kromatin dan sedikit jumlah nukleoplasma, karena itu bersifat padat. (Tampubolon, 2004). Sitoplasma protozoa tidak berbeda kepentingannya dari sitoplasma hewan. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(28) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 12. multiseluler. Sitoplasrna protozoa berisi berrnacam-macam organela, diantaranya retikulum endoplasma dan ribosom seperti pada sel eukaryotik lain. Pada mitokondria, krista berbentuk tubuler lebih banyak daripada yang berbentuk piringan seperti yang terdapat pada organisme yang lebih tinggi, serta organel yang lain seperti aparat golgi, vakuola kontraktil, zat cadangan seperti glikogen, vakuola makanan, dan silia atau flagella (Tampubolon, 2004). Menurut Levine (1990), protozoa bergerak dengan flagela, silia, pseudopodia (kaki palsu), dan selaput undulasi. Flagela adalah organela yang menyerupai cambuk tersusun oleh aksonema sentral dan selubung luar. Flagela ditemukan pada Flagellata, beberapa Amoeba, dan gamet jantan dari beberapa Apicomplexa. Silia adalah flagela yang kecil, silia umumnya tersusun berjajar sehingga mirip seperti bulu mata. Satu atau lebih jajaran silia longitudinal dapat bergabung membentuk selaput undulasi. Pseudopodia merupakan alat gerak sementara yang dapat dibentuk dan ditarik apabila dibutuhkan. Lobopodia merupakan pseudopodia yang relatif lebar dengan lapisan luar yang tebal dan banyak cairan di dalamnya. Filopodia merupakan pseudopodia yang bentuk penjulurannya langsing, lembut seperti benang, dan runcing. Retikulopodia merupakan kaki palsu yang berfilamen dengan lapisan dalam yang padat dan lapisan luar yang lebih encer di mana terjadi sirkulasi granuler. Aksopodia merupakan kaki palsu langsing yang tidak terdapat cabang, mempunyai filamen aksial (pipa fibriler) dan selaput luar tipis dari sitoplasma yang encer. Tepi yang mengombak memanjang pada permukaan luar tubuh memungkinkan untuk tipe gerak yang menggelinding pada beberapa protozoa Apicomplexa, misalnya Gregarina. Protozoa Apicomplexa lain, misalnya. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(29) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 13. Coccidia, sanggup mengelinding. Mikrotubulus subpelikuler hanya dapat dilihat dengan mikroskop elektron yang perannya belum diketahui. Gerakan dapat juga dihasilkan dari pembengkokan atau meliukkan seluruh tubuh (Levine, 1990). 2.2.1 Haemogregarina sp. Klasifikasi Haemogregarina sp. di dalam Jòzsef (2015) sebagai berikut: Filum: Apicomplexa, Kelas: Conoidasida, Ordo: Eucoccidiorina, Sub ordo: Adeleorina, Famili: Haemogregarinidae, Genus: Haemogregarina, Spesies: Haemogregarina sp. Kebanyakan jenis dari famili haemogregarinidae parasit dalam eritrosit katak dan kura-kura, sebagai hospes definitif, dan lintah sebagai hospes intermediet (parasit dalam epitalium usus lintah). Parasit ini tidak dapat diklasifikasikan secara akurat berdasarkan wujudnya dalam sel darah saja (AlFarraj, 2008). Pada sediaan ulas darah, gamont Haemogregarina sp. muncul sebagai inklusi berbentuk sosis dengan sitoplasma pucat ke ungu dan yang terpusat sedikit agak eksentrik, pewarnaan inti tampak lebih ungu gelap kecuali pada infeksi di mana meront eritrositik dapat ditemukan. Meront tidak berpigmen dan biasanya ditemukan sitoplasma eritrosit dan kadang-kadang dalam leukosit (Jacobson, 1983). Gamont dapat mendorong inti sel inang ke dalam atau mengelilinginya. Sel inang mungkin tampak tidak beraturan dalam bentuk dan ukuran (Shazly, 1994). Dua atau lebih organisme dapat ditemukan dalam satu eritrosit, atau gamont dapat ditemukan secara ekstraseluler. Gamont dari Haemogregarina sp. yang berbeda secara morfologis tidak dapat dibedakan di dalam darah tepi. Haemogregarina sp. dari genus Hepatozoon umumnya ditemukan pada ular darat dan air. Sporozoit Haemogregarina sp. sering ditularkan oleh arthropoda dan lintah yang terinfeksi. Protozoa ini mampu. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
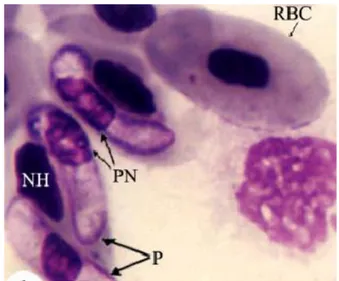
(30) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 14. beradaptasi dengan baik pada inang alami mereka, tetapi dapat menyebabkan penyakit radang klinis yang signifikan apabila pada spesies inang yang tidak biasanya (Keymer, 1981). Siklus hidup Haemogregarina sp. dapat dijelaskan sebagai berikut : pada saat lintah menghisap darah hospes definitif (kura-kura dan katak), zigot dari tubuh lintah akan diinjeksi kedalam tubuh hospes definitif, lalu membentuk sporozoit-sporozoit yang selanjutnya masuk ke dalam eritrosit dan terjadi pembelahan nukleus beberapa kali untuk membentuk merozoit. Selanjutnya merozoit berkembang secara skizogoni (membelah membentuk merozoit baru) pada eritrosit. Beberapa merozoit akan mengalami proses membentuk gametosit untuk menghasilkan mikrogamet dan makrogamet di dalam eritrosit. Pada saat lintah menghisap darah hospes, eritrosit yang telah mengandung mikrogamet dan makrogamet akan melebur untuk membentuk zigot. Kemudian zigot masuk ke tubuh hospes definitif untuk membentuk sporozoit yang baru. Gambar mikroskopis Haemogregarina sp. dapat dilihat pada Gambar 2.2.. Gambar 2.2 Gambaran mikroskopis dari Haemogregarina sp. dengan perbesaran 2200x menggunakan pewarnaan Giemsa. P: Parasite; NH: Nucleus of the host; PN: Nucleus of the parasite; RBC: Red blood cells. Sumber: Al-Farraj (2008).. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(31) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 15. 2.2.2 Cryptosporidium sp. Cryptosporidium sp. pertama sekali ditemukan tahun 1907 oleh Tyzzer dari dalam. lambung. dan. usus. halus. tikus. (Sinambela,. 2008).. Sejak. itu. Cryptosporidium sp. telah diidentifikasi lebih dari 170 spesies yang berasal dari hewan antara lain kalkun, ayam, babi, kuda, domba, anjing, tikus liar, ikan, burung dan reptil. Klasifikasi terdiri dari filum Apicomplexa, kelas Coccidea, ordo Eucoccidiorida, famili Cryptosporidiidae, genus Cryptosporidium, spesies C. baileyi (pada burung), C. felis (pada kucing), C. maleagridis (pada kalkun), C. muris (pada sapi dan tikus), C. nasorum (pada ikan), C. serpentis (pada ular), C. wrairi (pada babi), C. parvum (terdiri dari dua genotype yaitu genotipe I yang menyerang manusia yaitu Cryptosporidium hominis, serta genotipe II yang menyerang manusia, sapi dan mammalia lain (Morgan-Ryan et al., 2002). Cryptosporidium sp. pada biawak air di Indonesia berhasil ditemukan melalui metode PCR (Prabayudha, 2017). Cryptosporidium sp. dimulai ketika ookista matang yang telah mengandung 4 sporozoit ikut tertelan bersama air minum atau sumber air yang telah terkontaminasi feses hospes yang terinfeksi atau dapat juga terhisap dari sekret saluran respirasi hospes terinfeksi. Setelah masuk ke dalam tubuh manusia ookista matang tersebut mengalami ekskistasi. Sporozoit dilepaskan dan menginfeksi sel epitel pada saluran gastrointestinal dan dapat juga pada saluran pernapasan, yang kemudian disebut meront. Kemudian meront tersebut akan mengalami perkembangan aseksual (skizogoni atau merogoni) dan menghasilkan merozoit yang memasuki sel lain. Perkembangan selanjutnya adalah seksual (gametogoni) yang menghasilkan mikrogametosit (jantan) dan makrogametosit (betina) (Smith,. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(32) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 16. 2009). Mikrogametosit dan makrogametosit ini akan berkembang menjadi mikrogamet dan makrogamet yang selanjutnya akan fertilisasi menghasilkan ookista yang mengandung 4 sporozoit. Ookista yang dihasilkan, berukuran diameter 4-6 µm, terdiri dari 2 jenis yaitu ookista berdinding tebal yang akan diekskresikan dari hospes bersama feses dan ookista berdinding tipis yang umumnya berperan dalam terjadinya autoinfeksi dengan mengeluarkan sporozoit di dalam usus pada tubuh hospes (Smith, 2009). Menurut Smith (2009), ookista yang diekskresikan tersebut infektif yang akan menimbulkan infeksi secara langsung dan cepat melalui transmisi fekal-oral. Masa prepaten, yaitu waktu antara infeksi dan pengeluaran ookista berkisar antara 5-21 hari. Ookista dapat ditemukan pada feses hospes kira-kira sebulan atau lebih setelah hospes terinfeksi. Gambar ookista Cryptosporidium sp. dapat dilihat pada Gambar 2.3.. Gambar 2.3 Gambaran mikroskopis dari ookista Cryptosporidium sp. dengan perbesaran 400x menggunakan pewarnaan modifikasi tahan asam. Sumber: Martinez and Belda (2001).. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(33) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 17. 2.2.3 Eimeria sp. Beberapa spesies Eimeria dapat ditemukan di saluran pencernaan, menyebabkan penyakit coccidiosis yang ditransmisikan melalui rute fekal-oral. Eimeria sp. pada reptil biasanya tidak patogen, namun faktor predisposisi seperti stres, pakan, gangguan pencernaan, dan infeksi sekunder membuat protozoa tersebut patogen. Eimeria sp. memiliki siklus hidup langsung tanpa perantara Eimeria sp. pada stadium ookista mempunyai empat sporokista, masing-masing sporokista mengandung dua sporozoit. Stadium ookista ditemukan pada feses, karena pada siklus hidupnya ookista tersebut keluar dari usus kemudian terbawa oleh feses. Umumnya stadium ookista berbentuk bulat, ovoid, atau ellipsoid dengan ukuran yang beragam sesuai dengan spesiesnya. Dinding kista terdiri dari dua lapis yang berbatas jelas (Levine, 1995). Siklus hidup Eimeria sp. dimulai dari tertelannya ookista infektif yaitu ookista yang sudah bersporulasi. Selanjutnya di dalam usus hospes, dinding ookista pecah karena proses pencernaan sehingga menyebabkan keluarnya sporokista. Kemudian sporokista membebaskan sporozoit yang akan bergerak bebas menembus sel epitel usus halus. Eimeria sp. mengalami reproduksi seksual dan aseksual di dalam sel epitel usus. Sporozoit di dalam epitel usus halus menjadi meront atau skizon generasi pertama. Suatu proses reproduksi aseksual atau skizogoni, setiap meront akan membentuk 900 merozoit yang panjangnya masing-masing dua sampai tiga mikrometer. Selanjutnya meront generasi pertama membentuk 200-350 merozoit dengan panjang sekitar 16 μm dengan cara pembelahan banyak. Merozoit generasi kedua masuk ke dalam sel hospes baru dan memulai fase seksual atau gametogoni. Beberapa dari merozoit tersebut akan. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
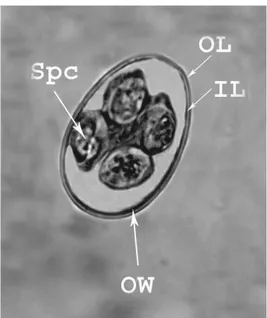
(34) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 18. berkembang menjadi makrogamet (gamet betina) dan sisanya berkembang menjadi mikrogamet (gamet jantan). Mikrogamet akan membuahi makrogamet akan terbentuk zigot yang selanjutnya berkembang menjadi ookista. Selanjutnya ookista keluar dari sel hospes menuju lumen usus dan terbawa bersama feses hospes (Levine, 1995). Diagnosa. coccidiosis. dilakukan. melalui. pemeriksaan. feses. untuk. menemukan ookista. Jika dalam pemeriksaan ditemukan ookista, maka sampel feses didiamkan selama satu sampai tiga hari agar terjadi sporulasi untuk mempermudah identifikasi bentuk ookista Eimeria sp.. Gambar ookista Eimeria sp. dapat dilihat pada Gambar 2.4.. Gambar 2.4 Morfologi ookista Eimeria sp. yang sudah bersporulasi dengan perbesaran 1600x. Spc: Sporocyst, OL: Outer layer of oocyst wall, OW: Oocyst wall, IL: Inner layer of oocyst wall. Sumber: AbdelAziz et al. (2019).. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(35) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. BAB 3 MATERI DAN METODE PENELITIAN. 3.1. Jenis dan Rancangan Penelitian Jenis penelitian ini adalah survei dengan rancangan penelitian cross. sectional. Parasit yang didapat dicatat dan dideskripsikan sesuai dengan distribusi, yaitu pada bagian darah dan saluran pencernaan.. 3.2. Sampel Penelitian Sampel penelitian yang didapat dari tempat pemotongan biawak di Sidoarjo. adalah 50 ekor biawak masing-masing berupa sampel darah dan feses. Sampel kemudian diberi nomor dan tanggal pengambilan sampel.. 3.3. Tempat dan Waktu Penelitian Pengambilan sampel dilaksanakan di pemotongan biawak Kecamatan. Buduran, Kabupaten Sidoarjo. Pemeriksaan sampel dilakukan di Laboratorium Departemen Parasitologi Fakultas Kedokteran Hewan Universitas Airlangga. Penelitian ini dilakukan pada bulan Maret – Juni 2019.. 3.4. Materi Penelitian. 3.4.1 Bahan penelitian Bahan pemeriksaan darah menggunakan sampel darah biawak yang diambil dari peternakan biawak di kecamatan Buduran, Sidoarjo. Bahan lain yang digunakan untuk pemeriksaan yaitu metanol absolut, pewarna Giemsa 20%,. 19 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(36) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 20. akuades dan oil emersi. Pada pemeriksaan feses dibutuhkan bahan berupa sampel feses biawak, larutan kalium bikromat sebagai media transport, larutan sukrosa 40%, akuades, carbol fuchsin 0,3%, asam alkohol 3%, malachite green 0,3 %. 3.4.2 Alat penelitian Alat pada pemeriksaan darah menggunakan object glass, cover glass, boks penyimpanan, staining jar, tabung EDTA, dan mikroskop. Alat yang dibutuhkan untuk pemeriksaan feses antara lain, pot salep sebagai tempat sampel feses, kertas label untuk melabeli dan memberi keterangan sampel yang sudah diambil. Selain itu alat-alat yang digunakan adalah lidi atau gelas pengaduk, saringan teh, pipet, kaca obyek, kaca penutup, mikroskop, tabung sentrifus, alat sentrifus, rak tabung, sarung tangan dan masker.. 3.5. Prosedur Penelitian. 3.5.1 Metode pemeriksaan darah Sampel darah diambil dari darah yang mengalir setelah biawak dipotong pada bagian leher dan ditampung menggunakan tabung EDTA 3 ml. Kemudian tabung EDTA digoyangkan membentuk angka 8 agar darah tercampur dengan larutan EDTA sehingga tidak menggumpal. Sampel darah yang sudah diambil diteteskan ke satu object glass dengan posisi mendatar. Object glass dipegang dengan ibu jari dan telunjuk tangan kiri. Kemudian object glass lain yang ujungnya rata dipegang dengan tangan kanan, object glass pada tangan kanan disentuhkan pada tetesan darah sehingga darah pada object glass yang berada di tangan kiri menyebar pada ujung object glass tangan kanan. Object glass pada tangan kanan dimiringkan dengan kemiringan 30-45o terhadap object glass pada. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(37) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 21. tangan kiri, dan object glass pada tangan kanan didorong sehingga darah terhapus secara tipis. Hapusan dikeringkan dengan cara diangin-anginkan pada suhu kamar. Kemudian hapusan darah diberi label. Menurut Suwanti dkk. (2011) cara membuat pewarnaan ulas darah dengan pewarnaan Giemsa diawali dengan memfiksasi hapusan darah ke dalam larutan methanol absolut selama 3 menit. Kemudian hapusan darah dimasukkan ke dalam larutan Giemsa 10 – 20 % selama 30 menit. Preparat diangkat dan dicuci dengan air mengalir sampai air cucian bening. Ulas darah dikeringkan dengan meletakkan object glass posisi berdiri pada bidang miring atau diangin-anginkan. 3.5.2 Metode pemeriksaan feses a). Metode natif Akuades diteteskan di atas object glass sebanyak dua tetes. Sampel feses. diambil menggunakan tusuk gigi dan oleskan di atas object glass yang telah ditetesi akuades. Sampel dan akuades dihomogenkan menggunakan tusuk gigi. Setelah feses dan akuades homogen, campuran homogen tersebut ditutup dengan cover glass. Preparat diperiksa di bawah mikroskop (Taylor et al., 2007). b). Metode apung sukrosa (sucrose flotation method) Feses biawak disimpan di pot sampel tanpa tutup kemudian dibiarkan. selama tiga hari untuk menemukan ookista yang sudah bersporulasi.. Feses biawak sebanyak 3 gram, ditambahkan air sehingga volume 15 ml. Larutan diaduk sehingga homogen dan di diamkan selama 15 menit. Larutan disaring dan disentrifugasi dengan kecepatan 1800 rpm selama 10 menit. Kemudian endapan dibiarkan dan supernatan dibuang. Sesuai dengan metode (Dubey, 1972), hasil endapan di tambahkan dengan larutan sukrosa 40% hingga 30 ml. Setelah. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(38) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 22. dicampur, larutan kembali di sentrifugasi selama 10 menit. Supernatan yang terbentuk diambil sebanyak 1 cc pada setiap tabung kemudian di periksa di bawah mikroskop perbesaran 400x. c). Metode Pewarnaan Modifikasi Tahan Asam (Modified Ziehl Neelsen) Sediaan sampel diletakkan dengan bagian apusan feses menghadap ke atas. pada rak pengecatan dengan jarak 1 jari antara satu sediaan dengan sediaan lainnya. Fiksasi sediaan dengan methanol absolute. Carbol fuchsin 0,3% dituang melalui kertas saring sampai menutupi seluruh permukaan sediaan dan didiamkan hingga kering. Sesudah kering sediaan dibilas dengan air suling secara hati-hati. Selanjutnya sediaan dituangi dengan asam alkohol 3% sampai semua warna merah fuchsin luntur. Kemudian sediaan dibilas kembali dengan air mengalir. Sediaan yang sudah terbilas dituang malachite green 0,3% selama 10-20 detik. Sediaan dibilas dengan air mengalir secara hati-hati dan dikeringkan pada rak pengering. Pemeriksaan sediaan menggunakan mikroskop dengan perbesaran 400x dan 1000x (Beauty et al., 2014).. 3.6 Analisis Data Data yang diperoleh dari hasil identifikasi protozoa pada darah dan saluran pencernaan biawak air melalui pemeriksaan darah dan feses disajikan secara deskriptif.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(39) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 23. 3.7 Kerangka Penelitian Alur penelitian ini dapat dijelaskan melalui diagram alir berikut ini: Pengambilan sampel darah dan saluran pencernaan biawak di tempat pemotongan biawak di Sidoarjo. Pemeriksaan di Laboratorium (Departemen Parasitologi FKH Unair). Pembuatan preparat pemeriksaan darah dan pemeriksaan feses. Pemeriksaan dengan mikroskop. Positif. Negatif. Identifikasi sampel. Penyajian data Gambar 3.1 Diagram alir. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
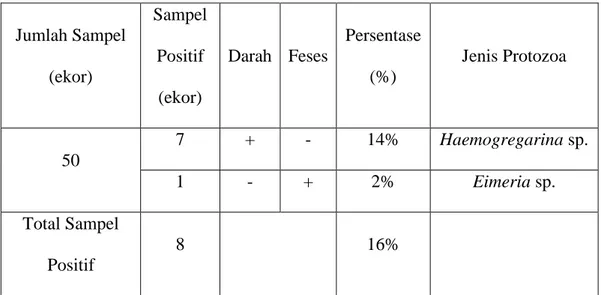
(40) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. BAB 4 HASIL PENELITIAN. 4.1 Identifikasi protozoa pada darah dan saluran pencernaan biawak yang di peroleh dari tempat pemotongan biawak di Sidoarjo Pemeriksaan protozoa pada 50 ekor biawak air yang didapat dari tempat pemotongan biawak di Sidoarjo selama bulan Maret-Juni 2019 telah ditemukan dua macam jenis protozoa antara lain satu genus protozoa darah yaitu Haemogregarina sp., dan satu genus protozoa dari saluran pencernaan yaitu Eimeria sp.. Infeksi protozoa pada penelitian ini tergolong infeksi tunggal, yaitu satu ekor biawak hanya terinfeksi satu jenis protozoa. Identifikasi pada penelitian ini masih terbatas pada tingkatan genus yang diamati di bawah mikroskop berdasarkan morfologi yang disesuaikan dengan beberapa buku dan jurnal terkait serta konsultasi dengan dosen pembimbing dan dosen protozoologi. Tabel 4.1 menyajikan hasil protozoa yang ditemukan dari sampel darah dan feses dari 50 ekor biawak yang diamati. Tabel 4.1 Hasil Pemeriksaan Protozoa pada Biawak Air. Sampel Jumlah Sampel. Persentase Positif. Darah Feses. (ekor). Jenis Protozoa (%). (ekor) 7. +. -. 14%. Haemogregarina sp.. 1. -. +. 2%. Eimeria sp.. 50. Total Sampel 8. 16%. Positif Keterangan: (+) Protozoa ditemukan, (-) Protozoa tidak ditemukan.. 24 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
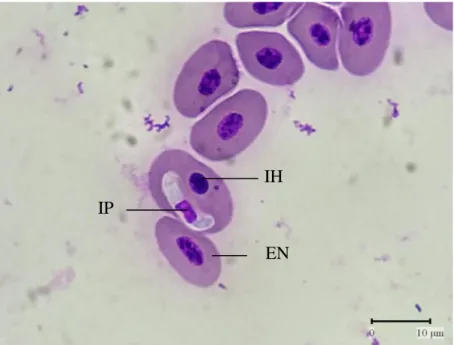
(41) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 25. Berdasarkan tabel di atas menunjukkan bahwa didapatkan hasil 14% positif Haemogregarina sp. dan 2% positif Eimeria sp., sehingga total persentase sampel positif protozoa sebesar 16%. Hasil pemeriksaan lengkap dapat dilihat pada Lampiran 1. Pada pemeriksaan ulas darah pada biawak terlihat protozoa dari Haemogregarina sp. berbentuk lonjong seperti sosis, berwarna pucat dengan inti lebih gelap, terletak di dalam sitoplasma eritrosit dan mendesak inti eritrosit hingga ke tepi. Haemogregarina sp. ditemukan pada tujuh ekor dari 50 ekor biawak yang diamati, sehingga persentase positif Haemogregarina sp. adalah 14%. Gambaran Haemogregarina sp. dapat dilihat pada Gambar 4.1. Hasil pengukuran Haemogregarina sp. dengan perbesaran 1000x dapat dilihat pada Gambar 4.2.. IH IP EN. Gambar 4.1 Haemogregarina sp. pada pemeriksaan mikroskopis dengan perbesaran 1000x. EN: Eritrosit normal, IH: Inti hospes, IP: Inti Protozoa.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(42) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 26. Gambar 4.2 Hasil pengukuran Haemogregarina sp. pada pemeriksaan mikroskopis dengan perbesaran 1000x. Protozoa yang ditemukan dari saluran pencernaan biawak adalah Eimeria sp.. Pemeriksaan feses biawak melalui metode natif didapatkan ookista Eimeria sp. yang telah bersporulasi dengan empat sporokista masing-masing berisi dua sporozoit, berbentuk ovoid, dan memiliki dinding yang berbatas jelas. Eimeria sp. ditemukan pada satu ekor dari 50 ekor biawak yang diamati, sehingga persentase positif Eimeria sp. adalah 2%. Gambaran Eimeria sp. dapat dilihat pada Gambar 4.3. Hasil pengukuran Eimeria sp. perbesaran 400x dapat dilihat pada Gambar 4.4.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(43) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 27. SK D. Gambar 4.3 Eimeria sp. pada pemeriksaan mikroskopis dengan perbesaran 400x. SK: Sporokista, D: Dinding Ookista.. Gambar 4.4 Hasil pengukuran Eimeria sp. perbesaran 400x pada sampel feses biawak.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
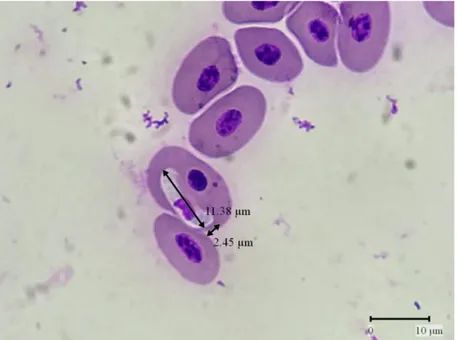
(44) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. BAB 5 PEMBAHASAN. Berdasarkan hasil penelitian pada 50 ekor biawak yang diambil dari tempat pemotongan biawak di Sidoarjo, didapatkan tujuh ekor biawak positif (14%) Haemogregarina sp. dan satu ekor biawak positif Eimeria sp. (2%), sehingga jumlah biawak yang terinfeksi protozoa bersifat tunggal sebanyak 8 ekor (16%). Jumlah tersebut lebih tinggi daripada penelitian yang sudah pernah dilakukan sebelumnya oleh Hanafiah dkk. (2018) di Banda Aceh yang melaporkan tidak ditemukan adanya protozoa pada biawak. Perbedaan tersebut kemungkinan disebabkan karena perbedaan kondisi wilayah, dimana biawak hidup, umur, serta waktu penelitian yang berbeda pada biawak yang diteliti. Menurut Wilson and Carpenter (1996), kerentanan hewan terhadap parasit dapat disebabkan antara lain, kapasitas penangkaran, suhu lingkungan, kebersihan, musim, jumlah parasit, ketersediaan hospes, serta gizi dan usia hospes. Protozoa yang paling banyak ditemukan adalah Haemogregarina sp.. Spesies ini terlihat pada pemeriksaan ulas darah dengan pewarnaan Giemsa. Gamont Haemogregarina sp. tampak berbentuk lonjong seperti sosis yang terletak di dalam eritrosit, parasit berwarna pucat dengan inti gelap keunguan, mendesak inti eritrosit hingga ke tepi. Karakteristik tersebut sesuai dengan penelitian yang dilakukan Tomé et al. (2018), Haemogregarina sp. merupakan parasit intraeritrositik yang berbentuk memanjang dengan inti parasit berwarna gelap, dan parasit mendesak inti eritrosit. Hasil pengukuran Haemogregarina sp. pada penelitian ini adalah 11,38 x 2,45 µm. Pengukuran tersebut sesuai dengan rata-rata. 28 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(45) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 29. ukuran gamont pada penelitian Rabie and Hussein (2014), yaitu (10−12.1) × (2.2−4.4) µm. American Association of Zoo Veterinarians (AAZV) menyebutkan bahwa Haemogregarina sp. ditularkan melalui gigitan vektor, sehingga kontak langsung antar hewan bukan merupakan faktor risiko infeksi (AAZV, 2013). Salah satu ektoparasit, yaitu tungau dari genus Ophionyssus berperan sebagai vektor dalam siklus hidup Haemogregarina sp. (Bannert et al., 1995). Habitat biawak pada lingkungan yang kotor memungkinkan biawak mudah terinfestasi ektoparasit tersebut, sehingga biawak memiliki peluang untuk terinfeksi Haemogregarina sp. melalui tungau Ophionyssus sp. Musim pengambilan sampel juga berpengaruh pada penyebaran parasit. Pengambilan sampel dilakukan pada bulan Maret-Juni saat musim hujan, sehingga kelembaban di pemotongan biawak Sidoarjo menjadi tinggi. Kelembaban yang tinggi merupakan faktor yang cocok untuk perkembangan parasit (Subronto, 2006) Infeksi Haemogregarina sp. pada reptil tidak dapat menular terhadap manusia. Reptil yang terinfeksi Haemogregarina sp. pada umumnya tidak menimbulkan gejala klinis, namun reptil dengan parasitemia yang tinggi dapat mengalami anemia ringan hingga lemas dan anoreksia (AAZV, 2013). Di dalam penelitian Abdel-Aziz et al. (2019), teridentifikasi ookista Eimeria sp. dengan karakteristik terdapat empat sporokista yang dilengkapi dengan dua sporozoit, berbentuk ovoid, memiliki mikropil, ukuran ookista bervariasi (23,7– 30,5) × (16,7–24,6) µm. Sporulasi terjadi dalam waktu 72 jam pada suhu kamar. Karakteristik tersebut sesuai dengan Eimeria sp. yang ditemukan melalui pemeriksaan natif pada penelitian ini, yaitu tampak ookista yang sudah. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(46) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 30. bersporulasi berisi empat sporokista, ukuran 31,96 – 32,25 µm, tanpa mikropil, dan memiliki bentuk ovoid. Perbedaan keberadaan mikropil kemungkinan disebabkan karena perbedaan jenis Eimeria pada biawak. Faktor lain yang mempengaruhi ada atau tidaknya mikropil dapat disebabkan karena perbedaan geografis dari hospes (Abdel-Aziz, 2019). Penyebaran Eimeria sp. bergantung dengan suhu, kelembaban, manajemen perawatan dan kebersihan lingkungan. Penelitian ini dilakukan ketika musim hujan dimana suhu lingkungan rendah dan kelembaban tinggi, sehingga kemungkinan timbul adanya infeksi Eimeria sp. pada biawak. Manajemen perawatan dan kebersihan lingkungan biawak tidak terkontrol karena biawak yang digunakan pada penelitian ini berasal dari tangkapan liar. Rendahnya prevalensi Eimeria sp. yang berkaitan pada faktor-faktor seperti, suhu, kelembaban, dan manajemen lingkungan diperlukan adanya penyelidikan yang lebih teliti terhadap Eimeria sp. Eimeria sp. merupakan penyebab coccidiosis pada reptil dan tidak bersifat zoonosis terhadap manusia. Coccidiosis yang disebabkan infeksi Eimeria sp pada reptil biasanya tidak patogen, namun faktor predisposisi seperti stres, pakan, gangguan pencernaan, dan infeksi sekunder membuat protozoa tersebut patogen. Reptil yang mengalami coccidiosis berat biasanya ditandai dengan anoreksia, penurunan berat badan, dan diare yang disertai darah (Raś-Noryńska, 2015). Tidak ditemukan protozoa lain khususnya yang bersifat zoonosis seperti, Cryptosporidium sp. dan Giardia sp. Pemeriksaan Cryptosporidium sp. pada penelitian ini dilakukan dengan menggunakan metode apung sukrosa dan modifikasi pewarnaan tahan asam (Modified Ziehl-Neelsen) pada feses biawak.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(47) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 31. Cryptosporidium sp. yang memiliki ukuran kecil kemungkinan menjadi penyebab terlewatkannya identifikasi saat diperiksa menggunakan mikroskop, sehingga diperlukan metode lanjutan yang lebih mendalam seperti PCR (Polymerase Chain Reaction) agar Cryptosporidium sp. teridentifikasi (Robinson et al., 2008). Hasil identifikasi Giardia sp. yang dilakukan melalui metode natif pada feses biawak adalah negatif. Pemeriksaan melalui metode yang lain diperlukan untuk menemukan Giardia sp. pada biawak, salah satunya dengan melakukan swab. mukosa. menggunakan. saluran mikroskop. pencernaan. bagian. (Raś-Noryńska. bawah. and. Sokół,. kemudian 2015).. diperiksa Uji. IFA. (Immunofluorescence Assay) dapat digunakan untuk mengidentifikasi kista Giardia sp., karena uji IFA memiliki spesifisitas dan sensitivitas yang tinggi dalam mendeteksi Giardia sp. (El-Nahas et al., 2012).. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(48) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. BAB 6 KESIMPULAN DAN SARAN. 6.1 Kesimpulan Berdasarkan hasil penelitian, maka dapat diambil kesimpulan bahwa jenis protozoa yang ditemukan pada darah dan saluran pencernaan biawak air adalah Haemogregarina sp. dan Eimeria sp.. 6.2 Saran Penelitian ini merupakan penelitian dasar berupa sebuah proses identifikasi. Penelitian lanjutan diperlukan untuk mengetahui protozoa pada biawak air yang belum ditemukan, serta untuk identifikasi yang lebih spesifik hingga ke tingkat spesies dengan PCR dan sekuensing.. 32 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(49) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. DAFTAR PUSTAKA [AAZV] American Association of Zoo Veterinarians. 2013. Haemogregarines of Reptiles.www.aazv.org/resource/resmgr/IDM/IDM_Hemogregarines_of_R eptil.pdf. [8 Juli 2019] Abdel-Aziz, A., F. M. Abou-Senna, M. A. Abdel-Gawad, and M. F. A. El-Nour. 2019. A new species of Eimeria (Apicomplexa: Eimeriidae) from the desert monitor, Varanus griseus griseus (Lacertilia: Varanidae). www.researchgate.net /publication/334224688. [8 Agustus 2019]. Al-Farraj, S. 2008. Light and electron microscopic study on a Haemogregarina sp. infecting viper cerastes cerastes gasperitti from Saudi Arabia. Pakistan J. Biol. Sci. 11: 141-142 Banks, R. C. 2004. Varanus indicus (Daudin, 1802). http://www.itis.gov/servlet/ SingleRpt/SingleRpt?search_topic=TSN&search_vaval=174116. [1 Desember 2018]. Bannert, B., E. Lux, and J. Sedlaczek. 1995. Studies on endo and ectoparasites of Canarian Lizards. Sci. Herp. 1995: 293–296. Barten, S.L. 1996. Section II lizards. Di dalam: Mader D. R., editor. Reptile Medicine and Surgery. W.B. Saunders Company. USA: 48-49, 52. Bennett, D. 2007. Varanus indicus (reptile). http://www.issg.org/database/spesies/ecology.asp?si=1065&fr=1&sts=&lan g=EN. [22 September 2018]. Bennett, D and S.S. Sweet. 2010. Varanus indicus. The IUCN Red List of Threatened Species 2010. http://www.iucnredlist.org/details/178416/0. [22 September 2018]. Beauty, E.O., U.N. Uchechukwu, S.U. Chukwuneke and O.O. Francis. 2014. Comparative diagnostic techniques for Cryptosporidium infection. J. Molecules. 19: 2674-2683. Carmena, D. 2010. Waterborne transmission of Cryptosporidium and Giardia: detection, surveillance and implications for public health. Di dalam: Méndez-Vilas, editor. Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology 1. Formatex Research Center. UK. p. 3-14.. 33 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(50) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 34. Chia, M. Y., C. R. Jeng, S. H. Hsiao, A. H. Lee, C. Y. Chen and V. F. Pang. 2009. Entamoeba invadens myositis in a common water monitor lizard (Varanus salvator). Vet. Pathol. 46: 673–676. [CITES] Convention of International Trade in Endangered Spesies of Wild Fauna and Flora. 2013. Appendices I, II, III. http:// www.cites.org/eng/app/appendices.php. [1 Oktober 2018]. Cook, C. A., E. C. Netherlands, and N. J. Smit. 2016. Redescription, molecular characterisation and taxonomic re-evaluation of a unique African monitor lizard haemogregarine Karyolysus paradoxa (Dias, 1954) n. comb. (Karyolysidae). Parasite Vect. 9(1): 347. Dalton, C., R. Hoffman and J. Pope. 1995. Iguana-associated salmonellosis in children. Pediatr. Infect. Dis. J. 14: 319–320. DeNardo, D. F. 1996. Reproductive biology. Di dalam: Mader D. R., editor. Reptile Medicine and Surgery. W.B. Saunders Co. USA. p. 212-214, 220, 223-224, 370-371. Dubey, J. P. 1972. A simplified method for isolation of Toxoplasma gondii from the faces of cats. J. Parasitol. 58: 1005-1007. El-Nahas, H. A., D. A. Salem, A. A. El-Henawy, H. I. El-Nimr, H. A. AbdelGhaffar, and A. M. El-Meadawy. 2013. Giardia diagnostic methods in human fecal samples: A comparative study. Clinic. Cytomet. 84B(1): 4449. Hanafiah, M., H. D. Alfiansyah, A. Sayuti. 2018. Identifikasi parasit pada biawak air (Varanus salvator). Jurnal Sain Veteriner. 36(1): 24-31. Hardiansyah, F. S. N. 2014. Protozoa Parasitik Darah dan saluran pencernaan pada ular sawah (Ptyas corros) di kabupaten Ngawi. [Skripsi]. Fakultas Kedokteran Hewan. Institut Pertanian Bogor. Hulu, A. 2011. Rendang biawak, kuliner ekstrem nan lezat. http://www.niasbangkit.com/2011/04/rendang-biawak-kuliner-ekstrem-nan-lezat/. [21 September 2011]. Iyai, D.A. dan F. Pattiselanno. 2006. Diversitas dan ekologi biawak (Varanus indicus) di pulau pepaya taman nasional teluk cenderawasih, Irian Jaya Barat. Biodiversitas. 7(2):181-186.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(51) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 35. Jacobson, E. R. 1983. Parasitic diseases of reptiles. Di dalam: Krik R. W., editor. Current Veterinary Therapy 8: Small Animal Practice. W. B. Saunders Co. Philadelphia. p. 601. Jòzsef, Özvegy, M. Darko, V. Miloš , G.Bojan , S. Jevrosima ,K. Dejan, A. K. Sanja. 2015. Cytological and molecular identification of Haemogregarina stepanowi in blood samples of the European pond turtle (Emys orbicularis) from quarantine at Belgrade Zoo. Acta Vet. Beograd. 65 (4): 443-453. Kahn, C.M. and S. Line. 2010. The Merck Veterinary Manual. 10th Ed. Merck & Co., Inc. USA. p. 1768. Keymer, I. F. 1981. Protozoa in Diseases of Reptiles. Vol. 1, Cooper JE and Jackson OF (Eds.). Academic Press. New York. p. 169. Koch, A., M. Auliya, A. Schmitz, U. Kuch and W. Böhme. 2007. Morphological studies on the systematics of Southeast Asian water monitors (Varanus salvator complex): nominotypic populations and taxonomic overview. J. Mertensiella. 16: 109–180. Levine, N. D. 1990. Buku Pelajaran Parasitologi Veteriner (terjemahan). Alih bahasa: G. Ashadi. Buku Pelajaran Parasitologi Veteriner. Gadjah Mada University Press. Yogyakarta. p. 147 -150, 420-424, 521. Levine, N. D. 1995. Protozoologi Veteriner (terjemahan). Alih bahasa: Soekardono, S. Gadjah Mada University Press. Yogyakarta. Mader, D. R. 1996. Section IV Medicine Parasitology. Di dalam: Mader D. R., editor. Reptile Medicine and Surgey. W.B. Saunders Company. USA. p. 343-364. Mardiastuti, A. dan T. Soehartono. 2003. Perdagangan reptil Indonesia di pasar internasional dalam konservasi amfibi dan reptil di Indonesia. Prosiding Seminar Hasil Penelitian Departemen Konservasi Sumberdaya Hutan. Institut Pertanian Bogor. Bogor. p.131-144. Martinez, I. and F.M Belda. 2001. Contribution To The Laboratory Diagnosis Of Human Cryptosporidiosis. Institute Tropical Medicine. Sao Paulo. p.79-82. Murray, M.J. 1996. Section VI specific diseases and conditions pneumonia and normal respiratory function. Di dalam: Mader D. R., editor. Reptile Medicine and Surgery. W. B. Saunders Company. USA. p. 400.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(52) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 36. Morgan-Ryan, U.M., A. Fall, L.A. Ward, N. Hijjawi, I. Sulaiman, R. Fayer, R.C. Thompson, M. Olson, A. Lal and L. Xiao. 2002. Cryptosporidium hominis sp. (Apicomplexa: Cryptosporidiidae) from Homo sapiens. J. Eu. Microbiol. 49: 433–440. Natadisastra, D. dan R. Agoes. 2009. Parasitologi Kedokteran Ditinjau dari Organ Tubuh yang Diserang. EGC. Jakarta. Prabayuda, F. D. 2017. Identifikasi Cryptosporidium sp. pada Biawak Air (Varanus salvator) yang didapat di Surabaya [Tesis]. Fakultas Kedokteran Hewan. Universitas Airlangga. Rabie, S. A. H. and A. A. Hussein. 2014. A description of haemogregarina species naturally infecting white-spotted gecko (Tarentola annularis) in Qena, Egypt. 44(2): 351-358. Ramadhan, R.A. 2011. Ragam Jenis Ektoparasit dan Manajemen Penangkaran Biawak [Skripsi]. Fakultas Kehutanan. Institut Pertanian Bogor. Raś-Noryńska, M. and R. Sokół. 2015. Internal parasites of reptiles. Ann. Parasitol. 61(2): 115-117. Roberts, L.S., J. Janovy, D. S. Gerald, S. Larry and Roberts. 2005. Foundations of Parasitology. 7th. The Mc Graw- Hill Companies. New York. p. 141. Robinson G., K. Elwin, R. M. Chalmers. 2008. Unusual Cryptosporidium Genotypes in Human Cases of Diarrhea. Emer. Infect. Dis. 14: 1800-1802. Shazly, M. A. 1994. Electron microscopic studies on the Gamogony and sporogony of Hepatozoon najae n. comb, inside the vector Culex pipiens. J. Egypt Ger. Soc. Zool. 195-211. Shine, R., P.S. Harlow, J.S. Keogh, and Boeadi. 1996. Commercial harvesting of giant lizards: the biology of water monitors Varanus salvator in Southern Sumatra. Biol. Cons. 77: 125-134. Sopha, P. 2018. Risiko Penularan Zoonosis Parasitik pada Mahasiswa Kedokteran Hewan. https://www.researchgate.net/publication/323768393. [8 Agustus 2019]. Sinambela A. H. 2008. Cryptosporidiosis. US e-Respository. Departemen Parasitologi Fakultas Kedokteran Universitas Sumatera Utara.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(53) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 37. Smith, S. 2009. Cryptosporidiosis. Parasites and Pestilence. HumBio: 153. Steel, R. 1996. Living Dragons. a Natural History of the World’s Monitor Lizards. Ralph Curtis Books, Sanibel Island. Subronto. 2006. Penyakit Infeksi Parasit dan Mikroba pada Anjing dan Kucing. Gadjah Mada University Press. Yogyakarta. Suwanti, L. T., N. D. R. Lastuti, Mufasirin, dan E. Suprihati. 2011. Petunjuk dan Laporan Praktikum Ilmu Penyakit Protozoa. Departemen Parasitologi Fakultas Kedokteran Hewan Universitas Airlangga. Surabaya. Tampubolon, M. P. 2004. Protozoologi. Pusat Studi Ilmu Hayati Institut Pertanian Bogor. Bogor. Taylor, M.A., R. L. Coop, and R. L. Wall. 2007. Veterinary Parasitology. 3rd. Blackwell Publishing Ltd. UK. p. 798. Tomé, B., A. Pereira, D. J. Harris, M. A. Carretero, and A. Perera. 2019. A paradise for parasites? Seven new haemogregarine species infecting lizards from the Canary Islands. J. Parasitol. 1–12. Upton, S. J., and C. A. Zien. 1997. Description of a Giardia varani-like flagellate from a water monitor, Varanus salvator, from Malaysia. J. Parasitol. 83(5): 970. Wilson, B. 2010. Lizards. Di dalam: Ballard BM, Cheek R, editor. Exotic Animal Medicine for the Veterinary Technician. 2nd. Blackwell Publishing Professional. UK. p. 76-84, 87-90, 104-106. Wilson S. C. and J. W. Carpenter. 1996. Endoparasitic diseases of reptiles. Seminars Avian Exo. Pet Med. 5: 64-74. Yudhastuti, R. 2012. Penyakit Bersumber Binatang dan Pengendaliannya. Pustaka Melati. Surabaya. p. 5. Zaman, V. 1997. Atlas Parasitologi Kedokteran II. Hipokrates. Jakarta.. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(54) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. DAFTAR LAMPIRAN Lampiran 1. Data Jenis Protozoa pada Biawak Air. Jenis Protozoa No. Biawak Darah. Saluran pencernaan. 1. -. -. 2. -. -. 3. -. -. 4. -. -. 5. -. -. 6. -. -. 7. -. -. 8. -. -. 9. Haemogregarina sp.. -. 10. -. -. 11. -. -. 12. -. -. 13. -. -. 14. -. -. 15. Haemogregarina sp.. -. 16. Haemogregarina sp.. -. 17. Haemogregarina sp.. -. 18. -. -. 19. -. -. 20. -. -. 38 SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(55) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. SKRIPSI. 39. 21. Haemogregarina sp.. -. 22. -. -. 23. -. -. 24. -. -. 25. -. -. 26. -. -. 27. -. -. 28. Haemogregarina sp.. -. 29. Haemogregarina sp.. -. 30. -. -. 31. -. -. 32. -. -. 33. -. -. 34. -. Eimeria sp.. 35. -. -. 36. -. -. 37. -. -. 38. -. -. 39. -. -. 40. -. -. 41. -. -. 42. -. -. 43. -. -. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(56) IR - PERPUSTAKAAN UNIVERSITAS AIRLANGGA. 40. 44. -. -. 45. -. -. 46. -. -. 47. -. Eimeria sp.. 48. -. -. 49. -. Eimeria sp.. 50. -. -. Keterangan: (-) Protozoa tidak ditemukan. SKRIPSI. IDENTIFIKASI PROTOZOA PADA.... AZIZAH BILQIS NURKARIMAH.
(57)
Gambar


Garis besar
Dokumen terkait
Penelitian ini bertujuan untuk mengetahui prevalensi dan identifikasi jenis cacing nematoda pada saluran pencernaan kerbau lumpur di Kecamatan Sambelia, Lombok
Berdasarkan jenis kelamin, dari 55 sampel Anjing Kintamani Bali berjenis kelamin jantan, 6 diantarannya positif terinfeksi protozoa saluran pencernaan dengan prevalensi
Dengan ini saya menyatakan bahwa skripsi dengan judul Identifikasi Cacing Parasitik dan Bakteri pada Insang dan Saluran Pencernaan Ikan Nila Hitam (Oreochromis niloticus)
Skripsi yang berjudul Identifikasi Bakteri Saluran Pencernaan Lumba-lumba Hidung Botol Indo-Pasifik ( Tursiops aduncus ) disusun berdasarkan hasil penelitian pada
Adapun tujuan dari penulisan ini adalah Segmentasi Citra Magnetic Resonance Imaging (MRI) Abdomen Untuk Identifikasi Polip Pada Saluran Pencernaan Dengan
Perlu dilakukan pengendalian penyakit yang disebabkan oleh infeksi protozoa saluran pencernaan pada Anjing Kintamani Bali yang bermanfaat untuk kesehatan anjing tersebut
Hasil penelitian menunjukkan bahwa bakteri probiotik dalam saluran pencernaan Colossoma macropomum terdiri dari Enterococcus facealis, Stapylococcus saprophyticus,
Skripsi yang berjudul Identifikasi Bakteri Saluran Pencernaan Lumba-lumba Hidung Botol Indo-Pasifik (Tursiops aduncus) disusun berdasarkan hasil penelitian pada