Kompleks-Kompleks Gadolinium (Gd(III)) Untuk
MRI Contrast Agent: Studi Komputasi
Metode Mekanika Molekul
Karya Tulis Ilmiah
Oleh:
Rustaman
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS PADJADJARAN
Kompleks-Kompleks Gadolinium (Gd(III)) Untuk
MRI Contrast Agent: Studi Komputasi
Metode Mekanika Molekul
Karya Tulis Ilmiah
Oleh:
Rustaman
Mengetahui/Menyetujui: Ketua Jurusan Kimia FMIPA Unpad,
Daftar Isi
Daftar Isi ... i
Abstrak ... 1
1. Pendahuluan ... 1
2. Metode komputasi... 6
2.1. Pengembangan medan gaya ... 6
2.2. Coordination Scans ... 7
3. Hasil dan diskusi ... 9
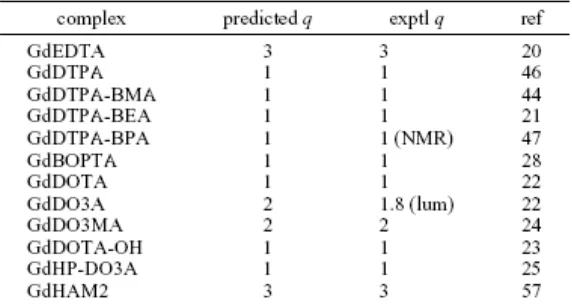
3.1. Kompleks Gd(III) dengan q =1 ... 13
3.2. Kompleks Gd(III) dengan q = 2. ... 19
3.3. Kompleks Gd(III) dengan q=3. ... 19
4. Ringkasan dan kesimpulan... 23
Kompleks-Kompleks Gadolinium (Gd(III)) Untuk MRI Contrast Agent:
(Studi Komputasi Metode Mekanika Molekul)
Abstrak
Parameter-parameter untuk paket program pemodelan SYBYL yang tersedia secara komersial telah dikembangkan untuk kompleks Gd3+ sehingga memungkinkan untuk mempelajari kompleks-kompleks tersebut dengan metode mekanika molekul. Dengan menggunakan parameter ini dan teknik yang disebut “coordination scan”, bilangan koordinasi kompleks-kompleks yang berbasis Gd(III) dapat diprediksi, dan dengan demikian bilangan hidrasinya (q) dapat ditentukan. Dengan mengetahui q, maka dapat diprediksi relaksifitas molarnya berdasarkan hubungannya dengan nilai-nilai literatur. Selain itu, nilai ΔEcoord
hasil perhitungan menghasilkan dugaan harga tetapan kestabilan termodinamik ligan-ligan poliaminokarboksilat dengan Gd3+ dengan hasil yang cukup baik. Kompleks Gadolinium biasanya digunakan sebagai media pengontras untuk penggunaan MRI, dan oleh karena itu, teknik-teknik yang digunakan pada penelitian ini dapat membantu dalam mengembangkan senyawa pengontras baru.
Kata Kunci: Kompleks gadolinium(III), MRI contrast agent, mekanika molekul, coordination scan.
1. Pendahuluan
Magnetic Resonance Imaging (MRI) telah menjadi salah satu alat
pencitraan utama pada pengobatan modern. Penggunaan MRI yang cukup luas, telah memunculkan kebutuhan akan media pengontras (contrast agent) paramagnetik yang efisien untuk meningkatkan kontras citra antara jaringan normal dengan jaringan berpenyakit atau untuk menunjukkan fungsi organ tertentu.1 Perkembangan ke depan pada bidang ini akan membutuhkan pengembangan media spesifik yang diarahkan pada organ tertentu atau bahkan pada keadaan penyakit tertentu. Penelitian-penelitiannya telah difokuskan terutama pada kompleks-kompleks ion paramagnetik gadolinium(III), besi(III), dan mangan(II) karena momen magnet dan relaksifitas protonnya yang tinggi. Saat ini, media pengontras untuk penggunaan klinis yang banyak digunakan adalah MAGNEVIST (GdDTPA, Berlex Laboratories), OMNISCAN (GdDTPA-BMA, Nycomed), ProHance (GdHP-DO3A, Squibb), dan DOTAREM (GdDOTA, Guerbet).
paramagnetik ini. Muatan total, kestabilan termodinamik dan kinetik, lipofilisitas dan bahkan pemaksimumam solvasi kulit dalam (inner shell solvation), semuanya dapat dikendalikan oleh disain ligan. Mengenai pengembangan media pengontras baru, mungkin akan lebih disukai untuk memprediksi sifat-sifat kompleks ini lebih dahulu sebelum dilakukan usaha yang cukup lama dan mungkin mahal untuk mensintesisnya, untuk mem-bypass kompleks-kompleks yang tidak diharapkan, seperti kestabilan in vivo terhadap disosiasi yang rendah.2,3 Metode-metode komputasi menyediakan Metode-metode untuk memahami struktur molekul dan keterkaitan dengan fungsinya; Jadi, pengembangan medan gaya dan teknik untuk memodelkan kompleks Gd(III) akan menyediakan alat untuk merancang media pengontras baru dengan sifat-sifat yang lebih baik.
Ion logam paramagnetik berfungsi sebagai media pengontras dengan cara meningkatkan laju relaksasi proton-proton air yang berada dekat ion, melalui interaksi antara spin elektron pusat paramagnetik dengan inti proton. Peningkatan relaksifitas ion paramagnetik, yang juga merupakan peningkatan laju relaksasi proton, dapat dibagi menjadi dua bagian, yaitu relaksifitas lingkar luar (outer-sphere relaxivity, R2) yang melibatkan interaksi-jauh dengan fasa ruah pelarut,
dan relaksifitas lingkar dalam (inner-sphere relaxivity, R1) yang ditentukan terutama oleh pertukaran molekul air yang terikat pada ion paramagnetik dengan molekul air di fasa ruahnya. Relaksifitas yang teramati adalah jumlah dari mekanisme lingkar luar dan dalam.
1 2
obs
R = +R R (1)
M adalah konsentrasi kompleks logam, q adalah bilangan hidrasi, T1M adalah waktu relaksasi longitudinal dan τM adalah waktu tinggal rerata air pada pusat logam. Waktu korelasi τc bergantung pada waktu tinggal τs, waktu relaksasi elektron τs, dan waktu tumbling rotasi senyawa kompleks τR. Variabel lain yang ada pada persamaan (3) adalah sebagai berikut: γH, rasio magnetogirik proton; g, faktor Lande; μB, Bohr magneton; S, bilangan kuantum spin; ωs, frekuensi larmor elektron; ωI, frekuensi larmor proton.
Untuk kompleks yang memiliki ukuran dan komposisi yang mirip, nilai relaksifitas lingkar luar R2 kira-kira sama. Jadi perbedaan yang teramati pada relaksifitas terutama disebabkan oleh kontribusi lingkar-dalam R1. Oleh karena itu peningkatan relaksifitas media pengontras MRI terutama akan bergantung pada peningkatan relaksifitas lingkar-dalam.
Ada tiga pendekatan utama untuk memodelkan geometri di sekitar ion logam; pertama dan yang paling umum adalah metode medan gaya valensi (Valence Force Field, VFF). Pada metode VFF, semua sudut ikatan L–M–L dinyatakan dengan sudut ikatan ideal dan tetapan gaya. Pendekatan kedua adalah metode titik-titik pada lingkaran (Points on a sphere, POS). Pada metode POS, interaksi ligan-logam dimodelkan dengan cara yang sama dengan VFF (sudut ikatan ideal dan tetapan gaya); akan tetapi tidak ada gaya yang digunakan pada sudut L–M–L dan oleh karena itu geometri di sekitar pusat logam dinyatakan semata-mata oleh tolakan sterik antara atom-atom donor. Metode ketiga adalah pendekatan ionik; metode ini memodelkan interaksi ligan-logam seluruhnya dengan gaya non-ikatan elektrostatik dan van der Waals.4
ab initio serta spektroskopi juga dapat digunakan untuk mengembangkan
parameter-parameter baru, terutama untuk menghitung tetapan gaya ulur ikatan M–L. Dengan pendekatan VFF, parameter-parameter untuk sudut dan torsi yang mungkin harus dikembangkan, selain penetapan jenis atom baru yang memungkinkan penggambaran sudut-sudut ini.
Fossheim dan Dahl melaporkan suatu metode untuk menghubungkan nilai log K dengan energi-energi molekul.6,7 Mereka menggunakan pendekatan ionik dengan semua ikatan Gd–L diperlakukan sebagai interaksi elektrostatik murni. Pekerjaan mereka secara komputasi intensif dimana semua muatan atom dihitung dengan metode ab initio. Pada penelitian tersebut, mereka mampu menghubungkan energi-energi hitung dengan nilai log K untuk GdDOTA, GdDTPA, GdDO3A, GdDTPA-BMA, GdNOTA, dan beberapa kompleks lain. Metode ini mensyaratkan perhitungan energi reaksi berair Er,aq yang dinyatakan sebagai berikut:
, 1 2
r aq ML L h h
E =E − +E E +E (5)
EML adalah energi kompleks pada fasa gas, EL energi ligan bebas pada fasa
gas, Eh1 adalah energi hidrasi ligan bebas dan Eh2 adalah energi hidrasi kompleks. Seperti yang diharapkan, kontribusi utama pada Er,aq adalah interaksi elektrostatik antara kation dan ligan.
dibandingkan dengan energi regang ligan hitung. Suatu korelasi linier yang sangat bagus (r2 = 0,999) diperoleh yang mensarankan bahwa reorganisasi intermediet dikontrol oleh rigiditas ligan.
Tahun 1991, Hay mempublikasikan suatu pendekatan POS pada pemodelan molekular mekanik untuk kompleks lantanida(III) aqua dan nitrato.9 Hay menetapkan panjang ikatan kesetimbangan Gd(III)–oksigen sebesar 2,25 Å untuk air dan 2,310 untuk gugus nitrato. Selain panjang ikatan, beberapa sudut yang meliputi H–O–M dan N–O–M ditetapkan nilai kesetimbangannya, juga torsi O–N–O–M dan O=N–O–M. Somerer dkk., telah menggunakan pendekatan yang sama, meskipun mereka memperlakukan ikatan Gd(III)–L sebagai elektrostatik murni, untuk menguji struktur dan ikatan kompleks basa Schiff Gd(III).10
Saat ini, Cundari dkk., telah melaporkan pengembangan medan gaya yang menggunakan pendekatan Hay untuk kompleks Gd(III).11 Ini melibatkan pengembangan banyak panjang ikatan kesetimbangan Gd–L, sudut X–L–Gd, dan sudut-sudut torsi. Medan gaya Cundari, kemudian digunakan untuk memodelkan beberapa kompleks Gd, dari mulai GdEDTA sampai dengan Gd(teksapirin) dengan kesesuaian yang sangat bagus (excellent agreement), (3% untuk panjang ikatan, dan 5% untuk torsi) dengan data struktur hasil eksperimen.
2. Metode komputasi
2.1. Pengembangan medan gaya
Semua pemodelan dilakukan menggunakan paket program pemodelan SYBYL12 yang tersedia secara komersial yang dijalankan pada Silocon Graphics Indigo. Medan gaya TAFF yang digunakan pada paket ini memodelkan molekul dengan cara meminimisasi energi total terhadap persamaan berikut:
str bend oop tors vdw
E=
∑
E +∑
E +∑
E +∑
E +∑
E (6)Estr adalah energi ulur ikatan dari panjang naturalnya, Ebend adalah energi sudut ikatan bending dari nilai naturalnya, Eoop adalah energi bending atom keluar bidang, Etors adalah energi torsi dan Evdw adalah energi yang disebabkan oleh interaksi van der Waals. Energi keseluruhan E terdiri atas penjumlahan energi-energi tersebut pada semua ikatan, sudut ikatan, torsi dan interaksi non-ikatan pada semua atom yang tidak terikat pada antara satu dengan yang lain.
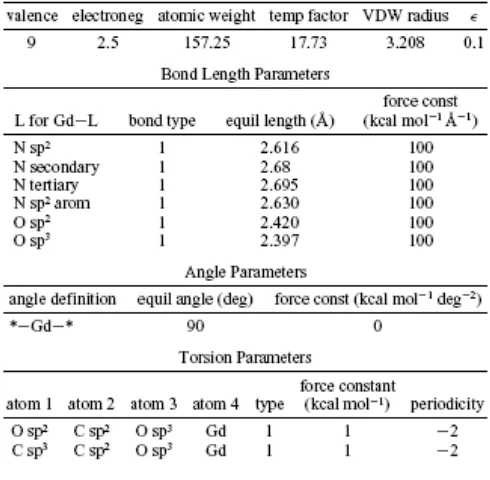
Metode POS digunakan pada pemodelan kompleks Gd(III), parameter-parameter yang dikembangkan untuk medan gaya TAFF dapat dilihat pada
Tabel 1. Parameter ini adalah jumlah minimal yang diperlukan untuk memodelkan kompleks Gd yang dilaporkan pada penelitian ini. Parameter yang tidak ditunjukkan pada
Tabel 1, secara eksplisit menggunakan parameter standar yang ada pada medan gaya TAFF.13 Parameter ini diturunkan dari 12 kompleks gadolinium, yaitu Gd(EDTA),14 Gd(DTPA-BEA),15 GdDOTA,16 GdDOTA-OH,17 Gd(DO3MA), GdHP-DO3A, Gd(HAM), Gd(18-crown-6), Gd(DO3A), GdBOPTA, Gd(DTPA-pn), and Gd(DTPAen).18 Parameter yang paling kritis mempengaruhi struktur kompleks logam adalah ulur ikatan TAFF. Parameter ini menentukan panjang ikatan kesetimbangan antara atom donor dengan logam, serta kemudahan ikatan ini mengalami stretching. Parameter-parameter yang ada pada
Tabel 1. Parameter-parameter Gd(III) untuk SYBYL.
2.2. Coordination Scans
Handcock dkk., berhasil menggunakan mekanika molekul untuk menentukan hubungan antara selektifitas ligan dengan ukuran ion logam. Teknik yang digunakan dalam penelitian ini adalah perhitungan energi regang kompleks sebagai fungsi panjang ikatan M–L. Ini dilakukan dengan memodelkan kompleks dengan logam generik dan memvariasikan jari-jari ionnya. Kurva yang dihasilkan memberikan energi minimum yang terkait dengan jari-jari ion logam yang paling sesuai. Ligan dengan selektifitas yang tinggi terhadap logam tertentu akan memiliki kurva yang curam (steep) dengan lokasi minimum mendekati harga jari-jari ionik, sebaliknya kurva yang dangkal akan mensarankan bahwa ligan tidak selektif terhadap pengikatan (binding) logam.
Teknik yang juga berhubungan dengan hal ini adalah “coordination scan”, yang dapat menghasilkan kurva yang mirip dengan cara meminimisasi
logam, yang pada saat yang sama mengubah-ubah panjang ikatan M–L. Bilangan koordinasi logam yang lebih disukai ditentukan oleh posisi jari-jari ionik yang tekait dengan lokasi titik-titik perpotongan.
Teknik coordination scan digunakan untuk menentukan bilangan koordinasi Gd(III) pada berbagai kompleks yang dipelajari. Struktur awal dibangun dari data koordinat sinar-x (jika mungkin). Atom Gd pada setiap kompleks kemudian diatur pada bilangan koordinasi yang berbeda yang secara kovalen mengikat jumlah air yang sesuai. Hal penting yang perlu dicatat adalah SYBYL menghitung air seolah-olah memiliki energi regang 0,00 kkal/mol; jadi air yang ditambahkan pada kompleks tidak menambah energi selain interaksi sterik dengan ligan.
Jari-jari ionik Gd(III) secara efektif divariasikan dengan cara sistematik dengan mengubah-ubah panjang ikatan kesetimbangan Gd–N dan Gd–O. Panjang ikatan Gd–N ditetapkan dengan hubungan berikut: panjang ikatan kesetimbangan = (jari-jari ionik Gd) + 1,7 Å. Dengan cara yang sama panjang ikatan kesetimbangan Gd–O ditetapkan menggunakan hubungan: panjang ikatan kesetimbangan = (jari-jari ionik Gd) + 1,4 Å. Jari-jari ionik awal Gd ditetapkan sebesar 0,5 Å. Faktor skala 1,7 dan 1,4 Å dihasilkan dari panjang ikatan kesetimbangan rata-rata untuk ikatan Gd–L dikurangi jari-jari ionik rata-rata Gd(III) 1,0 Å. Tetapan gaya untuk ulur ikatan dijaga pada nilai konstan 100 kkal mol–1 Å–1. Kemudian kompleks diminimisasi dan energi kompleks diperoleh. Kemudian jari-jari ionik dinaikkan sebesar 0,1 Å, panjang ikatan kesetimbangan dimodifikasi pada nilai baru, kemudian kompleks diminimisasi kembali. Proses ini dilakukan terus-menerus sampai jari-jari ionik Gd mencapai 1,5 Å; rentang 0,5-1,5 Å ini cukup besar sehingga dapat mencakup semua keadaan koordinasi yang mungkin. Prosedur ini diulang untuk kompleks dengan satu air, dua air dan seterusnya sampai semua keadaan koordinasi ditentukan.
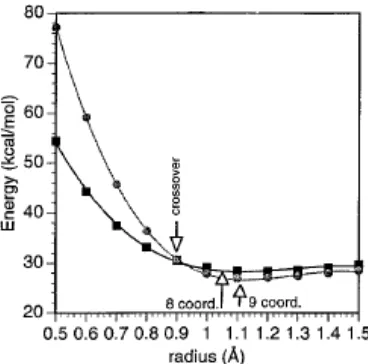
ketiga berikut: y=ax3+bx2+ +cx d dan kurva resultan diplot bersama-sama. Persamaan-persamaan kurva kemudian diselesaikan secara serempak untuk menentukan titik-titik perpotongan atau “crossover points”. Pengujian posisi titik-titik silang ini yang terkait dengan jari-jari ionik yang lebih disukai untuk ion logam pada keadaan koordinasi yang diberikan menunjukkan bilangan koordinasi yang lebih disukai. Pada Gd3+, jari-jari untuk lingkungan koordinasi 6 adalah 0,938 Å, untuk koordinasi 7 adalah 1,00 Å, koordinasi 8 adalah 1,053 Å dan koordinasi 9 adalah 1,107 Å.
Agar koordinasi yang diberikan bagus, jari-jari ionik harus berada pada sisi yang benar dari titik silang; semakin dekat jari-jari ionik kepada titik silang semakin besar keadaan koordinasi lain berkontribusi terhadap sistem kesetimbangan. Selain perbedaan energi antara jari-jari ideal dari suatu bilangan koordinasi tertentu dan titik silang memperlihatkan seberapa mudah koordinasi kompleks tertentu akan berubah; perbedaan energi yang kecil akan lebih disukai, sedangkan perbedaan yang besar tidak akan menyukai perubahan koordinasi.
3. Hasil dan diskusi
Dengan perbaikan parameter-parameter Gd(III) yang sesuai untuk paket pemodelan SYBYL, pemodelan kompleks-kompleks Gd(III) secara mekanika molekul (MM) telah dilakukan. Penelitian dilakukan pada dua kajian utama, yaitu kemampuan untuk memprediksi kestabilan kompleks Gd dan kemampuan untuk memprediksi keefektifan senyawa tertentu sebagai media pengontras. Untuk mengkalibrasi hasil yang muncul dari studi komputasi ini, dicari literatur tentang kompleks Gadolinium yang harga kestabilan termodinamika dan ukuran relaksifitasnya telah ditentukan dengan kondisi semirip mungkin.
penggunaan MRI. Faktor lain yang perlu dipertimbangkan adalah jumlah dan jenis gugus donor yang terlibat pada binding terhadap atom logam.
Parameter-parameter untuk memodelkan kompleks Gd dengan medan gaya TAFF yang diimplementasikan pada SYBYL dapat dilihat pada
Tabel 1; parameter lain yang diperlukan berasal dari nilai default medan gaya TAFF. Pada penelitian ini digunakan pendekatan minimal dengan jumlah parameter yang sedikit untuk menghasilkan data yang sesuai dengan struktur hasil eksperimen. Dua parameter penting yang ditemukan pada penelitian ini adalah torsi yang melibatkan ikatan karboksilat dengan Gd dan panjang ikatan kesetimbangan. Tanpa memasukkan parameter-parameter sudut torsi ini, karboksilat memiliki kecenderungan terikat kepada logam dengan cara bidentat. Panjang ikatan kesetimbangan yang digunakan pada penelitian ini, secara umum lebih panjang daripada yang dilaporkan oleh Hay dan Cundari, hal ini terutama disebabkan oleh perbedaan antara medan gaya TAFF dengan MM2.
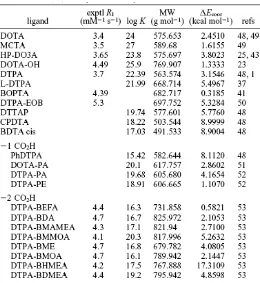
Tabel 2. Coordination scan dibandingkan dengan harga q hasil penenetuan secara eksperimen.
Coordination scan memungkinkan penentuan jumlah koordinasi dan
sekaligus harga q; juga membantu menentukan bobot molekul dari kompleks yang dilarutkan (solvated complex) yang penting untuk gerakan rotasi. Teknik ini nampaknya sangat berhasil dalam memprediksikan jumlah air yang terikat langsung pada Gd seperti yang dapat dilihat pada Tabel 2. Hasil untuk GdEDTA, GdDTPA, GdDTPA-BMA, GdDTPA-BEA, GdDTPA-BPA, GdBOPTA, GdDOTA, GdDO3A, GdDO3MA, dan GdHP-DO3A semua harga q-nya sesuai dengan literatur. Pada teknik coordination scan, kurva energi regang kompleks sebagai fungsi jari-jari ionik dibuat dengan cara meminimisasi kompleks terhadap berbagai jumlah molekul air yang terikat langsung pada ion logam. Bilangan koordinasi logam yang lebih disukai ditentukan oleh posisi jari-jari ionik yang terkait dengan lokasi titik-titik perpotongan. Jika koordinasi yang diberikan memiliki jari-jari sebelah kanan dari titik potong, maka bilangan koordinasi lebih disukai. Jika jari-jari ada di sebelah kiri titik potong, maka bilangan koordinasi tidak disukai dan bilangan koordinasi yang lebih kecil yang disukai. Contoh yang mewakili adalah coordination scan terhadap GdDTPA yang terlihat pada Gambar 1. Jari-jari ionik untuk Gd dengan bilangan koordinasi 9 adalah 1,107 Å yang terletak di sebelah kanan dari titik potong koordinasi 8/9. Jadi bilangan koordinasi 9 dari kompleks Gd lebih disukai daripada bilangan koordinasi 8 yang berarti kompleks akan mengikat 1 molekul air untuk memberikan bilangan hidrasi q = 1.
Penelitian yang menarik telah dilakukan melalui penggunaan “coordination scan”. Perbedaan energi ΔEcoord , antara kompleks dengan solvasi
Selain membagi kompleks Gd(III) berdasarkan jenis ligan, seperti EDTA dan DTPA, akan lebih informatif apabila membaginya berdasarkan jumlah molekul air yang terikat pada atom logam pusatnya. Tiga kategori utama muncul dari skema ini, yaitu bilangan hidrasi 1, 2 dan 3. Seksi berikutnya akan membicarakan ketiga kategori ini berdasarkan kestabilannya, dan pada kasus dengan q = 1 juga akan membicarakan relaksifitasnya. Akan tetapi sayangnya tidak ada relaksifitas pembandingnya untuk q =2 dan 3, karena terlalu sedikit kompleks tersebut yang telah diukur secara eksperimen. Untuk semua kompleks yang dibicarakan di sini, pertama-tama strukturnya dibuat dan diminimisasi, yang dimulai dari struktur berdasarkan koordinat hasil sinar-x. Kemudian diatur pada berbagai keadaan koordinasi untuk dilakukan coordination scan untuk menentukan q dan ΔEcoord .
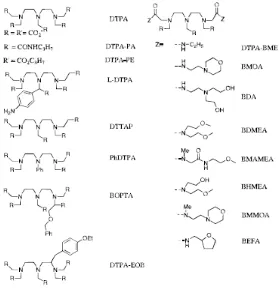
Gambar 2. Struktur ligan-ligan pada kompleks Gd(III) yang memiliki harga q=1.
3.1. Kompleks Gd(III) dengan q =1
Gambar 3. Struktur ligan-ligan kompleks Gd(III) tambahan yang memiliki harga q=1.
Tabel 3. Kompleks-kompleks Gd(III) dengan q=1.
reorganisasi dari intermediet Gd(*HL) pada kasus poliaminomakrosiklik. Jika dipertimbangkan harga energetik reorganisasi kompleks dari solvasi lingkar dalam, koordinasi maksimum, sampai kompleks desolvasi lingkar dalam, koordinasi minimum, sebagai ukuran rigiditas ligan, orang akan mengharapkan untuk mencari hubungan antara ΔEcoord dengan konstanta kestabilan termodinamik.
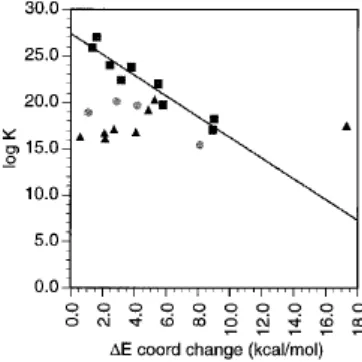
Jika tetapan kestabilan termodinamik, log K diplotkan terhadap ΔEcoord , diperoleh korelasi linier (r2 = 0,91). Plot ini (Gambar 4) memperlihatkan dengan jelas bahwa hubungan antara kestabilan dengan ΔEcoord tidak dipengaruhi oleh jenis ligan, linier atau makrosiklik. Karena ΔEcoord meningkat, kestabilan termodinamik menurun, yang menyarankan bahwa tahap kunci pembentukan kompleks melibatkan suatu reorganisasi ligan selama perubahan bilangan koordinasi untuk Gd pada saat kompleks lengkap. Dengan demikian, jika ada suatu peningkatan rigiditas kompleks, maka akan terjadi penurunan ΔEcoord , secara bersamaan meningkatkan kestabilan termodinamik.
Gambar 4. Perajahan tetapan kestabilan termodinamika, log K, sebagai fungsi
coord
E
Perbandingan ligan-ligan makrosiklik DOTA dan MCTA memperlihatkan dengan jelas hubungan antara ΔEcoord dan log K. Penambahan satu gugus metil pada tulang punggung MCTA meningkatkan rigiditas ligan, menurunkan ΔEcoord
dan terjadi peningkatan kestabilan. Pengaruh ini dapat juga dilihat dengan dua jenis ligan EDTA yang ditemukan hanya mengikat satu molekul air. Ligan CPTA sangat rigid dengan cincin siklopentil bergabung dengan jembatan etilen, sedangkan cis-BDTA punya dua gugus metil pada tulang punggungnya memberikan rigiditas.
Penelitian terbaru menyarakan bahwa faktor penting yang mempengaruhi relaksifitas proton kompleks lantanida(III) adalah kemampuan logam pusat untuk melewati dengan bilangan koordinasi 8 selama proses pertukaran air. Jika demikian, diharapkan untuk melihat hubungan antara ΔEcoord dengan relaksifitas eksperimen; tidak ada korelasi seperti itu pada penelitian ini. Akan nampak bahwa pengaruh ΔEcoord terhadap relaksifitas cukup kecil, dengan mudah dikalahkan oleh pengaruh tumbling rotasi yang bergantung pada bobot molekul.
Seperti dapat dilihat pada Tabel 3, modifikasi atau kehilangan gugus karboksilat punya pengaruh yang signifikan pada kestabilan kompleks. Penggantian karboksilat dengan amida, DTPA-PA dan DOTA-PE menurukan tetapan kestabilan sebesar 102–103. Dengan cara yang sama penggantian gugus karboksilat dengan ester DTPA-PE menurunkan tetapan kestabilan 103–104. Penggantian karboksilat dengan nonligating group, seperti fenil dalam PhDTPA menurunkan kestabilan yang lebih besar 107. Penggantian dua karboksilat dengan dua amida menurunkan tetapan kestabilan 102–106.
kestabilan yang setaraf kira-kira 105. Semua bis(amida) yang diperiksa memiliki tulang punggung DTPA yang tidak tersubstitusi, perubahan semuanya dalam gugus amida yang dihilangkan dari pusat logam, dengan demikian orang akan berharap substitusi-substitusi ini memainkan peranan yang kecil pada perubahan lingkungan sterik di sekitar pusat logam.
Relaxifitas
Seperti terlihat pada persamaan 2 dan 3, ada beberapa kemungkinan untuk meningkatkan relaktifitas. Satu metode adalah meningkatkan correlation time, τc. Dari persamaan 4, τc bergantung pada residence time, laju relaksasi elektron dan gerakan rotasi kompleks. Dari semua ini, dua faktor paling mudah dimodifikasi yaitu residence time dan gerakan rotasi. Gerakan rotasi secara mudah diubah dengan cara memodifikasi bobot molekul kompleks, yang paling umum adalah dengan merancang senyawa yang dikonjugasikan pada makromolekul.
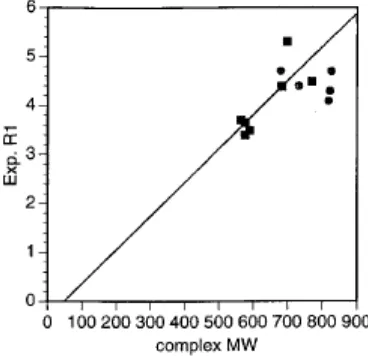
Gambar 5. Perajahan relatifitas lingkar-dalam sebagai fungsi bobot molekul kompleks tersolvasi: ligan yang hanya mengandung gugus karboksilat, =ligan dengan dua gugus amida.
daripada (GdDTPA kex (4,1 ± 0.3) × 106 s-1; GdDOTA kex (4,8 ± 0.4) × 106 s-1). Jelas, adanya gugus aminokarboksilat mempengaruhi laju pertukaran dibandingkan dengan kompleks aqua. Pada studi yang lebih baru yang dilakukan oleh Mesbach ditemukan bahwa pertukaran air melalui mekanisme disosiatif dengan Gd-DTPA-BMA dan berspekulasi bahwa laju pertukaran dapat dikontrol oleh persyaratan sterik ligan pada sisi binding air.
Aime dkk., menemukan hubungan antara bobot molekul dengan relaksifitas lingkar dalam R1. Untuk senyawa dengan ukuran dan massa yang sama dan oleh karenanya laju difusi, pada kekuatan medan magnet yang relatif tinggi, kontribusi R2 lingkar luar kira-kira akan sama. Twedle dkk., menunjukkan hal ini secara eksperimen untuk kompleks aminokarboksilat linier dan makrosiklik; pada 0,47 T dan 40°C mereka menemukan R2 rata-rata 2,0 ± 0.3 (mM.s)–1. Untuk kompleks dengan nilai q yang sama, berapapun perbedaan relaktifitas, akan disebabkan oleh perbedaan R1. Faktor utama yang mempengaruhi R1 dalam berbagai hal adalah nilai τR. Satu kekecualian teramati pada kompleks bis-(amida); pada kasus ini τm nampaknya mempengaruhi relaktifitas. Seperti dapat dilihat pada Gambar 5, korelasi yang baik antara relaktifitas eksperimen R1 dengan bobot molekul kompleks tersolvasi.
Tabel 4. Kompleks-kompleks Gd(III) dengan q=2.
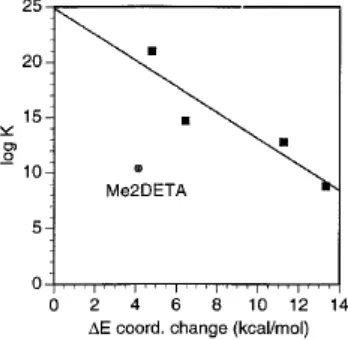
3.2. Kompleks Gd(III) dengan q = 2.
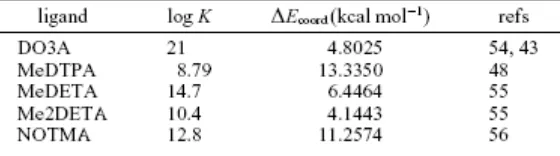
Lima kompleks Gd(III) ditemukan memiliki bilangan hidrasi 2, seperti ditunjukkan dalam Tabel 2. Sturktur dari ligan-ligan ini dapat dilihat pada Gambar 6. Dari semua ini hanya MeDTPA yang bukan makrosiklik; pada ligan ini daerah koordinasi tambahan pada Gd tersedia karena kuarternisasi dari gugus amina pusat pada ligan. Seperti yang ditemukan pada kompleks Gd(III) dengan q =1, ada korelasi linier antara log K dengan ΔEcoord (r
2
=0,85). Hubungan ini digambarkan pada Gambar 7. Satu kompleks yang memiliki kestabilan lebih rendah dari yang diharapkan adalah Me2DETA, dimana tambahan dua gugus metil pada cincin triazasiklodekana agak mendestabilisasi kompleks, meskipun ini nampaknya tidak disebabkan oleh regang sterik terhadap kompleks. Seperti yang dapat dilihat pada Tabel 4, ΔEcoord Me2DETA sebenarnya lebih rendah daripada MeDETA, yang menyarankan bahwa rintangan sterik bukan alasan untuk kestabilan yang lebih rendah ini; penjelasan yang mungkin adalah perubahan keasaman nitrogen karena efek elektronik dari substituen alkil.
Kemiringan (gradien) korelasi, juga perpotongan dengan sumbu-x dan sumbu-y adalah sangat dekat dengan kompleks yang ditemukan pada kompleks dengan q=1. Ini menyarankan mekanisme yang sama untuk kedua kelas kompleks ini.
3.3. Kompleks Gd(III) dengan q=3.
untuk mengikat molekul air untuk memberikan atom Gd(III) bilangan koordinasi 9. Hasil penelitian ini ditemukan pada tabel 5. Sayangnya, hanya hubungan antara
coord
E
Δ dan log K yang dapat diperikasa, karena hanya kompleks-kompleks yang relaksifitasnya telah diukur adalah GdEDTA, GdHAM, dan GdHAM2. Tiga ukuran ini tidak cukup untuk membentuk korelasi. Seperti yang ditunjukkan oleh DTPA bis(amida), relaksifitasnya sangat sensitif terhadap perubahan pada ligating atoms; perbedaan yang diharapkan antara amino karboksilat dan siklik heksaza, seperti HAM dan HAM2, pasti akan lebih besar daripada amino amida terhadap amino karboksilat.
Gambar 6. Struktur ligan kompleks Gd(III) dengan q=2.
Gambar 7. Perajahan tetapan kestabilan termodinamika, log K, sebagai fungsi
coord
E
Seperti pada kompleks dengan q sama dengan 1 dan 2, korelasi linier antara ΔEcoord dengan log K ditemukan seperti yang ditunjukkan Gambar 9. Korelasi ini jauh lebih rendah daripada yang ditemukan untuk dua kelas kompleks lain, r2= 0,54, selain kemiringan garis korelasi bertentangan dengan yang ditemukan untuk senyawa dengan q sama dengan 1 dan 2.
Gambar 8. Struktur ligan kompleks Gd(III) dengan q=3.
Ini akan menyarankan suatu perubahan mekanisme dari ligan jenis DTPA dan DOTA. Korelasi yang rendah yang ditemukan untuk kelas ini tidak mengagetkan karena variasi struktur yang besar dari ligan yang menyusun kelas ini.
Pemerikasaan struktur dari ligan-ligan ini mengarahkan kepada suatu pandangan bahwa pengaruh substituen pada kestabilan termodinamika. Pemasukan gugus-gugus alkil pada tangan-tangan karboksilat nampaknya tidak menyukai koordinasi 9 karena rintangan sterik. Ligan NOTA lebih suka mengikat 3 molekul air, sedangkan ligan NOTMA yang hampir sama yang mengandung gugus metil pada setiap tangan karboksilat lebih menyukai mengikat 2 molekul air.
Contoh lain, yang kurang dramatis, dapat ditemukan pada perbedaan kestabilan antara ligan EDTA dan ligan diMeEDTA dengan dua gugus metil menempati dua tangan; substitusi ini merendahkan kestabilan sekitar 0,35 satuan log. Perbedaan kestabilan antara EDTA dengan di(i-Pr)EDTA seperti yang diharapkan dengan memasukkan gugus isopropil yang secara sterik lebih besar pada tangan, adalah 0,75 satuan log. Perbedaan dalam syarat sterik untuk jenis ligan NOTA dan EDTA akan nampak signifikan. Substitusi alkil pada NOTA menyebabkan penurunan bilangan koordinasi sedangkan substitusi pada EDTA yang kurang sterik menghasilkan log K yang sedikit lebih rendah tanpa mempengaruhi bilangan koordinasi.
Gambar 9. Perajahan tetapan kestabilan termodinamika, log K, sebagai fungsi
coord
E
NOTA dan PMDTA ditemukan tidak terkait dengan ligan lain pada kelas ligan ini.
Substitusi pada tulang punggung etilen juga mempengaruhi bilangan koordinasi kompleks Gd juga kestabilannya. Kompleks GdCDTA memiliki cincin sikloheksana yang dimasukkan dalam jembatan etilen dan lebih suka dalam keadaan bilangan koordinasi 9, sedangkan kompleks GdCPDTA dengan cincin siklopentana lebih suka dengan keadaan bilangan koordinasi 7. Perbedaan yang mencolok lainnya dapat dilihat pada cis- dan trans-GdBDTA; ligan trans menyukai bilangan koordinasi 9, sedangkan cis lebih suka koordinasi 7.
Mengenai kestabilan, substitusi alkil pada tulang punggung etilen cenderung meningkatkan nilai log K. Jika log K dari GdEDTA dibandingkan dengan GdCDTA dan GdPDTA, teramati peningkatan kestabilan. Tetapi substitusi alkil juga dapat menurunkan kestabilan, perbandingan antara GdEDTA dengan GdMePDTA menemukan bahwa penambahan dua gugus metil pada salah satu karbon backbone menurunkan kestabilan dan bukannya menaikkan kestabilan. Meningkatkan ukuran backbone juga tidak disukai. Ligan TMDTA dengan backbone propil sebagai pengganti etil seperti pada EDTA memiliki kestabilan yang jauh lebih rendah Δ log K = 3,52. isu tentang ukuran cincin khelat ini secara luas telah diperikasa. Ligan PMDTA dengan backbone beranggota lima secara ekstrim didestabilkan dibandingkan dengan EDTA, Δ log K = 6,98, seperti pada Gambar 9.
4. Ringkasan dan kesimpulan
molekul air yang terikat pada Gd, yang terkait dengan relaksifitas total, juga perkiraan tentang kestabilan termodinamika suatu kompleks. Melalui hubungan antara kestabilan eksperiment dan ukuran relaksifitas ini, MM memungkinkan untuk memprediksi sifat-sifat ini untuk kompleks Gd yang baru. Selain itu, hubungan antara ΔEcoord dengan log K menyarankan suatu mekanisme umum pembentukan kompleks, baik untuk ligan jenis DTPA maupun DOTA yang melibatkan penyusunan ulang intermediet yang secara struktur mirip dengan kompleks akhir. Perkembangan teknik dan hubungan ini akan mengarahkan kepada perancangan rasional kontras media yang lebih baik untuk penggunaan MRI. Chim. Acta 1993, 209, 101.
1989, 10, 982.
14
Templeton, L.; Templeton, D. H.; Zalkin, A.; Ruben, H. W. Acta Crystallogr., Sect. B: Struct. Sci. 1982, 38, 2155.
15
Konigs, M. S.; Dow, W. C.; Love, D. B.; Raymond, K. N.; Quay, S. C.; Rocklage, S. M. Inorg. Chem. 1990, 29, 1488.
16
Chang, C. A.; Francesconi, L. C.; Malley, M. F.; Kumar, K.; Gougoutas, J. Z.; Tweedle, M. F.; Lee, D. W.; Wilson, L. J. Inorg. Chem. 1993, 32, 3501
17
Aime, S.; Anelli, P. L.; Botta, M.; Fedelli, F.; Grandi, M.; Paoli, P.; Uggeri, F. Inorg. Chem. 1992, 31, 2422.
18
Kang, S. I.; Ranganathan, R. S.; Emswiler, J. E.; Kumar, K.;