PENETAPAN KADAR NIKOTIN DALAM EKSTRAK ETANOLIK DAUN TEMBAKAU VORSTENLANDEN BAWAH NAUNGAN (VBN) DAN NA
OOGST (NO) DENGAN METODE KROMATOGRAFI LAPIS TIPIS (KLT)-DENSITOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh:
Helena Angelina Kurniawan
NIM : 088114010
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENETAPAN KADAR NIKOTIN DALAM EKSTRAK ETANOLIK DAUN TEMBAKAU VORSTENLANDEN BAWAH NAUNGAN (VBN) DAN NA
OOGST (NO) DENGAN METODE KROMATOGRAFI LAPIS TIPIS (KLT)-DENSITOMETRI
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh:
Helena Angelina Kurniawan
NIM : 088114010
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
iii
iv
HALAMAN PERSEMBAHAN
Jika kamu melakukan kesalahan, selalu ada jalan lain untukmu. Kamu
dapat memulai lagi kapanpun kamu mau, kita tidak menyebut hal ini
kegagalan yang menjatuhkan kita, tetapi berhenti di tempat
If you have made mistakes, there is always another chance for you. You
may have a fresh start any moment you choose, for this thing we call
“failure” is not falling down, but the staying down
(Mary Pickford)
Maafkan kesalahan masa lalu, jangan sesali.
Kemudian...
Tegaslah membebaskan diri untuk hidup seutuhnya
Sekarang, dan di masa depan....
Karya ini kupersembahkan untuk:
Papaku Antonius Kurniawan
v
vii
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa, atas segala berkat,
rahmat, bimbingan, serta perlindunganNya sehingga penulis dapat menyelesaikan
skripsi yang berjudul “Penetapan Kadar Nikotin dalam Ekstrak Etanolik Daun
Tembakau Vorstenlanden Bawah Naungan (VBN) dan Na Oogst (NO) dengan
Metode Kromatografi Lapis Tipis (KLT)-Densitometri” sebagai salah satu syarat
memperoleh gelar Sarjana Farmasi (S. Farm) di Fakultas Farmasi Universitas
Sanata Dharma.
Selama menjalani masa perkuliahan hingga penyusunan skripsi ini
penulis telah banyak mendapat pengetahuan, bimbingan, motivasi, dan dukungan
dari berbagai pihak. Oleh karena itu, penulis ingin mengucapkan terima kasih
kepada:
1. Bapak Ipang Djunarko M.Sc, Apt., selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Bapak Jeffry Julianus, M.Si., selaku dosen pembimbing skripsi yang telah
membimbing dan memberikan masukan maupun dorongan kepada penulis
selama penyusunan skripsi ini.
3. Ibu Christine Patramurti, M.Si, Apt., selaku dosen penguji yang telah
membimbing dan memberikan masukan maupun dorongan kepada penulis
selama penyusunan skripsi ini.
4. Bapak Yohanes Dwiatmaka, M.Si., selaku dosen penguji yang bersedia
memberikan masukan dan diskusi kepada penulis selama penyusunan skripsi
ini.
viii
5. Ibu dr. Fenty, M. Kes. Sp. PK, selaku Dosen Pembimbing Akademik penulis
selama studi di Fakultas Farmasi Universitas Sanata Dharma.
6. Ibu Rini Dwi Astuti, M.Sc, Apt. selaku Kepala Laboratorium Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta.
7. Segenap dosen dan karyawan atas ilmu yang diberikan selama studi di
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
8. Mas Bimo, Mas Parlan, Mas Kunto, dan Mas Wagiran, selaku staff
laboratorium, beserta staff keamanan dan kebersihan di Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
9. Novi, Citra, Dina, Ayessa, dan Amel sebagai rekan kerja satu tim nikotin atas
kerjasama, dukungan, dan bantuannya selama proses penelitian hingga
penyusunan skripsi.
10. Susi, Susan, Nona, Felicia, Sasa, Lele, Tere, Sari, dan Wiwi sebagai tim
analisis yang telah berjuang dan berbagi ilmu, serta canda dan tawanya dalam
menjalani penelitian di laboratorium Kimia Analisis Instrumental dan
memberi dukungan kepada penulis.
11. Rika, Elya, dan Lala sebagai sahabat penulis yang selalu mendukung dan
memberi semangat kepada penulis selama menjalani perkuliahan hingga
penyusunan skripsi ini.
12. Danny Trias Prisnanda atas segala perhatian, dukungan, suka dan duka serta
kesediaannya memberi cerita dalam rangkuman waktu untuk penulis.
13. Demas Daniel dan Yoki Christian Andrianto atas segala bantuan, semangat
ix
14. Bravo, Widi, Adi, Hepi, dan teman-teman FST maupun FKK 2008 yang telah
memberi warna dalam kebersamaan selama menempuh perkuliahan di
Fakultas Farmasi Universitas Sanata Dharma.
15. Teman-teman kelompok KKN Alternatif XXXIX-Tematik Pindul untuk
segala kebersamaannya.
16. Teman-teman penulis dari TK hingga sekarang yang berjuang bersama untuk
mencapai cita-cita.
17. Semua pihak yang tidak dapat disebutkan satu per satu.
Penulis menyadari bahwa skripsi ini masih belum sempurna. Oleh karena
itu penulis mengharapkan kritik dan saran yang membangun penulis dalam
perkembangan selanjutnya. Akhir kata, penulis berharap semoga skripsi ini
berguna bagi semua pihak.
Penulis
x
DAFTAR ISI
Hal
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
xi
B. Nikotin ... 8
C. Simplisia dan Penanganan Daun Tembakau ...
1. Simplisia ...
2. Penanganan Daun Tembakau ...
3. Curing ...
E. Kromatografi Lapis Tipis (KLT) ...
1. Kromatografi ...
2. Kromatografi Lapis Tipis (KLT) ...
3. Adsorben ...
BAB III. METODE PENELITIAN...
A. Jenis dan Rancangan Penelitian ...
xii
1. Variabel bebas ...
2. Variabel tergantung ...
3. Variabel pengacau terkendali ...
C. Definisi Operasional ...
D. Bahan Penelitian ...
E. Alat Penelitian ...
F. Tata Cara Penelitian ...
1. Pemilihan dan pengambilan sampel ...
2. Pembuatan serbuk daun tembakau ...
3. Pembuatan ekstrak etanolik daun tembakau ...
a. Optimasi lama waktu ekstraksi ...
b. Ekstraksi daun tembakau hasil optimasi ...
4. Pembuatan fase gerak ...
5. Pembuatan seri baku nikotin ...
a. Pembuatan larutan stok nikotin 50 ppm ...
b. Pembuatan seri larutan baku nikotin ...
6. Penentuan panjang gelombang (λ) maksimum kurkumin ...
7. Pembuatan HCl encer ...
8. Pembuatan NaOH 4N ...
9. Preparasi sampel ...
10. Elusi baku dan ekstrak etanolik daun tembakau VBN dan NO
pada KLT ...
xiii
12. Penetapan kadar nikotin dalam ekstrak etanolik daun
tembakau VBN dan NO ...
G. Analisis hasil ...
BAB IV. HASIL DAN PEMBAHASAN ...
A. Pemilihan Sampel …...
B. Pembuatan Serbuk Daun Tembakau ...
C. Ekstraksi secara Soxhletasi ...
D. Penetapan Panjang Gelombang Serapan Maksimum Nikotin ...
E. Pembuatan Kurva Baku Nikotin ...
F. Preparasi Sampel ...
G. Optimasi Lama Waktu Ekstraksi Nikotin ...
H. Analisis Kualitatif pada Ekstrak Etanolik Daun Tembakau VBN
dan NO ...
I. Penetapan Kadar Nikotin dalam Ekstrak Etanolik Daun Tembakau
VBN dan NO ...
BAB V. KESIMPULAN DAN SARAN ...
xiv
DAFTAR TABEL
Tabel I. Tata nama lempeng KLT ...
Tabel II. Data kurva baku nikotin ...
Tabel III. Hasil optimasi lama waktu ekstraksi ...
Tabel IV. Hasil perhitungan kadar nikotin dalam ekstrk etanolik daun
tembakau VBN dan NO ...
Tabel V. Uji normalitas data dua sampel tidak berpasangan ...
Tabel VI. Tabel hasil uji t tidak berpasangan ...
18
41
45
51
53
xv
DAFTAR GAMBAR
Gambar 1. Tanaman tembakau (Nicotiana tabacum) ...
Gambar 2. Struktur nikotin ...
Gambar 3. Struktur kimia nornikotin, anabasin, anatabin ...
Gambar 4. Jalur modifikasi biosintesis nikotin ...
Gambar 5. Instrumentasi kromatografi lapis tipis ...
Gambar 6. Instrumentasi densitometer …...
Gambar 7. Refleksi sinar pengukuran intensitas sinar ...
Gambar 8. Diagram TLC Scanner ...
Gambar 9. Alat Soxhletasi ...
Gambar 10. Gugus kromofor pada nikotin ...
Gambar 11. Spektra baku nikotin ...
Gambar 12. Grafik hubungan antara konsentrasi baku dan AUC nikotin ..
Gambar 13. Reaksi penggaraman nikotin dengan HCl ...
Gambar 14. Reaksi mengubah nikotin hidroklorida menjadi bentuk basa
kembali ...
Gambar 15. Grafik hubungan lama waktu ekstraksi dan AUC nikotin ....
Gambar 16. Perbandingan profil kromatogram analisis kualitatif ...
Gambar 17. Gugus polar dan non polar nikotin ...
Gambar 18. Interaksi nikotin dengan fase diam silika gel 60 F254 ...
Gambar 19. Interaksi nikotin dengan fase gerak n-heksan:toluen:dietil-
xvi
Gambar 20. Hasil elusi sampel...
Gambar 21. Bagan jalur biosintesis metabolit sekunder ...
50
xvii
DAFTAR LAMPIRAN
Lampiran 1. Surat keterangan tembakau VBN dan NO ...
Lampiran 2. Surat keterangan keaslian baku nikotin ...
Lampiran 3. Sistem KLT-densitometri yang digunakan ...
Lampiran 4. Deskripsi tembakau yang digunakan ...
Lampiran 5. Perhitungan kepolaran fase gerak ...
Lampiran 6. Hasil penyerbukkan daun tembakau VBN dan NO ...
Lampiran 7. Pembuatan seri larutan baku nikotin ...
Lampiran 8. Spektra pengukuran panjang gelombang serapan maksimum
nikotin pada konsentrasi 1 ppm; 3 ppm; dan 5 ppm ...
Lampiran 9. Data kurva baku nikotin ...
Lampiran 10. Kromatogram kurva baku nikotin replikasi III ...
Lampiran 11. Penimbangan untuk optimasi ...
Lampiran 12. Kromatogram nikotin dalam VBN untuk optimasi ...
Lampiran 13. Penimbangan untuk penetapan kadar ...
Lampiran 14. Kromatogram penetapan kadar nikotin dalam ekstrak
etanolik daun tembakau VBN ...
Lampiran 15. Kromatogram penetapan kadar nikotin dalam ekstrak
etanolik daun tembakau NO ...
Lampiran 16. Data perhitungan kadar nikotin dalam ekstrak etanolik daun
tembakau VBN dan NO ...
Lampiran 17. Data uji statistik ...
xviii
INTISARI
Nikotin merupakan alkaloid utama dalam tanaman tembakau. Cara penanaman tembakau berpengaruh terhadap intensitas cahaya yang tersedia untuk pertumbuhan tanaman sehingga dengan adanya perbedaan cara tanam tersebut berpengaruh terhadap kadar nikotin yang terkandung di dalamnya. Penelitian ini bertujuan untuk mengetahui kadar nikotin yang terkandung dalam ekstrak etanolik daun tembakau yang berbeda cara tanamnya, yaitu tembakau Vorstenlanden Bawah Naungan (VBN) dan tembakau Na Oogst (NO), serta mengetahui perbedaan kadar nikotin antara ekstrak etanolik daun tembakau Vorstenlanden Bawah Naungan (VBN) dan Na Oogst (NO).
Metode penetapan kadar yang digunakan dalam penelitian ini adalah Kromatografi Lapis Tipis (KLT)–densitometri dengan fase diam silika gel 60 F254
dan fase gerak n-heksan:toluen:dietilamin (15,25:5,75:4) yang diukur pada panjang gelombang maksimum 261nm.
Hasil penelitian yang didapat yaitu kadar rata-rata nikotin yang terdapat dalam ekstrak etanolik daun tembakau Vorstenlanden Bawah Naungan (VBN) adalah 0,00247 ± 2,38 x 10-5 %b/b dan Na Oogst (NO) adalah 0,00213 ± 1,90 x 10-5 %b/b. Hasil analisis statistik menggunakan uji t tidak berpasangan menunjukkan bahwa kadar nikotin rata-rata antara kedua sampel berbeda bermakna. Dengan demikian kadar nikotin yang terkandung dalam ekstrak etanolik daun tembakau Vorstenlanden Bawah Naungan (VBN) lebih tinggi daripada tembakau Na Oogst (NO).
xix
ABSTRACT
Nicotine is the primary alkaloid in tobacco plants. Way of planting tobacco affects the intensity of light available for plant growth so that the presence of differences in the way of planting affect on the levels of nicotine contained in it. This study aims to determine the levels of nicotine contained in ethanolic extracts of tobacco leaf in different ways of planting, namely tobacco Vorstenlanden Bawah Naungan (VBN) and tobacco Na Oogst (NO), as well as knowing the difference between the nicotine content in ethanolic extract of tobacco leaf Vorstenlanden awah Naungan (VBN ) and Na Oogst (NO).
Determination method used in this study is Thin Layer Chromatography (TLC)-densitometry with the stationary phase silica gel 60 F 254 and the mobile
phase n-hexane:toluene:diethylamine (15,25:5,75:4) measured on the maximum wavelength 261 nm.
The results obtained are the average levels of nicotine contained in ethanolic extract of tobacco leaf Vorstenlanden Bawah Naungan (VBN) is 0,00247 ± 2,38 x 10-5 % w/w and Na Oogst (NO) is 0,00213 ± 1,90 x 10-5 % w/w. The results of statistical analysis using unpaired t test showed that the average of nicotine levels between the two samples are significantly different. Thus the nicotine levels contained in ethanolic extract of tobacco leaf Vorstenlanden Bawah Naungan (VBN) is higher than Na Oogst (NO).
Key word: nicotine, tobacco Vorstenlanden Bawah Naungan (VBN) and Na Oogst (NO), TLC-densitometry, determination
1
PENGANTAR
A. Latar Belakang
Nikotin dikenal oleh masyarakat sebagai zat yang berbahaya dan zat
adiktif yang mempengaruhi sistem saraf pusat. Di samping merugikan kesehatan
karena sifat ketoksikannya, nikotin juga mempunyai efek positif sebagai
stimulan, obat penenang, atau penghilang rasa sakit (Susilowati, 2006). Sebagai
senyawa yang berpotensi sebagai obat, nikotin yang merupakan senyawa alkaloid
pada tanaman tembakau perlu dibuat dalam bentuk ekstrak. Kadar nikotin yang
terkandung dalam tembakau mencapai 0,3 sampai 5% dari berat kering tembakau
yang berasal dari hasil biosintesis di akar dan terakumulasi di daun (Anonima,
2011), oleh karena itu bagian tanaman tembakau yang digunakan untuk penelitian
adalah pada bagian daun.
Varietas Vorstenlanden banyak digunakan sebagai tembakau cerutu yang
dibudidaya di daerah Jawa. Salah satu tempat budidaya tembakau Vorstenlanden
berada di PT. Perkebunan Nusantara X Klaten yang ditanam sebagai pertanaman
Na Oogst (NO) dan di bawah naungan (VBN) (PT Perkebunan XIX (Persero),
1998). Vorstenlanden Bawah Naungan (VBN) ditanam pada bulan Juni dan
dipanen pada bulan Juli dengan diberi naungan / waring untuk mengurangi
intensitas cahaya dan diperlukan adanya pengendalian air untuk penyiraman.
Sedangkan Na Oogst (NO) ditanam pada pertengahan bulan September dan
2
hujan alami. Perbedaan cara tanam ini berpengaruh pada intensitas cahaya yang
tersedia untuk tumbuh pada tanaman tembakau, sehingga berpengaruh terhadap
kadar nikotin yang terdapat di dalamnya.
Pada penelitian ini, sampel berupa ekstrak etanolik didapatkan dari
proses ekstraksi daun tembakau dengan metode soxhletasi menggunakan cairan
penyari etanol. Metode soxhletasi dipilih karena pengerjaannya mudah dan jumlah
cairan penyari yang digunakan lebih sedikit dibandingkan metode ekstraksi
lainnya (Direktorat Jenderal Pengawasan Obat dan Makanan, 1986). Cairan
penyari pada soxhletasi selalu baru dengan adanya penguapan dan pendinginan
pelarut, sehingga penarikan kandungan nikotin dapat optimal.
Metode Kromatografi Lapis Tipis (KLT) dipilih untuk menetapkan kadar
nikotin karena metode KLT cocok untuk analisis bahan alam, selain itu juga
karena metodenya sederhana, cepat dalam pemisahan, sensitif, kecepatan
pemisahan tinggi, dan memerlukan jumlah cuplikan yang sangat sedikit (Khopkar,
1990). Nikotin merupakan senyawa kimia yang memiliki gugus polar dan gugus
nonpolar yang dapat berinteraksi dengan fase diam dan fase gerak pada sistem
KLT. Bercak nikotin dapat diukur di densitometer karena memiliki gugus
kromofor yang dapat dideteksi oleh detektor UV pada rentang panjang gelombang
UV. Metode densitometri digunakan untuk pengukuran kadar karena memiliki
sensitifitas dan selektifitas yang tinggi. Dengan demikian metode penetapan kadar
dengan KLT-densitometri ini memiliki keunggulan lebih efisien karena dapat
menganalisis dan mengkuantifikasi beberapa senyawa dalam matriks sampel
dalam sekali deteksi secara bersamaan.
Metode penetapan kadar nikotin dalam ekstrak etanolik daun tembakau
dengan KLT-densitometri ini menggunakan hasil optimasi dengan nilai As=1,
Rs=1,54, dan Rf =0,56 (Chairio, 2011) dan validasi metode dengan hasil
selektivitas menunjukkan Rs=1,54 dan linearitas r = 0,999 serta akurasi dan
presisi yang baik pada konsentrasi 3 ppm hingga 5 ppm (Ariani, 2012) yang telah
dilakukan sebelumnya pada serangkaian penelitian ini. Optimasi perlu dilakukan
untuk mendapatkan metode pemisahan yang optimal. Sedangkan validasi perlu
dilakukan untuk memberikan jaminan bahwa metode analisis dengan sistem
KLT-densitometri ini memenuhi parameter-parameter validasi sehingga dapat
memberikan hasil analisis yang dapat dipercaya.
Pengujian secara statistik dilakukan untuk mengetahui perbedaan kadar
nikotin dalam ekstrak etanolik daun tembakau Vorstenlanden Bawah Naungan
(VBN) dan Na Oogst (NO). Uji statistik yang digunakan adalah uji t tidak
berpasangan karena merupakan uji komparatif untuk membandingkan 2 macam
sampel dan berupa variabel independent atau tidak berpasangan.
1. Permasalahan
Berdasarkan latar belakang permasalahan di atas, timbul permasalahan
sebagai berikut:
a. berapakah kadar nikotin yang terkandung dalam ekstrak etanolik daun
tembakau Vorstenlanden Bawah Naungan (VBN) dan Na Oogst (NO)?
b. apakah terdapat perbedaan kadar nikotin dalam ekstrak etanolik daun
4
2. Keaslian Penelitian
Penetapan kadar nikotin dalam daun tembakau Vorstenlanden Bawah
Naungan (VBN) dan Na Oogst (NO) ini pernah dilakukan dengan metode
spektrofotometri UV-Vis oleh PT. Perkebunan Nusantara X Klaten. Penelitian
mengenai penetapan kadar nikotin lain yang pernah dilakukan sebelumnya yaitu
penetapan kadar nikotin dalam sampel biologis menggunakan metode
kromatografi cair kinerja tinggi (KCKT), kromatografi gas, spektrofotometri
massa, dan kromatografi cair-MS (LC-MS) (Nakajima, Yamamoto, Kuroiwa,
Yokoi, 2000), penentuan kadar nikotin dalam asap rokok (Susanna, Hartono,
Fauzan, 2003), analisis nikotin dalam asap dan filter rokok dengan
spektrofotodensitometer (Fidrianny, Supradja, Soemardji, 2004), penentuan kadar
nikotin dalam mainstream smoke rokok putih dengan titrasi potensiometri
(Primasari, 2006), penetapan kadar nikotin dalam rokok putih dengan metode
KLT-densitometri (Widiretnani, 2009), dan penetapan kadar nikotin dalam rokok
kretek berfilter dan tidak berfilter dengan metode KLT-densitometri (Oktiva,
2009).
Penelitian tentang penetapan kadar nikotin dalam ekstrak etanolik daun
tembakau Vorstenlanden Bawah Naungan (VBN) dan Na Oogst (NO) dengan
metode KLT-densitometri belum pernah dilakukan sebelumnya.
3. Manfaat penelitian
a. Manfaat metodologis. Penelitian ini diharapkan dapat memberikan
sumbangan ilmiah dalam dunia kefarmasian mengenai metode ekstraksi daun
tembakau dan penetapan kadar nikotin yang terkandung dalam ekstrak etanolik
daun tembakau Vorstenlanden Bawah Naungan (VBN) dan Na Oogst (NO)
dengan metode KLT-densitometri.
b. Manfaat praktis. Hasil dari penelitian ini diharapkan menambah
informasi dalam dunia farmasi dan juga masyarakat mengenai penetapan kadar
nikotin dalam ekstrak etanolik daun tembakau Vorstenlanden Bawah Naungan
(VBN) dan Na Oogst (NO) dengan metode KLT-densitometri dan perbandingan
kadar antara kedua tembakau tersebut.
B. Tujuan Penelitian
Tujuan dilakukan penelitian ini adalah untuk mengetahui :
a. kadar nikotin yang terdapat dalam ekstrak etanolik daun tembakau
Vortenlanden Bawah Naungan (VBN) dan Na Oost (NO) dengan
menggunakan metode KLT-Densitometri.
b. perbedaan kadar nikotin dalam ekstrak etanolik daun tembakau Vorstenlanden
6
BAB II
PENELAAHAN PUSTAKA
A. Tembakau
Tanaman tembakau (Nicotiana tabacum L) termasuk familia Solanaceae.
Spesies-spesies yang mempunyai nilai ekonomis adalah Nicotiana tabacum L dan
Nicotiana rustica dengan rincian sebagai berikut:
1. Nicotiana rustica L., mengandung kadar nikotin yang tinggi (max n =
16 %) biasanya digunakan untuk membuat abstrak alkaloid (sebagai bahan baku
obat dan insektisida), jenis ini banyak berkembang di Rusia dan India
2) Nicotiana tabacum L., mengandung kadar nikotin yang rendah (min n
= 0,6%) jenis ini umumnya digunakan sebagai bahan baku pembuatan rokok
(Anonim, 2000).
Gambar 1. Tanaman tembakau (Nicotiana tabacum) (Hanum, 2008)
Dalam spesies Nicotiana tabacum terdapat varietas yang banyak
jumlahnya, dan untuk tiap daerah terdapat perbedaan jumlah kadar nikotin, bentuk
daun, dan jumlah daun yang dihasilkan. Proporsi kadar nikotin banyak bergantung
kepada varietas, tanah tempat tumbuh tanaman, dan kultur teknis serta proses
pengolahan daunnya (Abdullah, 1982).
Varietas Vorstenlanden banyak digunakan sebagai tembakau cerutu yang
banyak dibudidaya di daerah Jawa. Salah satu tempat budidaya tembakau
Vorstenlanden berada di PT. Perkebunan Nusantara X Klaten yang ditanam
sebagai pertanaman Na Oogst (NO) dan di bawah naungan (VBN). Naungan yang
diberikan pada tanaman tembakau VBN bertujuan untuk mengurangi intensitas
cahaya sebesar 30% sehingga cahaya yang diperoleh tanaman tersebut sebesar
70% (PT. Perkebunan Nusantara XIX (Persero), 1998).
Kadar nikotin yang terdapat dalam daun tembakau VBN diketahui
sebesar 1,413% dan NO sebesar 0,867% (PT Perkebunan XIX (Persero), 1998).
Tembakau Vorstenlanden adalah produk dari daun tembakau (Nicotiana tabacum
L.) tipe Vorstenlanden yang ditanam di Surakarta dan Yogyakarta tepat waktu dan
dipanen saat musim penghujan, dikeringkan di los pengering serta difermentasi
dan disortasi (Standar Nasional Indonesia, 1995).
Nicotiana tabaccum L. tumbuh tegak dengan tinggi mencapai 2,5 m dan
batang sedikit bercabang. Daun tersebar, duduk, bertangkai pendek, memanjang
(lanset) pangkal menyempit atau sebagian memeluk batang, ujung runcing.
Batang maupun daunnya mempunyai rambut-rambut kelenjar. Daun tembakau
yang disebut folia nicotianae mengandung nikotin 1-3%, nornikotin, nikotimin,
nikotein, isonikotein, nikotoin, nikotelin (Tjitrosoepomo,1994).
Berdasarkan tipe fotosintesisnya, tanaman tembakau termasuk dalam
8
memiliki kebutuhan terhadap cahaya matahari rendah. Ketika tanaman C3
mendapatkan cahaya tinggi/berlebih pada siang hari, stomata akan menutup,
fotorespirasi meningkat sehingga C02 diikat oleh Ribulosa Bi Phospat (RUBP)
dan menghasilkan senyawa Phospho Gliseric Acid (PGA) yang memiliki 3 atom
C. Proses pengikatan oleh C02 terjadi secara spontan, sehingga energi yang
dihasilkan untuk proses fotosintesis rendah (Anonimb, 2011).
B. Nikotin
Nikotin larut dalam semua bagian air di bawah 60°C dan sangat
higroskopis. Sumber yang paling terkenal adalah tembakau N. tabacum L.
Sebagai alkaloid utama pada tembakau, nikotin memiliki dua nitrogen tersier yang
sangat berbeda: nitrogen pirolidin kuat (pKa 8,2) dan nitrogen piridin lemah (pKa
3,4). Nikotin menunjukkan λ maks pada 262 nm (log ε 3,46) dalam etanol dengan
sedikit perubahan pada penambahan asam (Cordell, 1981). Nilai pKa pada cincin
aromatik piridin lebih rendah dikarenakan efek hibridisasi sp2 yang menyebabkan
orbital s bertambah sehingga elektron-elektron dalam orbital lebih terikat kuat
pada nukleus (Crooks, 1999).
N
N CH3
1-metil-2-(2-piridil) pirolidin
Gambar 2. Struktur Nikotin (Pugh, 2002)
Nikotin merupakan senyawa tak berwarna hingga kuning pucat. Nikotin
dapat berubah warna (fotodegradasi) menjadi coklat apabila terkena paparan sinar
matahari dan udara. Berbau tajam serasa terbakar. Sangat larut dalam alkohol,
kloroform, eter, petroleum eter, kerosin, dan minyak (The Merck Index, 1989).
Titik didih nikotin berkisar antara 246-247°C. Rumus empiris nikotin yaitu
C10H14N2 dengan bobot molekul 162,23gram/mol; C 74,03%, H 8,70%, N
17,27%. Kerapatan jenis dari nikotin yaitu 1,0097kg/m3 (Domino, 1999).
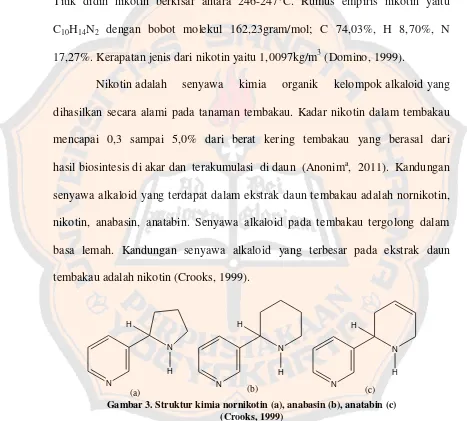
Nikotin adalah senyawa kimia organik kelompok alkaloid yang
dihasilkan secara alami pada tanaman tembakau. Kadar nikotin dalam tembakau
mencapai 0,3 sampai 5,0% dari berat kering tembakau yang berasal dari
hasil biosintesis di akar dan terakumulasi di daun (Anonima, 2011). Kandungan
senyawa alkaloid yang terdapat dalam ekstrak daun tembakau adalah nornikotin,
nikotin, anabasin, anatabin. Senyawa alkaloid pada tembakau tergolong dalam
basa lemah. Kandungan senyawa alkaloid yang terbesar pada ekstrak daun
tembakau adalah nikotin (Crooks, 1999).
N
Gambar 3. Struktur kimia nornikotin (a), anabasin (b), anatabin (c) (Crooks, 1999)
Nikotin dapat berlaku sebagai sebuah stimulan dan obat penenang atau
penghilang rasa sakit (Susilowati, 2006). Kandungan nikotin dalam tembakau
10
Azheimer karena nikotin dapat meningkatkan reseptor nikotinat yang berpengaruh
pada peningkatan asetilkolin dalam otak. Asetilkolin berperan penting untuk
fungsi otak dan memori (Hamilton, 2011).
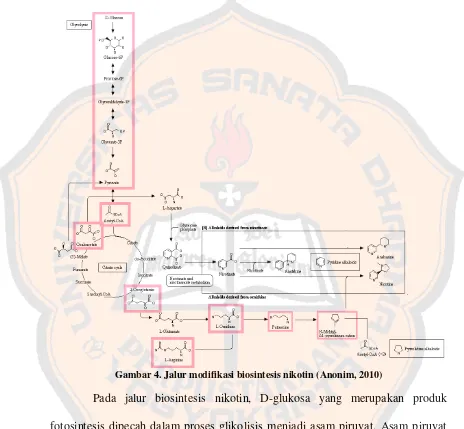
Gambar 4. Jalur modifikasi biosintesis nikotin (Anonim, 2010)
Pada jalur biosintesis nikotin, D-glukosa yang merupakan produk
fotosintesis dipecah dalam proses glikolisis menjadi asam piruvat. Asam piruvat
akan dirombak untuk masuk dalam siklus krebs menjadi asetil Co-A. Asetil Co-A
berikatan dengan oksaloasetat dan menghasilkan citrat sampai α-ketoglutarat. α
-ketoglutarat menghasilkan 2 asam amino yaitu L-glutamate dan L-arginin yang
menghantarkan ke prekusor biosintesis nikotin yaitu L-ornithine (Salisbury dan
Ross, 1995).
C. Simplisia dan Penanganan Daun Tembakau 1. Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain simplisia
merupakan bahan yang dikeringkan (Direktorat Jendral Pengawasan Obat dan
Makanan, 1995). Pada umumnya pembuatan simplisia melalui tahap seperti
berikut pengumpulan bahan baku, sortasi, pencucian, perajangan, pengeringan,
sortasi kering, pengepakan, penyimpanan dan pemerikasaan mutu (Direktorat
Jendral Pengawasan Obat dan Makanan, 1985).
2. Penanganan Daun Tembakau
Kegiatan yang perlu dilakukan pada penanganan daun tembakau setelah
dipanen adalah sortasi pendahuluan, penyejunan, dan pengolahan untuk
mendapatkan hasil akhir yang baik.
a. Sortasi pendahuluan, daun tembakau yang telah dipetik dan terkumpul
di tempat yang teduh disortasi terlebih dahulu sebelum tahap pengolahan daun.
Tujun dari sortasi pendahuluan yaitu : memudahkan proses pengolahan dan
memudahkan dalam pengelompokkan ke dalam kualitas menurut mutu
b. Penyejunan, kegiatan penataan daun tembakau dengan cara menusuk
bagian pangkal gagang daun/ibu tulang daun atau pada bagian ruas batang di
antara dua dua daun. Tujuan dari penyejunan yaitu : memudahkan dalam penataan
di ruang pengering/pengolahan dan mencegah daun tidak saling melekat ketika
12
c. Curing, proses curing bertujuan melepaskan air dari daun tembakau
dari kadar air 80-90% menjadi 10-15% dan perubahan warna dari zat hijau daun
menjadi warna orange (Cahyono, 1998).
3. Curing
Pengolahan pasca panen dari tembakau Vorstenlanden adalah dengan
cara curing. Curing merupakan proses pengeringan daun tembakau yang bertujuan
untuk melepaskan kadar air dari 80-90% menjadi 10-15%, dan untuk mengubah
warna dari zat hijau daun menjadi warna orange dengan aroma sesuai dengan
standar tembakau yang diproses (Hanum, 2008).
Tahapan curing ada 4, yaitu:
1. Penguningan, merupakan proses perubahan warna dari hijau ke warna
kuning karena hilangnya zat hijau daun/klorofil ke zat kuning daun dan terjadi
penguraian zat tepung menjadi gula dengan menggunakan suhu 32-42°C
2. Pengikatan warna, suhu dinaikkan secara perlahan setelah seluruh
daun berwarna kuning. Suhu yang digunakan yaitu 43-52°C dan akan
menghasilkan warna kuning orange
3. Pengeringan lembar daun, tujuannya untuk mengurangi kadar air di
dalam lembar daun dengan menaikkan suhu pada 53-62°C. Ciri-ciri proses ini,
daun sudah terasa kering apabila dipegang, tapi tulang daun masih terasa basah
4. Pengeringan gagang, dilakukan pada suhu 63-72°C. Ciri tahapan ini
apabila seluruh tulang daun sudah kering, dan bila ditekuk batangnya akan patah
dan berbunyi (Hanum, 2008).
D. Ekstraksi 1. Ekstrak
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
ditetapkan (Direktorat Jendral Pengawasan Obat dan Makanan,1995).
Ekstrak tumbuhan merupakan material yang diperoleh dengan cara
menyari bahan tumbuhan dengan pelarut tertentu (Saifudin, 2011). Ekstrak
dikelompokkan menurut sifatnya menjadi:
a. Ekstrak encer (extractum tenue), sediaan ekstrak encer ini memiliki
konsistensi madu dan mudah dituang
b. Ekstrak kental (extractum spissum), sediaan ekstrak kental ini
memiliki konsistensi liat dalam keadaan dingin dan tidak dapat dituang serta
kandungan airnya berjumlah sampai 30%
c. Ekstrak kering (extractum siccum), sediaan ekstrak kering ini memiliki
konsistensi kering dan mudah digosokkan dengan kandungan lembab tidak lebih
dari 5%
d. Ekstrak cair (extractum fluidum), pada ekstrak cair memilki
konsistensi cair dan mudah dituang (Voigt, 1995).
2. Ekstraksi
Ekstraksi adalah kegiatan penarikan zat aktif yang dapat larut sehingga
14
dan cara ekstraksi yang tepat dapat dipermudah dengan mengetahui terlebih
dahulu zat aktif yang dikandung simplisia. Ekstraksi dipengaruhi oleh derajat
kehalusan serbuk dan perbedaan konsentrasi (Direktorat Jenderal Pengawasan
Obat dan Makanan, 1986).
3. Soxhletasi
Soxhletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinyu dengan jumlah
pelarut relatif konstan dengan adanya pendingin balik. Penyarian dengan
soxhletasi menggunakan larutan yang dipanaskan terus menerus sehingga zat aktif
yang tidak tahan pemanasan kurang cocok (Direktorat Jenderal Pengawasan Obat
dan Makanan, 2000).
Soxhlet adalah alat yang umumnya dipakai untuk melakukan ekstraksi
dengan pelarut mudah menguap. Dimana jumlah bahan obat yang diekstraksi
sedikit, dikerjakan pada analisa kuantitatif. Suhu pada cara ekstraksi ini ialah titik
didih masing-masing pelarut yang dipakai (Litasari, 2000).
Kelebihan metode soxhletasi:
a. Uap panas tidak melalui serbuk simplisia tetapi melalui pipa samping.
b. Cairan penyari yang diperlukan lebih sedikit daripada metode ekstraksi lainnya
dan secara langsung diperoleh hasil ekstrak yang lebih pekat.
c. Serbuk simplisia disari dengan cairan penyari yang murni sehingga dapat
menyari zat aktif lebih banyak.
d. Penyarian dapat diteruskan sesuai keperluan tanpa menambah volume cairan
penyari (Yalapuspa, 2010).
4. Cairan penyari
Cairan penyari dalam proses pembuatan ekstrak adalah pelarut yang
optimal untuk senyawa kandungan yang berkhasiat atau yang aktif, dengan
demikian senyawa tersebut dapat terpisahkan dari bahan dan dari senyawa
kandungan lainnya. Ekstrak yang diperoleh hanya mengandung sebagian besar
senyawa yang diinginkan. Dalam hal ekstrak total, maka cairan pelarut dipilih
yang melarutkan hampir semua metabolit sekunder yang terkandung
(Departemen Kesehatan Republik Indonesia, 2000).
Faktor utama yang dipertimbangkan pada pemilihan cairan penyari
adalah selektivitas, kemudahan bekerja dan proses dengan cairan penyari tersebut,
ekonomis, ramah lingkungan, dan faktor keamanan. Pelarut yang diperbolehkan
adalah air dan alkohol (etanol) serta campurannya. Jenis pelarut lain seperti
metanol, heksana, toluen, kloroform, aseton, umumnya digunakan sebagai pelarut
untuk tahap kemurnian (Departemen Kesehatan Republik Indonesia, 2000).
Cairan penyari harus memenuhi kriteria berikut ini:
a. murah dan mudah diperoleh
b. stabil secara fisika dan kimia
c. berreaksi netral
d. tidak mudah menguap dan tidak mudah terbakar
e. selektif yaitu hanya menarik zat berkhasiat yang dikehendaki
f. tidak mempengaruhi zat berkhasiat
g. diperbolehkan oleh peraturan (Direktorat Jenderal Pengawasan Obat dan
16
E. Kromatografi Lapis Tipis (KLT) 1. Kromatografi
Kromatografi merupakan teknik pemisahan yang paling umum dan
paling sering digunakan dalam bidang kimia analisis dan dapat dimanfaatkan
untuk melakukan analisis, baik analisis kualitatif maupun analisis kuantitatif atau
preparatif dalam bidang farmasi, lingkungan, industri dan sebagainya.
Kromatografi merupakan suatu teknik pemisahan yang menggunakan fase diam
(stationary phase) dan fase gerak (mobile phase) (Gandjar dan Rohman, 2009).
Teknik kromatografi umum membutuhkan zat terlarut terdistribusi di
antara dua fase, satu diantaranya diam (fase diam), yang lainnya bergerak (fase
gerak). Fase gerak membawa zat terlarut melalui media, hingga terpisah dari zat
terlarut lainnya, yang tereluasi lebih awal atau lebih akhir (Direktorat Jenderal
Pengawasan Obat dan Makanan, 1995).
Umumnya zat terlarut dibawa melalui media pemisah oleh aliran suatu
pelarut berbentuk cairan atau gas yang disebut eluen. Fase diam dapat menjadi zat
penyerap, seperti halnya penyerap alumina yang diaktifkan, silika gel, dan resin
penukar ion, atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi
antara fase diam dan fase gerak (Direktorat Jenderal Pengawasan Obat dan
Makanan, 1995).
2. Kromatografi lapis tipis
Kromatografi lapis tipis (KLT) merupakan metode pemisahan
komponen- komponen atas dasar perbedaan adsorpsi atau partisi oleh fase diam di
bawah gerakan pelarut pengembang atau pelarut pengembangan campur.
Pemilihan pelarut pengembangan atau pelarut pengembangan campur sangat
dipengaruhi oleh macam dan polaritas zat- zat kimia yang dipisahkan (Mulja dan
Suharman, 1995).
Gambar 5. Instrumentasi kromatografi lapis tipis (Clark, 2007)
Kromatografi Lapis Tipis adalah teknik pemisahan yang lebih ekonomis
daripada HPLC karena beberapa sampel (termasuk standar) dapat terdeteksi dan
dipisahkan dalam sekali deteksi secara bersamaan. Keuntungan utama dari KLT
adalah kecepatan analisis pada basis per sampel. Hal ini disebabkan oleh
pengembangan jarak pendek (sekitar 10 sampai 15 cm) dan waktu pengembangan
yang dihasilkan singkat (Dean, 1995).
Kromatografi Lapis Tipis memiliki banyak keuntungan lebih dari
kromatografi kolom. Karena pelat kromatografi digunakan hanya sekali, sampel
dengan matriks relatif kompleks dapat dipisahkan. Pada KLT yang perlu
diperhatikan adalah totolan kecil di awal yang dapat terdeteksi dengan sensitif
(Popl, 1990).
3. Adsorben
Adsorben yang paling banyak digunakan dalam kromatografi lapis tipis
18
tambahan kalsium sulfat untuk mempertinggi daya lekatnya. Zat ini digunakan
sebagai adsorben universal untuk kromatografi senyawa netral, asam dan basa
(Roth, 1994). Fase diam silika gel dengan mekanisme sorpsi dapat digunakan
untuk keperluan analisis asam amino, hidrokarbon, vitamin, dan alkaloid (Gandjar
dan Rohman, 2009).
Tabel I. Tatanama lempeng KLT (Gandjar dan Rohman, 2009)
Simbol/Singkatan Arti
“Sil” Suatu produk yang mengandung silika gel seperti Anasil dari pabrik Analabs
G Pengikat (lapisan halus) gipsum (CaSO4. ½H20) S Pengikat starch (pati)
F atau UV Ditambah bahan yang berfluoresensi seperti seng silikat teraktivasi mangan
254 atau 366 Digunakan setelah simbol F atau UV, untuk menunjukkan panjang gelombang eksitasi senyawa berfosforesensi yang ditambahkan
60 Silika gel (dari E. Merck) yang mempunyai ukuran pori 60A0 (100 = 1nm). Ukuran pori yang lain ditandai 40, 80, dan 100
4. Pelarut
Fase gerak dalam medium KLT merupakan medium angkut dan terdiri
atas satu atau beberapa bahan pelarut yang bergerak dalam fase diam, karena gaya
kapiler. Pelarut yang mengelusi terlalu cepat tidak akan memisahkan dengan baik,
sebaliknya pelarut yang bergerak terlalu lambat akan memberikan waktu elusi
yang panjang (Stahl, 1985).
Pemilihan sistem pelarut dan komposisi lapisan tipis ditentukan oleh
prinsip kromatografi yang akan digunakan. Untuk meneteskan sampel yang akan
dipisahkan digunakan suatu mikro-syringe (penyuntik berukuran mikro). Pelarut
harus nonpolar dan mudah menguap (Khopkar, 1990).
Campuran pelarut organik dipilih yang mempunyai polaritas serendah
mungkin karena akan mengurangi serapan setiap komponen dari campuran
pelarut. Jika komponen-komponen campuran mempunyai sifat polar tinggi akan
mengubah sistem menjadi partisi (Sastrohamidjojo, 1991).
5. Penotolan sampel
Pemisahan pada kromatografi lapis tipis yang optimal akan diperoleh
hanya jika menotolkan sampel dengan ukuran bercak sekecil dan sesempit
mungkin. Sebagaimana dalam prosedur kromatografi yang lain, jika sampel yang
digunakan terlalu banyak maka akan menurunkan resolusi (Rohman, 2009).
Penotolan sampel dalam jumlah banyak secara manual membutuhkan
waktu yang lama dan juga menghasilkan reprodusibilitas yang kurang bagus.
Reprodusibilitas dan kecepatan sering dicapai dengan menggunakan penotol
otomatis. Penotolan sampel yang tidak tepat akan menyebabkan bercak yang
menyebar dan puncak ganda (Rohman, 2009).
6. Pengembangan
Penjenuhan bejana dilakukan dengan pelarut yang berfungsi untuk
memperkecil penguapan pelarut dan akan menghasilkan bercak lebih bundar dan
lebih baik. Penjenuhan biasanya dilakukan dengan melapisi dinding bejana
dengan kertas saring. Kertas harus terbasahi dengan pelarut dan bejana ditutup
sebelum lapisan adsorben dimasukkan ke dalamnya (Gritter, 1991).
Harga Rf mengukur kecepatan bergeraknya zona realtif terhadap garis
depan pengembang. Kromatogram yang dihasilkan diuraikan dan zona-zona
dicirikan oleh nilai-nilai Rf. Nilai Rf didefinisikan oleh hubungan:
20
Pengukuran itu dilakukan dengan mengukur jarak dari titik
pemberangkatan (pusat zona campuran awal) ke garis depan pengembang dan
pusat rapatan tiap zona. Nilai Rf harus sama baik pada descending maupun
ascending (Khopkar, 1990).
Penyebab umum dalam pembentukkan ekor adalah: jumlah totolan yang
terlalu banyak dan tidak adanya pengendalian pH yang cukup pada lapisan. pH
pada lapisan harus dibuat sedemikian rupa sehingga asam berada dalam bentuk
asamnya, dan juga basa berada dalam bentuk basanya. Paling mudah adalah
dengan menambahkan satu tetes asam asetat atau ammonium hidroksida ke dalam
pelarut pengembang yang dipakai untuk memisahkan asam atau basa (Gritter,
1991).
F. Densitometri
Densitometri merupakan metode analisis instrumental yang
mendasarkan pada interaksi radiasi elektromagnetik dengan analit yang
merupakan bercak pada plat KLT. Densitometri lebih dititikberatkan untuk
analisis kuantitatif analit-analit dengan kadar kecil, yang mana diperlukan
pemisahan terlebih dahulu dengan KLT (Rohman, 2009).
Metode densitometri mempunyai cara kerja yang sederhana dan cepat.
Pada metode densitometri diperlukan adsorbens dan fase gerak yang murni. Untuk
memperoleh hasil yang baik lazimnya digunakan adsorbens siap pakai yang telah
mengalami pencucian (Gritter, 1991).
Penggunaan densitometer saat ini jauh lebih memudahkan, dengan adanya
program komputerisasi yang menghubungkan langsung dengan
instrument-instrumen canggih. CAMAG densitometer memiliki kemampuan untuk memutar
plat kromatogram dari tepi dan tengah, horizontal maupun vertikal dalam satu
garis. Komputerisasi pada densitometer dikendalikan dan memiliki banyak fungsi,
seperti mengetahui lokasi puncak secara otomatis, optimasi kondisi pengukuran
luas bawah kurva, scanning seluruh totolan pada plat secara langsung, merekam
spektra, scanning panjang gelombang, kompensasi baseline otomatis untuk
menghilangkan sinyal palsu yang disebabkan oleh interfensi pada plat, kalibrasi,
pelaporan data, dan penyimpanan data untuk perhitungan kembali sekaligus
(Sherma dan Fried, 1996).
Gambar 6. Instrumentasi densitometer: linomat (a), TLC Scanner (b),
lampu UV (c) (Camag, 2005)
Teknik pengukuran dapat didasarkan atas pengukuran intensitas sinar yang
diserap (absorbansi), intensitas sinar yang dipantulkan (reflaktansi) atau intensitas
sinar yang difluoresensikan (fluoresensi). Teknik pengukuran berdasarkan refleksi
di mana sinar datang sebagian diserap dan sebagian lagi dipantulkan. Pada
dasarnya dapat digambarkan sebagai berikut:
Gambar 7. Refleksi sinar pengukuran intensitas sinar (Mintarsih, 1990) a. Sinar yang datang
b. Sinar yang dipantulkan
22
Sifat pemantulan ini akan menjadi sensitif dan selektif bila sinar yang
datang adalah monokromatis. Disini biasanya dipilih sinar pada panjang
gelombang yang diserap atau dipantulkan paling banyak oleh noda yang diteliti.
Banyaknya sinar yang direfleksikan akan ditangkap oleh suatu alat yang disebut
reflection photomultiplier yang akan diteruskan ke pencatat atau rekorder untuk
diubah menjadi suatu puncak atau kromatogram. Luas puncak atau tinggi puncak
sesuai dengan konsentrasi senyawa pada noda yang diukur kerapatannya
(Mintarsih, 1990).
Terdapat dua model pembacaan pada densitometri yaitu model pemantulan
(reflection) dan transmitan. Model refleksi mengukur jumlah cahaya yang
dipantulkan dari permukaan dengan menggunakan lampu yang berbeda sebagai
lampu UV/VIS. Lampu halogen dan tungsten cocok digunakan untuk sinar
tampak, sedangkan lampu xenon dan deuterium digunakan pada sinar UV.
Monokromator digunakan untuk menghasilkan cahaya monokromatis. Cahaya
yang dihamburkan diukur dengan photomultiplier, photodioda, dan photoresistor.
Hasil dari detektor dikonversikan ke dalam sinyal tertentu. Kekurangan model ini
adalah pengaruh posisi bercak terhadap sinyal yang dihasilkan. Kesalahan yang
signifikan disebabkan karena perbedaan konsentrasi profil sampel dengan baku.
(Sherma dan Fried,1996).
Gambar 8. Diagram TLC Scanner (Sherma dan Fried, 1996)
Ada dua cara penetapan kadar dengan alat densitometer. Pertama, setiap
kali penetapan ditotolkan sediaan baku dari senyawa yang bersangkutan dan
dielusi bersama dalam satu lempeng, kemudian AUC (luas daerah di bawah
kurva) sampel dibandingkan dengan harga AUC zat baku. Yang kedua, dengan
membuat kurva baku hubungan antara jumlah zat baku dengan AUC. Kurva baku
diperoleh dengan membuat totolan zat baku pada pelat KLT dengan
bermacam-macam konsentrasi (minimal tiga bermacam-macam konsentrasi). Dari kurva baku diperoleh
persamaan y = bx + a dimana x adalah banyaknya zat yang ditotolkan dan y
24
G. Landasan teori
Nikotin merupakan senyawa kimia dari golongan alkaloid yang
terkandung dalam tanaman tembakau. Kadar nikotin dalam tembakau mencapai
0,3 sampai 5,0% dari berat kering tembakau dan terakumulasi di daun.
Varietas tembakau Vorstenlanden sebagai tembakau cerutu banyak
dibudidaya sebagai pertanaman Na Oogst (NO) dan di bawah naungan (VBN).
Kedua tembakau ini dibedakan cara tanamnya. Tembakau VBN dalam
penanamannya menggunakan waring/penutup untuk mengurangi intensitas cahaya
dan memerlukan pengendalian air untuk penyiramannya, sedangkan tembakau
NO tanpa pemberian waring/penutup dan mendapatkan hujan alami. Adanya
perbedaan cara tanam ini berpengaruh terhadap intensitas cahaya yang tersedia
untuk tumbuh pada tanaman tembakau. Kadar nikotin yang terdapat dalam daun
tembakau VBN diketahui sebesar 1,413% dan NO sebesar 0,867%.
Tanaman tembakau termasuk dalam kelompok tanaman C3. Tanaman C3
merupakan kelompok tanaman yang membutuhkan intensitas cahaya matahari
yang rendah. Apabila kelompok tanaman C3 mendapatkan cahaya yang berlebih
akan menyebabkan menutupnya stomata dan meningkatnya fotorespirasi.
Ketersediaan 02 yang lebih banyak daripada CO2 menyebabkan CO2 diikat secara
spontan oleh RuBP. Akibatnya energi yang dihasilkan untuk proses fotosintesis
rendah dan hasil fotosintesis berupa glukosa berkurang. Glukosa merupakan
substrat dalam proses glikolisis yang akan menghasilkan asam piruvat. Asam
piruvat ini kemudian dirombak dalam siklus krebs menjadi L-Ornithine yang
merupakan prekusor dalam biosintesis nikotin. Kurangnya produk fotosintesis
berupa glukosa menyebabkan L-ornithine yang terbentuk berkurang, dengan
demikian nikotin yang dihasilkan pun akan berkurang.
Metode KLT dapat digunakan untuk memisahkan senyawa campuran
menjadi senyawa tunggal dengan prinsip pemisahan berdasarkan interaksi analit
dengan fase diam dan fase geraknya. Nikotin merupakan senyawa kimia yang
memiliki gugus polar dan gugus nonpolar yang dapat berinteraksi dengan fase
diam dan fase gerak pada sistem KLT. Bercak nikotin kemudian dapat diukur di
densitometer karena memiliki gugus kromofor yang dapat dideteksi oleh detektor
UV pada rentang panjang gelombang UV.
Penetapan kadar dilakukan dengan mengukur kerapatan bercak senyawa
nikotin yang dipisahkan dari ekstrak etanolik daun tembakau dengan kerapatan
bercak senyawa baku nikotin yang dielusikan bersama dan membandingkan nilai
AUC (Area Under Curve) antara keduanya. Persamaan kurva baku nikotin yang
didapatkan merupakan kurva hubungan antara konsentrasi baku nikotin dengan
AUC yang dihasilkan, dinyatakan dengan y = bx + a, dimana y adalah AUC dan x
adalah kadar nikotin. AUC sampel yang didapat kemudian dimasukkan dalam
persamaan kurva baku, sehingga kadar nikotin dalam ekstrak etanolik daun
tembakau dapat diketahui.
H. Hipotesis
Terdapat perbedaan antara kadar nikotin dalam ekstrak etanolik daun
26
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian non eksperimental deskriptif
karena tidak ada intervensi terhadap subjek uji.
B. Variabel 1. Variabel bebas
Variabel bebas dalam penelitian ini adalah ekstrak etanolik daun
tembakau VBN dan NO.
2. Variabel tergantung
Variabel tergantung dalam penelitian ini adalah kadar nikotin dalam
ekstrak etanolik daun tembakau VBN dan NO.
3. Variabel pengacau terkendali
Variabel pengacau terkendali yang terdapat dalam penelitian ini adalah:
a. pelarut, untuk mengatasinya digunakan pelarut pro analysis dengan
kemurnian tinggi.
b. Cahaya dan udara terkait dengan sifat nikotin yang fotosensitif dan mudah
teroksidasi, cara mengatasinya pada saat preparasi semua peralatan gelas yang
akan digunakan dilapisi dengan aluminium foil.
C. Definisi Operasional
1. Ekstrak etanolik daun tembakau merupakan ekstrak kental hasil ekstraksi daun
tembakau dengan soxhletasi menggunakan cairan penyari etanol.
2. Daun tembakau yang digunakan adalah Vorstenlanden Bawah Naungan
(VBN) dan Na Oogst (NO).
3. Sistem KLT yang digunakan adalah fase diam silika gel 60 F254 dan fase gerak
n-heksan:toluen:dietilamin (15,25:5,75:4).
4. Kadar nikotin dalam 1 gram ekstrak dinyatakan dalam satuan % b/b ± SD.
D. Bahan Penelitian
Semua bahan yang digunakan dalam penelitian ini berkualitas pro
analysis (p.a.) kecuali dinyatakan lain baku nikotin (E. Merck), etanol (E. Merck),
n-heksan (E. Merck), toluen (E. Merck), dietilamin (E. Merck), kloroform (E.
Merck), HCl (E. Merck), NaOH (E. Merck), aquadest, etanol teknis 96%
(Bratachem), lempeng KLT silika gel 60 F254 (E. Merck), indikator pH (E.
Merck), dan ekstrak etanolik daun tembakau VBN dan NO.
E. Alat-alat Penelitian
Alat yang digunakan dalam penelitian ini meliputi autosampler (CAMAG
Linomat 5 CAT. No. 027.7808 SER. No.170610 ), densitometer (CAMAG TLC
Scanner 3 CAT. No. 027.6485 SER. No. 160602), timbangan analitik (Ohaus
Carat Series PAJ 1003 max 60/120 g, min 0,001 g, d=0,01/0,1 mg, e=1 mg),
28
(Socorex), bejana kromatografi, corong pisah, cawan porselen, labu takar 5 ml,
flakon, pipet tetes, buret 25 ml,buret 10 ml, buret 5 ml, beaker glass 100 ml, kaca
pengaduk, magnetic stirrer (Heidolph MR 2002), ultrasonikator (Retschtipe T460
no. V935922013 Ey), tabung soxhlet, labu alas bulat 250ml, pendingin alihn.
F. Tata Cara Penelitian 1. Pemilihan dan pengambilan sampel
Sampel yang digunakan berupa daun tembakau kering VBN dan NO
yang diambil secara acak di lahan tembakau PT. Perkebunan Nusantara X Klaten.
2. Pembuatan serbuk daun tembakau
Daun tembakau kering yang didapatkan dari PT. Perkebunan Nusantara
X Klaten diserbukkan.
3. Pembuatan ekstrak etanolik daun tembakau
a. Optimasi lama waktu ekstraksi. Serbuk daun tembakau VBN
ditimbang kurang lebih seksama sebanyak 20 gram. Kemudian dibungkus dengan
kertas saring dan dimasukkan dalam tabung soxhlet yang telah terisi 130 ml etanol
teknis 96% dalam LAB. Optimasi lama waktu ekstraksi dilakukan pada waktu 7;
8; 9; dan 10 jam dengan suhu waterbath 80-90°C. Filtrat yang didapat kemudian
diuapkan dengan vacuum rotary evaporator dengan pemanas waterbath pada
suhu 65°C hingga diperoleh ekstrak agak kental dan dituangkan dalam cawan
porselin. Lalu hasil evaporator diuapkan di atas waterbath suhu 80°C dan didapat
ekstrak kental.
b. Ekstraksi daun tembakau hasil optimasi. Ekstraksi daun tembakau
VBN dan NO dilakukan dengan prosedur yang sama pada optimasi lama waktu
ekstraksi (3.a). Waktu optimal ekstraksi yang digunakan sesuai dengan hasil
optimasi (3.a). Ekstraksi untuk masing-masing tembakau direplikasi sebanyak 5
kali.
4. Pembuatan fase gerak
Campuran fase gerak yang digunakan dalam penelitian adalah
n-heksan:toluen:dietilamin (15,25:5,75:4). Fase gerak dibuat dalam labu takar 25,0
ml, kemudian digojog. Fase gerak dituang dalam bejana kromatografi kemudian
kertas saring dimasukkan dan ditempelkan pada sisi dinding bejana. Bejana
ditutup dengan rapat dan dibiarkan hingga seluruh kertas saring terbasahi oleh
fase gerak sebagai indikator bejana telah jenuh.
5. Pembuatan seri baku nikotin
a. Pembuatan larutan stok nikotin 50 ppm. Baku induk nikotin dipipet
sebanyak 248 µL dan dimasukkan ke dalam labu takar 5,0 ml. Kemudian
diencerkan dengan etanol hingga batas tanda dan diperoleh konsentrasi 50 ppm.
b. Pembuatan seri larutan baku nikotin. Larutan stok nikotin 50 ppm (5.a)
dipipet sebanyak 100; 200; 300; 400; 500 µL dan dimasukkan ke dalam labu takar
5,0 ml. Kemudian diencerkan dengan etanol hingga batas tanda dan diperoleh
konsentrasi baku berturut-turut 1; 2; 3; 4; 5 ppm.
6. Penetapan panjang gelombang (λ) serapan maksimum nikotin
Seri baku kadar 1;3;5 ppm ditotolkan dengan volume penotolan 1 µ l pada
30
jarak totol 1 cm dari bawah, 1 cm dari kiri dan jarak totolan 1 cm. Plat yang telah
ditotolkan kemudian dikembangkan dalam bejana kromatografi yang telah
dijenuhkan sebelumnya dengan fase gerak n-heksan:toluen:dietilamin
(15,25:5,75:4) dengan jarak rambat 10 cm. Plat hasil pengembangan dikeluarkan
kemudian dikeringkan.
Bercak larutan baku nikotin dengan kadar 1;3;5 ppm diukur (scanning)
AUC nya pada rentang panjang gelombang 200–300 nm dengan TLC Scanner.
Panjang gelombang maksimum ditentukan berdasarkan serapan maksimum yang
dihasilkan oleh bercak tersebut.
7. Pembuatan HCl encer
Asam klorida pekat (HCl p) dipipet sebanyak 2,26 ml, dimasukkan ke
dalam labu takar 10,0 ml dan diencerkan dengan aquadest hingga tanda.
8. Pembuatan NaOH 4N
Natrium Hidroksida (NaOH) ditimbang sebanyak 4 gram, dilarutkan
dengan aquadest dan dimasukkan ke dalam labu ukur 25,0 ml, kemudian
diencerkan hingga tanda batas.
9. Preparasi Sampel
Ekstrak etanolik daun tembakau VBN dan NO masing-masing ditimbang
kurang lebih seksama sebanyak 1 gram dan dilarutkan dengan 10 ml HCl encer
dalam beaker glass 50 ml dengan cara disonikasi selama 30 menit. Kemudian
kloroform ditambahkan sebanyak 10 ml dan dimasukkan ke dalam corong pisah.
Dilakukan penggojogan selama 5 menit. Setelah itu didiamkan hingga terbentuk 2
lapisan. Fase air (atas) diambil dan kemudian ditambahkan NaOH sedikit demi
sedikit sampai pH dari sampel menjadi basa (pH 13, ± 8ml) sambil distirer selama
5 menit. Setelah pH sampel menjadi basa, kloroform ditambahkan lagi sebanyak
10 ml. Fase kloroform (bawah) diambil dan selanjutnya diuapkan di lemari asam
hingga tak tersisa lagi kloroformnya. Residu nikotin yang telah diuapkan
kloroformnya kemudian dilarutkan dengan etanol dan dimasukkan ke dalam labu
takar 5,0 ml. Replikasi masing-masing sampel dilakukan sebanyak 5 kali.
10.Elusi baku dan ekstrak etanolik daun tembakau VBN dan NOpada KLT
Masing- masing larutan sampel dan seri baku kadar 1;2;3;4;5 ppm
ditotolkan dengan volume penotolan 1µ l pada plat KLT dengan fase diam silika
gel 60 F254 menggunakan autosampler dengan jarak totol 1 cm dari bawah, 1 cm
dari kiri dan jarak totolan 1 cm. Plat yang telah ditotolkan lalu dikembangkan
dalam bejana kromatografi yang telah dijenuhkan sebelumnya dengan fase gerak
n-heksan:toluen:dietilamin (15,25:5,75:4) dengan jarak rambat 10 cm. Plat hasil
pengembangan dikeluarkan kemudian dikeringkan.
11.Penetapan kurva baku nikotin
Bercak larutan seri baku kadar 1; 2; 3; 4; 5 ppmdiukur (scanning)
AUC-nya dengan TLC Scanner pada panjang gelombang maksimum hasil pengukuran
(poin 6). Persamaan regresi linear kemudian dihitung untuk digunakan sebagai
persamaan kurva baku.
12.Penetapan kadar nikotin dalam ekstrak etanolik daun tembakau VBN dan NO
Ekstrak etanolik yang telah dipreparasi pada hasil optimasi lama waktu
32
(scanning) AUCnya dengan menggunakan TLC Scanner pada panjang gelombang
maksimum hasil pengukuran (poin 6) sehingga didapatkan kromatogram sampel.
Hasil AUC dimasukkan ke dalam persamaan regresi linear baku sehingga
diperoleh kadar sampel.
G. Analisis Hasil
Analisis kualitatif dapat dilihat dari Rf dan analisa kuantitatif dari AUC
yang didapatkan dari hasil scanning. Hasil scanning baku dibuat persamaan
regresi linear y = bx + a. AUC sampel dimasukkan dalam persamaan kurva baku
sehingga didapat kadarnya. Satuan kadar nikotin dalam satu gram ekstrak adalah
%b/b ± SD.
Uji statistik yang dilakukan adalah uji t tidak berpasangan, uji statistik ini
dilakukan untuk mengetahui perbedaan kadar nikotin dalam ekstrak etanolik daun
tembakau VBN dan NO.
33
HASIL DAN PEMBAHASAN
Penetapan kadar nikotin dalam ekstrak etanolik daun tembakau VBN dan
NO dapat dilakukan menggunakan metode kromatografi lapis tipis (KLT)–
densitometri. Penelitian ini menggunakan metode yang telah dioptimasi dan
divalidasi yang sebelumnya dilakukan dalam serangkaian penelitian.
Pada tahap optimasi metode diperoleh komposisi fase gerak yang
optimum agar dapat memisahkan nikotin dalam ekstrak etanolik daun tembakau
dengan optimal. Fase gerak yang digunakan yaitu n-heksan:toluen:dietilamin
(15,25:5,75:4) dengan nilai indeks polaritas 0,901, nilai As = 1, nilai Rf = 0,56,
dan nilai resolusi = 1,54 (Chairio, 2011).
Pada tahap validasi metode diperoleh bahwa metode KLT–densitometri
yang digunakan telah memenuhi persyaratan validasi, yaitu selektivitas (dilihat
dari nilai Rs = 1,54) dan linearitas yang baik (r = 0,999), serta akurasi dan presisi
yang baik pada konsentrasi 3 ppm hingga 5 ppm (Ariani, 2012).
A. Pemilihan Sampel
Tujuan penelitian ini adalah untuk mengetahui dan membandingkan
kadar nikotin yang terkandung dalam ekstrak etanolik daun tembakau yang
berbeda cara tanamnya. Sampel yang digunakan adalah daun tembakau VBN dan
NO yang diperoleh dari perkebunan tembakau milik PT. Perkebunan Nusantara X
34
Teknik pengambilan sampel merupakan cara mengambil sampel yang
representatif dari populasi. Teknik pengambilan sampel yang digunakan adalah
probability sampling: simple random. Probability sampling merupakan teknik
sampling untuk memberikan peluang yang sama pada setiap anggota populasi
untuk dipilih menjadi anggota sampel. Sedangkan simple random ialah cara
pengambilan sampel dari anggota populasi secara acak. (Riduwan, 2008).
Pengambilan sampel dilakukan dengan menghubungi PT. Perkebunan
Nusantara X Klaten yang membudidayakan tembakau VBN dan NO. Pengambilan
daun tembakau dilakukan secara acak pada lahan perkebunan dengan jenis yang
berbeda.
B. Pembuatan Serbuk Daun Tembakau
Sampel daun tembakau yang diterima dari PT Perkebunan Nusantara X
Klaten berupa lembaran daun kering yang telah melalui tahap curing. Daun-daun
tembakau tersebut kemudian dikeringkan lagi dengan almari pengering selama 2
hari guna mendapatkan daun tembakau yang benar-benar kering. Daun yang telah
kering ditandai dengan daun yang mudah hancur saat diremas, sehingga
memudahkan dalam tahap penyerbukkan.
Pembuatan serbuk daun tembakau dilakukan untuk memperkecil ukuran
partikel. Proses pembuatan serbuk daun tembakau dilakukan di Lembaga Pusat
Penelitian Terpadu (LPPT) UGM dengan pengayakan serbuk berdiameter 1mm.
Tujuan dari pengayakan untuk memperoleh serbuk yang halus dan seragam
sehingga luas permukaan serbuk untuk kontak dengan pelarut semakin besar,
sehingga kandungan nikotin dalam daun tembakau akan tersari lebih banyak.
Berdasarkan Farmakope Indonesia edisi IV, ukuran lubang pengayak
1,00 mm menunjukkan nomor pengayak 18. Derajat halus serbuk dalam
Farmakope Indonesia edisi III dinyatakan dengan nomor pengayak. Apabila
derajat halus suatu serbuk dinyatakan dengan satu nomor, dimaksudkan bahwa
semua serbuk dapat melalui pengayak dengan nomor tersebut. Nomor pengayak
18 berarti semua serbuk dapat melalui pengayak nomor 18.
Serbuk yang terlalu halus dapat keluar dari celah antar jahitan pada
kantung kertas saring pada proses soxhletasi, sedangkan serbuk yang terlalu kasar
akan sulit ditembus oleh cairan penyari pada proses soxhletasi.
C. Ekstraksi secara Soxhletasi
Metode ekstraksi yang digunakan adalah soxhletasi. Metode soxhletasi
ini menggunakan pemanasan yang dilakukan terus menerus, nikotin termasuk
senyawa yang tahan terhadap pemanasan, titik didih nikotin cukup tinggi, yakni
246-247°C sehingga metode soxhletasi dapat digunakan untuk ekstraksi nikotin.
Alasan lain dalam pemilihan metode soxhletasi karena pengerjaannya mudah dan
cairan penyari yang digunakan lebih sedikit dibandingkan metode ekstraksi
lainnya (Direktorat Jenderal Pengawasan Obat dan Makanan, 1986).
Prinsip kerja adalah ekstraksi secara kontinyu dengan pemanasan dan
pendinginan berulang (refluks). Pemanasan menyebabkan pelarut menguap. Uap
36
simplisia yang dibungkus dengan kertas saring dimasukkan ke dalam tabung,
cairan penyari dipanaskan hingga mendidih. Uap cairan penyari naik ke atas
melalui pipa samping, kemudian diembunkan kembali melalui pendinginan tegak.
Cairan turun ke labu melalui tabung yang berisi serbuk daun tembakau.
Gambar 9. Alat soxhletasi: pendingin (a), aliran air (b), tabung soxhlet (c), serbuk daun tembakau dalam kertas saring (d), labu alas bulat (e), waterbath (f)
Cairan penyari yang digunakan pada penelitian ini adalah etanol 96%.
Etanol dapat melarutkan alkaloid basa, sehingga zat pengganggu yang larut hanya
terbatas (Direktorat Jenderal Pengawasan obat dan Makanan, 1986). Nikotin
termasuk golongan alkaloid basa, selain itu nikotin juga sangat larut dalam etanol
(The Merck Index, 1989).
Jumlah cairan penyari yang digunakan ialah sebanyak dua kali sirkulasi.
Satu kali sirkulasi dihitung ketika cairan naik sampai penuh di tabung soxhlet dan
turun kembali menuju labu alas bulat. Penggunaan cairan penyari sebanyak dua
kali sirkulasi dilakukan untuk menjaga kondisi ekstraksi apabila sudah terjadi satu
kali sirkulasi masih ada pelarut yang tertinggal di labu.
Pemanas yang digunakan adalah dengan menggunakan waterbath, karena
dengan menggunakan waterbath, suhu dapat diatur dan pemanasan di setiap
bagian waterbath sama (keseragaman suhu). Suhu yang digunakan pada
waterbath dijaga sekitar 80-90°C dengan pengamatan suhu pada termometer yang
dipasang pada statif, suhu ini berada di atas titik didih etanol (78°C).
Keuntungan ekstraksi dengan soxhletasi yaitu penarikan kandungan
kimianya dapat optimal karena pelarutnya selalu baru, pelarutnya diuapkan dan
dengan adanya pendinginan maka uap yang ada berubah menjadi tetes-tetes
pelarut lagi dan turun mengenai serbuk, demikian seterusnya hingga waktu yang
telah ditentukan selesai. Dalam penelitian ini didapatkan waktu optimal ekstraksi
adalah 8 jam.
Ekstrak cair hasil dari ekstraksi soxhletasi mengandung cairan penyari
etanol yang masih banyak (encer), sehingga perlu diubah menjadi ekstrak kental.
Proses pengentalan dapat dilakukan dengan penguapan menggunakan vacuum
rotary evaporator pada suhu 65°C. Prinsip dari vacuum rotary evaporator
(penguapan dengan disedot/divakum dan diputar) adalah penguapan pada suhu
rendah dengan cara menurunkan tekanan supaya zat aktif yang terdapat dalam
ekstrak tersebut tidak rusak. Pemanasan menyebabkan pelarut menguap kemudian
uap akan menetes masuk ke penampung. Perendaman labu alas bulat dalam air
panas adalah untuk meningkatkan suhu yang juga akan meningkatkan kecepatan
penguapan. Suhu yang digunakan adalah 65°C, sehingga dengan penurunan