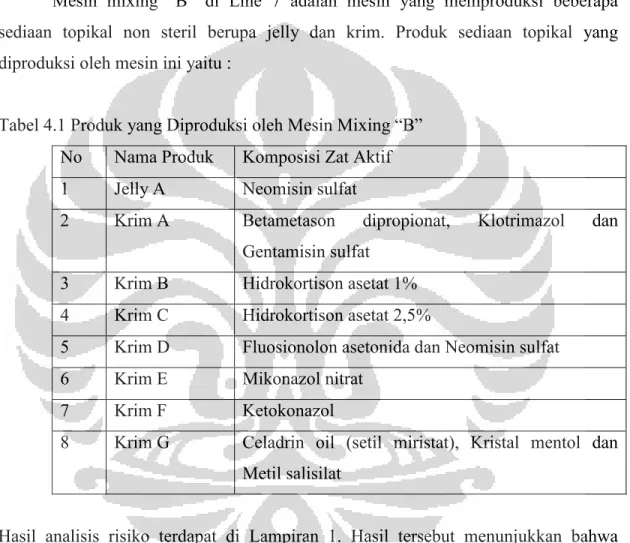
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI
KAWASAN INDUSTRI DELTA SILICON
JL M.H. THAMRIN BLOK A3
PERIODE
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
PATRICIA SIMON
PROGRAM PROFESI APOTEKER
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KALBE FARMA, Tbk.
KAWASAN INDUSTRI DELTA SILICON
JL M.H. THAMRIN BLOK A3-1, LIPPO CIKARANG, BEKASI
PERIODE 1 FEBRUARI – 28 MARET 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
PATRICIA SIMON, S. Farm.
1206313476
ANGKATAN LXXVI
FAKULTAS FARMASI PROGRAM PROFESI APOTEKER
DEPOK JUNI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
1, LIPPO CIKARANG, BEKASI
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI
KAWASAN INDUSTRI DELTA SILICON
JL M.H. THAMRIN BLOK A3
PERIODE
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar
PATRICIA SIMON
PROGRAM PROFESI APOTEKER
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. KALBE FARMA, Tbk.
KAWASAN INDUSTRI DELTA SILICON
JL M.H. THAMRIN BLOK A3-1, LIPPO CIKARANG, BEKASI
PERIODE 1 FEBRUARI – 28 MARET 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar
Apoteker
PATRICIA SIMON, S. Farm.
1206313476
ANGKATAN LXXVI
FAKULTAS FARMASI PROGRAM PROFESI APOTEKER
DEPOK JUNI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
1, LIPPO CIKARANG, BEKASI
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas berkat dan rahmat-Nya, penulis dapat menyelesaikan Laporan Praktek Kerja Profesi Apoteker (PKPA) di PT. Kalbe Farma, Tbk. Penulisan laporan ini dilakukan dalam rangka memenuhi salah satu syarat untuk mencapai gelar Apoteker pada Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia. Penulis menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak, penulis tidak bisa menyelesaikan laporan ini. Oleh karena itu, penulis menyampaikan terima kasih kepada:
1. Ibu Sumarti, S.Si., Apt., selaku pembimbing dan Manager Pemastian Mutu PT. Kalbe Farma, Tbk. yang telah mengarahkan dan membimbing penulis selama menjalankan PKPA di bagian Pemastian Mutu.
2. Dr. Harmita, Apt., selaku Ketua Program Profesi Apoteker Fakultas Farmasi UI dan pembimbing di Program Profesi Apoteker Fakultas Farmasi UI yang telah memberikan kesempatan, arahan, dan bimbingan selama pelaksanaan dan penyusunan laporan PKPA di PT. Kalbe Farma, Tbk.
3. Ibu Nurulhuda Sofianingrum, S. Farm., Apt. selaku Supervisor Pemastian Mutu PT. Kalbe Farma, Tbk yang telah banyak memberikan bimbingan dan pengetahuan selama melaksanakan PKPA di PT. Kalbe Farma, Tbk.
4. Prof. Dr. Yahdiana Harahap, M.S. selaku Dekan Fakultas Farmasi UI .
5. Seluruh staf di PT. Kalbe Farma, Tbk., khususnya para inspektor validasi atas kerja sama dan bantuan selama penulis melaksanakan kegiatan PKPA dan penyusunan laporan PKPA.
6. Seluruh staf pengajar Program Profesi Apoteker Fakultas Farmasi UI.
7. Keluargaku yaitu papa dan mama atas segala dukungan, motivasi, perhatian, kasih sayang, doa dan dana yang diberikan kepada penulis.
8. Teman-teman seperjuangan di PT. Kalbe Farma, Tbk. atas kerjasama selama pelaksanaan PKPA.
9. Semua pihak yang telah memberikan bantuan, bimbingan dan pengarahan kepada penulis selama penulisan laporan PKPA ini.
Penulis menyadari bahwa masih terdapat kekurangan dalam laporan PKPA ini. Oleh karena itu, penulis mengharapkan saran dan kritik untuk kesempurnaan laporan PKPA ini. Semoga pengetahuan dan pengalaman yang didapatkan penulis selama mengikuti PKPA dapat memberi manfaat bagi semua pihak yang membutuhkan.
Penulis
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Indonesia, saya yang bertanda tangan di bawah ini:
Nama : Patricia Simon
NPM : 1206313476
Program studi : Apoteker Departemen : Farmasi Fakultas : Farmasi Jenis karya : Karya Akhir
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Noneksklusif (Non-exclusive Royalty
Free Right) atas karya ilmiah saya yang berjudul:
Laporan Praktek Kerja Profesi Apoteker di PT. Kalbe Farma, Tbk. Kawasan Industri Delta Silicon Jl M.H. Thamrin Blok A3-1, Lippo Cikarang, Bekasi
Periode 1 Februari – 28 Maret 2013
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Noneksklusif ini Universitas Indonesia berhak menyimpan, mengalihmedia/format-kan, mengelola dalam bentuk pangkalan data (database), merawat, dan memublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian saya buat pernyataan ini dengan sebenarnya.
Dibuat di : Depok
Pada tanggal : Juni 2013 Yang menyatakan
DAFTAR ISI
HALAMAN JUDUL ...ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERSETUJUAN PUBLKIKASI KARYA ILMIAH ... vi
DAFTAR ISI ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 2. TINJAUAN UMUM ... 3 2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik ... 6
3. TINJAUAN KHUSUS PT. KALBE FARMA, Tbk. ... 13
3.1 Sejarah PT. Kalbe Farma Tbk ... 13
3.1 Visi dan Misi ... 15
3.2 Lokasi dan Tata Ruang ... 15
3.3 Struktur Organisasi PT. Kalbe Farma Tbk ... 28
4. PEMBAHASAN ... 36
4.1 Manajemen Mutu ... 36
4.2 Personalia ... 37
4.3 Bangunan dan Fasilitas ... 38
4.4 Peralatan ... 40
4.5 Sanitasi dan Higiene ... 42
4.6 Produksi ... 43
4.7 Pengawasan Mutu ... 46
4.8 Inspeksi Diri dan Audit Mutu ... 47
4.9 Penanganan Keluhan terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian ... 48
4.10 Dokumentasi ... 50
4.11 Pembuatan dan Analisis terhadap Kontrak ... 51
4.12 Kualifikasi dan Validasi ... 52
5. KESIMPULAN DAN SARAN ...55
5.1 Kesimpulan ...55
5.2 Saran ...55
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1.1. Latar Belakang
Kesehatan adalah salah satu hak asasi manusia dan harus diwujudkan sesuia dengan cita-cita bangsa Indonesia. Salah satu upaya Pemerintah dalam mewujudkan kesehatan adalah melalui pengadaan obat yang berkualitas untuk masyarakat (Presiden RI, 2009). Industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat dan bahan obat. Pembuatan obat adalah seluruh tahapan kegiatan dalam menghasilkan obat yang meliputi pengadaan bahan awal dan bahan pengemas, produksi, pengemasan, pengawasan mutu dan pemastian mutu sampai diperoleh obat untuk didistribusikan (Menteri Kesehatan RI, 2010).
Setiap industri farmasi harus memenuhi persyaratan Cara Pembuatan Obat yang Baik (CPOB) untuk menjamin agar obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. Aspek yang diatur dalam CPOB yaitu manajemen mutu; personalia; bangunan dan fasilitas; peralatan; sanitasi dan higiene; produksi; pengawasan mutu; inspeksi diri, audit mutu, dan audit persetujuan pemasok; penanganan keluhan terhadap produk dan penarikan kembali produk; dokumentasi; pembuatan dan analisis berdasarkan kontrak dan kualifikasi dan validasi. Aspek tersebut mencakup seluruh aspek produksi dan pengendalian mutu karena mutu obat terbentuk dari sepanjang proses pembuatan obat (BPOM, 2012).
Setiap sumber daya manusia dalam industri farmasi harus memahami prinsip CPOB. Apoteker adalah salah satu sumber daya manusia yang mutlak diperlukan dalam proses penerapan CPOB di suatu industri farmasi. Apoteker di industri farmasi adalah personil kunci bidang produksi, pengawasan mutu, dan pemastian mutu. Dalam memenuhi tanggung jawabnya, seorang apoteker harus memperoleh pelatihan yang sesuai, memiliki pengalaman praktis yang memadai dan keterampilan manajerial sehingga mampu mengerjakan tugasnya secara profesional (BPOM, 2012).
Dalam rangka pembinaan terhadap generasi apoteker baru di industri farmasi, PT. Kalbe Farma, Tbk. memberi kesempatan kepada calon apoteker untuk melaksanakan Praktek Kerja Profesi Apoteker. Kegiatan ini memberikan kesempatan kepada calon Apoteker untuk memperoleh pengalaman yang bermanfaat dan memahami peran Apoteker dalam produksi obat serta melihat penerapan CPOB di industri farmasi.
1.2 Tujuan
Tujuan pelaksanaan PKPA di PT. Kalbe Farma, Tbk. adalah untuk:
a. Memperoleh pengetahuan dan wawasan mengenai penerapan segala aspek CPOB di PT. Kalbe Farma, Tbk.
2.1. Industri Farmasi (Menteri Kesehatan RI, 2010)
Menurut Peraturan Menteri Kesehatan Republik Indonesia Nomor 1799/MENKES/PER/XII/2010 tentang Industri Farmasi, yang dimaksud dengan industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat. Fungsi industri farmasi adalah pembuatan obat/bahan obat, pendidikan & pelatihan dan penelitian & pengembangan. Setiap pendirian Industri Farmasi wajib memperoleh izin Industri Farmasi dari Direktur Jendral Kementrian Kesehatan. Persyaratan untuk memperoleh izin industri farmasi yaitu
a. Berbadan usaha berupa perseroan terbatas
b. Memiliki rencana investasi dan kegiatan pembuatan obat c. Memiliki NPWP
d. Memiliki secara tetap 3 orang apoteker Warga Negara Indonesia masing-masing sebagai penanggung jawab pemastian mutu, produksi dan pengawasan mutu
e. Komisaris dan direksi tidak pernah terlibat, baik langsung dan tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
Agar dapat memperoleh izin usaha industri farmasi, diperlukan tahap persetujuan prinsip. Permohonan persetujuan prinsip diajukan kepada Direktur Jendral dengan tembusan kepada kepala Badan dan kepada kepala Dinas Kesehatan Provinsi setelah sebelumnya mengajukan permohonan Rencana Induk Pembangunan (RIP) kepada kepala Badan. Persetujuan prinsip diberikan kepada industri farmasi untuk dapat langsung melakukan persiapan dan usaha pembangunan, pengadaan, pemasangan instalasi, peralatan dan lain-lain yang diperlukan, termasuk produksi percobaan dengan memperhatikan ketentuan perundang-undangan di bidang obat. Persetujuan prinsip tersebut berlaku selama jangka waktu 3 tahun dan selama jangka waktu tersebut, perusahaan yang bersangkutan harus menyampaikan laporan informasi kemajuan pembangunan
fisik setiap 6 bulan sekali kepada Direktur Jenderal dengan tembusan kepada Kepala Badan Pengawas Obat dan Makanan (Badan POM) dan Kepala Dinas Kesehatan Provinsi.
Persyaratan agar mendapatkan persetujuan prinsip, yaitu :
a. Fotokopi akta pendirian badan hukum yang sah sesuai ketentuan peraturan perundang-undangan
b. Fotokopi KTP/identitas direksi dan komisaris perusahaan c. Susunan direksi dan komisaris
d. Pernyataan direksi dan komisaris tidak pernah terlibat pelanggaran peraturan perundang-undangan di bidang farmasi
e. Fotokopi sertifikat tanah/bukti kepemilikan
f. Fotokopi Surat Izin Tempat Usaha berdasarkan Undang-Undang Gangguan (HO)
g. Fotokopi Surat Tanda Daftar Perusahaan h. Fotokopi Surat Izin Usaha Perdagangan i. Fotokopi NPWP
j. Persetujuan lokasi dari pemerintah daerah provinsi k. Persetujuan RIP dari Kepala Badan
l. Rencana investasi dan kegiatan pembuatan obat
m. Surat asli pernyataan kesediaan bekerja penuh dari masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu
n. Fotokopi surat pengangkatan bagi masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu
Setelah selesai melaksanakan tahap persetujuan prinsip, dapat dilakukan permohonan izin usaha industri. Permohonan diajukan kepada Direktur Jenderal Kementrian Kesehatan dengan tembusan kepada Kepala BPOM dan Kepala Dinas Kesehatan Provinsi setempat. Izin industri farmasi berlaku untuk seterusnya selama industri farmasi bersangkutan masih berproduksi dan memenuhi ketentuan peraturan perundang-undangan. Surat permohonan izin industri farmasi harus ditandatangani oleh direktur utama dan apoteker penganggung jawab pemastian mutu dengan kelengkapan yaitu :
a. Fotokopi persetujuan prinsip Industri Farmasi
b. Surat persetujuan penanaman modal untuk industri farmasi dalam rangka Penanaman Modal Asing (PMA) atau Penanaman Modal Dalam Negeri (PMDN)
c. Daftar peralatan dan mesin yang digunakan d. Jumlah tenaga kerja dan kualifikasinya
e. Fotokopi sertifikat upaya Pengelolaan Lingkungan dan Upaya Pemantauan Lingkungan /Analisis Mengenai Dampak Lingkungan
f. Rekomendasi kelengkapan administratif izin industri farmasi dari Kepala Dinas Kesehatan Provinsi
g. Rekomendasi Pemenuhan CPOB dari Kepala BPOM. h. Daftar pustaka wajib seperti Farmakope edisi terakhir
i. Surat asli pernyataan kesediaan bekerja penuh dari masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu
j. Fotokopi surat pengangkatan bagi masing-masing apoteker penanggung jawab produksi, pengawasan mutu dan pemastian mutu dari pimpinan perusahaan k. Fotokopi ijazah dan STRA dari masing--masing apoteker penanggung jawab
produksi, pengawasan mutu dan pemastian mutu
l. Surat pernyataan komisaris dan direksi tidak pernah terlibat, baik langsng maupun tidak langsung dalam pelanggaran peraturan perundang-undangan di bidang kefarmasian.
Industri farmasi yang melakukan penambahan kapasitas produksi atau penambahan bentuk sediaan tidak memerlukan izin perluasan. Izin perluasan diperlukan apabila perusahaan yang bersangkutan akan menambah luas area produksi. Izin usaha industri farmasi berlaku untuk seterusnya selama perusahaan industri farmasi yang bersangkutan berproduksi. Permohonan izin usaha industri farmasi dapat diajukan setelah pembangunan fisik industri farmasi selesai dan perusahaan siap melaksanakan kegiatan produksi komersial.
2.2. Cara Pembuatan Obat yang Baik (CPOB)
CPOB diterapkan untuk memastikan agar mutu obat yang dihasilkan sesuai dengan persyaratan dan tujuan penggunaan. CPOB mencakup seluruh aspek produksi dan pengawasan mutu. CPOB merupakan pedoman yang sangat penting tidak hanya bagi industri farmasi dan regulator, tetapi juga bagi konsumen dalam memenuhi kebutuhannya akan pengobatan yang aman, berkhasiat, dan berkualitas. Terdapat 12 aspek dalam CPOB, yaitu:
2.2.1 Manajemen Mutu
Dalam manajemen mutu, industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar dan tidak menimbulkan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah, atau tidak efektif. Manajemen mutu bertanggung jawab untuk pencapaian tujuan ini melalui suatu kebijakan mutu yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen dalam perusahaan, para pemasok, dan distributor.
Unsur dasar manajemen mutu adalah suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses, dan sumber daya, serta tindakan sistematis untuk mendapatkan kepastian dengan tingkat kepercayaan tinggi, sehingga produk atau jasa pelayanan yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut pemastian mutu.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pengawasan mutu yang memuaskan dan pembuatan obat yang benar. Industri farmasi bertanggungjawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing. Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal yang berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan.
Personil Kunci mencakup kepala bagian Produksi, kepala bagian Pengawasan Mutu dan kepala bagian Manajemen Mutu (Pemastian Mutu). Posisi utama tersebut dijabat oleh personil purnawaktu. Kepala bagian Produksi dan kepala bagian Manajemen Mutu (Pemastian Mutu) / kepala bagian Pengawasan Mutu harus independen satu terhadap yang lain.
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat harus memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadi kekeliruan, pencemaran silang dan kesalahan lain, serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindarkan pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Persyaratan bangunan menurut CPOB yaitu
a. Letak bangunan hendaklah sedemikian rupa untuk mencegah terjadinya pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah, dan air maupun dari kegiatan industri lain yang berdekatan
b. Bangunan dan fasilitas hendaklah dikonstruksi, dilengkapi, dan dirawat agar memperoleh perlindungan maksimal.
c. Dalam menentukan rancang bangunan dan tata letak hendaklah dipertimbangkan hal-hal sebagai berikut: kesesuaian dengan kegiatan lain, yang mungkin dilakukan dalam sarana yang sama atau dalam sarana yang berdampingan; tata letak ruang yang sedemikian rupa untuk memungkinkan kegiatan produksi dilaksanakan di daerah yang letaknya diatur secara logis dan berhubungan mengikuti urutan tahap produksi dan menurut kelas kebersihan yang disyaratkan; luasnya ruang kerja yang memungkinkan penempatan peralatan dan bahan secara teratur dan logis serta terlaksananya kegiatan, kelancaran arus kerja, komunikasi dan pengawasan yang efektif; pencegahan penggunaan kawasan industri sebagai lalu lintas umum;
dirancang dan dibangun secara khusus;
e. Produk antibiotika tertentu, hormone tertentu, sitotoksik tertentu, bahan aktif berpotensi tinggi hendaklah diproduksi di bangunan terpisah;
f. Permukaan bagian dalam ruangan (dinding, lantai, dan langit-langit) hendaklah licin, bebas dari keretakan, dan sambungan yang terbuka serta mudah dibersihkan dan bila perlu mudah didesinfeksi.
g. Saluran air limbah hendaklah cukup besar dan mempunyai bak kontrol serta ventilasi yang baik;
h. Area produksi diventilasi secara efektif dengan fasilitas pengendali udara
2.2.4 Peralatan
Pembuatan obat hendaklah menggunakan peralatan yang memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, sehingga mutu yang dirancang bagi tiap produk obat terjamin secara seragam dari bets ke bets dan memudahkan pembersihan dan perawatannya. Permukaan peralatan yang bersentuhan dengan bahan baku, produk antara, produk ruahan atau obat jadi tidak boleh bereaksi atau mengabsorpsi, yang dapat mengubah identitas, mutu, atau kemurniannya di luar batas yang telah ditentukan.
Hendaklah tersedia alat timbang dan alat ukur dengan rentang dan ketelitian yang tepat untuk proses produksi dan pengawasan. Peralatan untuk mengukur, menimbang, mencatat dan mengendalikan hendaklah dikalibrasi dan diperiksa pada interval waktu tertentu dengan metode yang ditetapkan.
Peralatan hendaklah dipasang sedemikian rupa untuk mencegah risiko kesalahan atau kontaminasi. Antara masing-masing peralatan hendaklah ditempatkan pada jarak yang cukup untuk menghindarkan kesesakan dan memastikan tidak terjadi kekeliruan dan kecampurbauran produk.
Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat memengaruhi identitas, mutu atau kemurnian produk. Peralatan dan alat bantu hendaklah dibersihkan, disimpan, dan bila perlu disanitasi dan disterilisasi untuk mencegah kontaminasi atau sisa bahan dari proses sebelumnya yang akan memengaruhi mutu produk.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personil, bangunan, peralatan, dan perlengkapan, bahan produksi serta wadahnya dan segala sesuatu yang dapat merupakan sumber kontaminasi produk. Program sanitasi dan higiene yang menyeluruh dan terpadu dilakukan untuk menghilangkan sumber kontaminasi potensial.
Penerapan higiene perorangan meliputi pemeriksaan kesehatan, mencuci tangan sebelum memasuki area produksi, memakai pakaian pelindung. Semua personil hendaklah menjalani pemeriksaan kesehatan pada saat direkrut. Sesudah pemeriksaan kesehatan awal hendaklah dilakukan pemeriksaan kesehatan kerja dan kesehatan personil secara berkala. Tiap personil yang mengidap penyakit atau menderita luka terbuka yang dapat merugikan mutu produk hendaklah dilarang menangani bahan awal, bahan pengemas, bahan yang sedang diproses dan obat jadi sampai kondisi personil tersebut dipertimbangkan tidak lagi menimbulkan risiko. Kegiatan makan, minum dan merokok tidak diperbolehkan dalam area gudang, laboratorium dan area produksi.
Sanitasi meliputi bangunan dan fasilitas. Tiap bangunan yang digunakan untuk pembuatan obat hendaklah didesain dan dikonstruksi dengan tepat untuk memudahkan sanitasi yang baik. Tiap kali sebelum dipakai, kebersihan peralatan diperiksa untuk memastikan bahwa semua produk atau bahan dari bets sebelumnya telah dihilangkan. Prosedur pembersihan, sanitasi dan higiene hendaklah divalidasi dan dievaluasi secara berkala untuk memastikan efektivitas prosedur memenuhi persyaratan.
2.2.6 Produksi
Kegiatan produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi).
Unsur-unsur produksi yang diatur oleh CPOB meliputi pembelian bahan awal yaitu bahan baku & bahan pengemas; validasi proses; pencegahan kontaminasi silang; sistem penomoran bets/ lot; penimbangan & penyerahan;
pengolahan; pengemasan; pengawasan selama proses; penanganan bahan dan produk yang ditolak, dipulihkan & dikembalikan; karantina & penyerahan produk jadi; catatan pengendalian pengiriman obat; penyimpanan bahan awal, bahan kemas, produk antara, produk ruahan & produk jadi dan pengiriman & pengangkutan.
2.2.7 Pengawasan Mutu
Kegiatan pengawasan mutu merupakan bagian yang penting dari CPOB untuk memastikan bahwa produk yang dibuat senantiasa mempunyai mutu yang sesuai dengan tujuan penggunaannya. Keterlibatan dan komitmen semua pihak yang berkepentingan dalam seluruh rangkaian pembuatan adalah mutlak untuk mencapai sasaran mutu yang ditetapkan mulai dari awal pembuatan sampai distribusi obat jadi. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Pengawasan Mutu hendaklah mencakup semua kegiatan analisis.
Pengawasan Mutu mencakup pengambilan sampel, spesifikasi, pengujian serta termasuk pengaturan, dokumentasi dan prosedur pelulusan yang memastikan bahwa semua pengujian yang relevan telah dilakukan, dan bahan tidak diluluskan untuk dipakai atau produk diluluskan untuk dijual, sampai mutunya telah dibuktikan memenuhi persyaratan. Pengawasan Mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan Pengawasan Mutu dari Produksi dianggap hal yang fundamental agar Pengawasan Mutu dapat melakukan kegiatan dengan memuaskan.
2.2.8. Inspeksi Diri, Audit Mutu, dan Audit & Persetujuan Pemasok
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB ditetapkan. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan. Inspeksi diri hendaklah dilakukan
secara rutin dan pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Prosedur dan catatan inspeksi diri hendaklah didokumentasikan dan dibuat program tindak lanjut yang efektif.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen dengan tujuan spesifik untuk meningkatkan mutu. Audit mutu umumnya dilaksanakan oleh spesialis dari luar, independen, atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan.
2.2.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali, dan Obat Kembalian
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif.
Penarikan kembali produk dapat berupa satu atau beberapa bets atau seluruh bets produk tertentu dari semua peredaran distribusi. Hendaklah tersedia prosedur tertulis yang diperiksa secara berkala untuk mengatur segala tindakan penarikan kembali. Tindakan penarikan kembali produk hendaklah dilakukan segera setelah diketahui ada produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan. Catatan dan laporan penarikan kembali produk hendaklah didokumentasikan dengan baik
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, dokumen produksi induk/ formula pembuatan, prosedur, metode, instruksi, laporan, dan catatan harus
bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak dilakukan jika suatu perusahan membuat produk di perusahaan lain atau sebaliknya. Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dengan penerima kontrak harus dibuat secara jelas dalam hal tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian manajemen mutu (pengawasan mutu).
2.2.12 Kualifikasi dan Validasi
Kualifikasi dan validasi adalah bagian penting dari sistem pemastian mutu sehingga tercantum sebagai persyaratan CPOB bagi industri farmasi. CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV). Validasi diklasifikasikan menjadi tiga, yakni validasi pembersihan, validasi metode analisis dan validasi proses. Kualifikasi diklasifikasikan menjadi empat, yaitu kualifikasi desain, kualifikasi instalasi, kualifikasi operasional dan kualifikasi kinerja.
3.1. Sejarah dan Perkembangan
PT. Kalbe Farma, Tbk. didirikan oleh seorang farmakolog bernama dr. Boenjamin Setiawan pada tanggal 10 September 1966 di sebuah garasi rumah di Jalan Simpang I No. 1, Tanjung Priok, Jakarta Utara. Nama Kalbe merujuk pada nama para pemegang saham awal, yakni Khoew Sioe Tjiang, Liem Lian Kiok dan Boenjamin Setiawan. Tujuan pendirian PT. Kalbe Farma, Tbk. adalah turut berpartisipasi dalam pembangunan nasional pada umumnya dan meningkatkan kesejahteraan serta derajat kesehatan masyarakat pada khususnya, yang tercermin dalam moto perusahaan yaitu The Scientific Pursuit of Health For A Better Life (Mengabdikan Ilmu Untuk Kesehatan dan Kesejahteraan).
Tujuan pendirian PT. Kalbe Farma Tbk. yang semula berupa home
industry ini adalah untuk berpartisipasi dalam pembangunan masyarakat pada
umumnya dan meningkatkan kesejahteraan serta derajat kesehatan masyarakat pada khususnya. Produk pertama yang dihasilkan oleh PT. Kalbe Farma adalah obat kulit Bioplacenton yang menjadi ciri khas PT. Kalbe Farma hingga sekarang. Produk PT. Kalbe Farma kemudian berkembang menjadi berbagai macam produk farmasi sesuai dengan kebutuhan konsumen yang beragam. Dalam rangka meningkatkan pelayanan penyediaan obat sebagai tuntutan atas meningkatnya kebutuhan obat yang berkualitas maka pada bulan April 1972, PT. Kalbe Farma melakukan perluasan usahanya dengan memindahkan usahanya ke lokasi yang lebih luas yaitu ke Jl. Ahmad Yani, Pulomas, Jakarta Timur. Pada tahun 1980, aktivitas distribusi produk-produk PT. Kalbe Farma dipisahkan dari kegiatan industrinya yaitu dengan mendirikan PT. Enseval Putra Megatrading yang bertindak sebagai distributor tunggal PT. Kalbe Farma.
Dalam menjalankan setiap kegiatannya, PT Kalbe Farma, Tbk. senantiasa bertujuan untuk memenuhi dan atau mencapai visi yang diterapkan perusahaan. Visi, Misi, Motto, Goal, danStrategi PT Kalbe Farma Tbk. adalah sebagai berikut :
1. Visi PT. Kalbe Farma, Tbk.:
“Menjadi perusahaan perawatan kesehatan Indonesia terbaik yang dimotori oleh inovasi, nama dagang yang kuat dan manajemen yang unggul”
2. Misi PT. Kalbe Farma, Tbk.:
“Meningkatkan kesehatan untuk kehidupan yang lebih baik” 3. Motto PT. Kalbe Farma, Tbk.:
“Mengabdikan ilmu di bidang kesehatan untuk kesehatan dan kesejahteraan” Selain itu, PT Kalbe Farma, Tbk. juga membuat suatu core values (nilai inti) yang berfungsi menunjang penerapan visi dan misi yaitu berupa Kalbe Panca Sradha dan dijadikan landasan oleh seluruh karyawan dalam menjalankan kinerja sehari-hari:
1. Trust is the glue of life
Saling percaya adalah perekat diantara kami.
2. Mindfulness is the foundation of our action
Kesadaran penuh adalah dasar setiap tindakan kami.
3. Innovation is the key to our success
Inovasi adalah kunci keberhasilan kami.
4. Strive to be the best
Bertekad untuk menjadi yang terbaik.
5. Interconnectedness is a universal way of life
Saling keterkaitan adalah panduan hidup kami.
Gambar 1.1 Logo PT. Kalbe Farma, Tbk.
PT. Kalbe Farma Tbk. berhasil melakukan integrasi sertifikasi ISO 9001:2000, sertifikasi ISO 14001:2004 dan OHSAS 18001:1999.
3.2. Visi dan Misi
Visi PT. Kalbe Farma, Tbk. adalah ”Menjadi perusahaan perawatan kesehatan terbaik yang dimotori oleh inovasi, nama dagang yang kuat, dan manajemen yang unggul”. Untuk mencapai visi tersebut, PT. Kalbe Farma, Tbk. menetapkan misi perusahaan yakni “Meningkatkan kesehatan untuk kehidupan yang lebih baik”. Misi tersebut terfokus pada tiga elemen utama, yaitu:
a. Konsumen
PT. Kalbe Farma, Tbk. mampu menyediakan produk berkualitas dengan harga murah dan terjangkau, mudah diperoleh, serta dengan pelayanan yang prima untuk menyenangkan hati pelanggan agar menjadi pilihan pertama konsumen. b. Sumber Daya Manusia (SDM)
PT. Kalbe Farma, Tbk. mampu mewujudkan SDM yang sesuai dengan kualifikasi dan tuntutan pekerjaan, memiliki dedikasi tinggi, inovatif, berorientasi pada pelayanan dan kualitas, serta pengembangan SDM melalui proses belajar yang berkelanjutan dan lingkungan kerja yang sehat dan mendukung.
c. Proses dan Kualitas
PT. Kalbe Farma, Tbk. mampu meningkatkan kecepatan dan efisiensi proses kerja melalui sistem dan prosedur kerja yang rapi sesuai dengan perencanaan, usaha, pemeriksaan, dan aksi (plan, do, check, and action/PDCA).
Visi dan misi tersebut didukung oleh nilai-nilai utama yakni gigih untuk mencapai yang terbaik, inovasi, kerjasama yang kokoh, lincah, memberikan pelayanan terbaik, serta integritas. Dalam mencapai visi dan misi tersebut, PT. Kalbe Farma, Tbk. memiliki moto The Scientific Pursuit of Health For A
Better Life (Mengabdikan Ilmu Untuk Kesehatan dan Kesejahteraan).
3.3. Lokasi dan Tata Ruang
PT. Kalbe Farma, Tbk. terletak di Kawasan Industri Delta Silicon Jalan M.H. Thamrin Blok A1-3, Lippo Cikarang, Bekasi. Bangunan ini terdiri dari gedung kantor, gedung produksi, teknik, gudang dan sarana pendukung seperti pengolahan limbah, lapangan parkir, koperasi, dan kantin. Bangunan PT. Kalbe Farma, Tbk. terdiri dari dua bagian yaitu bangunan kantor dan bangunan pabrik.
3.3.1 Bangunan Kantor
Gedung kantor PT. Kalbe Farma, Tbk. terdiri dari empat lantai yaitu: a. Lantai 1 meliputi bagian Operasional Cikarang, Departemen Sumber Daya
Manusia dan Pengembangan, Departemen Personalia dan Umum, Departemen Pengembangan Proses, Departemen Akuntansi, ruang perpustakaan, dan kantin.
b. Lantai 1½ meliputi Departemen Perencanaan Produksi dan Pengendalian Persediaan Pusat, Departemen Veteriner, serta Departemen Teknologi Informasi.
c. Lantai 2 meliputi Departemen Keuangan dan Pemasaran, serta Departemen Hukum atau Legal.
d. Lantai 3 meliputi Departemen Research and Development, yang terdiri dari bagian pengembangan operasional Cikarang dengan laboratorium formulasi dan laboratorium pengembangan metode analisis, Departemen Pemastian Mutu, Departemen Pengawasan Mutu dengan laboratorium pengawasan mutu. e. Lantai 4 meliputi ruangan pilot plant Departemen Research and Development.
3.3.2 Bangunan Pabrik
Gedung produksi terdiri dari tiga lantai yang masing-masing lantai dipisahkan oleh ruang yang disebut Mezanin, yaitu ruang khusus untuk penempatan fasilitas utilitas seperti penyedot udara, pipa-pipa, kabel listrik, dan lain-lain. Tiap lantai terdiri dari jalur-jalur produksi dengan jumlah total 10 jalur, yaitu jalur 1, 2, 4, 5, 6, 7, 8A, 8B, 9 dan 10. Pada tahun 2013, ada penambahan kapasitas ruangan pada line tertentu dan sampai penyusunan laporan ini dibuat ruangan tersebut sedang dalam kualifikasi sistem bangunan dan fasilitas. Pembagian ruangan pada gedung produksi adalah sebagai berikut:
a. Lantai dasar digunakan untuk ruang produksi jalur 9 dan 10, gudang alkohol, Departemen Teknik, Ruang QA Facility Utility dan ruang loker karyawan. b. Lantai 1 digunakan untuk ruang produksi jalur 1, jalur 2, jalur 4, jalur 5,
gudang bahan baku dan wadah, gudang kemas, dan gudang obat jadi. c. Lantai 2 digunakan untuk ruang produksi jalur 6, jalur 7, jalur 8A, dan 8B.
d. Lantai 3 digunakan untuk ruang purified water generator, pure steam
generator, water for injection generator, dan oil free air compressor.
Lantai ruang produksi di PT. Kalbe Farma, Tbk. dicat dengan cat epoksi agar mudah dibersihkan, dibuat melengkung (tidak memiliki sudut) agar tidak menjadi tempat berkumpulnya debu, serta bingkai jendelanya dibuat miring dengan maksud agar mudah dibersihkan dan juga tidak menjadi tempat berkumpulnya debu. Berdasarkan CPOB tahun 2012, ruangan di industri farmasi dibagi menjadi 5 jenis area berdasarkan perbedaan tingkat kebersihannya, yaitu kelas A, B, C, D dan E. Kelas A, B, C, dan D digunakan untuk produksi sediaan steril dan kelas E untuk produksi sediaan nonsteril. PT. Kalbe Farma, Tbk. telah menyesuaikan kembali klasifikasi ruangan sesuai dengan pedoman CPOB 2012. Meskipun demikian dalam kesehariannya area produksi steril (kelas A, B, C, dan D) masih disebut sebagai area putih (white area), area produksi nonsteril (kelas E) disebut area abu-abu (grey area), dan area pengemasan sekunder disebut area hitam (black area).
3.4 Struktur Organisasi PT. Kalbe Farma, Tbk.
Bagan struktur organisasi PT. Kalbe Farma, Tbk. dapat dilihat pada Lampiran 1.
3.4.1 Departement Research and Development
Departemen Research and Development (R&D) berperan antara lain dalam pengembangan produk baru, perbaikan, atau improvement existing product, pengatasan masalah produksi, proyek penelitian khusus, penentuan spesifikasi bahan baku untuk manufacturing, penyusunan metode analisa, penentuan
shelf-life produk, dan penunjang data untuk penyusunan dossier registrasi (formula,
data stabilitas, dan kemasan). Departemen R&D dipimpin oleh seorang R&D
Pharma Deputy Director. Departemen R&D mencakup tiga bagian utama, yaitu:
3.4.1.1 Packaging Development (pengembangan kemasan)
Tugas utama Packaging Development adalah melakukan penelitian dan pengembangan material kemasan (primer dan sekunder) untuk produk baru,
melakukan penelitian dan pengembangan desain produk baru, dan menyiapkan atau menyediakan dokumen yang terkait dengan kemasan meliputi dokumen spesifikasi, metode analisis (MA), dan Prosedur Pengemasan Induk 3 (PPI 3).
3.4.1.2 Formulation (pengembangan formula)
Tugas utama Formulation adalah pengembangan produk baru, baik OTC maupun ethical, sesuai dengan perkembangan teknologi sediaan farmasi. Proses pengembangan produk baru ini dapat dilakukan di dalam perusahaan atau di luar perusahaan, misalnya melalui kegiatan lisensi atau bekerja sama dengan lembaga penelitian/ pendidikan.
3.4.1.3 Analytical Development (pengembangan metode analisis) Tugas utama Analytical Development adalah sebagai berikut:
a. Mengembangkan metode analisis suatu senyawa obat, bahan pengemas, dan sampel produk sehingga diperoleh metode analisis yang sesuai. Metode analisis yang diperoleh selanjutnya divalidasi dan dijadikan acuan analisis pemeriksaan rutin sehingga metode analisis tersebut menjadi valid, efektif, dan praktis.
b. Menentukan approved manufacturer bahan baku baru yang digunakan di PT. Kalbe Farma, Tbk.
3.4.2 Departemen Process Development
Pada awalnya Departemen Process Development merupakan bagian dari departemen Research & Development. Pada awal tahun 2007, Process
Development dipisahkan dari Departemen R&D di mana R&D fungsinya lebih ke
arah riset pengembangan produk baru sedangkan untuk Proses Development lebih ke produk-produk yang sudah ada (existing product). Secara umum Departemen
Proses Development menangani semua produk-produk yang sudah ada (existing),
menerima peralihan tanggung jawab terhadap status material yang berubah dari percobaan menjadi induk, dan mengatasi masalah atau trouble shooting produksi. Departemen Process Development dibagi menjadi 2 bagian, yaitu:
3.4.2.1 Formulation (formulasi)
Tugas utama bagian formulasi adalah memperbaiki atau mengembangkan formula-formula produk existing, mendukung bagian produksi jika ada masalah terutama dalam hal formulasi, dan mendukung bagian pembelian (purchasing) dalam hal diversifikasi raw material. Menyiapkan dokumen untuk bagian produksi, seperti: Prosedur Pengolahan Induk 1 (PPI 1) yang berisi keterangan
Raw Material yang digunakan dan Prosedur Pengolahan Induk 2 (PPI 2) yang
berisi prosedur pembuatan obat dan spesifikasinya.
3.4.2.2 Packaging (kemasan)
Tugas utama bagian kemasan adalah melakukan penelitian dan pengembangan material kemasan, baik primer dan sekunder, penelitian dan pengembangan tersebut juga mencakup uji stabilitas dan trial di produksi (jika diperlukan). Selain itu bagian kemasan juga melakukan penelitian dan pengembangan desain kemasan produk existing, mulai dari pembuatan konsep, verifikasi sampai dengan penyiapan disket dan print-out final art work untuk dikirim ke supplier kemasan serta menyiapkan/ menyediakan dokumen yang terkait dengan kemasan, seperti Prosedur Pengolahan Induk (PPI) dan Production
Model (PM) Kemas. Bagian ini juga memberi dukungan terhadap bagian lain
untuk masalah-masalah yang terkait/ berhubungan dengan kemasan, seperti pembelian mesin baru di bagian produksi, diversifikasi supplier oleh bagian
Purchasing dan permintaan penyederhanaan prosedur pemeriksaan dari bagian
QC.
3.4.3 Departemen Perencanaan Produksi dan Pengendalian Persediaan
Departemen Perencanaan Produksi dan Pengendalian Persediaan/
Production Planning and Inventory Control (PPIC) PT. Kalbe Farma, Tbk.
merupakan bagian dari grup PPIC dari empat situs perusahaan yang berada di bawah grup Kalbe, yaitu PT. Kalbe Farma, Tbk., PT. Dankos Farma, PT. Hexpharm Jaya, dan PT. Fima. Grup PPIC ini menjadi penghubung antara bagian pemasaran dan distributor, yaitu PT. Enseval Putera Megatrading dengan divisi produksi masing-masing situs.
PPIC manager membawahi PPIC specialist, sedangkan PPIC specialist membawahi empat bagian yaitu Inventory Plannning Control (IPC), Production
Planning Control (PPC), dan Toll Manufacturing.
Secara umum tugas dari departemen ini adalah sebagai berikut:
a. Merencanakan, mempersiapkan, dan mengendalikan proses produksi mulai dari bahan baku sampai obat jadi.
b. Melakukan kegiatan toll manufacturing, meliputi:
1. Toll in, yaitu permintaan produksi dari perusahaan lain yang bisa dipenuhi karena masih tersedia kapasitas.
2. Toll out, yaitu permintaan bantuan produksi ke perusahaan lain karena tidak memiliki fasilitas produksi produk bersangkutan atau karena kapasitas tidak mencukupi.
c. Membuat laporan ke instansi terkait, antara lain hasil produksi, pemakaian material seperti prekursor, dan narkotik/psikotropik.
Tugas dari masing-masing bagian di Departemen PPIC adalah: a. Inventory Planning Control (IPC):
1. Menghitung Evaluasi Kebutuhan Material (EKM) bulanan selama 6 bulan kedepan berdasarkan Rolling Production Plan (RPP).
2. Memantau persediaan bahan baku, wadah, dan kemasan dengan mempertimbangkan prioritas penggunaan material di bagian produksi. 3. Membuat Formulir Permintaan Barang (FPB) untuk material.
4. Memperbanyak dan menurunkan Kartu Produksi (KP) atau Prosedur Pengolahan Induk (PPI)
b. Production Planning Control (PPC):
1. Menerjemahkan rolling forecast (ROFO) yang merupakan permintaan dari PT. Enseval Putera Megatrading menjadi Rolling Production Plan (RPP) dengan mempertimbangkan stock, buffer stock, work in process (WIP),
batch size, average selling out, pending order, dan day of inventory (DOI).
dalam satuan unit. RPP merupakan rencana produksi yang dibuat setiap 6 bulan mendatang dalam satuan batch.
2. Mengirim RPP ke bagian IPC untuk dijadikan dasar penyusunan Rencana Pemakaian Material (RPM) setiap bulan.
3. Membuat rencana produksi bulanan (RPB) yang berisikan jumlah batch dan target yang harus dicapai oleh Departmen Produksi selama satu bulan. 4. Mengevaluasi pencapaian rencana produksi bulan lalu untuk perencanaan
rencana produksi bulan berikutnya.
c. Toll Manufacturing bertugas mengkoordinasi produk-produk toll out dan toll in untuk menjamin agar kebutuhan sales dan marketing tetap dapat dipenuhi oleh rekanan yang telah ditentukan oleh perusahaan apabila kapasitas produksi tidak tersedia/ tidak mencukupi.
3.4.4 Departemen Produksi
Departemen produksi merupakan bagian Plant Department yang dipimpin oleh Group Production Manager (GPM). GPM membawahi 4
manager produksi. Masing-masing manager memiliki tanggung jawab terhadap mini company produksi yang terdiri dari beberapa jalur produksi, yang disebut line. Mini company promag terdiri dari line 1 dan line 1 extension. Mini company
I terdiri dari line 2, 9, dan 10. Pada mini company I terdapat seorang manajer produksi, yaitu manajer produksi yang mengepalai line 2, 9, dan 10. Mini company II terdiri dari line 4, 5, dan 6. Sedangkan untuk mini
company III terdiri dari line 7, 8A, dan 8B. Masing-masing line dijalankan
oleh supervisor produksi atau disebut juga Penanggung Jawab Line (PJL) yang bertanggung jawab kepada manager produksi di masing-masing mini company. Sedangkan PJL pada masing-masing line produksi membawahi coordinator lapangan, administrasi, operator, pembantu operator, production helper, dan
packer.
Line Produksi di PT. Kalbe Farma, Tbk. Cikarang terdiri dari 11 bagian line yaitu line 1, 2, 4, 5, 6, 7, 8A, 8B, 9, dan 10. Line tersebut digolongkan
yang memproduksi obat dalam jenis produk yang relatif sedikit, tapi dengan ukuran batch yang besar. Line ini terdiri atas line 1, 4, 9 dan 11.
Non-dedicated line merupakan line yang memproduksi obat dengan jenis produk
relatif banyak namun dengan ukuran batch yang relatif kecil atau sedikit. Line ini terdiri atas line 2, 5, 6, 7, 8A, 8B, dan 10. Produk obat yang diproduksi di setiap line adalah sebagai berikut:
1. Line 1: line ini memproduksi 1 jenis produk sediaan padat yaitu tablet Promag®. Line ini juga mempunyai extension. Line 1 extension ini khusus memproduksi tablet Promag® untuk menunjang permintaan pasar yang tidak dapat dipenuhi oleh line 1, namun hingga saat ini proyek pendirian line 1 extension ini masih pada tahap kualifikasi ruangan. Untuk ke depan line 1 extension ini akan membantu line 1 karena ruangan produksi tablet Promag® akan diperbesar dan akan menggunakan mesin yang lebih baru sehingga dapat memproduksi jumlah batch yang lebih besar dan lebih cepat.
2. Line 2: line ini terdiri atas 2 line yang merupakan gabungan dari line 2A dan line 2B. Sebagian besar produk line 2A adalah tablet inti, sedangkan produk line 2B adalah tablet coating. Produk line 2 antara lain: Neo Entrostop ® , Xon-Ce ® , Pronicy ® , Neuralgin ® , Cypron ® , Vitazym ® , Zegavit ® , dan Zegase ® .
3. Line 4: line yang memproduksi tablet inti, contoh produknya: Procold
®
, dan Promag Double Action
®
.
4. Line 5: line yang memproduksi sediaan cair oral antara lain sirup, emulsi, dan suspensi, seperti Cerebrofort
® , Plantacid ® , dan Woods ® .
5. Line 6: line ini khusus memproduksi sediaan cair steril (injeksi) seperti Rantin ® , Ulsikur ® , dan Kalmethasone ® .
6. Line 7: line ini memproduksi sediaan semi padat topikal seperti krim, semi solid seperti jeli, dan salep, serta sediaan suppositoria dan ovula. Contoh produknya adalah Bioplacenton
® (gel), Mycoral ® (krim), dan Kaltrofen ®
(gel dan suppositoria).
namun volumenya kecil. Produk yang dihasilkan tersebut sebagian besar merupakan produk ethical. Line ini dibagi menjadi 2 yaitu line 8A yang menangani proses pembuatan produk, line 8B menangani pengemasan produk.
8. Line 9: line ini khusus memproduksi sediaan cair non oral seperti Kalpanax Tincture
®
.
9. Line 10: line ini khusus melakukan pengemasan ulang (repack) untuk produk impor.
Tugas umum Departemen Produksi secara keseluruhan adalah melakukan proses produksi dari raw material dan packaging material menjadi produk jadi. Tugas dan tanggung jawab masing-masing line produksi antara lain:
a. Mencapai target produksi (kuantitas, kualitas, dan waktu yang tepat) yang ditetapkan berdasarkan ketersediaan kapasitas mesin dan ketersediaan tenaga kerja serta memonitor aktivitas harian dan mingguan berdasarkan Jadwal Produksi Mingguan (JPM).
b. Mengoptimalkan dan mengontrol expense (biaya bulanan dan tahunan) yang dipakai untuk mencapai target produksi. Sebagai contoh, biaya lembur dan gaji karyawan, biaya toolsand supplies (selang, solvent, dan oli) dan maintenance mesin (break down dan periodik).
c. Mencapai rendemen (yield) yang ditetapkan dengan cara meminimalkan bahan baku yang terbuang pada setiap tahap proses dan mengusulkan penyederhanaan proses (bekerjasama dengan R&D). Rendemen sudah ditetapkan standarnya setiap tahun.
d. Memastikan ketersediaan utilitas kerja, seperti Air Handling Unit (AHU), pengendali tekanan, Relative Humidity (RH), udara, dan suhu.
e. Memantau produktivitas kerja (orang dan mesin).
f. Mengefisienkan pemakaian kapasitas mesin dengan cara melakukan penjadwalan yang efisien, penempatan operator yang tepat, dan perawatan mesin.
g. Memeriksa, mengevaluasi, dan memberi approval dokumen-dokumen yang dipakai dan dikirim ke QC.
h. Membimbing supervisor dan subordinat.
i. Memberi masukan kepada atasan, untuk perencanaan jangka panjang (misal: perubahan lay out ruangan, penambahan mesin dan karyawan, optimalisasi cara kerja).
j. Memastikan suasana kerja yang sehat dan memotivasi bawahan (misalnya membantu masalah mereka dan memberi training).
k. Memastikan dipenuhinya standar atau peraturan yang berlaku (misal: CPOB, ISO 9000, OSHAS 18000, ISO 14000, dan cGMP) dan berkomitmen untuk mengimplementasikan kebijakan mutu, Kesehatan dan Keselamatan Kerja (K3), dan lingkungan.
3.4.5. Departemen Group Process Improvement (GPI)
Departemen Group Process Improvement adalah departemen yang terbentuk pada tahun 2006. Departemen ini bertujuan untuk mengadakan
continual improvement agar perusahaan dapat terus berkembang menjadi lebih
baik. Misi GPI adalah untuk mengarahkan perbaikan berkesinambungan agar tumbuh menjadi budaya di lingkungan Kalbe Group serta untuk memfasilitasi kegiatan tersebut di empat operasi bisnis agar dapat tumbuh secara bersama. Tugas dan tanggung jawab dari departemen GPI antara lain adalah:
1. Energy Cost Saving
2. Standar Minimal Spesifikasi Mesin 3. Focus Plant
4. Proyek Lean
5. Ringkas, Rapi, Resik, Rawat, dan Rajin (5R) 6. Continual improvement
Dalam melakukan perbaikan proses dengan metode Continual
Improvement ada enam tahapan yaitu:
a. Understand the customer
Memahami pernyataan end customer terkait tentang keinginan, kebutuhan, harapan terhadap suatu produk atau jasa yang dijadikan sebagai persyaratan.
Untuk memenuhi persyaratan tersebut, perusahaan harus mengukur kemampuan dan mengidentifikasi adanya gap.
b. Analisis Efisiensi
Fokus pada pemenuhan kebutuhan dan harapan pelanggan internal, minimasi biaya, minimasi variasi, dan waktu siklus.
c. Analyze the Process
Pada tahap analisis, amati kondisi proses exsisting, proses yang tidak efektif, tidak efisien, dan proses yang buruk.
d. Improve the Process
Aktivitas improvement tergantung dari tujuan yang ingin dicapai. Continual
Improvement membentuk pemahaman yang fundamental pada customer requirement, kapabilitas proses, dan root cause gap yang terjadi. Contohnya
dengan tujuan untuk meningkatkan kualitas produk atau jasa, maka aktivitas
improvement yang dilakukan adalah berfokus pada pengurangan variasi, error,
serta cacat.
e. Implement changes f. Standardize and monitor
3.4.6. Departemen Quality Operation
Quality Operation adalah departemen yang bertugas menjamin mutu
produk yang dihasilkan dengan memperhatikan seluruh aspek yang berpengaruh pada kualitas produk. Departemen QO dipimpin oleh seorang QO Manajer yang bertanggung jawab kepada Group Head Quality. Secara umum QO dibagi menjadi dua kelompok besar yaitu Quality Control (QC) dan Quality Assurance (QA).
3.4.6.1 Quality Control (QC)
Secara umum bagian QC bertugas dalam:
a. Pelulusan dan pengujian terhadap material yang datang (raw material dan
packaging material), produk ruahan dan produk jadi.
b. Memberikan persetujuan pemeriksaan (retesting) dan pengerjaan ulang (rework) suatu produk.
c. Menangani pemusnahan material atau produk jadi (daluwarsa atau tidak memenuhi syarat).
Bagian-bagian dalam Departemen QC: a. Seksi Bahan Baku (Raw material)
Bagian ini bertanggung jawab dalam menganalisa semua bahan baku yang masuk yang akan digunakan untuk proses produksi.
b. Seksi Wadah dan Kemasan (Packaging Material)
Bagian ini bertugas melakukan pemeriksaan terhadap semua wadah dan kemasan dengan prosedur berdasarkan MA yang telah ditetapkan oleh Departemen R&D.
c. Seksi Obat Jadi
Seksi obat jadi bertugas dalam melakukan pemeriksaan dan meloloskan atau menolak produk jadi yang akan dipasarkan.
d. Laboratorium Mikrobiologi
Bagian ini bertugas melakukan pemeriksaan mikrobiologi material dan obat sesuai dengan MA yang telah ditetapkan oleh Departemen R&D. Pemeriksaan yang dilakukan yaitu: potensi antibiotika, uji sterilitas, uji pirogen/ endotoksin, pemeriksaan angka total mikroba, pemeriksaan untuk uji sampel stabilitas, pemeriksaan sampel pertinggal, dan pemeriksaan hasil validasi pembersihan mesin. Selain mendukung seksi bahan baku, seksi wadah dan kemasan, dan seksi obat jadi, laboratorium mikrobiologi juga mendukung bagian validasi dalam pemeriksaan ruangan.
Hubungan Departemen QC dengan departemen lain adalah sebagai berikut: a. Departemen Logistik
Bahan baku dan bahan kemas yang diterima oleh Departemen Logistik diperiksa oleh Departemen QC.
b. Departemen R&D
Departemen QC melakukan pemeriksaan rutin menggunakan metode analisa yang ditetapkan oleh Analytical Development dan Packaging Development yang merupakan bagian dari Departemen R&D. Sebelum suatu metode analisa ditetapkan oleh Analytical Development dan Packaging Development, dilakukan transfer metode analisa ke Departemen QC untuk menyempurnakan metode analisa tersebut.
c. Departemen Produksi
Departemen QC memeriksa kualitas produk ruahan berdasarkan sampling yang dilakukan oleh Departemen Produksi (IPC mandiri). Untuk In Process
Control (IPC) dilakukan oleh Departemen Produksi karena bagian produksi
di PT. Kalbe Farma, Tbk. dianggap sudah mampu untuk melakukan IPC sendiri dan Departemen QC melakukan pemeriksaan composit sample dari hasil suatu proses produksi.
d. Departemen Pembelian (Purchasing)
Hubungan Departemen QC dengan bagian pembelian melibatkan bagian
Analytical Development dan Formulasi. Bagian pembelian akan membeli
bahan baku maupun bahan kemas dari pemasok baru setelah memperoleh persetujuan dari bagian Analytical Development dan Formulasi. Selanjutnya, bahan baku dan bahan kemas yang dibeli dari source baru diperiksa kualitasnya oleh Departemen QC menggunakan metode analisa yang ditetapkan oleh bagian Analytical Development.
e. Departemen Marketing
Departemen QC memberikan informasi ke Departemen Marketing tentang
release batch number pertama produk baru dan pemberitahuan perubahan
3.4.6.2 Quality Assurance (QA)
Departemen QA dipimpin oleh seorang QA Manajer yang bertanggung jawab langsung kepada QO manager. Secara umum QA dibagi menjadi empat kelompok besar yaitu Audit Proses, Post Marketing, Validasi, dan GMP
Compliance.
a. Audit Proses
Audit Proses/ Process Inspection dilakukan untuk memastikan proses produksi yang sedang berjalan sesuai dengan prosedur yang telah ditetapkan. Petugas inspeksi datang ke departemen produksi secara langsung dan berkala untuk mengamati apakah pada proses produksi terdapat penyimpangan atau tidak.
b. Post Marketing
Post Marketing bertugas melakukan pemantauan atau pengawasan terhadap
kualitas produk jadi setelah produk tersebut diproduksi dan dipasarkan. Tugas dari post marketing adalah menangangi keluhan pelanggan (product
complaint), menangani recall dan returned product, menangani batch record,
dan post marketing stability testing.
c. Validasi
Validasi adalah suatu tindakan pembuktian dengan cara yang sesuai bahwa tiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi dan pengawasan akan senantiasa mencapai hasil yang diinginkan. Bagian Validasi di PT. Kalbe Farma, Tbk memiliki bagian validasi proses, validasi pembersihan, validasi fasilitas dan utilitas, validasi computer, dan annual product review.
d. GMP Compliance
a. Kalibrasi dan Kualifikasi
Tujuan dilakukan kalibrasi untuk memastikan semua peralatan yang digunakan untuk pengukuran selalu memenuhi persyaratan yang telah ditetapkan sehingga menjamin ketelitian pengukuran berada dalam batas
yang diijinkan. Sebagai parameter digunakan suatu kalibrator yang spesifik untuk setiap instrumen. Kualifikasi adalah tindakan untuk memastikan kelayakan dari suatu mesin atau peralatan. Kualifikasi yang dilakukan meliputi: Design Qualification (DQ), Installation Qualfication (IQ), Operational Qualification (OQ), dan Performance Qualification (PQ). Kalibrasi merupakan bagian dari kualifikasi, dengan interval pengujian yang lebih sempit (misalnya, kalibrasi dilakukan per 6 bulan, sedangkan kualifikasi dilakukan minimal 3 tahun bila tidak ada perubahan yang signifikan).
b. Evaluasi catatan bets (Evaluation Batch Record/ EBR)
Bagian ini bertanggung jawab memeriksa kelengkapan batch record serta menyatukan data-data dari produksi dan hasil analisa dari departemen QC. EBR diperlukan sebagai dokumentasi dan untuk memastikan produk sebelum di-release telah dievaluasi dengan benar termasuk penelusuran masalah jika terjadi penyimpangan.
c. Pengendalian Perubahan (Change Control)
Tujuan Change Control adalah agar setiap perubahan yang berkaitan dengan mutu, lingkungan dan K3 (Kesehatan dan Keselamatan Kerja) dievaluasi dahulu dampaknya terhadap mutu, lingkungan, dan K3 serta sesuai pada ketentuan, peraturan atau undang-undang terkait sebelum diimplementasikan. Jika terjadi suatu perubahan, misalnya terjadi penggantian mesin, maka departemen tersebut akan mengajukan usulan perubahan, kemudian perubahan tersebut diamati dan dipelajari oleh tiap departemen yang terkait, apakah perubahan memberikan dampak atau tidak.
3.4.7. Departemen Quality System
Quality System (QS) mempunyai fungsi utama memastikan standar atau
pedoman yang ada senantiasa berjalan dengan baik. QS bertugas memelihara dan mengembangkan sistem di PT. Kalbe Farma, Tbk. Secara keseluruhan, sistem
yang dibuat telah memasukkan unsur-unsur CPOB/c-GMP, ISO 9001:2000, ISO 14001:2004, dan OHSAS 18001.
a. System Compliance
Bagian ini memiliki tanggung jawab dalam Management Review, Audit
Development, Corrective Action/Preventive Action (CAPA), dan Standard Development.
b. Document Compliance
Secara umum tugas QS dalam Document Compliance adalah apabila terdapat dokumen baru atau perubahan pada dokumen lama, dokumen baru atau dokumen yang telah diubah tersebut harus dikaji terlebih dahulu oleh QS. Selanjutnya QS akan mengkaji dampak perubahan terhadap departemen lain. Setelah dokumen diperbaiki disetujui oleh QS, perlu dilakukan pelatihan pada semua personil yang terkait. Setelah itu, dokumen tersebut baru bisa didistribusikan kepada pihak-pihak yang berkepentingan.
c. Occupational Health, Safety & Environment (OHSE) Compliance
OHSE dikoordinasi oleh System Compliance yang bertugas untuk memastikan kinerja sistem manajemen K3 & lingkungan telah diterapkan dengan baik. Selain itu OHSE juga bertugas untuk melakukan identifikasi, mencegah, dan mengatasi hazard (bahaya) yang akan timbul akibat tidak memahami standar prosedur yang telah ditetapkan oleh perusahaan. Cara yang dilakukan antara lain: eliminasi, substitusi, engineering control, visual control dan
administration Control, alat pelindung diri (APD).
d. Plan Do Check Action (PDCA)
Divisi ini bertugas untuk memeriksa setiap kegiatan kerja yang akan dilaksanakan oleh departemen-departemen yang ada di PT. Kalbe Farma, Tbk. Pada umumnya mereka akan mengikuti setiap rapat kerja yang ada dan mengevaluasi kinerja program serta status kemajuannya.
e. Continual Improvement Program Development
Bagian Program Development memiliki tugas yang terbagi menjadi dua, yaitu
Program Development & Maintenance dan Training Development Maintenance. Bagian ini bertanggung jawab untuk merancang dan
melaksanakan sistem pelatihan bagi karyawan, khususnya karyawan baru, sebagai sarana untuk meningkatkan budaya kualitas karyawan sehingga tercipta produk yang berkualitas. Program-program pengembangan yang dilaksanakan antara lain 5R, Ko HASE, serta CONIM (Continual
Improvement). Setiap kebijakan CONIM yang telah dibuat oleh Group Process Improvement (GPI) kemudian diteruskan kepada divisi ini untuk
kemudian dirancang pelaksanaannya.
3.4.8. Departemen Logistik
Logistik atau Warehouse adalah departemen yang bertanggung jawab atas penerimaan, penyimpanan, pengeluaran bahan baku, wadah, bahan kemas, dan produk jadi. Secara struktural departemen logistik dipimpin oleh seorang Manager Logistik yang membawahi empat supervisor gudang, yaitu supervisor gudang bahan baku dan wadah, supervisor gudang penimbangan, supervisor gudang kemasan, serta supervisor gudang produk dan sarana promosi. Bagian Logistik memiliki peranan penting dalam kegiatan penerimaan, penyimpanan, dan pengeluaran bahan baku, wadah, kemasan, maupun produk. Dalam menjalankan peran tersebut, Departemen Logistik terkait dengan beberapa bagian, yaitu bagian QA/QC, R&D, Purchasing, PPIC, Produksi, dan Teknik. Fungsi dan tugas dari masing-masing seksi adalah sebagai berikut:
a. Seksi gudang bahan baku / wadah
Gudang bahan baku dan wadah mempunyai beberapa ruang penyimpanan dengan suhu ruangan yang berbeda-beda, yaitu ruang suhu kamar (25-30°C), ruang AC (20-25°C), dan ruang pendingin/cool room (2-8°C) untuk penyimpanan bahan baku yang rentan terhadap suhu. Untuk ruang AC terdiri dari 6 ruangan yaitu, ruang AC 1 untuk penyimpanan material halal, ruang AC 2 untuk penyimpanan essence dan flavouring, ruang AC 3 untuk penyimpanan
bahan kemas primer (foil), ruang AC 4 untuk penyimpanan berbagai macam bahan baku, ruang AC 5 untuk penyimpanan bahan baku beta laktam dalam kemasan asli, ruang AC 6 untuk penyimpanan bahan baku dan wadah yang bersifat umum, serta ruang AC khusus untuk penyimpanan menthae
peppermint oil. Selain itu, terdapat beberapa area atau ruang yang penting
seperti:
1. Area khusus prekursor serta tempat khusus penyimpanan bahan baku yang bersifat prekursor narkotika dan psikotropika. Area ini selalu terkunci dan akses ke area ini harus mendapat persetujuan supervisor dan mengisi log
book.
2. Ruang sampling QC, ruang khusus untuk proses sampling bahan baku dan wadah yang baru datang untuk diuji kualitasnya sebelum digunakan. 3. Ruang tolak, ruangan atau area yang terpisah yang menyimpan bahan baku
dan wadah yang ditolak oleh QC.
Penataan barang di gudang bahan baku dan wadah menggunakan system
racking secara alfabetis dan numerik dimana setiap rak terdapat beberapa level
(tingkat vertikal) dan beberapa kolom (horizontal), serta didata secara komputerisasi menggunakan sistem IBAS (Integrated Barcode Application
System) yang menggantikan fungsi kartu letak barang dan memuat kode
produk, nama produk, dan nomor Certificate of Analysis (CoA). Cara penyimpanan barang di gudang pada dasarnya disusun antara lain berdasarkan hal-hal berikut:
1. kondisi penyimpanan yang dipersyaratkan (suhu, cahaya, dan kelembaban).
2. kedekatan dengan pelanggan (gudang timbang atau produksi).
3. bentuk material dan sifat bahan baku (flammable atau non flammable). 4. untuk barang-barang toll out didekatkan area toll out.
b. Seksi gudang penimbangan
Gudang timbang adalah tempat berlangsungnya proses penimbangan dan penyediaan bahan baku dan wadah yang dibutuhkan oleh produksi berdasarkan JPM (Jadwal Produksi Mingguan). Bahan baku dan wadah yang ditimbang dan disediakan sesuai dengan Prosedur Pengolahan Induk yang diturunkan yaitu: PPI 1A, 1B dan 3A. Bahan baku dan wadah ditimbang dan disediakan dengan sistem First Expired First Out (FEFO) oleh gudang timbang, kemudian dikirim ke produksi sesuai line yang membutuhkan.
c. Seksi gudang kemasan
Gudang kemas memiliki tanggung jawab melayani permintaan kemasan sekunder berupa master box, dus, brosur, dan label kemudian mengirimkannya ke setiap line produksi berdasarkan PPI 3B. Kemasan sekunder yang dikirim oleh vendor akan diperlakukan sama seperti bahan baku dan wadah, yaitu akan dikarantina terlebih dahulu untuk pengujian kualitas kemasan tersebut. Jika QC menyatakan status kemasan adalah “BAIK” maka kemasan yang sesuai dengan PPI 3B akan dikirim ke produksi. Sistem FEFO juga diterapkan untuk pengiriman kemasan sekunder untuk produksi.
d. Seksi gudang produk dan sarana promosi
Ruang lingkup, fungsi, dan tugas seksi gudang produk dan sarana promosi adalah sebagai berikut:
a. Menerima, memeriksa produk dan dokumen, serta memasukkan data. b. Menata dan menyimpan produk.
c. Mengirimkan produk untuk pelanggan (distributor, ekspor, dan sebagainya) atas Sales Order/Shipping Instruction Internal dari marketing atau Formulir Kebutuhan Barang (FKB).
d. Melaksanakan cycle count produk.
e. Menerima, memeriksa, dan memasukkan data produk retur.
f. Menerima, menata, menyimpan, dan mengirimkan sarana promosi atas permintaan Marketing.