TINJAUAN PUSTAKA
Anatomi Kandung Empedu dan Traktus Biliaris
Ikterus adalah perubahan warna kulit, sklera mata atau membran mukosa jaringan tubuh lainnya menjadi kuning, akibat peningkatan kadar bilirubin dalam sirkulasi darah oleh berbagai sebab. Bilirubin dibentuk sebagai akibat pemecahan cincin heme pada metabolisme sel darah merah. Ikterus yang ringan dapat dilihat paling awal pada sklera mata, biasanya terjadi jika kadar bilirubin dalam darah berkisar antara 2,0-2,5 mg/dl atau lebih. Makin tinggi kadar bilirubin dalam darah, warna kuning akan semakin nyata. Kata ikterus (jaundice) berasal dari bahasa Perancis jaune yang berarti kuning (Talley 1996; Amirudin 2006).
Gambar 7. Anatomi kandung empedu dan traktus biliaris (Dikutip dari Amirudin 2006)
Empedu dan komponen-komponennya diproduksi oleh sel-sel hati setiap saat untuk kemudian dialirkan ke dalam kanalikulus hati, kemudian dialirkan melalui duktus hepatikus kiri dan duktus hepatikus kanan yang keduanya membentuk duktus hepatikus komunis. Sebagian dari empedu ini sebelum
dialirkan ke dalam duodenum, disimpan di dalam kandung empedu melalui duktus sistikus. Setelah penggabungan dengan duktus sistikus dari kandung empedu, duktus hepatikus komunis menjadi duktus biliaris komunis (common bile duct) atau disebut juga duktus koledokus. Dalam keadaan normal, kandung empedu dapat menampung ± 50 ml cairan empedu (Amirudin 2006). Pada bagian distal duktus koledokus sebelum mencapai muaranya di duodenum terdapat muara duktus pankreatikus. Kedua saluran ini bermuara di duodenum melalui papilla Vateri. Pada keadaan ikterus dapat terjadi berbagai perubahan biokimiawi, fisiologi bahkan perubahan struktur jaringan hati, baik yang bersifat reversible maupun yang irreversible. Tergantung penyebabnya, ikterus dapat diikuti dengan berbagai perubahan/kerusakan pada berbagai bagian organ tubuh lain seperti pankreas, usus, ginjal bahkan otak (Sulaiman 2006).
Hati mempunyai fungsi yang beraneka ragam yang meliputi fungsi metabolisme, fungsi sintesis, fungsi ekskresi, fungsi endokrin, fungsi imunologi dan lain-lain. Fungsi utama hati adalah pembentukan dan ekskresi empedu. Hati mengekskresikan sebanyak ± 1 liter empedu perhari ke dalam usus halus melalui muara saluran empedu di duodenum. Empedu terdiri dari asam empedu (asam kolat, asam kenodeoksikolat, asam deoksikolat dan dalam jumlah kecil asam ursodeoksikolat), bilirubin, kolesterol, trace metal, serta metabolit obat, dengan air sebagai unsur utama (97%). Hasil metabolisme monosakarida dari usus halus diubah menjadi glikogen untuk kemudian disimpan di hati (glikogenesis). Dari depot glikogen ini disuplai glukosa secara konstan ke dalam darah (glikogenolisis) untuk memenuhi kebutuhan energi tubuh. Sebagian glukosa dimetabolisme di dalam jaringan untuk menghasilkan energi dan sisanya diubah menjadi glikogen yang disimpan dalam otot atau lemak yang disimpan dalam jaringan subkutan. Fungsi metabolisme protein dari hati terutama menghasilkan protein plasma berupa albumin, protrombin, fibrinogen serta faktor-faktor pembekuan lainnya. Adapun fungsi metabolisme lemak dari hati terutama dalam pembentukan lipoprotein, kolesterol, fosfolipid dan asam asetoasetat (Sherlock 1993; Amirudin 2006).
Empedu sangat berperan dalam membantu pencernaan dan absorpsi lemak, ekskresi metabolit hati dan produk sisa seperti kolesterol, bilirubin dan logam
berat. Asam empedu dibentuk dari kolesterol di dalam sel-sel hati (hepatosit), bersifat larut dalam air akibat konyugasi dengan glisin, taurin dan sulfat. Asam empedu berfungsi sebagai deterjen dalam mengemulsi lemak, membantu kerja enzim-enzim pankreas serta berperan utama dalam absorpsi lemak intraluminal. Bilirubin, suatu pigmen kuning dengan sebuah struktur tetrapirol yang tidak larut dalam air, sebagian besar berasal dari sel-sel darah yang telah hancur dan sebagian lagi berasal dari katabolisme protein-protein heme lainnya (Talley 1996; Amirudin 2006).
Patofisiologi Ikterus
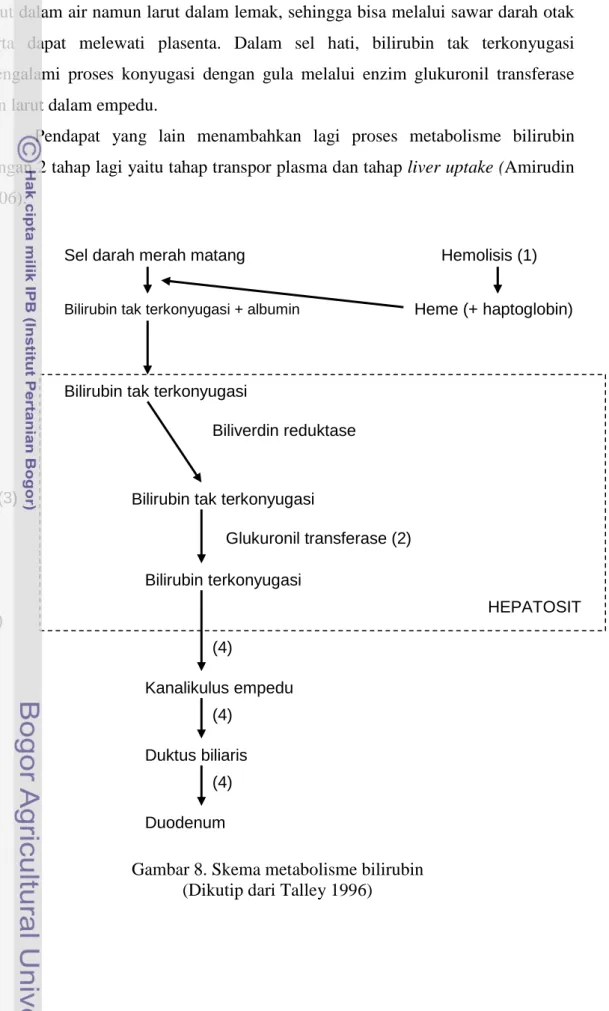
Setiap hari tubuh manusia membentuk sekitar 250 sampai 350 mg bilirubin atau sekitar 4 mg/kg bobot badan. 70-80% berasal dari pemecahan sel darah merah yang matang, sedangkan 20-30% sisanya berasal dari protein heme lainnya di sumsum tulang dan hati. Sebagian dari protein heme dipecah menjadi besi dan bilirubin (produk antara) dengan perantaraan enzim hemeoksigenase. Sementara itu enzim biliverdin reduktase akan mengubah biliverdin menjadi bilirubin. Tahapan ini terutama terjadi di dalam sel sistem retikuloendotelial. Bilirubin bebas yang terkonsentrasi dalam sel hati mengalami konyugasi dengan asam glukuronat membentuk bilirubin diglukuronida (disebut juga bilirubin terkonyugasi atau bilirubin direk) yang larut dalam air. Reaksi ini dikatalisis oleh enzim mikrosomal glukuronil transferase. Dalam beberapa keadaan reaksi ini hanya menghasilkan bilirubin monoglukuronida, dengan bagian asam glukuronat kedua ditambahkan dalam saluran empedu melalui enzim yang berbeda, namun ini tidak fisiologis. Bilirubin terkonyugasi dikeluarkan ke dalam kanalikulus hati bersama zat-zat lainnya, sampai ke duodenum. Di dalam usus, flora bakteri men”dekonyugasi” bilirubin menjadi sterkobilinogen, dan mengeluarkannya sebagian besar ke dalam tinja yang memberi warna coklat. Sebagian diserap dan dikeluarkan kembali ke dalam empedu, dan dalam jumlah kecil mencapai urin sebagai urobilinogen. Ginjal dapat mengeluarkan diglukuronida tetapi tidak bisa mengeluarkan bilirubin terkonyugasi. Hal ini dapat menerangkan warna urin yang lebih gelap pada gangguan hepatoselular atau kolestasis intrahepatik (Sherlock 1993; Talley 1996).
Bilirubin tak terkonyugasi (disebut juga bilirubin indirek) bersifat tidak larut dalam air namun larut dalam lemak, sehingga bisa melalui sawar darah otak serta dapat melewati plasenta. Dalam sel hati, bilirubin tak terkonyugasi mengalami proses konyugasi dengan gula melalui enzim glukuronil transferase dan larut dalam empedu.
Pendapat yang lain menambahkan lagi proses metabolisme bilirubin dengan 2 tahap lagi yaitu tahap transpor plasma dan tahap liver uptake (Amirudin 2006).
Gambar 8. Skema metabolisme bilirubin (Dikutip dari Talley 1996)
(4)
Kanalikulus empedu
Duktus biliaris
Duodenum (4)
Sel darah merah matang Hemolisis (1)
Heme (+ haptoglobin) Bilirubin tak terkonyugasi + albumin
Bilirubin tak terkonyugasi
Uptake (3)
Konyugasi (3)
Ekskresi (3)
Bilirubin tak terkonyugasi
Bilirubin terkonyugasi
Biliverdin reduktase
Glukuronil transferase (2)
(4)
Dengan memperhatikan proses metabolisme bilirubin di atas, maka ikterus dibagi atas 3 kelompok, yaitu ikterus prehepatik (ikterus hemolitik), ikterus hepatik (ikterus hepatoselular) dan ikterus kolestatik (ikterus obstruktif). Kadang-kadang terdapat overlap antara ikterus hepatoselular dengan ikterus kolestatik (Sherlock 1993; Sulaiman 2006).
Pada keadaan ini terdapat peningkatan ringan kadar bilirubin total terutama bilirubin tak terkonyugasi, namun enzim SGOT (serum glutamic oxaloacetic transaminase) dan SGPT (serum glutamic pyruvic transaminase) serta fosfatase alkali normal. Begitu pula fungsi hati dan ekskresi empedu normal. Keadaan ini dapat terjadi pada anemia hemolitik oleh berbagai sebab (misalnya pada keadaan autoimmune hemolytic anemia (AIHA), defisiensi enzim G6PD (Glucose-6-phosphate dehydrogenase), thalassemia, infeksi malaria, dan lain-lain) atau pada beberapa penyakit gangguan metabolisme bilirubin yang bersifat familial seperti Sindrom Gilbert dan Sindrom Crigler-Najjar (Sherlock 1993; Talley 1996).
Ikterus prehepatik (ikterus hemolitik)
Keadaan ini disebabkan proses inflamasi/kerusakan pada jaringan hati, misalnya pada hepatitis (karena virus, bakteri atau obat-obatan). Dalam keadaan ini, kadar bilirubin meningkat, baik bilirubin terkonyugasi maupun bilirubin tak terkonyugasi, disertai dengan peningkatan enzim transaminase. Pada keadaan ini, dapat pula terjadi kolestasis intrahepatik yang akan memperberat keadaan ikterus (Sherlock 1993; Sulaiman 2006). Tergantung penyebabnya keadaan ini bisa bermanifestasi akut maupun kronik dengan gambaran fungsi hati yang berbeda walaupun bisa memberikan gambaran sebagian fungsi hati yang hampir sama. Umumnya terdapat peningkatan enzim SGOT dan SGPT, dan pada keadaan yang kronik bisa terjadi penurunan kadar albumin sebagai manifestasi terganggunya fungsi sintesis hati (Sherlock 1993).
Ikterus hepatoseluler
Pada sindrom Dubin-Johnson dan sindrom Rotor yang merupakan penyakit herediter, terjadi keadaan ikterus ringan dan tanpa keluhan, yang disebabkan oleh gangguan berbagai anion organik termasuk bilirubin, namun ekskresi empedu tidak terganggu. Berbeda dengan sindrom Gilbert, pada kedua
keadaan ini hiperbilirubinemia yang terjadi adalah bilirubin terkonyugasi dan empedu terdapat dalam urin.
Gambaran Fungsi Hati pada Ikterus Obstruktif Ikterus Kolestatik
Pada keadaan ini terjadi sumbatan (obstruksi) total atau parsial dari aliran empedu dan komponen-komponennya dari mulai sel hati (kanalikulus) sampai ke duodenum. Untuk kepentingan klinik, ikterus kolestatik dibagi menjadi dua yaitu kolestasis intrahepatik dan kolestasis ekstrahepatik. Kolestasis intrahepatik bisa terjadi pada keadaan hepatitis, sirosis hati bilier primer atau pada karsinoma hati metastatik. Pada kolestasis ekstrahepatik terjadi sumbatan secara mekanis pada duktus biliaris ekstrahepatik mulai dari duktus hepatikus komunis sampai muara duktus koledokus (common bile duct) di duodenum. Keadaan ikterus kolestatik ekstrahepatik ini sering disebut sebagai ikterus obstruktif (obstructive jaundice). Ikterus obstruktif sering disebabkan oleh batu duktus koledokus, kanker kaput pankreas, tumor duktus koledokus, tumor papilla Vateri atau striktur CBD (Lu dan Kaplowitz 1995; Siddique et al. 2008; Pangestu et al. 2007). Pada keadaan ini terjadi peningkatan kadar bilirubin plasma terutama bilirubin terkonyugasi.
Dalam menghadapi keadaan ikterus, harus segera dapat ditentukan bila ada ikterus prehepatik (hemolitik), ikterus hepatoselular atau ikterus obstruktif. Pemeriksaan fungsi hati yang meliputi kadar bilirubin (bilirubin total, bilirubin direk dan bilirubin indirek), SGOT/AST (Aspartate Aminotransferase), SGPT/ALT (Alanine Transaminase), dan fosfatase alkali dapat memberi petunjuk awal untuk membedakan ketiga kelompok ikterus di atas. Pada ikterus hemolitik yang menonjol adalah kadar bilirubin indirek lebih tinggi dibanding bilirubin direk, hal ini tidak terjadi pada ikterus obstruktif maupun ikterus hepatoselular, dengan fungsi enzimatik hati umumnya normal (Sherlock 1993; Hayat et al. 2005). Peningkatan kadar SGOT dan SGPT merupakan indikator yang sensitif untuk ikterus hepatoselular (misalnya pada hepatitis virus akut maupun kronik, hepatitis autoimun, hemokromatosis, defisiensi α1-antitripsin serta penyakit Wilson),
sedangkan pada ikterus obstruktif peningkatan kadar fosfatase alkali lebih tinggi dibanding peningkatan SGOT/SGPT.
Seiring dengan peningkatan kadar bilirubin darah, pada keadaan ikterus obstruktif terjadi peningkatan kadar fosfatase alkali lebih dari 3 kali nilai normal, sedangkan peningkatan enzim transminase (SGOT dan SGPT) umumnya kurang dari 3 kali nilai normal. Kadar enzim gamma glutamyl transpeptidase (GGT) umumnya meningkat pada keadaan ikterus obstruktif, namun peningkatan ini bisa juga terjadi pada keadaan-keadaan lain, misalnya pada keadaan fatty liver, hepatitis akibat obat-obatan serta penyakit-penyakit non-hepatik yang lain (Giannini et al. 2005).
Keadaan ikterus obstruktif berkepanjangan dapat menimbulkan kerusakan struktur hati terutama hepatosit yang akan diikuti dengan menurunnya fungsi sintesis hati khususnya sintesis albumin. Kadar albumin plasma dapat menurun jika sudah terjadi keadaan kerusakan hati lanjut (sirosis bilier). Hal ini terjadi karena pada keadaan ikterus obstruktif lanjut akan terjadi kerusakan hati yaitu nekrosis hepatoselular, proliferasi sel-sel epitelial duktulus biliaris, aktivasi sel-sel stelat yang diikuti dengan fibrosis hati (Giannini et al. 2005; Hong et al. 2007).
Berbagai hasil penelitian telah dilaporkan mengenai mekanisme terjadinya kerusakan hati pada keadaan ikterus obstruktif. Wang et al. (2005) pada penelitiannya mengenai ikterus obstruktif dengan hewan model tikus melaporkan bahwa kerusakan hati yang terjadi pada keadaan ini, disebabkan akumulasi garam empedu di dalam sel-sel hati. Mekanisme yang pasti mengenai hal ini belum diketahui, namun diduga hal ini disebabkan oleh karena terganggunya proses apoptosis selular oleh protein kinase C pada keadaan ikterus obstruktif. Mekanisme patogenesis lain tentang terjadinya kerusakan hati pada keadaan ikterus obstruktif dilaporkan juga oleh penelitian Hong et al. (2007) dengan hewan model tikus, yang melaporkan adanya peranan bakteri intestinal, efek dari endotoksin plasma akibat translokasi bakteri melalui mukosa usus halus, meningkatnya kadar sitokin dan kadar imunoglobulin A (IgA) serta meningkatnya oxidative stress di dalam plasma. Mekanisme patogenesis lainnya disampaikan oleh Cindoruk et al. (2007) yang melaporkan peranan peroxisome proliferators-activated receptor alpha (PPARα) dalam mengurangi derajat kerusakan hati pada tikus percobaan dengan ikterus obstruktif. Hal ini dihubungkan dengan pemberian
fenofibrat yang merupakan PPARα agonist yang ternyata dapat meningkatkan metabolisme kolesterol, serta menekan sintesis asam empedu yang pada akhirnya akan mempengaruhi sitokin proinflamasi, apoptosis, serta kerusakan hepatoselular lebih lanjut.
Untuk mengetahui reversibilitas gangguan fungsi hati pada keadaan ikterus obstruktif, Fraser et al. (1989) melakukan penelitian dengan mengikat (ligasi) duktus koledokus pada 11 ekor anjing. Setelah 4 minggu, dilakukan dekompresi dengan melakukan anastomosis bilioenterik. Selama 2 bulan setelah dekompresi, dilakukan evaluasi berkala fungsi hati, perubahan mikroskopik dari biopsi hati serta pemeriksaan dynamic liver scintiscanning, dibandingkan dengan keadaan sebelum dilakukan dekompresi. Hasil dari penelitian ini menunjukkan bahwa perlu waktu yang lama (lebih dari 10 hari) untuk mengembalikan berbagai fungsi hati setelah dilakukan dekompresi.
Penelitian yang hampir sama dilakukan oleh Kocher et al. (1997), untuk melihat perubahan histopatologi jaringan hati pada 14 ekor anjing mongrel yang mengalami pengikatan duktus koledokus. Dari penelitian ini diketahui bahwa perubahan histopatologi jaringan hati pada ikterus obstruktif dimulai dengan proses inflamasi akut, edema, fibrosis serta akhirnya terjadi distorsi arsitektur jaringan hati yang irreversible.
Metabolisme Lemak pada Ikterus Obstruktif
Ikterus obstruktif ditandai dengan akumulasi bilirubin, asam empedu dan kolesterol intraselular akibat terhambatnya sekresi empedu, yang diikuti dengan keadaan hiperbilirubinemia dan hiperlipidemia. Asam empedu yang merupakan produk utama dari metabolisme kolesterol di dalam hati, berfungsi sebagai deterjen fisiologis yang memfasilitasi absorpsi dan transpor lemak dan vitamin yang larut dalam lemak melalui mukosa usus halus.
Gangguan metabolisme lemak pada ikterus obstruktif telah banyak dilaporkan, baik pada manusia maupun hewan percobaan. Peningkatan kadar kolesterol plasma terjadi setelah pengikatan duktus koledokus pada tikus percobaan, tetapi perlu waktu yang lebih lama, untuk memastikan adanya peningkatan kadar kolesterol plasma ini berlanjut terus atau tidak. Eliminasi
kolesterol dari tubuh terutama melalui ekskresi kolesterol bebas/fosfolipid dan asam empedu melalui traktus biliaris. Dengan demikian, pada ikterus obstruktif akan terjadi gangguan homeostasis kolesterol. Penelitian Dueland et al. (1991) dengan mengikat duktus koledokus tikus Sprague-Dawley menunjukkan:
1) penurunan kadar dan fungsi enzim sitokrom P-450 di hati, 2) akumulasi asam empedu di hati,
3) peningkatan aktivitas enzim kolesterol 7 α hidroksilase,
4) peningkatan aktivitas enzim HMG-CoA reduktase serta peningkatan kadar kolesterol plasma, dan
5) peningkatan ekskresi asam empedu melalui urin.
Dengan tidak adanya ekskresi cairan empedu ke dalam duodenum akibat ikterus obstruktif, akan terjadi gangguan pada absorbsi lemak enteral. Pengaruh pemberian fat emulsion enteral pada absorpsi lemak dilaporkan oleh Sato et al. (1991). Sato membagi hewan percobaannya (tikus) atas kelompok ikterus obstruktif dan non-ikterus obstruktif. Kepada kedua kelompok diberikan fat emulsion dan unemulsified fat yang dilabel dengan 14C. Dengan mengukur kadar 14CO2 melalui pernafasan dapat diukur penyerapan dari lemak melalui usus halus.
Penelitian ini menyimpulkan bahwa absorpsi lemak (baik emulsified fat maupun unemulsified fat) pada kelompok ikterus obstruktif lebih rendah dibanding kelompok non-ikterus obstruktif.
Pengaruh Ikterus Obstruktif terhadap Mukosa Lambung
Kerusakan mukosa lambung akut dalam bentuk erosi atau ulkus merupakan komplikasi yang sering terjadi pada pasien-pasien dengan ikterus obstruktif. Berbagai mekanisme patogenesis mengenai hal ini telah banyak dilaporkan yang meliputi faktor-faktor lokal maupun sistemik. Faktor-faktor lokal meliputi keadaan hiperasiditas lambung, berkurangnya lapisan mukus, menurunnya kadar prostaglandin mukosa serta berkurangnya aliran darah mukosa. Adapun yang termasuk faktor sistemik meliputi berkurangnya asupan lemak, faktor infeksi serta peningkatan kadar bilirubin plasma (Mizumoto 1986).
Dalam mempertahankan integritas mukosa lambung terhadap berbagai faktor agresif, baik yang berasal dari luar maupun yang berasal dari dalam, tubuh memiliki berbagai faktor defensif antara lain lapisan mukus mukosa lambung,
bikarbonat, prostaglandin serta sirkulasi darah mukosa lambung. Dalam keadaan normal terdapat keseimbangan antara faktor agresif dan faktor defensif. Apabila faktor agresif lebih kuat daripada faktor defensif maka integritas mukosa lambung terganggu diikuti dengan pembentukan erosi, ulkus bahkan tidak jarang terjadi perdarahan dan perforasi (Makmun 2005).
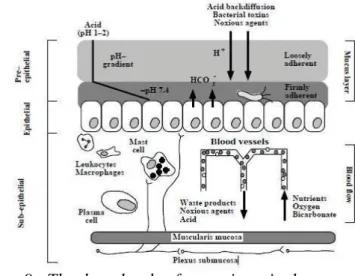
Secara anatomis, struktur dari saluran cerna termasuk lambung terdiri dari lapisan mukosa, submukosa, muskularis dan serosa. Lapisan mukosa terdiri dari sel-sel epitelial yang didasari oleh lamina propria yang terdiri dari sel-sel penunjang, pembuluh darah, pembuluh limfa, serat saraf enterik dan sel-sel sistem imun yang meliputi sel mast, leukosit dan makrofag. Di bawah lamina propria terdapat lapisan muskularis mukosa yang tipis. Lapisan submukosa terdiri dari jaringan ikat padat yang mengandung serat-serta saraf enterik, pembuluh darah dan pembuluh limfa, serta di bawahnya terdapat lapisan muskularis submukosa. Bagian luar dari struktur anatomis saluran cerna adalah lapisan serosa yang terdiri dari jaringan ikat yang longgar yang ditutupi oleh sel-sel skuamosa (Atuma 2000). Dalam tiga dekade terakhir telah banyak dilakukan studi intensif mengenai mekanisme defensif dari saluran pencernaan. Pendapat terkini mengenai mekanisme defensif saluran pencernaan ini dikenal dengan the three levels of gastrointestinal mucosal defense (Atuma 2000), yang membagi mekanisme defensif ini menjadi 3 faktor yaitu faktor pre-epitelial, faktor epitelial dan faktor sub-epitelial (Gambar 9).
Gambar 9. The three levels of gastrointestinal mucosal defense (Dikutip dari Atuma 2000)
Faktor-faktor pre-epitelial disekresikan kedalam lumen saluran cerna, terdiri dari mukus, bikarbonat, imunoglobulin dan laktoferin. Faktor-faktor epitelial terdiri dari membran sel, jaringan ikat intraselular, membran plasma serta restitusi yang merupakan proses perbaikan secara cepat dari sel-sel mukosa yang rusak dengan cara migrasi sel-sel epitel yang normal ke tempat sel-sel epitel yang rusak. Adapun faktor-faktor sub-epitelial terdiri dari aliran darah mukosa, sistem saraf, berbagai mediator inflamasi seperti nitric oxide, berbagai eikosanoid seperti prostaglandin, leukotrien dan tromboksan serta sel-sel sistem imun seperti makrofag dan sel mast (Atuma 2000; Makmun 2005).
Lapisan mukus merupakan faktor defensif pertama dari saluran cerna mulai dari lambung sampai dengan usus besar, melindungi mukosa saluran cerna dari difusi zat-zat yang bersifat merusak, sebagai perangkap bagi mikroorganisme, berinteraksi dengan sistem imun saluran cerna serta sebagai lubrikan. Mukus merupakan senyawa yang kohesif yang terdiri dari air (merupakan bagian terbesar) dan glikoprotein. Fosfolipid merupakan unsur utama dalam pembentukan dan kekuatan lapisan mukus (Slomiany dan Slomiany 1991; Atuma 2000) (Gambar 10). Keberadaan fosfolipid dalam lapisan mukus mukosa lambung ini dapat melindungi mukosa lambung terhadap berbagai faktor agresif termasuk obat-obatan golongan anti inflamasi nonsteroid seperti golongan coxib dan aspirin (Anand et al. 1999; Lichtenberger et al. 2007).
Gambar 10. Skematik mukosa gaster (Dikutip dari Slomiany dan Slomiany 1991) Prostaglandin merupakan salah satu eikosanoid, dibentuk dari asam arakhidonat melalui aktivitas enzim cyclooxygenase (COX). Terdapat dua isoform COX yaitu COX-1 dan COX-2. Peranan prostaglandin dalam ketahanan mukosa
lambung antara lain dengan merangsang sekresi mukus dan bikarbonat, mempertahankan aliran darah mukosa yang optimal, meningkatkan ketahanan sel-sel epitelial terhadap pengaruh buruk sitotoksin, serta menghambat inflitrasi leukosit pada saat terjadi proses inflamasi mukosa (Makmun 2005; Takeuchi et al. 2010).
PUFA merupakan sumber pembentukan fosfolipid dan prostaglandin, disamping sebagai sumber sebagian energi tubuh. PUFA tidak bisa disintesis dalam tubuh, sehingga satu-satunya sumber PUFA tubuh adalah diet sehari-hari. Pada keadaan ikterus obstruktif terjadi gangguan absorpsi lemak terutama asam lemak esensial, menyebabkan terganggunya absorpsi PUFA melalui usus. Jika keadaan ini terus berlanjut, maka akan terjadi berbagai komplikasi terutama terganggunya integritas membran sel, menurunnya berbagai respon biologis tubuh, menurunnya pembentukan reseptor serta terganggunya pembentukan berbagai eikosanoid termasuk prostaglandin (Popovic et al. 2009).
Pada Gambar 11 dijelaskan tentang peranan PUFA sebagai pembentuk fosfolipid (fungsi struktural) melalui bantuan enzim fosfolipase, sebagai sumber energi melalui katabolisme oksidatif, serta PUFA sebagai sumber pembentukan prostaglandin melalui jalur asam arakhidonat. PUFA (dalam hal ini asam linoleat) akan mengalami desaturasi menjadi asam linolenat, yang kemudian mengalami elongasi menjadi asam dihomo-γ-linolenat, serta selanjutnya mengalami denaturasi menjadi asam arakhidonat. Prostaglandin dibentuk dari asam arakhidonat melalui bantuan enzim COX-1 dan COX-2. Prostaglandin yang dibentuk melalui jalur COX-1 berperan penting pada upaya tubuh untuk mempertahankan integritas mukosa saluran cerna, sementara itu prostaglandin yang dibentuk melalui jalur COX-2 berperan dalam timbulnya edema, demam dan rasa nyeri (Sessler dan Ntambi 1998; Makmun 2005; Coste et al. 2010; Takeuchi et al. 2010).
Gambar 11. Jalur metabolisme PUFA menjadi fosfolipid dan prostaglandin
(Diadaptasi dari Sessler dan Ntambi 1998; Coste et al. 2010)
Peranan prostaglandin dalam mekanisme patogenesis kerusakan mukosa lambung akut pada keadaan ikterus obstruktif, dilaporkan oleh penelitian yang dilakukan oleh Nagahata et al. (1997) serta Aslan et al. (2007). Kedua penelitian ini melaporkan terjadinya penurunan kadar prostaglandin E2 jaringan mukosa lambung yang disertai dengan penurunan aliran darah mukosa lambung pada tikus percobaan dengan ikterus obstruktif. Keadaan ini diikuti dengan terjadinya erosi dan ulserasi pada tikus percobaan dengan ikterus obstruktif dibanding dengan tikus kontrol.
Lauterbach et al. (1980) melakukan penelitian mengenai kerusakan mukosa lambung akut pada tikus percobaan dengan ikterus obstruktif melalui pengikatan duktus koledokus. Penelitian ini menyimpulkan bahwa ulkus lambung lebih sering terjadi pada tikus yang mengalami ikterus obstruktif dibanding dengan tikus kontrol.
Sasaki et al. (1997) melakukan penelitian pada 240 ekor tikus yang dibagi menjadi 2 kelompok, yaitu kelompok ikterus obstruktif (dengan pengikatan
Cyclooxygenase Lipoxygenase
Prostaglandin Leukotrien
Desaturase D5 Asam dihomo-γ-linolenat C20:3 ω-6
Asam arakhidonat Elongase Asam linolenat C 18:3 ω-6
Desaturase D6 Asam linoleat 18:2 ω-6
(Fungsi Struktural) fosfolipase (Sumber Energi)
Katabolisme oksidatif PUFA
Fosfolipid
duktus koledokus) dan kelompok kontrol (simple laparotomy). Dua minggu setelah operasi, dilakukan prosedur water immersion restraint stress (WIRS). Aliran darah mukosa lambung diukur dengan teknik hydrogen clearance. Dilakukan juga pengukuran kadar lipid (fosfolipid) hidroperoksida (PCOOH) dengan teknik kromatografi dikombinasi dengan teknik chemiluminescence serta kadar glutation pada mukosa lambung dan hati dengan metode Akerboom. Hasil dari penelitian ini menunjukkan tingginya ulcer index dan penurunan aliran darah mukosa lambung pada kelompok ikterus obstruktif dibanding kontrol. Begitu pula pada kelompok ikterus obstruktif didapatkan kadar glutation yang rendah pada hati serta mukosa lambung dan kadar lipid hidroperoksida yang tinggi pada mukosa lambung dibanding kontrol. Pemberian glutation intraperitoneal dapat meningkatkan kadar glutation mukosa lambung serta menurunkan ulcer index dan kadar lipid hidroperoksida mukosa lambung. Penelitian ini menyimpulkan bahwa penurunan aliran darah mukosa lambung yang menyebabkan penurunan metabolisme energi dan lipid hidroperoksida mempunyai peranan penting dalam patogenesis terjadinya ulserasi gaster akut pada ikterus obstruktif.
Penelitian yang senada dilakukan oleh Ito et al. (1993) pada tikus yang dibagi atas 4 kelompok, yaitu kelompok ikterus obstruktif (pengikatan duktus koledokus), vagotomi, vagotomi dan ikterus obstruktif, dan kelompok kontrol. Hasil penelitian ini menunjukkan:
1) pada kelompok ikterus obstruktif terdapat peningkatan ulcer index, penurunan aliran darah mukosa lambung tanpa perubahan pH intragastrik, peningkatan oxygen radical generating system (aktivitas XOD mukosa gaster dan asam tiobarbiturat) dan oxygen radical scavenging system dibanding kontrol;
2) pada kelompok yang mengalami vagotomi terdapat peningkatan pH intragastric dibanding kontrol, tanpa perubahan aktivitas oxygen radical generating system dan oxygen radical scavenging system; dan
3) pada kelompok ikterus obstruktif dengan vagotomi memperlihatkan penurunan ulcer index dan peningkatan aktivitas oxygen radical generating system dan oxygen radical scavenging system tanpa perubahan pH intragastric dibanding kelompok kontrol.
Penelitian ini menyimpulkan adanya peranan oxygen radical dalam patogenesis terjadinya kerusakan mukosa lambung akut pada ikterus obstruktif.
Hal yang sama dilaporkan juga oleh Ljubuncic et al. (2000) yang menemukan adanya penurunan kadar glutation dan peningkatan kadar peroksida lipid pada plasma, ginjal, otak dan jantung tikus yang mengalami ikterus obstruktif.
Glutation berperan dalam respon tubuh terhadap berbagai oxidative stress pada mukosa lambung melalui pembentukan heat shock protein yang berperan sebagai pelindung sel-sel epitel. Berkurangnya kadar glutation intraselular 10%, dapat menghambat pembentukan heat shock protein tersebut yang bisa diikuti dengan kerusakan mukosa lambung akut (Terano 1998).
Mizumoto et al. (1986) melaporkan mekanisme patogenesis lain terjadinya kerusakan mukosa lambung akut pada ikterus obstruktif. Pada penelitiannya dengan tikus percobaan yang mengalami pengikatan duktus koledokus, dilakukan pengukuran kadar bilirubin plasma, pengukuran lapisan mukus mukosa lambung secara biokimia maupun histokimia. Penelitian ini melaporkan bahwa peningkatan kadar asam empedu plasma terutama asam taurokholat menyebabkan terjadinya efek toksik langsung terhadap lapisan mukus mukosa lambung serta berkurangnya lapisan mukus mukosa lambung sehingga terjadi erosi dan ulserasi.
Hal yang senada dilaporkan oleh Kameyama et al. (1984) melalui penelitiannya pada anjing dengan ikterus obstruktif. Penelitian ini menyimpulkan bahwa peningkatan kadar bilirubin plasma terutama asam taurokholat menyebabkan terjadinya peningkatan permeabilitas mukosa yang dapat mendasari kerusakan mukosa lambung akut pada keadaan ikterus obstruktif.
Peningkatan permeabilitas mukosa saluran cerna pada keadaan ikterus obstruktif diduga juga disebabkan karena faktor-faktor oxidative stress, serta ketidakseimbangan pada proliferasi dan apoptosis sel-sel enterosit. Hal ini dapat diikuti dengan keadaan endotoksemia yang akan meningkatkan mortalitas pasien karena sepsis dan gangguan fungsi ginjal (Assimakopoulos et al. 2007).
Pengaruh Ikterus Obstruktif terhadap Fungsi Ginjal
Penelitian pada kelinci sebagai hewan model ikterus obstruktif yang dilakukan oleh Hishida et al. (1982) memperlihatkan adanya penurunan perfusi ginjal dan peningkatan kadar aldosteron plasma pada kelompok ikterus obstruktif dibanding kontrol tanpa adanya retensi natrium. Pada kelompok ikterus obstruktif juga tidak ditemukan adanya perubahan tekanan darah maupun perubahan laju filtrasi glomerulus.
Penelitian yang berbeda dilakukan oleh Kaler et al. (2004) pada tikus percobaan berdasarkan atas asumsi bahwa ekskresi asam empedu melalui urin akan meningkat pada ikterus obstruktif, sebagai bagian dari upaya tubuh untuk mempertahankan homeostasis kolesterol. Hal ini terjadi beberapa hari setelah obstruksi bilier. Hasil penelitian ini memperlihatkan peningkatan kadar asam empedu plasma, peningkatan kadar asam empedu urin, perubahan gambaran histologi ginjal serta penurunan fungsi ginjal 3-4 hari pasca pengikatan duktus koledokus. Semua peubah ini kembali menjadi normal setelah kadar asam empedu plasma dan urin menurun. Penelitian ini menunjukkan bahwa asam empedu bersifat nefrotoksik.
Yuceyar et al. (1998) melaporkan bahwa pada ikterus obstruktif terjadi keadaan gagal ginjal akut. Dengan mengukur kadar ureum dan kreatinin plasma, kadar enzim xanthine oxidase (XOD), superoxide dismutase (SOD), catalase dan glutathione peroxidase (GSH-Px) plasma pada tikus percobaan dengan ikterus obstruktif dibanding dengan tikus kontrol dapat disimpulkan bahwa iskemi ginjal yang terjadi pada keadaan ikterus obstruktif disebabkan oleh karena terjadinya oxidant injury yang dapat berlanjut menjadi gagal ginjal.
Adapun penelitian yang dilakukan oleh Tanaka et al. (2002), Assimakopoulos dan Vagianos (2009) tentang penurunan fungsi ginjal pada tikus percobaan dengan ikterus obstruktif, keduanya melaporkan hasil penelitian yang hampir senada dengan laporan hasil penelitian Kaler et al. (2004). Gangguan fungsi ginjal akut pada keadaan ikterus obstruktif disebabkan peningkatan kadar empedu dalam sirkulasi darah yang bersifat nefrotoksik, disamping adanya peranan endotoksemia. Jika obstruksi berkelanjutan, dapat terjadi kerusakan hati lanjut (sirosis bilier) yang dapat mencetuskan terjadinya sindrom hepatorenal.
Sepsis pada Ikterus Obstruktif
Obstruksi sistem bilier berkelanjutan dapat menimbulkan keadaan sepsis, serta dalam jangka panjang dapat mengakibatkan terjadinya fibrosis hati dengan patogenesis yang belum sepenuhnya dimengerti. Salah satu faktor yang diduga berperan dalam hal tersebut adalah peranan kemotaksis netrofil yang diduga dirangsang oleh cairan empedu sendiri yang mengandung sitokin dan endotoksin. Beberapa penelitian mengenai hal ini antara lain dilakukan oleh Shibatani et al. (2002) yang melaporkan adanya peningkatan kemotaksis netrofil pada tikus yang mengalami pengikatan duktus koledokus, dengan mengukur kadar interleukin 8 yang telah diketahui sebagai chemoattractant. Tindakan drainase bilier dapat menurunkan aktivitas netrofil, sehingga dapat mencegah timbulnya komplikasi sepsis.
Di sisi lain, Saito dan Maher (2000) melaporkan adanya infiltrasi netrofil pada jaringan hati dari tikus yang mengalami ikterus obstruktif, serta menemukan adanya peningkatan kadar cytokine induced neutrophil chemoattractant (CIMC) dalam darah. Hal ini menunjukkan adanya peranan netrofil dalam patogenesis terjadinya kerusakan jaringan hati pada ikterus obstruktif.
Penelitian yang sama mengenai kemotaksis netrofil pada tikus percobaan juga dilakukan oleh Tsuji et al. (1999) dengan hasil yang sama bahwa peningkatan aktivitas netrofil bertanggung jawab atas respons inflamasi pada ikterus obstruktif.
Keadaan sepsis merupakan komplikasi yang sering bersifat fatal pada ikterus obstruktif. Hal ini diduga karena adanya gangguan homeostatic environment dari gut-liver-axis. Saluran cerna merupakan sumber dari banyak bakteri gram negatif dalam tubuh, sementara itu integritas dari barier mukosa saluran cerna dapat mencegah terjadinya translokasi dari bakteri tersebut. Dalam keadaan ikterus obstruktif (seperti halnya dalam keadaan obstruksi usus, perdarahan, infeksi, trauma dan luka bakar) terjadi kerusakan pada integritas mukosa saluran cerna, sehingga dapat mengakibatkan terjadinya translokasi bakteri dan endotoksin. Pada tahun 1996, Clements et al. melakukan penelitian tentang endotoksemia pada ikterus obstruktif dengan mengukur kadar endotoksin plasma dan translokasi bakteri pada dinding usus (baik secara kuantitatif maupun
kualitatif) pada tikus percobaan. Penelitian ini menunjukkan adanya peningkatan kadar endotoksin plasma serta translokasi bakteri secara bermakna pada dinding kolon dan ileum terminal. Dua tahun kemudian (1998), Clements et al. melaporkan adanya peningkatan endotoksin pada tikus yang mengalami ikterus obstruktif dengan mengukur anticore glycolipid antibody (ACGA) dengan menggunakan teknik enzyme linked immunosorbent assay (ELISA). Hal senada dilaporkan oleh Abdeldayem et al. (2007) dan Assimakopoulos et al. (2007). Ada 4 faktor yang diduga berperan dalam fenomena ini:
1) penurunan sistem imun tubuh, 2) disfungsi barier intestinal, 3) overgrowth flora intestinal, dan 4) endotoksemia.
Peranan defisiensi arginin dalam patogenesis terjadinya penurunan sistem imun selular pada ikterus obstruktif dilaporkan oleh Houdijk et al. (1997). Dengan menggunakan tikus sebagai hewan percobaan, penelitian ini menunjukkan adanya defisiensi arginin yang disebabkan karena peningkatan aktivitas enzim arginase plasma akibat peningkatan kadar endotoksin. Arginin adalah salah satu asam amino yang sangat berperan dalam fungsi limfosit. Pada penelitian ini juga dilaporkan bahwa kolestiramin dapat mencegah terjadinya defisiensi arginin dengan menurunkan aktivitas enzim arginase plasma melalui pengikatan terhadap endotoksin.
Zhou et al. (1992) meneliti tentang peranan platelet activating factor (PAF) pada patogenesis terjadinya inflamasi dan endotoksemia pada tikus yang mengalami ikterus obstruktif.
Penelitian ini menunjukkan:
1) adanya hubungan antara endotoksemia dengan peningkatan kadar PAF plasma, dan
2) adanya peranan PAF dalam kerusakan jaringan hati serta hubungan antara PAF dengan mediator inflamasi lainnya.
Gangguan Hemostasis pada Ikterus Obstruktif
Sebagai bagian dari fungsi sintesis protein dari hati, berbagai faktor koagulasi (fibrinogen, protrombin, faktor V, VII, IX, X, XI, XII, XIII, prekalikrein), natural anticoagulant (anti-trombin III, heparin, kofaktor II, Protein C dan Protein S) serta faktor fibrinolitik diproduksi di dalam hati. Oleh sebab itu pada penyakit hati yang berkepanjangan (karena obstruksi atau penyakit parenkim hati) akan terjadi gangguan hemostasis. Menurunnya faktor-faktor koagulasi akibat kerusakan hepatosit diperberat dengan adanya penurunan absorpsi vitamin K (yang larut dalam lemak) karena tidak adanya cairan empedu dalam usus pada keadaan ikterus obstruktif. Dalam keadaan ini terjadi penurunan sintesis faktor-faktor koagulasi yang vitamin K dependent yaitu faktor-faktor II, VII. IX, X, protein C, protein S dan anti-trombin III), yang akan memperburuk sistem koagulasi. Faktor lain yang diduga turut berperan pada gangguan hemostasis dalam keadaan ikterus obstruktif adalah adanya translokasi bakteri. Dalam keadaan ini translokasi bakteri dan endotoksin melewati barier mukosa lambung akan mencapai kelenjar getah bening mesentrium atau jaringan tubuh yang lebih jauh yang menyebabkan timbulnya respons inflamasi sistemik yang pada akhirnya akan mengganggu sistem koagulasi melalui penurunan produksi tissue factor (Clarke et al. 2006; Papadopoulos et al. 2007). Gangguan hemostasis ini pada akhirnya akan memperberat terjadinya perdarahan yang diakibatkan oleh adanya kerusakan mukosa lambung akut pada keadaan ikterus obstruktif.
Hewan Model
Penelitian mengenai ikterus obstruktif dengan menggunakan hewan model telah banyak dilakukan dengan menggunakan tikus, anjing atau kelinci. Keadaan ikterus obstruktif pada hewan-hewan model ini terjadi setelah dilakukan pengikatan duktus koledokus. Pada hewan model tikus, umumnya dilakukan berbagai observasi yang bersifat jangka pendek, karena keadaan tikus akan segera memburuk jika tidak dilakukan drainase bilier. Observasi yang agak lama dalam keadaan ikterus obstruktif dilakukan pada kelinci dan anjing. Pada keadaan ini, selain dilakukan evaluasi fisik dan biokimiawi, dapat dilakukan juga evaluasi perubahan histopatologik jaringan seperti ginjal dan hati. Hal ini memungkinkan
untuk dilakukan, karena kedua hewan model ini dapat bertahan lebih lama dalam keadaan ikterus obstruktif sebelum dilakukan drainase bilier (Hishida et al. 1982; Fraser et al. 1989).
Penggunaan satwa primata dalam penelitian biomedis, khususnya ikterus obstruktif didasari atas kenyataan bahwa karakteristik fisiologi satwa primata hapir sama dengan manusia. Begitu pula anatomi tubuh khususnya saluran cerna hampir sama dengan saluran cerna manusia. Di sisi lain, pola nutrisi yang dibutuhkan satwa primata umumnya tak jauh berbeda dengan yang dibutuhkan manusia (Napier dan Napier 1985, Fleagle 1996; Nishizono dan Fuioka 2005). Keuntungan lain dari penggunaan satwa primata pada penelitian ini, bahwa hewan ini mudah diperoleh di negara kita (tidak harus diimpor dari luar negeri), mudah di handle (dikelola) dengan fasilitas yang kita sediakan, serta jumlah hewan model yang akan digunakan memungkinkan untuk dikelola oleh peneliti. Dengan menggunakan hewan model satwa primata pada penelitian ini diharapkan dapat dilakukan berbagai observasi, baik secara fisik, biokimiawi maupun histopatologik jaringan sehingga dapat menjawab tujuan penelitian.