MENTERI KESEHATAN REPUBLIK INDONESIA
KEPUTUSAN MENTERI KESEHATAN REPUBLIK INDONESIA
NOMOR 761/MENKES/SK/IX/1992 TENTANG
PEDOMAN FITOFARMAKA
MENTERI KESEHATAN REPUBLIK INDONESIA
Menimbang : a. bahwa dalam rangka pengembangan obat tradisional ke arah fitofarmaka perlu adanya pedoman uji fitofarmaka
b. bahwa untuk pelaksanaan hal tersebut dalam butir (a) dan dalam rangka pelaksanaan Pasal 11 Ayat (2) Peraturan Menteri Kesehatan Republik lndonesia No. 760/ Menkes/ Per/ IX/ 1992 tentang fitofarmaka perlu ditetapkan Keputusan Menteri Kesehatan Republik Indonesia tentang Pedoman Fitofarmaka
Mengingat : 1. Keputusan Presiden Rl No. 44 tahun 1974 tentang Pokok-pokok Organisasi Departemen 2. Keputusan Presiden R l No. 15 tahun 1984
tentang Susunan Organisasi Departemen,
3. Peraturan Menteri Kesehalan Rl No. 246/MenKes/Per/V/l990 tentang lzin Usaha Industri Obat Tradisional dan Pendaftaran Obat Tradisional.
4. Peraturan Menteri Kesehatan Rl No. 700/ Men,Kes/ Per/ lX/ 1992 tentang Filofarmaka. 5. Keputusan Menteri Kesehatan Rl No.
99a/Men.Kes/SK/lll/1992 tentang berlakunya Sistem Kesehatan Nasional.
6. Keputusan Menteri Kesehatan Rl No. 47/ Men.Kes/ SK/ ll/ 1983 tentang Kebijaksanaan Obat Nasional.
M E M U T U S K A N :
Pertama : Mengesahkan dan memberlakukan Pedoman Fitofarmaka sebagaimana tercantum dalam Lampiran Keputusan ini, sebagai pedoman bagi semua pihak yang terlibat dalam pembuatan pengembangan fitofarmaka.
Kedua : Hasil uji fitofarmaka yang dikeluarkan oleh Sentra Uji Fitofarmaka merupakan syarat untuk pendaftaran Fitofarmaka.
Ketiga : Hasil Uji Fitofarmaka yang berasal dari luar negeri perlu mendapatkan pengkajian dan rekomendasi lebih dahulu dari Komisi Ahli Fitofarmaka.
Keempat : Dalam rekomendasi yang dimaksud pada amar ketiga Komisi Ahli Fitofarmaka dapat menyarankan untuk melakukan uji fitofarmaka pada Sentra Uji Fitofarmaka.
Kelima : Pedoman Fitofarmaka yang dimaksud dalam amar pertama dapat ditinjau dan ditetapkan kembali oleh Direktur Jenderal Pengawasan Obat dan Makanan.
Keenam : Keputusan ini berlaku sejak tanggal ditetapkan.
Ditetapkan di : Jakarta
Pada Tanggal : 4 September 1992
MENTERI KESEHATAN REPUBLIK INDONESIA
ttd
LAMPIRAN : KEPUTUSAN MENTERI KESEHATAN R.I. NOMOR : 761/MENKES/SK/IX/1992 TANGGAL : 4 SEPTEMBER 1992
PEDOMAN FITOFARMAKA
I. FITOFARMAKA
DEFINISI
Fitofarmaka adalah sediaan obat yang telah dibuktikan keamanan dan khasiatnya, bahan bakunya terdiri dari simplisia atau sediaan galenik yang telah memenuhi persyaratan yang berlaku.
PRIORITAS PEMILIHAN
1. Bahan bakunya relatif mudah diperoleh. 2. Didasarkan pada pola penyakit di Indonesia.
3. Perkiraan manfaatnya terhadap penyakit tertentu cukup besar.
4. Memiliki rasio resiko dan kegunaan yang menguntungkan penderita.
5. Merupakan satu-satunya alternatif pengobatan.
RAMUAN
Ramuan (komposisi) hendaknya terdiri dari 1 (satu) simplisia/ sediaan galenik. Bila hal tersebut tidak mungkin, ramuan dapat terdiri dari beberapa simplisia,/sediaan galenik dengan syarat tidak melebihi 5 (lima) simplisia/sediaan galenik. Simplisia tersebut masing-masing sekurang-kurangnya telah diketahui khasiat dan keamanannya berdasar pengalaman.
STANDAR BAHAN BAKU
Penggunaan ketentuan atau persyaratan lain diluar Farmakope Indonesia, Ekstra Farmakope Indonesia dan Material Indonesia harus mendapat persetuiuan pada waktu pendaftaran fitofarmaka. untuk menjamin keseragaman khasiat dan keamanan fitofarmaka harus diusahakan pengadaan bahan baku yang terjamin keseragaman komponen aktifnya. Untuk keperluan tersebut, bahan baku sebelum digunakan harus dilakukan pengujian melalui analisis kualitatif dan kuantitatif.
Secara bertahap industri harus meningkatkan persyaratan tentang rentang kadar alkaloid total, kadar minyak atsiri dan lain sebagainya.
ZAT KIMIA BERKHASIAT
Penggunaan zat kimia berkhasiat (tunggal murni) dalam fitofarmaka dilarang.
BENTUK SEDIAAN
untuk mendapatkan formulasi yang tepat, diperlukan suatu percobaan. Dari beberapa percobaan tersebut dipilih formula yang memberikan keamanan, khasiat, mutu dan stabilitas yang paling tinggi. Bentuk sediaan Fitofarmaka seperti tertera pada Lampiran 1 .
STANDAR FITOFARMAKA
setiap fitofarmaka.harus dapat dijamin kebenaran komposisi, keseragaman komponen aktif dan keamanannya baik secara kualitatif maupun secara kuantitatif. Pada analisis terhadap ramuan, sebagai baku pembanding digunakan zat utama atau zat identitas lainnya. Secara bertahap industri harus mempertajam perhatian terhadap galur fitokimia simplisia yang digunakan.
KHASIAT
DUKUNGAN PENELITIAN
Fitofarmaka harus didukung oleh. Hasil pengujian, dengan protocol pengujian yang jelas dan dapat dipertanggung jawabkan. Pengujian meliputi toksisitas, uji efek, farmakologik, uji klinik, uji kualitas dan pengujian lain yang dipersyararkan.
II. UJI KLINIK FITOFARMAKA
DEFINISI
Uji klinik Fitofarmaka adalah pengujian pada manusia, untuk mengetahui atau memastikan adanya efek farmakologi tolerabilitas, keamanan dan manfaat klinik untuk pencegahan penyakit, pengobatan penyakit atau pengobatan segala penyakit.
DASAR PEMIKIRAN
1. Obat tradisional baik dalam bentuk simplisia tunggal maupun ramuan sebagian besar penggunaan dan kegunaannya masih berdasarkan pengalaman.
2. Data yang meliputi kegunaan, dosis dan efek samping sebagian besar belum didasarkan pada landasan ilmiah, karena penggunan obat tradisional baru didasarkan kepada kepercayaan terhadap Informasi berdasarkan pengalaman. 3. Dalam rangka upaya pembangunan di bidang kesehatan,
obat tradisional perlu dikembangkan dan secara berangsur-angsur dimanfaatkan berdasarkan atas landasan ilmiah, sehingga dapat digunakan dalam upaya pelayanan kesehatan normal kepada masyarakat.
4. Dalam rangka pengembangan obat tradisional tersebut maka obat tradisional perlu dikelompokkan kedalam 2 golongan yaitu:
a) Obat tradisional jamu. b) Fitofarmaka.
Dalam kaitannya dengan pemanfaatannya di dalam kesehatan, Fitofarmaka perlu mendapat prioritas.
TUJUAN
Tujuan pokok uji klinik fitofarmaka adalah:
1. Memastikan keamanan dan manfaat klinik fitofarmaka pada manusia dalam pencegahan atau pengobatan penyakit maupun gejala penyakit.
2. Untuk mendapatkan fitofarmaka yang dapat dipertanggung jawabkan keamanan dan manfaatnya.
TAHAP-TAHAP PELAKSANAAN
1. Merencanakan tahap-tahap pelaksanaan uji klinik Fitofarmaka termasuk formulasi, uji farmakologik eksperimental dan uji kimia.
2. Melaksanakan uji klinik fitofarmaka.
3. Melakukan evaluasi hasil uji klinik fitofarmaka.
4. Menyebar luaskan informasi tentang hasil uji klinik litofarmaka kepada masyarakat (peneliti diperbolehkan mempublikasikan pengujian yang dilakukan dengan memperhatikan kode etik publikasi ilmiah).
5. Memantau penggunaan dan kemungkinan timbulnya efek samping fitofarmaka.
PERSYARATAN UJI KLINIK FITOFARMAKA
Beberapa syarat yang harus dipenuhi dalam uji klinik Fitofarmaka
1. Terhadap calon fitofarmaka dapat dilakukan pengujian klinik pada manusia apabila sudah melalui penelitian toksisitas dan kegunaan pada hewan coba yang sesuai dan dinyatakan memenuhi syarat, yang membenarkan dilakukannya pengujian klinik pada manusia.
2. Alasan untuk melaksanakan uji klinis terhadap suatu fitofarmaka dapat didasarkan pada :
b. Adanya pengalaman empirik dan / atau histori bahwa fitofarmaka tersebut mempunyai manfaat klinik dalam pencegahan dan pengobatan dan pengobatan penyakit atau gejala penyakit.
3. Uji Klinik Fitofarmaka merupakan suatu kegiatan pengujian multidisiplin.
4. Uji klinik Fitofarmaka harus memenuhi syarat-syarat ilmiah dan metodologi suatu uji klinik untuk pengembangan dan evaluasi khasiat klinik suatu obat baru. Protokol uji klinik suatu calon fitofarmaka harus selaras dengan Pedoman Fitofarmaka yang ditetapkan oleh Menteri Kesehatan Rl. Protokol uji klinik dengan rancangan dan metodologi yang sesuai dikembangkan dulu oleh tim peneliti. Protokol uji klinik harus dinilai dahulu oleh suatu Panitia llmiah yang independent untuk mendapatkan persetujuan.
5. Uji Klinik Fitofarmaka harus memenuhi prinsip-prinsip etika sejak perencanaan sampai pelaksanaan dan penyelesaian uji klinik. Setiap pengujian harus mendapatkan ijin kelaikan etik (ethical clearance) dari Panitia Etika Penelitian Biomedik pada manusia. 6. Uji Klinik Fitofarmaka hanya dapat dilakukan oleh
tim peneliti yang mempunyai keahlian, pengalaman, kewenangan dan tanggung jawab dalam pengujian klinik dan evaluasi khasiat klinik obat.
7. Uji Klinik Fitofarmaka hanya dapat dilakukan oleh unit-unit pelayanan dan penelitian yang memungkinkan untuk pelaksanaan suatu uji klinik, baik dipandang dari segi kelengkapan sarana, keahlian personalia, maupun tersedianya pasien yang mencukupi. Pengulian klinik dalam unit-unit pelayanan kesehatan di luar Sentra Uji Fitofarmaka, misalnya di Puskesmas atau Rumah Sakit, harus mendapatkan supervisi dan monitoring dari Sentra Uji Fitofarmaka sejak perencanaan, pelaksanaan sampai dengan penyelesaiannya.
REFERENSI PENIIAIAN
Referensi penilaian:
2. Dalam hal belum ada data penilaian dapat ditetapkan berdasarkan penilaian kelayakan.
III. RENCANA KERANGKA TAHAP-TAHAP PENGEMBANGAN
Agar supaya fitofarmaka dapat dipertanggung jawabkan keamanan dan khasiatnya dalam pemakaiannya pada manusia, maka pengembangan obat tradisional tersebut harus mencakup berbagai tahap pengujian dan pengembangan secara sistematik. Tahap-tahap ini meliputi:
1. Pemilihan.
2. Pengujian Farmakologik
a. Penapisan aktivis farmakologik diperlukan bila belum terdapat petunjuk mengenai khasiat.
b. Bila telah ada petunjuk mengenai khasiat maka langsung dilakukan pemastian khasiat.
3. PengujianToksisitas a. Uji toksisitas akut. b. Uji toksisitas sub akut. c. Uji toksisitas kronik.
d. Uji toksisitass pesifik: - Toksisitas pada janin.
- Mutagenisitas. - Toksisitasto pikal. - Toksisitaso ada darah. - Dan lain-lain.
4. Pengujian Farmakodinamik
5. Pengembangan Sediaan (formulasi).
6. Penapisan Fitokimia dan Standarisasi Sediaan. 7. Pengujian klinik.
Sesudah fitofarmaka terbukti mempunyai khasiat yang bermakna dan memenuhi syarat keamanan pemakaian pada manusia, maka pengembangan dan penelitian lebih lanjut perlu dilakukan.
1. TAHAP PEMILIHAN (SELEKSI)
a. Jenis obat tradisional yang diharapkan mempunyai khasiat untuk penyakit-penyakit yang menduduki urutan atas dalam morbiditas (pola penyakit).
b. Jenis obat tradisional yang diperkirakan mempunyai khasiat untuk penyakit-penyakit tertentu berdasarkan inventarisasi pengalaman pemakaian.
c. Jenis obat tradisional yang diperkirakan merupakan alternatif yang jarang (atau satu satunya alternatif ) untuk penyakit tertentu. Misalnya untuk obat kencing batu (kalkuli).
Ketentuan lanjut tentang prioritas pemilihan jenis obat tradisional yang akan diuji dan dikembangkan kearah fitotarmaka akan ditetapkan oleh Direktur Jenderal Pengawasan Obat dan Makanan, Departemen Kesehatan Republik Indonesia. Pada saat ini pengujian dilakukan terhadap calon-calon obat yang tidak bersifat narkotik.
2. TAHAP PENGUJIAN FARMAKOLOGIK
Penapisan efek farmakologi Fitofarmaka ditujukan untuk melihat dan kerja farmakologik pada system biologic yang dapat merupakan petuniuk terhadap adanya khasiat terapetik.
Pengujian dapat dilakukan secara in vivo maupun in vitro pada hewan coba sesuai. Petunjuk tentang khasiat calon fitofarmaka seyogyanya diperoleh dari percobaan in vivo pada hewan mamalia yang sesuai, sedapat mungkin dikaitkan dengan model penyakitnya pada manusia. Tidak semua khasiat terapetik calon obat bisa diperkirakan secara langsung dari model-model percobaan hewan. Beberapa khasiat yang mungkin bisa diperkirakan dari uji penapisan dengan model percobaan hewan misalnya daya analgetik, daya menidurkan, anti hipertensia, anti diabetes, anti arthritis dll. Kegunaan uji penapisan farmakologik sebenarnya adalah untuk menghindari pemborosan dalam tahap uji lebih lanjut. Hasil positif dapat digunakan untuk perkiraan kemungkinan efek pada manusia.
3. TAHAP PENGUJIAN TOKSISITAS
Pengamatan kematian dalam waktu 24 jam digunakan untuk menghitung LD50, dan hewan dipelihara selama 14
hari. Uji toksisitas akut merupakan prasyarat formal keamanan calon fitofarmaka (obat) untuk pemakaian pada manusia. Secara ideal uji toksisitas akut dilakukan pada beberapa jenis hewan, sekurang-kurangnya jenis hewan pengerat dan satu jenis hewan bukan pengerat. Namun karena berbagai pertimbangan uji toksisitas akut pada saat ini sudah cukup memadai , bila dilakukan pada tikus dari kedua jenis kelamin, menggunakan minimal hewan dari tiap kelamin perdosis. Yang perlu dicari disini adalah : a. Spektrum toksisitas akut Sistem biologik yang paling
peka terhadap calon Fitofarmaka. b. Cara kematian (mode of death).
c. Nilai dosis lethal median( LD50) yang dihitung dengan
metode statistic baku.
Pada kasus dimana sulit untuk memperoleh harga LD50
a. Toksisitas sub akut. b. Toksisitas kronik. c. Toksisitas spesifik.
a. Toksisitas Sub Akut
Rancangan uji toksisitas sub akut dibuat berdasarkan hasil uji toksisitas akut.
Uji toksisitas sub akut. Dapat memberikan gambaran tentang toksisitas calon fitofarmaka pada penggunaan berulang untuk jangka waktu yang relatif lama. Kecenderungan kumulasi dan reversibilitas efek toksik calon fitofarmaka dapat dinyatakan dari hasil uji toksisitas sub akut.
- Hewan coba ideal tiga jenis, yaitu 2 rodent dan 1 non rodent, untuk sementara cukup memadai menggunakan satu jenis yaitu tikus, minimal 3 dosis, salah satu dosis adalah dosis ekivalen yang akan digunakan pada manusia, 10 hewan per dosis, dua jenis kelamin.
- Route pemberian sama dengan route yang digunakan pada manusia.
- Jangka waktu uji pemberian calon fitofarmaka pada toksisitas sub akut 3 (tiga) bulan.
Pemeriksaan organ-organ vital seperti hepar, ginjal, paru, otak, system hematologik , di kerjakan dengan metode standar (baku), termasuk pemeriksaan histopatologik . Teknis pelaksanaan pengujian harus dikerjakan dengan cara-cara standar (baku) yang memenuhi persyaratan ilmiah. Bilamana pada pengamatan Uji toksisitas akut terlihat adanya gejala toksik pada organ hati dan atau ginjal maka parameter perlu dilengkapi dengan parameter biokimia mengenai hati dan ginjal.
b. Toksisitas Kronik
- Rancangan uji toksisitas kronik dibuat berdasarkan hasil uji toksisitas sub akut.
- Jumlah hewan coba yang digunakan harus cukup banyak, minimal 20 ekor per dosis, agar hasil uji toksisitas kronik masih dapat ditafsirkan dengan cermat, walaupun terjadi kematian hewan yang tidak berkaitan dengan hal-hal teknis percobaan selama waktu pengujian.
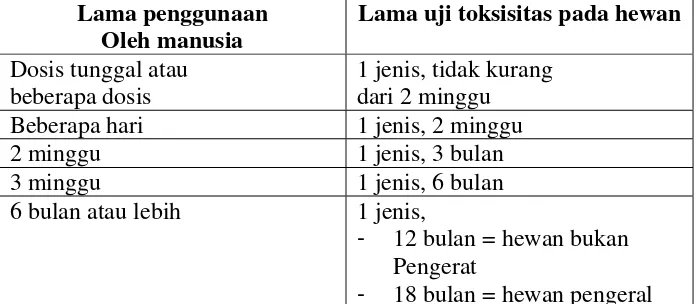
Lama Pemberian Calon Fitofarmaka ada Uji Toksisitas. Lama pemberian fitofarmaka pada hewan coba untuk uji toksisitas dianjurkan agar disesuaikan dengan lamanya pemakaian obat pada manusia.
Tabel berikut memperlihatkan skema lama pemberian yang diperlukan pada uji toksisitas dihubungkan dengan pemberian pada manusia. Tabel ini merupakan modifikasi dari pedoman FDA untuk evaluasi obat yang akan digunakan pada manusia ( 1975).
Lama penggunaan Oleh manusia
Lama uji toksisitas pada hewan
Dosis tunggal atau beberapa dosis
1 jenis, tidak kurang dari 2 minggu Beberapa hari 1 jenis, 2 minggu 2 minggu 1 jenis, 3 bulan 3 minggu 1 jenis, 6 bulan 6 bulan atau lebih 1 jenis,
- 12 bulan = hewan bukan Pengerat
- 18 bulan = hewan pengeral
Sebagai jalan tengah, perlu selalu dicari dan dikembangkan alternatif-alternatif model dan prosedur uji toksisitas yang masih memenuhi persyaratan minimal keamanan obat.
c. Toksisitas Spesifik
pada manusia. Misalnya uji teratogenisitas atau uji toksisitas terhadap janin harus dikerjakan bila pemakaian klinik fitofarmaka nantinya diberikan pada masa-masa organogenesis dan kehamilan.
Uji mutagenisitas dan karsinogenisitas harus dikerjakan bila fitofarmaka dipakai secara kronik, peraksanaan penguiian, harus memenuhi cara-cara standar (baku) yang lazim. Untuk sediaan-sediaan yang digunakan secara topikal dipersyaratkan untuk dilakukan pengujian toksisitas secara topikal misalnya iritasi kulit dengan model hewan percobaan yang sesuai.
4. TAHAP PENGUJIAN FARMAKODINAMIK
Tahap ini dimaksudkan untuk lebih mengetahui secara lugas penqaruh farmakologik pada berbagai system biologik. Bila diperlukan , penelitian dikerjakan pada hewan coba yang sesuai, baik secara invitro atau invivo. Bila calon fitofarmaka sudah menjalani uji penapisan biologic (tahap 2) dan dipandang belum bias atau belum mungkin untuk dikerjakan pengujian farmakodinamik , maka hal ini seyogyanya tidak merupakan penghambat untuk lebih lanjut. Tahap pengujian farmakodinamik akan lebih banyak tergantung pada sarana dan prasarana yang ada, baik perangkat lunak maupun perangkat keras.
5. TAHAP PENGEMBANGAN SEDIAAN (FORMULASI)
Perkembangan sediaan dimaksudkan agar bentuk sediaan fitofarmaka yang akan diberikan pada manusia nantinya memenuhi persyaratan-persyaratan kualitas maupun estetika. Syarat-syarat kualitas yang sesuai dengan cara pemberian baik peroral maupun cara pemberian lain harus diperhatikan secara khusus.
Yang perlu mendapat perhatian , sediaam calon fitofarmaka yang diberikan harus :
1. Tidak memberikan bau dan rasa yang menyebabkan kegagalan pengujian (contoh pada bawang putih). 2. mempunyai ketersediaan hayati yang baik, hasil uji
kadang-kadang disebabkan ketersediaan hayati calon fitofarmaka yang tidak memadai.
6. PENAPISAN FITOKIMIA DAN STANDARISASI SEDIAAN
jika sebelum diketahui kandungan aktifnya, tahap pertama yang harus dilakukan bersamaan dengan pengujian klinik dalam pembuatan profil kromatogram bertahap dengan pelarut non polar, semi polar dan polar.
Slanjutnya dilkukan standarisasi sediaan dengan menggunakan zat identitas.
Penelitian fitokimialebih lanjut adalah penentuan kandungan kimia aktif. Jika kandungan kimia aktif sediaan sudah diketahui, maka dapat dilakukan standarisasi sediaan berdasarkan atas kadar kandungan aktif tersebut.
7. TAHAP PENGUJIAN KLINIK
Persyaratan dilaksanakannya uji klinik calon fitofarmaka antara lain adalah :
a. Adanya dasar pertimbangan pelaksanaan Dasar pertimbangan dilakukannya uji klinik terhadap suatu calon fitofarmaka adalah:
- Adanya pengalaman empiris bahwa calon fitofarmaka tersebut mempunyai manfaat klinik dalam pencegahan dan pengobatan penyakit atau gejala penyakit.
- Adanya data farmakologik pada pengujian terhadap hewan yang menunjukkan fitofarmaka tersebut emmpunyai aktifitas farmakologik yang relevan.
b. Persyaratan untuk uji klinik Terhadap fitofarmaka dapat dilakukan Uji Klinik pada manusia apabila sudah terbukti aman berdasarkan penelitian toksikologi dan dinyatakan memenuhi syarat keamanan untuk pengujian pada manusia.
- Uji klinik fitofarmaka harus memenuhi syarat-syarallmiah dan metodologik suatu uji klinik untuk pengembangan dan evaluasi suatu obat baru.
- Protokol uji klinik fitofarmaka harus sudah disetujui oleh suatu Panitia llmiah yang independent
- Uji klinik fitofarmaka hanya dapat dilakukan oleh beberapa orang (tim) peneliti yang mempunyai keahlian, pengalaman, kewenangan dan tanggung jawab dalam pengujian klinik dan evaluasi obat.
- Uji klinik fitofarmaka harus memenuhi prinsip-prinsip etika sejak perencanaan pelaksanaan sampai dengan penyelesaian uji klinik
- Setiap pengujian harus menciapatkan izin kelaikan etik (Ethical clearance) dari Panitia Etika Penelitian Biomedik pada manusia.
Uji klinik fitofarmaka hanya dapat dilakukan di unit-unit pelayanan dan penelitian yang memungkinkan untuk pelaksanaan suatu uji klinik, baik dari segi kelengkapan sarana, personalia, kemampuan maupun tersedianya pasien-pasien yang mencukupi. Uji klinik Fitofarmaka seyogyanya dilakukan sesuai dengan tahap-tahap uji klinik calon obat baru yang meliputi fase l , fase ll, fase lll dan fase lV. Uji klinik Fitofarmaka secara praktis dapat disederhanakan sebagai berikut :
1. Tahap Awal (uji klinik rancangan terbuka). Uji Klinik Tahap Awal adalah suatu uji klinik tanpa pembanding (uncontrolled trial). Tahap ini bertujuan untuk melihat adanya kemungkinan manfaat klinik, menentukan dosis yang dapat menimbulkan efek tersebut serta untuk
Uji klinik dapat dilakukan disalah satu pusat penelitian (mono centre) atau di beberapa pusat penelitian (multi centre).
2. Tahap Pemantauan (Fase lV)
Uji klinik tahap pemantauan merupakan survailan efek samping yang langka ( rare, side effects) yang baru muncul setelah pemberian jangka panjang yang tidak mungkin terkendali pada fase-fase uji klinik sebelum pemasaran. System survailan ini seyogyanya merupakan bagian dari system Monitoring Efek Samping Obat (MESO) Nasional. Disamping itu, Uji Klinik Tahap Pemantauan dilakukan untuk melihat manfaat obat pada keadaan yang sesungguhnya dalam klinik, pada populasi penderita yang khusus misalnya anak-anak, orang lanjut usia dan lain-lain.
Perlu diketahui bahwa efek yang tidak diinginkan (adverse effects) yang dapat dikenali pada tahap awal dan tahap lanjut adalah tipe yang umum. Beberapa hal yang perlu diperhatikan dalam uji klinik:
A. Umum:
1. Tujuan uji klinik harus jelas.
2. Memenuhi prinsip ilmiah yang telah diakui.
3. Prinsip etik penelitian pada manusia harus jelas, Kepentingan pasien harus diutamakan.
4. Dikerjakan oleh Tim Ahli yang berpengalaman di kerjakan dengan prinsip-prinsip, metodologi dan rancangan yang memadai.
5. Uji Klinik Fitofarmaka dikerjakan oleh Tim Ahli yang secara ilmiah dan etis memenuhi syarat dan berada di bawah pengawasan seorang tenaga medis yang mempunyai kompetensi klinik.
7. Pasien dan keluarganya secara singkat perlu diberitahu prosedur terapik yang akan dijalani dan memberi persetujuan tertulis.
8. Calon Fitofarmaka harus memenuhi persyaratan.
9. Bentuk sediaan fitofarmaka harus sesuai dengan tujuan pengobatan dan sifat bahan bakunya.
10.Dari hasil pengujian farmakologik eksperimental dan toksisitas dengan spesies dan jumlah hewan coba yang memadai, dinyatakan memadai untuk dilanjutkan dengan Uji Klinik Fitofarmaka.
11.Adanya data yang memadai yang berasal dari pustaka ilmiah.
12.Rancangan dan Pelaksanaan setiap prosedur percobaan harus dirumuskan secara jelas dan rinci dalam suatu protocol penelitian.
13.Protokol penelitian harus diajukan kepada panitia independen yang khusus ditunjuk untuk memberi pertimbangan, ulasan dan bimbingan.
14.Uji Klinik Fitofarmaka harus:
a. Didahului dengan penilaian yang cermat mengenai risiko yang dapat diramalkan
b. Dapat memberi manfaat yang lebih besar bila disbanding dengan resiko yang akan dialami subyek.
c. Mengutamakan kepentingan subyek dari pada kepentingan ilmiah.
15.Uji Klinik Fitofarmaka harus dihentikan bila ditemukan bahwa bahayanya melebihi manfaat yang mungkin diperoleh.
16.Uji Klinik Fitofarmaka harus memberi penjelasan kepada subyek tentang:
dihadapi, keadaan kurang menyenangkan yang mungkin timbul.
b. Kebebasan untuk tidak ikut serta dalam uji klinik fitofarmaka
c. Kebebasan untuk membatalkan persetujuannya untuk berpartisipasi.
17.Pada Uji Klinik Fitofarmaka, penguji harus memperoleh persetujuan subyek sebaiknya secara tertulis (informed consent) setelah mendapatkan penjelasan. Persetujuan tersebut sebaiknya dari subyek, orang tua subyek atau wali subyek.
B. Khusus:
1. Pemeriksaan pasien sebelum pengobatan meliputi pemeriksaan anamnestis, Klinik, laboratorium dan pemeriksaan khusus lain yang perlukan
2. Kriteria diagnostik harus dipastikan, juga stratilikasi derajat penyaklt.
3. Kriteria seleksi terdiri dari :
a. Kriteria penerimaan (inclusion criteria), kriteria pasien yang memenuhi syarat untuk penelitian harus dipastikan
b. Kriteria penolakan (exclusion criteria), Kondisi pasien yang tidak memungkinkan untuk ikut dalam penelitian.
4. Persiapan calon fitofarmaka. Bahan baku harus diketahui asal-usulnya dan diketahui mutunya. Bentuk sediaan harus memperhatikan bentuk sediaan yang digunakan oleh masyarakat.
5. Perlakuan terapi : Jenis terapi calon fitofarmaka yang diteliti , cara pemberian dosis, lama pemberian dll .
7. Randomisasi perlakuan antara terapi calon fitofarmaka yang diteliti dan pembanding. 8. Penilaian hasil terapi : Kapan dinilai, oleh
siapa, bagaimana cara penilaian dan kriteria penilaian.
9. Tehnik tersamar( blinding technique) apakah tersamar tunggal (single blind) atau tersamar ganda (double blind)
10.Pengelolaan data; pengumpulan, organisasi, pengolahannya, siapa yang melakukan, metode analisis statistika dan penyimpulan harus jelas.
11.Penulisan laporan harus mudah dipahami
IV. ORGANISASI DAN TUGAS Uji Fitofarmaka melibatkan 1. Komisi Ahli Uji Fitofarmaka. 2. Sentra Uji Fitofarmaka. 3. Pelaksana Uji Fitofarmaka
1. Komisi Ahli Uji Fitolarmaka
Komisi Ahli ini diangkat oleh Kesehatan R.l. dan bertanggung jawab kepada Menteri Tugas RI.
Tugas
a) Mengajukan saran-saran dan pertimbangan tentang rencana, pelaksanaan dan hasil uji preklinik dan uji fitofarmaka
b) Memberikan masukan tentang prioritas fitofarmaka c) Menyusun dan mengusulkan protocol uji fitofarmaka d) Menyusun dan mengusulkan ketentuan limiah dan
lain-lain yang perlu dianggap.
2. Sentra Uji Fitofarmaka
Sentra uji fitofarmaka adalah instansi Pelayanan atau penelitian kesehatan yang disetujui Menteri untuk melaksanakan dan mengkoordinasi uji fitofarmaka.
Tugas
a) megkoordinasi tugas pelaksana uji fitofarmaka
c) memberikan laporan kepada direktur Jenderal Pengawasan Obat dan Makanan , mengenai perencanaan dan hasil uji fitofarmaka
3. Pelaksanan Uji Fitofarmaka
Uji klinik Tahap Lanjut adalah suatu uji klinik dengan pembanding (randomized controlled trial).
Sesudah diketahui adanya kemungkinan efek yang dicari barulah diteruskan dengan uji klinik terkedali. Rancangan yang paling sesuai adalah rancangan paralel atau rancangan antar subyek (randomized controlled trial parallel desaign).
Subyek yang memenuhi peryaratan terbagu secara acak menjadi tiga kelompok perlakuan yang masing-masing menerima perlakuan pengobatan sebagai berikut :
a. Calon fitofarmaka. b. Kontrol negatif.