BAB II
TINJAUAN PUSTAKA
2.1. Latihan Fisik
Menurut Caspersen, (1985) di dalam Yudianto (2014) istilah " latihan fisik" dan "aktivitas fisik" sering tertukar penggunaannya. Aktiv
itas fisik diartikan pada gerakan tubuh yang dihasilkan oleh otot rangka yang mengeluarkan energi, yang pada masing-masing orang bervariasi (diukur oleh kilokalori). Latihan fisik adalah subkategori dari aktivitas fisik yang direncanakan, terstruktur, berulang, dan bermanfaat dalam arti untuk perbaikan atau pemeliharaan dari satu atau lebih komponen kebugaran fisik pada seseorang. Latihan kondisi fisik adalah proses memperkembangkan kemampuan Aktivitas gerak jasmani yang dilakukan secara sistematik dan ditingkatkan secara progressif untuk mempertahankan atau meningkatkan derajat kebugaran jasmani agar tercapai kemampuan kerja fisik yang optimal(Yudianta, 2014).
pemanasan selama 15 menit dan diakhiri oleh pendinginan selama 10 menit (Pangkahila, 2009).
Saat latihan fisik akan terjadi peningkatan konsumsi oksigen. Peningkatan ini akan mencapai maksimal saat penambahan beban kerja tidak mampu lagi meningkatkan konsumsi oksigen. Hal ini dikenal dengan konsumsi oksigen maksimum (VO2 max). Sesudah VO2 max tercapai, kerja ditingkatkan dan dipertahankan hanya dalam waktu singkat dengan metabolisme anaerob pada otot yang latihan. Secara teoritis, VO2 max dibatasi oleh cardiac output, kemampuan sistem respirasi untuk membawa oksigen darah, dan kemampuan otot yang bekerja untuk menggunakan oksigen. Faktanya, pada orang normal (kecuali atlet pada yang sangat terlatih), cardiac output adalah faktor yang menentukan VO2 max (Vander et al., 2001).
2.1.1. Respon fisiologis terhadap latihan fisik
Manfaat latihan fisik akan hilang bila latihan fisik dilakukan sampai kelelahan. Latihan fisik maksimal yang melelahkan, terutama bila dilakukan sekali-sekali, dapat menyebabkan kerusakan struktur atau reaksi inflamasi pada otot. Kerusakan ini, berhubungan dengan, paling tidak sebagian diantara kerusakan tersebut diakibatkan oleh oksidan yang dihasilkan oleh latihan fisik (Thirumalai et al., 2011).
kerusakan enzim, reseptor protein, membran lipida, dan DNA (Leeuwenburgh, et al., 2001).
Menurut Ji (2003), selama Aktivitas fisik maksimal, konsumsi oksigen seluruh tubuh meningkat sampai 20 kali, sedangkan konsumsi oksigen pada serabut otot diperkirakan meningkat 100 kali lipat, sebagian kecil dari oksigen tersebut ±2-4% akan dirubah menjadi superoksida melalui transport elektron.
Pelaku olahraga dengan intensitas tinggi (Olahraga berat), menghasilkan radikal bebas dalam jumlah besar. Bila terjadi over training maka produksi radikal bebas meningkat melebihi kemampuan antioksidan exogen. Tetapi orang yang berlatih, khususnya terlatih dalam lingkup Olahraga Kesehatan, lebih tahan terhadap stress oxidative, kecuali bila olahraga demikian berat dan lama yang memerlukan pemakaian glikogen otot yang tinggi.
Peningkatan konsumsi oksigen oleh tubuh selama berolahraga berat dapat meningkat sepuluh sampai dua puluh kali atau lebih. Dibawah stress yang tinggi, dalam serat otot terjadi peningkatan penggunaan oksigen diatas kebutuhan normal. Peningkatan oksigen yang luar biasa ini dapat memicu pelepasan radikal bebas, yang akan terlibat dalam proses oksidasi lemak membran sel otot. Proses tersebut disebut peroksidasi lipid dan menyebabkan sel menjadi lebih mudah mengalami proses penuaan atau kerusakan lain (Cooper, 2001)
Species). Oksigen yang digunakan dalam proses metabolisme tubuh saat aktivitas fisik berat, dapat menyebabkan peningkatan produksi radikal bebas yang bersifat sangat reaktif terhadap sel atau komponen sel sekitarnya (Chevion et al, 2003).
Mekanisme pembentukan oksidan selama olahraga : (1)Kebocoran elektron, Pada olahraga berat konsumsi oksigen dapat meningkat 10-20 kali istirahat atau lebih. Sedangkan serabut otot yang paling terbebani (paling aktif) dapat mengkonsumsi O2 100-200 kali normal. Pemakaian O2 yang luar biasa banyak ini memicu pembebasan oksidan dalam jaringan itu dan dapat melelahkan mitokondria yang merupakan pusat pembentukan energi; (2)Ischaemic refurfusion, Pada olahraga berat, darah yang menuju ke organ-organ yang tidak aktif misalnya hepar, ginjal, lambung dan usus, dialihkan ke otot-otot yang aktif (tungkai dan jantung). Hal ini menyebabkan terjadinya kekurangan O2 (hypoxia) secara akut pada organ-organ tersebut. Bila olahraga dihentikan, darah akan dengan cepat mengalir kembali ke organ-organ tersebut. Proses ini disebut sebagai ―reperfusion” dan hal ini dikaitkan dengan terbebaskannya oksidan dalam jumlah besar. Hal demikian juga pada otot yang terlibat dalam olahraga berat (overload) terutama bila mendekati atau mencapai tingkat exhaustion (Cooper, 2001).
dan hampir pada tingkat tiga, bahkan pada saat istirahat. Latihan akut pada subjek yang tidak terlatih dapat menyebabkan stres oksidatif. Namun secara terus menerus dalam beberapa periode menginduksi pencegahan pada kerusakan oksidatif (Leeuwenburgh, et al., 2001).
2.2. Radikal Bebas
Reaksi oksidasi terjadi setiap saat. Ketika kita bernapas pun terjadi reasksi oksidasi. Reaksi ini mencetuskan terbentuknya radikal bebas yang sangat aktif, yang dapat merusak struktur serta fungsi sel. Namun, reaktivitas radikal bebas itu dapat dihambat oleh sistem antioksidan yang melengkapi sistem kekebalan tubuh. Seringkali pengertian oksidan dan radikal bebas dianggap sama karena keduanya memiliki kemiripan sifat. Kedua jenis senyawa ini juga memiliki aktivitas yang sama dan memberikan akibat yang hampir sama, meskipun melalui proses yang berbeda. Sebagai contoh, dampak reaksi H2O2 (sebagai oksidan) dan radikal bebas hidroksil (OH•) terhadap glutation (GSH) (Winarsi, 2007).
a) H2O2 + GSH GSSG + H2O b) OH• + H2O H2O + GS•
Radikal bebas c) GS• + GS• GSSG
Dalam tubuh terdapat molekul oksigen yang stabil dan yang tidak stabil. Molekul oksigen yang stabil, sangat penting untuk memelihara kehidupan. Yang tidak stabil termasuk golongan radikal bebas. Sejumlah tertentu radikal bebas diperlukan untuk kesehatan, tetapi kelebihan radikal bebas bersifat merusak dan sangat berbahaya. Fungsi radikal bebas dalam tubuh adalah melawan radang, membunuh bakteri dan mengatur tonus otot polos dalam organ tubuh dan pembuluh darah (Araújo, et al. 2011).
Produksi radikal bebas yang terlalu banyak terjadi oleh adanya berbagai faktor misalnya: sinar ultra violet (terdapat dalam sinar matahari), kontaminan dalam makanan (zat warna textile yang dipergunakan untuk mewarnai makanan), polusi udara (pencemaran udara oleh asap pabrik dan kendaraan bermotor), asap rokok, insektisida (dalam pertanian dan rumah tangga) dan olahraga berat, serta berbagai bentuk stress psikis (Sharma, 2010).
diistilahkan sebagai senyawa oksigen reaktif/ Reactive Oxygen Species (ROS) (Winarsi, 2007).
Senyawa oksigen reaktif berasal dari oksigen (O2) pada reaksi siklus Krebs. Siklus Krebs atau disebut juga siklus asam sitrat atau TCA (Tricarboxilic Acid Cycle) terjadi didalam mitokondria sel dimana asetil KoA (asetat aktif) dioksidasi menghasilkan CO2, membebaskan ekuivalen hydrogen yang akhirnya membentuk air dan menghasilkan ATP. ATP merupakan senyawa sumber energy bebas untuk jaringan bagi manusia yang dibentuk melalui proses fosforilasi oksidatif (Mayes 1998). Reaksi yang tejadi adalah sebagai berikut:
2NADH + 2H+ + O2 2 NAD+ + H2O + ATP Pada reaksi diatas terjadi reduksi O2 menjadi H2O sbb O2 + 4H+ + 4e- H2O
Pada proses tersebut reduksi O2 menjadi H2O merupakan pengalihan 4 elektron. Bila pengalihan elektron berjalan kurang sempurna maka akan terbentuk senyawa-senyawa oksigen berbahaya. Molekul oksigen sekarang dikatakan mempunyai diradikal karena memiliki dua elektronyang tidak berpasangan tapi keduanya terletak pada orbital yang berbeda dan menunjukkan angka kuantum putaran yang sama dan memiliki putaran sejajar (Halliwel, 2001).
oksigen. Molekul oksigen akan menjadi sangat reaktif bila kedua elektron tunggal disatukan dalam satu orbital dengan putaran yang berlawanan dengan perpindahan ini satu orbital menjadi kosong dan mudah diisi oleh sepasang elekton dengan putaran yang berlawanan disebut singlet oksigen (Oenzil, 2014).
2.2.1. Struktur kimia
Dalam rangka mendapatkan stabilitas kimia, radikal bebas tidak dapat mempertahankan bentuk asli dalam waktu lama dan segera berikatan dengan bahan sekitarnya. Radikal bebas akan menyerang molekul stabil yang terdekat dan mengambil elektron, zat yang terambil elektronnya akan menjadi radikal bebas juga sehingga akan memulai suatu reaksi berantai, yang akhirnya terjadi kerusakan sel tersebut (Droge, 2002). Gambar 2.1. dibawah ini menunjukkan bagaimana bentuk dari struktur kimia penyusun radikal bebas tersebut.
Gambar 2.1. Struktur kimia radikal bebas (Sumber : Arief, 2014)
sistem biologi karena memerlukan tenaga yang tinggi dari sinar ultraviolet, panas, dan radiasi ion; (2)Kehilangan satu elektron dari molekul normal; (3)Penambahan elektron pada molekul normal. Pada radikal bebas elektron yang tidak berpasangan tidak mempengaruhi muatan elektrik dari molekulnya, dapat bermuatan positif, negatif, atau netral (Arief, 2014).
2.2.2. Sumber radikal bebas
Oksigen untuk metabolisme aerobik digunakan sekitar 95-98 %, sisanya 2-5 % akan berubah menjadi radikal bebas endogen. Sumber radikal bebas yang lain berasal dari lingkungan berupa asap rokok, bahan kimia karsinogen dan radiasi. Radikal bebas merupakan molekul yang memiliki elektron yang tidak berpasangan pada orbit luarnya sehingga bersifat tidak stabil dan reaktif. Sifat tersebut akan memudahkan radikal bebas untuk bereaksi dengan molekul lain untuk mencapai stabil (Halliwel, 2001).
Sumber radikal bebas, baik endogenus maupun eksogenus terjadi melalui sederetan mekanisme reaksi antara lain : pembentukan awal radikal bebas (inisiasi), terbentuknya radikal baru (propagasi), dan tahap terakhir (terminasi) yaitu pemusnahan atau pengubahan menjadi radikal bebas stabil dan tak reaktif. Sumber radikal bebas endogen ini sangat bervariasi, dapat melewati autoksidasi, oksidasi enzimatik, fagositosis dalam respirasi, transpor elektron di mitokondria, oksidasi ion-ion logam transisi, atau melalui iskemik (Simanjuntak, 2012).
Keberadaan radikal bebas dalam tubuh merupakan suatu hal yang fisiologis, karena tubuh akan mengimbangi dengan antioksidan endogen. Kerusakan oksidatif sel terjadi jika jumlah antioksidan yang dihasilkan tidak mampu mengimbangi jumlah radikal bebas yang ada. Perlindungan sel dari kerusakan oksidatif dapat menggunakan tambahan antioksidan dari makanan berupa vitamin E, vitamin A dan vitamin C yang larut air (Halliwel, 2001).
OH- + Fe3 +. Secara singkat, xantin oksidase selama iskemik menghasilkan superoksida dan asam urat (Simanjuntak, 2012).
2.2.3. Tipe radikal bebas dalam tubuh
Radikal bebas terpenting dalam tubuh adalah radikal derivat dari oksigen yang disebut kelompok oksigen reaktif (reactive oxygen species/ROS), termasuk didalamnya adalah triplet (3O2), tunggal (singlet/1O2), anion superoksida (O2-•),
radikal hidroksil (-OH•), nitrit oksida (NO-•), peroksinitrit (ONOO-•), asam hipoklorus (HOCl•), hidrogen peroksida (H2O2•), radikal alkoxyl (LO-•), dan radikal peroksil (LO-2•). Radikal bebas yang mengandung karbon (CCL3-) yang berasal dari oksidasi radikal molekul organik. Radikal yang mengandung hidrogen hasil dari penyerangan atom H. Bentuk lain adalah radikal yang mengandung sulfur yang diproduksi pada oksidasi glutation menghasilkan radikal thioyl (R-S-). Radikal yang mengandung nitrogen juga ditemukan, misalnya radikal fenyldiazine (Arief, 2014).
bebas dengan DNA yang memicu terbentuknya zat karsinogenik. Zat tersebut dapat mengubah bentuk susunan DNA atau mutasi DNA (Simanjuntak, 2012).
2.2.4. Pertahanan sel terhadap radikal bebas
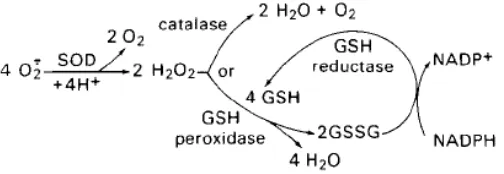
Sifat reaktif yang tersebar dari sistem pembentukan radikal dalam sel menyebabkan evolusi mekanisme pertahanan terhadap efek perusakan suatu bahan teroksidasi kuat. SOD (superoksida dismutase dan katalase) mengkatalisasi dismutasi dari superoksida dan hidrogen peroksida. GSH (glutation) peroksidase mereduksi peroksida hidrogen dan organik menjadi air dan alkohol (Arief, 2014).
GSH S-transferase melakukan pemindahan residu glutation menjadi metabolit elektrofilik reaktif dari xenobiotic. Produksi glutation teroksidasi (GSSG) direduksi secara cepat oleh reaksi yang menggunakan NADPH yang dihasilkan dari berbagai sistem intraseluler, diantaranya hexose-monophosphate shunt. Berbagai isoenzim organel spesifik dari dismutase superoksida juga ditemukan. SOD Zn, Cu merupakan sitoplasmik, sedangkan enzim Zn, Mn mitokondrial. Isoenzim ini tidak ditemukan dalam cairan ekstraseluler. Gambar 2.2. dibawah ini menunjukkan Aktivitas enzim intraseluler tersebut.
Gambar 2.2. Enzim-enzim pertahanan antioksidan (Sumber : Arief, 2014)
menginaktivasi berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal. Antioksidan juga merupakan senyawa yangn dapat menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif. Akibatnya kerusakan sel akan dihambat (Winarsi, 2007) .
Beberapa bahan tereduksi juga bekerja sebagai antioksidan, reduksi kelompok radikal aktif seperti radikal peroksi dan hidroksi menjadi bentuk yang kurang reaktif misalnya air. Seperti halnya pembangkitan kembali oksigen singlet. Penggabungan tersebut juga mengakhiri reaksi radikal berantai. Pertahanan antioksidan kimiawi bagai pedang bermata dua. Pertama, saat bahan tereduksi menjadi radikal maka derivat radikalnya juga terbentuk. Sehingga, jika suatu radikal sangat tidak stabil, reaksi radikal berantai mungkin akan berlanjut. Kedua, bahan tereduksi dapat mereduksi oksigen menjadi superoksida atau peroksida merupakan radikal hidroksil dalam reaksi auto-oksidasi. Ascorbat dan asam urat dapat berfungsi sebagai anti oksidan, ikut serta secara langsung dalam auto-oksidasi, baik melalui reduksiaktifator oksigen lain seperti rangkaian logam transisi atau quinone, atau bertindak sebagai kofaktor enzim (Inoue, 2001).
Radikal yang terbentuk tersebut cukup stabil dan dalam konsentrasi cukup tinggi namun dapat terjadi mekanisme seperti pada glutation dan superoksida. pH sangat mempengaruhi reduksi langsung oksigen menjadi superoksida oleh senyawa sulfidril, sedangkan faktor lokal lainnya seperti konsentrasi molar dari molekul oksigen juga punya peranan penting (Arief, 2014).
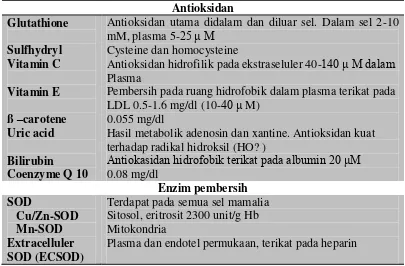
Oksigen singlet dan bagian triplet molekul yang tereksitasi mungkin disempurnakan melalui interaksi bersama sistem konjugasi sistem diene seperti yang ditemukan pada karoten, tokoferol, atau melanin. Seperti antioksidan pereduksi, senyawa tersebut dapat juga menghasilkan jenis elektron aktif dan mungkin juga penyakit (Inoue, 2001). Tabel 2.1. dibawah ini menunjukkan berbagai jenis antioksidan dan enzim pembersih dalam menangkal radikal bebas beserta lokasinya di dalam tubuh.
Tabel 2.1. Antioksidan dan enzim pembersih (scavenging)
Antioksidan
Antioksidan hidrofilik pada ekstraseluler 40-140 μ M dalam Plasma
Pembersih pada ruang hidrofobik dalam plasma terikat pada LDL 0.5-1.6 mg/dl (10-40 μ M)
0.055 mg/dl
Hasil metabolik adenosin dan xantine. Antioksidan kuat terhadap radikal hidroksil (HO? )
Catalase
Radikal bebas memiliki reaktivitas yang sangat tinggi. Hal ini ditunjukkan oleh sifatnya yang segera menarik atau menyerang elektron di sekelilingnya. Senyawa radikal bebas juga dapat mengubah suatu molekul menjadi suatu radikal baru. Jika senyawa radikal baru tersebut bertemu dengan molekul lain, akan terbentuk radikal baru lagi, dan seterusnya sehingga akan terjadi reaksi berantai (chain reactions). Reaksi ini akan berlanjut terus dan akan berhenti apabila reaktivitasnya diredam (quenched) oleh senyawa yang bersifat antioksidan seperti glutation (Winarsi, 2007).
2.3. Glutation Peroksidase (GPx)
Glutation Peroksidase (GPx) merupakan selenoenzyme yang berfungsi sebagai antioksidan. Glutation peroksidase (GPx, EC 1.11.1.9) adalah enzim yang berperan penting dalam melindungi organisme dari kerusakan oksidatif dan mengandung selenium (Se) pada sisi aktifnya. Kerja enzim ini mengubah molekul hidrogen peroksida (yang dihasilkan SOD dalam sitosol dan mitokondria) dan berbagai hidro serta lipid peroksida menjadi air (Muges et al., 2001).
glutathione peroksidase terdiri dari 4 atom selenium yang terikat sebagai selenocystein. Glutation peroksidase dapat membentuk pertahanan terhadap oksidan atau radikal bebas didalam tubuh dan mencegah kerusakan sel dengan cara mengkatalisa peroksida menjadi air dan oksigen. Karena kemampuannya inilah maka enzim ini disebut sebagai antioksida. Enzim glutathione peroksidase banyak terdapat di hepar, ginjal otot, dan plasma, terutama pada sitosol dan mitokondria. Aktivitas enzim GPx yang paling besar berada pada hepar sebesar 65,6 %, eritrosit 21,2%, dan otot sebesar 6,1% (Boylan, 2006).
GSH-Px
2GSH + H2O2 --- GSSG +2H2O
Glutation peroksidase adalah enzim intraseluler yang terdispersi dalam sitoplasma, namun aktivitasnya juga ditemukan dalam mitokondria. Glutation peroksidase ekstraseluler (secara genetik berbeda dari bentuk intraseluler) terdeteksi dalam berbagai jaringan. Glutation peroksidase sebagai ensim antioksidan bekerja sebagai peredam (quenching) radikal bebas. Glutation peroksidase juga berperan dalam metabolism xenobiotik yang ditemukan dalam kadar milimolar dalam sel (Sen, 1999).
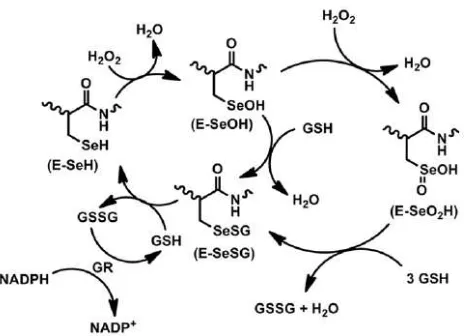
Glutation peroksidase intraseluler berpotensi mengubah molekul hidrogen peroksida dengan cara mengoksidasi glutation bentuk tereduksi mencegah lipid membran dan unsur-unsur sel lainnya dari kerusakan oksidasi, dengan cara merusak molekul hidrogen peroksida dan lipid hidroperoksida. Menurut Delmas-Beauvieaux, et al. (1996) melaporkan bahwa enzim glutation peroksidase mendekomposisikan H2O2 lebih kuat dibandingkan dengan enzim katalase. Agar enzim bisa bekerja, selalu diperlukan adanya substrat, misalnya glutation, yang merupakan substrat enzim glutation peroksidase (Winarsi, 2007).
Gambar 2.3. Mekanisme katalisis h2o2 oleh glutation peroksidase (Sumber : Bhabak, 2013)
Glutation peroksidase juga berperan dalam metabolisme xenobiotik dan sintesis leukotrien, yang ditemukan dalam kadar milimolar dalam sel. Aktivitas enzim glutation peroksidase mampu mereduksi 70% peroksida organik dan lebih dari 90% H2O2. Aktivitas enzim ini juga dapat di induksi oleh antioksidan sekunder isoflavon. Senyawa flavonoid banyak ditemukan dalam sayur-sayuran dan buah-buahan, dan dilaporkan sebagai antioksidan berpotensi lebih kuat dibandingkan dengan vitamin C dan E (Prior, 2003).
menekan kerusakan sel yang berlebihan dan mempertahankan status antioksidan seluler (Winarsi, 2007).
Senyawa-senyawa polifenol seperti flavonoid dan antosianin mampu menghambat reaksi oksidasi melalui mekanisme radical scavenging dengan cara menyumbangkan satu elektron pada elektron yang tidak berpasangan dalam radikal bebas sehingga banyaknya radikal bebas menjadi berkurang (Polcomy et al., 2001). Selain sebagai scavenger, senyawa flavonoid dengan kandungan anthosianin dalam tumbuhan Ipomoea batatas diduga berfungsi sebagai antioksidan dengan cara menghambat langkah propagasi, yaitu memutus rantai autoksidasi atau disebut juga Chain-breaking antioxidants (Rachmani, 2009).
2.4. Ubi Jalar
Ubi jalar dikenal hampir di seluruh wilayah Indonesia. Ubi jalar memiliki nama daerah ubi jawa (Sumatera Barat), gadong jalur (Batak), ketela (Jakarta), ketela rambat (Jawa), katila (Dayak), watata (Sulawesi Utara). Ubi jalar (Ipomoea batatas) merupakan tanaman yang dipercaya berasal dari Benua Amerika dan telah tersebar hampir di seluruh dunia. Di Asia, negara produsen ubi jalar terbesar adalah Cina. Umbi dari tanaman ubi jalar merupakan salah satu dari sumber karbohidrat terpenting di dunia terutama Asia dan Afrika (SEAFAST, 2012).
jalar tidak hanya diarahkan pada hasil tinggi, tetapi juga mengedepankan kualitas gizi, di antaranya protein dan betakaroten (Truong, 2010).
Ubi jalar merupakan bahan pangan lokal sumber karbohidrat, berdasarkan warna umbinya dapat dibedakan menjadi 3 jenis, yaitu ubi jalar putih, kuning, merah/jingga hingga ungu (Budiman, 2014). Berdasarkan warna umbi, ubi jalar dibedakan menjadi beberapa golongan sebagai berikut :
1. Ubi jalar putih, yakni ubi jalar yang memilki daging umbi berwarna putih, misalnya, varietas tembakur putih, varietas tembakar ungu, varietas Taiwan dan varietas MLG 12659-20P.
2. Ubi jalar kuning, yaitu jenis ubi jalar yang memilki daging umbi berwarna kuning, kuning muda atau putih kekuningan. Misalnya, varietas lapis 34, varietas South Queen 27, varietas Kawagoya, varietas Cicah 16 dan varietas Tis 5125-27.
3. Ubi jalar oranye yaitu jenis ubi jalar yang memiliki daging umbi berwarna jingga hingga jingga muda. Misalnya, varietas Ciceh 32, varietas mendut dan varietas Tis 3290-3.
4. Ubi jalar ungu yakni ubi jalar yang memiliki daging umbi berwarna ungu hingga ungu muda (Juanda, et al. 2000)
kering bervariasi dari 16 hingga 40% dibanding ubi jalar segar. Sukrosa umumnya terdapat pada umbi dalam bentuk segar. Kadar maltosa pada ubi jalar meningkat saat ditanak, karena aktivitas enzim beta-Amilase (Takagi et al., 1996).
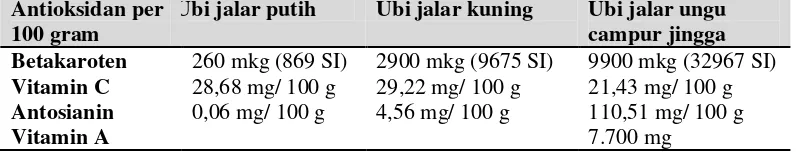
Berdasarkan penelitian Marsono dkk (2002), ubi jalar sebagai sumber karbohidrat memiliki indeks glikemik 54. Nilai indeks glikemik (IG) < 55 termasuk kelompok yang rendah, IG 55-70 sedang, dan >70 tinggi, jadi IG ubi jalar termasuk rendah. Tepung ubi jalar mengandung serat makanan yang relatif tinggi disertai dengan indeks glikemik yang rendah, artinya, tepung ubi jalar atau makanan berbasis tepung ubi jalar lebih lamban dicerna dan lamban meningkatkan kadar gula darah (SEAFAST, 2012). Pada tabel 2.2. terlihat jelas perbedaan kadar antosianin pada ketigas jenis ubi, terlihat jelas bahwa ubi jalar ungu lah yang memiliki kadar antosianin tertinggi.
Tabel 2.2. Ubi jalar juga mengandung berbagai antioksidan : Antioksidan per
100 gram
Ubi jalar putih Ubi jalar kuning Ubi jalar ungu campur jingga Betakaroten 260 mkg (869 SI) 2900 mkg (9675 SI) 9900 mkg (32967 SI) Vitamin C 28,68 mg/ 100 g 29,22 mg/ 100 g 21,43 mg/ 100 g Antosianin 0,06 mg/ 100 g 4,56 mg/ 100 g 110,51 mg/ 100 g
Vitamin A 7.700 mg
Antosianin berperan dalam mencegah terjadinya penuaan, kemerosotan daya ingat dan kepikunan, polyp, asam urat, penderita sakit maag (asam lambung), penyakit jantung koroner, penyakit kanker dan penyakit-penyakit degeneratif, seperti arteosklerosis. Selain itu, antosianin juga memiliki kemampuan sebagai antimutagenik dan antikarsinogenik terhadap mutagen dan karsinogen yang terdapat pada bahan pangan dan olahannya, mencegah gangguan pada fungsi hepar, antihipertensi dan menurunkan kadar gula darah (antihiperglisemik) (Singh, 2008).
2.4.1. Ubi Jalar Ungu
Klasifikasi Ilmiah
Kerajaan : Plantae
Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Solanales Famili :Convolvulaceae Genus : Ipomoea
Spesies : I. batatas
Nama binomial: Ipomoea batatas L.
Gambar 2.4. Ubi jalar ungu (http://id.wikipedia.org/wiki/Ubi_jalar)
Selain betakaroten, warna jingga pada ubi jalar memberi isyarat akan tingginya kandungan senyawa Lutein dan Zeaxantin, pasangan anti-oksidan karotenoid. Keduanya termasuk pigmen warna sejenis klorofil, merupakan pembentuk vitamin A. Lutein dan Zeaxantin merupakan senyawa aktif yang memiliki peran penting menghalangi proses perusakan sel (Budiman, 2014).
Berbagai penelitian membuktikan bahwa beberapa flavonoids yang terdapat dalam ubi jalar ungu memiliki khasiat antioksidan, karena mikronutrien yang merupakan gugus fitokimia dari berbagai bahan makanan yang berasal dari tumbuh-tumbuhan tersebut diyakini sebagai proteksi terhadap stres oksidatif. Salah satu jenis flavonoid dari tumbuh-tumbuhan yang dapat berfungsi sebagai antioksidan adalah zat warna alami yang disebut antosianin (Oki, 2008).
210,00mg/100g bahan. Besar kandungan antosianin dalam ubi jalar tergantung pada intensitas warna ungu pada ubi ungu, makin ungu warna ubi maka kandungan antosianin makin tinggi. Konsumsi antosianin yang diperbolehkan per hari menurut ADI (Acceptable Daily Intake) sebesar 0 – 0,25mg/kg berat badan, apabila konsumsinya berlebihan akan menyebabkan keracunan (Liptan, 2008).
Bentuk antosianidin yang banyak dikandung oleh ubi jalar ungu adalah bentuk sianidin dan peonidin. Sekitar 80% dari total antosianin tersebut berada dalam bentuk terasilasi. Antosianin yang terasilasi relatif lebih stabil jika dibandingkan dengan antosianin yang tidak terasilasi. Oleh karena itu, antosianin dari ubi jalar ungu berpotensi besar sebagai pewarna alami. Seperti antosianin pada umumnya, antosianin pada ubi jalar ungu juga dipengaruhi dipengaruhi oleh tingkat keasaman lingkungan. Pada lingkungan dengan pH rendah, warna yang diekspresikan lebih merah dan lebih stabil selama penyimpanan (SEAFAST, 2012).
2.5. Antosianin
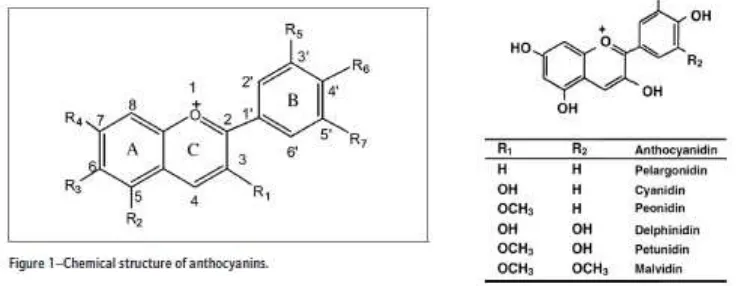
Antosianin disusun dari sebuah aglikon (antosianidin) yang teresterefikasi dengan satu atau lebih gugus gula (glikon). Kebanyakan antosianin ditemukan dalam enam bentuk antosianidin, yaitu pelargonidin, sianidin, peonidin, delfinidin, petunidin, dan malvidin. Gugus gula pada antosianin bervariasi, namun kebanyakan dalam bentuk glukosa, ramnosa, galaktosa, atau arabinosa. Gusus gula ini bias dalam bentuk mono atau disakarida dan dapat diasilasi dengan asam fenolat atau asam alifatis. Terdapat sekitar 539 jenis antosianin yang telah diekstrak dari tanaman (Pojer, 2013). Struktur antosianin yang paling sering dijumpai di alam dan klasifikasinya dapat dilihat pada gambar 2.5. dibawah ini.
Gambar 2.5. Struktur antosianin dan klasifikasinya (Sumber : Pojer. 2013)
jumlah, dan lokasi gula yang melekat pada molekul ; dan (4) sifat dan jumlah asam alifatik atau aromatik yang melekat pada gula (Pojer. 2013).
Rodrigues-Saona dan Wrolstad (2001), Antosianin memiliki stabilitas yang rendah. Stabilitas antosianin sangat dipengaruhi oleh konsentrasi antosianin, pH, suhu, keberadaan enzim, oksigen dan cahaya, serta keberadaan enzim, oksigen dan cahaya, serta keberadaan senyawa lain seperti asam askorbat,pigmen, protein, logam dan gula. Untuk mencegah terjadinya degradasi, perlu penambahan asam pada pelarut yang digunakan (SEAFAST, 2012).
Antosianin merupakan senyawa berwarna yang bertanggung jawab untuk kebanyakan warna merah, biru, dan ungu pada buah, sayur, dan tanaman hias.Senyawa ini termasuk dalam golongan flavonoid. Struktur utamanya ditandai dengan adanya dua cincinaromatik benzene (C6H6) yang dihubungkandengan tiga atom karbon yang membentuk cincin (Jasabi, et al, 2013). Jenis pelarut antosianin secara nyata mempengaruhi warna yang diekspresikannya. Sifat antosianin yang hidrofilik menyebabkannya sering diekstrak dengan menggunakan pelarut alcohol atau air. Pelarut alcohol menghasilkan warna antosianin yang lebih biru dibandingkan dengan pelarut air (Philpott, et al., 2004).
Ekstrak antosianin dengan menggunakan pelarut kimia pada kenyataannya menghasilkan antosianin yang tidak murni. Seringkali amilosa dan protein yang berasal dari ubi ikut larut bersama pelarut selama proses ekstraksi antosianin. Ekstrak antosianin yang lebih murni bisa didapatkan dengan melakukan fermentasi terhadap ubi ungu. Fermentasi dilakukan dengan bantuan kultur
dilumatkan didalam larutan asam sitrat dengan perbandingan 1:1. Campuran diinokulasi dengan starter dan diinkubasi pada temperature 28 oCselama 72 jam. Hasil fermentasi kemudian disentrifus untuk mendapatkan ekstrak antosiani. Ekstrak dapat dipekatkan dengan menggunakan evaporator (SEAFAST, 2012).
Fan et al. (2008) membandingkan ekstrak antosianin yang didapat dari hasil fermentasi dan ekstraksi secara kimia dengan menggunakn pelarut. Hasil ekstrak antosianin dengan metode fermentasi memang memiliki intensitas warna yang lebih renda jika dibandingkan dengan metode ekstraksi kimia, namun tingkat kestabilan antosianinya relative lebih tinggi. Tingkat kemurnian antosianin dari ekstraksi fermentasi juga lebih tinggi jika dibandingkan dengan ekstraksi secara kimia.
2.6. Hati/ Hepar
Hepar adalah organ terbesar dalam tubuh, berat hepar pada orang dewasa normal lebih dari 1 kg. Fungsi hepar dapat dibagi menjadi dua kategori umum.
Mayoritas metabolit buangan dan zat hasil detoksifikasi disekresi dari tubuh, di empedu, dari saluran gastrointestinal, atau melalui sekresi dari hepar ke dalam aliran darah untuk kemudian diekskresi oleh ginjal (Praphatsorn, et al,.
2010).
2.6.1. Anatomi dan Fisiologi Hepar
Hepar terdiri dari empat lobus, setiap lobus terdiri dari berpuluh-puluh ribu lobulus heksagonal berdiameter 1-2 mm yang merupakan unit fungsional hepar. Setiap lobulus terdiri dari vena hepatika. Vena sentralis ini dikelilingi oleh kolom-kolom tunggal sel-sel hepar (hepatosit) yang mengarah ke luar; di antara hepatosit-hepatosit ini terdapat kanalikuli kecil yang awalnya adalah struktur buntu pada ujung dekat vena sentralis, tetapi mengalir ke duktus biliaris pada bagian perifer lobul. Pada keenam sudut lobulus terdapat ‘triad porta’ yang terdiri
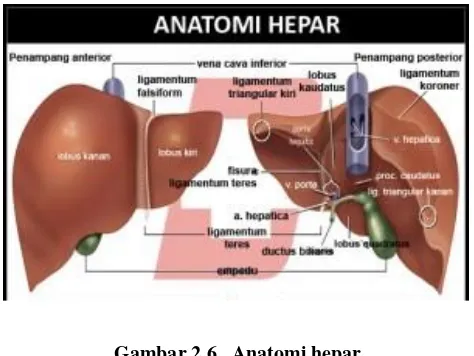
dari cabang-cabang arteri hepatika, vena porta, dan duktus biliaris. Duktus biliaris pada akhirnya mengalir ke duktus biliaris terminalis (Ward et al. 2007). Bagaimana bentuk anatomi hepar di dalam tubuh manusia dapat dilihat pada gambar 2.4.
Gambar 2.6. Anatomi hepar
Batas atas hepar berada sejajar dengan ruangan interkostal V kanan dan batas bawah menyerong ke atas dari iga IX kanan ke iga VIII kiri. Permukaan posterior hepar berbentuk cekung dan terdapat celah transversal sepanjang 5 cm dari sistem porta hepatis. Omentum minor terdapat mulai dari sistem porta yang mengandung arteri hepatica, vena porta dan duktus koledokus. Sistem porta terletak di depan vena kava dan dibalik kandung empedu. Permukaan anterior yang cembung dibagi menjadi 2 lobus oleh adanya perlekatan ligamentum falsiform yaitu lobus kiri dan lobus kanan yang berukuran kira-kira 2 kali lobus kiri. Hepar terbagi 8 segmen dengan fungsi yang berbeda. Pada dasarnya, garis cantlie yang terdapat mulai dari vena cava sampai kandung empedu telah membagi hepar menjadi 2 lobus fungsional, dan dengan adanya daerah dengan vaskularisasi relatif sedikit, kadang-kadang dijadikan batas reseksi. Secara mikroskopis didalam hepar manusia terdapat 50.000-100.000 lobuli, setiap lobulus berbentuk heksagonal yang terdiri atas sel hepar berbentuk kubus yang tersusun radial mengelilingi vena sentralis (Barrets et al, 2010).
detoksifikasi dengan 2 mekanisme, disebut fase I dan fase II. Pada fase I, enzim-enzim dalam tubuh menggerakkan zat-zat racun agar lebih mudah diproses di fase II. Di fase II ini ada lagi enzym-enzym lain yang mengubah racun-racun menjadi bentuk yang lebih mudah larut oleh air. Tubuh kemudian akan membuangnya lewat urine atau feses (BPOM, 2004).
Sementara hati yang tidak sehat tidak bisa melakukan detoksifikasi secepat yang dilakukan oleh hati yang sehat, maka bila proses detoksifikasi lebih lambat dan hati yang belum selesai bekerja men-detoksifikasi itu sudah diberi serangan racun-racun yang harus didetoksifikasi, akibatnya akan lebih banyak racun yang beredar ke seluruh tubuh lewat darah (BPOM, 2004).
Sebagian racun yang tidak dapat diubah atau hanya sedikit berubah akan sulit dibuang dari tubuh karena lolos dari kerja hati. Akhirnya racun-racun itu bersembunyi di jaringan tubuh berlemak, di otak, dan sel sistem saraf. Racun-racun yang tersimpan itu pelan-pelan akan ikut aliran darah dan menyumbang penyakit-penyakit kronis. Misalnya, sakit liver yang bisa berujung pada hepatitis, dan semakin kronis menjadi sirosis (BPOM, 2004).
berkepanjangan; (4) Warna urine sangat gelap atau feses berwarna pucat; (5) Kelelahan kronis, mual atau kehilangan nafsu makan. (Barrets et al, 2010).
Unit fungsional dasar hati adalah lobulus hati, yang berbentuk silindris dengan panjang beberapa milimeter dan berdiameter 0,8 sampai 2 milimeter. Hati manusia berisi 50.000 sampai 100.000 lobulus. Lobulus hati terbentuk megelilingi sebuah vena sentralis yang mengalir ke vena hepatika kemudian ke vena cava. Lobulus sendiri dibentuk terutama dari banyak lempeng sel hepar yang memancar secara sentrifugal dari vena sentralis seperti jeruji roda. Masing-masing lempeng hepar tebalnya satu sampai dua sel, dan di antara sel yang berdekatan terdapat kanalikuli biliaris kecil yang megalir ke duktus biliaris di dalam septum fibrosa yang memisahkan lobulus hati yang berdekatan (Guyton dan Hall, 2006).
2.6.2. Mikroskopis Kerusakan Hepar
Tipe kerusakan organ hepar tergantung pada tipe agen toksikannya, berat intoksikasi, dan lama menderita baik akut maupun kronis. Suatu proses degeneratif yang mengarah pada kematian sel disebut nekrosis (Hodgson dan Levi, 2000).
dan nukleusnya. Peristiwa biokimiawi yang mungkin menyebabkan kerusakan hepar adalah ikatan antara metabolit reaktif dan protein juga lemak tak jenuh (menginduksi peroksidasi lemak dan selanjutnya pengrusakan membran), gangguan keseimbangan homeostasis Ca2+ seluler, gangguan pada jalur metabolik, perubahan keseimbangan Na+ dan K+, dan hambatan pada sintesa protein. Karena hepar memiliki kemampuan untuk beregenerasi, lesi nekrotik bukan merupakan suatu keadaan yang genting. Tetapi nekrotik hepar yang luas bisa membawa pada kerusakan bahkan kegagalan hepar (Hodgson dan Levi, 2000).
Pada jejas ringan, hepar dapat segera beregenerasi kembali pada fungsinya semula. Namun, kapasitas cadangan hepar dapat habis apabila hepar terkena penyakit yang menyerang seluruh parenkim hepar sehingga timbul kerusakan pada hepar (Robbin et al., 2004).
2.6.3. Metabolisme Antioksidan dalam Hepar
Hepar menerima semua hasil absorbi usus lewat pembuluh darah balik (vena) dari usus yang akhirnya terkumpul dalam satu vena besar yang disebut vena porta. Vena porta berisi banyak nutrien dan xenobiotik yang berasal dari usus. Selain darah dari usus, hati juga menerima darah balik dari ginjal dan tungkai bawah. Karena tugas detoksikasi oleh hati, maka apabila terjadi metabolit yang toksik dan reaktif hati yang pertama menerima efek toksiknya (soemirat, 2003).
dan ginjal jika dibandingkan dengan organ lainnya. Hal ini berhubungan dengan fungsi kedua liver dan ginjal dalam mengeliminasi toksikan dalam tubuh. Ginjal dan liver mempunyai kemampuan untuk mengeluarkan toksikan, akan tetapi organ liver memiliki kapasitasnya yang lebih tinggi dalam proses biotransformasi toksikan. Liver berperan menghilangkan bahan toksik dari darah setelah di absorpsi pada saluran pencernaan, sehingga dapat dicegah distribusi bahan toksik tersebut ke bagian lain dari tubuh yang akan menyebabkan terbentuknya radikal. (Mukono, 2005)
Terbentuknya radikal didalam hati menyebabkan peroksidasi lemak dalam membran di dalam sel. Mitokondria terserang dan melepaskan ribosom dari retikulum endoplasmik sehingga pemasokan energi yang diperlukan untuk memelihara fungsi dan struktur retikulum endoplasmik terhenti, sintesis protein menjadi menurun, sel kehilangan daya untuk mengeluarkan trigliserida dan terjadi apa yang disebut degenerasi berlemak sel hati. Bila bagian yang sangat luas dari hati telah rusak maka hati akan kehilangan fungsinya (Musthofiyah, H. 2008).
2.7. Kerangka Konsep
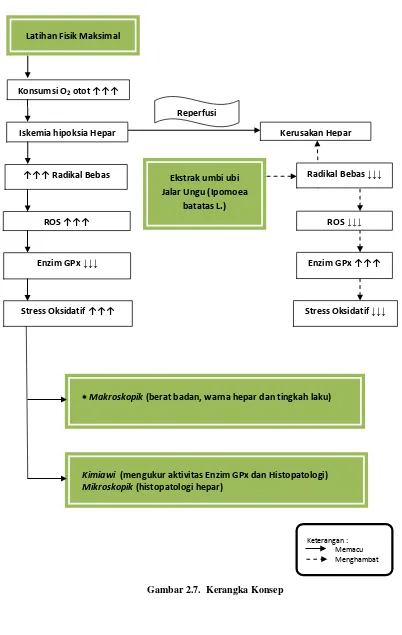
Gambar 2.7. Kerangka Konsep
Keterangan : Memacu Menghambat Latihan Fisik Maksimal
Makroskopik (berat badan, warna hepar dan tingkah laku)
Stress Oksidatif ↑↑↑
Konsumsi O2 otot ↑↑↑
Enzim GPx ↓↓↓
Ekstrak umbi ubi Jalar Ungu (Ipomoea
batatas L.)
Kimiawi (mengukur aktivitas Enzim GPx dan Histopatologi) Mikroskopik (histopatologi hepar)
↑↑↑ Radikal Bebas
Iskemia hipoksia Hepar Kerusakan Hepar
ROS ↑↑↑
Reperfusi
Radikal Bebas ↓↓↓
ROS ↓↓↓
Enzim GPx ↑↑↑