PRAKTIKUM AKTIVITAS ENZIM DALAM BEBERAPA SAYURAN DAN
BUAH-BAUHAN
FAKULTAS TEKNOLOGI INDUSTRI PERTANIAN
UNIVERSITAS PADJADJARAN
HENDI KUSWENDI (240210160049)
Departemen Teknologi Industri Pangan Universitas Padjadjaran, Jatinangor Jalan Raya Bandung-Sumedang Km. 21, Jatinangor, Sumedang 40600 Telp. (022)
7798844, 779570 Fax. (022) 7795780 Email: [email protected]
ABSTRACT
Humans need protein for growth, repair damaged body cells, plasma gland, hormone, and enzyme ingredients, energy reserves in case of deficiency, and maintain the balance of acid-base blood. Proteins are a source of amino acids that contain elements C, H, O and N that are not owned by fat or carbohydrates. In this experiment biuret test was used, ninhydrin test of coagulation properties of isoelectric point test protein and salting out test in protein test in sample. The biuret test showed that positive albumin and urea had peptide bonds. The ninhydrin test on albumin samples shows that positive albumin contains free amino acids, whereas urea does not have free amino acids. Precipitation of acids and alkalis occurs in proteins that are added strong acids and strong bases. Proteins which are supplemented with heavy metal salts will precipitate with the heavy metals present in the salt. Denaturation and coagulation of protein (albumin) occurred in albumin given the addition of acetate buffer with pH 4, pH 4.5 and pH 4.98. The isoelectric point is marked by decreased protein solubility and the formation of precipitate. The isoelectric point of albumin occurs at pH 4.55-4.90. Salting out occurs in protein (albumin) which is given the addition of neutral salt. It is characterized by the formation of white protein precipitate which can give positive results if done biuret test.
Keywords:
albumin,
protein, amino acids, biuret test, ninhydrin testPENDAHULUAN
Manusia membutuhkan protein untuk pertumbuhan, memperbaiki sel tubuh yang rusak, bahan pembentuk plasma kelenjar, hormon, dan enzim, cadangan energi jika terjadi kekurangan, dan menjaga keseimbangan asam basa darah (Sandjaja, 2010). Protein merupakan suatu zat makanan yang amat penting bagi tubuh, karena zat gizi ini disamping sebagai bahan bakar dalam tubuh juga berfungsi sebagai zat pembangun dan pengatur. (Winarno, 1992).
Protein merupakan sumber asam amino yang mengandung unsur-unsur C,
H, O dan N yang tidak dimiliki oleh lemak maupun karbohidrat.
Mahluk hidup mempunyai kemampuan yang tidak sama dalam membentuk Asam amino. Asam amino yang umum terdapat dalam alam akan disintesis oleh sekelompok enzim yang berbeda satu sama lain dan melalui jalur yang berbeda pula (Martoharsono, 2006).
Selain berbentuk asam amino, protein didalam tubuh juga dapat berupa zat antibodi, enzim, dan hormon yang berfungsi mengangkut zat gizi, oksigen dan hasil metabolit ke seluruh tubuh atau ke organ-organ tubuh tertentu. Antibodi atau immunoglobin dapat mengenali dan menghancurkan zat asing. Enzim berperan terhadap proses kimiawi dalam sel. Enzim mengontrol kecepatan dan kelangsungan reaksi dalam sel.
Hormon adalah pembawa pesan yang disekresikan untuk respons keadaan tubuh yang menyimpang. Di samping itu, protein dalam keadaan tertentu menjadi sumber energi, di mana tiap gram protein menghasilkan energi 4 kalori (Sandjaja, 2010).
METODOLOGI Bahan
Bahan yang digunakan antaralain: akuades, urea albumin 2% CuSO4 1% buffer asetat pH 5 ninhidrin H2SO4 1 N, KOH 0,5 N, NaOH 4 N, asam asetat glasial, HCl pekat PbAc, CuSO4, FeCl3, HgCl2, dan ZnAc buffer asetat pH 4, pH 5 dan pH 6 kasein NaOH, NaCl, MgSO4, Na2SO4
Alat
Alat yang digunakan antaralain: bulb pipet, penjepit kayu, tabung reaksi, penangas air, pipet volume, pipet tetes, neraca analitik, ruang asam, botol semprot, spons.
Metode Uji Biuret
Terdapat 3 perlakuan pada uji biuret kali ini, yaitu dengan penambahan 1 ml albumin 2%, penambahan urea, dan
penambahan urea yang dipanaskan terlebih dahulu. Masing-masing perlakuan dimasukan dalam tabung reaksi. Kemudian ditambahkan 1 ml NaOH 10% dan diaduk sampai homogen. Ditambahkan pula CuSO4 1% hingga warna menjadi merah ungu. Maksimal penambahan CuSO4 1% yaitu 10 tetes, kemudian diamati perubahan yang terjadi.
Uji Ninhidrin
Terdapat 2 perlakuan pada uji biuret kali ini, yaitu dengan penambahan albumin 1% dan urea yang dipanaskan. Masing-masing perlakuan dimasukan dalam tabung reaksi, kemudian ditambahkan 1 ml buffer asetat pH 5, dan 20 tetes ninhidrin, kemudian dipanaskan dan diamati perubahan warna yang terjadi.
Uji Sifat Koagulasi Protein
Pembentukan endapan dengan asam dan alkali
Mula-mula ditambahkan 1 ml sampel albumin dan gelatin dalam tabung reaksi, kemudian ditambahkan tetes demi tetes koagulan (H2SO4 1 N, KOH 0,5 N, NaOH 4 N, asam asetat glasial, dan HCl pekat) dan diamati perubahannya. Selanjutnya, sampel diamkan selama 90 menit dan diamati, kemudian dikocok dan dipanaskan, dan kembali diamati perubahan yang terjadi. Pembentukan endapan dengan garam
dan logam berat
Mula-mula ditambahkan 1 ml sampel albumin dan gelatin dalam tabung reaksi, kemudian ditambahkan tetes demi tetes larutan logam (PbAc, CuSO4, FeCl3, HgCl2, dan ZnAc) kemudian diamati perubahan yang terjadi.
Denaturasi dan Koagulasi
Uji Titik Isoelektrik
Ditambahkan larutan asam seperti pada tabel diktat praktikum kimia pangan halaman 32, ditambahkan akuades seperti pada tabel dihalaman 32, dan terakhir di tambahkan 1 M larutan kasein dalam Na-asetat, kemudian dikocok dan diamati selama 10 – 20 menit.
Uji Salting Out
Mula-mula ditambahkan 1 ml sampel albumin dan gelatin, dipanaskan pada suhu 40
℃
, kemudian ditambahkan amonium sulfat sampai titik jenuh, diaduk dan disaring sampai menjadi filtrat. Kemudian ditambahkan padatan (NaOH, NaCl, MgSO4, Na2SO4) dan ditambahkan pereaksi buret kemudian diamati perubahan yang terjadi.HASIL DAN PEMBAHASAN
Praktikum kali ini membahas uji kualitataif terhadap protein. Uji kualitatif protein yang dilakukan da yaitu uji biuret, uji ninhidrin, pengujian mengenai pembentukan asam dan alkali, pembentukan garam dan logam berat, denaturasi dan koagulasi protein, titik isoelektrik protein, serta salting out. Jenis protein yang digunakan untuk pengujian diantaranya yaitu albumin 2%, urea, kasein, dan gelatin.
Uji Biuret
Tabel 1. Data Hasil Pengamatan Uji Biuret
Kel Sampel Perubahan Warna +/ -1,
2, urea tidak dipanaska n
ungu muda
bening
+
6 Albumin Adanya
warna ungu bening di atas larutan
+
5, 9, 10
Urea dipanaska n
Ungu muda
bening
+
Sumber: Dokumentasi pribadi, 2017 Biuret adalah senyawa dengan dua ikatan peptida yang terbentuk pada
pemanasan dua molekul urea. Suatu enzim akan dapat menyatukan kedua asam amino melalui reaksi dehidrasi ketika dua asam amino berdekatan dengan gugus amino dari asam amino lain. Uji biuret merupakan suatu pengujian untuk mengetahui adanya ikatan peptida dari suatu sampel. Adanya ikatan peptida mengindikasikan adanya protein. Suatu polimer asam amino tersusu atas ikatan-ikatan peptida. Peptida adalah jenis ikatan kovalen yang menghubungkan suatu gugus karboksil satu asam amino dengan gugus amino asam amino lainnya sehingga terbentuk ikatan yang terbentuk ketika atom karbon dari gugus karboksil suatu molekul berikatan dengan atom nitrogen dari gugus amina molekul lain. (Toha, 2001). ditambahkan dan diaduk sampai homogen.
Uji biuret dilakukan dengan menambahkan 1 ml NaOH 10% dan ke dalam sampel yaitu albumin dan urea, lalu ditambahkan CuSO4 1%. Terdapat 3 perlakuan pada uji biuret kali ini, yaitu dengan penambahan 1 ml albumin 2%, penambahan urea, dan penambahan urea yang dipanaskan terlebih dahulu. Penambahan larutan NaOH pada larutan protein tersebut yaitu sebagai katalis yang berfungsi untuk menghancurkan atau memecahkan molekul-molekul protein.
Berdasarkan hasil uji biuret, pada tiap sampel mengalami perubahan warna. Sampel yang positif mengandung ikatan peptida akan mengalami perubahan warna menjadi warna ungu. Pada uji biuret ini ion Cu2+ akan membentuk ikatan kompleks berwarna ungu dengan peptida pada kondisi alkali (Maligan, 2014).
Prinsip dari reaksi biuret adalah
Protein + Cu2+ Komplex Cu-NaOHalbumin mengalami perubahan warna menjadi warna ungu dan tampak bening. Hal ini karena reaksi biuret bersifat positif terhadap dua buah ikatan peptida atau lebih seperti yang terdapat pada albumin yang merupakan salah satu protein globuler atau protein yang berbentuk bulat (Winarno, 1997). Akan tetapi, intensitas warna ungu pada sampel urea tidak sebanyak pada sampel albumin. Hal ini menunjukkan bahwa ikatan peptida pada albumin lebih banyak dibandingkan dengan ikatan peptida pada urea. Urea bukan merupakan protein, namun karena urea mengandung gugus –NH2 (amin) yang mempunyai kesamaan dengan gugus protein sehingga membentuk warna ungu sebagai hasil reaksi antara Cu2+ dengan –NH. Oleh karena itu urea memberikan hasil positif pada uji biuret.
Ninhidrin atau triketohidrien hidrat adalah suatu senyawa oksidator kuat yang bereaksi dengan asam amino pada pH 4-8 dan dihasilkan senyawa berwarna ungu. Ninhidrin biasa digunakan untuk pengujian protein. Ninhidrin dapat digunakan untuk penentuan kadar asam amino baik secara kualitatif maupun kuantitatif (Maligan, 2014). Uji ninhidrin dilakukan dengan menyiapkan sampel dalam tabung reaksi kemudian sampel tersebut ditambahkan dengan larutan buffer asetat pH 5 yang fungsinya adalah untuk menjaga reaksi dalam suasana asam. Terdapat 2 perlakuan pada uji biuret kali ini, yaitu dengan penambahan albumin 1% dan urea yang dipanaskan. Masing-masing perlakuan dimasukan dalam tabung reaksi, kemudian ditambahkan 1 ml buffer asetat pH 5, dan 20 tetes ninhidrin, kemudian dipanaskan dan diamati perubahan warna yang terjadi.
Reaksi ninhidrin sering digunakan untuk menghitung asam amino bebas. Suatu asam amino jika direaksikan dengan ninhidrin dalam jumlah berlebih, maka untuk setiap mol asam amino yang bereaksi dengan ninhidrin, akan terbentuk 1 mol ammonia, 1 mol aldehid, 1 mol CO2, dan 1 mol hidrindantin. Amonia yg dibebaskan
akan bereaksi dengan 1 mol ninhidrin
Gambar 1. Reaksi pada Uji Ninhidrin (Fennema, 1996) sampel urea warnanya bening dan hanya sedikit berwarna ungu muda. Semakin pekat warna hasil reaksi, semakin tinggi kandungan asam amino dalam sampel. Oleh karena itu, dari hasil uji ninhidrin yang dilakukan dapat disimpulkan bahwa albumin menunjukkan hasil positif mengandug asam amino bebas sedangkan urea menunjukkan hasil negatif (tidak mengandung asam amino bebas).
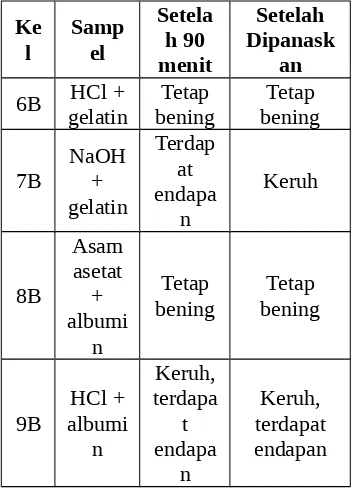
10 B
NaOH + albumi
n
Tetap bening
Tetap bening Sumber: Dokumentasi pribadi, 2014
Pengujian sifat koagulasi protein yaitu pembentukan endapan asam dan alkali, sampel berupa albumin dan gelatin ditambahkan asam dan basa yaitu H2SO4 1 N, KOH 0,5 N, NaOH 4 N, asam asetat glasial, dan HCl pekat. Setelah itu, sampel yang telah ditambahkan asam dan basa tersebut didiamkan selama 90 menit lalu dikocok dan dipanaskan. Masing-masing sampel diamati perubahan yang terjadi setelah didiamkan selama 90 menit dan setelah dilakukan pemanasan.
Berdasarkan hasil pengujian terhadap sampel gelatin dan albumin, dapat diketahui bahwa pada beberapa perlakuan penambahan asam dan basa terjadi kekeruhan dan endapan setelah didiamkan selama 90 menit dan setelah dipanaskan. Sampel yang terdapat eendapan putih yaitu albumin + KOH,
Albumin + NaOH 4 N, Albumin 1 ml
+ HCl pekat, sedangkan pada
penambahan CH3COOH atau asam asetat tidak terjadi perubahan pada sampel. Hal ini dikarenakan CH3COOH atau asam asetat merupakan asam lemah. Menurut Lehninger (1990), jika protein dipanaskan dengan asam atau basa kuat, asam amino unit pembangunnya dibebaskan dari ikatan kovalen yang menghubungkan molekul-molekul ini menjadi rantai. Oleh karena itu, dapat dikatakan bahwa penambahan asam kuat dan basa kuat menyebabkan terjadinya hidrolisis protein menjadi asam amino.Gambar 1. Hidrolisis Protein menjadi Asam Amino
(Toha, 2001)
Sifat koagulasi protein selanjutnya yang diuji yaitu mengenai pembentukan endapan garam dan logam berat. Pada pengujian ini, sampel yang digunakan adalah gelatin dan albumin 1% sebanyak 1 ml. Masing-masing sampel ini ditambahkan dengan garam yang mengandung logam berat diantaranya yaitu PbAc, CuSO4, FeCl3, HgCl2, dan ZnAc. Garam-garam tersebut ditambahkan sedikit demi sedikit sampai terjadi perubahan pada sampel.
Berdasarkan hasil pengujian yang dilakukan, diperoleh hasil bahwa penambahan garam dan logam berat menimbulkan beberapa perubahan pada beberapa sampel dan perlakuan. Perubahan tersebut diantaranya berupa timbulnya endapan dan gelembung pada bagian atas sampel.
Berdasarkan data hasil pengamatan menunjukan sampel Albumin + PbAc, albumin + CuSO4, Albumin + ZnAc , dan Gelatin 1ml+ PbAc yang menimbulkan endapan, sisa sampel tidak menunjukan adanya endapan yang terbentuk.
Endapan yang terbentuk pada sampel gelatin, akibat penambahan garam FeCl3, sedangkan pada sampel albumin endapan terbentuk akibat penambahan garam logam. Albumin merupakan protein dengan berat molekul kecil yang biasa terdapat dalam telur, serum dan susu. Oleh karena itu, albumin dapat mengendapkan garam dan logam berat, sedangkan gelatin yang merupakan protein dari jaringan kolagen tidak dapat mengendapkan garam dan logam berat karena kadar proteinnya yang rendah.
larut dalam air. Adanya endapan disebabkan karena adanya kemampuan protein atau asam amino untuk berikatan dengan ion logam di atas titik isoelektriknya. Kemampuan ini disebabkan karena pada saat pH berada di atas titik isoelektrik protein atau asam amino, maka ia akan bermuatan negatif sehingga mampu mengikat ion logam yang bermuatan positif.
Selain menyebabkan terbentuknya endapan, adanya pertambahan ion logam menyebabkan putusnya jembatan disulfida dan ikatan kovalen S-S pada protein yang mengandung gugus sulfuhidril. Sedangkan untuk asam amino seperti asam aspartat, glisin, dan alanin tidak membentuk endapan karena suasana larutan masih berada di bawah titik isoelektrik kedua asam amino tersebut, sehingga asam amino yang bermuatan positif tidak mampu berikatan dengan ion logam yang bermuatan positif pula. Selain itu, ketiga jenis asam amino tersebut tidak mengandung gugus sulfuhidril (Fennema, 1996).
Pengendapan garam logam berat oleh protein banyak digunakan atau diaplikasikan dalam berbagai aspek. Salah satunya yaitu dalam pengendapan dan pengeluaran logam beracun dalam tubuh. Menurut Winarno (1991), garam-garam logam berat dan asam-asam mineral kuat ternyata baik digunakan untuk mengendapkan protein. Prinsip ini dipakai untuk mengobati orang yang keracunan logam berat dengan memberi minum susu atau makan telur mentah kepada pasien.
Denaturasi dan Koagulasi
Denaturasi adalah proses yang mengubah struktur molekul tanpa memutus salah satu dari ikatan peptida dari protein. Proses ini khas pada setiap protein dan mempengaruhi protein yang berbeda untuk derajat yang berbeda, tergantung pada struktur protein. Denaturasi dapat disebabkan oleh beberapa faktor, seperti panas, pH, garam, dan efek permukaan (DeMan,1999).
Denaturasi protein dapat diartikan suatu perubahan atau modifikasi terhadap struktur sekunder, tertier dan kuartener molekul protein tanpa terjadinya pemecahan ikatan-ikatan kovalen. Karena itu, denaturasi dapat diartikan suatu proses terpecahnya ikatan hidrogen, interaksi hidrofobik, ikatan garam dan terbukanya lipatan molekul protein. Proses denaturasi biasanya disertai dengan terjadinya koagulasi atau penggumpalan pada protein. (Winarno 1992),
Pengujian terhadap denaturasi dan koagulasi protein kali ini, jenis protein yang digunakan yaitu albumin dan gelatin. Sampel diberi beberapa perlakuan yaitu ditambahkan 1 ml buffer asetat pH 4, pH 5 dan pH 6. Selanjutnya dikocok dan diamati pada menit ke 0, 5 dan 15.
Selanjutnya, masing-masing sampel dipanaskan hingga beberapa saat untuk mengetahui apakah perlakuan panas dapat memengaruhi denaturasi dan koagulasi protein.
Adanya pembentukan endapan dan gumpalan pada protein mengindikasikan terjadinya denaturasi dan koagulasi. Pada nilai pH di bawah dan di atas pH isoelektrik, protein membawa muatan positif atau muatan negatif. Tolakan elektrostatik dan hidrasi residu memengaruhi kelarutan protein. Mayoritas protein memiliki kelarutan minimum pada pH 4-5 (pH isoelektrik) dan kelarutan maksimum pada pH basa (DeMan, 1999). Hal ini sesuai dengan hasil pengujian dimana pada pH 4 dan 5,98 terbentuk banyak endapan dan gumpalan yang mengindikasikan kelarutan protein yang minimum, sedangkan pada pH 5,0 ke atas protein (kasein) memiliki kelarutan yang tinggi (tidak membentuk endapan dan gumpalan).
Denaturasi dan koagulasi protein dapat menimbulkan beberapa efek pada protein tersebut. Efek dari denaturasi dan koagulasi protein salah satunya adalah terjadinya perubahan pada struktur sekunder dan tersier. Selain itu, menurut DeMan (1999), denaturasi dan koagulasi protein adalah aspek stabilitas panas yang dapat berhubungan dengan komposisi asam amino dan urutan protein.
Uji Titik Isoelektrik
Titik isoelektrik suatu asam amino adalah suatu besaran fisis. Pada titik isoelektrik, terdapat kesetimbangan antara bentuk-bentuk asam amino sebagai ion amfoter, anion, dan kation. Pada setiap pH di atas titik isoelektrik, asam amino mempunyai muatan negatif. Sedangkan pada pH di bawah titik isoelektrik, asam amino mempunyai muatan positif. (Fessenden & Fessenden, 1986)
Titik isoelektrik adalah pH dimana protein tidak mempunyai selisih muatan dan karena itu tidak bergerak dalam medan listrik (Sudarmadji, 1996). Protein merupakan polimer dari asam amino. Asam amino mengandung sebuah gugus karboksil (asam) dan sebuah gugus amino (basa), sehingga asam amino bersifat asam dan basa atau disebut ampholytes (Fennema, 1996).
Tiap jenis protein mempunyai titik isoelektrik yang berlainan. Pengendapan paling cepat terjadi pada titik isoelekrik ini, dan prinsip ini digunakan dalam proses-proses pemisahan serta pemurnian protein (Winarno, 1991). Tabel 6. Hasil Pengamatan Uji Titik Isoelektrik
Sumber: Dokumentasi pribadi, 2017 Pengujian titik isoelektrik protein kali ini, sampel yang digunakan adalah kasein. Sampel tersebut diberi beberapa perlakuan seperti penambahan asam asetat dan aquades seperti yang terlihat pada tabel berikut:
Gambar 2. Prosedur Uji Titik Isoelektrik
(Sumber: Diktat Praktikum Kimia Pangan (hlm 32)
Setelah diberi berbagai perlakuan, sampel diamati selama 10-20 menit dan dilihat perubahan yang terjadi.
perbandingan yang relatif tetap antara asam asetat dan aquades yang ditambahkan, sehingga konsentrasi dan pH dari asam asetat relatif sama.
Asam asetat merupakan asam lemah yang memiliki pH yang tidak terlalu kecil atau sekitar 4-5. Menurut Pirie (1987), sebagian besar protein hasil ekstraksi berdasarkan studi yang dilakukan mengendap pada pH antara 4 dan 5. Selain itu, menurut Fennema (1996), titik isoelektrik albumin adalah : 4,55-4,90. Oleh karena itu, penambahan asam asetat pada albumin.menyebabkan albumin mencapai titik isoelektriknya. Pada kondisi ini protein memiliki kelarutan minimum, sehingga protein dapat dipisahkan dari bagian bahan lainnya yang tidak diinginkan (Page, 1981).
Salting Out
Salting out adalah prinsip seberapa besarnya daya kelarutan protein setelah diberi garam. Pada pengujian salting out, sampel yang digunakan adalah albumin dan gelatin. albumin dan gelatin, dipanaskan pada suhu 40
℃
, kemudian ditambahkan amonium sulfat sampai titik jenuh, diaduk dan disaring sampai menjadi filtrat. Kemudian ditambahkan padatan (NaOH, NaCl, MgSO4, Na2SO4) dan ditambahkan pereaksi buret kemudian diamati perubahan yang terjadi. Berdasarkan hasil pengujian salting out, tidak ditemukan adanya endapan pada semua sampel. Bila dalam suatu larutan protein ditambahkan garam, daya larut protein akan berkurang, akibatnya protein akan terpisah sebagai endapan. Peristiwa pemisahan protein ini disebut salting out. Bila garam netral yang ditambahkan berkonsentrasi tinggi, maka protein akan mengendap (Winarno, 1991). Pada percobaan ini, ketika ke dalam larutan protein ditambahkan garam, larutan protein tidak mengendap. Dikarenakan proteintidak larut dalam larutan garam
pekat. Protein jika terlarut dalam
garam akan menimbulkan endapan
berwarna putih. Mengendapnya
protein disebabkan karena adanya kompetisi antara ion-ion garam dengan molekul protein untuk mengikat air. Karena ion-ion dari garam lebih mudah dalam mengikat air, menyebabkan kelarutan protein dalam air berkurang. Dengan penambahan garam secara kontinyu, molekul air akan keluar dari larutan dan mengendap.Setelah dilakukan pengujian biuret terhadap endapan putih semua sampel, diperoleh hasil bahwa endapan yang dilarutkan berubah warna menjadi ungu, kecuali pada sampel yang diberi garam MgCl2. Timbulnya warna ungu pada sampel mengindikasikan adanya protein yang mengendap akibat penambahan garam. Adapun pada sampel yang diberi garam MgCl2 seharusnya menunjukkan hasil positif pada biuret. Akan tetapi, dari hasil percobaan sampel ini tidak berubah warna atau menunjukkan hasil negatif. Hal ini disebabkan oleh adanya beberapa kesalahan yang terjadi ketika pengujian. Kesalahan ini terjadi karena adanya ketidaktelitian dalam pengambilan endapan sampel ataupun
faktor-faktor lainnya.
KESIMPULAN
bersama logam berat yang terdapat pada garam tersebut. Denaturasi dan koagulasi protein (albumin) terjadi pada albumin yang diberi penambahan buffer asetat dengan pH 4, pH. 4,5 dan 4,98. Titik isoelektrik ditandai dengan menurunnya kelarutan protein dan terbentuknya endapan. Titik isoelektrik albumin terjadi pada pH 4,55-4,90.
Salting out terjadi pada protein
(albumin) yang diberi penambahan
garam netral. Hal ini ditandai dengan
terbentuknya endapan protein
berwarna putih yang dapat
memberikan hasil positif jika
dilakukan uji biuret.
DAFTAR PUSTAKA
Fennema, O. R. 1996. Food Chemistry 3rd Edition. Marcel Dekker Inc, New York. Inc, Maryland
Maligan, J. M. 2014. Uji Kualitatif Karbohidrat dan Protein.
Available at:
http://maharajay.lecture.ub.ac.id/fi les/2014/02/Uji-Kualitatif-KH-Protein.pdf
Lehninger, A.L. 1990. Dasar-Dasar Biokimia Jilid 1. Terjemahan Maggy Thenawidjaja. Penerbit Lehninger, A.L. 1990. Dasar-Dasar
Biokimia Jilid 1. Terjemahan Maggy Thenawidjaja. Penerbit Erlangga, Jakarta.
Page, D. 1981. Prinsip-Prinsip Biokimia. Terjemahan R. Soendoro. Penerbit Erlangga, Jakarta.
Pirie, N.W. 1987. Leaf Protein and Its By-products in Human and Animal 2nd Edition. Combridge University Press, Melborne. Sudarmadji, S. 1996. Teknik Analisa
Biokimiawi. Liberty, Yogyakarta.
Toha, A. H. 2001. Biokimia: Metabolisme Biomolekul. Alfabeta, Bandung.
Winarno, F. G. 1991. Kimia Pangan dan Gizi. PT. Gramedia Pustaka Utama: Jakarta.