Ikatan Kimia
Ikatan Kimia : Gaya tarik yang menyebabkan atom-atom yang terikat satu sama lain dalam suatu kombinasi
untuk membentuk senyawa yang lebih kompleks.
2 Klasifikasi Ikatan Kimia :
2. Ikatan Kovalen :
Ikatan yang terjadi antar atom dalam molekul yang melibatkan pemakaian elektron
bersama. 1. Ikatan ion :
Ikatan yang terjadi antara ion positif dan ion negatif dalam satu senyawa ionik.
Mengapa logam membentuk kation
dan Non logam membentuk anion
Logam : - Cenderung untuk menghasilkan ion positif
- Pada posisi sebelah kiri dalam sistem periodik mempunyai energi ionisasi dan afinitas elektron yang kecil
- Relatif diperlukan energi yang kecil untuk melepaskan elektron valensinya untuk menghasilkan ion positif (kation).
Non logam : - Cenderung untuk menghasilkan ion negatif
- Pada posisi sebelah kanan dalam sistem periodik mempunyaii energi ionisasi dan afinitas elektron yang besar.
- Sulit untuk melepaskan elektron valensinya, tetapi menghasilkan energi bila unsur tersebut menangkap elektron / terjadi peningkatan elektron untuk menghasilkan ion negatif (anion).
Na = 1s2 2s2 2p6 3s 1 Na+ = 1s2 2s2 2p6
Na+ mempunyai konfigurasi elektron yang sama dengan gas mulia Ne
1 x EI = 496 kj/mol
2 x EI = 4563 kj/mol ? Na 2+ tidak stabil/energi tinggi.
Perubahan dalam konfigurasi elektron
20Ca = 1s2 2s2 2p6 3s2 3p6 4s2
Ca2+ = 1s2 2s2 2p6 3s2 3p6
Ca2+ konfigurasi e- sama dengan gas mulia Ar 1 x EI = 590 kj / mol
2 x EI = 1140 kj / mol
3 x EI = 4940 kj / mol → Ca3+
tidak stabil/energi tinggi.
Non logam :
17Cl : 1s2 2s2 2p6 3s2 3p5
Cl¯ : 1s2 2s2 2p6 3s2 3p6
Cl¯ dan O2¯ mempunyai konfigurasi e¯ yang sama dengan gas mulia
Kekecualian aturan oktet
Aturan oktet : - Kation logam gol IA dan IIA
- Anion Non logam
Tetapi pada logam transisi dan post – transisi tidak berlaku dengan baik. Ex : Sn : [ Kr ] 4d10 5s2 5p2 Fe : [ Ar ] 3d6 4s2
Sn2+ : [ Kr ] 4d10 5s2 Fe2+ : [ Ar ] 3d6 Sn4+ : [ Kr ] 4d10 Fe3+ : [ Ar ] 3d5
“Bookkeeping” elektron : simbol lewis
-
G. N. Lewis (1875 – 1946), Amerika
Simbol Lewis unsur-unsur group / gol A periode 2 :
L
iB
B
B
eeeB
C
N O F N
eGol IA IIA IIIA IVA VA VIA VIIA O
Simbol
Ket : Jumlah elektron valensi
N
a+ CL
N
a+
CI
CL
Ca
CI
Ca
2++
2
CI
Simbol Lewis dapat juga digunakan untuk menjelaskan
pembentukan ion, meskipun banyak digunakan untuk
ikatan kovalen
Penggunaan Bersama elektron : pembentukan ikatan kovalen
Ikatan yang terjadi kombinasi atom-atom netral
untuk membentuk molekul disebut ikatan kovalen.
Ex : - H
2O : air
- C
12H 22O 11 : gula
Perubahan energi dalam pembentukan ikatan kovalen
- Kombinasi atom-atom non logam
pembentukan ikatan antara 2 atom Hidrogen
Pasangan elektron
10
Ikatan kovalen dan aturan oktet
Aturan oktet Aturan oktet : bila atom-atom membentuk ikatan kovalen, maka cenderung untuk membagi elektron-elektron untuk mencapai 8 elektron-elektron pada kulit
tertuanya (elektron valensi), kecuali atom H. Ex. :
- Ikatan kovalen dari pemakaian dua pasang elektron antara 2 atom disebut ikatan rangkap dua
C
O
O
O
C
= C =
- Ikatan kovalen dari pemakaian 3 pasang elektron antara 2 atom disebut ikatan rangkap tiga
Ex. : Ex. :
Elektronegatifitas dan polaritas ikatan
a. Ikatan kovalen non polar b. Ikatan kovalen polar
Polaritas : - perbedaan keelektronegatifan
12
Elektronegatifitas unsur-unsur
Variasi dalam karakter ion dalam ikatan dengan perbedaan keelektronegatifan.
Penulisan struktur Lewis
- Struktur Lewis yang tidak mematuhi aturan oktet :
P
Cl
Cl
Cl
C
l
Cl
C
l B
eC
l
Cl
B Cl
Cl
F
F
F
F
F
F
S
-
Penataan atom-atom yang terikat :
Ex : CO
2O C O
O
ClO
4O Cl O
O
O
HNO
3H O N O
14Perhitungan elektron valensi
untuk penulisan suatu ion, tambahkan 1
elektron valensi untuk setiap muatan
negatif, atau kurangi satu elektron valensi
untuk setiap muatan positip.
Ex : SO
3S (gol VIA) mempunyai 6e
-1 x 6 = 6
O (gol VIA) mempunyai 6e
-3 x 6 = 18
+
Total 24e
-ClO4- Cl (gol VIIA) mempunyai 7e- 1 x 7 = 7
O (gol VIA) mempunyai 6e- 4 x 6 = 24 Tambahkan 1e - untuk muatan 1- + 1 + total 32e
-NH
4+N (gol VA) mempunyai 5e
-1 x 5 = 5
H (gol IA) mempunyai 1e
-4 x 1 = 4
Kurangi 1e
-untuk muatan 1+
-1
+
total 8e
-latihan : - SO2, PO43-, NO+ hitung semua elektron valensi ?
- Tuliskan struktur Lewis dari HClO3, SO3, CO, SF4, OF2, NH4+, SO2, NO3-, ClF3 dan HClO4.
Resonansi : bila struktur Lewis tunggal gagal
- Hibrida resonansi
- Struktur resonansi atau struktur penyumbang
-Ex : Kalor pembentukan standar C6H6 = +230 KJ / mol
( molekul hipotesis )
Kalor pembentukan standar Benzen = -84 KJ/ mol 146 KJ / mol
ini berarti Benzen lebih stabil dengan selisih 146 KJ / mol, penurunan energi molekul disebut energi resonansi.
18
Pengaruh resonansi terhadap stabilitas molekul dan ion - Resonansi dapat menyebabkan molekul dan atau ion lebih stabil
daripada tanpa resonansi. - Ikatannya lebih kuat.
Ikatan kovalen koordinasi : ikatan
yang terjadi apabila kedua elektron
pada suatu ikatan berasal dari salah
satu atom (donor pasangan elektron).
+ H
+
H
H
N O
H
H
H
N H
H
+
Definisi Asam dan Basa Lewis
1. Asam adalah spesies ionik atau molekul
yang dapat menerima (aseptor) sepasang elektron dalam pembentuk ikatan kovalen koordinat
2. Basa adalah spesies ionik atau molekul
yang dapat memberi (donor) sepasang elektron dalam pembentuk ikatan kovalen koordinat
3. Netralisi adalah pembentuk ikatan kovalen
koordinat antara donor (basa) dan aseptor (asam)
20
Contoh reaksi Asam - Basa Lewis
Asam
Basa
+
H
H
N
H
H
N
H
H
B CI
CI
CI
B CI
CI
CI
Struktur Molekul
Bentuk molekul
Molekul Linier = sudut ikatan 180
Molekul Segitiga planar = sudut ikatan 120
Molekul tetrahedral = sudut ikatan 109,5 Langkah-langkahGambar :
Menggambar molekul tetrahedral
Molekul Oktahedral : 2 square pyramid
Molekul Trigonal bipiramidal : 2 trigonal piramid Model ikatan : - ikatan ekuatorial : 120
- ikatan aksial : 180
- diantara ekuatorial dengan aksial 90
Prediksi Bentuk Molekul : Teori ”VSEPR”
Teori “VSEPR” (Valance Shell Elektron Pari Requlsion) : Pasangan e- kulit valensi atom pusat akan saling
tolak-menolak sampai tercapai tolakan yang paling minimal. ex : - BeCl2
Gambar : Two pairs
Three pairs
Four pairs
Five pairs
Six pairs
Ex : BeCl2 Be B 120o
Cl
Be
Cl
180oCl
Cl
Be
< 180o B Cl Cl Cl (benar) (salah) Linier Segitiga Planar BCl3 Latihan : CCl4, SbCl5 4Bentuk molekul bila beberapa pasangan e
-tidak dipakai untuk ikatan
Pasangan e- yang tidak dipakai akan memberikan tolakan
yang sama seperti pasangan e- yang tidak dipakai untuk ikatan
Gambar :
Cl
Sn
Cl
Molekul dengan 4 pasangan e
-dalam kulit Valensi
Gambar :N
H
H
H
O
H
H
6Molekul dengan 5 pasangan e
-dalam kulit Valensi
Molekul dengan 6 pasangan e
-dalam kulit Valensi
Gambar : Latihan : ClO2-, XeF 2, XeOF4 8Bentuk molekul dan ion dengan ikatan rangkap dua atau tiga
Sama seperti ikatan tunggal Gambar :
N
O
O
O
Segitiga PlanarO
N
O
O
C
O
Non LinierBentuk Molekul dan Polaritas Molekul
Momen di pol molekul
• Kekuatan interaksi tergantung pada jumlah muatan dalam molekul dan jarak antara muatan
• Di tentukan secara eksperimen
Molekul Polar
Molekul Polar
Mekanika Gelombang dan
Ikatan Kovalen : Teori Ikatan Valensi
• Bagaimana atom-atom berpatungan elektron antara kulit-kulit valensi
mekanika kuantum untuk mempelajari bagaimana orbital-orbital atom berinteraksi satu sama lain
• Teori modern ikatan berdasarkan fungsi-fungsi mekanika gelombang
• Teori ikatan modern : 1. Teori ikatan valensi 2. Teori orbital molekul
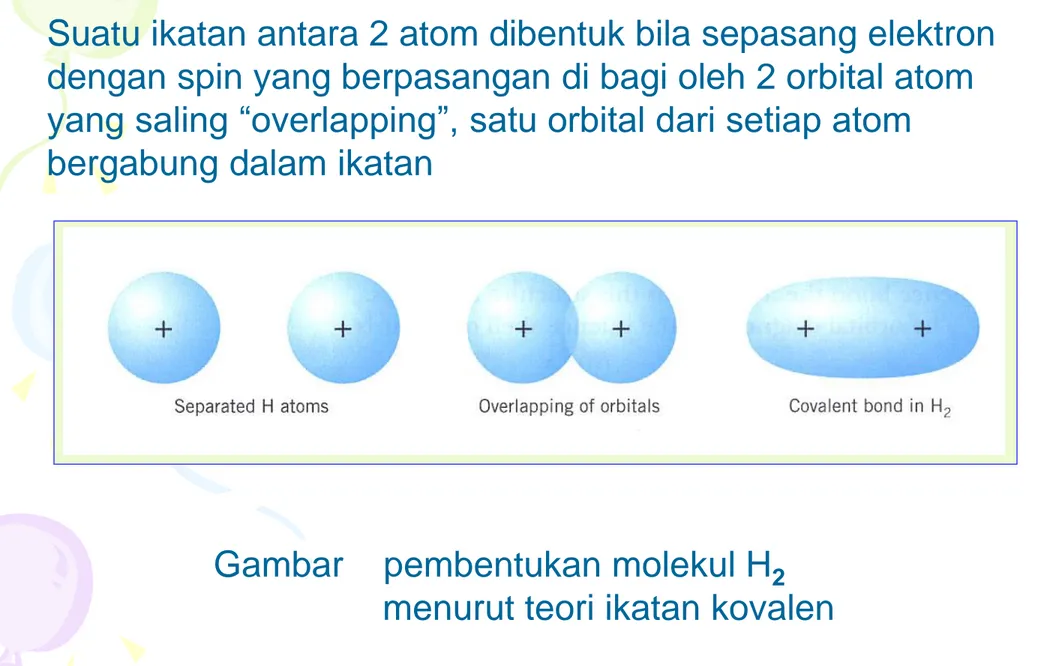
Postulat dasar teori ikatan valensi
Suatu ikatan antara 2 atom dibentuk bila sepasang elektron dengan spin yang berpasangan di bagi oleh 2 orbital atom yang saling “overlapping”, satu orbital dari setiap atom
bergabung dalam ikatan
Gambar pembentukan molekul H2 menurut teori ikatan kovalen
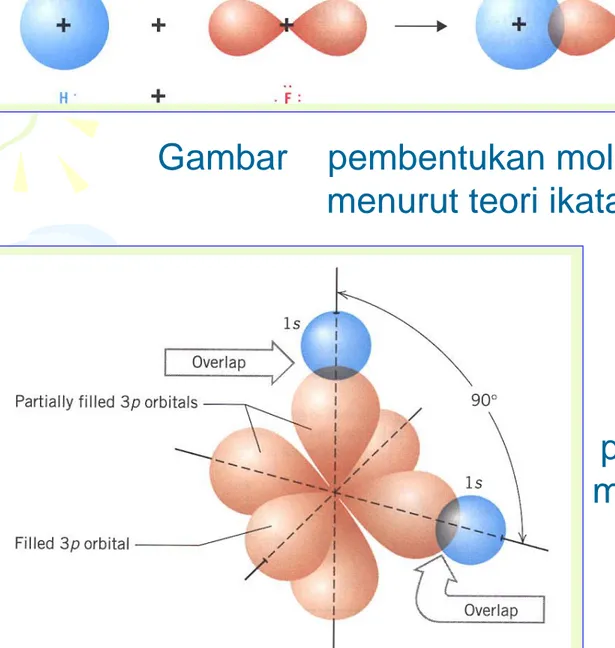
Gambar pembentukan molekul HF menurut teori ikatan kovalen
Gambar
pembentukan molekul H2S menurut teori ikatan kovalen
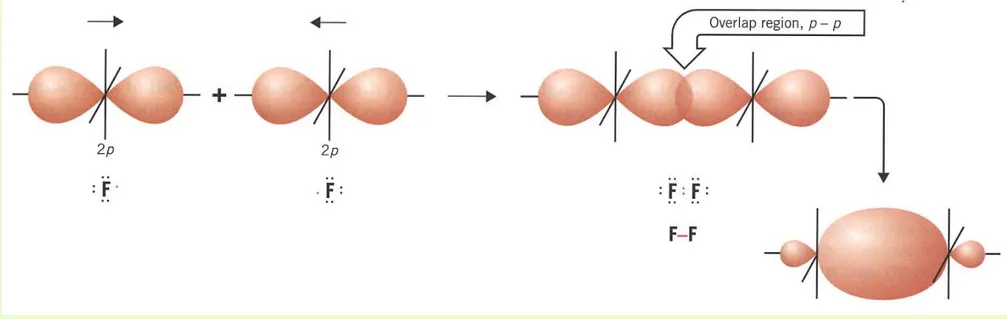
Gambar pembentukan molekul F2
menurut teori ikatan kovalen
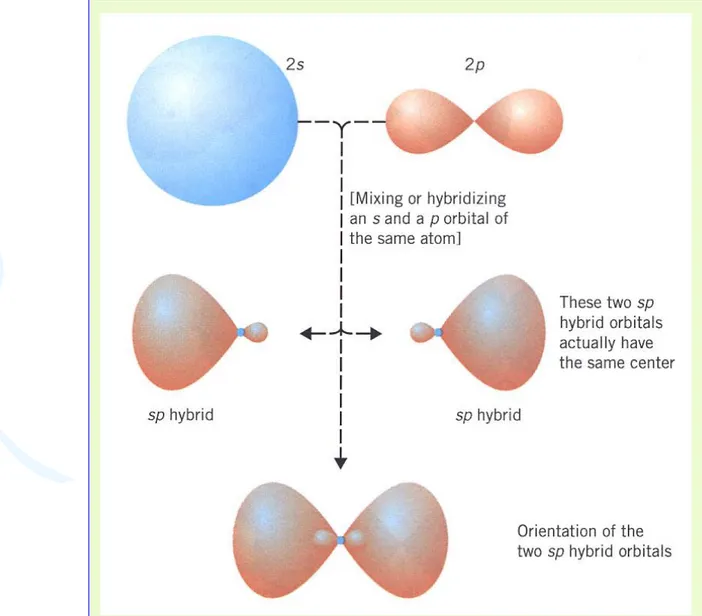
Orbital Hibrid
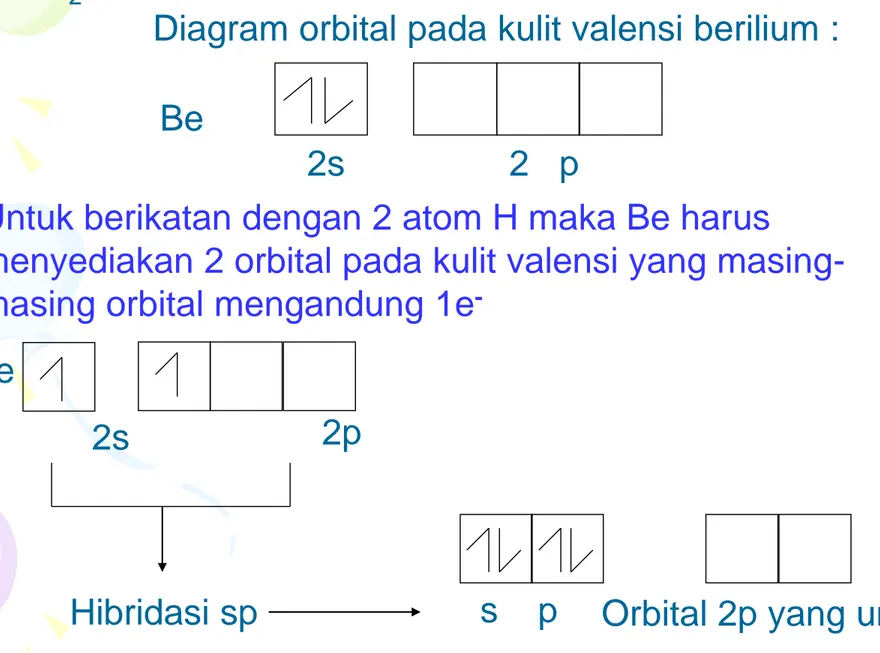
Be H2 :Diagram orbital pada kulit valensi berilium : Be
2s 2 p
Untuk berikatan dengan 2 atom H maka Be harus
menyediakan 2 orbital pada kulit valensi yang
masing-masing orbital mengandung 1e
-Be
2s 2p
Hibridasi sp s p Orbital 2p yang unhibrid
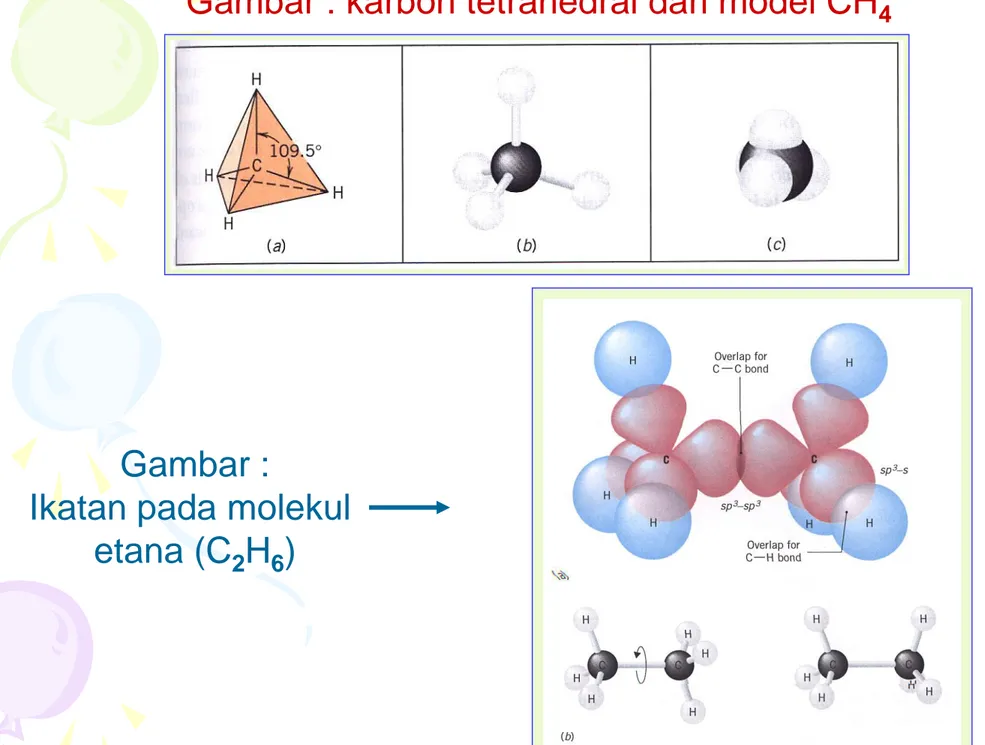
Gambar : karbon tetrahedral dari model CH4
Gambar :
Ikatan pada molekul etana (C2H6)
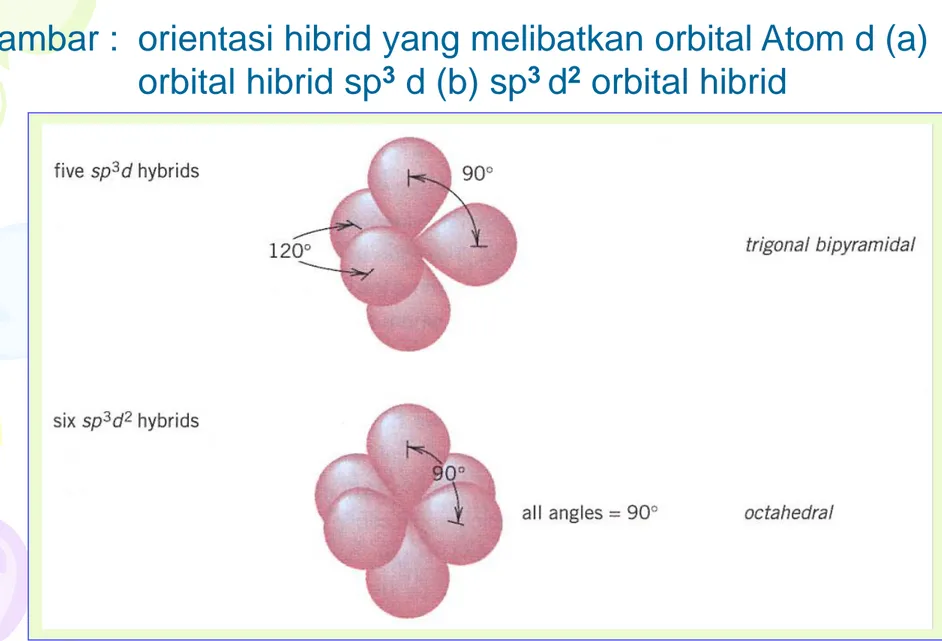
Hibridasi bila atom pusat mempunyai lebih dari oktet
Gambar : orientasi hibrid yang melibatkan orbital Atom d (a) orbital hibrid sp3 d (b) sp3 d2 orbital hibrid
Penggunaan teori VSEPR untuk memprediksi Hibridasi
CH4 tetrahedral hibridasi sp3
SF6 oktahedral hibridasi sp3 d2
Latihan : SiH4, PCl5
Hibridasi dalam molekul yang mempunyai
pasangan elektron bebas
CH4 adalah molekul tetrahedral hibridasi sp3 orbital karbon Sudut ikatan H - C - H = 109,5
NH3, sudut ikatan H - N - H = 107 H2O, sudut ikatan H - O - H = 104,5
Sudut ikatan H – X – H
mendekati sudut untuk molekul yang atom pusat mempunyai hibrid sp3
Ikatan Rangkap Dua dan Tiga
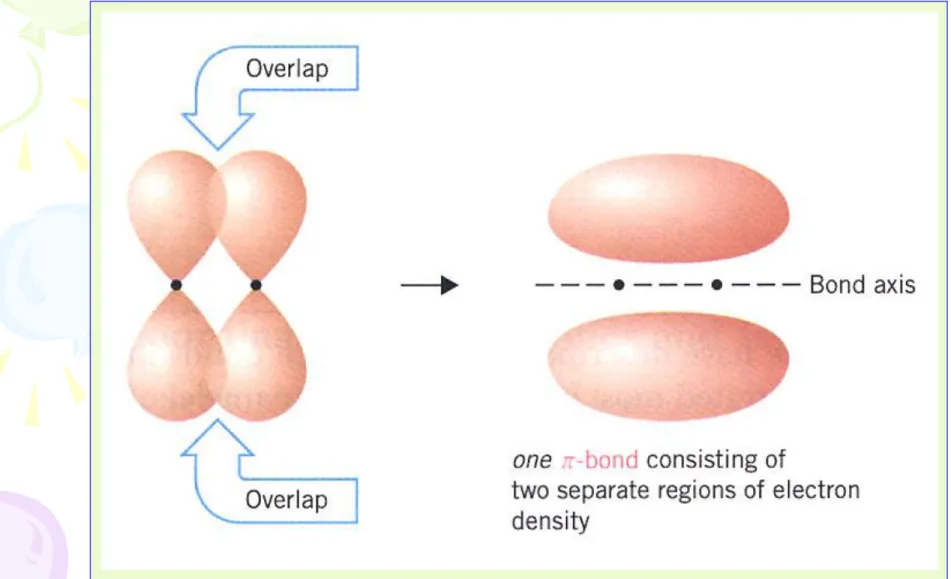
“Overlap” orbital-orbital s, p, atau orbital hibrid disebut Ikatan Sigma atau Ikatan
a) overlap dari orbital s
b) overlap dari orbital p dari ujung ke ujung Gambar :
Ikatan yang terjadi overlap dari orbital p dari ujung
ke ujung secara aksial yang menghasilkan densitas e-yang dibagi diantara 2 daerah e-yang berlawanan pada 2 inti yang bergabung disebut ikatan pi (ikatan )
C
C
H
H
H
H
Hibridisasi sp2
Teori Orbital Molekul
Memandang bahwa suatu molekul mirip dengan atom dalam Satu respek yang penting level energi tergantung kepada Variasi orbital yang dipopulasikan oleh e-.
Atom orbital atom
Molekul orbital molekul
Orbital molekul yang dibentuk = orbital atom-atom yang Berkombinasi
Molekul terdiri dari susunan inti atom tertentu, dan di sekitar Inti tersebut tersebar satu set orbital molekul.
Teori orbital molekul dapat digunakan untuk menghitung Keberadaan molekul tertentu
Mengapa beberapa molekul ada dan yang lain tidak ?
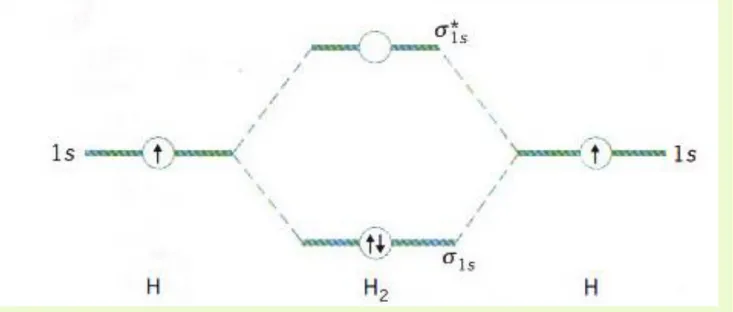
Gambar :
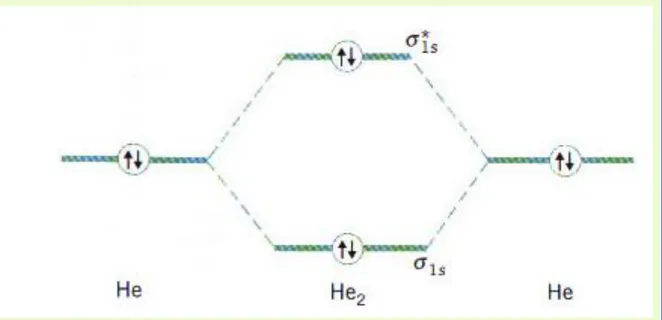
Gambar : diagram level energi orbital molekul He2
Pada molekul He2 e- ikatan = e- anti ikatan
tidak stabil
Jika kehilangan 1e- anti ikatan He2 He2+ maka masih ada
Elektron ikatan netro ion tersebut bisa ada walaupun tidak Stabil dan tidak dapat diisolasi.
Orde ikatan
0,5 2 1 -2 ikatan orde : He Ion 0 2 2 -2 ikatan orde : He Molekul 1 2 0 -2 ikatan orde : H Molekul 2 e -ikatan e ikatan Orde 2 2 2 -
Ikatan molekul diatonik periode 2
• Kulit terluar unsur periode 2 mengandung subkulit 2s dan 2p • Bila atom-atom pada periode 2 berikatan, maka subkulit orbital
Konfigurasi e- orbital molekul diperoleh dengan aturan yang sama seperti pengisian orbital atom dalam atom 1. Pengisian e- dimulai dari orbital energi terendah
2. Dalam setiap orbital, diisi maksimal 2e- dengan
spin berlawanan
3. Penyebaran e- dengan spin tidak berpasangan di atas
orbital yang mempunyai energi yang sama
Teori orbital molekul memprediksikan molekul Be2 dan Ne2 tidak ada lain orde ikatan = 0
Orde ikatan meningkat dari B C N dan berkurang dari N O F
Teori orbital molekul dapat menjelaskan struktur e- molekul O 2
- Dari eksperimen O2 : paramagnetik ( terikat lemah dengan magnet )
- Mempunyai 2e- yang tidak berpasangan
- panjang ikatan O2 ikatan ikatan O - O
dengan teori e- valensi hal tersebut telah dapat dijelaskan ex : struktur lewis :
O
O
O
O
( tidak diterima berdasarkan eksperimen karena semua elektron berpasangan) ( tidak diterima berdasarkan eksperimen