IKATAN KIMIA
IKATAN KIMIA
Drs. I Gusti Agung Gede Bawa, M.Si
Drs. I Gusti Agung Gede Bawa, M.Si
Jurusan Kimia
Jurusan Kimia
Materi Ikatan Kimia
Materi Ikatan Kimia
•• Gaya
Gaya Intramolekul
Intramolekuler
er
•• Ikatan ionikIkatan ionik •• Ikatan kovalenIkatan kovalen
•• Gaya
Gaya Intermolekul
Intermolekuler
er
•• Gaya dipol-dipolGaya dipol-dipol •• Gaya ion-dipolGaya ion-dipol •• Gaya dispersiGaya dispersi
•• Gaya Van der WaalsGaya Van der Waals •• Ikatan hidrogenIkatan hidrogen
•• Ikatan logamIkatan logam
•• Stabilitas Senyawa :
Stabilitas Senyawa :
•• Senyawa ionik (Energi Kisi)Senyawa ionik (Energi Kisi) •• Senyawa kovalen (Energi Ikat)Senyawa kovalen (Energi Ikat)
•• Geometri
Geometri Molekuler
Molekuler ::
•• TTeori VSeori VSEPREPR
•• TTeori Ieori Ikatan Valensikatan Valensi •• Teori Orbital MolekulTeori Orbital Molekul
•• Polaritas
Polaritas Senyawa
Senyawa ::
Gaya Intramolekuler
Gaya Intramolekuler
1.
1. GayGaya Iona Ionik ik (ikata(ikatan n ion)ion)
Gaya yang memegang atom-atom dalam
Gaya yang memegang atom-atom dalam suatu molekul.
suatu molekul.
Gaya Intramolekuler dibedakan menjadi dua, yaitu
Gaya Intramolekule
r dibedakan menjadi dua, yaitu ::
Ikatan yang terjadi sebagai akibat terjadinya serah-terima Ikatan yang terjadi sebagai akibat terjadinya serah-terima elektron antara atom-atom yang
elektron antara atom-atom yang memiliki potensial ionisasimemiliki potensial ionisasi rendah dengan atom-atom yang memiliki affinitas elektron rendah dengan atom-atom yang memiliki affinitas elektron tinggi.
tinggi.
Gol. IA ; IIA dengan VIA ; VIIA Gol. IA ; IIA dengan VIA ; VIIA
Ikatan yang terjadi sebagai akibat penggunaan
Ikatan yang terjadi sebagai akibat penggunaan pasanganpasangan elektron secara bersama-sama diantara atom-atom yang elektron secara bersama-sama diantara atom-atom yang berikatan.
berikatan. 2.
2. GayGaya Koa Kovavalen len (ik(ikataatan kn kovovalealen)n)
Ikatan ini umumnya terjadi antara unsur-unsur non
Ikatan ini umumnya terjadi antara unsur-unsur non logamlogam
Contoh : Contoh :
HCl ; Cl
Gaya Intermolekuler
Gaya Intermolekuler
Gaya tarik menarik diantara Gaya tarik menarik diantara molekul-molekul.molekul-molekul. Gaya ini bertanggung-jawab terhadap :Gaya ini bertanggung-jawab terhadap :
1.
1. PriPrilaklaku nou non-in-ideadeal dal dari sri suatuatu gu gasas 2.
2. KebKeberaeradaadaan fase tern fase terkonkondendensassasi suati suatu materu materi.i. 1.
1. GaGayya dia dipopol-l-didipopoll
Gaya yang bekerja pada
Gaya yang bekerja pada molekul-molekul polarmolekul-molekul polar
+
2. Gaya ion-dipol
Gaya yang terjadi pada suatu ion dengan molekul polar
+ – – + Na+ I – Contoh : - Hidrasi
3. Gaya dispersi
Gaya yang bekerja pada molekul-molekul non-polar
+ – +
kation Dipol terinduksi
Dipol terinduksi dipol
(b) (a)
4. Ikatan Hidrogen
Jenis interaksi dipol-dipol yang khusus antara atom hidrogen dalam suatu ikatan polar,seperti O―H atau N―H dengan atom -atom yang elektronegatif, seperti O, N atau F.
Ikatan yang terjadi diantara atom-atom logam 5. Ikatan Logam N H O H H H H
Stabilitas suatu senyawa
• Senyawa ionik
Stabilitas senyawa ionik bergantung pada interaksi dari semua ion-ion yang terlibat dalam pembentukan kisi kristalnya.
Ukuran kuantitatifnya dinamakan Energi Kisi :
Energi yang diperlukan untuk memisahkan secara lengkap 1 mol senyawa ionik padat menjadi ion-ion dalam keadaan gas.
Penentuan Energi Kisi
• Secara tidak langsung menggunakan siklus Born-Haber
Siklus Born-Haber menghubungkan antara energi kisi dengan
energi ionisasi, affinitas elektron, dan sifat-sifat atom atau molekul lainnya.
Contoh :
Penentuan energi kisi senyawa ionik LiF(s).
Pembentukan senyawa LiF(s), berdasarkan reaksi : Li(s) + ½ F2(g) LiF(s). ∆Hf o = -594,1 kJ
Pembentukan senyawa ini sesungguhnya melibatkan beberapa tahapan reaksi, yaitu :
1. Perubahan litium padat menjadi gas (entalpi sublimasi)
Li(s) Li(g) ∆H1o = 155,2 kJ
2. Disosiasi ½ mol gas F2 menjadi atom F(g)
½ F2(g) F(g) ∆H2o = 75,3 kJ
3. Ionisasi 1 mol atom Li(g)
Li(g) Li+(g) + e ∆H
3o = 520 kJ
4. Bertambahnya 1 mol e pada atom F(g) (afinitas e)
F(g) + e F –(g) ∆H
4o = -333 kJ
• Siklus Born-Harber
H
3o H
4oLi(g)
+
F(g)
F
(g) + Li
+(g)
H
1o H
2o H
5o H
f oLi(s)
+
½ F
2(g)
LiF(s)
H
f o=
H
1o+
H
2o+
H
3o+
H
4o+
H
5oKekuatan ikatan kovalen
• Energi ikat disosiasi
Energi yang diperlukan untuk memutuskan ikatan tertentu dari 1 mol molekul diatomik dalam keadaan gas.
H2(g) H(g) + H(g) ∆Ho = 436,4 kJ
Cl2(g) Cl(g) + Cl(g) ∆Ho = 242,7 kJ
HCl(g) H(g) + Cl(g) ∆Ho = 431,9 kJ
• Energi ikat rata-rata
Mengukur kekuatan ikatan kovalen menjadi lebih komplek untuk molekul poliatomik.
H2O(g) H(g) + OH(g) ∆Ho = 502 kJ
OH(g) H(g) + O(g) ∆Ho = 427 kJ
Contoh :
Energi yang diperlukan untuk memutuskan ikatan O―H pertama dalam molekul H2O, berbeda dengan energi yang diperlukan untuk memutuskan ikatan O―H kedua.
Berdasarkan studi H2O di atas, kita dapat memahami mengapa energi dari ikatan O―H, dalam dua molekul yang berbeda tidak sama.
Jadi untuk molekul poliatomik, kita hanya dapat mengatakan energi ikat rata-ratanya.
Geometri Molekuler
“Penataan tiga dimensi dari suatu atom dalam molekul.”
Beberapa sifat fisik dan sifat kimia, seperti titik leleh, titik didih, densitas, dan jenis reaksi yang molekul alami dipengaruhi oleh geometri molekulnya.
Ada dua cara yang umum dipakai untuk menentukan geometri molekuler, khususnya senyawa kovalen.
1. Metode VSEPR
Teori VSEPR
Dasar : tolak menolak pasangan elektron kulit valensi.
Tolak menolak ps. e. bebas x ps. e. bebas > ps. e. bebas x ps. e. ikatan > ps. e. ikatan x ps. e. ikatan.
Pedoman menggunakan Model VSEPR
1. Tulislah struktur Lewis dari suatu molekul.
2. Hitunglah jumlah total pasangan elektron yang mengelilingi atom pusat.
3. Ikatan rangkap 2 dan 3, dianggap sebagai ikatan tunggal.
4. Dalam meramalkan sudut ikatan, ingat tolak menolak ps. e bebas x ps. e bebas > ps. e bebas x ps. e ikatan > ps. e ikatan x ps. e ikatan.
Pedoman menulis Struktur Lewis
• Menulis kerangka struktur senyawa.
• Umumnya, atom-atom kurang elektronegatif menempati posisi atom pusat.
• Hidrogen dan flourine biasanya menempati posisi terminal. • Hitung jumlah total elektron valensi yang terlibat
• Untuk anion poliatomik, tambahkan sejumlah muatan negatif pada jumlah total elektron valensi.
• Untuk kation poliatomik, kurangi sejumlah muatan positif dari jumlah total elektron valensi.
• Gambarkan ikatan kovalen tunggal diantara atom pusat dan atom terminal, kemudian penuhi aturan oktet pada atom-atom terminal dengan menambahkan pasangan elektron bebas untuk
menghabiskan jumlah total elektron valensi.
• Jika atom pusat tidak memenuhi aturan oktet, cobalah ikatan rangkap dua atau rangkap tiga diantara atom pusat dan atom terminal dengan memakai pasangan elektron bebas dari atom terminal.
• Dengan memperhatikan struktur Lewis senyawa-senyawa kovalen, maka kita dapat mengelompokan senyawa-senyawa tersebut
menjadi dua kelompok, yaitu :
1. Atom pusat tidak mempunyai pasangan elektron bebas 2. Atom pusat mempunyai pasangan elektron bebas.
Ad. 1. Atom pusat tanpa pasangan elektron bebas. Contoh :
1. BeCl2
Karena atom pusat (Be) mengandung 2 pasangan elektron ikatan yang saling tolak menolak, menyebabkan kedua pasangan elektron ikatan ini menjauh sampai pada suatu posisi dimana tingkat tolakan paling
minimum, dalam hal ini membentuk sudut 180o.
2. BF3 Contoh
Struktur lewis : F
Tataan elektron Bentuk Contoh
Linear
Segi tiga planar
Tataan elektron Bentuk Contoh
Segitiga bipiramida
Atom pusat memiliki pasangan elekron bebas
Jlm ps. e. pd atom pusat Jlm. Ps. e. ikatan Bentuk Contoh 3 4 2 3 .. Bengkokan Segitiga piramida GeF2 NH3Jlm ps. e. pd atom pusat Jlm. Ps. e. ikatan Bentuk Contoh 5 5 4 3 Tetrahedral tak beraturan Bentuk T SF4 ; IF4+ ; XeO2F2 ClF3 ; ICl3
Jlm ps. e. pd atom pusat Jlm. Ps. e. ikatan Bentuk Contoh 6 6 5 4 Piramida segiempat BrF5 ; SbS52 – ; XeOF4 IF4 – ; XeF 4 ; ICl4 –
Latihan :
• Ramalkan bentuk Geometri dari :
a. ClO
3 –; XeO
4; CO
32 –b. SO
3; CCl
4; H
2CO
c. FCl
2+; AsF
5; SeO
2d. TeF
4; SbCl
6 –; NO
2 –; PO
43 –e. SbH
3; PCl
4+; SiO
44 –Teori Ikatan Valensi
• Teori ikatan valensi menganggap bahwa elektron-elektron dalam suatu molekul menempati orbital atom individunya.
• Pembentukan ikatan terjadi akibat tumpang-tindih (overlapping)
antara orbital-orbital kulit valensi dari masing-masing atom individu. Contoh :
Pembentukan H2 merupakan hasil dari tumpang-tindih orbital 1s dari masing-masing atom H.
• Pembentukan HF
• Tidak semua pembentukan ikatan dapat dijelaskan dengan model overlapping seperti di atas.
Orbital Hibrid
Contoh : senyawa BeH2
• Konfigurasi elektron valensi atom Be : 1s2 2s2
• Pada keadaan dasar, orbital atom 2s tidak dapat melakukan overlapping, karena orbital ini mengandung dua elektron. • Overlapping dapat terjadi apabila masing-masing orbital
mengandung satu elektron.
• Hal ini dapat dipecahkan dengan mengeksitasi sebuah elektron valensi ke orbital diatasnya (orbital 2p), sehingga konfigurasi
• Jika dalam kondisi ini dia melakukan overlapping dengan orbital atom yang diikatnya, maka bentuk molekul yang diramalkan oleh teori VSEPR maupun bentuk riilnya tak dapat dijelaskan.
• Teori mekanika kuantum, memungkinkan untuk mencampur dua
orbital yang tidak sama dalam atom yang sama untuk menghasilkan orbital-orbital hibrid.
• Jumlah orbital hibrid yang dihasilkan harus sama dengan jumlah orbital yang dicampur.
• Orientasi orbital-orbital hibrid yang dihasilkan, akan menentukan bentuk geometri molekulnya.
Pembentukan BCl
3• Konfigurasi elektron atom B pada keadaan : Dasar : [He] 2s2 2p1
Tereksitasi : [He] 2s1 2p2
Pembentukan etana (CH
3-CH
3)
• Konfigurasi elektron atom C pada keadaan : Dasar : [He] 2s2 2p2
Tereksitasi : [He] 2s1 2p3
Pembentukan etena (CH
2=CH
2)
• Konfigurasi elektron atom C pada keadaan : Dasar : [He] 2s2 2p2
Tereksitasi : [He] 2s1 2p3
hibrid sp2
• Atom C hanya mengikat 3 atom lain, yaitu 1 atom C dan 2 atom H, maka hibrid yang terjadi sp2 dengan sebuah elektron yang tidak
Pembentukan molekul formaldehid
H
H O C
• Konfigurasi elektron atom C pada keadaan :
Dasar : [He] 2s2 2p2
Tereksitasi : [He] 2s1 2p3
hibrid sp2
• Konfigurasi elektron atom O pada keadaan :
Dasar : [He] 2s2 2p4
Pembentukan etuna
• Konfigurasi elektron atom C pada keadaan : Dasar : [He] 2s2 2p2 Tereksitasi : [He] 2s1 2p3 hibrid sp C C H H
Pembentukan gas N
2• Konfigurasi elektron atom N pada keadaan : Dasar : [He] 2s2 2p3
Teori Orbital Molekul
Berdasarkan teori orbital molekul, suatu molekul secara nyata tak begitu banyak berbeda dengan suatu atom.
Bedanya, molekul mengandung beberapa inti, sedangkan atom hanya satu inti.
Baik molekul maupun atom mempunyai tingkat-tingkat energi atau orbital yang dapat ditempati elektron.
Dalam atom dinamakan orbital atom, sedangkan dalam molekul dinamakan orbital molekul
Tumpang-tindih (Overlaping) dari dua orbital atom akan menghasilkan dua jenis “orbital molekul”, yaitu orbital molekul bonding (membantu menstabilkan molekul) dan orbital molekul anti bonding (membantu mendestabilisasi molekul).
Contoh : pembentukan molekul H2
Diagram tingkat energi orbital molekul dalam molekul H2
Konfigurasi elektron molekul H2 adalah
1s2
Kedua elektron molekul H2 berada pada orbital bonding, sehingga molekul H2 stabil.
Contoh : pembentukan molekul He2
Overlaping dua orbital 1s dalam molekul He2
Diagram tingkat energi orbital molekul dalam molekul He2
Konfigurasi elektron molekul He2 :
Ordo Ikatan
2 g antibondin elektron jumlah bonding elektron jumlah ikatan Ordo Jika ordo ikatan > 1, maka molekul ada atau kemungkinan ada Jika ordo ikatan = 0, molekul tidak stabil (tidak pernah ada)
Contoh, 1 2 0 2 H molekul ikatan ordo 2 Molekul stabil 0 2 2 2 He molekul ikatan ordo 2
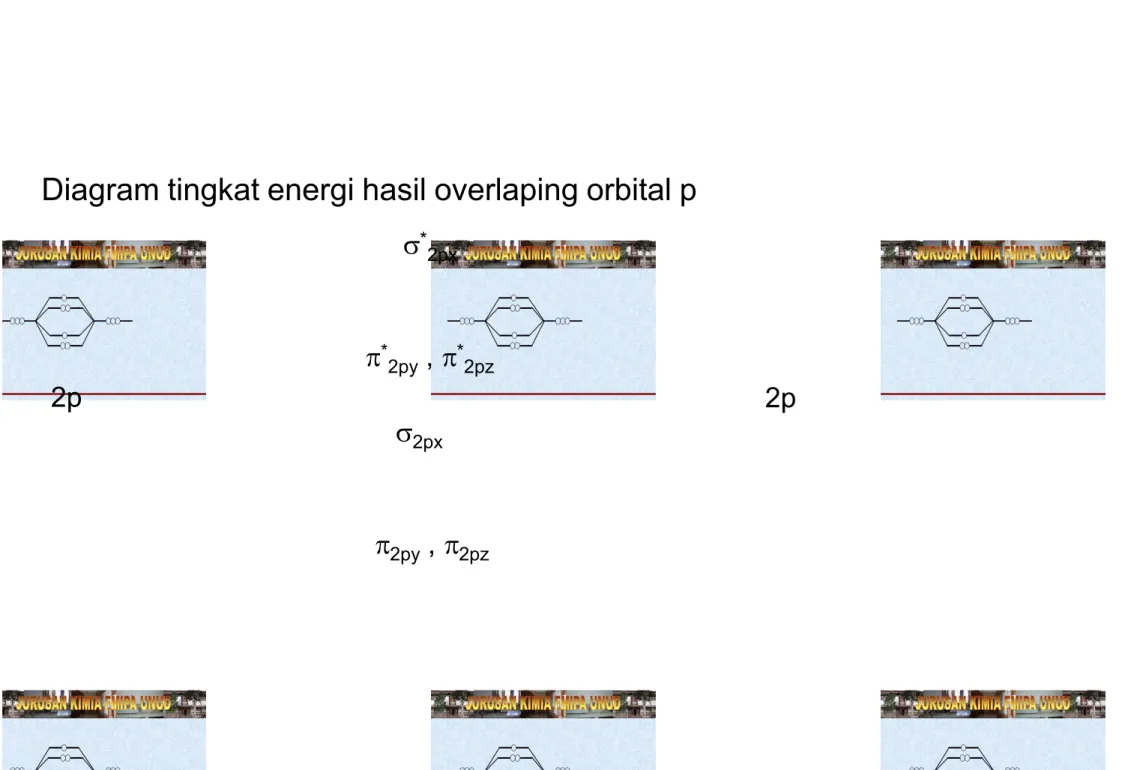
Diagram tingkat energi hasil overlaping orbital p 2p 2p 2py , 2pz * 2py , *2pz 2px * 2px
Contoh :
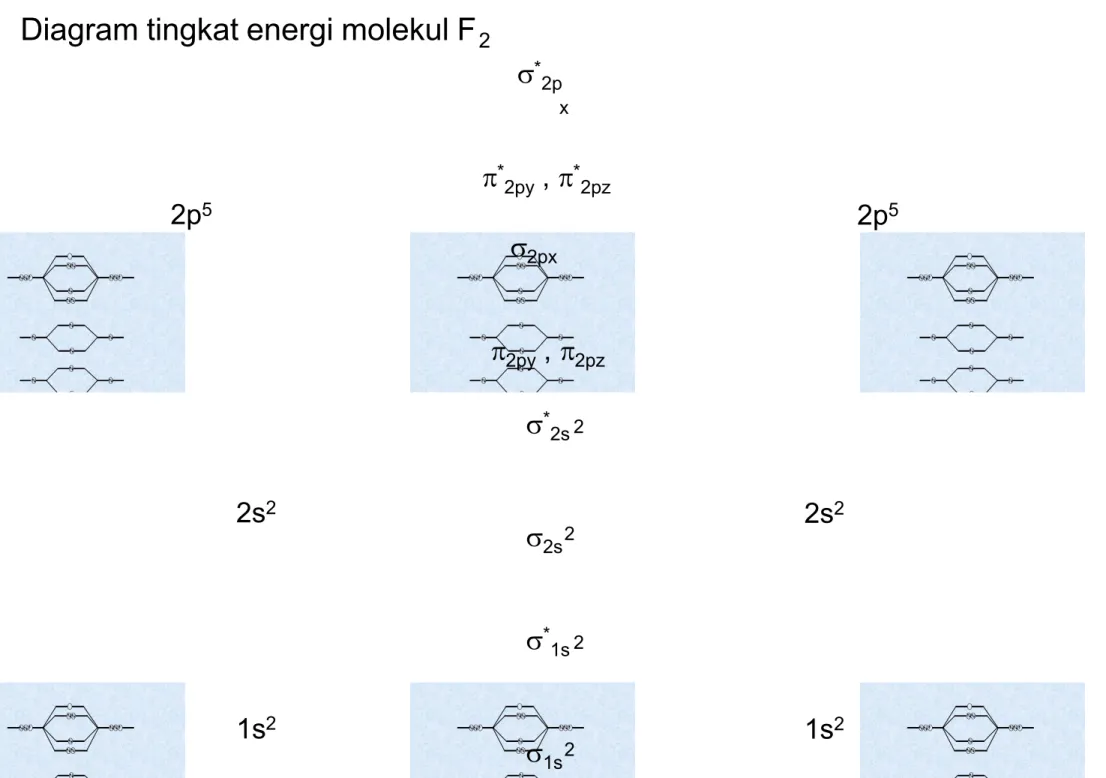
Buatlah diagram tingkat energi molekul F2 dan konfigurasi elektron molekul F2. Apakah molekul F2 stabil ?
Jawab :
* 1s 2 2s2 2s2 2s * 2s 2 2 2p5 2p5 2py , 2pz * 2py , *2pz 2px * 2p x
Konfigurasi elektron molekul F2 :
1s2, *1s2, 2s2, *2s2, 2py2, 2pz2, 2px2, *2py2, *2pz2.
Ordo ikatan molekul F2 :
1 2 10 F molekul ikatan ordo 2 8
Polaritas Senyawa
Polaritas suatu senyawa ditentukan oleh : 1. Polaritas ikatan
2. Bentuk molekul
Polaritas ikatan ditentukan oleh beda nilai keelektronegatifan dari atom-atom yang terikat.
Beda keelektronegatifan = 0 ikatan non-polar Beda keelektronegatifan 0 ikatan polar
Contoh :
H―H ; Cl―Cl molekul non-polar, ikatan non-polar H―Cl ; H―Br molekul polar, ikatan polar
• Untuk senyawa poliatomik, polaritasnya juga ditentukan oleh bentuk molekulnya.
Contoh :
CO2 ikatan polar, molekul non-polar
• Ikatan polar, molekul non polar
• Ikatan polar, molekul polar
Soal :
1. Klor trifluorida (ClF3) adalah zat untuk proses fluorinasi yang telah digunakan untuk memisahkan uranium dari produk batang bahan bakar di reaktor nuklir.
a. Tulislah rumus dot Lewis ClF3
b. Tentukan hibridisasi di atom Cl yang digunakan dalam pembentukan ClF3
c. Ramalkan gambar bentuk molekul ClF3 berdasarkan orbital hibrida yang anda uraikan pada pertanyaan “b”.
d. Berikan gambar bentuk lain yang mungkin, dan jelaskan menurut anda mengapa ClF3 tidak berbentuk seperti ini.
e. Hantaran listrik cairan ClF3 hanya sedikit lebih rendah daripada hantaran listrik air murni. Hantaran listrik cairan ini dijelaskan
2. Secara kimiawi unsur Xenon (Xe) adalah unsur lemban (inert).
Unsur ini membentuk sejumlah senyawa kimia dengan unsur-unsur elektronegatif seperti dengan fluorin dan oksigen. Reaksi xenon
dengan fluorin yang jumlahnya beragam dapat menghasilkan XeF2 dan XeF4. Selanjutnya, bila XeF2 dan XeF4 direaksikan dengan air, yang bergantung pada kondisinya, dapat menghasilkan XeO3,
XeO4 dan H2XeO6 serta senyawa campuran seperti XeOF4. Nomor atom Xe = 54; F = 9 dan O = 8.
Pertanyaan :
a. Gambarkan struktur keenam senyawa tersebut berdasarkan teori ikatan valensi.
b. Prediksikan / ramalkan struktur dari keenam senyawa tersebut berdasarkan teori VSEPR.
3. Dua senyawa yang salah satu unsurnya dari halogen (fluorin) yaitu SF4 dan BrF5. Nomor atom : S = 16; Br = 35 dan F = 9.
Pertanyaan :
a. Gambarkan rumus Lewis (dot) bagi masing-masing senyawa tersebut.
b. Gambarkan struktur ruangannya. c. Sebutkan hibridisasinya
d. Sebutkan struktur mana yang memenuhi aturan oktet ?
e. Sebutkan bentuk ruang yang terbangun dari kedua senyawa atas dasar teori VSEPR.