BIOSENSOR GLUKOSA MENGGUNAKAN GDH-FAD YANG
DIIMOBILISASI PADA NANOPARTIKEL
ZEOLIT SECARA ELEKTROKIMIA
RAUDHATUL FADHILAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Biosensor Glukosa menggunakan Glukosa Dehidrogenase Flavin Adenin Dinukleotida yang Diimobilisasi pada Nanopartikel Zeolit secara Elektrokimia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013 Raudhatul Fadhilah NIM G451110041
RINGKASAN
RAUDHATUL FADHILAH. Biosensor Glukosa menggunakan Glukosa Dehidrogenase Flavin Adenin Dinukleotida yang Diimobilisasi pada Nanopartikel Zeolit secara Elektrokimia. Dibimbing oleh LATIFAH KOSIM DARUSMAN dan DYAH ISWANTINI PRADONO.
Biosensor glukosa telah dikembangkan secara luas untuk mengukur kadar glukosa darah. Kinerja biosensor glukosa terus ditingkatkan untuk menghasilkan biosensor dengan aktivitas dan stabilitas yang semakin baik. Faktor kunci keberhasilan dalam pengembangan biosensor glukosa berbasis enzim adalah ketepatan penggunaan teknik dan matriks imobilisasi sehingga eksplorasi material yang dapat digunakan sebagai matriks pengimobilisasi terus dilakukan.
Tujuan dari penelitian ini adalah menentukan aktivitas dan stabilitas enzim glukosa dehidrogenase (GDH) yang diimobilisasi pada nanopartikel zeolit (NPZ) serta menentukan parameter kinetika dan keragaan analitik dengan metode elektrokimia. Hasilnya elektrode enzim dengan NPZ dan elektrode enzim dengan zeolit A menunjukkan aktivitas yang tinggi terhadap glukosa dibandingkan elektrode enzim tanpa NPZ.
Kinetika reaksi ketiga elektrode enzim mengikuti pola kinetika Dixon. Nilai 𝐼𝑚𝑎𝑥𝑎𝑝𝑝 elektrode enzim tanpa NPZ, dengan NPZ, dan dengan zeolit A secara berturut-turut 27.25 μA, 77.52 μA, dan 48.54 μA. Nilai𝐾𝑀𝑎𝑝𝑝untuk enzim GDH yang diimobilisasi pada NPZ adalah 1.16 mM, 0.30 mM untuk enzimGDH yang diimobilisasi pada zeolit A dan 0.95 mM untuk enzim GDH imobilisasi tanpa NPZ. Elektrode enzim juga menunjukkan sensitivitas yang cukup tinggi dengan nilai sensitivitas 2.41 µA mM-1 untuk elektrode enzim dengan zeolit A, 0.81 µA mM-1 untuk elektrode enzim dengan NPZ, dan 0.58 µA mM-1 untuk elektrode enzim tanpa NPZ.
Ketiga elektrode enzim menghasilkan daerah linear yang berbeda-beda dengan rentang konsentrasi untuk elektrode enzim tanpa NPZ, dengan NPZ dan dengan zeolit A secara berturut-turut 1.00 mM-15.00 mM, 2.00 mM-20.00 mM, dan 0.06 mM-10.00 mM. Rentang konsentrasi glukosa darah normal pada manusia yaitu dari 4 sampai 6 mM, sehingga elektrode enzim dengan NPZ dan tanpa NPZ yang cocok digunakan dalam penentuan konsentrasi gula darah. Sementara elektrode enzim dengan zeolit A memiliki range yang lebih sempit sehingga lebih cocok diaplikasikan dalam penentuan konsentrasi gula dalam makanan atau minuman.
Elektrode enzim dengan NPZ dan elektrode enzim dengan zeolit A menunjukkan akurasi baik dengan nilai kesalahan relatif secara berturut-turut sebesar 3.84% dan 3.48%. Keterulangan pengukuran juga menunjukkan hasil yang cukup teliti dengan nilai standar deviasi relatif (%RSD) sebesar 3.83% untuk elektrode enzim dengan NPZ dan untuk elektrode enzim dengan zeolit A sebesar 3.16%. Tingginya aktivitas, akurasi dan keterulangan pengukuran elektrode enzim yang diimobilisasi pada NPZ dan zeolit A disebabkan oleh adanya kombinasi dua teknik imobilisasi, yaitu adsorpsi fisik antara enzim dengan zeolit dan penjebakan pada elektrde pasta karbon. Elektrode enzim dengan NPZ dan elektroda enzim dengan zeolit A menunjukkan respon elektrokimia yang baik terhadap glukosa
sehingga dapat diterapkan dalam penentuan kadar glukosa darah maupun kadar glukosa dalam makanan dan minuman.
SUMMARY
RAUDHATUL FADHILAH. Glucose Biosensor using a Glucose Dehydrogenase Flavin Adenine Dinucleotide Electrochemically Immobilized on Zeolite Nanoparticles. Supervised by LATIFAH KOSIM DARUSMAN and DYAH ISWANTINI PRADONO.
A glucose biosensor was developed to measure blood glucose levels. The performance of these new glucose biosensors was continuously improved, producing better performance and stability. The technique selection and immobilization matrix are key factors for biosensor development, so that the prospecting of materials that can be used as a matrix for supporting enzyme, continue to be explore.
The purpose of this study was to determine the activity and stability of the enzyme glucose dehydrogenase (GDH) that were immobilized on zeolite nanoparticles (NPZ) and determine the kinetic parameters and analytical performance by electrochemical methods. The resulting enzyme electrode with NPZ and enzyme electrode with zeolite A showed a high activity against the enzyme electrode glucose than without NPZ.
The reaction kinetics of third electrodes of enzyme followed the Dixon equation. The 𝐼𝑚𝑎𝑥𝑎𝑝𝑝 values for enzyme electrode without NPZ, with NPZ, and with zeolite A were 27.25 μA, 77.52 μA, and 48.54 μA, respectively. The 𝐾𝑀𝑎𝑝𝑝 values for GDH enzyme that immobilized on the NPZ were 1.16 mM, 12.30 mM for GDH enzyme that immobilized on zeolite A and 0.95 mM for GDH enzyme immobilization without NPZ. The enzyme electrode without NPZ, with NPZ, and with zeolite A also showed a high sensitivity with value for the sensitivity were 0.58 μA mM-1, 0.81 μA mM-1, and 2.51 μA mM-1, respectively.
The third enzyme electrodes showed different linear area with range for the enzyme electrode without NPZ, with NPZ and with zeolite A were 1.00-15.00 mM, 2.00-20.00 mM, and 0.06-10.00 mM, respectively. The blood glucose level of normal person ranged from 4 to 6 mM, so that the enzyme electrode with NPZ and without NPZ are suitable for use in the determination of the concentration of blood glucose. While the enzyme electrode with zeolite A has a smaller range so it is more suitable to use in the determination of glucose concentration in the foods or beverages.
The enzyme electrode with NPZ and the enzyme electrode with zeolite A showed a good accuracy with relative error values were 3.84% and3.48%, respectively. Repeatability measurements also showed a good precission results with relative standard deviation values (%RSD) for the enzyme electrode with NPZ and enzyme electrode with zeolite A were 3.83% and 3.16%, respectively. By combining two immobilization techniques, physical adsorption on zeolite and entrapment on carbon paste, high enzymatic activity, good accuracy, and repeatability was attained. The enzyme electrode with NPZ and the enzyme electrode with zeolite A demonstrated a good electrochemical response toward glucose, allowing it to detect blood glucose levels and glucose levels in foods and
beverages.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
BIOSENSOR GLUKOSA MENGGUNAKAN GDH-FAD YANG
DIIMOBILISASI PADA NANOPARTIKEL
ZEOLIT SECARA ELEKTROKIMIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Biosensor Glukosa menggunakan Glukosa Dehidrogenase Flavin Adenin Dinukleotida yang Diimobilisasi pada Nanopartikel Zeolit secara Elektrokimia
Nama : Raudhatul Fadhilah NIM : G451110041
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Latifah K Darusman, MS Ketua
Prof Dr Dyah Iswantini Pradono, MScAgr Anggota
Diketahui oleh
Ketua Program Studi Kimia
Prof Dr Dra Purwantiningsih Sugita, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2012 ini ialah biosensor, dengan judul Biosensor Glukosa menggunakan Glukosa Dehidrogenase Flavin Adenin Dinukleotida yang Diimobilisasi pada Nanopartikel Zeolit secara Elektrokimia.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Latifah Kosim Darusman, MS dan Ibu Prof Dr Dyah Iswantini Pradono, MScAgr selaku komisi pembimbing, Ibu Dr Eti Rohaeti, MS selaku dosen penguji luar komisi, serta seluruh dosen Pascasarjana Kimia atas segala bimbingan dan ilmu yang diberikan. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf Laboratorium Kimia Analitik IPB (Bapak Eman, Ibu Nunung, Bapak Kosasih), Pusat Studi Biofarmaka IPB (Mbak Salina, Ibu Nunuk, Mbak Wiwik, Mas Zaim, Mas Nio, Mas Endi, Mas Feri), Laboratorium Bersama Kimia IPB (Bapak Wawan, Mas Eko), dan Laboratorium Fisika Puspitek LIPI Serpong (Bapak Agus Sukarto) yang telah membantu selama penelitian. Ungkapan terima kasih juga disampaikan kepada Pimpinan dan keluarga besar Universitas Muhammadiyah Pontianak, Direktorat Jenderal Pendidikan Tinggi (Dikti), dan Pusat Studi Biofarmaka IPB atas beasiswa dan bantuan dana penelitian dari Pendanaan Pusat Unggulan yang telah diberikan, serta kepada Bapak Dr Zaenal Abidin, MScAgr yang telah memberikan zeolit A. Tak lupa pula, ungkapan terima kasih penulis sampaikan kepada Ibu Trivadila, teman-teman Pascasarjana Kimia (Kak Titi, Qadri, Kak Ammar, Kak Budi), dan S-1 Kimia group riset biosensor (Lukman La Gia, Yuanita, Dinie) atas masukan, saran dan motivasi yang diberikan. Untuk ayah, ibu, kakakku Desi dan Erni, abangku Fadhli, adikku Nova dan Arul, keponakanku Aurellio dan Aura, dan seluruh keluarga terima kasih atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2013 Raudhatul Fadhilah
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
DAFTAR SINGKATAN DAN LAMBANG xii
1 PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 3 Hipotesis 3 2 TINJAUAN PUSTAKA 3 Biosensor 3 Glukosa Dehidrogenase 4 Imobilisasi Enzim 4 Zeolit 5 Metode Elektrokimia 6 Kinetika Enzim 7
3 BAHAN DAN METODE 7
Waktu dan Tempat Penelitian 7
Bahan dan Alat 8
Metode Penelitian 8
4 HASIL DAN PEMBAHASAN 12
Pengondisian Zeolit Alam 12
Pembuatan Nanopartikel Zeolit Alam 12
Skrining Faktor menggunakan Desain Fractional Factorial (FF) 14
Optimasi Respon menggunakan RSM 15
Imobilisasi Enzim GDH tanpa NPZ dan pada NPZ 16 Aktivitas Enzim GDH Terimobilisasi tanpa NPZ, pada NPZ dan Zeolit A 18
Parameter Kinetika Enzim 20
Limit Deteksi 25
Ketepatan Pengukuran 27
Keterulangan Pengukuran 28
Stabilitas Elektrode 29
5 SIMPULAN DAN SARAN 30
Simpulan 30
Saran 30
DAFTAR PUSTAKA 30
LAMPIRAN 35
DAFTAR TABEL
1 Output minitab estimasi pengaruh variabel bebas terhadap respon pada
elektrode enzim tanpa nanopartikel zeolit 14
2 Output minitab estimasi pengaruh variabel bebas terhadap respon pada
elektrode enzim dengan nanopartikel zeolit 14
3 Output minitab estimasi koefisien persamaan model elektrode enzim
tanpa nanopartikel zeolit 15
4 Output minitab estimasi koefisien persamaan model elektrode enzim
dengan nanopartikel zeolit 16
5 Analisis parameter kinetika 24
6 Hasil pengukuran ketepatan pengukuran 27
7 Hasil pengukuran keterulangan pengukuran 28
DAFTAR GAMBAR
1 Teknik imobilisasi enzim 5
2 Struktur zeolit A 6
3 Distribusi frekuensi ukuran nanopartikel zeolit 13
4 Kontur hubungan antara faktor dan arus 16
5 Ilustrasi model elektrode enzim (a) tanpa NPZ (b) dengan NPZ 17 6 Citra SEM (a) NPZ (b) enzim terimobilisasi pada NPZ 17 7 Citra TEM (a) NPZ (b) enzim terimobilisasi pada NPZ 18
8 Voltammogram siklik elektrode enzim 19
9 Hubungan konsentrasi substrat glukosa dan aktivitas GDH pada
elektrode enzim 21
10 Linearitas konsentrasi glukosa dan aktivitas GDH elektrode enzim 22 11 Linearitas elektrode enzim pada rentang konsentrasi 0.01 – 0.10 mM 26 12 Stabilitas elektrode enzim tanpa NPZ, dengan NPZ dan zeolit A 29
DAFTAR LAMPIRAN
1 Diagram alir penelitian 35
2 Skrining variabel bebas (faktor) pada elektrode enzim tanpa NPZ 37 3 Skrining variabel bebas (faktor) pada elektrode enzim dengan NPZ 38 4 Optimasi aktivitas enzim GDH pada elektrode enzim tanpa NPZ 39 5 Optimasi aktivitas enzim GDH pada elektrode enzim dengan NPZ 40 6 Spektrum inframerah zeolit dan enzim terimobilisasi zeolit 40
7 Nilai rata-rata puncak arus oksidasi 41
DAFTAR SINGKATAN DAN LAMBANG
SingkatanGDH Glukosa dehidrogenase i
NPZ Nanopartikel zeolit i
DM Diabetes melitus 1
WHO World Health Organization (Badan Kesehatan Dunia) 1
GOD Glukosa oksidase 1
NAD Nikotin adenin dinukleotida 1
PQQ Pyrroloquinoline quinone 1
FAD Flavin adenin dinukleotida 1
IUPAC International Union of Pure and Applied Chemistry 3
KTK Kapasitas tukar kation 8
PSA Particle size analyzer 9
FF Fractional factorial 9
RSM Response surface methodology (Metode permukaan respon) 9 AOAC Association of Official Analytical Chemists 12
PBM Planetary ball mill 12
SEM Scanning electron microscope 17
TEM Transmission electron microscope 17
FT-IR Fourier transform infrared 17
Lambang
KMapp Konstanta Michaelis Menten hasil pengukuran i
Imaxapp Arus maksimum hasil pengukuran i
RSD Relative standard deviation (standar deviasi relatif) i
Vmax Laju maksimum 7
r Koefisien korelasi 11
LD Limit deteksi 11
Kr Kesalahan relatif 11
KV Koefisien variansi 12
1 PENDAHULUAN
Latar Belakang
Diabetes melitus (DM) adalah penyakit kronis yang ditandai dengan kadar glukosa darah yang tinggi akibat pankreas tidak memproduksi insulin yang cukup atau ketika tubuh tidak dapat secara efektif menggunakan insulin yang dihasilkan. Berdasarkan data Badan Kesehatan Dunia (WHO) pada tahun 2011, 346 juta orang di seluruh dunia mengidap DM. DM dibedakan menjadi tiga. Pertama, DM tipe 1 ditandai dengan kekurangan produksi insulin dan membutuhkan konsumsi insulin harian. Penyebab DM tipe 1 belum diketahui dan belum dapat dicegah dengan pengetahuan saat ini. Kedua, DM tipe 2 merupakan akibat dari penggunaan insulin yang tidak efektif. DM tipe 2 merupakan jenis yang diderita 90% penderita DM di seluruh dunia, dan sebagian besar diakibatkan karena kelebihan berat badan dan aktivitas fisik. Ketiga, DM gestational merupakan jenis DM yang muncul saat kehamilan. Untuk Indonesia, WHO memprediksi kenaikan jumlah penderita diabetes dari 8.4 juta pada tahun 2000 menjadi sekitar 21.3 juta pada tahun 2030. Tingginya angka tersebut menjadikan Indonesia peringkat keempat jumlah penderita DM terbanyak di dunia setelah Amerika Serikat, India, dan Cina (WHO 2010). Oleh karena itu diperlukan cara untuk memantau kadar glukosa darah, salah satunya dengan biosensor.
Biosensor di dunia pertama kali dikembangkan oleh Leland Clark tahun 1956. Clark menggunakan enzim glukosa oksidase (GOD) sebagai komponen pengenal analat yang bereaksi spesifik dengan glukosa dan secara alamiah dihasilkan dari jamur Aspergillus niger. Mekanisme kerja enzim ini sangat bergantung pada keberadaan oksigen. Akibatnya, alat pengukur kadar gula dalam darah memberikan hasil yang berbeda dari individu yang sama. Hal tersebut, mendorong penggantian enzim GOD dengan enzim glukosa dehidrogenase (GDH). Enzim GDH spesifik terhadap substrat glukosa dan aktivitasnya tidak dipengaruhi oleh kadar oksigen (Monosik et al. 2012). Koenzim yang cocok untuk membuat biosensor yang tidak memerlukan O2 sebagai akseptor elektron atau nikotin adenin dinukleotida (NAD) sebagai koenzim adalah pyrroloquinoline quinone (PQQ) (Li et al. 2008) atau flavin adenin dinukleotida (FAD) (Tsujimura et al. 2006).
Pemanfaatan GDH-PQQ sebagai biosensor untuk penggunaan komersial sangatlah rumit. Hal ini berdasarkan fakta bahwa GDH-PQQ yang diisolasi dari permukaan luar membran sitoplasma memerlukan pembersih yang sesuai untuk solubilisasi dan purifikasi (Matsushita et al. 1980). Sementara itu, GDH-PQQ yang diisolasi dari dalam sel memiliki spesifitas rendah dan dapat mengoksidasi berbagai sakarida seperti manosa, maltosa, laktosa, dan gula lain sehingga menyebabkan gangguan dalam pengukuran (Igarashi dan Sode 2004). Selama 10 tahun terakhir, laporan mengenai kesalahan pembacaan kadar glukosa darah karena gangguan dari gula lain selain glukosa yang terkait dengan uji strip s GDH-PQQ mengakibatkan 13 kematian (Frias et al. 2010). Berkenaan dengan fakta-fakta tersebut pengembangan biosensor GDH dengan koenzim FAD menarik untuk dilakukan. Keunggulan GDH-FAD dibandingkan sGDH-PQQ adalah pada
2
GDH-FAD hampir tidak bereaksi dengan maltosa, xilosa, dan galaktosa (Frias et al. 2010).
Perkembangan biosensor glukosa sampai saat ini di antaranya adalah novel FAD bergantung pada GDH dengan mediator Fe(CN)63- menghasilkan sensor yang stabil dan tahan lama (1 bulan) dengan selektivitas yang tinggi (Tsujimura et al. 2006), biosensor glukosa menggunakan bakteri asal Indonesia menunjukkan bahwa E. coli yang diimobilisasi di atas permukaan elektrode pasta karbon dapat mendeteksi konsentrasi glukosa sampai 20 mM (Iswantini et al. 2011), biosensor glukosa amperometri memanfaatkan GDH-FAD yang diimobilisasi pada nanokomposit elektrode menghasilkan stabilitas yang tinggi dan tahan lama (Monosik et al. 2012).
Penelitian untuk mengembangkan biosensor glukosa yang memiliki sensitivitas dan stabilitas yang tinggi serta tahan lama terus dilakukan. Penelitian yang dilakukan Iswantini et al. (2011) menunjukkan bahwa mGDH yang dihasilkan E. coli dengan kofaktor PQQ memiliki stabilitas selama 6 jam. Setelah 6 jam, aktivitas GDH menurun menjadi 58%. Monosik et al. (2012) dalam penelitiannya menemukan bahwa kestabilan aktivitas enzim GDH bertambah ketika enzim GDH diimobilisai dengan nanokomposit elektrode. Aktivitas enzim baru menurun setelah minggu kelima menjadi 82%. Faktor kunci keberhasilan Monosik et al. (2012) mempertahankan aktivitas GDH selama 5 minggu dikarenakan penggunaan kitosan sebagai matriks pengimobilisasi enzim. Enzim diadsorpsi pada kitosan model sandwich sehingga menyediakan lingkungan yang hidrofilik yang cocok dengan enzim. Oleh karena itu pencarian material lain sebagai matriks pengimobilisasi enzim perlu dieksplorasi.
Salah satu kandidat material yang paling menjanjikan sebagai matriks pendukung adsorpsi enzim GDH adalah zeolit. Hal ini disebabkan oleh sifat zeolit yang memiliki karakteristik struktur yang unik dan tahan terhadap biodegradasi serta permukaan dapat dimodifikasi dan mudah disiapkan dengan rongga mulai dari mikro pori (< 20 Å) (Xing et al. 2000).
Penelitian tentang pemanfaatan zeolit sebagai matriks pengimobilisasi untuk sensor telah banyak dilakukan. Balal et al. (2009) melakukan modifikasi elektrode pasta karbon yang termodifikasi zeolit Y dengan mediator Fe3+ untuk mengukur dopamin dan triptofan. Hasilnya elektrode pasta karbon termodifikasi zeolit Y menghasilkan stabilitas yang cukup tinggi dengan puncak arus oksidasi dopamin dan triptofan hanya berkurang 11% setelah 24 jam Goriushkina et al. (2010) melaporkan bahwa penggunaan zeolit jenis silicalite-1 untuk imobilisasi glukosa oksidase pada biosensor amperometri dapat mempertahankan stabilitas GOD selama 16 hari. Setelah 16 hari, stabilitas GOD hanya berkurang 17%. Penelitian yang dilakukan oleh Weniarti (2011) juga menemukan bahwa penggunaan nanokomposit zeolit sebagai matriks pengimobilisasi enzim superoksida dismutase (SOD) meningkatkan sensitivitas biosensor yang ditunjukkan dengan puncak arus anodik pada enzim SOD yang diimobilisasi dengan zeolit lebih tinggi, yaitu sebesar 1.02 μA dibandingkan dengan enzim SOD tanpa imobilisasi, yaitu sebesar 0.08 μA (Trivadila 2011).
Penelitian menggunakan nanopartikel zeolit sebagai matrik imobilisasi pada biosensor GDH-FAD belum banyak dilakukan. Oleh karena itu, penelitian ini menggunakan imobilisasi enzim dengan nanopartikel zeolit sebagai material pendukung untuk biosensor GDH-FAD.
3
Tujuan Penelitian
Penelitian ini bertujuan menentukan aktivitas dan stabilitas enzim GDH yang diimobilisasi pada nanopartikel zeolit serta menentukan parameter kinetika dan keragaan analitik dengan metode elektrokimia.
.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah nanopartikel zeolit dapat digunakan sebagai matriks imobilisasi enzim GDH karena dapat meningkatkan aktivitas dan stabilitas biosensor GDH-FAD.
2 TINJAUAN PUSTAKA
Biosensor
Biosensor menurut International Union of Pure and Applied Chemistry (IUPAC) didefinisikan sebagai suatu alat yang menggunakan reaksi biokimia spesifik yang dimediasi oleh enzim, sistem kekebalan tubuh, jaringan, organel atau seluruh sel yang diisolasi untuk mendeteksi senyawa kimia oleh sinyal listrik (electrical signal), panas (thermal signal) atau optis (optical signal) (IUPAC 1997). Biosensor terdiri atas dua bagian utama, yaitu komponen pengenal hayati yang berinteraksi secara interaktif terhadap analat target dan transduser yang berfungsi mengubah respon hayati yang dihasilkan menjadi sinyal yang dapat diukur (Castilo et al. 2004). Perkembangan biosensor dibagi menjadi tiga generasi, yaitu generasi pertama, generasi kedua dan generasi ketiga. Biosensor generasi pertama melibatkan oksigen dalam pengukuran. Biosensor generasi kedua merupakan generasi biosensor yang menggunakan mediator untuk menghubungkan reaksi oksidasi substrat dengan elektrode, sedangkan biosensor generasi ketiga mulai meningkatkan integrasi mediator dengan elektrode (Liu dan Wang 2000).
Perancangan biosensor yang lebih inovatif terus dilakukan untuk menyempurnakan biosensor yang telah berkembang selama ini yang memiliki berbagai kelemahan di antaranya: (1) tidak dapat digunakan secara berulang, (2) daya variasi kurang tinggi, (3) waktu respon yang relatif rendah, (4) rentang linear sempit, (5) sensitivitas rendah dan kurang stabil, dan (6) presisi dan deteksi yang masih rendah (Wang et al. 2008).
Biosensor glukosa merupakan salah satu dari aplikasi biosensor yang berkembang dengan cepat dan telah dimanfaatkan secara komersial (Fiorito dan Torresi 2001; Castillo et al. 2004). Biosensor glukosa pertama kali dikembangkan pada tahun 1956 oleh Lend Clark. Clark menggunakan enzim GOD yang bereaksi spesifik dengan glukosa dan dapat dihasilkan secara alamiah dari jamur Aspergillus niger.
4
Glukosa Dehidrogenase
Glukosa dehidrogenase (GDH) adalah enzim yang berperan dalam reaksi oksidasi langsung glukosa membentuk asam glukonat (EBI 2005). Enzim GDH aktif dalam pengambilan atom hidrogen dari substrat (spesifik terhadap substrat glukosa) dan aktivitasnya tidak dipengaruhi kadar oksigen (Winarno 2010). Reaksinya secara umum adalah:
glukosa + penerima elektron asam glukonat + penerima elektron tereduksi (1) Reaksi oksidasi glukosa membentuk asam glukonat dengan bantuan enzim GDH merupakan jalur lain dari proses metabolisme glukosa selain jalur fosforilasi membentuk glukosa-6-fosfat. Proses reaksi oksidasi glukosa ini juga bersamaan dengan terjadinya transfer elektron ke ubiquinon oksidase melalui ubiquinon pada rantai respirasi (Elias et al. 2001).
Glukosa dehidrogenase terbagi menjadi 3 jenis berdasarkan kofaktor redoks yang digunakan, yaitu kelompok 1.1.1 EC menggunakan NAD atau nikotin adenin dinukleotida fosfat (NADP) sebagai kofaktor, kelompok 1.1.5 EC menggunakan PQQ sebagai kofaktor dan kelompok 1.1.99.10 EC menggunakan FAD sebagai kofaktor. GDH dengan menggunakan FAD sebagai kofaktor mendapat banyak perhatian karena berpotensi dalam aplikasi sensor dengan selektivitas yang tinggi (Ferri et al. 2011).
Imobilisasi Enzim
Enzim imobilisasi adalah suatu enzim yang secara fisik maupun kimia tidak bebas bergerak sehingga enzim dapat dikendalikan kapan harus kontak dengan substrat. Proses ini dapat dilakukan secara fisika maupun kimia. Cara fisika merupakan cara yang tidak melibatkan pembentukan ikatan kovalen. Cara ini umumnya revesibel, yaitu enzim dapat kembali pada keadaan aslinya. Sedangkan cara kimia merupakan cara imobilisasi enzim yang melibatkan paling sedikit satu ikatan kovalen antara dua atau lebih residu enzim yang sejenis. Cara kimia menjadikan molekul ireversibel, yaitu enzim tidak dapat kembali ke keadaan aslinya (Winarno 2010).
Keuntungan enzim yang diimobilisasi dibandingkan dengan enzim bebas adalah dapat digunakan kembali, sesuai untuk aplikasi dalam operasi yang berkesinambungan, menghasilkan produk yang bebas enzim sehingga tidak perlu dilakukan proses lebih lanjut seperti penghilangan atau penginaktifan enzim dan meningkatkan stabilitas dari aktivitas enzim. Laurinavicius et al. (2004) melakukan studi terhadap aktivitas enzim mGDH yang dimobilisasi dan tidak diimobilisasi (native enzyme). Studinya menunjukkan bahwa imobilisasi mGDH menghasilkan sifat yang sangat berbeda dari sifat native enzyme. Imobilisasi enzim meningkatkan selektivitas substrat, meningkatkan laju regenerasi pusat aktif dan laju dari pengikatan substrat mulai memberikan peran yang signifikan terhadap keseluruhan proses (Laurinavicius et al. 2004).
Enzim redoks banyak digunakan dalam biosensor elektrokimia karena enzim ini dapat menghasilkan atau menggunakan elektron dalam mengatalisis
5
suatu substrat menjadi produk (Grieshaber 2008). Ada beberapa pemasalahan yang muncul dalam penggunaan enzim dalam biosensor, yaitu: pemulihan enzim, stabilisasi enzim, selektivitas enzim dan reduksi inhibisi oleh medium atau produk. Salah satu metode yang dapat digunakan untuk menjaga kestabilan enzim adalah dengan melakukan imobilisasi enzim pada material yang berpori dan untuk meningkatkan stabilitas dapat digunakan nanomaterial (Mateo et al.2007).
Penggunaan nanomaterial (seperti karbon nanotube, nanopartikel) untuk desain perangkat biosensing merupakan pendekatan yang menarik dan baru untuk meningkatkan kinerja deteksi platform. Nanomaterial merupakan prospek yang sangat menjanjikan karena sifatnya yang unik. Karbon nanotube memiliki sifat listrik, mekanik dan struktur yang luar biasa (Wang 2005b). Nanomaterial dapat meningkatkan reaktivitas elektrokimia biomolekul dan dapat meningkatkan reaksi transfer elektron pada protein. Nanopartikel dari komposisi dan ukuran yang berbeda juga telah digunakan beberapa tahun terakhir sebagai pelacak yang sensitif dan serbaguna untuk elektronik, optik atau transduksi mikrogravimetri biomolekuler yang berbeda (Wang 2005a). Konduktivitas logam nanopartikel yang sangat baik memungkinkan untuk meningkatkan transfer elektron antara pusat redoks pada protein dan permukaan elektrode (Luo et al. 2008.; Pingarron et al. 2008). Selain itu, adsorpsi langsung enzim ke permukaan logam sering menyebabkan denaturasi protein dan hilangnya bioaktivitas yang dapat dihindari jika enzim pertama teradsorpsi ke nanopartikel sebelum elektrodeposisi pada permukaan elektrode (Liu et al. 2005). Beberapa teknik imobilisasi disajikan pada Gambar 1 berikut.
Gambar 1 Teknik imobilisasi enzim (Sassolas et al. 2012)
Zeolit
Zeolit secara harfiah berasal dari kata yunani “zein” yang berarti mendidihkan dan “lithos” yang berarti batu atau disebut juga batu mendidih (Goltardi dan Galli 1985). Zeolit adalah mineral yang terdiri atas kristal alumino silikat terhidrasi yang mengandung kation alkali atau alkali tanah dalam kerangka tiga dimensi. Zeolit biasanya ditulis dengan rumus kimia
6
Mx/n[(AlO2)x(SiO2)y.zH2O, dengan x dan y adalah bilangan bulat, y/x sebanding atau lebih besar dari 1, n adalah valensi logam M, z adalah jumlah molekul air dalam masing-masing unit, x dan y adalah masing-masing jumlah alumina dan silika (Tang 2003).
Zeolit dapat dimanfaatkan dalam elektrokimia dengan merancang berbagai modifikasi elektrode zeolit dan dapat diaplikasikan dalam bidang sensor molekul, elektrokatalisis dan elektroanalisis (Hamlaoui et al. 2008). Contoh struktur zeolit diperlihatkan pada Gambar 2 berikut.
Gambar 2 Struktur zeolit (Xinyuan 2006)
Nano zeolit merupakan senyawa yang dimanfaatkan karena peningkatan kinerja dari adanya pori yang lebih teratur. Pemanfaatan ini berdasarkan pada kemampuan molekul untuk masuk ke permukaan bagian dalam nano zeolit yang akan meningkatkan kemampuan katalitik dari zeolit tersebut. Kemampuan dari nano zeolit ini dapat ditingkatkan lagi dengan cara memodifikasi permukaan zeolit dengan beberapa gugus fungsi sehinga menjadi lebih selektif terhadap reaktan yang berinteraksi dengan permukaan (Bauer et al. 2007). Kugbe et al. (2009) melaporkan nanokomposit zeolit-geotit hasil sintesis merupakan komposit dengan sifat adsorben yang sangat baik.
Zeolit yang digunakan dalam penelitian ini adalah zeolit sintesis (zeolit A) dan zeolit alam asal Lampung. Zeolit A merupakan jenis zeolit sintesis rendah silika dengan rasio Si/Al =1. Zeolit ini merupakan isotop dari zeolit Lindan Type A yang memiliki 8 cincin dengan diameter pori 0.41 nm dan memiliki rongga berbentuk spherical dengan ukuran 1.14 nm (Chen 2001). Sedangkan zeolit alam asal Lampung merupakan jenis Klinoptilolit (Arif 2011).
Metode Elektrokimia
Elektrokimia merupakan ilmu yang mempelajari aspek elektronika dari reaksi kimia. Elektrokimia mempelajari hubungan antara reaksi kimia dan aliran listrik. Reaksi yang dimaksud adalah reaksi yang melibatkan adanya pelepasan dan penerimaan elektron atau yang dikenal dengan reaksi oksidasi dan reduksi (reaksi redoks). Terdapat 3 metode dasar yang biasa digunakan dalam analisis elektrokimia, yaitu: (1) pengukuran potensial dengan kondisi tanpa arus yang
7
mengalir, (2) pengukuran potensial dengan arus tetap, dan (3) pengukuran arus dengan potensial terkontrol (Harvey 2000). Penggunaan metode elektrokimia dalam pengoptimuman aktivitas enzim GDH (Ikeda et al. 1998) terdiri atas voltametri dan amperometri.
Voltametri merupakan metode elektroanalisis yang berdasarkan pada pengukuran arus listrik sebagai fungsi peubah potensial listrik yang diterapkan pada sel elektrolisis. Sel elektrolisis terdiri atas elektrode kerja (working electrode) yaitu elektrode tempat reaksi terjadi, elektrode bantu (auxiliary electrode) yaitu sebuah elektrode inert yang berfungsi membawa sebagian besar arus listrik dan elektrode pembanding (reference electrode) yaitu elektrode yang memiliki nilai potensial tetap. Elektrode yang digunakan dalam sistem voltametri biasanya merupakan elektrode mikro dengan tujuan untuk meningkatkan polarisasi (Brett dan Brett 1998; Monk 2001; Wang 2000).
Kinetika Enzim
Sifat enzim terimobilisasi berbeda dari enzim bebas dikarenakan adanya pengaruh dari material penyangga, matriks, perubahan konformasi enzim yang berasal dari interaksi enzim dengan material penyangga dan modifikasi kovalen dari residu asam amino. Perubahan konformasi pada struktur protein sekunder dan tersier mungkin terjadi disebabkan oleh modifikasi kovalen atau karena efek elektrostatik, ikatan hidrogen, interaksi hidrofobik dengan material penyangga.
Faktor-faktor utama yang memengaruhi aktivitas enzim adalah konsentrasi enzim, substrat, produk, senyawa (inhibitor dan aktivator), pH, dan suhu lingkungan. Sifat-sifat enzim dapat dipelajari dengan mengetahui pengaruh faktor-faktor tersebut terhadap enzim, sekaligus mengetahui lingkungan yang dapat memaksimumkan maupun menghambat aktivitas enzim (Muchtadi et al. 1992). Aktivitas spesifik dari enzim pada imobilisasi hampir menurun dan nilai laju kecepatan maksimum (V
max) substrat menjadi produk menjadi turun sedangkan KM meningkat. Untuk itu diperlukan pengukuran kinetika enzim yang terimobilisasi berupa parameter KM dan Vmax (Weniarti 2011). Nilai KM dapat digunakan dalam menentukan ukuran afinitas enzim-substrat (E-S), yang merupakan suatu indikator kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S. Nilai KM kecil berarti kompleks E-S mantap, afinitas enzim tinggi terhadap substrat, sedangkan bila KM besar berlaku kebalikannya (Fox 1991).
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Oktober 2012 sampai Juni 2013 di Laboratorium Kimia Analitik Departemen Kimia IPB, Laboratorium Bersama
8
Kimia Departemen Kimia IPB, Laboratorium Pusat Studi Biofarmaka IPB, Laboratorium Kimia Fisika Departemen Kimia IPB, Laboratorium Biofisika Departemen Fisika IPB, dan Laboratorium Puspitek Fisika LIPI Serpong.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah enzim GDH berasal dari Aspergillus sp. dengan aktivitas 1050 U/mg dibeli dari Sekisui Inggris, FADNa2.×H2O dibeli dari Sigma, aquabides, air bebas ion, NaCl, KCl, gliserol, grafit, parafin cair, D-glukosa, kalium ferisianida, larutan bufer fosfat, membran dialisis, NaOH, gas N2, amonium serium sulfat, etanol, metanol, zeolit A, dan zeolit alam asal Lampung.
Alat atau instrumen yang digunakan dalam penelitian antara lain eDAQ Potensiostat-Galvanostat (Ecorder 410) yang dilengkapi dengan perangkat lunak Echem v2.1.0 dengan sistem 3 elektrode (elektrode Ag/AgCl sebagai elektrode pembanding, elektrode pasta karbon sebagai elektrode kerja, elektrode platina sebagai elektrode bantu), sel elektrokimia, pipet mikro, Spektrofotometer Inframerah Transform Fourier (IR Prestige-21, Shimadzu), Scanning Electron Microscope, Transmission Electron Microscope (JEM-1400), Particle Size Analyzer (Delsa Nano), Planetary Ball Mill serta alat-alat gelas lainnya.
Metode Penelitian
Penelitian ini terdiri atas 6 tahap. Tahap pertama yaitu pengondisian zeolit, pembuatan nanopartikel zeolit, dan penentuan nilai kapasitas tukar kation (KTK) zeolit alam. Tahap kedua yaitu pembuatan dan karakterisasi elektrode pasta karbon. Tahap ketiga yaitu penentuan desain eksperimen. Tahap keempat, yaitu imobilisasi enzim GDH pada matriks nanopartikel zeolit dan permukaan elektrode pasta karbon. Tahap kelima, yaitu optimasi aktivitas GDH. Dan tahap keenam, yaitu penentuan parameter kinetika dan keragaan analitik meliputi: stabilitas elektrode, linearitas pengukuran, limit deteksi pengukuran, ketepatan pengukuran, dan keberulangan pengukuran. Diagram alir penelitian dicantumkan pada Lampiran 1.
Pengondisian zeolit alam (Djaeni et al. 2010)
Zeolit awalnya dihancurkan, dikeringkan, dan disaring sampai didapatkan fraksi yang diinginkan (ukuran 325 mesh). Sebanyak 200 g zeolit dicuci dengan larutan 500 mL NaOH 1 M dididihkan selama 6 jam dengan 2 kali ulangan. Sampel kemudian disaring dan dicuci dengan air deionisasi sampai pH = 7. Selanjutnya sampel dikeringkan pada suhu 60 ºC selama 12 jam. Sampel yang telah kering kemudian ditentukan kapasitas tukar kation (KTK)nya.
9
Pembuatan nanopartikel zeolit alam ( Wahyudi et al. 2010)
Zeolit yang telah dikondisikan digerus dengan alat planetary ball mill secara basah (wet milling) menggunakan metanol dan amonium serium sulfat 5% selama 10 jam. Hasil yang diperoleh kemudian diultrasonikasi selama 30 menit pada amplitudo 40% dan diukur dengan Particle Size Analyzer (PSA).
Pembuatan dan karakterisasi elektrode pasta karbon (Mirel et al. 1998)
Elektrode pasta karbon dibuat dari campuran grafit dan parafin cair 2:1. Grafit dicampur dengan parafin cair hingga membentuk pasta. Kemudian pasta karbon dimasukkan ke dalam badan elektrode hingga memadat sampai ke permukaan kaca. Permukaan kaca elektrode dihaluskan dan dibersihkan dengan ampelas dan kertas minyak. Elektrode ini selanjutnya dikarakterisasi dengan elektrolit pendukung KCl 0.10 M menggunakan teknik voltametri siklik. Pengukuran ini menggunakan elektrode pembanding Ag/AgCl dan elektrode bantu kawat platina.
Karakterisasi elektrode standar Ag/AgCl (Hattu 2009)
Elektrode standar Ag/AgCl dikualifikasi kinerjanya dengan elektrolit pendukung KCl 0.10 M menggunakan teknik voltametri siklik. Pengukuran ini menggunakan elektrode kerja emas dan elektrode bantu platina.
Desain eksperimen (Engineering 2003)
Desain eksperimen dilakukan melalui dua tahap, yaitu screening factor menggunakan desain Fractional Factorial (FF) dan optimasi menggunakan metode permukaan respon(RSM). Tahap skrining dilakukan dengan memasukkan kombinasi faktor-faktor peubah bebas yang meliputi pH (5.00–8.00), konsentrasi glukosa (5.00–35.00 mM), konsentrasi kalium ferisianida (25.00–100.00 mM), konsentrasi FADNa2.×H2O (1.00–12.00 μM), jumlah zeolit (25.00–250.00 mg) terhadap aktivitas enzim GDH pada perangkat lunak statistika Minitab 14 English dengan menggunakan 2 replikat. Selanjutnya percobaan dilakukan sesuai dengan kombinasi yang dihasilkan (Lampiran 2).
Skrining faktor bertujuan melihat faktor mana yang paling berpengaruh terhadap aktivitas enzim GDH. Setelah diperoleh faktor yang paling berpengaruh terhadap respon, dilakukan pengoptimumam respon menggunakan metode permukaan respon (RSM). Metode ini dilakukan dengan cara memasukkan kombinasi faktor-faktor peubah bebas hasil screening terhadap aktivitas enzim GDH pada perangkat lunak statistika Minitab 14 English dengan menggunakan 3 replikat. Selanjutnya percobaan dilakukan sesuai dengan kombinasi yang dihasilkan untuk memperoleh nilai aktivitas optimum (Lampiran 3).
Imobilisasi enzim GDH pada nanopartikel zeolit alam
Enzim GDH diimobilisasi dengan metode adsorpsi menggunakan nanopartikel zeolit dengan memodifikasi penelitian Salih (2012). Modifikasi yang
10
dilakukan yaitu penggantian enzim urease dengan enzim GDH. Imobilisasi enzim GDH dilakukan dengan menyiapkan 8.0 U/mL enzim GDH, gliserol (10%). Setelah itu, nanopartikel zeolit dengan komposisi tertentu dicampurkan dengan gliserol (10%) dan 1 mL larutan enzim GDH kemudian diaduk hingga homogen.
Campuran selanjunya dishaker selama 24 jam. Kemudian larutan diteteskan pada permukaan elektrode pasta karbon dan didiamkan hingga pelarutnya menguap/mengering. Selanjutnya permukaan elektrode dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektrode kemudian direndam dalam bufer fosfat pada suhu 5 ºC ketika tidak digunakan, untuk memberikan keadaan yang sama dengan lingkungan sebenarnya. Elektrode dapat langsung digunakan untuk pengukuran aktivitas GDH secara elektrokimia.
Pengukuran elektrokimia
Pengukuran elektrokimia dilakukan dengan memodifikasi penelitian Iswantini et al. (2000). Modifikasi yang dilakukan yaitu penggantian bakteri E. coli K-12 penghasil enzim GDH dengan enzim GDH, penggantian kofaktor PQQ menjadi FAD, penggantian mediator Q0 menjadi kalium ferisianida. Pengukuran elektrokimia dilakukan dengan menggunakan seperangkat alat eDAQ potensiostat-galvanostat yang dilengkapi perangkat lunak Echem v2.1.0. Elektrode yang digunakan ialah elektrode Ag/AgCl sebagai elekrode pembanding, platina sebagai elektrode bantu, dan elektrode enzim sebagai elektrode kerja.
Sebanyak 1 mL larutan bufer fosfat ditambahkan ke dalam sel elektrokimia dan puncak arus anode yang terbentuk diamati sebagai blanko. Selanjutnya, ditambahkan berturut-turut mediator (kalium ferisianida), glukosa, kofaktor (FAD) dan MgSO4. Sebelum dilakukan pengukuran, larutan dideaerasi dengan mengalirkan gas nitrogen selama ± 1 menit. Setelah penambahan setiap zat ke dalam larutan, perubahan arus yang terjadi diamati hingga mencapai arus keadaan tunak secara runut.
Penentuan parameter kinetika (Hoshino et al. 2012)
Penentuan parameter kinetika dilakukan setelah diperoleh kondisi optimum aktivitas GDH-FAD. Parameter kinetika enzim GDH yang diimobilisasi ditentukan dengan menggunakan persamaan Michaelis–Menten:
𝐼= 𝐼𝑚𝑎𝑥𝑎𝑝𝑝[𝐷−𝑔𝑙𝑢𝑘𝑜𝑠𝑎]
𝐾𝑀𝑎𝑝𝑝+[𝐷−𝑔𝑙𝑢𝑘𝑜𝑠𝑎] (1)
dengan 𝐼𝑚𝑎𝑥𝑎𝑝𝑝 adalah respon arus maksimal yang terukur (apparent), 𝐾𝑀𝑎𝑝𝑝adalah konstanta Michaelis–Menten (apparent) dan [glukosa] adalah konsentrasi D-glukosa. Persamaan Michaelis-Menten yang diperoleh dibuat turunannya, yaitu plot Lineweaver-Burk, Eadie-Hofstee dan Dixon. Prosedur pengukuran adalah sama, namun pada uji kinetika ini, konsentrasi substrat GDH divariasikan, yaitu dengan memvariasikan konsentrasi D-glukosa antara 0.00–35.00 mmol/mL.
11
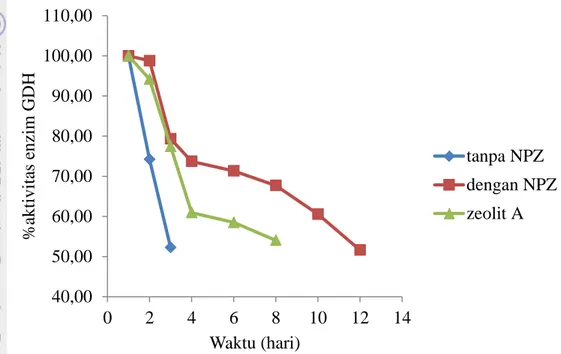
Penentuan stabilitas elektrode (Trivadilla 2006)
Stabilitas elektrode ditentukan dari pengukuran aktivitas enzim GDH setelah didapat kondisi optimum. Nilai aktivitas yang diperoleh pada pengukuran awal dianggap 100%. Aktivitas diukur ulang pada setiap waktu tertentu dan aktivitas yang tersisa.
Aktivitas enzim GDH(%) = 𝑰𝒔𝒂𝒂𝒕𝒌𝒆−𝒕(µ𝑨)
𝑰𝒔𝒂𝒂𝒕𝒂𝒘𝒂𝒍(µ𝑨)𝒙𝟏𝟎𝟎% (2)
Penentuan linearitas pengukuran (Harvey 2000)
Penentuan konsentrasi linear ditetapkan melalui pengukuran larutan standar D-glukosa pada kondisi optimum elektrode dan parameter instrumen pada berbagai rentang konsentrasi. Arus puncak yang terbaca dialurkan terhadap konsentrasi larutan standar untuk memperoleh kurva kalibrasi. Linearitas dan daerah kerja diperoleh dari interpretasi kurva kalibrasi. Konsentrasi yang memberikan hubungan linear adalah rentang konsentrasi kerja elektrode. Hubungan yang linear dinyatakan dengan koefisien korelasi (r) yang mengikuti persamaan:
𝑟= ∑𝑖[(𝑥𝑖−𝑥̅)(𝑦𝑖−𝑦 �)]
[{∑𝑖(𝑥𝑖−𝑥̅)2}{∑𝑖(𝑦𝑖−𝑦�)2}]1/2 (3) Dengan xi adalah konsentrasi larutan D-glukosa ke-i, 𝑥̅ adalah konsentrasi rata-rata larutan D-glukosa, yi adalah arus puncak yang terukur pada konsentrasi larutan D-glukosa ke-i dan 𝑦� adalah arus puncak rata-rata.
Penentuan limit deteksi pengukuran (Harvey 2000)
Limit deteksi ditentukan dengan melakukan pengukuran terhadap larutan D-glukosa dalam larutan elektrolit pendukung dengan rentang konsentrasi terkecil. Limit deteksi (LD) dihitung dengan persamaan:
𝐿𝐷 =3𝑥𝛿𝑎𝑏 (4)
Dengan 𝛿𝑎adalah simpangan baku dari intersep dan b adalah kemiringan persamaan regresi.
Penentuan ketepatan pengukuran (Ermer dan Miller 2005)
Ketepatan pengukuran ditentukan dengan melakukan pengukuran terhadap larutan glukosa dengan konsentrasi yang diketahui. Konsentrasi yang terukur dihitung menggunakan persamaan kurva kalibrasi. Selanjutnya dihitung kesalahan relatifnya menggunakan persamaan sebagai berikut:
12
Dengan ketentuan Kr adalah kesalahan relatif, xi adalah nilai hasil pengukuran dan xt adalah nilai sesungguhnya.
Sementara persen perolehan kembali ditentukan dengan persamaan berikut: 𝑝𝑒𝑟𝑠𝑒𝑛𝑝𝑒𝑟𝑜𝑙𝑒ℎ𝑎𝑛𝑘𝑒𝑚𝑏𝑎𝑙𝑖 =𝑛𝑖𝑙𝑎𝑖 𝑠𝑒𝑏𝑒𝑛𝑎𝑟𝑛𝑦𝑎𝑛𝑖𝑙𝑎𝑖 𝑡𝑒𝑟𝑢𝑘𝑢𝑟 𝑥 100% (6)
Penentuan keterulangan pengukuran (AOAC 2002)
Keterulangan pengukuran ditentukan dengan melakukan pengukuran pada larutan glukosa pada konsentrasi optimum selama 10 kali, kemudian dihitung simpangan baku (SB) menggunakan persamaan berikut:
𝑆𝐵= �∑(𝑥𝑖−𝑥̅) 2 𝑖 (𝑛−1) � 1/2 (7) Sementara persen koefisien variasi (%KV) dihitung dengan persamaan berikut:
%𝐾𝑉= 𝑆𝐵
𝑥̅ 𝑥 100% (8)
Hasil perhitungan menunjukkan kesalahan pengukuran arus.
4 HASIL DAN PEMBAHASAN
Pengondisian Zeolit Alam
Pengondisian zeolit alam bertujuan membersihkan pengotor yang terikat pada zeolit alam. Pada penelitian ini zeolit dikondisikan secara basa, kemudian ditentukan nilai KTKnya. Setelah dikondisikan secara basa terjadi peningkatan nilai KTK zeolit, yaitu dari 60.89 mek/100g menjadi 91.34 mek/100g. Hasil ini sejalan dengan penelitian yang dilakukan Arif (2011) yang menyebutkan bahwa perlakuan basa akan semakin meningkatkan nilai KTK karena dengan perlakuan basa, permukaan dari zeolit akan berubah menjadi semakin negatif. Nilai KTK yang semakin tinggi mengindikasikan zeolit semakin bersifat hidrofilik sehingga baik digunakan sebagai matriks pengimobilisasi enzim.
Pembuatan Nanopartikel Zeolit Alam (NPZ)
Nanopartikel zeolit alam (NPZ) dibuat dengan metode top down (memperkecil material yang besar secara langsung) dengan cara penggilingan menggunakan alat planetary ball mill (PBM) secara basah (wet milling) menggunakan metanol dan ammonium serium sulfat sebagai grinding agent.
13 0,0 10,0 20,0 30,0 40,0 70,0 77,3 85,4 94,3 f (%) d (nm)
Partikel yang dihasilkan dari proses penggilingan ini terlihat lebih halus dikarenakan pada proses penggilingan dengan alat PBM, sampel ditumbukkan dengan bola penggiling dalam botol penggiling yang diletakkan di atas pergerakan rotasi yang disebut dengan gaya Corioli. Perbedaan kecepatan antara bola dan botol penggiling menghasilkan interaksi antara gaya gesek dan tekan yang melepaskan energi dinamik yang tinggi. Perbedaan gaya inilah yang menghasilkan tingkat pengecilan ukuran yang tinggi dan efektif. Namun, partikel yang dihasilkan dari proses penggilingan ini masih teraglomerasi sehingga perlu diultrasonikasi agar dalam penentuan ukuran partikel diperoleh nilai yang sesungguhnya. Ultrasonikasi menghasilkan gelombang tekanan rendah dan tekanan tinggi yang saling bertukar dalam cairan, sehingga dapat memecah gumpalan dari ukuran bahan mikro dan nano (Fuchs diacu dalam Wahyudi et al. 2011). Setelah diultrasonikasi, partikel diukur menggunakan alat PSA dengan hasil disajikan pada Gambar 3 berikut.
Gambar 3 Distribusi frekuensi ukuran NPZ
Gambar 3 memperlihatkan terbentuk 4 puncak dengan ukuran diameter partikel yang berbeda-beda. Frekuensi tertinggi adalah partikel berdiameter 70.0 nm yaitu sebesar 38.7%, sementara frekuensi terendah yaitu 6.9% adalah partikel yang memiliki diameter 94.3 nm. Hal ini menunjukkan bahwa ukuran nano partikel yang terbentuk tidak seragam. Artinya, pada proses ultrasonikasi, penguraian partikel-partikel zeolit yang teraglomerasi tidak terjadi secara merata. Selain itu, disebabkan oleh keterbatasan alat PSA yang digunakan. PSA yang digunakan tidak bisa mengukur sampel berbentuk padatan, sehingga zeolit dilarutkan terlebih dahulu dalam etanol sebelum diukur, sementara zeolit merupakan padatan yang sulit terdispersi dalam pelarut sehingga hasil PSA memperlihatkan distribusi yang tidak seragam. Ukuran nanopartikel zeolit pada penelitian ini masih lebih besar jika dibandingkan dengan hasil penelitian yang diperoleh Wahyudi et al. (2010) yang berhasil mensintesis nanopartikel zeolit berdiameter sebesar 42.1 nm dengan menggunakan metode yang sama. Perbedaan hasil ini disebabkan oleh penggunaan grinding agent yang berbeda. Grinding agent merupakan material yang memiliki sifat keras dan abrasif sehingga membantu proses penggilingan menjadi lebih efektif (Varma 1991). Grinding agent yang digunakan dalam penelitian ini adalah ammonium serium sulfat, sedangkan penelitian yang dilakukan Wahyudi et al. (2010) menggunakan ammonium serium nitrat. Ammonium serium nitrat bersifat lebih keras dan
14
abrasif dibandingkan ammonium serium sulfat sehinggga proses penggilingan menggunakan ammonium serium nitrat menjadi lebih efektif.
Skrining Faktor menggunakan Desain Fractional Factorial (FF)
Desain FF digunakan untuk menskrining variabel bebas (faktor) yang berpengaruh signifikan pada respon yang dipengaruhi oleh banyak faktor. Terdapat 4 faktor yang berpengaruh dalam aktivitas enzim pada elektrode enzim tanpa NPZ, yaitu pH (X1), konsentrasi glukosa (X2), konsentrasi kalium ferisianida (X3) dan konsentrasi FAD (X4). Sedangkan, pada elektrode enzim dengan NPZ faktor yang berpengaruh dalam aktivitas enzim adalah pH (X1), konsentrasi glukosa (X2), konsentrasi ferisianida (X3), konsentrasi FAD (X4), dan konsentrasi zeolit (X5). Hasil eksperimen diolah dengan minitab dan output hasil eksperimen untuk elektrode enzim tanpa NPZ dan dengan NPZ disajikan pada Tabel 1 dan Tabel 2.
Tabel 1 Output minitab estimasi pengaruh variabel bebas terhadap respon pada elektrode enzim tanpa NPZ
S = 3.51 R-Sq = 91.87% R-Sq(adj) = 84.76%
Tabel 2 Output minitab estimasi pengaruh variabel bebas terhadap respon pada elektrode enzim dengan NPZ
S = 5.26 R-Sq = 90.80% R-Sq(adj) = 82.20%
Tabel 1 memperlihatkan bahwa faktor yang berpengaruh signifikan dalam meningkatkan respon (arus) pada elektrode enzim tanpa NPZ yang ditunjukkan dengan Pvalue < 0.05 adalah konsentrasi ferisianida (0.00) dan konsentrasi FAD (0.027). Sementara pada elektrode enzim dengan NPZ, faktor yang berpengaruh signifikan dalam meningkatkan arus adalah konsentrasi ferisianida dan konsentrasi zeolit dengan Pvalue sama-sama 0.00 (Tabel 2).
Term Coef T P Constant 12.54 14.31 0.00 X1 -1.15 -1.32 0.22 X2 1.65 1.88 0.09 X3 7.45 8.51 0.00 X4 -2.37 -2.70 0.03 Term Coef T P Constant 13.52 14.54 0.00 X1 0.63 0.67 0.51 X2 -0.01 -0.01 0.99 X3 10.07 10.83 0.00 X4 -0.001 -0.00 0.99 X5 4.59 4.93 0.00
15
Optimasi Respon menggunakan RSM.
Setelah diperoleh faktor yang berpengaruh signifikan terhadap respon, maka faktor tersebut dioptimasi menggunakan metode RSM. RSM merupakan himpunan metode-metode matematika dan statistika yang bertujuan mengoptimalkan respon (Montgomery 2001). Kelebihan dari optimasi menggunakan RSM dibandingkan dengan konvensional adalah RSM dapat mengoptimasi faktor dengan melihat hubungan antar sesama faktor dengan respon dalam waktu bersamaan. Hasil optimasi aktivitas enzim GDH pada elektrode enzim tanpa NPZ diperlihatkan pada Lampiran 4 dan Lampiran 5. Sementara output minitab estimasi koefisien persamaan model elektrode enzim tanpa NPZ ditunjukkan pada Tabel 3.
Tabel 3 Output minitab estimasi koefisien persamaan model elektrode enzim tanpa NPZ
S = 0.92 R-Sq = 94.11% R-Sq(adj) = 93.20%
Tabel 3 menunjukkan bahwa semua faktor memberikan sumbangan yang bermakna pada model dengan semua P value faktor < 0.05. Tabel 3 juga memperlihatkan nilai R2 sebesar 94.11%, yang berarti faktor-faktor dapat memprediksi respon sebesar 94.11%. Alur kontur hubungan antara berbagai faktor dan puncak arus oksidasi diperlihatkan pada Gambar 4. Alur kontur menunjukkan puncak arus oksidasi yang tertinggi pada daerah dengan warna hijau gelap ( > 20.00 µA). Puncak arus oksidasi yang dihasilkan pada alur kontur digunakan sebagai nilai awal penentuan kondisi optimum menggunakan Response Optimizer pada RSM. Analisis dengan menggunakan Response Optimizer pada minitab dan diperoleh kondisi optimum untuk kalium ferisianida adalah saat konsentrasi sebesar 100 mM dan untuk FAD saat konsentrasi sebesar 12 µM. Hasil ini sejalan dengan yang dilaporkan oleh Li et al. (2008) yang juga memperoleh konsentrasi optimum kalium ferisianida yang sama untuk biosensor GDH-PQQ. Term Coef T P Constant 8.93 37.49 0.00 X3 4.12 21.88 0.00 X4 0.41 2.16 0.04 X32 0.69 3.41 0.02 X42 X3.X4 0.72 1.26 3.56 4.72 0.01 0.00
16
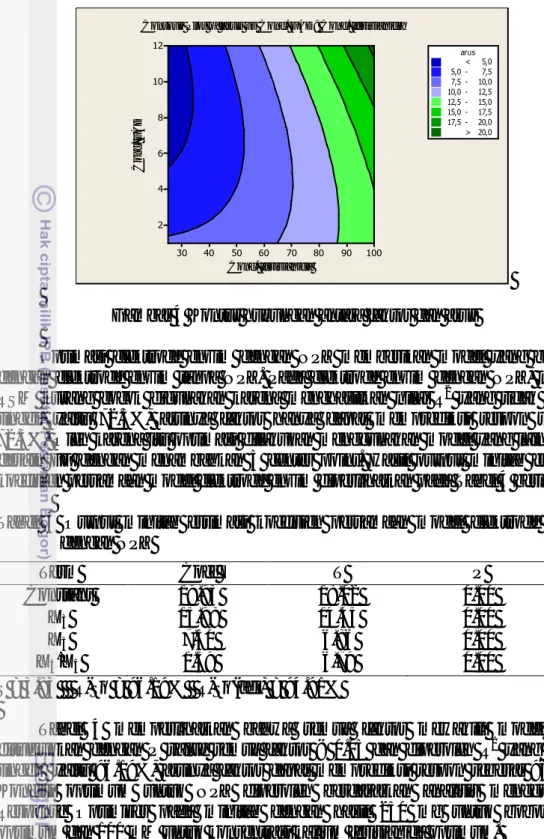
Gambar 4 Kontur hubungan antara faktor dan arus
Optimasi elektrode enzim dengan NPZ memberikan model yang berbeda dengan elektrode enzim tanpa NPZ. Pada elektrode enzim dengan NPZ, metode RSM kurang cocok digunakan karena menghasilkan nilai R2 yang tidak terlalu tinggi, yaitu 72.3%, artinya faktor hanya dapat memprediksi respon sebesar 72.3%. Oleh karena itu optimasi dilakukan menggunakan model yang lain, yaitu desain FF dengan menambahkan 5 center point. Hasil output minitab estimasi koefisien persamaan model elektrode enzim diperlihatkan pada Tabel 4 berikut. Tabel 4 Output minitab estimasi koefisien persamaan model elektrode enzim
dengan NPZ
S = 3.83 R-Sq = 96.19% R-Sq(adj)= 94.91%
Tabel 4 memperlihatkan bahwa semua faktor mewakili model yang ditunjukkan dengan P value semua faktor < 0.05 dan diperoleh R2 yang cukup tinggi yaitu 96.19%, artinya faktor dapat memprediksi respon sebesar 96.19%. Kondisi optimum untuk NPZ diperoleh berdasarkan analisis menggunakan Response Optimizer pada minitab dengan hasil 250 mg untuk bobot NPZ optimum dan 100 mM untuk konsentrasi kalium ferisianida optimum.
Imobilisasi Enzim GDH tanpa NPZ dan pada NPZ
Imobilisasi enzim bertujuan mempertahankan aktivitas dan stabilitas enzim. Imobilisasi yang dilakukan melalui dua model dengan ilustrasi sebagai berikut.
Conc. fe risianida C o n c. F A D 100 90 80 70 60 50 40 30 12 10 8 6 4 2 arus 7,5 - 10,0 10,0 - 12,5 12,5 - 15,0 15,0 - 17,5 17,5 - 20,0 < > 20,0 5,0 5,0 - 7,5
Contour Plot of arus vs Conc. FAD; Conc. fe risianida
Term Coef T P
Constant 19.93 18.02 0.00
X3 15.98 14.45 0.00
X5 7.50 6.86 0.00
17
(b)
Gambar 5 Ilustrasi model elektrode enzim (a) tanpa NPZ (b) dengan NPZ. Gambar 5a merupakan model pertama, yaitu enzim diimobilisasi pada elektrode pasta karbon tanpa NPZ dengan cara enzim diteteskan langsung di atas elektrode pasta karbon kemudian ditutup dengan membran dialisis. Pada model ini, enzim dijebak pada pasta karbon dan membran dialisis. Pasta karbon berfungsi sebagai matriks pengimobilisasi enzim, sedangkan membran dialisis berfungsi sebagai membran selektif permeabel. Sementara model kedua (Gambar 5b), enzim diimobilisasi pada NPZ dan elektrode pasta karbon. Pada model kedua ini menggabungkan dua teknik imobilisasi (adsorpsi fisik dan penjebakan), yaitu enzim diimobilisasi terlebih dahulu pada nanopartikel zeolit kemudian diteteskan pada elektrode pasta karbon dan ditutup dengan membran dialisis. Untuk mengetahui enzim telah terimobilisasi pada NPZ, dilakukan pencirian dengan menggunakan SEM (Gambar 6), TEM (Gambar 7) dan FT-IR (Lampiran 6).
Gambar 6 Citra SEM (a) NPZ dan (b) enzim terimobilisasi pada NPZ Keterangan: anak panah menunjukkan enzim
(a) (b)
Elektrode pasta karbon Membran Zeolit +δ H H H Hδ+ O O O O Cδ- -δC Elektrode pasta karbon
Membran
18
Gambar 7 Citra TEM (a) NPZ dan (b) enzim terimobilisasi pada NPZ Keterangan: anak panah menunjukkan enzim
Gambar 6a memperlihatkan permukaan NPZ sebelum diimobilisasi, sementara Gambar 7a memperlihatkan bagian lebih dalam dari NPZ sebelum diimobilisasi. Gambar 6b dan 7b sama-sama memperlihatkan bahwa enzim telah terimobilisasi ke dalam matriks NPZ yang ditandai dengan permukaan NPZ menjadi lebih kasar karena tertutupi oleh enzim.
Interpretasi spektrum inframerah (Lampiran 6) juga menunjukkan bahwa terjadi puncak baru pada bilangan gelombang 2950.37 cm-1 yang berada pada rentang bilangan gelombang untuk ikatan antara karbon dan hidrogen (C-H) (Cooke 2005). Dengan demikian enzim telah terimobilisasi pada matriks NPZ. Penelitian yang dilakukan oleh Zhou et al. (2007) juga memperlihatkan hasil morfologi kristal zeolit yang terimobilisasi enzim menggunakan TEM menunjukkan permukaan zeolit menjadi semakin tidak rata. Hal ini mengindikasikan bahwa enzim memerlukan karakteristik permukaan dan area permukaan eksternal yang luas untuk imobilisasi.
Aktivitas Enzim GDH Terimobilisasi tanpa NPZ, pada NPZ dan Zeolit A
Aktivitas enzim GDH diukur menggunakan metode voltammetri siklik. Prinsip voltammetri siklik adalah pengukuran nilai arus listrik sebagai fungsi aluran potensial, dengan potensial awal sama dengan potensial akhir. Potensial diubah secara linear dengan laju tertentu sampai suatu potensial tertentu yang memungkinkan senyawa elektroaktif yang ada di dalam sel elektrokimia mengalami reaksi oksidasi-reduksi (Wang 2000). Aktivitas yang terukur dalam bentuk arus yang besarnya sebanding dengan konsentrasi produk yang dihasilkan. Pada proses ini, elektron akan dihasilkan dari reaksi oksidasi substrat glukosa yang dikatalisis enzim GDH. Kondisi pengukuran menggunakan buffer fosfat pH =8 yang berfungsi sebagai penyedia lingkungan yang cocok untuk aktivitas maksimum enzim sekaligus sebagai elektrolit pendukung, kalium ferisianida = 100 mM sebagai mediator, FAD = 12 µM sebagai kofaktor dan MgSO4 10 mM sebagai aktivator. Kondisi pengukuran ini dipilih berdasarkan hasil optimasi menggunakan RSM (mediator dan kofaktor), sementara untuk pH dipilih
19
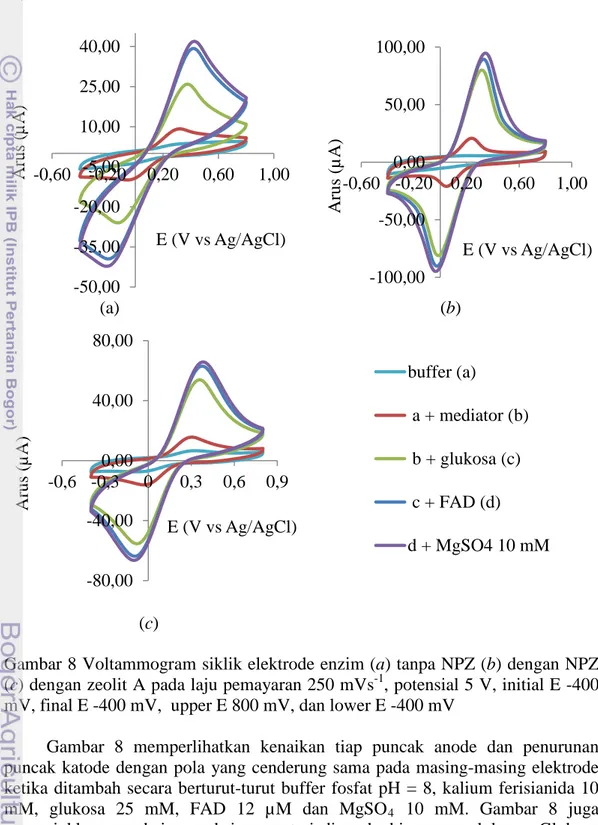
berdasarkan hasil percobaan dan untuk aktivator dipilih berdasarkan kondisi pengukuran yang dilaporkan Iswantini et al. (2011). Selanjutnya pengukuran dilakukan dengan memvariasikan konsentrasi glukosa. Berikut disajikan voltammogram siklik untuk elektrode enzim terimobilisasi pada elektrode enzim tanpa NPZ (Gambar 8a), dengan NPZ (Gambar 8b) dan dengan zeolit A (Gambar 8c).
(a) (b)
(c)
Gambar 8 Voltammogram siklik elektrode enzim (a) tanpa NPZ (b) dengan NPZ (c) dengan zeolit A pada laju pemayaran 250 mVs-1, potensial 5 V, initial E -400 mV, final E -400 mV, upper E 800 mV, dan lower E -400 mV
Gambar 8 memperlihatkan kenaikan tiap puncak anode dan penurunan puncak katode dengan pola yang cenderung sama pada masing-masing elektrode ketika ditambah secara berturut-turut buffer fosfat pH = 8, kalium ferisianida 10 mM, glukosa 25 mM, FAD 12 µM dan MgSO4 10 mM. Gambar 8 juga menunjukkan rangkaian reaksi yang terjadi pada biosensor glukosa. Glukosa dioksidasi oleh enzim GDH menghasilkan D-α-glukonolakton seperti yang ditunjukkan pada skema reaksi 9. Selanjutnya enzim GDH bentuk tereduksi akan
-50,00 -35,00 -20,00 -5,00 10,00 25,00 40,00 -0,60 -0,20 0,20 0,60 1,00 A ru s (µ A ) E (V vs Ag/AgCl) -100,00 -50,00 0,00 50,00 100,00 -0,60 -0,20 0,20 0,60 1,00 A ru s (µ A ) E (V vs Ag/AgCl) -80,00 -40,00 0,00 40,00 80,00 -0,6 -0,3 0 0,3 0,6 0,9 A ru s (µ A ) E (V vs Ag/AgCl) buffer (a) a + mediator (b) b + glukosa (c) c + FAD (d) d + MgSO4 10 mM
20
bereaksi dengan kalium ferisianida yang mengakibatkan enzim GDH kembali ke bentuk semula dan kalium ferisianida tereduksi menjadi kalium ferosianida (10). Kemudian kalium ferosianida akan teroksidasi kembali menjadi kalium ferisianida dan melepaskan elektron (11). Elektron ini sebanding dengan D-α-glukonolakton yang dihasilkan dan berperan dalam menguatkan sinyal yang terukur (Kulys 2006).
GDH(ox)+ β-D-glukosa GDH(red) + D-α-glukonolakton (9) [Fe(CN)6]3- + GDH(red) [Fe(CN)6]4- + GDH(ox) (10) [Fe(CN)6]4- [Fe(CN)6]3- + e (11) Elektrode enzim dengan NPZ (Gambar 8b) memiliki aktivitas yang paling tinggi dengan perubahan arus puncak anode (ΔIpa) sebesar 85.45 µA. Kemudian elektrode enzim dengan zeolit A (Gambar 8c) yang memiliki ΔIpa sebesar 54.29 µA dan aktivitas terendah adalah elektrode enzim tanpa NPZ (Gambar 8a) dengan nilai ΔIpa sebesar 30.89 µA. Nilai ΔIpa seluruh pengukuran dicantumkan pada Lampiran 7.
Elektrode enzim dengan NPZ dan elektrode enzim dengan zeolit A memiliki aktivitas yang lebih tinggi dibandingkan dengan elektrode enzim tanpa NPZ disebabkan oleh pada elektrode enzim dengan NPZ dan elektrode enzim dengan zeolit A, terjadi adsopsi fisik antara enzim dengan zeolit sebelum dijebak di dalam pasta karbon. Adsorpsi fisik menyebabkan aktivitas material yang lebih besar bila dibandingkan dengan jebakan yang memiliki keterbatasan dalam kinerja sensor karena kemungkinan terjadi hambatan difusi yang mengakibatkan aktivitas enzim lebih rendah (Sassolas et al. 2012). Sementara elektrode enzim dengan NPZ memiliki aktivitas yang lebih tinggi jika dibandingkan dengan elektrode enzim dengan zeolit A. Hal ini dikarenakan pada elektrode enzim dengan NPZ, menggunakan zeolit alam yang telah dibuat dalam ukuran nano. Partikel nano dapat meningkatkan laju transfer elektron menjadi lebih efisien sehingga aktivitas (respon arus) menjadi lebih tinggi (Luo et al. 2006; Pingarron et al. 2008). Selain itu pada zeolit alam kemungkinan besar masih terdapat pengotor yang umumnya merupakan oksida logam, seperti oksida kalsium, oksida besi, oksida natrium yang diduga juga berperan dalam meningkatkan arus.
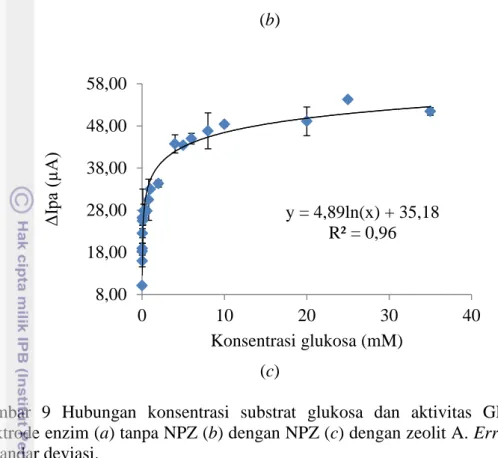
Parameter Kinetika Enzim
Pengaruh konsentrasi substrat terhadap aktivitas GDH dapat diketahui dengan mengukur aktivitas GDH dengan memvariasikan konsentrasi substrat glukosa pada rentang konsentrasi 0.00 – 35.00 mM. Gambar 9 merupakan kurva Michaelis-Menten yang menunjukkan hubungan konsentrasi glukosa dan aktivitas GDH. Reaksi yang dikatalisis oleh enzim pada berbagai variasi konsentrasi substrat mengalami 2 fase, yaitu (1) jika konsentrasi substrat masih rendah, daerah yang aktif pada enzim tidak semuanya terikat pada substrat dan (2) jika jumlah molekul substrat meningkat maka daerah yang aktif terikat seluruhnya oleh substrat dan pada saat ini enzim telah bekerja dengan kapasitas penuh (Wang 2000). Pada elektrode enzim tanpa NPZ (Gambar 9a). Ketika konsentrasi glukosa
21
di bawah 15.00 mM, reaksi berada pada fase pertama dan ketika konsentrasi glukosa mencapai 15.00 mM aktivitas GDH mulai mencapai maksimum yang artinya semua sisi aktif GDH telah terikat dengan substrat sehingga penambahan substrat yang lebih tinggi tidak memberi pengaruh yang signifikan terhadap aktivitas GDH atau dengan kata lain enzim GDH telah jenuh dengan substrat. Hal ini sedikit berbeda dengan aktivitas enzim GDH pada elektrode enzim dengan NPZ (Gambar 9b) dan elektrode enzim dengan zeolit A (Gambar 9c) yang memperlihatkan aktivitas enzim GDH mencapai keadaan jenuh saat konsentrasi glukosa secara berturut-turut sebesar 20 mM dan 10 mM.
(a) y = 3.19ln(x) + 17.96 R² = 0.96 5,00 15,00 25,00 35,00 0 10 20 30 40 ΔIp a (µ A ) Konsentrasi glukosa (mM) y = 7.34ln(x) + 51.82 R² = 0.96 17,00 37,00 57,00 77,00 97,00 0,00 10,00 20,00 30,00 40,00 ΔI pa (µ A ) Konsentrasi glukosa (mM)
22
(b)
(c)
Gambar 9 Hubungan konsentrasi substrat glukosa dan aktivitas GDH pada elektrode enzim (a) tanpa NPZ (b) dengan NPZ (c) dengan zeolit A. Error bars = ± standar deviasi.
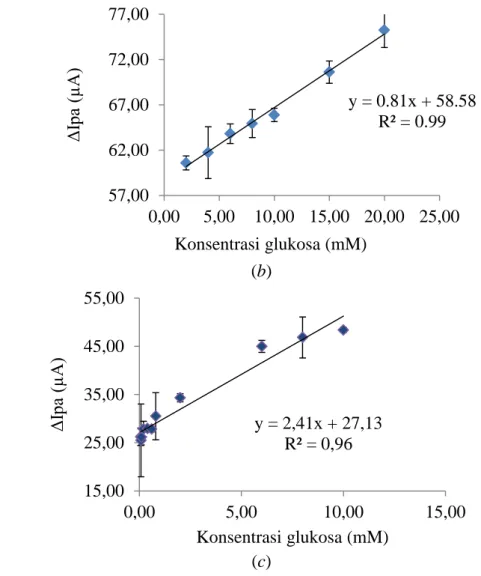
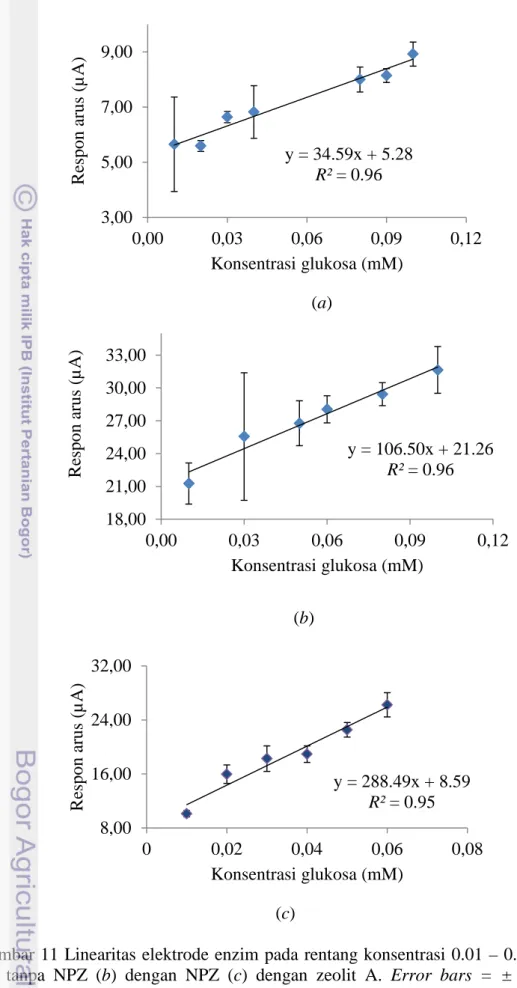
Representasi regresi non linear dari hubungan konsentrasi substrat dan aktivitas GDH (Gambar 9) memiliki kelemahan yaitu kemungkinan terjadi distorsi dari hiperbola sehingga nilai KM yang ditentukan bisa sepuluh kali lebih rendah atau sepuluh kali lebih tinggi dari nilai KMsebenarnya (Bisswanger 2002). Oleh karena itu, ditentukan daerah linear pada kurva parabola masing-masing elektrode seperti yang ditunjukkan pada Gambar 10.
(a) y = 4,89ln(x) + 35,18 R² = 0,96 8,00 18,00 28,00 38,00 48,00 58,00 0 10 20 30 40 ΔI pa (µ A ) Konsentrasi glukosa (mM) y = 0.58x + 18.26 R² = 0.95 15,00 20,00 25,00 30,00 0,00 5,00 10,00 15,00 ΔI pa (µ A ) Konsentrasi glukosa (mM)
23
(b)
(c)
Gambar 10 Linearitas konsentrasi glukosa dan aktivitas GDH elektrode enzim (a) tanpa NPZ (b) dengan NPZ (c) dengan zeolit A. Error bars = ± standar deviasi.
Daerah linear untuk elektrode enzim tanpa NPZ (Gambar 10a ), elektrode enzim dengan NPZ (Gambar 10b) dan elektrode enzim dengan zeolit A (Gambar 10c) berada pada rentang konsentrasi secara berturut-turut 1.00–15.00 mM, 2.00– 20.00 mM dan 0.06–10.00 mM. Ketiga elektrode enzim ini menghasilkan daerah linear yang berbeda-beda sehingga aplikasinya juga berbeda. Rentang konsentrasi glukosa darah normal pada manusia yaitu dari 4 sampai 6 mM (Shan et al. 2010), sehingga elektrode enzim dengan NPZ dan tanpa NPZ yang cocok digunakan dalam penentuan konsentrasi gula darah karena memiliki range yang lebar. Sementara elektrode enzim dengan zeolit A memiliki range yang lebih sempit sehingga lebih cocok diaplikasikan dalam penentuan konsentrasi gula dalam makanan atau minuman.
Analisis kinetika ditentukan melalui turunan dari kurva Michaelis-Menten dengan metode Lineweaver-Burk, Dixon, dan Eadie-Hofstee. Nilai 𝐾𝑀𝑎𝑝𝑝 dan 𝐼𝑚𝑎𝑥𝑎𝑝𝑝 masing-masing elektrode berdasarkan analisis persamaan garis dari ketiga metode dirangkum pada Tabel 5.
y = 0.81x + 58.58 R² = 0.99 57,00 62,00 67,00 72,00 77,00 0,00 5,00 10,00 15,00 20,00 25,00 ΔI pa (µ A ) Konsentrasi glukosa (mM) y = 2,41x + 27,13 R² = 0,96 15,00 25,00 35,00 45,00 55,00 0,00 5,00 10,00 15,00 ΔI pa (µ A ) Konsentrasi glukosa (mM)
24
Tabel 5 Analisis parameter kinetika
a
LB: Lineweaver-Burk, bEH: Eadie-Hofstee
Tabel 5 memperlihatkan bahwa masing-masing metode memberikan hasil parameter kinetika yang cenderung sama. Berdasarkan hasil analisis persamaan garis pada masing-masing metode (Lampiran 8), nilai koefisien determinasi (R2) dari metode Dixon lebih tinggi dibandingkan kedua metode lainnya, sehingga dapat disimpulkan bahwa kinetika mengikuti pola kinetika Dixon. Penelitian yang menggunakan metode Dixon dalam penentuan parameter kinetika dilakukan oleh Nakae dan Stoward (1995) dengan hasil KM dan Vmax enzim laktat dehidrogenase masing-masing sebesar 14.8 mM dan 46 µmol/cm3/menit. Maurer dan Fung (2000) juga menentukan parameter kinetika enzim nitrat oksida sintase berdasarkan metode Dixon dan memperoleh nilai 𝐾𝑀𝑎𝑝𝑝 sebesar 2.5 µM dan 𝐼𝑚𝑎𝑥𝑎𝑝𝑝 sebesar 3.7 pmol/menit. Karena pola kinetika mengikuti pola Dixon, maka untuk pembahasan selanjutnya, nilai 𝐾𝑀𝑎𝑝𝑝, 𝐼𝑚𝑎𝑥𝑎𝑝𝑝 dan efisiensi katalitik akan difokuskan pada metode Dixon.
Elektrode enzim dengan zeolit A memiliki 𝐾𝑀𝑎𝑝𝑝 terendah yaitu sebesar 0.33, kemudian berturut-turut elektrode enzim tanpa NPZ (0.95 mM) dan elektrode enzim dengan NPZ (1.16 mM). Nilai KM merupakan ukuran kuat atau lemahnya enzim mengikat substrat. Semakin besar nilai KM, semakin lemah enzim mengikat substrat dan semakin kecil nilai KM, semakin kuat pula enzim mengikat substrat atau semakin tinggi afinitasnya. Dengan demikian, elektrode enzim dengan zeolit A memiliki afinitas tertinggi terhadap substrat dibandingkan kedua elektrode enzim lainnya. Nilai 𝐾𝑀𝑎𝑝𝑝 ketiga elektrode enzim ini jauh lebih rendah dibandingkan nilai KM dari supplier, yaitu sebesar 50 mM. Perbedaan ini dapat terjadi dikarenakan perbedaan metode dan kondisi pengukuran. Nilai KM yang disediakan supplier diukur berdasarkan metode spektrofotometri dan dikalkulasi berdasarkan plot Eadie-Hofstee. Sedangkan pada penelitian ini, nilai 𝐾𝑀𝑎𝑝𝑝 ditentukan dengan metode pengukuran secara elektrokimia dan dikalkulasi berdasarkan plot Dixon. Penentuan KM secara elektrokimia menggunakan metode penentuan langsung dari kurva Michaelis-Menten yang dilaporkan oleh Monosik et al. (2012) juga mendapatkan nilai KM yang rendah, yaitu sebesar 3.09 mM. Nilai ini juga masih lebih tinggi jika dibandingkan dengan nilai 𝐾𝑀𝑎𝑝𝑝 ketiga elektrode enzim dalam penelitian ini.
Sementara 𝐼𝑚𝑎𝑥𝑎𝑝𝑝 tertinggi pada elektrode enzim dengan NPZ menggunakan metode Dixon yaitu sebesar 77.52 µA kemudian berturut-turut elektrode enzim Elektrode
enzim
𝐾𝑀𝑎𝑝𝑝R(mM) 𝐼𝑚𝑎𝑥
𝑎𝑝𝑝 (µA) Efisiensi katalitik (µA/mM)
LBa EHb Dixon LBa EHb Dixon LBa EHb Dixon Tanpa NPZ 0.45 0.47 0.95 25.00 25.43 27.25 55.56 54.11 28.68 Zeolit alam 1.00 1.34 1.16 100.00 100.23 77.52 100.00 74.80 66.83 Zeolit sintesis 0.33 0.04 0.30 33.33 38.07 48.54 101.00 951.75 161.80