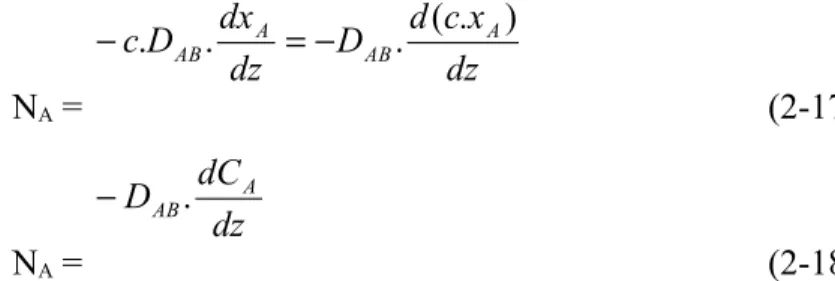Nama: Debi Anggun Sari
Alih Jenjang 2015
Tugas I
CHEMICAL ENGINEERING TOOLS
Konsep-konsep dasar yang selalu dipakai dalam penyusunan persamaan matematis dan penyelasaian masalah di bidang teknik kimia termasuk teknokimia nuklir tercakup dalam chemical engineering tools, yang meliputi:
1. Neraca massa (material balance); 2. Neraca Energi (energy balance) 3. Kesetimbangan (equilibrium)
4. Proses-proses kecepatan (rate processes) 5. Ekonomi ; dan
6. Humanitas.
Dalam praktek penyusunan persamaan-persamaan matematis, tools nomor 1 sampai dengan nomor 4 adalah yang sering digunakan.
1. Neraca massa (material balance);
Penyusunan neraca massa didasarkan pada hukum kekekalan massa yang berbunyi: Massa tidak dapat diciptakan maupun dimusnahkan atau massa itu kekal.
Bentuk yang lebih operasional dalam bidang teknik adalah:
Input – Output = Accumulation (2-1)
Bentuk tersebut juga dapat dinyatakan dalam tiap satuan waktu (rate), yaitu:
Rate of Input – Rate of Output = Rate of Accumulation (2-2)
Persamaan (2.1) dan (2.2) berlaku untuk massa total.
Jika massa terdiri atas banyak komponen, kimia, fasa, ukuran, dan sebagainya, dan tidak ada perubahan dari komponen satu menjadi komponen lain (misalnya ada reaksi kimia), maka massa masing-masing komponen juga tetap, sehinga neraca massa komponen
dapat disusun dalam bentuk seperti Persamaan (2.1) dan (2.2). Untuk sistem dengan n komponen massa, dapat disusun n persamaan neraca massa (1 neraca massa total dan n-1 neraca massa komponen atau (neraca komponen). Misalnya ada 4 komponen massa yaitu A, B, C, dan D, maka dapat disusun misalnya neraca massa total, neraca massa A, neraca massa B, dan neraca massa C. Neraca massa D tidak perlu disusun karena tidak bermanfaat.
Jika massa terdiri atas banyak komponen dan ada perubahan suatu komponen menjadi komponen lain, maka bentuk persamaan neraca massa total tetap seperti Persamaan (2.1) atau (2.2), tetapi persamaan neraca massa komponen perlu dikoreksi menjadi sebagai berikut (misalnya neraca massa untuk komponen A):
Rate of A Input – Rate of A Output +Rate of A Formation - Rate of A disappearance = Rate
of Accumulation (2-3)
Pada keadaan steady (tunak), atau keadaan sudah tidak berubah terhadap waktu lagi, akumulasi = 0.
2. Neraca energi (energy balance);
Hukum dasar penysusunan neraca energi adalah hukum kekekalan energi yaitu energi itu kekal, tidak dapat diciptakan maupun dimusnahkan, hanya dapat berubah bentuk. Salah satu bentuk operasional adalah seperti pada neraca massa serupa dengan Persamaan (2.1) dan (2.2).
Rate of energy into system – rate of energy out of system = Rate of energy accumulation (2-4)
Untuk sistem terbuka:
(Flow of internal, kinetics and potensial energy into system) – (Flow of internal, kinetics and potensial energy out of system + heat added to system by conduction, convection, radiation, and rection) – (work done by system on suroundin (shaft work + PV work) = (rate of change internal, kinetic, and potensial energy inside system) (2-5)
Bentuk-bentuk lain juga banyak, seperti Persamaan Bernoulli dalam Mekanika Fluida.
3. Kesetimbangan
Dalam bidang teknik kimia termasuk teknokimia nuklir, jenis kesetimbangan yang penting adalah kesetimbangan fasa dan kesetimbangan kimia.
Fasa I y
Fasa II x
Pada sistem kesetimbangan, ada persamaan matematis yang menghubungkan komposisi suatu fasa dengan fasa lain
a. Kesetimbangan fasa
Gambar 2.1. Kesetimbangan fasa
Sebagai contoh, pada kesetimbangan fasa uap-cair untuk sistem biner dapat didekati dengan persamaan Raoult-Dalton:
x x y ) 1 ( 1 (2-6) Pendekatan Henry yang serupa dengan koefisien distribusi pada ekstraksi, leaching, kelarutan gas dalam cairan, dan sebagainya secara umum dapat ditulis dengan:
y = Hx (2-7)
b. Kesetimbangan Kimia
Jika ada suatu reaksi kimia yang setimbang, misalnya:
aA + bB +…. ⇄ rR + sS (2-8)
Tetapan kesetimbangan konsentrasi dapat ditulis dengan:
A B ... ... S R k k K b a s r ' c (2-9)Selain tetapan kesetimbangan konsentrasi masih ada bentuk lain, misalnya aktivitas dan tekanan parsial.
4. Proses-proses Kecepatan
Proses-proses kecepatan meliputi kecepatan perpindahan panas, momentum, dan massa, banyak dipelajari dalam operasi teknik kimia, perpindahan panas, proses transfer, dan kinetika kimia.
a. Kecepatan perpindahan panas
Dalam kuliah ini hanya dibahas 2 cara perpindahan panas, yaitu konduksi dan antar fasa. Daya dorong terjadinya perpindahan panas adalah adanya beda suhu.
Kecepatan perpindahan panas konduksi
Perpindahan panas konduksi adalah perpindahan panas secara merambat dalam bahan. Dengan kata lain, perpindahan panas konduksi adalah perpindahan panas yang tidak disebabkan oleh gerak makroskopis medianya melainkan oleh gerak mikroskopis atau molekuler atau atomis medianya. Hukum yang banyak dipakai untuk perpindahan panas konduksi adalah hukum Fourier, yang dapat ditulis dengan persamaan:
Q=-kA dx dT (2-10) Atau q = -k dx dT (2-11) Dengan :
Q = perpindahan panas tiap satuan waktu; (Fluks panas) q = perpindahan panas tiap satuan waktu tiap satuan luas; A=luas permukaan transfer
T= suhu
x=jarak (posisi)
k=koefisien perpindahan panas konduksi
Nilai k tergantung pada jenis bahan, dapat tetap, dipengaruhi suhu, arah, dan lain-lain.
Perpindahan panas antar fasa
Perpindahan panas antar fasa misalnya terjadi dari benda padat yang suhunya tinggi berada di lingkungan fluida yang suhunya lebih rendah.
pad
ata
n
Gambar 2.2. Perpindahan panas antar fasa Hukum yang berlaku adalah hukum Newton:
Q = -hA(T2-T1) = hA(T1-T2) (2-12) Dengan Q = perpindahan panas tiap satuan waktu, A = luas permukaan, h = koefisien perpindahan panas.
Dalam kasus ini dibayangkan ada suatu lapisan film fluida pada permukaan padatan yang mengontrol perpindahan panas dari permukaan ke fluida. Jika luas permukaan sulit dievaluasi, persamaan (2-12) dapat diubah menjadi:
Q = -volume.h.a.(T2-T1) = hA(T1-T2) (2-13) Dengan a adalah luas persatuan volume. Dengan demikian, h.a. dapat dianggap sebagai satu kesatuan yang dapat disebut dengan koefisien perpindahan panas volumetris.
b. Perpindahan massa
Disini hanya dibahas perpindahan massa secara difusi dalam satu fasa, antar fasa satu film, dan antar fasa dua film.
Persamaan kecepatan untuk perpindahan massa A dalam medium B (difusi) didekati dengan hukum Fick:
NA = (NA+NB).xA – c.DAB. dxA/dz (2-14) dengan
NA = perpindahan massa A tiap satuan waktu tiap satuan luas. NB = perpindahan massa B tiap satuan waktu tiap satuan luas. C = konsentrasi total (A+B)
XA = fraksi mol A
DAB = difusivitas A melalui B Z = jarak (posisi)
Untuk difusi ekimolar arus berlawanan, NB = -NA sehingga persamaan (2-14) menjadi: NA = – c.DAB. dxA/dz (2-15)
Untuk difusi A melalui media B yang diam, NB = 0, persamaan (2-14) menjadi:
NA =
A
A AB x dz dx D c 1 . . (2-16)CAs NA CA solven Padatan A (dapat larut)
Untuk konsentrasi A yang kecil, maka xA0 dan c praktis tetap, sehingga persamaan (2-16) menjadi: NA = dz x c d D dz dx D c A AB A AB ) . ( . . . (2-17) NA = dz dC D A AB. (2-18) Perpindahan massa antar fasa satu film misalnya antara padatan dengan cairan atau padatan dengan gas.
Gambar 2.3. Perpindahan massa antar fasa satu film
Persamaan pendekatan makroskopis untuk peristiwa ini adalah:
NA = kc(CAs – CA) (2-19) dengan:
NA = perpindahan massa A tiap satuan waktu tiap satuan luas. CAs = konsentrasi jenuh A di larutan
CA = konsentrasi A di larutan kc = koefisien perpindahan massa.
Persamaan (2-19) kadang-kadang dinyatakan dalam bentuk:
NA = kx(xAs – xA) (2-20) NA = ky(yAs – yA) (2-21) NA = kG(pAs – pA) (2-22) dengan: yA = fraksi mol A pA = tekanan parsial A
Bila luas permukan sulit dievaluasi, dapat digunakan persamaan: ) ( As A c Av k a C C volum waktu massa N (2-23) dengan
a = luas per satuan volum
kca =koefisien perpindahan massa volumetris
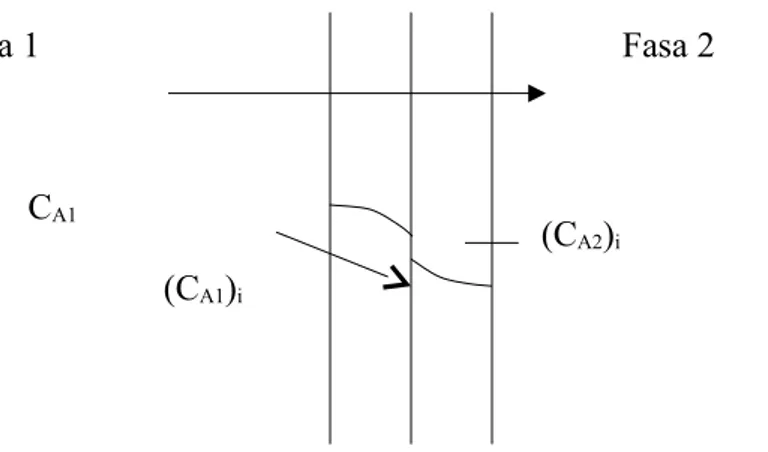
Perpindahan massa antar fasa dua film terjadi pada batas fasa cir-gas, atau cair-cair, dengan gradien konsentrasi seperti Gambar 2-4.
Gambar 2.4. Perpindahan massa antar fasa dua film
Dengan menganggap bahwa tidak ada akumulasi A pada film-film, (CA1)i setimbang dengan (CA2)i dan hubungan kesetimbangan mengikuti hukum Henry:
(CA1)i = H.(CA2)i (2-24)
Dengan demikian kecepatan perpindahan massa A dari fasa 1 ke fasa 2 dapat didekati dengan persamaan:
NA = kc1(CA1 – (CA1)i) = kc2((CA2)i – CA2) (2-25) Persamaan (2-24) sukar dipakai karena konsentrasi pada interface (CA1)i dan ((CA2)i Sukar dievaluasi/diukur. Hal ini diatasi dengan membayangkan bahwa dua film itu dapat diwakili oleh satu film yang merupakan gabungan 2 film. Film gabungan ini dapat dianggap terjadi di fasa 1 atau fasa 2.
Fasa 2 Fasa 1 CA1 (CA2)i (CA1)i CA2
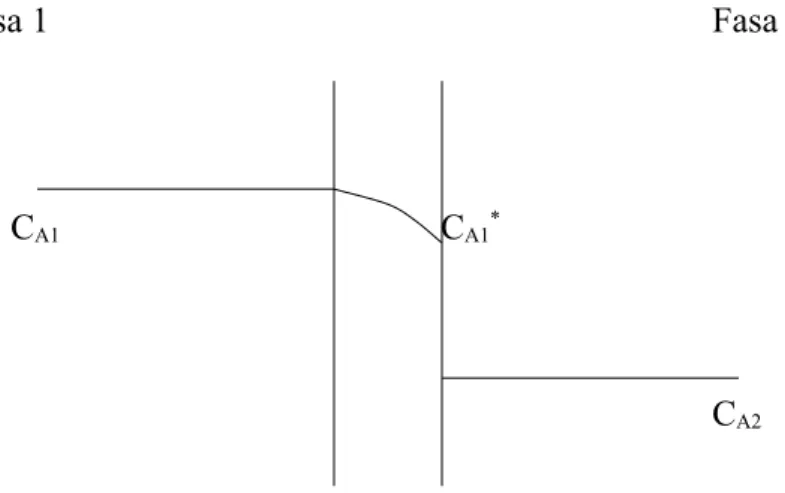
Jika film gabungan dianggap terjadi di fasa 1, gradien konsentrasi A dapat didekati dengan Gambar 2.5.
Fasa 1 Fasa 2
CA1 CA1*
CA2
Gambar 2.5. Film gabungan di fasa 1
Dalam hal ini CA1* setimbang dengan CA2 sehingga:
CA2 = H.CA1* (2-26) Dengan pendekatan itu, persamaan (2-24) dapat ditulis dengan:
NA = Kc1(CA1 – CA1*) (2-27) Dengan Kc1 adalah koefisien perpindahan massa gabungan di fasa 1.
Nilai Kc1 dapat dievaluasi dengan manipulasi matematis sebagai berikut:
CA1 – CA1* = (CA1 – (CA1)i) + ((CA1)i- CA1*) (2-28) CA1 – CA1* = (CA1 – (CA1)i) + (1/H)((CA2)i- CA2) (2-29) 2 1 1 1 c A c A c A k N H k N K N (2-30) 2 1 1 1 1 1 c c c k Hk K (2-31)
Jika film gabungan dianggap terjadi di fasa 2, maka gradien konsentrasi A dapat dilihat pada Gambar 2.6. Fasa 1 CA1 fasa 2 CA2* CA2
Gambar 2.6. Film gabungan di fasa 2
Dengan cara yang sama, diperoleh:
NA = Kc2.( CA2* - CA2) (2-32) CA2* = H. CA1 (2-33) 2 1 2 1 1 c c c k Hk H K (2-34)
Jika luas perpindahan sulit dievaluasi, dapat digunakan kecepatan perpindahan massa volumetris. ) ( * 1 1a C CA1 K volum waktu massa NAv c A = Kc2.(CA2* - C2) (2-35) c. Perpindahan momentum
Perpindahan momentum biasanya menggunakan hukum Newton
d. Kinetika Kimia/kecepatan reaksi
Untuk reaksi elementer
aA + bB C (2-37)
Kecepatan berkuranganya A
-rA = kCAa.CBb (2-38)
Kecepatan reaksi juga dapat dilihat sebagai kecepatan pembentukan produk, sehingga nilainya positif.
Dengan k adalah konstante kecepatan reaksi = f(T) = Ae-E/RT (2-39)
Disamping chemical engineering tools di atas, seringkali masih diperlukan persamaan lain yang berkaitan dengan fenomena yang ditinjau, misalnya persamaan keadaan.
Persamaan keadaan yang sering digunakan:
Entalpi cairan = h = Cp.T (2-40) Entalpi gas/uap = H = Cp.T + .W (2-41)
= f (T) (2-42)
Cp = f (T) = a + bT + cT2 (2-43) PV = nRT; n/V = P/RT; = MP/RT (2-44)
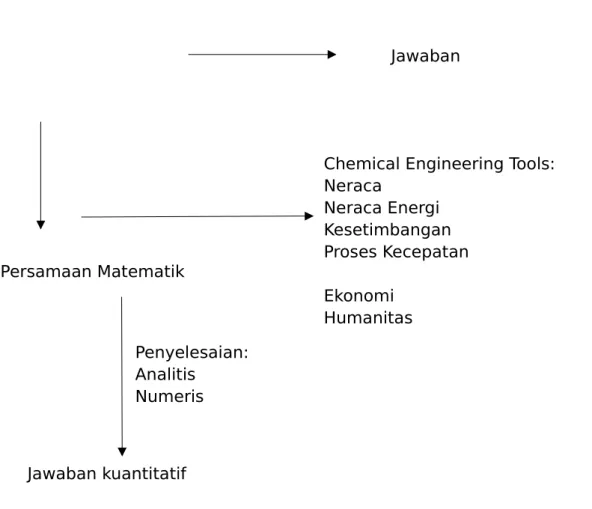
Jawaban
Persamaan Matematik
Chemical Engineering Tools: Neraca Neraca Energi Kesetimbangan Proses Kecepatan Ekonomi Humanitas Jawaban kuantitatif Penyelesaian: Analitis Numeris
Pengembangan model dari fenomena fisis dapat digambarkan dalam bagan Gambar 2.7 berikut.
Gambar 2.7. Pengembangan model dari fenomena fisis
Contoh 2.1.
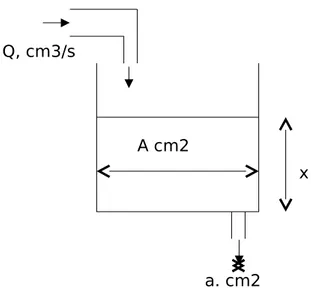
Tangki luas permukaan A cm2 mula-mula kosong diisi cairan dengan kecepatan Q cm3/detik dibagian bawah tangki terdapat lubang kecil dengan luas a cm2 tentukan: (a) permukaan cairan setelah t detik (b) Tinggi maksimum permukaan cairan.
Penyelesaian:
Q, cm3/s x Ingin dicari: hubungan x dengan t x maksimum A cm2 a. cm2
Gambar 2.8. Visualisasi contoh 2.1
Neraca massa air dalam tangki: Pada interval waktu tertentu
Massa air masuk – massa air ke luar = bertambahnya massa air dalam tangki Input – Output = Accumulation
Berdasarkan rate (peninjauan sesaat):
Kecepatan massa air masuk – kecepatan massa air keluar = kecepatan bertambahnya massa air dalam tangki
Rate of input – rate of output = rate of accumulation. a. Interval waktu t
Input – Output = Accumulation
Q.. t - a.û. .. t = A. x. x/ t = Q/A - a/A. û t 0 û = U Lim U A a A Q t x t 0 U A a A Q dt dx
gx A a A Q dt dx 2 Keadaan batas: t=0; x=0 ] 2 [ 2 x g a Q g A a dt dx
t t x x x dt g A a x g Q dx 0 0 2 2 2 x = ….. Latihan/PR:Suatu tangki mula-mula berisi air murni sebanyak Mo kg air murni. Mulai suatu saat air garam dengan kecepatan F kg/jam dengan kadar garam Co kg garam/kg larutan dimasukkan ke dalam tangki dan L kg/jam dikeluarkan dari tangki. Carilah hubungan kadar garam dalam tangki dengan waktu. Jika F=200, L=100, Co = 0,1, dan Mo= 1000, hitunglah kadar garam dalam tangki tepat setelah 1 jam.
Dik :
m air = 1000 kg
t= 0 , konsentrasi input (Ci) = massa garam : massa larutan : 0.1 kg garam : 1 kg larutan = 1 : 10 = 10 %
Q in = 200 kg/jam out Q out = 100 kg/jam
Dit :
Konsentrasi keluaran per jam (Co/jam) ?
Neraca massa air dalam tangki: Pada interval waktu tertentu
Massa air masuk – massa air ke luar = bertambahnya massa air dalam tangki Input – Output = Accumulation
Kecepatan massa air masuk – kecepatan massa air keluar = kecepatan bertambahnya massa air dalam tangki
Rate of input – rate of output = rate of accumulation.
Rate of Accumulation = Qin – Q out = (200 – 100) kg/jam = 100 kg/jam
Interval waktu t
Input – Output = Accumulation t = 0 , air :
90% Qin - Co . Qout = 100% m air
90% . 200 - Co . 100 = 100% 1000 180 – 100 Co = 1000
100 Co = 180 – 1000
10% Qin . t - Co . Qout . t = 100% m air x/ t = Q/A - a/A. Û Q.. t - a.û. .. t = A. x. x/ t = Q/A - a/A. û t 0 û = U Lim U A a A Q t x t 0 U A a A Q dt dx gx A a A Q dt dx 2
Q, cm3/s x Ingin dicari: hubungan x dengan t x maksimum A cm2 a. cm2 diketahui: V0 = 100liter Fi = 20ml/detik Ci=10gram/ml Fo= 5 ml/detik persamaan = V=100+15 t 1/15 ln [(100+15t)/100] = -1/20 ln [(200-20C)/200] C itu konsentrasi..dan t itu waktu...