JURUSAN TEKNOLOGI PRODUKSI DAN INDUSTRI SUB JURUSAN TEKNIL PRODUKSI DAN HAYATI
INSTITUT TEKNOLOGI SUMATERA
POTENSIOMETRI
Oleh :
Dikri Uzlifah Janah 120280074 Lingga Ayu Amelia 120280072
Syifa Az-Zahra 120280076
Dikumpulkan kepada : Desi Riana Saputri, S.Si, M.T
Devita Amelia, S.T, M.T Aldillah Herlambang, S.T, M.Eng
Yusril Mahendra Simbolon
TK 2101
URUSAN TEKNOLOGI PRODUKSI DAN INDUSTRI SUB JURUSAN TEKNIL PRODUKSI DAN HAYATI
INSTITUT TEKNOLOGI SUMATERA
Ganjil 2021
1
2 Potensiometri
Abstrak
Pada praktikum kali ini mengenai percobaan potensiometri yang bertujuan untuk menentukan titik akhir dari reaksi netralisasi dengan menggunakan alat berupa potensiometer dan indikator. Pada praktikum ini larutan Na3PO4 digunakan sebagai titrat dan HCl sebagai titran. Untuk percobaan pertama mengenai preparasi larutan Na3PO4 0,5 N sebanyak 250 ml dan diperoleh massa sebesar 6,83 gr. Kemudian untuk percobaan selanjutnya untuk menentukan titik akhir reaksi netralisasi Na3PO4 dengan HCl serta indikator. Larutan Na3PO4 dituangkan kedalam empat tabung Erlenmeyer yang kemudian akan ditambahkan indikator PP pada tabung Erlenmeyer I dan II serta Erlenmeyer III dan IV ditambahakan indikator metil merah. Lalu titrasi dengan HCl hingga mengalami perubahan warna, untuk volume yang digunakan sebesar 10 ml. volume larutan peniter pada Erlenmeyer I dan II sebesar 0,35 ml dan untuk Erlenmeyer III dan IV sebesar 7,2 ml dan 4,4 ml. pada percobaan untuk menentukan titrasi akhir reaksi netralisasi dengan alat potensiometer dilakukan dengan penambahan elektroda.
Larutan Na3PO4 ditambahkan dengan akuades ±½ volume gelas beaker kemudian ditambahkan elektroda. Selanjutnya hitung PH dan potensialnya. Setelah diperoleh PH dan potensialnya, lalu tambahkan HCl hingga mencapai PH ± 2,0.
Untuk setiap penambahan HCl hitung PH dan potensialnya kembali. Pada volume HCl 0, 2, 3, 5, 6 ml diperoleh PH sebesar 7,8; 3,3; 3; 2,8; 2,7. Setelah dilakukan percobaan didapat kesimpuln bahwa terjadinya perubahan warna disebabkan oleh tercapainya titik akhir serta penambahan indikator. Jika nilai E menurun maka PH akan menurun juga seiring dengan penambahan HCl. Adapun rekomendasi dari praktikum kali ini yaitu praktikan harus benar-benar memehami materi pada modul dengan baik serta berhati-hati dalam melakukan percobaan.
Kata kunci : indikator, potensiometri, PH meter, titran, titrasi
3 Daftar Isi
I. Pendahuluan ... 5
II. Tinjauan Pustaka ... 5
III. Metode... 7
3.1 Alat ... 7
3.2 Bahan ... 7
3.3 Bagan Alir Percobaan ... 8
3.4 Metode Percobaan ... 10
IV. Hasil dan Pembahasan ... 11
4.1 Hasil ... 11
4.2 Pembahasan ... 14
V. Kesimpulan/Rekomendasi ... 15
5.1 Kesimpulan ... 15
5.2 Rekomendasi ... 15
VI. Daftar Pustaka ... 16
VII. Lampiran ... 17
7.1 Lampiran A ... 17
7.2 Lampiran B ... 19
7.3 Lampiran C ... 21
7.5 Lampiran D ... 22
7.5 Lampiran E ... 62
4 Daftar Tabel dan Gambar
Tabel ... 17
Tabel 1 ... 17
Tabel 2 ... 19
Gambar ... 17
Gambar 1 ... 17
Gambar 2 ... 19
Gambar 3 ... 17
Gambar 4 ... 19
Gambar 5 ... 17
Gambar 6 ... 19
Gambar 7 ... 17
5 Potensiometri
I. Pendahuluan
Sebagian besar metode analitik didasari pada sifat-sifat elektrokimia larutan. Metode analitik elektrokimia didasarkan pada signal-signal listrik yang timbul sebagai hasil interaksi antara materi dengan listrik baik berupa potensial maupun hantaran listrik. Pengukuran kuantitatif dalam kimia analitik secara umum dibedakan menjadi potensiometri (potensialsel) dan voltametri (arus sel).
Dalam praktikum kali ini, pengukuran kuantitatif kimia analitik yang akan dilakukan adalah potensiometri. Potensiometri saat ini merupakan metode elektroanalitis yang akan terus dikembangkan. Pada sistem potensiometri biasanya selalu menghubungkan dengan ion yang bermuatan. Larutan-larutan yang mengandung ion - ion akan menghantarkan listrik yang biasa disebut larutan elektrolit. Larutan elektrolit dibagi menjadi larutan elektrolit nyala dan larutan elektrolit potensial.
Metode analitik didasari sifat-sifat elektrokimia larutoa, jika pada suatu elektrolit dicelupkan dua buah elektroda kemudian dihubungkan dengan rangkaian listrik luar, maka arus akan mengalir melalui larutan bila suatu baterai di letakkan pada rangkaian luar atou system elektrolit dengan kedua elektradanya sebagai suatu sel akan berperan sebagai sumber energi dan akan menghasilkan arus yang akan mengalir ke rangkaian luar.
Dalam titrasi manual potensial diukur sekelah penambahan tiap tetes berurutan dari titran dan hasil pengamatan digambarkan pada suatu kertas grafik pada volume titran untuk diperoleh kurva titrasi. Dalam banyak hal, suatu potensiometer sederhana dapat digunakan, akan tetapi jika tersangkut elektroda gelas, seperti dalam kebanyakan titrasi asam basa suatu peralatan pengukur dengan impendansi masukan tinggi diperlukan adanya suatu tahanan tinggi seperti pH meter khusus.
II. Tinjauan Pustaka
Suatu eksperimen dapat diukur dengan menggunakan dua metode yaitu potensial langsung dan titrasi langsung potensial langsung merupakan pengukuran tunggal terhadap potensial dari suatu aktivitas ion yang diamati seperti yang diterapkan dalam pengukuran pH larutan air sedangkan titrasi langsung yaitu proses titrasi ion dan pengukuran potensial ion sebagai fungsi volume titran potensial sel diukur sehingga dapat digunakan untuk menentukan titik ekuivalen suatu potensial sel Galvani bergantung pada aktivitas spesies ion tertentu dalam larutan sel pengukuran potensial sel menjadi penting dalam banyak analisis kimia (Basset, J., dkk., 1994).
Potensiometri adalah metode analisa kimia untuk menentukan potensial listrik dengan menggunakan elektroda dan alat yang digunakan adalah alat potensiometer. potensiometri merupakan aplikasi langsung dari persamaan Nernst dengan cara pengukuran potensial dua elektroda tidak terpolarisasi pada kondisi arus nol. persamaan Nernst memberikan hubungan antara potensial relatif suatu
6 elektroda dan konsentrasi spesies ionik nya yang sesuai dengan larutan. Dengan pengukuran reversibel suatu elektroda, maka perhitungan aktivitas atau konsentrasi suatu komponen dapat dilakukan (Underwood, 1980).
Persamaan yang digunakan dalam percobaan adalah persamaan Nernst : E = E° + (RT/nF) ln a Mn+
Penjelasannya:
E = potensial elektroda standar yang konstan dengan logam R = tetapan gas (1 atm/mol.K)
T = temperatur mutlak (K) F = tetapan faraday n = valendi ion
a Mn+ = aktivitas ion dengan larutan
Prinsip dari potensiometri didasarkan pada pengukuran potensial listrik antara elektroda indikator dengan elektroda pembanding yang dicelupkan pada suatu larutan. untuk mengukur potensial pada elektroda indikator harus digunakan elektroda standar yang berfungsi sebagai pembanding yang mempunyai harga potensial tetap selama pengukuran (Gandjar dan Rohman, 2007).
Perbedaan potensial antara elektroda dan larutan pada sistem setengah sel seringkali disebut sebagai potensial elektroda dan untuk membandingkan nilai untuk semua potensial elektrode suatu sistem sel dipakai dengan menggunakan proses reaksi reduksi dari logamnya, M dan ion nya Mn+, jika dituliskan reaksi umumnya adalah :
Mn+(aq) + ne M (s) (Suyanta, 2013) Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan mempunyai kenaikan yang tajam di sekitar kesetaraan. dari grafik itu dapat diperkirakan titrasi akhir. ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi. misalnya dalam hal larutan keruh atau bila daerah kesetaraan sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indicator (Rivai, 1995).
Keuntungan dari metode potensiometri adalah biayanya yang relatif murah dan sederhana. dan elektroda jauh lebih murah daripada instrumen scientific yang paling modern, potensial saat dibaca tidak ada arus yang mengalir dalam larutan.
potensial potensial yang stabil sering diperoleh dengan cukup cepat dan tegangan yang cukup mudah dicatat sebagai fungsi waktu, sehingga potensiometri kadang juga bermanfaat untuk pemantauan yang kontinu dan tidak diawasi (Skoog, 1998). Salah satu kekurangan dalam pengukuran potensiometri adalah nilai potensial yang diukur dapat berubah secara reversibel terhadap kereaktifan dan ion tertentu (Muldel, 1996).
Aplikasi di bidang industri antara lain adalah untuk penentuan sulfat dengan surfaktan modified zeolit carbon paste electrode (SCZ-CPE) Sebagai adsorben untuk adsorpsi kation Cu2+, anion SO42- dan warna amonia metal merah.
Potensiometri juga digunakan dalam penentuan karbon organik total tanah dengan mengubah senyawa senyawa karbon menjadi CO2 (Abdul Haris dan Bukhori, 2000).
7 III. Metode
Pada percobaan praktikum kali ini mengenai penentuan titik akhir titrasi larutan natrium fosfat dengan larutan asam klorida dengan menggunakan indikator dan secara potensiometri. Persamaan yang digunakan dalam percobaan potensiometri adalah persamaan Nernst :
E = E° + (RT/nF) ln a Mn+
Penjelasannya:
E = potensial elektroda standar yang konstan dengan logam R = tetapan gas (1 atm/mol.K)
T = temperatur mutlak (K) F = tetapan faraday n = valendi ion
a Mn+ = aktivitas ion dengan larutan
3.1 Alat
Adapun alat-alat yang digunakan dalam praktikum potensiometri ini adalah :
a. Batang pengaduk i. Magnetic stirrer
b. Beakerglass j. Neraca analitik
c. Buret k. pH meter
d. Botol akuades l. Pipet ball
e. Erlenmeyer m. Pipet tetes
f. Corong n. Pipet volume
g. Gelas arloji o. Statif dan klem
h. Labu ukur p. Termometer
3.2 Bahan
Sedangkan untuk bahan yang digunakan dalam praktum potensiometri ini adalah :
a. Akuades (H2O) b. Asam klorida (HCl)
c. Indikator metal merah (C15H15H3O5) d. Indikator phenolphthalein (PP) e. Natrium fosfat (Na3PO4)
8 3.3 Bagan Alir Percobaan
3.3.1 Preparasi Larutan
3.3.2 Menentukan Titik Akhir Reaksi Netralisasi Larutan Natrium Fosfat Dengan Laurtan Asam Klorida Menggukanan Indikator
Mulai
Siapkan larutan Na3PO4 0,2 N 400 ml
Siapkan luratan HCl 0,5 N 250 ml
Selesai
Mulai
10 ml Na3PO4
Erlenmetyer 1 Erlenmeyer 2 Erlenmeyer 3 Erlenmeyer 4
2 tetes indikator MM 2 tetes indikator PP
Kocok hingga homogen
Titrasi dengan HCl
Pink Tidak
berwarna/kuning
Amati dan catat hasilnya
Selesai
9 3.3.3 Menentukan Titik Akhir Reaksi Netralisasi Larutan Natrium Fosfat
Dengan Larutan Asam Klorida Secara Potensiometri
Mulai
Hidupkan pH meter
Atur jarum petunjuk skala 10
Tambahkan 10 ml Na3PO4
Tambahkan akuades
Aduk menggunakan magnetic stirrer
Masukkan elektroda
Tentukan pH dan potensial
Ukur pH dan potensial
Tambahkan 1 ml HCl hingga pH ± 2,0
Selesai Tambahkan 1 ml HCl
10 3.4 Metode Percobaan
Pada percobaan pertama yaitu mengenai preparasi larutan dengan membuat larutan natrium fosfat 0,2 N sebanyak 100 ml. Lalu larutan asam klorida 0,5 N sebanyak 200 ml.
Pada percobaan ke-2 mengenai penentuan titik akhir reaksi netralisasi Larutan natrium fosfat dengan larutan asam klorida menggunakan indikator. Pada percobaan ini bertujuan untuk melihat perubahan warna yang terjadi. Terdapat empat buah Erlenmeyer yang telah diteteskan 10 ml larutan natrium fosfat. Untuk selanjutnya tabung Erlenmeyer 1 dan 2 ditambahkan 2 tetes indikator pp sedangkan Erlenmeyer 3 dan 4 ditambahkan 2 tetes indikator metil merah, kemudian kocok sampai homogen. Setelah itu titrasi dengan larutan HCl dan diperoleh perubahan warna bening pada erlenmeyer 1 dan 2 serta warna merah muda pada Erlenmeyer 3 dan 4.
Untuk percobaan terakhir mengenai penentuan titik akhir reaksi netralisasi Larutan natrium fosfat dengan larutan asam klorida menggunakan indikator untuk melihat pH larutan dan potensial nya. PH meter yang akan digunakan setelah disetel dengan skala 10 dengan larutan buffer. Kemudian masukan 10 ml larutan Na3PO4 ke dalam gelas beker 250 ml Dan tambahkan aquades volume ±
½ dari volume gelas beker, lalu aduk hingga homogen. Setelah itu masukkan elektroda. Tentukan pH dan juga potensialnya. selanjutnya tambahkan larutan HCl 1 ml melalui buret, setelah beberapa menit hitung kembali pH serta potensialnya. Lalu tambahkan HCL hingga larutan dengan pH ± 2,0.
11 IV. Hasil dan Pembahasan
4.1 Hasil
4.1.1 Titik Akhir Netralisasi dengan Indikator
4.1.1.1 Data Pengamatan Titik Akhir Netralisasi dengan Indikator Tabel 1. Data Pengamatan Titik Akhir Netralisasi dengan Indikator
Keterangan
PP MM
I II III IV
Volume larutan yang dititrasi (mL) 10 10 10 10
Volume larutan peniter (mL) 0,3 0,3 7,4 4,4
4.1.1.2 Gambar Perubahan Warna
4.1.1.2.1 Perubahan Warna menggunakan Indikator Metil Merah
Gambar 1. Perubahan Warna menggunakan Indikator Metil Merah 4.1.1.2.2 Perubahan Warna menggunakan Indikator Phenolphtalein
Gambar 2. Perubahan Warna menggunakan Indikator Phenolphtalein
12 4.1.2 Titik Akhir Netralisasi secara Potensiometri
4.1.2.1 Data Pengamatan Titik Akhir Netralisasi secara Potensiometri Tabel 2. Data Pengamatan Titik Akhir Reaksi Netralisasi Secara
Potensiometri
No. V HCl
(mL) E (Volt) E/V ∆E/∆V ∆^2E/∆^2V pH
1 0 0,61098 0 0 0 7,8
2 2 0,34503 0,172515 0,132975 0,0176824 3,3 3 3 0,3273 0,1091 0,01773 0,000314353 3 4 5 0,31548 0,063096 0,00591 0,0000349 2,8 5 6 0,30957 0,05195 0,00591 0,0000349 2,7 4.1.2.2 Grafik Hubungan
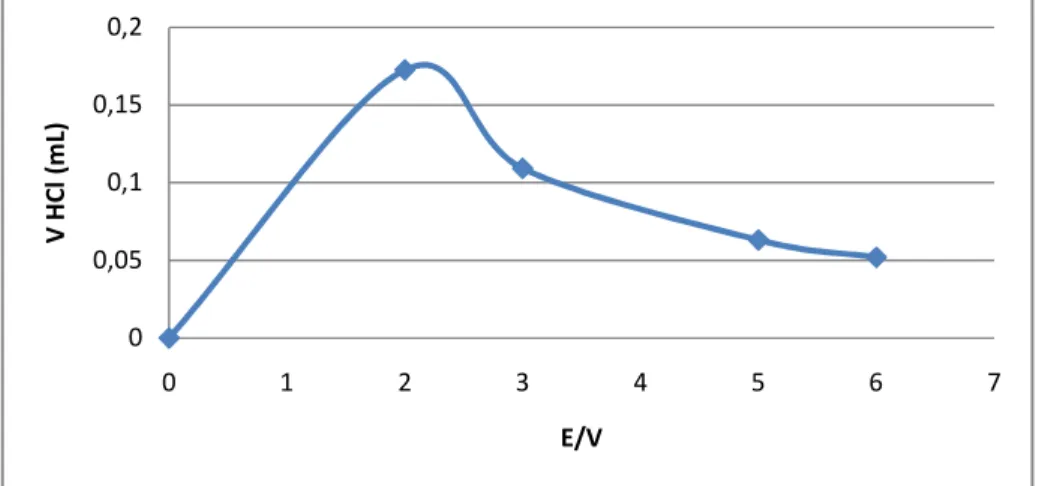
4.1.2.2.1 Hubungan V HCl dengan E (Volt)
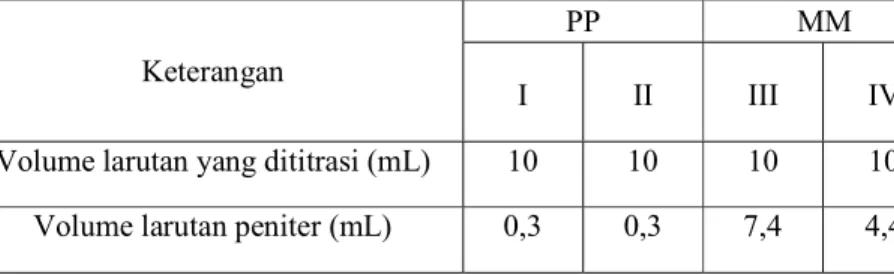
Gambar 3. Hubungan V HCl dengan E (Volt) 4.1.2.2.2 Hubungan V HCl dengan E/V
Gambar 4. Hubungan V HCl dengan E/V 0
0,2 0,4 0,6 0,8
0 1 2 3 4 5 6 7
V HCl (mL)
E (Volt)
0 0,05 0,1 0,15 0,2
0 1 2 3 4 5 6 7
V HCl (mL)
E/V
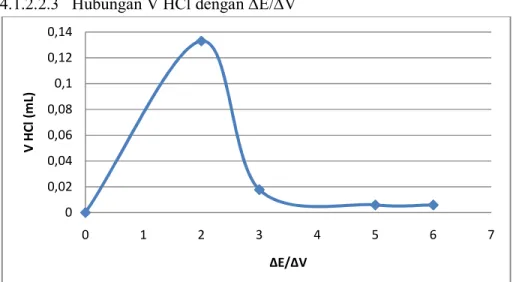
13 4.1.2.2.3 Hubungan V HCl dengan ∆E/∆V
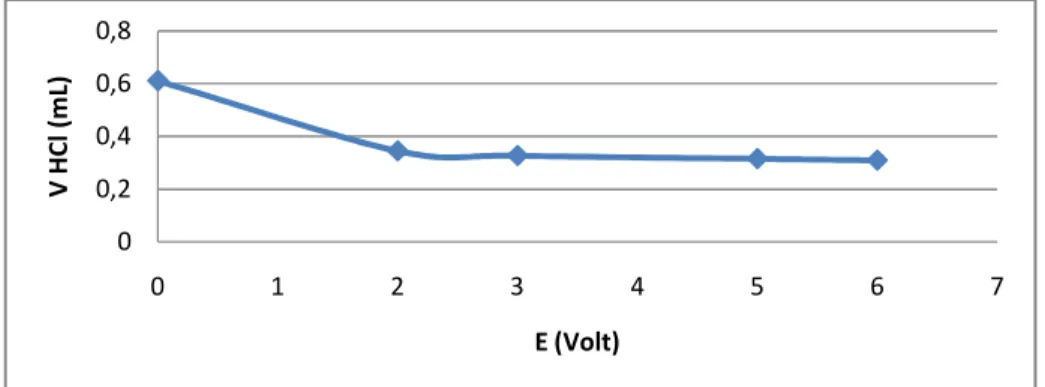
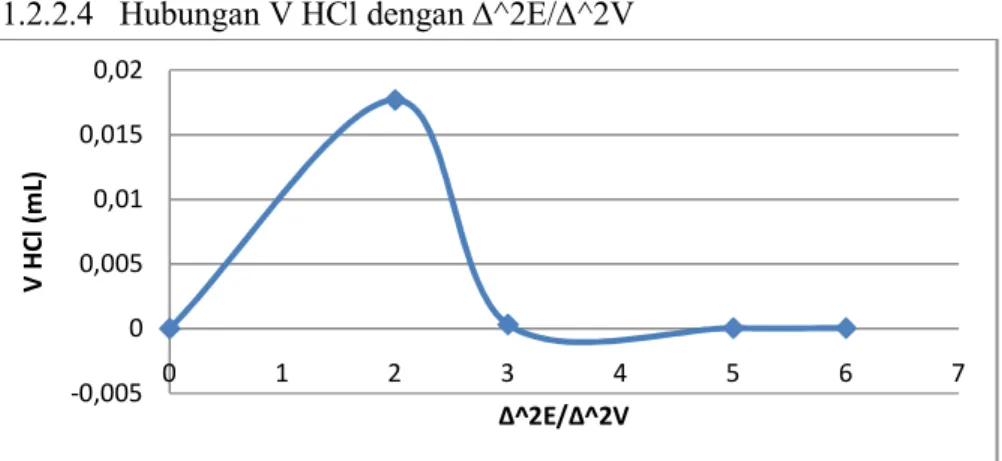
Gambar 5. Hubungan V HCl dengan ∆E/∆V 4.1.2.2.4 Hubungan V HCl dengan ∆^2E/∆^2V
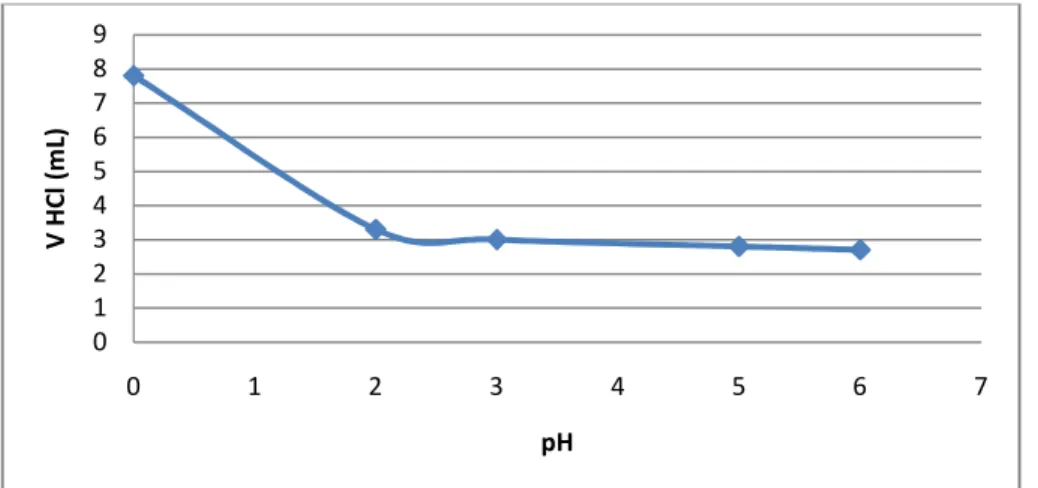
Gambar 6. Hubungan V HCl dengan ∆^2E/∆^2V 4.1.2.2.5 Hubungan V HCl dengan pH
Gambar 7. Hubungan V HCl dengan pH 0
0,02 0,04 0,06 0,08 0,1 0,12 0,14
0 1 2 3 4 5 6 7
V HCl (mL)
∆E/∆V
-0,005 0 0,005 0,01 0,015 0,02
0 1 2 3 4 5 6 7
V HCl (mL)
∆^2E/∆^2V
0 1 2 3 4 5 6 7 8 9
0 1 2 3 4 5 6 7
V HCl (mL)
pH
14 4.2 Pembahasan
Reaksi netralisasi indikator adalah reaksi asam basa hingga mencapai titik ekuivalen dengan bahasa yang digunakan. untuk indikator yang digunakan kali ini adalah indikator PP untuk basa dengan pH 8,3 hingga 10,5 dimana sesuai dengan larutan Na3PO4 yang bersifat basa serta dititrasi dengan HCl yang bersifat asam. Sehingga menunjukkan hasil perubahan warna yang awalnya merah muda menjadi tidak berwarna (bening). Selanjutnya dengan menggunakan indikator metil merah dengan pH 4,4 hingga 6,2 di mana Na3PO4 yang bersifat basa dititrasi dengan HCl terjadi perubahan warna yang semula tidak berwarna (bening) menjadi merah muda.
Pada tabel 4.1.1.1 diperoleh volume larutan pada tabung Erlenmeyer PP 1 dan 2 sebesar 0,3 mL dan pada tabung Erlenmeyer MM 3 dan 4 sebesar 7,2 mL dan 4,4 mL. Pada tabel 4.1.2.1 tentang penentuan titik akhir reaksi netralisasi secara potensiometri. setelah melakukan perhitungan diperoleh kesimpulan bahwa volume HCl yang ditambahkan akan berbanding terbalik terhadap nilai pH.
Dimana jika volume HCl semakin tinggi nilainya maka pH akan semakin menurun. Begitu juga dengan volume HCl akan berbanding terbalik dengan nilai E, di mana jika nilai E semakin kecil maka volume HCl akan meningkat sehingga dapat ditarik kesimpulan bahwa larutan akan semakin asam jika terus ditambahkan dengan HCl. Jadi beda potensial (E) akan berbanding lurus nilainya dengan pH, di mana ketika E menurun maka PH juga akan menurun jika ditambahkan HCl terus menerus.
Pada grafik telah menunjukkan terjadi reaksi netralisasi yang ditandai dengan menurunnya grafik pada nilai pH untuk setiap penambahan volume HCl.
untuk titrasi pH mengalami penurunan hingga mendekati pH 2,0, penurunan ini yang disebut sebagai titik ekuivalen atau titik akhir netralisasi. Pada grafik hubungan antara volume HCl dengan ∆E/∆V Dapat ditarik kesimpulan bahwa grafik turun dan naik tergantung dengan nilai awal potensialnya sedangkan pada grafik hubungan volume HCl dengan ∆^2E/∆^2V mengalami kenaikan dan penurunan yang cukup drastis serta kenaikan yang teratur. Serta untuk grafik hubungan volume HCl dengan E/V mengalami kenaikan yang cukup drastis dan penurunan yang teratur.
15 V. Kesimpulan/Rekomendasi
5.1 Kesimpulan
Kesimpulan dari percobaan ini yaitu :
1. Penambahan indikator PP digunakan untuk mengetahui perubahan warna apa yang terjadi pada larutan yang awalnya berwarna menjadi tidak berwarna.
2. Penambahan indikator Metil Merah digunakan untuk mengetahui perubahan warna apa yang terjadi pada larutan yang awalnya tidak berwarna menjadi berwarna.
3. Cara lain untuk mengetahui pH dari hasil titrasi bisa memakai perhitungan atau dengan metode pengukur pH meter.
5.2 Rekomendasi
Adapun rekomendasi yang dapat dilakukan pada praktikum adalah : 1. Setiap praktikan yang akan melakukan percobaan ini, diharapkan
memakai perlengkapan APD. Seperti jas lab, masker, sarung tangan dan lain lain. Untuk menghindari bahaya yang ada dilabratorium.
2. Praktikan mengetahui semua tanda tanda (MSDS) dari setiap bahan kimia yang ada dilaboratorium untuk menghindari bahan bahan yang berbahaya dilaboratorium.
3. Selanjutnya praktikan diharapkan dapat melakukan percobaan dengan teliti agar memperoleh data yang akurat.
16 VI. Daftar Pustaka
A.L, Underwood,. R.A. Day. 1980. Quantitative Analysis. 4th Edition. Prentice- Hall. Inc. 393-395.
Abdul Haris dan Bukhori. 2000. Studi Aplikasi Metode Potensiometri Pada Penentuan Kandungan Karbon Organik Total Tanah. Jurnal Matematika
& Sains. FMIPA ITB
Basset, J., dkk. 1994. Buku Ajar Vogel:Kimia Analisis Kuantitatif Anorganik Terjemahan A. Hadyana Pudjaatmaka dan L. Setiono, Penerbit Buku Kedokteran EGC, Jakarta.
Dr. Suyanta, M.Si. 2013. Potensiometri. UNY Press, Cetakan pertama, Yogyakarta.
Gandjar, I. G. dan Rohman, A., 2007, Kimia Farmasi Analisis, Pustaka Pelajar, Yogyakarta.
Muldel. M. 1996. Basic Prinsiple Of Membrane Technologiy. Kluer Academic University.
Rivai Harrizul. 1995. Asas Pemeriksaan Kimia. Universitas Indonesia (UI Press).
Skoog, 1998, Principles of Instrumental Analysis, Fifth Edition, Sounders Colleges Publishing, USA.
17 VII. Lampiran
7.1 Lampiran A
A. Perhitungan Preparasi Larutan
1. Larutan HCl 0,5 N 250 ml Dik : N HCl = 0,5 N
V = 250 ml = 0,25 L Mr = 36,46 gr/mol Dit : massa = ?
Jawab : 𝑁 = 𝑚 𝑥 𝑒
𝑚𝑟𝑥 𝑣 0,5 = 𝑔𝑟 𝑥 1
36,46𝑥 0,25 𝐺𝑟 = 4,5575 𝑔𝑟
2. Larutan Na3PO4 0,2 N 400 ml Dik : N Na3PO4 = 0,2 N
V = 100 ml
Mr = 164
Dit : massa = ? Jawab :
𝑁 = 𝑚 𝑥 𝑒 𝑀𝑟𝑥 𝑣 0,2 = 𝑚 𝑥 3
164𝑥 0,1 𝑚 (𝑔𝑟) = 3,28
3 = 1,093 𝑔𝑟
18 B. Perhitunganpengamatanpenentuantitikakhirreaksinetralisasi
19 7.2 Lampiran B
1. Buatlah larutan Na3PO4 (fase solid) 0,5 N sebanyak 250 ml ! Jawab :
Dik : N Na3PO4 : 0,5 N V Na3PO4 : 250 ml Dit : Gr Na3PO4 : ? Penyelesaian :
𝑁 = 𝑔𝑟
𝐵𝐸𝑥1000
𝑉 𝐵𝐸 = 𝑀𝑟
𝑣𝑎𝑙𝑒𝑛𝑠𝑖 =164
3 = 54,66 0,5 = 𝑔𝑟
54,66𝑥1000 250 0,5 = 1000 𝑔𝑟
13.665 6.832,5 = 1000 𝑔𝑟
𝐺𝑟 =6.832,5 1000 𝐺𝑟 = 6,8325 2. Setarakan reaksi Na3PO4 danHCl !
Jawab : NaPO4 + HCl Na3Cl + HPO4
3. Buat larutan HCl 0,2 N sebanyak 100 mL, jika kadar HCl adalah liquid dan kadar yang tersedia 32%. Hitunglah volume HCl yang dibutuhkan dan setarakan dengan massa HCl yang dibutuhkan. Dik massa jenis HCl 1,2 gr/ml.
Jawab :
Dik : N = 0,2 N M = N/e = 0,2/1 = 0,2 N
V = 100 ml % = 32%
e = 1 HCl H+ +Cl- 𝜌 = 1,2 gr/ml
20 Dit : V HCl (liquid) = ?
Penyelesaian :
𝑀𝑎𝑠𝑠𝑎 𝐻𝐶𝑙 𝑑𝑎𝑙𝑎𝑚 32% = 𝜌 . 𝑉 𝑥 %
= 32
100𝑥 1,2𝑔𝑟 𝑚𝑙
= 0,384 𝑔
𝑚𝑜𝑙 0,384 𝑔𝑟 = 1 𝑚𝑙 1 𝑔𝑟 = ? 𝑚𝑙
1 𝑔𝑟 𝐻𝐶𝑙 = 1
0,384= 2,604 𝑚𝑙 𝑉 = 0,1 𝐿
𝑀𝑟 𝐻𝐶𝑙 = 36,46 𝑔𝑟 𝑚𝑜𝑙
𝑛 = 𝑀 𝑥 𝑉
= 0,2 𝑥 0,1 𝑛 = 0,02 𝑚𝑜𝑙
𝑚𝑎𝑠𝑠𝑎 = 𝑚𝑜𝑙 (𝑛) 𝑥 𝑀𝑟 𝑚𝑎𝑠𝑠𝑎 = 0,02 𝑚𝑜𝑙 𝑥 36,46 𝑔
𝑚𝑜𝑙 𝑚𝑎𝑠𝑠𝑎 = 0,729 𝑔𝑟 𝐻𝐶𝑙
𝑚𝑎𝑘𝑎 ∶ 1 𝑔𝑟
2,604𝑚𝑙 = 0,729𝑔𝑟 𝑉 𝐻𝐶𝑙
𝑉 𝐻𝐶𝑙 = 1,9 𝑔𝑟 𝑚
21 7.3 Lampiran C