LAPORAN
PRAKTIKUM DASAR TEKNIK KIMIA 1 (HKKK 217)
PERCOBAAN 3 ANALISA GRAVIMETRI
DOSEN PEMBIMBING: RINNY JELITA, ST., M. Eng.
DISUSUN OLEH : KELOMPOK XI (SEBELAS)
MUHAMMAD ADAM A. (1910814210017) RIDHAYANTI MU’MINAH (1910814220022) SELMA NOVITA SARI (1910814320011)
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS LAMBUNG MANGKURAT
FAKULTAS TEKNIK
PROGRAM STUDI S-1 TEKNIK KIMIA BANJARBARU
2020
analit dari zat lain dengan metode pengendapan. hasil setelah bahan yang dianalisa direaksikan.
Hasil dari reaksi tersebut biasanya berupa endapan yang dibentuk dari bahan yang dianalisa.
Tujuan dari percobaan ini adalah menentukan berat endapan BaSO4 dan kadar (%) Ba2+ dari hasil BaCl2 dan H2SO4. Percobaan ini dilakukan dengan metode pengendapan BaCl2 yang diencerkan dan dipanaskan hingga mendidih. Sebelum dilakukan pemanasan, ditambahkan HCl sebanyak 2 tetes. Selanjutnya dilakukan penambahan larutan H2SO4 dengan cara meneteskan sedikit demi sedikit sambil diaduk hingga terjadi perubahan warna. Larutan didinginkan hingga terbentuk endapan. Endapan disaring menggunakan kertas saring lalu dipijarkan di oven dan didinginkan di dalam desikator. Langkah terakhir dilakukan penimbangan dan perhitungan berat endapan. Dari hasil percobaan diperoleh Massa endapan BaSO4 sebesar 1,2069 gram dan kadar Ba2+ yang ada dalam endapan sebesar 58,1382%.
Kata kunci: BaCl2, H2SO4, metode pengendapan
III-i
PERCOBAAN 3 ANALISA GRAVIMETRI
3.1 PENDAHULUAN
3.1.1 Tujuan Percobaan
Tujuan percobaan ini adalah menentukan berat endapan BaSO4 dan kadar (%) Ba2+ dari hasil BaCl2 dan H2SO4.
3.1.2 Latar Belakang
Analisa gravimetri adalah analisa kuantitatif di mana kadar komponen analitnya ditetapkan berdasarkan pemisahan dan penimbangan bahan. Kelebihan yang dimiliki analisa gravimetri adalah penyusun zat yang telah diisolasi, selain itu dapat diseleksi terhadap ada atau tidaknya zat pengotor dan diadakannya koreksi. Bagian terbesar analisa gravimetri menyangkut perubahan unsur atau gugus dari senyawa yang dianalisis menjadi senyawa lain.
Pemisahan unsur-unsur atau senyawa yang dikandung dilakukan dengan beberapa cara, yaitu metode pengendapan, metode penguapan, metode elektroanalisis, atau berbagai macam metode lainnya. Tahapan dalam analisa gravimetri, yaitu memilih pelarut sampel, memanaskan larutan sampai mendidih, mengendapkan zat terlarut, menyaring larutan, menimbang endapan serta melakukan pencucian dengan bersih.
Aplikasi gravimetri di dunia industri biasanya digunakan dalam penentuan kalor suatu unsur. Misalnya, penentuan kadar emas (Au) dari hasil pertambangan, penentuan kadar air dalam biji-bijian, minyak goreng, minyak bumi, dan gas alam (penentuan fraksi minyak), elektrogravimetri, dan thermal gravimetri. Ketika mempelajari tentang analisa gravimetri, diharapkan nantinya praktikan dapat menghasilkan prinsip-prinsip dari analisa gravimetri sehingga dapat mendukung kerja sebagai engineer.
III-1
meliputi transformasi unsur atau radikal ke senyawa murni stabil yang dapat segera diubah menjadi bentuk yang dapat ditimbang dengan teliti. Berat unsur dihitung berdasarkan rumus senyawa dan berat atom unsur yang menyusunnya.
Pemisahan unsur-unsur yang dikandung dilakukan dengan beberapa cara, seperti metode pengendapan, metode penguapan, metode elektroanalisis atau berbagai metode lainnya. Metode gravimetri memakan waktu cukup lama, adanya pengotor pada konstituen dapat diuji atau bila perlu faktor-faktor koneksi dapat digunakan (Khopkar, 2003).
Agar memperoleh keberhasilan pada analisis secara gravimetri, maka harus memperhatikan tia hal berikut (Wiryawan, 2008):
1. Unsur atau senyawa yang ditentukan harus diendapkan secara sempurna.
2. Bentuk endapan yang ditimbang harus diketahui dengan pasti rumus molekulnya.
3. Endapan yang diperoleh harus murni dan mudah ditimbang.
Proses penyaringan dalam analisa gravimetri melewati beberapa tahapan.
Tujuan dari penyaringan adalah memisahkan coprecipitation dari endapan BaSO4, sehingga berfungsi juga untuk pemurnian. Penyaringan dilakukan dengan menggunakan kertas saring whatman 40 yaitu kertas saring bebas abu agar setelah pemijaran, endapan yang diperoleh berupa garam sulfat murni (Charan, 2011).
Tujuan mencuci endapan adalah menghilangkan kontaminasi pada permukaan. Komposisi laporan pencuci tergantung pada kecenderunganya yang kuat dan harus mengandung ion sejenis dengan endapan untuk mengurangi kelarutan endapan. Larutan tersebut juga harus mudah menguap agar mudah untuk menimbang endapannya. Reagen R biasanya ditambahkan secara berlebihan untuk mengetahui kelarutan endapan. Larutan pencuci dibagi 3 kelompok sebagai berikut (Khopkar, 2003):
III-2
III-3
a) Larutan yang mencegah terbentuknya koloid yang mengakibatkan dapat lewat kertas saring, misalnya penggunaan amonium nitrat untuk mencuci endapan fenol hodroksida.
b) Larutan yang mengurangi kelarutan dari endapan, misalnya alkohol.
c) Larutan yang dapat mencegah hidrolisis garam dari asam lemah atau basa lemah.
Umumnya, metode-metode gravimetri tidaklah sangat khas (spesifik) seperti yang telah disebutkan tadi, beberapa ahli kimia pernah memikirkan bahwa pada akhirnya harus mempunyai suatu pengendapan spesifik untuk tiap kation.
Sementara hal ini tidak lagi diharapkan, reagensi gravimetri bersifat sangat selektif yaitu dalam arti mereka membentuk endapan hanya dengan kelompok- kelompok ion tertentu. Keselektifan zat pengendapan dapat ditingkatkan dengan mengendalikan faktor-faktor semacam pH dan konsentrasi zat-zat penompang tertentu (Underwood, 1998).
Faktor-faktor yang menentukan analisis dengan pengendapan yang berhasil sebagai berikut (Basset, 1994):
1) Endapan harus begitu tidak dapat larut sehingga akan terjadi kehilangan yang berarti bila endapan disaring dengan penyaringnya. Pada praktik ini biasanya berarti bahwa larutan tidak melampaui jumlah minimum yang terdeteksi oleh neraca analitik yaitu 0,1 mg.
2) Sifat fisika endapan harus sedemikian rupa sehingga endapn dapat dengan mudah dipisahkan dari larutan dengan penyaring dan dapat dicuci sampai bebas dari zat pengotor yang larut. Kondisi ini menentukan bahwa partikelnya berukuran bermacam-macam sehingga tidak lolos melalui medium penyaringan dan ukuran partikel tidak dipengaruhi (tidak berkurang oleh proses pencucian).
3) Endapan harus dapat diubah menjadi suatu zat yang murni dengan komposisi kimia tertentu, ini dapat dicapai dengan operasi-operasi kimia yang sederhana, seperti penguapan bersama cairan yang sesuai.
Pereaksi organik yang digunakan pada analisa gravimetri dikenal sebagai endapan organik. Pemisahan satu atau lebih ion-ion organik dari campurannya
dilakukan dengan menambahkan pereaksi organik karena senyawa-senyawa organik tersebut mempunyai berat molekul yang besar maka dapat ditentukan dengan sejumlah kecil ion dengan pembentukan endapan dalam jumlah yang besar. Endapan organik yang baik harus mempunyai sifat spesifik. Endapan yang terbentuk oleh pereaksi organik dikeringkan atau dibakar dan ditimbang sebagai oksidannya. Selektivitas (pemilihan) optimum reaksi tercapai dengan mengawasi variabel-variabel seperti konsentrasi pereaksi pH larutan dan penggunaan reagen pelindung untuk mengurangi gangguan ion-ion asing. Pereaksi organik yang banyak digunakan adalah pereaksi pembentuk khelat. Apabila menginginkan polifungsional dapat menempati lebih dari dua posisi koordinasi ion pusat logam, maka terbentuk senyawa koordinasi dengan struktur cincin yang disebut sebagai khelat (Khopkar, 2003).
Suatu metode gravimetri untuk analisis biasanya didasarkan pada suatu reaksi kimia seperti berikut:
Aa + rR AaRr ...(3.1)
dimana a molekul analit A bereaksi dengan r molekul reagennya R. Produknya yakni AaRr biasanya merupakan suatu substansi bersifat sedikit larut dan dapat menjadi senyawa lain yang komposisinya diketahui untuk kemudian ditimbang.
Sebagai contoh, kalsium bisa ditetapkan secara gravimetri melalui pengendapan kalsium oksalat dan pembakaran oksalat menjadi kalsium oksida. Berikut adalah reaksinya (Underwood, 1998) :
Ca2+ + C2O42- CaC2O4(s) ...(3.2)
CaC2O4(s) CaO(s) + O2(q) + CO(s) ....(3.3)
Tujuan utama dari reaksi pengendapan adalah untuk memisahkan suatu fase padat murni dalam bentuk yang seragam, rapat, dan dapat disaring dengan mudah. Pentingnya derajat keadaan lewat jenuh yang kecil telah sejak lama dipahami dan karena alasan inilah larutan zat pengendap encer ditambahkan perlahan-perlahan dari suatu reaksi homogen. Zat pengendap tidak ditambahkan sebagai zat pengendapan itu sendiri, melainkan perlahan-lahan dari suatu reaksi
III-5
homogen di dalam larutan itu. Oleh karena itu, endapan dibentuk pada kondisi yang tidak mengandung akan terelakkan terkait dengan proses pengendapan konvensional. Endapan akan rapat dan mudah disaring, kopresipitasi berkurang sampai minimum. Terlebih lagi dengan mengubah-ubah reaksi yang membentuk zat pengendap dalam larutan homogen itu adalah untuk mengubah lebih lanjut penampilan fisik endapan apabila reaksi berlangsung lambat, (umumnya) akan semakin besar kristal-kristal yang terbentuk (Svehla, 2004).
Biasanya endapan yang didapat mengandung anait bersama dengan unsur lain. Berat analit dapatditentukan dengan faktor gravimetri (Kurnaen, 2004):
Faktor gravimetri = Ar senyawa ditentukan
Mr senyawa bentuk ditimbang ...(3.4) Faktor gravimetri didefinisikan sebagai jumlah berat analit 1 gram berat endapan. Hasil kali dari berat endapan R dengan faktor gravimetri sama dengan besar analit (Kurnaen, 2014):
Besar analit A = Besar endapan R × faktor graimetri ×100 % Berat sampel
...(3.5) Asam Klorida atau yang biasa disebut HCL memiliki sifat fisika dan kimia seperti (Science Staff, 2014):
Nama bahan : Asam Klorida Rumus molekul : HCl
Bentuk fisik : Berwujud cair (fluida) dan tidak berwarna Tekanan uap : 1 mmhg
Titik didih : 145,8 °C
pH : < 1
Densitas : 1,1 g/cm3 pada suhu
Penenganan dan penyimpanan asam klorida yaitu dengan menyimpan asam klorida ditempat yang dingin, kering, serta mempunyai ventilasi yang baik, dan jauh dari material yang tidak cocok.
Barium Klorida (BaCl2) memiliki nama produk Barium Klorida didhidrat dengan rumus kimia BaCl2 . 2H2O yang merupakan senyawa yang berbahaya bila terhirup dan akan menjadi toksik bila tertelan. Sifat fisika dan kimia BaCl2 adalah sebagai berikut (Smart Lab, 2017):
Nama bahan : Barium Klorida Rumus molekul : BaCl2.2H2O Massa molar : 208,23 g/mol Bentuk fisik : Serbuk putih Titik didih : 1560 °C
pH : 5,2-8,0
asam sulfat atau H2SO asam kuat yang mudah larut dalam air dingin, stabil, dan tidak berbau. Sifat-sifat H2SO4 (Northeastern, 2009):
Nama bahan : Asam Sulfat Rumus molekul : H2SO4
Bentuk fisik : cair dan tidak berwarna Berat molekul : 98,08 gr/mol
Titik didih : 276 °C Titik leleh : -29,5 °C Titik beku : -15 °C
pH : 0,3
Perak nitrat meripakan senyawa anorganik dengan rumus kimia AgNO3
Sifat fisika dan kimia dari AgNO3 adalah sebagai berikut (Carlroth, 2018):
Nama bahan : Perak nitrat Rumus molekul : AgNO3
Bentuk fisik : Berwujud padat (kristalin), tidak berwarna dan berbau Titik didih : 440 oC
Titik beku : 210 oC Densitas : 4,35 g/Cm3
III-7
Ph : 4-6 pada suhu 20 ̊ oC
Cara untuk menentukan jumlah zat salah satunya dengan menggunakan cara evolusi. Caranya dapat dengan memanaskan bahan tersebut atau mereaksikan dengan suatu pereaksi. Umumnya yang dicari ialah banyaknya zat gas yang terbentuk. Cara mencari jumlah gas dapat secara langsung dan tidak langsung.
Secara langsung, gas yang ditimbang adalah bahan penyerap, yaitu sebelum dan sesudah penyerapan sedangkan berat gas diperoleh sebagai selisih kedua penimbangan. Secara tidak langsung, bahan yang ditimbang adalah analitnya setelah bereaksi. Berat gas diperoleh sebagai selisih berat analit dan sesudah reaksi itu terjadi (Harjadi,1993).
Endapan dalam gravimetri biasanya dikumpulkan dengan penyaringan cairan induknya melalui kertas saring atau alat penyaringan cairan induknya melalui kertas saring atau penyaring kaca masir. Kertas saring yang digunakan dalam gravimetri terbuat dari selulosa yang sangat murni sehingga jika dibakar hanya meninggalkan sisa abu sedikit. Intinya kertas saring dibagi menjadi 3 kelompok, yaitu kertas saring yang digunakan berpori besar, sedang, dan kecil.
Pemilihan kertas saring itu bergantung pada sifat endapan yang akan disaring.
Sebaliknya, alat penyaring kaca masir digunakan bila endapan yang disaring tidak akan dipijar setelah penyaringan, tetapi hanya dikeringkan saja (Rivai, 1995).
3.3 METODOLOGI PERCOBAAN
3.3.1 Alat dan Rangkaian Alat
Alat-alat yang digunakan dalam percobaan ini adalah gelas beker 500 mL, labu ukur 250 mL, erlenmeyer 500 mL, gelas arloji, propipet, pipet ukur 10 mL, pipet tetes, sudip, gegep, gelas ukur, desikator, oven, pengaduk kaca, corong, cawan porselin, neraca o’hauss, hotplate, botol semprot, dan aluminium foil.
Rangkaian Alat:
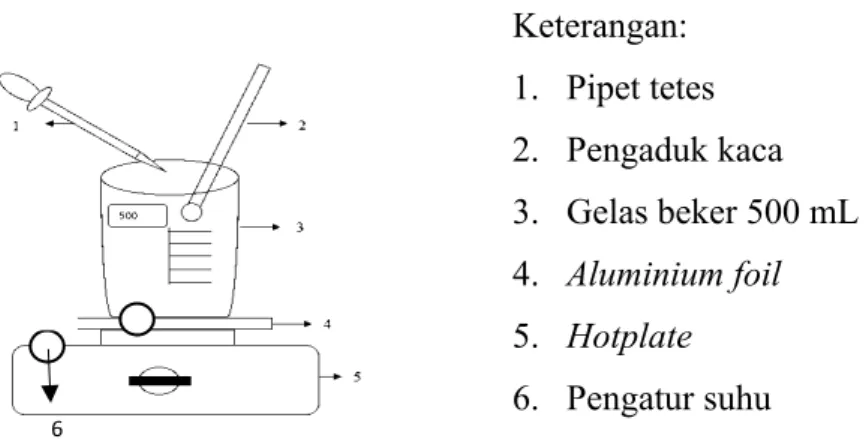
Keterangan:
1. Pipet tetes 2. Pengaduk kaca 3. Gelas beker 500 mL 4. Aluminium foil 5. Hotplate 6. Pengatur suhu
Gambar 3.1 Rangkaian Alat Pemanas dan Pencampuran Larutan
Keterangan:
1. Gelas beker 500 mL 2. Corong
3. Kertas saring 4. Erlenmeyer 500 mL
Gambar 3.2 Rangkaian Alat Penyaringan
3.3.2 Bahan
Bahan-bahan yang digunakan pada percobaan ini adalah BaCl2 0,02 M, H2SO4 0,5M, AgNO3 0,5 M, HCl 0,1 M, akuades, dan kertas saring.
III-8
6
3.3.3 Prosedur Kerja
Langkah pertama yang dilakukan adalah alat-alat yang digunakan dicuci sampai bersih kemudian dipijarkan menggunakan oven. Cawan porselin dan kertas saring ditimbang dengan neraca o’hauss sampai nilainya konstan.
Kemudian, padatan BaCl2 ditimbang sebanyak 1,2214 gram. Setelah ditimbang padatan BaCl2 dimasukkan ke dalam gelas beker dan dilarutkan dengan akuades serta diaduk hingga homogen. Larutan dipindahkan ke labu ukur 250 mL dan ditambahkan akuades hingga tanda tera, dikocok hingga homogen. Larutan BaCl2
yang sudah diolah dipindahkan ke dalam gelas beker 500 mL, lalu ditambahkan dengan HCl 0,1 M sebanyak 2 tetes. Larutan dipanaskan pada suhu 300 oC dengan menggunakan hotplate hingga mendidih. Setelah mendidih, larutan ditambahkan dengan H2SO4 0,5 M sebanyak 15 mL setetes demi setetes sambil diaduk, lalu dibiarkan hingga dingin dan mengendap. Kertas saring dimasukkan ke dalam corong dan diletakkan di atas erlenmeyer 500 mL. Kemudian, larutan BaCl2
disaring sebanyak 6 kali penyaringan dan pada penyaringan ke-5 ditambahkan AgNO3 sebanyak 1 tetes untuk mengetahui apakah penyaringan telah sempurna atau tidak. Kertas saring yang berisi endapan dimasukkan ke dalam cawan porselin dan dipijarkan dengan oven selama 15 menit pada suhu 80°C. Setelah itu dinginkan dengan desikator selama 5 menit. Terakhir, cawan porselin dan kertas saring berisi endapan ditimbang dengan neraca o’hauss kemudian dihitung massa endapannya.
III-10
3.3.4 Diagram alir 3.2.2
- Dicuci bersih kemudian dipijarkan di dalam oven - Ditimbang dengan neraca o’hauss
- Dilakukan sampai konstan
- Ditimbang sebanyak 1,2214 gram - Dilarutkan dengan akuades
- Diencerkan dengan akuades sampai 250 mL pada labu ukur 250 mL
- Dimasukkan ke dalam gelas beker 500 mL - Ditambahkan 2 tetes HCl 0,1 M
- Dipanaskan dengan hotplate hingga mendidih
- Diambil dengan pipet ukur sebanyak 15 mL
- Ditambahkan ke dalam gelas beker yang berisi larutan BaCl2
sedikit demi sedikit
- Diendapkan hingga dingin dan terbentuk endapan - Disaring dengan kertas saring sebanyak 6 kali
- Ditambahkan AgNO3 0,5 M sebanyak 1 tetes pada penyaringan yang ke-5.
- Dimasukkan ke dalam oven dengan cawan porselin selama 15 menit pada suhu 80˚C
- Dinginkan dengan desikator selama 15 menit - Ditimbang dengan neraca o’hauss
Alat-alat laboratorium
Kertas saring + cawan porselin porselin
Padatan BaCl2.2H2O
Larutan H2SO4
Endapan BaSO4
Hasil
Gambar 3.3 Diagram Alir Percobaan Analisa Gravimetri
3.4 HASIL DAN PEMBAHASAN
3.4.1 Hasil Pengamatan
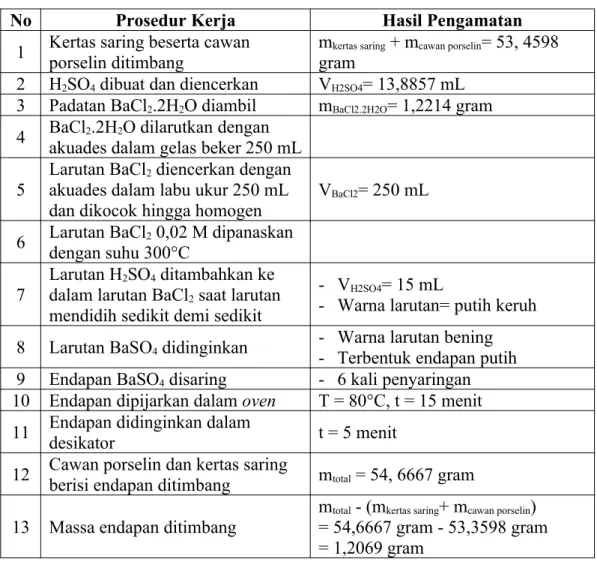
Tabel 3.1 Hasil Pengamatan Percobaan Analisa Gravimetri
No Prosedur Kerja Hasil Pengamatan 1 Kertas saring beserta cawan
porselin ditimbang
mkertas saring + mcawan porselin= 53, 4598 gram
2 H2SO4 dibuat dan diencerkan VH2SO4= 13,8857 mL 3 Padatan BaCl2.2H2O diambil mBaCl2.2H2O= 1,2214 gram 4 BaCl2.2H2O dilarutkan dengan
akuades dalam gelas beker 250 mL 5
Larutan BaCl2 diencerkan dengan akuades dalam labu ukur 250 mL dan dikocok hingga homogen
VBaCl2= 250 mL 6 Larutan BaCl2 0,02 M dipanaskan
dengan suhu 300°C 7
Larutan H2SO4 ditambahkan ke dalam larutan BaCl2 saat larutan mendidih sedikit demi sedikit
- VH2SO4= 15 mL
- Warna larutan= putih keruh 8 Larutan BaSO4 didinginkan - Warna larutan bening
- Terbentuk endapan putih 9 Endapan BaSO4 disaring - 6 kali penyaringan 10 Endapan dipijarkan dalam oven T = 80°C, t = 15 menit 11 Endapan didinginkan dalam
desikator t = 5 menit
12 Cawan porselin dan kertas saring
berisi endapan ditimbang mtotal = 54, 6667 gram
13 Massa endapan ditimbang mtotal - (mkertas saring+ mcawan porselin)
= 54,6667 gram - 53,3598 gram
= 1,2069 gram 3.4.2 Pembahasan
Gravimetri merupakan suatu metode analisa berdasarkan penentuan berat analitnya (Widiarto, 2003). Analisis gravimetri kandungan suatu unsur atau ion dalam suatu cuplikan dapat dianalisa dengan cara gravimetri dengan mengubah unsur atau ion tersebut ke dalam suatu bentuk senyawa yang mudah larut dengan penambahan reaksi pengendap. Tujuan dari percobaan ini untuk menentukan berat endapan BaSO4 dari kadar Ba2+ dari hasil BaCl2 dan H2SO4. Percobaan ini dilakukan dengan metode pengendapan BaSO4 dengan melartukan BaCl2.
III-12
Sebelum alat-alat laboratorium dipakai, sebaiknya dicuci bersih terlebih dahulu dikarenakan keberhasilan suatu percobaan tergantung pada ketelitian bekerja dan penggunaan alat-alat yang bersih. Alat-alat yang kotor dapat menghasilkan pengukuran yang salah. Alat gelas terutama cawan porselin dipijarkan di dalam oven. Pemijaran cawan porselin menggunakan oven berfungsi untuk mensterilkan cawan porselin dari zat-zat pengotor akibat penggunaan sebelumnya karena zat-zat pengotor dapat menambah berat cawan porselin sehingga massa cawan porselin tidak konstan. Pemijaran juga dilakukan untuk menghilangkan uap air yang ada pada cawan porselin. Kemudian cawan porselin dan kertas saring ditimbang dengan neraca o’hauss dan didapatkan massa sebesar 53,4598 gram.
Pengenceran BaCl2 dilakukan untuk menentukan konsentrasi dan memperkecil kesalahan akibat kopresipitasi yaitu konsentrasi zat yang ikut terlarut dalam pelarut. Sebelum dilakukan pemanasan, ditambahkan HCl sebanyak 2 tetes.
Penambahan HCl ini berfungsi untuk mengasamkan larutan agar ketika ditambahkan larutan H2SO4 tidak langsung terbentuk endapan. Setelah larutan ditambahkan HCl, larutan kemudian dipanaskan dengan hotplate dengan suhu 300°C. Tunggu beberapa menit hingga larutan mendidih. Pemanasan ini digunakan untuk mempercepat laju reaksi dan larutan mengendap secara sempurna sehingga memiliki kemurnian yang cukup tinggi. Reaksi yang terjadi adalah:
BaCl2(aq) Ba2+(aq) + 2Cl-(aq) ...(3.6)
Penambahan larutan H2SO4 0,5 M sebanyak 15 mL pada larutan BaCl2
yang mendidih dilakukan dengan cara meneteskan sedikit demi sedikit sambil diaduk hingga terjadi perubahan warna. Hal ini dilakukan agar tidak terjadi penggumpalan. Penambahan H2SO4 0,5 M tersebut menyebabkan terjadinya reaksi regional yaitu BaCL2 menjadi Ba2+ dan Cl- serta H2SO4 menjadi 2H+ dan SO42-. Perubahan warna menjadi putih keruh menunjukkan bahwa ion Ba2+
bereaksi dengan ion SO42- untuk membentuk endapan untuk membentuk endapan
III-14
BaSO4 di dasar gelas beker. Hal ini dikarenakan adanya pengaruh gaya gravitasi.
Berikut adalah reaksi yang terjadi:
BaCl2(aq) + H2SO4(aq) BaSO4(s) ↓ + 2HCl(aq) ...(3.7)
Reaksi yang terjadi yaitu BaCl2 menjadi Ba2+ dan 2Cl-. H2SO4 menjadi 2H+ dan SO42-. Kemudian ion Ba2+ saling berkaitan dengan ion SO42- membentuk endapan. Pengadukan tersebut bertujuan agar konsentrasi reagen pengendap tetap rendah serta tidak terjadi penumpukan konsentrasi pada satu tempat saja. Berikut adalah reaksi yang terjadi:
Ba2+(aq) + SO42-
(aq) BaSO4(s) ↓ ...(3.8)
Endapan yang didapat dengan penyaringan berulang sebanyak 6 kali lebih efektif dibanding sekali penyaringan dengan volume yang sama. Penyaringan dilakukan dengan kertas saring. Kertas saring yang digunakan dalam gravimetri terbuat dari selulosa yang sangat murni sehingga jika dibakar hanya meninggalkan sisa abu sedikit. Kertas saring dibagi menjadi 3 kelompok, yaitu kertas saring yang digunakan berpori besar, sedang, dan kecil. Pemilihan kertas saring itu bergantung pada sifat endapan yang akan disaring. Umumnya ukuran standar yang sering digunakan adalah 0,44 mm (Rivai, 1995). Dari proses penyaringan endapan yang terjadi belum murni karena masih dengan ion Cl- yang dapat mengikat 2H+ pada H2SO4. Berikut adalah reaksi yang terjadi.
2Cl-(aq) + H2SO4(aq) 2HCl(aq) + SO42-
(aq) ...(3.9) Penambahan AgNO3 0,5 M sebanyak 1 tetes pada penyaringan ke-5 berfungsi untuk memastikan pada ion Ba2+ dari BaCl2 telah bereaksi dengan SO42-
dari H2SO4 sehingga ion Cl- bebas yang ada pada filtrat akan bereaksi dengan ion Ag2+ dari AgNO3 0,5 M serta membentuk endapan. Saat AgNO3 diteteskan pada larutan akan terjadi perubahan warna yaitu larutan menjadi keruh sesaat dan membentuk endapan AgCl serta jatuh ke dasar gelas beker akibat adanya
pengaruh gaya gravitasi maka endapannya belum murni. Fungsi AgNO3 0,5 M ini digunakan untuk melihat suatu larutan jenuh. Berikut adalah reaksi yang terjadi.
AgNO3(aq) + HCl(aq) AgCl(s)↓ + HNO3(aq) ...(3.10)
Setelah penyaringan selesai, cawan porselin, kertas saring, dan endapan yang telah diperoleh dipijarkan di dalam oven Proses pemijaran endapan pada kertas saring dimaksudkan untuk menghilangkan sisa airnya. Pemijaran dilakukan untuk mendapatkan endapan yang benar-benar kering. Pendinginan endapan dilakukan dengan menggunakan desikator menyesuaikan suhu endapan dengan suhu kamar agar saat dilakukan penimbangan dengan neraca o’hauss berat yang ditimbang adalah berat murni endapan. Perbedaan suhu yang terlalu besar dapat menyebabkan kerusakan pada neraca o’hauss serta dapat menyebabkan ketidaktelitian sehingga massa yang ditimbang tidak valid. Pendinginan harus dilakukan dengan desikator karena apabila dilakukan di ruang terbuka maka akan menyebabkan terjadinya penyerapan uap air oleh cawan porselin sehingga berpengaruh terhadap berat endapan. Lalu, endapan, cawan porselin, dan kertas saring ditimbang dengan neraca o’hauss.
Data yang diperoleh dari percobaan ini adalah massa total sebesar 52,6667 gram. Setelah itu, massa endapan yang terbentuk dapat dihitung dan diperoleh sebesar 1,2069 gram serta kadar Ba2+ sebesar 58,1383%. Faktor-faktor yang menentukan analisis dengan pengendapan berhasil, yaitu endapan harus tidak dapat larut sehingga tidak akan terjadi kehilangan yang berarti apabila larutan disaring dengan kertas saring, sifat fisika endapan harus diperhatikan sehingga endapan mudah dipisahkan dari larutan dengan penyaringan dan juga dapat dicuci sampai bebas dari zat pengotor yang larut. Endapan harus diubah menjadi suatu zat murni yang didapat pada komposisi kimia tertentu (Basset,1994). Hasil endapan yang didapatkan tidak 100% murni karena dalam endapan tidak hanya murni dari tetesan Ba2+ saja, tetapi masih terdapat kontaminasi dari zat pengotor yang tidak habis. Selain itu, waktu pemanasan sampel juga berpengaruh yang
III-16
mana semakin lama proses pemanasan dan semakin sering dalam suhu yang optimal akan membuat kadar endapan yang akan ditimbang konstan dan akurat.
menghasilkan endapan BaSO4. BaSO4 merupakan hasil reaksi dari BaCl2 dan H2SO4. Massa endapan BaSO4 yang diperoleh sebesar 1,2069 gram dan kadar Ba2+
yang ada dalam endapan sebesar 58,1382%.
3.5.2 Saran
Saran yang dapat diberikan untuk percobaan selanjutnya yaitu konsentrasi larutan BaCl2 digantikan menjadi 0,005 M. Hal ini dikarenakan semakin encer larutan, maka didapatkan endapan yang lebih banyak. Selain itu, akan memperkecil kesalahan akibat kopresipitasi.
III-16
DAFTAR PUSTAKA
Basset, J. dkk. 1994. Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik.
Jakarta: Buku Kedokteran EGG.
Carloth. 2018. Safety Data Silver Nitrate.
https://www.carlroth.com/downloads/sdb/en/2/SDB-6207-ID-IN.pdf diakases pada tanggal 24 April 2020.
Charan, D. D. 2011. Analysical Chemistry. New Delhi: Ph Learning Dutand.
Harjadi, W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Khopkar, S. M. 2003. Konsep Dasar Kimia Analitik. Jakarta: Universitas Indonesia.
Kurnaen. 2014. Kimia Analitik: Analisis Gravimetri. Jurnal Ilmiah. BJG: 23-60.
http://staff.unila.ac.id/kurnaen/files/2014/09/kimia-analitik-analisa- gravimetri.pdf
Diakses pada 1 Maret 2020
Northeasten. 2009. Sulfuric Acid MSDS.
http://www.northeastern.edw/wanunu/
Diakses pada 29 Februari 2020
Rivai, Harrizal. 1995. Asas Pemeriksaan Kimia. Jakarta: Universitas Indonesia.
Science, Stuff. 2014. MSDS Asam Klorida.
http://www.sciencestuff.com/MSDS/C2784.html Diakses pada 29 Februari 2020
DP.III-1
Smartlab. 2017. Material Safety Data Sheet Barium Chloride.
Smartlab.co.id/assets/pdp/MSDS/-BARIUM-CHLORIDE- DIHYDRATE.pdf.
Diakses pada 29 Februari 2020
Svehla, G. 1985. Kimia Analisis. Jakarta: PT Kalman Media Pustaka.
Underwood, A. L. dan Day, R.A. 1998. Analisis Kimia Kuantitatif Edisi Keenam.
Jakarta: Erlangga.
Widiarti, Sonny. 2009. Kimia Analitik. Lampung: Universitas Lampung.
Wiryawan, Adam. 2008. Kimia Analitik untuk SMK. Jakarta: Direktorat Pembinaan SMK.
DP.III-3
Diketahui : V2 = 500 mL
M2 = 0,5 M
ρ = 1,84 gram/mL
BM H2SO4 = 98,08 gram/mol Konsentrasi = 95,97%
Ditany : V1 =....?
Penyelesaian : M1= 10×%× ρ
BM H2S O4=10×95,97×1,84gram/mL 98,08gram/mol
¿18,0041 mol/mL
M1 × V1 = M2 × V2
0,5 M . 500 = 18,0041 mol/mL . V1
V1 = 250mL
18,0041M
= 13,8857 mL
2. Pembuatan Larutan 0,1 M HCl sebanyak 250 Ml Diketahui : V2 =100 mL
M2 = 0,1 mL
P = 1,19 gram/mol BM HCl = 36,46 gram/mol Konsentrasi = 37 %
Ditanya : V1 =....?
Penyelesaian : M1=10×%× ρ
BM HCl =10×37×1,19gram/mL 36,46gram/mol
LP.III-1
LP.III-2
= 12,0762 M M1 × V1 = M2 × V2
0,1 M . 100 mL = 12,0762 mol/mL . V1
V2 = 10mL 12,0762M = 0,8280 mL.
3. Pembuatan Larutan 0,5 M AgNO3 sebanyak 250 mL Diketahui : V =250 mL 0,25 liter
M = 0,5 M
BM AgNO3 = 170 gram/mol Ditanya : massa = …?
Penyelesaian :
Massa AgNO3 = M . BM . V
= 0,5 M . 170 gram/mol . 0,25 liter
= 21,25 gram
4. Pembuatan Larutan 0,02 M BaCl2.2H2O sebanyak 250 mL Diketahui : V =250 mL 0,25 liter
M = 0,02 M
BM BaCl2.2H2O = 244,28 gram/mol Ditanya : massa= . . . . ? gram
Penyelesaian :
massa BaCl2.2H2O = M . BM . V
= 0,02 M . 244,28 gram/mol . 0,25 liter
= 1,2214 gram 5. Perhitungan massa endapan BaSO4
Diketahui : massa cawan porselin + massa kertas saring + massa endapan = 54,6667 gram.
massa cawan porselin + massa kertas saring = 53,4598 gram
Ditanya : massa endapan = . . . . gram Penyelesaisan :
Massa endapan = (m cawan porselin + m kertas saring + m endapan)- (m cawan porselin + m kertas saring)
= (54,6667 – 53,4598) gram
= 1,2069 gram 6. Perhitungan Faktor Gravimetri
Diketahui : Ar Ba2+ = 137,3400 gram/mol Mr BaSO4 = 233,3976 gram/mol Ditanya : Faktor gravimetri . . . .?
Penyelesaian :
Faktor gravimetri = Ar Ba2+ ¿ Mr BaSO4¿
= 137,3400gram/mol 233,3976gram/mol
= 0,5884
7. Perhitungan Massa Ba2+
Diketahui : Faktor gravimetri = 0,5884 massa endapan = 1,2069 gram Ditanya : massa Ba2+
Penyelesaian :
massa Ba2+ = massa endapan x faktor gravimetri
= 1,2069 gram x 0,5884
= 0,7101 gram 8. Penentuan (%) Kadar Ba2+
Diketahui : massa Ba2+ =0,7101 gram
LP.III-4
massa BaCl2.2H2O = 1,2214 gram Ditanya : % kadar Ba2+ = …?
Penyelesaian :
% kadar Ba2+ = massa Ba2+ ¿
massa BaCl2 .2H2O¿ x 100 %
= 0,7101gram
1,2214gram x 100 %
= 58,1383 %