PROTEIN, SINTESIS
PROTEIN DAN METABOLISMENY
A
BLOK 6 TAHUN 2021
1
TUJUAN BELAJAR
• Mampu mengetahui dan memahami asam amino, protein, struktur protein
• Mampu menjelaskan dan memahami konsep Dogma Molekular (Replikasi, Transkripsi, dan Translasi)
• Dapat menjelaskan mekanisme sintesis protein
• Dapat menjelaskan metabolism protein
2
Protein
Makromolekul yang terdiri dari > 100 asam
amino yang dihubungkan dengan ikatan peptida.
Polipeptida : kurang dari 100 asam amino
Berperan penting dalam berbagai fungsi fisiologis dalam tubuh manusia
3
Asam Amino
Mempunyai gugus asam (-COOH) dan gugus amino (–NH2) , sehingga dapat bersifat asam atau basa.
Hidrolisis sempurna protein akan menghasilkan 20 macam asam amino. DNA mengkode 20
macam asam amino.
Mempunyai atom C asimetris, mengakibatkan adanya D dan L isomer. Asam amino dalam tubuh manusia ada dalam bentuk L-asam amino.
Atom C yang mengikat gugus asam (-COOH) dan gugus amino (–NH2) disebut C-alpha,
berikutnya B-beta, C-gamma dst.
4
Penamaan asam amino dapat disingkat dengan
5
satu huruf atau 3 huruf
6
7
8
9
10
11
12
13
Non-polar and hydrophobic
Polar and hydrophilic
Neutral Basic Acid
Chemical properties of amino acids
14
Macam-macam asam amino
Rantai R-nya berupa rantai alifatis : glisin, alanin, valin, leusin, isoleusin
Rantai R-nya mengikat gugus –OH : serin, treonin, tirosin
Rantai R-nya mengikat S : sistein dan metionin Rantai R-nya mengikat gugus asam atau
amidanya : aspartat, asparagin, asam glutamat, glutamin
Rantai R-nya mengikat gugus basa : arginin, lisin, hidroksilisin, histidin
Rantai R-nya mengikat cincin aromatis : histidin, fenilalanin, tirosin, triptofan,
Asam amino : prolin dan hidroksi prolin
15
Asam amino esensiil : asam amino yang
diperlukan tetapi tidak dapat dapat disintesis
oleh tubuh (valin, leusin, isoleusin, lisin, treonin, fenilalanin, triptofan dan metionin).
Asam amino semi esensiil : asam amino yang dapat disintesis tubuh, tapi tidak cukup untuk mendukung pertumbuhan anak-anak (arginin dan hisitidin).
16
Di dalam tubuh manusia terdapat asam amino yang penting, tetapi tidak ikut menyusun
protein (asam amino non-proteinogenik).
Misalnya :
1. Sitrulin yang berperan dalam siklus urea.
2. GABA (gamma-amino butyric acid) berperan sebagai neurotransmitter
3. Homosistein berperan dalam metabolisme asam folat
4. Karnitin sebagai transporter lipid dalam sel Asam amino proteinogenik : asam amino yang menyusun protein tubuh manusia (20 macam).
17
18
Protein
Diet Digesti,
Absorpsi Asam
Amino
Protein Diet dan Sintesis
Protein
• Limiting amino acid (asam amino pembatas):
asam amino yang terdapat dalam jumlah paling sedikit dalam suatu bahan makanan dibandingkan dengan kebutuhan.
• Asam amino pembatas diantaranya adalah Lisin → gandum
Metionine → kacang dan polong2-an
Triptofan → jagung (gelatin tdk mengandung triptofan)
19
Peptid
Polimerisasi asam L-alpha amino oleh ikatan
a
peptida merupakan strukutur dasar protein.
Apabila asam amino < 100 disebut polipeptida;
apabila asam amino > 100 disebut protein.
Polipeptida pada bidang kesehatan:
hormon : insulin, TRH
antibiotik : valinomisin, gramisidin Avaksin : peptida virus
antitumor : bleomisin Glutation
20
Ikatan Peptida
dipeptida : 2 residu asam amino, 1 ikatan peptida
tripeptida : 3 residu asam asam amino, 2 ikatan peptida
penulisan dengan 3 atau 1 huruf Glu-Ala-Lys-Gly-Tyr-Ala
E A K G Y A
adanya ikatan peptida dapat ditunjukkan dengan reaksi biuret
21
Protei n
Klasifika si
Berdasar bentuk molekul
Protein fibrosa : bentuk memanjang, sumbu panjang : pendek > 10. Contoh : kolagen, keratin, fibrin, miosin
Protein globuler : bentuk membulat, sumbu panjang : pendek 3:1 atau 4:1. Contoh :
albumin, globulin, insulin, enzim
Struktur menentukan fungsi protein
22
Berdasar elemen penyusunnya
Protein sederhana : bila dihidrolisis sempurna akan menghasilkan asam amino saja. Contoh : albumin, globulin, glutelin, prolamin, histon
dan protamin
Protein terkonjugasi : mengandung gugus non- protein (gugus prostetis). Contoh :
nukleoprotein, glikoprotein, lipoprotein, fosfoprotein, metaloprotein, kromoprotein Berdasar kelarutannya
albumin : larut dalam air dan larutan garam globulin : larut dalam larutan
garam
protamin : larut dalam etanol 70 80%
histon : larut dalam larutan garam
23
Berdasar fungsinya Katalisis : enzim
Kontraksi : aktin, miosin
Regulasi gena : histon, faktor transkripsi Hormon : insulin
Proteksi : fibrin, imunoglobulin Pengaturan : kalmodulin
Struktural : kolagen, elastin, keratin
Transport : albumin, hemoglobin, transferin Biosignal : reseptor hormon
24
Struktur Protein
Struktur protein primer
Struktur rantai polipeptida yang berupa urutan asam amino yang dihubungkan dengan ikatan peptida
Struktur protein sekunder
Terbentuknya alpha-helix atau beta-sheet, beta-bends, loops dan coils karena adanya interaksi-interaksi kimia
Interaksi kimia yang menentukan struktur sekunder yaitu ikatan hidrogen, interaksi
hidrophobik, interaksi elektrostatik, interaksi van der Waals
25
Struktur protein tersier
Struktur protein yang melipat (folding) menjadi struktur 3 dimensi
Struktur protein kuartener
Beberapa rantai polipeptida/protein yang bergabung menjadi satu. Tiap
polipeptida/protein disebut dengan subunit, bisa sama (homo) atau berbeda (hetero)
Protein yang terdiri dari 2 subunit yang sama disebut homodimer, bila subunit berlainan
disebut heterodimer.
26
27
STRUCTURE OF EUCARYOTIC CELLS
28
mitochondria cell membrane lysosomes
Golgi
rEPR (ribosomes) sEPR
centrosome nucleolus
nucleus
cytoplasm
NUKLEUS
• Pusat simpanan informasi dalam sel
• Informasi ditulis dalam bentuk nukleotida
• Nukleotida :
Basa nitrogen
Gula 5 karbon (pentosa): Deoksiribosa (DNA) atau ribosa (RNA)
dan Fosfat
29
30
31
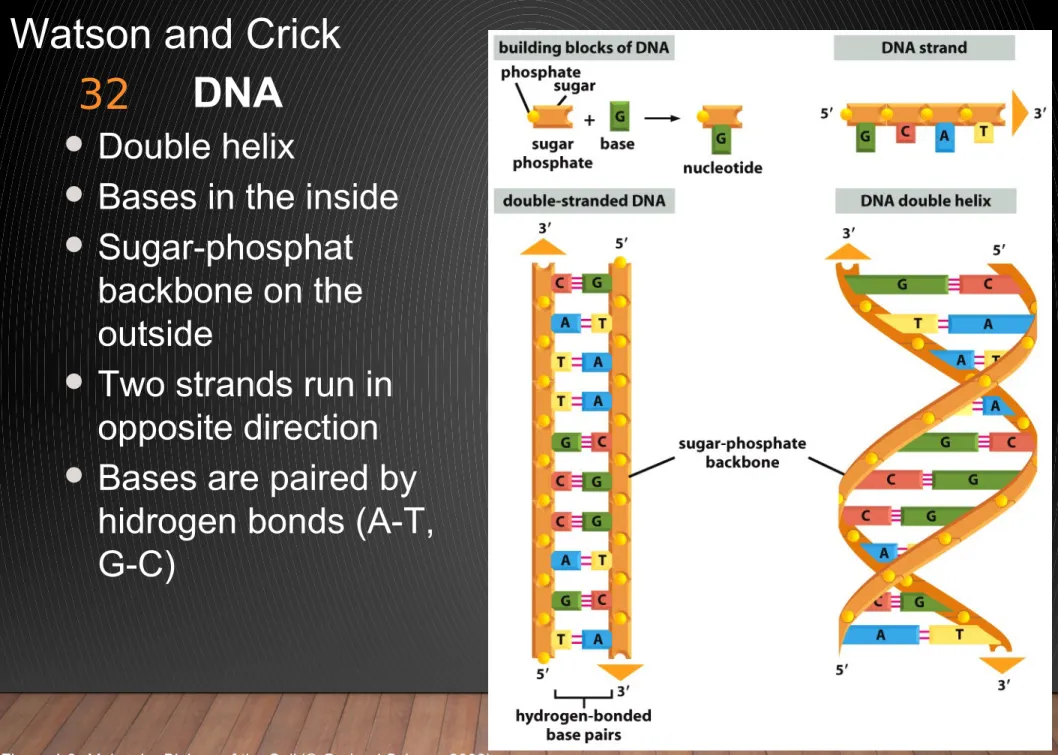
Watson and Crick DNA
Double helix
Bases in the inside
Sugar-phosphat backbone on the outside
Two strands run in opposite direction
Bases are paired by hidrogen bonds (A-T, G-C)
Figure 4-3 Molecular Biology of the Cell (© Garland Science 2008)
32
• Informasi di dalam nukleus dibagi ke dalam buku berupa “kromosom” (molekul DNA yg dapat diamati di dalam sel selama mitosis)
• Buku dibagi mjd beberapa bagian/chapter berupa “gen”.
33
34
SINTESIS PROTEIN
35
INTI SEL SITOPLASMA
L O K A S I
DOGMA MOLEKULAR
gene expression?
-
Transkripsi : sintesis RNA dari DNA
template
- Translasi : formasi sebuah protein
(rangkaian asam
amino) dari RNA
36
SINTESIS PROTEIN
37
DNA RNA PROTEIN
P R O S E S
Transkripsi Transformas i
Transkripsi terjadi di dalam inti,
sedangkan translasi/transformasi
terjadi di sitoplasma
• Proses dimana molekul DNA dikopi menjadi rantai komplementer RNA (messenger RNA=mRNA)
38
• Proses pengkodean mRNA menjadi protein dengan menggunakan beberapa jenis RNA
TRANSFORMASI
TRANSKRIPSI
DNA REPLICATION
• Semiconservative process
• Each parental
strands serves as a template
• Central enzyme DNA polymerase
• Catalyze joining of
deoxyribonucleas e 5’ triphosphat (dNTP)
39
40
DNA POLYMERASE
E. coli
• 3 types of polymerase
• Polymerase I repair of DNA damage
• Polymerase II unknown
• Polymerase III replication
Eukariot
• 5 types of polymerase
• , , most active in dividing cells
replication
• located in mitocondria replication in mitocondria
• active in nondividing and dividing cells repairing of DNA damage
41
PROPERTIES OF DNA POLYMERASE
Critical implications for DNA replication
• Synthesize DNA only in 5’ to 3’ direction adding a dNTP to the 3’ hydroxyl group of a growing chain
42
DNA SYNTHESIS
43
ORIGIN OF REPLICATION
• Unique sequence of DNA
• Serves as a specific binding site for proteins that initiate the replication process
44
ORIGIN OF REPLICATION
• Bacterial & viral genome single ORI
• E.coli 4x106 bp 1 ORI 30 min
• Mamm 3x109 bp 1 ORI 30,000 min (3 weeks)
• Complex structure rate of replication 10x lower
• Mamm replication few hours multiple ORI
• Mammalian genome 30,000 ORI
• Specific sequence (+ 100 bp) Autonomously Replicating Sequence (ARS)
45
ORIGIN OF REPLICATION
• ARS 11 bp highly conserved sequence binding site of Origin Replication Complex
(ORC) initiate DNA replication
• 1 ORI 2 replication forks DNA being actively replicated
46
47
STEPS OF REPLICATION
1. Binding of an initiator protein (ORC) to ARS 2. Unwind the origin DNA
3. Recruit the other protein
• Helicase
• Single stranded DNA-binding protein Unwinding and exposing the template DNA
• Brace and sliding-clamp protein
Maintain association of polymerase with its template
48
PROTEIN IN
REPLICATION FORK
• Helicase
Catalyze the unwinding of parental DNA
Ahead of the replication fork
49
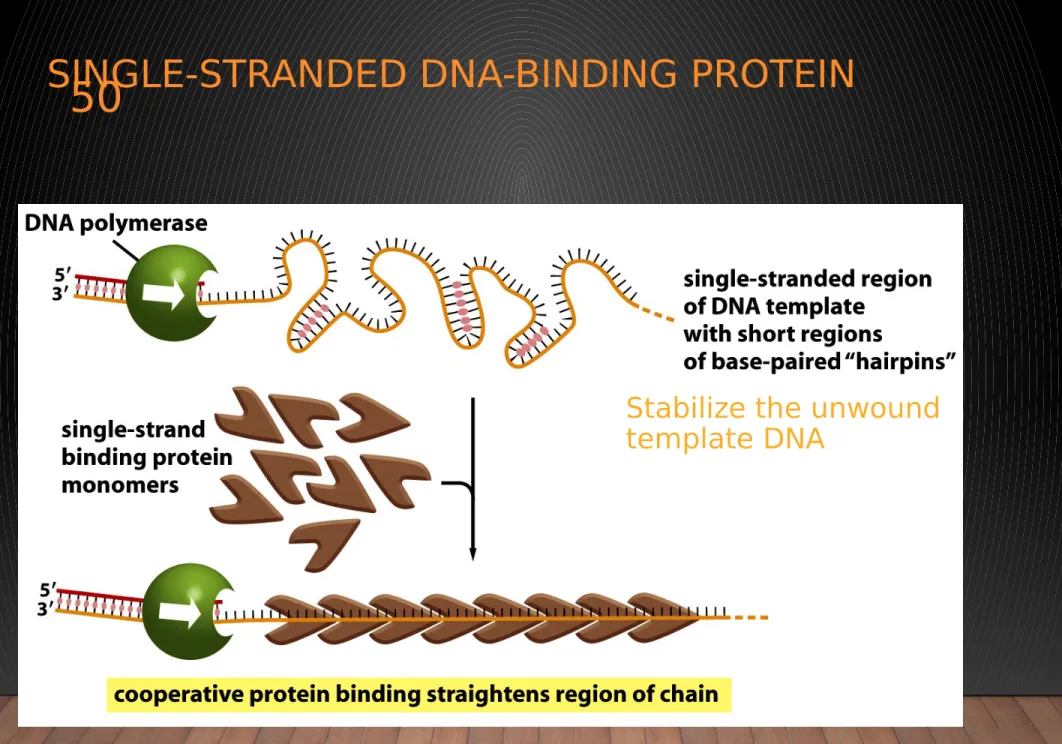
Figure 5-16 Molecular Biology of the Cell (© Garland Science 2008)
SINGLE-STRANDED DNA-BINDING PROTEIN
Stabilize the unwound template DNA
Keep it in an extended single-stranded state
50
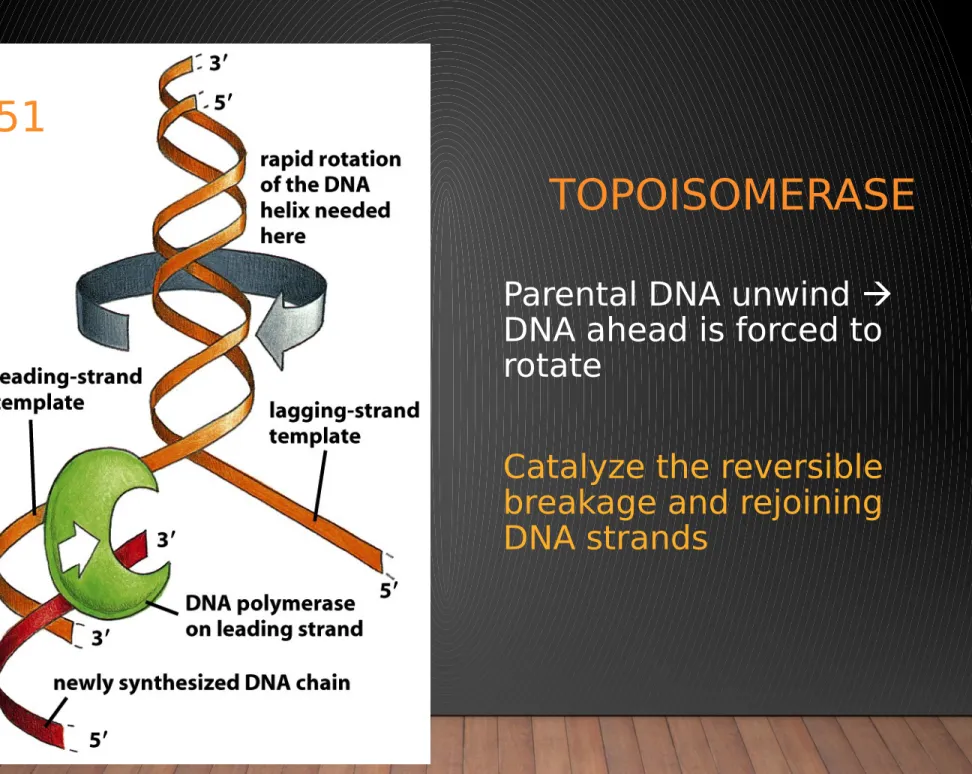
Figure 5-21 Molecular Biology of the Cell (© Garland Science 2008)
TOPOISOMERASE
Parental DNA unwind DNA ahead is forced to rotate
Catalyze the reversible breakage and rejoining DNA strands
51
PROTEINS IN REPLICATION FORK
• Accessory protein:
• Sliding-clamps protein Proliferating Cell Nuclear Antigen (PCNA)
bind to adjacent brace protein, forming a ring around the template DNA
Maintain the association of the polymerase with its template allowing uninterrupted synthesis of DNA
52
Figure 5-18c Molecular Biology of the Cell (© Garland Science 2008)
53
54
55
56
57
58
59
60
61
62
63
64
65
66
THE REPLICATION FORKS
• Each fork 2 parental strands of DNA 2 new daughter strands
• Facts:
• 2 parental strands run in opposite direction (antiparallel) continuous synthesis :
• 1strand be synthesize 5’ to 3’ direction
• 1strand be synthesize 3’ to 5’ direction
• DNA polymerase only catalyze polymerization 5’ to 3’ direction
67
THE REPLICATION FORK
• 1 strand is synthesized continuously leading strand
• 1 strand is formed from small, discontinuous pieces lagging strand
• Small pieces of newly synthesized DNA Okazaki fragments
68
69
70
71
72
73
SYNTHESIZE OF LAGGING STRAND
• FACT !!
• DNA polymerase requires a primer cannot initiate synthesis de novo
• How is the synthesis of Okazaki fragments initiate?
• Short fragment of RNA serve as primers synthesis of RNA can initiate de novo primase synthesizes
short fragments of RNA
74
INITIATION OF LAGGING STRAND
• Primase + polymerase α polymerase α-primase complex initiate
synthesis of RNA de novo complement to the
lagging strand template
RNA primer
• DNA polymerase add a new
deoxyribonucleotide only to a preformed primer strand that is hydrogen- bonded to the template Okazaki fragment
• Contain RNA-DNA joint
75
76
77
78
79
80
81
82
83
84
85
86
• Continuous lagging strand RNA primers 87 removed replaced with DNA
• RNA removal:
▫RNase H : degrades the RNA strand of RNA-DNA hybrid
▫Polymerase δ as an exonuclease : hydrolyze DNA (or RNA) in 3’ to 5’or 5’ to 3’ direction
5’ to 3’ exonuclease remove ribonucleotide from 5’ end of Okazaki replaced with dNTP
• Joining gap DNA ligase
88
89
90
91
92
93
94
95
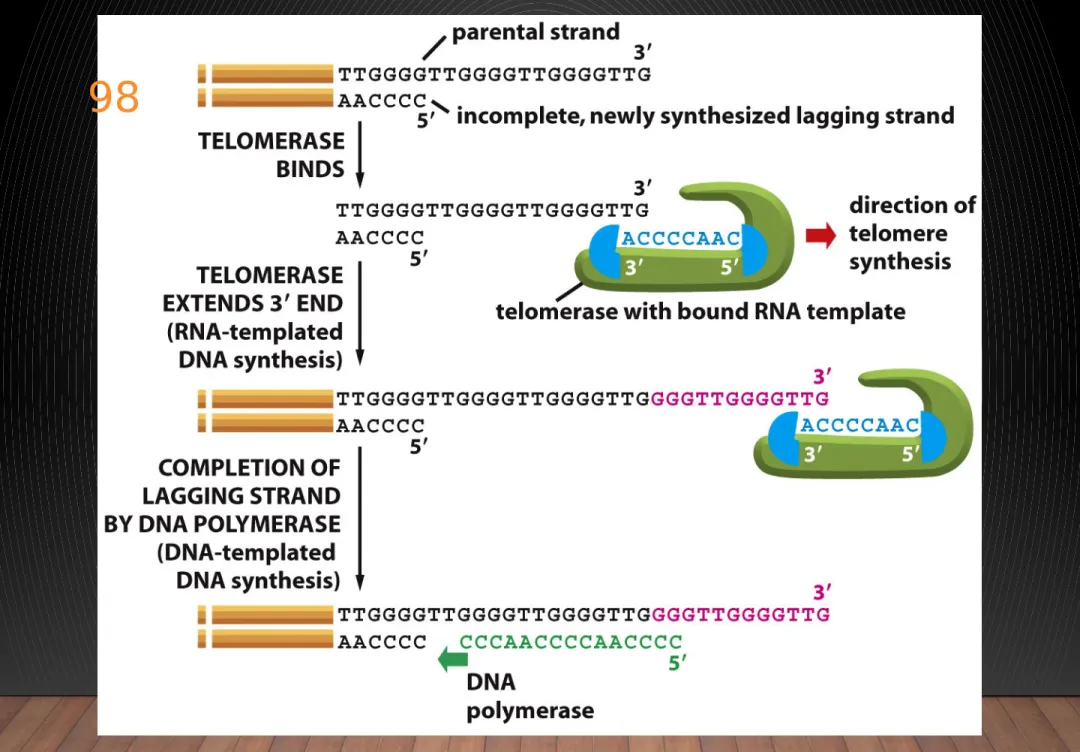
TELOMERE
• DNA polymerase extend primers 5’ to 3’ direction
unable to copy the extreme 5’ end special mechanisms are required to replicate terminal sequence
• Terminal sequence (telomere) tandem repeats of simple sequence DNA replicate by unique enzyme telomerase
96
TELOMERASE
• Capable to maintain telomeres catalyzing telomere synthesis in the absence of DNA
template
• A reverse transcriptase synthesize DNA from RNA template
• Carries its own template RNA complement to the telomere
97
Figure 5-41 Molecular Biology of the Cell (© Garland Science 2008)
98
99
10
0
TRANSKRIPSI
10
1
TRANSCRIPTION
• Process of copying DNA to RNA
• Differs from DNA synthesis in that only one strand of DNA, the template strand, is used to make mRNA
• Does not need a primer to start
• Can involve multiple RNA polymerases
• Divided into 3 stages
• Initiation
• Elongation
• Termination
10
2
10
3
10
4
10
5
TRANSCRIPTION: THE FINAL PRODUCT
10
6
10
7
TRANSLASI
10
8
TRNA
• Is in a clover shaped structure
• Brings the amino acids to the mRNA
• Has an anticodon loop to recognise the codons in the mRNA (by Watson-Crick base pairing)
• Is responsible for the specificity of the codon recognition
10
9
TRNA CHARGING
• Aminoacylation is the process of adding an aminoacyl group to a compound.
• It produces tRNA molecules with their CCA 3' ends covalently linked to an amino acid
• Each tRNA is aminoacylated(or charged) with a specific amino acid by an aminoacyl tRNA synthase.
• There is normally a single aminoacyl tRNA synthetase for each amino acid, despite the fact that there can be more than one tRNA, and more than one anticodon, for an
amino acid.
11
0
11
1
PROCESS OF TRANSLATION
• Initiation
• Recognition and specificity
• Elongation
• Termination
• Recognition of STOP codons
• Usage of release factors
11
2
11 3
mRNA
attaches to small
ribosomal subunit
TRANSLATION - OUTLINE
11
4
TRANSLATION.
MRNA USED TO MAKE POLYPEPTIDE CHAIN (PROTEIN)
11
5
1.
11 6
•First the mRNA attaches itself to a ribosome (to the small subunit).
•Six bases of the mRNA are exposed.
•A complementary tRNA molecule with its attached amino acid (methionine) base pairs via its anticodon UAC with the AUG on the mRNA in the first
position P.
•Another tRNA base pairs with the other three mRNA bases in the ribosome at position A.
•The enzyme peptidyl transferase forms a peptide bond between the two amino acids.
•The first tRNA (without its amino acid) leaves the ribosome.
TRANSLATION 2
11 7
The ribosome moves along the mRNA to the next codon (three bases).
The second tRNA molecule moves into position P.
Another tRNA molecule pairs with the mRNA in position A bringing its amino acid.
A growing polypeptide is formed in this way until a stop codon is reached.
END OF TRANSLATION
11 8
A stop codon on the mRNA is reached and this signals the ribosome to leave the mRNA. A newly synthesised protein is now complete!