Bahan Skripsi Departemen Kimia
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
INGUL
(Toona sureni (Blume) Merr.)
SKRIPSI
IWAN FREDDY SIDABUTAR
090802023
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
INGUL (
Toona sureni (Blume) Merr
.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
IWAN FREDDY SIDABUTAR
090802023
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul:ISOLASI SENYAWA FLAVONOIDA DARI DAUN
TUMBUHAN INGUL(Toona sureni (Blume) Merr.) Kategori : SKRIPSI
Nama : IWAN FREDDY SIDABUTAR Nomor Induk Mahasiswa : 090802023
Program Studi : SARJANA (S1) KIMIA Departemen : KIMIA
Fakultas :MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, September 2013
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Sovia Lenny,M.Si Prof.Dr.Tonel Barus
NIP. 1975 1018 2000 032001 NIP. 1945 0801 1974 121001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
INGUL (
Toona sureni (Blume) Merr.
)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2013
IWAN FREDDY SIDABUTAR
PENGHARGAAN
Segala puji dan Ucapan Syukur saya panjatkan pada Tuhan Yesus Kristus , karena berkat dan penyertaanNYA, sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini untuk memenuhi syarat guna mencapai gelar sarjana Kimia pada Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Pada kesempatan ini dengan segala kerendahan hati , penulis mengucapkan terima kasih yang tiada hentinya kepada Ibu saya tercinta Tamauli Damanik dan Ayah saya Jusen Paulus Sidabutar serta adik-adik saya Azies Rikardo Sidabutar, Mora Apriani Sidabutar, Novita Sidabutar yang telah memberikan kasih sayang, doa serta dorongan kepada penulis selama ini.
Penulis menyadari bahwa skripsi ini tidak akan terwujud tanpa adanya bantuan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih yang tulus kepada :
1. Bapak Prof.Dr.Tonel Barus dan Ibu Dr.Sovia Lenny M.Si., selaku dosen pembimbing yang telah membimbing penulis dengan penuh kesabaran dan keikhlasan selama penelitian hingga selesainya penulisan skripsi ini.
2. Ibu Dr.Rumondang Bulan Nst., MS dan Bapak Drs. Albert Pasaribu M.Sc., selaku Ketua dan Sekretaris Departemen KIMIA Fakultas MIPA USU yang telah mensahkan dan memberikan pengarahan dalam penyusunan skripsi ini.
3. Bapak Darwis Surbakti, Drs, MS., selaku dosen wali yang selama ini telah banyak membina dan membimbing penulis selama masa pendidikan.
4. Bapak Lamek Marpaung, M.Phil, Ph.D., selaku Kepala Laboratorium Kimia Organik Bahan Alam Hayati atas segala arahan, bimbingan, dan masukan walaupun sangat berat tetapi penulis sadar untuk lebih bergiat dan berjuang lebih keras lagi.
5. Bapak/Ibu dosen Departemen KIMIA Fakultas MIPA USU yang telah memberikan pendidikan dan bimbingan selama penulis menuntut ilmu di Fakultas MIPA USU.
6. Teman-teman asisten Kimia Organik Bahan Alam Hayati, Sahabat-sahabat ku Able kelompok kecil Blacklist, serta teman seperjuangan stambuk 2009, abang/kakak stambuk 2008 dan adik stambuk 2010,2011,2012., terima kasih atas bantuannya.
7. Serta semua pihak yang langsung maupun tidak langsung telah banyak membantu dalam menyelesaikan skripsi ini.
ABSTRAK
ISOLATION OF FLAVANOID FROM THE LEAVES OF INGUL
PLANT (
Toona sureni (Blume) Merr.
)
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan I
Pernyataan Ii
Penghargaan Iii
Abstrak Iv
Abstract V
Daftar isi Vi
Daftar Lampiran Viii
Daftar Gambar Ix
Daftar Tabel X
Bab 1 Pendahuluan 1
1.1. Latar Belakang 1
1.2. Permasalahan 2
1.3. Tujuan Penelitian 3
1.4. Mamfaat Penelitian 3
1.5. Lokasi Penelitian 3
1.6. Metodologi Penelitian 4
Bab 2 Tinjauan Pustaka 5
2.1. Uraian Tumbuhan 5
2.1.1. Penyebaran dan Habitat 5 2.1.2. Deskripsi Tumbuhan 5
2.1.3. Meliaceae 6
2.1.5 Nama Daerah 7
2.1.6. Mamfaat 7
2.2. Senyawa Bahan Alam 7
2.3. Uraian Kandungan Kimia Tumbuhan 9 2.3.1. Senyawa Fenol 9 2.3.2. Senyawa Flavonoida 10 2.3.2.1. Sifat Kelarutan Senyawa Flavonoid 13 2.3.2.2. Klasifikasi Senyawa Flavonoid 13 2.3.3. Senyawa Alkaloid 20 2.3.4. Senyawa Terpenoida 21 2.3.5. Senyawa Sterol 22 2.3.6. Senyawa Glikosida 22 2.3.7. Senyawa Tanin 22
2.4. Teknik Pemisahan 23
2.4.1. Ekstraksi 23
2.4.2. Kromatografi 24 2.4.2.1. Kromatografi Lapis Tipis 25 2.4.2.2. Kromatografi Kolom 25 2.4.2.3. Harga Rf (Reterdation Factor) 27
2.4.3. Pemurnian 27
2.5. Spektroskopi 28
2.5.1. Spektrometri Ultra Violet 28 2.5.2. Spektrometri Infra Merah (FT-IR) 29 2.5.3. Spektometri Resonansi Magnetik Inti Proton(-1H-NMR) 30
Bab 3 Metode Penelitian 33
3.1. Alat-alat 33
3.2. Bahan-bahan 34
3.3.1. Penyediaan sampel 35 3.3.2. Skrining Fitokimia Daun Tumbuhan Ingul
(Toona Sureni (Blume) Merr.)
35
3.3.3. Ekstraksi Maserasi Daun Tumbuhan Ingul 36 3.3.4. Ekstrak Partisi Daun Tumbuhan Ingul 37
3.3.5. Hidrolisis 37
3.3.6. Analisis Kromatografi lapis Tipis (KLT) 37 3.3.7. Isolasi Senyawa Flavonoida
dengan Kromatografi Kolom
38
3.3.8. Penggabungan Fraksi 39
3.3.9. Pemurnian 39
3.3.10. Uji Kemurnian Hasil Isolasi 40 3.3.11. Identifikasi Hasil Isolasi 40 3.3.11.1. Identifikasi dengan Spektrometer UV-Vis 40 3.3.11.1. Identifikasi dengan Spektrometer Inframerah
(FT-IR)
41
3.3.11.2. Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1-H-NMR)
41
3.4. Bagan Penelitian 42
3.4.1. Bagan Skrining Fitokimia 42 3.4.2. Bagan Isolasi 45
Bab 4 Hasil dan Pembahasan 47
4.1. Hasil Penelitian 47
4.2. Pembahasan 51
Bab 5 Kesimpulan dan Saran 55
5.1. Kesimpulan 55
DAFTAR PUSTAKA 56
DAFTAR LAMPIRAN
Lampiran A Hasil Determinasi Tumbuhan Ingul (Toona sureni (Blume) Merr.) Lampiran B Gambar Tumbuhan Ingul
(Toona sureni (Blume) Merr.)
Lampiran C Hasil Kromatogram Ekstrak Pekat Klorofom Daun Tumbuhan Ingul Sebelum Kromatografi Kolom Lampiran D Kromatogram Lapisan Tipis Fraksi Hasil Isolasi Daun
Tumbuhan Ingul Penggabungan fraksi
Lampiran E Kromatogram Lapisan Tipis Senyawa Murni Hasil Isolasi Lampiran F Spektrum Ultaviolet-Visible Beberapa Senyawa
Flavonoida
Lampiran G Spektrum H-NMR Senyawa Hasil Isolasi pada
δ=1,2491- 7,5478 ppm
Lampiran H Spektrum H-NMR Senyawa Hasil Isolasi pada
δ = 6,7786-7,5478 ppm
Lampiran I Spektrum H-NMR Senyawa Hasil Isolasi pada
δ = 4,3193-5,7 ppm
Lampiran J Spektrum H-NMR Senyawa Hasil Isolasi pada
δ = 3,63-3,99 ppm
Lampiran K Spektrum H-NMR Senyawa Hasil Isolasi pada
δ = 1,75-2,02 ppm
Lampiran L Spektrum H-NMR Senyawa Hasil Isolasi pada
δ = 1,2452-1,6136 ppm
DAFTAR GAMBAR
Halaman
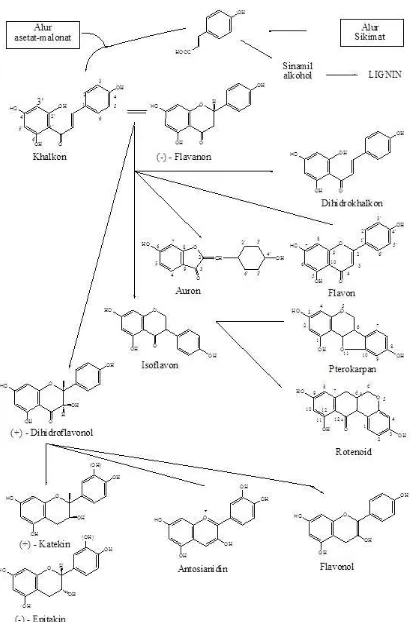
Gambar 1 Biosintesisa Hubungan antara Jenis Monomer Flavonoida dari Alur Asetat-Malonat dan Alur Sikimat
12
DAFTAR TABEL
Halaman
ABSTRAK
ISOLATION OF FLAVANOID FROM THE LEAVES OF INGUL
PLANT (
Toona sureni (Blume) Merr.
)
ABSTRACT
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Salah satu potensi yang dikembangkan dari tumbuhan adalah pemamfaatan senyawa metabolit sekundernya untuk bahan obat (Kurz&Constabel,1998). Tumbuhan obat adalah semua tumbuhan baik yang sudah ataupun belum dibudidayakan yang dapat digunakan sebagai obat, berkisar dari yang terlihat mata hingga yang tampak dibawah mikroskop (Hamid et al, 1991).
Penelitian fitokimia sebelumnya terhadap spesies T.sinensis telah menemukan senyawa kaempferol, kuersitin, kuersitrin, rutin, kaempferol-glukosida, katekin, epikatekin,
asam stearat, asam palmitat, β-sitosterol, stigmasterol, β-sitosteril-glukosida dan stigmasteril-glukosida diisolasi (Hsieh et al, 2004) dan diidentifikasi dari tumbuhan T.sinensis dan juga ada 7 senyawa polifenol menggunakan adsorbansi UV, yaitu katekin, epikatekin, metil galat, rutin, asam galat, kuersitrin, dan kaempferol, dan juga diindikasikan bahwa katekin dan polifenol yang terdapat dalam buah, sayur, teh, T.Sinensis dan anggur merah mempunyai sifat profilaktif yang sangat cocok dengan kesehatan manusia (Hsieh et al, 2006). Pada tahun 2012 telah dilakukan penelitian aktivitas antioksidan dan total senyawa- senyawa fenolik dari ekstrak daun T.sinensis (Chih, 2012). Efek anti-neoplastik dari asam galilic sebagai senyawa mayor dari ekstrak daun T.sinensis, aktifitas cytotokxic dalam sel kanker paru-paru manusia (Chia, 2010).
mempunyai bioaktifitas sebagai antimikroba terhadap staphylococcus. Pucuk daun Ingul juga dapat digunakan untuk mengatasi pembengkakan ginjal. Kulit kayu, daun dan buahnya kaya akan kandungan minyak atsiri (Yuhernita, 2011).
Telah diteliti bahwa bunga, kulit dan batang dari T.sinensis (A.Juss) sering digunakan sebagai pestisida nabati dan merupakan bahan alam yang potensial dikembangkan menjadi anti kanker ovarium, dalam penelitian sebelumya ini ditelaah kandungan senyawa kimianya (Sesilia,dkk, 2006) Uji aktivitas anti bakteri dari ekstrak etanol dan air rebusan kulit batang Ingul terhadap beberapa bakteri (Fahwid, 2009), Senyawa kolestan dari ekstrak kloroform kulit batang tumbuhan T.sinensis dan uji bioinsektisidanya (Eka, 2012), Bioaktivitas ekstrak etanol suren beureum terhadap larva udang (Jamhari, 2011) dan aktivitas antioksidan hasil isolasi metil galat dari daun tumbuhan T.sureni (Ekaprasada, 2009).
Dari uji pendahuluan yang peneliti lakukan dengan uji skrining fitokimia untuk identifikasi senyawa bahan alam hayati khususnya senyawa metabolit sekunder dari ekstrak metanol daun tumbuhan Ingul (T.sureni(Blume)Merr.) positif dengan pereaksi-pereaksi senyawa fenol, flavonoid, alkaloid, terpenoida dan steroida.
Dari uraian diatas dan berdasarkan literatur mengenai kandungan kimia yang terdapat pada daun tumbuhan Ingul, maka peneliti tertarik melakukan penelitian terhadap tumbuhan tersebut, khususnya menentukan senyawa metabolit sekunder dan isolasi senyawa flavonoid yang terkandung didalam tumbuhan ini. Penelitian ini dibatasi pada penentuan struktur hasil isolasi, diidentifikasi dengan Spektrofotomer Ultra Violet-Visible (UV-V), Spekrofotometer Resonansi Magnetik Inti Proton (H1-NMR), Spektrofotometer Inframerah (FT-IR).
1.2Permasalahan
1.3Tujuan Penelitian
Tujuan dari penelitian ini adalahuntuk mengisolasi senyawa flavonoida yang terdapat dalam daun tumbuhan Ingul (T.sureni (Blume) Merr.)
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Organik Bahan Alam Hayati dalam pengembangan ilmu fitokimia senyawa metabolit sekunder khususnya mengenai senyawa flavonoida yang terkandung didalam daun tumbuhan Ingul (T. sureni (Blume) Merr.)
1.5 Lokasi Penelitian
1. Tempat Pengambilan Sampel
Sampel yang digunakan diperoleh dari daerah Desa Tomok, Kecamatan Simanindo, Kabupaten Samosir, Sumatera Utara.
2. Tempat Identifikasi Tumbuhan secara Ilmiah
Identifikasi tumbuhan secara ilmiah dilakukan dilaboratorium Herbanium Medanense FMIPA Universitas Sumatera Utara (USU), Medan.
3. Tempat Melakukan Penelitian
4. Tempat Identifikasi Senyawa Hasil Isolasi
Analisis Spektrofotometer UV-Visible, Spektrofotometer Inframerah (FT-IR) dan Spektrometer Resonansi Magnetik Inti Proton (1-H-NMR) dilakukan di Pusat Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang.
1.6 Metodologi Penelitian
Dalam penelitian ini, ditentukan senyawa metabolit sekunder dengan menggunakanbeberapa reaksi pengenal yang mengambarkan sebahagian besar golongan senyawa bahan alam dan Isolasi senyawa flavonoida dari daun tumbuhan Ingul berupa serbuk halus yang kering (1400 gram).
Tahapan isolasi yang dilakukan : 1.Ekstraksi Maserasi
2.Ekstraksi Partisi
3.Analisis Kromatografi Lapis Tipis 4.Analisis Kromatografi Kolom 5. Analisis Senyawa Hasil Isolasi
Analisis SenyawaHasil Isolasi meliputi: 1. Analisis Kromatografi Lapis Tipis
BAB 2
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
2.1.1 Penyebaran dan Habitat
Tumbuhan Ingul, (Toona sureni (Blume) Merr.) adalah genus Toona yang terdistribusi merata secara alami didaerah Nepal, India, Bhutan, Myanmar, Indochina, China selatan, Thailand, dan seluruh daerah malaysia kedaerah barat New Guinea. Di Indonesia ditemukan di Sumatera, Jawa, dan Sulawesi. Tumbuhan Ingul sering ditemukan di daerah hutan pedesaan, lereng-lereng bukit, padaketinggian1,200-2,700mdi daerah dengansuhu tahunanrata-ratasekitar22°C. Tumbuhan Ingul memiliki nama sinonim Cedrela febrifuga Blume, Toona fbrifuga (Blume) M.J Roemer, Cedrela sureni (Blume) Burkill (Darmawati, 2003).
2.1.2 Deskripsi Tumbuhan
memiliki panjang 3-6 mm dan lebar 2-4 mm. Dan bunganya dijumpai diujung cabang, berukuran kecil, berwarna putih atau merah muda pucat.
Di Indonesia dikenal dua jenis genus Toona yaitu Toona sinensis dan Toona sureni. Kedua jenis tersebut sangat sulit untuk dibedakan, tetapi jika dilihat secara jeli terdapat perbedaan pada daun dan buahnya. Tulang daun pada T.sinensis terdapat bulu-bulu halus dan ujung daun muda berwarna merah, sedangkan pada T.sureni tidak terdapat bulu-bulu halus dan daun muda berwarna hijau. Buah dari T.sinensis terdapat pada ujung ranting, sedangkan
T.sureni terdapat pada batangnya (Darmawanti, 2003).
2.1.3 Meliaceae
Tumbuhan yang tergolong dalam suku Meliaceae biasanya berupa semak atau pohon, mempunyai kelenjer resin atau minyak, daun majemuk menyirip, duduknya tersebar, tanpa daun penumpu, bunga antinomorf. Kelopak seringkali kecil, terdiri atas 4-5 daun kelopak. Buahnya berupa daun kendaga atau buah batu. Biji dengan atau tanpa endosperm, seringkali bersayap (Gembong, 1991).
2.1.4 Sistematika Tumbuhan
Menurut hasil identifikasi tanaman dari Herbarium Medanesense (MEDA) Universitas Sumatera Utara diperoleh sistematika tumbuhan Ingul sebagai berikut :
Kingdom : Plantae
Ordo : Meliales Famili : Meliaceae Genus : Toona
Spesies : Toona sureni (Blume) Merr.
Nama lokal : Ingul
2.1.5 Nama daerah
Nama daerah dari tumbuhan Ingul secara umum Indonesia (suren), Sumatera (surian amba), Malaysia (surian wangi), Philippines (danupra), Myanmar (ye tama), Thailand (surian), dan nama dagang (cedar merah, toon, surian, limpaga).
2.1.6 Manfaat
Banyak penelitian telah membuktikan mamfaat mengkomsumsi tanaman yang berkhasiat antioksidan, seperti dapat menurunkan resiko penyakit jantung, kanker, katarak, dan penyakit degeneratif lain. Ingul merupakan salah satu tumbuhan tingkat tinggi yang terdapat di Indonesia. Tumbuhan ini telah banyak dimamfaatkan oleh masyarakat untuk berbagai keperluan. Kayu Ingul berkualitas tinggi karena sangat kuat dan tahan terhadap serangga sehingga sering digunakan untuk bahan bangunan dan pembuatan meubel.
diketahui mempunyai efek antibiotik serta mempunyai bioaktivitas sebagai anti mikroba terhadap staphylococcus. Pucuk daun Ingul juga dapat digunakan untuk mengatasi pembengkakan ginjal. Kulit kayu, daun, dan buahnya kaya akan kandungan minyak atsiri.
2.2 Senyawa Bahan Alam
Senyawa bahan alam didefenisikan sebagai senyawa organik yang melimpah dari alam seperti bahan tanaman mentah, bahan makanan, resin, dan eksudat tanaman atau ekstrak tanaman. Peninjauan pada setiap farmakope akan menunjukkan bahan alam memiliki peran penting sebagai senyawa yang aktif secara biologis, kenyataannya, diperkirakan bahwa 20-25% dari seluruh obat diperoleh dari alam.
Ada beberapa pendekatan yang dapat digunakan untuk menemukan induk obat baru dari alam, dan semuanya pernah digunakan oleh perusahaan farmasi dalam upaya memamfaatkan potensi hayati bahan alam yaitu :
1. Pendekatan etnobotani
Penetahuan tentang penggunaan tumbuhan tertentu oleh penduduk asli dimamfaatkan untuk mengarahkan pencarian induk obat baru, biasanya dilakukan oleh ahli botani dan kemudian menguji aktifitas biologisnya.
2. Pendekatan Kemotaksonomik
3. Pendekatan acak
Tanaman dikumpulakan tanpa memperhatikan aktifitas kimia atau biologis yang telah ada sebelumnya. Pendekatan ini tergantung pada ketersediaan tanama yang melimpah diwilayah tertentu. Pendekatan ini murni coba-coba karena seleksi tanaman secara acak akan mengarah pada penemuan ekstrak yang memiliki aktifitas biologis (bioaktivitas).
4. Pendekatan berbasis-informasi
Memamfaatkan kombinasi pendekatan etnobotani, kemotaksonomi dan acak bersama dengan mengumpulkan data yang memiliki semua informasi yang relevan mengenai spesies tumbuhan tertentu. Kumpulan data ini digunakan untuk memprioritaskan tanaman yang harus diekstraksi dan diskrining untuk mencari bioaktivitasnya.
Sejumlah kelompok senyawa bahan alam dapat dibuat dari asam amino fenillalanin, terutama fenilpropana, lignan, kumarin, dan flavonoida, semuanya memiliki substruktur umum yang berbasis cicin 6-karbon aaromatik (unit C6) dengan rantai 3-karbon (unit 3) yang melekat pada cicin aromatik ( Heinrich M, 2005).
2.3 Uraian Kandungan Kimia Tumbuhan
2.3.1 Senyawa Fenol
Jika murni, fenol sederhana berupa zat warna tan warna kelarutan dalam air kecil dan semakin besar jika gugus hidroksil semakin besar . Banyak senyawa fenolik alami mengandung sekurang-kurangnya gugus hidroksil, dan lebih banyak yang membentuk senyawa eter, ester dan glikosida (Robinson, 1995).
Senyawa fenol yang sering ditemui dialam dan telah diketahui strukturnya adalah flavonoida, fenol monosiklik sederhana, fenilpropanoid, dan kuinon fenolik terdapat dalam jumlah besar. Dan beberapa golongan bahan polimer penting dalam tumbuhan lignin, melanin, dan tanin adalah senyawa polifenol.
Bagi biokimiawan tumbuhan, senyawa fenol tumbuhan dapat menimbulkan gangguan besar karena kemampuannya membentuk kompleks dengan protein melalui ikatan hidrogen. Bila kandungan sel tumbuhan dan membran menjadi rusak selama proses isolasi, senyawa fenol cepat sekali membentuk kompleks dengan protein. Akibatnya, sering terjadi hambatan terhadap kerja enzim pada ekstrak tumbuhan kasar. Sebaliknya fenol sendiri sangat peka terhadap isolasi enzim dan mungkin hilang pada proses isolasi akibat kerja enzim fenolase yang terdapat dalam tumbuhan.
Secara klasik untuk mendeteksi senyawa fenol sederhana ialah dengan menambahakan larutan besi (III) klorida 1% dalam air dan kalium heksasianoferrat (III) 1%. Semua senyawa fenol berupa senyawa aromatik sehingga semuanya menunjukkan serapan kuat didaerah spektrum UV. Selain itu secara khas senyawa fenol menunjukkan pergeseran batokrom pada spektrumnya bila ditambahakan basa.
2.3.2 Senyawa Flavonoida
Flavonoida berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida. Senyawa flavonoida diturunkan dari unit C6-C3 (fenilpropana)
yang bersumber dari asam sikimat (viafenilalanin) dan unit C6 yang diturunkan dari jalur
poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil Ko-A, yang bergabung dengan unit C6-C3 (sebagai tioester) untuk membentuk unit awal triketida ( Heinrich M,
2005).
Senyawa flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat yang dihubungkan dengan tiga satuan karbon. Struktur dasar flavonoida dapat digambarkan sebagai berikut:
C C C
A B
Kerangka Dasar Flavonoida
(Sastrohamidjojo, 1996).
Senyawa flavonoida adalah senyawa-senyawa polifenol yang mempunyai 15 atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh rantai linear yang terdiri dari tiga atom karbon. Kerangka ini dapat ditullis sebagai C6-C3-C6. Jadi senyawa
flavonoida adalah senyawa 1,3 diarilpropana, senyawa isoflavonoida adalah senyawa 1,2 biarilpropana, sedang senyawa-senyawa neoflavonoida adalah senyawa 1,1 diarilpropana.
cincin C dengan tingkat oksidasi yang paling rendah dan dianggap sebagai struktur induk dalam nomenklatur kelompok senyawa ini (Manitto, 1992).
Menurut perkiraan, kira-kira 2% dari seluruh karbon yang difotosintesis oleh tumbuhan diubah menjadi flavonoida atau senyawa yang berkaitan erat dengannya. Flavonoida terdapat dalam semua tumbuhan hijau. Flavonoida terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, nektar, bunga, buah dan biji.
Semua varian flavonoida saling berkaitan karena alur biosintesis yang sama, yang memasukkan prazat dari alur sikimat dan asetat malonat. Flavonoida pertama dihasilkan segera setelah kedua alur tersebut bertemu. Flavonoida yang dianggap pertama kali terbentuk pada biosintesis adalah khalkkon dan semua bentuk lain diturunkan darinya melalui berbagai alur (Markham, 1988).
2.3.2.1. Sifat Kelarutan Senyawa Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia seperti fenol yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi bila didiamkan dalam larutan basa dan disamping itu terdapat banyak oksigen maka akan banyak yang terurai. Karena mempunyai sejumlah gugus hidroksil yang tak tersulih atau suatu gula, flavonoida merupakan senyawa polar maka umumnya flavonoida larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, air dan lain-lain. Adanya gula yang terikat pada flavonoida cenderung menyebabkan flavonoida lebih mudah larut dalam air. Dengan demikian campuran pelarut di atas dengan air merupakan pelarut yang lebih baik untuk glikosida. Sebaliknya, aglikon yang kurang polar seperti isoflavon, flavanon, flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.3.2.2. Klasifikasi Senyawa Flavonoida
Flavonoida biasanya terdapat sebagai flavonoida O-glikosida. Pada senyawa tersebut satu gugus hidroksil flavonoida atau lebih terikat pada satu gula atau lebih dengan ikatan hemimasetal yang tak tahan asam. Pengaruh glikosilasi menyebabkan flavonoida menjadi kurang reaktif dan lebih mudah larut dalam air. Glukosa merupakan gula yang paling umum terlibat walaupun galaktosa, ramnosa, xilosa dan arabinosa juga sering ditemukan.
Gula dapat juga terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam. Glikosida yang demikian disebut C-glikosida. Jenis gula yang terlibat lebih sedikit dibandingkan dengan gula pada O-glikosida.
Flavonoida sulfat adalah golongan flavonoida lain yang mudah larut dalam air. Senyawa ini mengandung satu ion sulfat atau lebih yang terikat pada hidroksi fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam yaitu flavon-O-SO3K. Banyak yang berupa glikosida bisulfat, bagian bisulfat terikat pada hidroksil fenol
Biflavonoida merupakan flavonoida dimer. Flavonoida yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana dan ikatan antar flavonoida berupa ikatan karbon-karbon atau ikatan eter. Monomer flavonoida yang digabungkan menjadi biflavonoida dapat berjenis sama atau berbeda, dan letak ikatannya berbeda-beda. Banyak sifat fisika dan kimia biflavnoida menyerupai sifat monoflavonoida pembentuknya dan akibatnya kadang-kadang biflavonoida sukar dikenali. Biflavonoida jarang ditemukan sebagai glikosida.
Sejumlah aglikon flavonoida mempunyai atom karbon asimetrik dengan demikian dapat menunjukkan keaktifan optik (yaitu memutar cahaya terpolarisasi-datar). Yang termasuk dalam golongan flavonoida ini adalah flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid dan beberapa biflavonoida (Markham, 1988).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu:
1. Flavonol
Flavonol sering terdapat sebagai glikosida, biasanya 3-glikosida dan aglikon flavonol yang umum yaitu kamferol, kuarsetin dan miresetin yang berkhasiat sebagai antioksidan dan antiinflamasi. Flavonol lain yang terdapat di alam bebas kebanyakan merupakan variasi struktur sederhana dari flavonol. Larutan flavonol dalam suasana basa dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan.
O O
OH
Flavonol
2. Flavon
paling umum dijumpai adalah apigenin danluteolin. Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yangpaling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gulamelalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida.Flavon dianggapsebagai induk dalam nomenklatur kelompok senyawa flavonoida.
O O
Flavon
3. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan sebagai fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinyatidak khas dengan pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein)memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapikebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi coklat.
O O
Isoflavon
4. Flavanon
O O
Flavanon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
O O
OH
Flavanonol
6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai antioksidan.
O HO
OH
OH OH
OH
Katekin
Leukoantosianidin merupakan senyawa tanwarna, terutama terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol.
O
OH
HO
OH
Leukoantosianidin
8. Antosianidin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warnamerah jambu, merah marak, ungu dan biru dalam daun, bunga dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan struktur aromatik tunggal yaitu sianidin dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
O
OH
Antosianidin
9. Khalkon
O
Khalkon
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita. Dalam larutan basa senyawa ini berwarna ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jungga bila diberi uap amonia (Robinson, 1995).
HC
O
O
Auron
Tabel 1 Sifat golongan flavonoida
Golongan
flavonoida
Penyebaran Ciri khas
Antosianin Pigmenbunga merah marak,dan
biru juga dalam daun dan jaringan
lain.
Larutdalam air, λmaks 515-545 nm, bergerak dengan BAA pada kertas.
Proantosianidin Terutama tanwarna, dalam daun
tumbuhan berkayu.
Menghasilkan antosianidin bila jaringan
dipanaskan dalam HCl 2M selama
setengah jam.
Flavonol Terutamako-pigmen tanwarna
dalam bunga sianik dan asianik
tersebar luas dalam daun.
Setelah hidrolisis, berupa bercak kuning
murup pada kromatogram Forestal bila
disinari sinar UV; λmaks spektrum pada 330 – 350 nm.
Flavon Seperti flavonol Setelah hidrolisis, berupa bercak coklat
redup pada kromatogram Forestal; λmaks
spektrum pada 330-350 nm.
Glikoflavon flavonol Mengandung gula yang terikat melalui
ikatan C-C; bergerak dengan pengembang
air, tidak seperti flavon biasa.
Biflavonil Tanwarna;hampir seluruhnya
terbatas pada gimnospermae
Pada kromatogram BAA beupa bercak
redup dengan RF tinggi.
Khalkon dan
auron
Pigmenbunga kuning,
kadang-kadang terdapat juga dalam
jaringan lain
Dengan amonia berwarna merah
(perubahan warna dapat diamati in situ), maksimal spektrum 370-410 nm.
Flavanon Tanwarna; dalam daun dan
buah(terutama dalamCitrus)
Berwarna merah kuat dengan Mg/HCl;
kadang – kadang sangat pahit
Isoflavon TanwaTanwarna; sering kali dalam
akar; hanya terdapat dalam satu
suku,Leguminosae
BergerBergerak pada kertas dengan
pengembang air; tak ada uji warna yang
2.3.3 Senyawa Alkaloid
Alkaloid merupakan senyawa metabolit sekunder bersifat basa yang mengandung satu atau lebih atom nitrogen membetuk heterosiklik. Alkaloid seringkali beracun bagi manusia dan banyak mempunyai kegiatan fisiologis yang menonjol jadi digunakan secara luas dalam bidang pengobatan (Harbone,1987).
Pembagian alkaloid menurut Hegnauer sebagai berikut : 1. Alkaloid sesungguhnya
Alkaloid sesungguhnya bersifat basa yang merupakan turunan asam amino dan mengandung gugus nitrogen dalam cicin heterosiklik dan biasanya terdapat dalam tanaman sebagai garam asam organik.
2. Protoalkaloid
Protoalkaloid merupakan amin yang relatif sederhana dimana nitrogen asam amino tidak terdapat dalam cincin heterosiklik diperoleh berdasarkan biosintesa asam amino.
3. Pseudoalkaloid
Pseudoalkaloid merupakan alkaloid yang tidak diturunkan dari asam amino dan biasanya bersifat basa (Sastrohamidjojo,1996).
Mamfaat Alkaloida dalam bidang farmakologi yaitu :
1. Sebagai analgetika dan narkotika seperti opium dan morfin
2. Alkaloid jantung digunakan untuk mengubah kerja jantung seperti kinidin dan spartein. 3. Alkaloid mempengaruhi peredaran darah dan pernapasan seperti Veratum, Rauvolfia 4. Sebagai kemoteraupika dan antiparasit seperti alkaloid kina
5. Sebagai stimulan uterus seperti secale alkaloid
Alkaloid merupakan senyawa bahan alam yang telah menyumbangkan begitu banyak bagi dunia medis dan sediaan farmasetik. Alkaloid menunjukkan aktifitas biologis dan tersebar luas, terdapat pada tanaman, fungi, bakteri, amfibi, serangga, hewan laut dan manusia. Alkaloid juga terdapat dialam sebagai garam yang merupakan hasil reaksi antara basa (alkaloid) dan asam. Alakaloid merupakan bahan alam heterosiklik yang mengandung nitrogen ( Heinrich M, 2005).
2.3.4 Senyawa Terpenoida
Senyawa terpen tersebar luas dialam dalam banyak spesies, kadang-kadang disebut isoprena unit C5 berulang bercabang. Senyawa terpen adalah contoh sempurna bahan alam yang
memiliki struktur sangat beragam, mempunyai banyak angota kiral dan memiliki gugus kimia fungsional yang ekstensif. Terpen yang paling sederhana adalah hemiterpen (C5) kemudian
monoterpen (C10), seskuiterpen (C15), diterpen (C20), triterpen, dan steroid (Turunan C30), dan
tetraterpen (Kareotenoid, C40), semuanya berfungsi penting dalam pengobatan ( Heinrich M,
2005).
Terpenoid merupakan senyawa alam yang terbentuk dengan proses biosintesis, terdistribusi luas dalam dunia tumbuhan dan hewan. Struktur terpenoid dibangun oleh molekul isoprena.Senyawa terpenoid berkisar dari senyawa yang volatil, yakni komponen minyak atsiri, yang merupakan monoterpen dan seskuiterpen, senyawa yang kurang volatil yakni diterpen sampai senyawa yang nonvolatil seperti triterpenoid dan sterol serta pigmen karotenoid (Midian, 2007).
Triterpenoid adalah senyawa yaang kerangka karbonya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C3 asiklik, yaitu skualena.
2.3.5 Senyawa Sterol
Sterol merupakan triterpena yang kerangka dasarnya sistem cicin siklopentana perhidropenantrena. Senyawa fitosterol yang sering ditemukan yaitu sitosterol, stigmasterol, dan kampesterol. Saponin adalah glikosida triterpen dan sterol dimana merupakan senyawa aktif yang bersifat seperti sabun membentuk busa dan menghemolisis sel darah (Harbone, 1987).
2.3.6 Senyawa Glikosida
Glikosida adalah suatu senyawa, bila dihidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon atau genin). Glikosida yang gulanya berupa glukosa disebut glukosida. Pembagian glikosida dapat dilakukan berdasarkan glikon, aglikon, dan khsiatnya. Glikosida yang berkasiat obat dapat digolongkan menjadi kardioaktif, antrakinon, saponin, sianofor, tiosianat, flavonol, alkohol, aldehid, lakton, dan fenol. Umunya glikosida mudah terhidrolisis oleh asam mineral atau enzim. Hidrolisis oleh asam memerlukan panas. Dan hidrolisis dengan enzim tidak memerlukan panas. Kegunaannya bagi manusia sebagai obat jantung, diuretika, tonika, ekspektoran, dan sebagai prekursor hormon steroid (Midian, 2007).
2.3.7 Senyawa Tanin
hidrolisis tanin. Beberapa tanin yang terbukti mempunyai aktivitas antioksidan, menghambat pertumbuhan tumor, dan menghambat enzim (Robbinson, 1995).
Secara garis besar tanin dibagi menjadi dua golongan: tanin dapat terhidrolisis, yang terbentuk dari esterifikasi gula dengan asam fenolat sederhana yang merupakan tanin turunan sikimat ( misalnya asam galat) dan tidak dapat terhidrolisis, yang terkadang disebut sebagai tanin terkondensasi, yang berasal dari reaksi polimerisasi (kondensasi) antar flavonoid ( Heinrich M, 2005).
2.4 Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya.
Ada 2 jenis teknik pemisahan yaitu :
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam suatu golongan (Muldja, 1995).
2.4.1 Ekstraksi
metoda sokletasi dapat dilakukan secara bertingkat dengan berbagai pelarut berdasarkan kepolarannya, misalnya n-heksana, eter, benzena, kloroform, etil asetat, etanol, metanol, dan air.
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak yang pekat biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1987).
2.4.2 Kromatografi
Kromatografi adalah berbagai cara pemisahan berdasarkan partisi cuplikan antara fase yang bergerak, dapat berupa gas atau zat cair, dan fase diam, dapat berupa zat cair atau zat padat. Pemisahan secara kromatografi yang berhasil baik berkaitan dengan mengkompromikan daya pisah kromatografi, beban cuplikan, dan waktu analisis (Gritter, 1991)
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat – sifat dari fasa diam, yang dapat berupa zat padat atau zat cair.Jika fasa diam berupa zat padat disebut kromatografi serapan, jika berupa zat cair disebut kromatografi partisi. Karena fasa gerak dapat berupa zat cair atau gas maka ada empat macam sistem kromatografi yaitu:
1) Fasa gerak cair–fasa diam padat (kromatografi serapan): a.kromatografi lapis tipis
b.kromatografi penukar ion
2) Fasa gerak gas–fasa diam padat, yakni kromatografi gas padat
a. kromatografi gas–cair b. kromatografi kolom kapiler
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa – senyawa yang dipisahkan terdistribusi diantara fasa gerak dan fasa diam dalam perbandingan yang sangat berbeda – beda dari satu senyawa terhadap senyawa yang lain (Sastrohamidjojo, 1985).
2.4.2.1 Kromatografi Lapis Tipis
Kromatografi Lapis Tipis pada plat berlapis yang berukuran lebih besar, biasanya 5x20 cm, 10x20 cm, atau 20x20 cm. Biasanya memerlukan waktu pengembangan 30 menit sampai satu jam. Pada hakikatnya KLT melibatkan dua fase yaitu fase diam atau sifat lapisan, dan fase gerak atau campuran pelarut pengembang. Fase diam dapat berupa serbuk halus yang berfungsi sebagai permukaan penyerap atau penyangga untuk lapisan zat cair. Fase gerak dapat berupa hampir segala macam pelarut atau campuran pelarut (Sudjadi, 1986).
Lempeng lapis penyerap sering menggunanakan indikator flueresensi sehingga bahan alam yang mengabsobsi sinar uv gelombang pendek 245 nm akan tampak sebagai bercak hitam pada latar hijau
2.4.2.2 Kromatografi Kolom
Pemisahan senyawa dengan kromatografi kolom merupakan salah satu teknik pemisahan biokimia yang banyak dipakai. Hal yang perlu diperhatikan adalah penyediaan kolom, operasi kolom, serta pemilihan pelarut yang tepat sebelum melakukan kromatografi. Kolom kromatografi biasanya terbuat dari gelas. Panjang kolom biasanya disesuaikan dengan jumlah komponen yang akan dianalisa dalam suatu senyawa, sedangkan lebar kolom disesuikan dengan jumlah senyawa yang akan dianalisis.
Bahan yang dapat dipakai untuk sediaan kromatografi sebagai pengisi kolom cukup banyak jenisnya. Sebagai contoh adalah beberapa jenis gel yang dapat menyerap air (hidrofi); suatu matriks (isi kolom) yang dapat aktif dengan pemanasan atau perlakuan dengan asam; dan untuk pertukaran ion resin, yang diperlakukan adalah bentuk ionik yang dapat dicuci. Selama proses kesetimbangan dengan pelarut, bahan pengisi kolom dibiarkan mengendap, dan partiket-partikel halus yang tertinggal dalam suspensi dibuang dengan cara dekantasi.
Penjerap dapat dikemas kedalam tabung, dengan cara basah maupun dengan cara kering. Pada cara kering, adsorbent diletakkan didalam kolom, penjerap dituangkan kedalam tabung sedikit demi sedikit. Setelah siap penambahan permukaan diratakan dan dimampatkan sedikit menggunakan alat pemampat. Alat pemampat ini dapat berupa sumbat karet atau silinder kayu yang dipasang pada ujung batang kaca atau gagang. Setelah semua penjerap dimasukkan, diatasnya diletakkan kertas saring. Kemudian pengelusi dibiarkan mengalir kebawah melalui penjerap dengan kran terbuka sampai permukaan pelarut tepat sedikit diatas bagian kolom. Cara basah , adsorben dimasukkan kedalam kolom, dan tabung diisi dengan sepertiganya dengan pelarut. Pelarut yang dipakai untuk proses pengemasan sesuai dengan pelarut yang akan digunakan dalam kromatografi kolom atau mungkin pelarut yang kepolarannya lebih rendah.
Kromatografi cair yang dilakukan dalam kolom besar merupakan metode kromatografi terbaik untuk pemisahan dalam jumlah besar (lebih dari 1 g). Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam, dan tabung plastik. Pelarut atau fasa gerak dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari atas kolom (Gritter, 1991).
2.4.2.3 Harga Rf (Reterdation Factor)
Mengidentifikasi noda-noda dalam lapisan tipis lazim menggunakan harga Rf yang diidentifikasikan sebagai perbandingan antara jarak perambatan suatu zat dengan jarak perambatan pelarut yang dihitung dari titik penotolan pelarut zat. Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Untuk mengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan dengan harga Rf senyawa pembanding.
Jarak perambatan bercak dari titik penotolan Rf =
Jarak perambatan pelarut dari titik penotolan (Sastrohamidjojo, 1985).
2.4.3 Pemurnian
Amorf yang diperoleh dari hasil isolasi dilarutkan kembali dengan EtOAc, diaduk hingga semua amorf larut sempurna. Kemudian ditambahkan n – heksana secara perlahan – lahan hingga pembentukan kembali senyawa yang lebih murni dari sebelumnya dan jatuh di dasar wadah. Didekantasi larutan bagian atas wadah. Lalu diuapkan sisa pelarut dari amorf hingga diperoleh kristal yang benar – benar bebas dari pelarut (Jacobs, 1974).
2.5Spektroskopi
elektromagnetik akan diubah menjadi besaran listrik dan melalui amplifier akan diubah menjadi besaran yang dapat diamati. Radiasi elektromagnetik adalah energi yang digunakan untuk penyerapan dan emisi radiasi magnetik yang diteruskan melalui ruang dengan kecepatan luar biasa. Dikenal dua kelompok utama spektroskopi, yaitu spektroskopi atom dan spektroskopi molekul. Dasar dari spektroskopi atom adalah tingkat energi elektron terluar suatu atom atau unsur, sedangkan dasar dari spektroskopi molekul adalah tingkat energi molekul yang melibatkan energi elektronik, energi vibrasi, dan energi rotasi. Energi elektronik yaitu energi yang melibatkan tingkat energi yang ditempati orbit elektron suatu atom dari molekul- molekul. Energi vibrasi yaitu energi yang melibatkan vibrasional antar atom dalam molekul. Energi rotasi yaitu energi yang melibatkan rotasi dari molekul (Bintang, 2011).
2.5.1 Spektrofotometri Ultra Violet
Serapan molekul di dalam derah ultra violet dan terlihat dari spektrum bergantung pada struktur ultra elektronik dari molekul. Penyerapan sejumlah energi, menghasilkan percepatan dari elektron dalam orbital tingkat dasar ke orbital yang berenergi lebih tinggi di dalam keadaan tereskitasi (Silverstein, 1986).
2.5.2 Spektrofotometri Infra Merah (FT-IR)
Spektrum inframerah terletak pada daerah dengan panjang gelombang berkisar 0,78-1000 µm atau bilangan gelombang 12.800 sampai 10-7. Penggunaan paling banyak spektroskopi inframerah adalah untuk identifikasi senyawa organik, karena spektrumnya sangat kompleks, yaitu terdiri dari banyak puncak-puncak. Spektrum inframerah dari senyawa organik mempunyai sifat fisik yang khas, artinya kemungkinannya kecil sekali dua senyawa mempunyai spektrum yang sama (Bintang, 2011) .
Pancaran inframerah yang kerapatannya kurang dari 100 cm -1 (panjang gelombang lebih daripada 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi putaran energi molekul maka spektrum rotasi molekul terdiri dari garis-garis yang tersendiri. Pancaran inframerah antara 10.000 - 10 cm-1 (Panjang gelombang 1-100 µm), diserap oleh sebuah molekul organik dan diubah menjadi energi getaran molekul (Silverstein, 1986).
Dalam molekul sederhana beratom dua atau beratom tiga tidak sukar untuk menentukan jumlah dan jenis vibrasinya dan menghubungkan vibrasi-vibrasi tersebut dengan energi serapan. Tetapi untuk molekul-molekul beratom banyak, analisis jumlah dan jenis vibrasi itu menjadi sukar sekali atau tidak mungkin sama sekali, karena bukan saja disebabkan besarnya jumlah pusat – pusat vibrasi, melainkan karena juga harus diperhitungkan terjadinya saling mempengaruhi (inter-aksi) beberapa pusat vibrasi.
Vibrasi molekul dapat dibagi dalam dua golongan , yaitu vibrasi regang dan vibrasi lentur.
1. Vibrasi regang
2.Vibrasi lentur
Di sini terjadi perubahan sudut antara dua ikatan kimia. Ada empat macam vibrasi lentur yaitu vibrasi lentur dalam bidang yang dapat berupa vibrasi scissoring atau vibrasi rocking dan vibrasi keluar bidang yang dapat berupa waging atau berupa twisting (Noerdin, 1985).
2.5.3 Spektrometri Resonansi Magnetik Inti Proton (1-H-NMR)
Resonansi magnet inti (nuclear magnetic resonance, NMR) merupakan spektroskopi absorbsi yang didasarkan pada pengukuran adsorbsi radiasi elektromagnetik pada daerah frekuensi radio 0,1 – 100 MHz (1MHz = 106 putaran per detik) atau panjang gelombang 3-3000m, oleh partikel ( inti atom) yang berputar didalam medan magnet. Inti atom hidrogen atau proton mempunyai sifat-sifat magnet. Bila suatu senyawa yang mengandung hidrogen diletakkan pada bidang magnet yang sangat kuat dan diradiasi dengan dengan radiasi elektromagnetik, maka inti atom hidrogen dari senyawa tersebut akan menyerap energi melalui suatu proses adsorbsi yang dikenal dengan resonansi magnetik. Adsorbsi radiasi terjadi bila kekuatan medan magnet sesuai dengan frekuensi radiasi elektomagnet.
Spektrometri Resonansi Magnetik Inti Proton (1-H-NMR) merupakan alat yang berguna pada penentuan struktur molekul organik. Teknik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam molekul. Spektrum 1-HNMR memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen (Cresswell, 1982).
1. Menentukan jumlah proton yang memiliki lingkungan kimia yang sama pada suatu senyawa organik.
2. Mengetahui informasi mengenai struktur suatu senyawa organik (Dachriyanus, 2004).
Pergeseran kimia adalah pengukuran medan magnet dalam keadaan bebas. Semua proton-proton dalam satu molekul yang ada dalam lingkungan kimia yang serupa kadang-kadang menunjukkan pergeseran kimia yang sama. Setiap senyawa memberikan penaikan menjadi puncak absorbsi tunggal dalam spektrum 1-H-NMR. Di dalam medan magnet, perputaran elektron-elektron valensi dari proton menghasilkan medan magnet yang melawan medan magnet yang digunakan. Hingga setiap proton dalam molekul dilindungi dari medan magnet yang digunakan dan bahwa besarnya perlindungan ini tergantung pada kerapatan elektron yang mengelilinginya. Makin besar kerapatan elektron yang mengelilingi inti, maka makin besar pula medan magnet yang dihasilkan yang melawan medan magnet yang digunakan (Bernasconi,1995).
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah tetrametilsilana (TMS). Beberapa keuntungan dari pemakaian standar internal TMS yaitu:
1. TMS mempunyai 12 proton yang setara sehingga akan memberikan spektrum puncak tunggal yang kuat.
Si
CH3 CH3
CH3 H3C
Pada spektrometri RMI integrasi sangat penting. Harga integrasi menunjukkan daerah atau luas puncak dari tiap – tiap proton . Sedangkan luas daerah atau luas puncak tersebut sesuai dengan jumlah proton. Dengan demikian perbandingan tiap integrasi proton sama dengan perbandingan jumlah proton dalam molekul (Muldja, 1995).
BAB 3
METODE PENELITIAN
Penelitian ini dilakukan dilakukan di Laboratorium Kimia Organik Bahan Alam Hayati, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Dan identifikasi senyawa hasil isolasi dilakukan di Laboratorium Pusat Penelitian Kimia – LIPI, Kawasan PUSPITEK Serpong, Tagerang.
3.1Alat – Alat
1. Gelas ukur 50 ml/100 ml Pyrex 2. Gelas Beaker 250 ml/1000 ml Pyrex 3. Gelas Erlenmeyer 250 ml Pyrex 4. Corong kaca
5. Corong pisah 500 ml Pyrex
6. Ekstraktor 5 L Schott/ Duran 7. Kolom kromatografi Pyrex
8. Tabung reaksi Pyrex
9. Plat tetes
10. Rotari evaporator Büchi R-114 11. Labu alas 1L Schott/ Duran 12. Statif dan klem
13. Lampu UV 14. Spatula
15. Batang pengaduk
16. Neraca analitis Mettler AE 200 17. Pipet tetes
18. Penangas air Büchi B-480 19. Botol vial
20. Bejana Kromatografi Lapis Tipis
22. Spektrometer 1H-NMR DELTA2-NMR 23. Spektrofotometer UV-Visible HITACHI
3.2 Bahan-Bahan
1. Daun Tumbuhan Ingul
2. Metanol Teknis
3. n-Heksana Teknis
4. Etil asetat Teknis
5. Aquadest Teknis
6. Silika gel 60 (0.063-0,200) E.Merck. KGaA 7. FeCl3 5%
8. NaOH 10% 9. HCl 37% 10. Serbuk Mg 11. KI
12. Iodium 13. HgCl2
14. Bismut Nitrat 15. HNO3(p)
16. CH3COOH anhidrida
17. Cerium Sulfat 1% 18. H2SO4 10%
19. H2SO4(p)
20. Klorofom Teknis
21. HCl 6%
22. Pelat KLT silika gel 60 F254 E.Merck.Art554
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
Sampel yang diteliti adalah daun tumbuhan Ingul yang dikeringkan di udara terbuka lalu dihaluskan, yang diperoleh dari Desa Tomok Kecamatan Simanindo Kabupaten Samosir Sumatera Utara. Daun tumbuhan Ingul di Determinasi di Herbanium Medanense (MEDA) Universitas Sumatera Utara untuk memastikan jenis pohon secara ilmiah. Diperoleh serbuk halus daun tumbuhan Ingul sebanyak 1400 g.
3.3.2Skrining Fitokimia Daun Tumbuhan Ingul (Toona sureni (Blume) Merr.)
1. Skrining Flavonoida
Untuk mengetahui adanya senyawa flavonoida pada daun tumbuhan Ingul, maka dilakukan uji pendahuluan secara kualitatif. 10 g serbuk halus daun tumbuhan Ingul diekstraksi maserasi dengan metanol kemudian disaring. Filtratnya diuji dengan menggunakan pereaksi. - Filtrat ditambahkan 3 tetes larutan pereaksi FeCl3 5%, terbentuk koloid berwarna hitam
(Harborne, 1987).
- Filtrat ditambahkan 0,1 gram serbuk Mg dan 1ml HCl 2N terbentuk larutan merah muda, orange, merah ungu (Cannell, 1998).
- Filtrat ditambahkan 3 tetes larutan pereaksi NaOH 10% terbetuk larutan biru violet (Tobing, 1989).
- Filtrat ditambahkan 3 tetes larutan pereaksi H2SO4 10%, terbentuk larutan berwarna
2. Skrining Alkaloida
Untuk mengetahui adanya senyawa alkaloida pada daun tumbuhan Ingul, maka dilakukan uji pendahuluan secara kualitatif. 10 g serbuk halus daun tumbuhan Ingul diekstraksi maserasi dengan metanol kemudian disaring. Filtratnya diuji dengan menggunakan pereaksi.
- Filtrat ditambahkan 3 tetes larutan pereaksi Bouchardat, terbentuk endapan coklat (Tobing, 1989)
- Filtrat ditambahkan 3 tetes larutan pereaksi wagner terbentuk endapan coklat
- Filtrat ditambahkan 3 tetes larutan pereaksi Mayer terbentuk endapan putih kekuningan - Filtrat ditambahkan 3 tetes larutan pereaksi Dragendorf terbentuk endapan orange
kecoklatan (Cannell, 1998)
3. Skrining Terpenoida/ Steroida
Untuk mengetahui adanya senyawa terpenoida/ steroida pada daun tumbuhan Ingul, maka dilakukan uji pendahuluan secara kualitatif. 10 g serbuk halus daun tumbuhan Ingul diekstraksi maserasi dengan metanol kemudian disaring. Filtratnya diuji dengan menggunakan pereaksi.
- Filtrat ditambahkan 3 tetes larutan pereaksi Salkowsky terbentuk larutan merah
- Filtrat ditambahkan 3 tetes larutan pereaksi Lieberman Burchard terbentuk larutan berwarna hijau- kebiruan
- Filtrat ditambahkan 3 tetes larutan pereaksi pereaksi CeSO41% dalam H2SO4 10%
3.3.3 Ekstrasi Maserasi Daun Tumbuhan Ingul
Sampel diambil dari Desa Tomok Kecamatan Simanindo Kabupaten Samosir Sumatera Utara. Pada penelitian ini, 1400 g daun Ingul yang sudah kering halus dimaserasi selama ±48 jam dengan pelarut metanol 9,6 L pada suhu kamar. Ekstrak metanol yang diperoleh dari 3 kali maserasi yang telah dirotarievaporator dan diuapkan hingga pelarut menguap. Ekstrak berbentuk cairan kental berwarna coklat tua kehijauan. Pemisahan senyawa yang diduga tanin dilakukan dengan menggunakan pelarut etilasetat sebagai pelarut polar aprotik. Ekstrak pekat metanol 140,9 g dilarutkan dengan etilasetat kemudian diaduk hingga merata dan disaring. Filtrat yang diperoleh dirotarievaporator kemudian diuapkan hingga semua pelarut etilasetat menguap. Residu dilarutkan kembali hingga filtrat yang diperoleh bening. Residu yang diperoleh merupakan tanin 55,79 g dan filtrat ekstrak etilasetat yang diperoleh 84,30 g.
3.3.4 Ekstrasi Partisi Daun Tumbuhan Ingul
Eksrtaksi partisi daun tumbuhan Ingul dilakukan pada ekstrak etil asetat 84,30 g dilarutkan dengan metanol, kemudian dimasukkan kedalam corong pisah dan dipartisi berulang-ulang dengan n-heksana dengan perbandingan ekstrak metanol:n-heksan 1:2. Terbentuk dua lapisan, lapisan bawah merupakan lapisan ekstrak metanol dan lapisan atas merupakan lapisan ekstrak n-heksan. Dilakukan partisi sebanyak 10 kali hingga lapisan n-heksana bening.
3.3.5 Hidrolisis
± 30 menit diatas penangas air. Kemudian didinginkan dan disaring sebelum dipartisi kembali dengan klorofom (Harborne, 1987)
3.3.6 Analisis Kromatografi Lapis Tipis (KLT)
Analisis kromatografi lapis tipis dilakukan terhadap ekstrak klorofom daun tumbuhan Ingul, dengan menggunakan fasa diam silika gel 60F254Merck dan fasa gerak yang digunakan
adalah campuran n-heksana : etil asetat dengan perbandingan pelarut berturut 90:10 v/v , 80:20 v/v , 70:30 v/v , 60:40 v/v . Analisis ini dimaksudkan untuk mencari pelarut yang sesuai didalam analisis kromatografi kolom. Untuk melihat perubahan eludasi, kromatogram lapis tipis diberi tanda batas atas dan batas bawah dengan menggunakan pensil. Ekstrak pekat kloroform ditotolkan pada garis awal lempeng lapis tipis, kemudian dimasukkan kedalam chamber yang berisi eluen dan dibiarkan hingga eluen bergerak naik sampai batas atas.
Kromatogram lapis tipis disinari dengan lampu ultra violet untuk melihat spot-spot senyawa, kemudian ditandai dengan pensil dan dihitung nilai Rf-nya. Selanjutnya lapis tipis difiksasi dengan larutan FeCl3 5% menghasilkan spot hitam pada kromatogram lapisan tipis
menujukkan positif mengandung senyawa fenol. Diamati warna bercak yang timbul dan dihitung harga Rf yang diperoleh. Dilakukan hal yang sama pada setiap perbandingan eluen yang digunakan untuk mengetahui hasil pemisahan kromatogram lapisan tipis (Lampiran C).
3.3.7Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
(0,063-0-200)dan fasa gerak campuran pelarut n-heksana : etil asetat dengan perbandingan 90:10 v/v, 80:20 v/v, 70:30 v/v, 60:40 v/v. Tahapan Isolasi kolom kromatografi dilakukan dengan cara kering dimana kolom kromatografi yang telah dirangkai dan dilengkapi kapas pada batas bawah, dimasukkan pelarut n-heksan 100% hingga ¾ volume kolom yang digunakan. Dimasukkan silika gel 50 g dengan perlahan-lahan, dielusi dengan pelarut n-heksan hingga padatan silika gel didalam kolom merata dan bebas gelembung udara. Ditambahkan kapas pada lapisan atas silika gel sebagai bidang batas sampel dengan silika gel. Dimasukkan 1,3 g ekstrak pekat klorofom daun tumbuhan Ingul ke dalam kolom kromatografi yang telah dicampurkan silika gel 10 g, lalu ditambahkan fasa gerak n-heksana : etil asetat(90 : 10) v/v secara perlahan – lahan, dan diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas. Ditingkatkan kepolaran dengan menambahkan fasa gerak n – heksana : etil asetat dengan perbandingan 80:20 v/v, 70:30 v/v, 60:40 v/v. Hasil yang diperoleh ditampung dalam botol vial setiap 5 ml .
3.3.8 Penggabungan Fraksi
Fraksi-fraksi yang diperoleh dari kromatografi kolom kemudian digabungkan dengan harga Rf yang sama. Penggabungan fraksi-fraksi dilakukan dengan analisiskromatografi lapis tipis terhadap fraksi etilasetat. Fraksi 55-68 dengan menggunakan fasa diam silika gel 60F254Merck dan fasa gerak yang digunakan adalah campuran n-heksana : etil asetat dengan
perbandingan pelarut 60:40 v/v. Analisis ini dimaksudkan untuk mencari harga Rf yang sama pada setiap fraksi hasil kromatografi kolom. Untuk melihat perubahan eludasi, kromatogram lapis tipis diberi tanda batas atas dan batas bawah dengan menggunakan pensil. Fraksi ditotolkan pada garis awal lempeng lapis tipis, kemudian dimasukkan kedalam chamber yang berisi eluen dan dibiarkan hingga eluen bergerak naik sampai batas atas.
Kromatogram lapis tipis disinari dengan lampu ultra violet untuk melihat spot-spot senyawa, selanjutnya lapis tipis difiksasi dengan larutan FeCl3 5% menghasilkan spot hitam
3.3.9 Pemurnian
Pasta yang diperoleh dari isolasi dengan kromatografi kolom dilarutkan kembali dengan etilasetat. Kemudian ditambahkan n-heksan secara perlahan – lahan hingga terbentuk dua lapisan. Kemudian didekantasi larutan bagian atas . Lalu diuapkan sisa pelarut hingga diperoleh pasta yang benar – benar bebas dari pelarut, hingga diperoleh senyawa murni (Jacobs, 1974).
3.3.10 Uji Kemurnian Hasil Isolasi
1.Kromatografi Lapis Tipis (KLT)
Uji kemurnian senyawa hasil isolasi dilakukan dengankromatografi lapis tipis. Senyawa hasil isolasi yang diperoleh dilarutkan dengan pelarut etilasetat, elusidasi dilakukan dengan menggunakan eluen yang dibuat dengan beberapa perbandingan pelarut yakni pelarut n-heksan : etilasetat perbandingan 60:40 v/v, pelarut kloroform : metanol perbandingan 80:20 v/v, pelarut etilasetat : metanol perbandingan 90:10 v/v. Untuk melihat perubahan elusidasi, kromatogram lapis tipis diberi tanda batas atas dan batas bawah dengan menggunakan pensil. Senyawa hasil isolasi ditotolkan pada batas bawah lempeng lapis tipis, kemudian dimasukkan kedalam chamber yang berisi eluen dan dibiarkan hingga bergerak sampai batas atas.
Kromatogram lapis tipis disinari dengan lampu ultra violet untuk melihat spot-spot senyawa, kemudian ditandai dengan pensil dan dihitung nilai Rf-nya. Selanjutnya lapis tipis difiksasi dengan larutan FeCl3 5% menghasilkan spot hitam yang tunggal pada kromatogram
3.3.11 Identifikasi Senyawa Hasil Isolasi
3.3.11.1 Identifikasi dengan Spektrometer UV-Visible
Identifikasi senyawa hasil isolasi, dianalisis dengan alat Spektrometer UV-Visible di Laboratorium Pusat Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang dengan menggunakan metanol sebagai pelarut (Gambar 2).
3.3.11.2 Identifikasi dengan Spektrometer Inframerah (FT-IR)
Identifikasi senyawa murni hasil isolasi dianalisis dengan alat Spektrometer FT-IR di Laboratorium Pusat Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang dengan menggunakan KBr sebagai pelarut (Gambar 3).
3.3.11.3Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton(1-H-NMR)
3.4 Bagan Penelitian
3.4.1 Bagan Skrining Fitokimia
1. Skrining Fitokimia Senyawa Flavonoida
10 gram serbuk daun tumbuhan Ingul (Toona sureni (Blume) Merr.)
diekstraksi maserasi dengan metanol
disaring
dipekatkan
dibagi kedalam 4 tabung reaksi
Tabung I Tabung II Tabung III Tabung IV
Ditambahkan pereaksi FeCl35%
diamati perubahan warna ditambahkan pereaksi NaOH 10% diamati perubahan warna ditambahkan pereaksi Mg-HCl diamati perubahan warna ditambahkan pereaksi H2SO4(p)
diamati perubahan warna
2. Skrining Fitokimia Senyawa Alkaloida
10 gram serbuk daun tumbuhan Ingul (Toona sureni (Blume) Merr.)
diekstraksi maserasi dengan metanol
disaring
dipekatkan
dibagi kedalam 4 tabung reaksi
Tabung I Tabung II Tabung III Tabung IV
Ditambahkan pereaksi Bouchardat diamati perubahan warna ditambahkan pereaksi Wagner diamati perubahan warna ditambahkan pereaksi Mayer diamati perubahan warna ditambahkan pereaksi Dragendorff diamati perubahan warna
3. Skrining Fitokimia Senyawa Terpenoida / Steroida
10 gram serbuk daun tumbuhan Ingul (Toona sureni (Blume) Merr.)
diekstraksi maserasi dengan metanol
disaring
dipekatkan
dibagi kedalam 3 tabung reaksi
Tabung I Tabung II Tabung III
Ditambahkan pereaksi Salkosky
diamati perubahan warna
ditambahkan pereaksi
CeSO4 1% dalam H2SO4 10%
diamati perubahan warna
ditambahkan pereaksi Lieberman Burchard
diamati perubahan warna
3.4.2 Bagan Isolasi
1400 g serbuk daun tumbuhan Ingul (Toona sureni (Blume) Merr.)
Diskrining fitokimia
Dimaserasi dengan metanol sebanyak 9,6 L
Didiamkan selama ±48 Jam Diulangi sebanyak 2 kali
Ekstrak metanol Residu
Diskrining fitokimia
Dipekatkan dengan rotarievaporator
Ekstrak pekat metanol
Diuapkan hingga seluruh metanol menguap Dilarutkan dengan etil asetat dan disaring
Ekstrak etil asetat Residu
Diskrining fitokimia
Dipekatkan dengan rotarievaporator
Ekstrak pekat etil asetat
Diuapkan hingga seluruh etil asetat menguap Dilarutkan dengan metanol
Diekstraksi partisi dengan n-heksana hingga bening
Lapisan metanol Lapisan n-heksana
Dipekatkan dengan rotarievaporator
Diuapkan hingga seluruh metanol menguap Dihidrolisa dengan menggunakan HCl 2N sambil dipanaskan selama ± 45 menit Didinginkan dan disaring
Diskrining Fitokimia
Hasil negatif
Lapisan metanol-asam Residu
Diekstraksi partisi dengan dengan klorofom sebanyak 3 kali
Diskrining Fitokimia
Lanjutan
Lapisan Klorofom
Diskrining fitokimia
Dipekatkan dengan rotarievaporator
Ekstrak pekat klorofom
Diuji kromatografi lapis tipis
Dikolom kromatografi menggunakan silika gel 60 (0,063-0,200) dan n-heksan : etilasetat
(90:10,80:20,70:30,60:40)v/v
Ditampung 5ml tiap fraksi dalam botol vial
Fraksi 1-20 90:10v/v
Fraksi 21-40 80:20v/v
Fraksi 41-68
70:30v/v Fraksi 69-16060:40v/v
Diuji FeCl3 5%
Diuji FeCl3 5%
Diuji
FeCl3 5% DiujiFeCl
3 5%
Hasil positif
Hasil negatif Hasil positif Hasil positif
Diuji kromatografi lapis tipis Digabungkan fraksi dengan harga Rf yang sama
Fraksi 41-54 Fraksi 55-68
Pemurnian
Senyawa murni
Diuapkan
Dianalisis kromatografi lapis tipis Dianalisis struktur dengan Spektrometer UV-Visible, Spektrometer FT-IR, Spektrometer H-NMR
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Hasil identifikasi senyawa metabolit sekunder dengan menggunakanbeberapa reaksi pengenal yang mengambarkan sebahagian besar golongan senyawa bahan alam dari daun Ingul (Toona sureni (Blume) Merr.), menunjukkan bahwa ekstrak metanol positif terhadap pereaksi-pereaksi fenol, flavonoid, alkaloid, terpenoid dan steroida. Hasil isolasi senyawa flavonoida dari daun tumbuhan Ingul yaitu berupa pasta berwarna kuning dengan massa 47 mg, dan harga Rf= 0,44 diperoleh dengan fase gerak n-heksan: etil asetat (60:40)v/v.
Hasil analisis Spektrofotometer Ultra Violet- Visible pada senyawa hasil isolasi dengan pelarut metanol, yang dapat dilihat pada gambar 2 serapan sebagai berikut:
Gambar 2. Spektrum Ultra Violet-Visible Senyawa hasil isolasi
Hasil analisis Spektrofotometer Ultra Violet- Visible senyawa hasil isolasi dengan pelarut metanol yang memberikan panjang gelombang maksimum, serapan sebagai berikut:
1. Pita I pada panjang gelombang Maksimum (λmaks) 263 nm
2. Pita II pada panjang gelomang Maksimum (λmaks) 222 nm
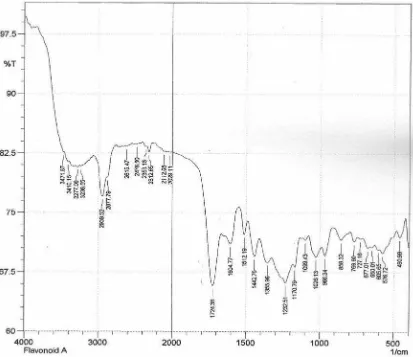
Hasil analisis Spektrofotometer FT-IR pada senyawa hasil isolasi menghasilkan pita– pita serapan pada daerah bilangan gelombang yang dapat dilihat pada gambar 3 dengan penjelasan sebagai berikut :
[image:66.595.74.487.318.675.2]Keterangan , x : Bilangan gelombang (cm-1) y : Transmitasi (%T)
Hasil analisis Spektrofotometer FT-IR senyawa hasil isolasi menghasilkan pita–pita serapan pada daerah bilangan gelombang dengan penjelasan sebagai berikut :
1. Pada bilangan gelombang 3471,87-3236,55 cm-1 puncak sedang menunjukkan adanya vibrasi ulur –OH
2. Pada bilangan gelombang 2939,52-2877,79 cm-1 puncak sedang menunjukkan adanya vibrasi ulur –CH alifatik.
3. Pada bilangan gelombang 1724,36 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C=O dari keton
4. Pada bilangan gelombang 1604,77 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C=C dari sistem alifatis.
5. Pada bilangan gelombang 1512,19 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C=C dari sistem aromatik.
6. Pada bilangan gelombang 1442,75-1355,96 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk –CH3.
7. Pada bilangan gelombang 1232,51 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C-O alkohol.
8. Pada bilangan gelombang 1170,79 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk C-CO-C dari keton
9. Pada bilangan gelombang 1099,43-1026,13 cm-1 puncak sedang menunjukkan adanya adanya vibrasi ulur dari C-O-C tak simetrik.
10. Pada bilangan gelombang 966.34-858,32 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk =C-H aromatik (Pavia, 1979).
O
R3
R4
R2
R1 O
[image:68.595.76.501.72.464.2]R5 1 2 3 4 5 6 7 8 9 10 1' 2' 3' 4' 5' 6'
A
B
C
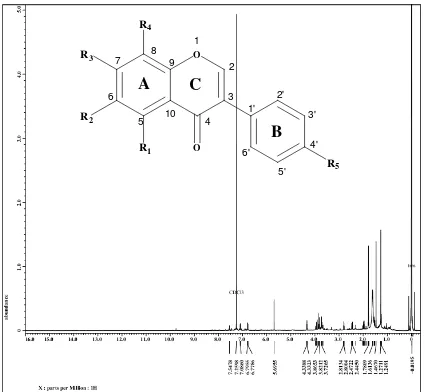
Gambar 4. Spektrum 1-H-NMR Senyawa hasil isolasi
Hasil analisis Spektrometer Resonansi Magnetik Inti Proton (H1-NMR) senyawa hasil isolasi dengan menggunakan pelarut Kloroform dan TMS sebagai standar yang memberikan signal – signal pergeseran kimia dengan penjelasan sebagai berikut :
1. Pergeseran kimia pada daerah δ= 7,5478 ppm dengan puncak singlet menunjukkan proton dari H-2 pada cincin C senyawa flavonoida
3. Pergeseran kimia pada daerah δ = 6,7955-6,7786 ppm puncak doblet menunjukkan proton-proton dari H-3’ dan H-5’ pada cincin B senyawa flavonoida
4. Pergeseran kimia pada daerah δ = 5,6955 ppm puncak singlet menunjukkan proton dari senyawa vinil
5. Pergeseran kimia pada daerah δ = 3,8653 ppm puncak singlet menunjukkan proton dari –OCH3
6. Pergeseran kimia pada daerah δ = 3,8212 ppm puncak singlet menunjukkan proton dari –OCH3
7. Pergeseran kimia pada daerah δ = 1,7809 ppm puncak singlet menunjukkan proton dari CH3
8. Pergeseran kimia pada daerah δ = 1,4670 ppm puncak singlet menunjukkan proton dari CH3
9. Pergeseran kimia pada daerah δ = 1,2802 ppm puncak singlet menunjukkan proton dari CH3
4.2 Pembahasan
hasil isolasi, kemudian dikromatografi lapis tipis kembali untuk menentukan harga Rf pasta hasil isolasi dengan beberapa eluen (Lampiran E).
Dari hasil interpretasi spektrum UV-Vis memberikan serapan pada pita I dengan panjang gelombang 263 nm dan pita II dengan panjang gelombang 222 nm yang menunjukkan bahwa senyawa hasil isolasi mirip dengan spektrum UV-Vis dari senyawa pembanding flavonoida yaitu isoflavon (Lampiran F ).
Hasil interpretasi Spektrum Inframerah (FT-IR) dan Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut CDCl3 dalam
stsndar TMS diperoleh:
1. Pergeseran kimia pada daerah δ= 7,5478 ppm dengan puncak singlet menunjukkan proton dari H-2 pada cincin C senyawa flavonoid, hal ini didukung oleh spektrum infra merah pada bilangan gelombang 2939,52-2877,79 cm-1 puncak sedang menunjukkan adanya vibrasi ulur –CH alifatik dan didukung pada bilangan gelombang 1099,43-1026.13 cm-1 puncak sedang menunjukkan adanya adanya vibrasi ulur dari C-O-C tak simetrik .
2. Pergeseran kimia pada daerah δ = 7,1029-7,0860 ppm puncak doblet menunjukkan proton-proton dari H-2’ dan H-6’ pada cincin B senyawa flavonoida, hal ini didukung oleh spektrum infra merah pada bilangan gelombang 1512,19 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C=C dari sistem aromatis.
3. Pergeseran kimia pada daerah δ = 6,7955-6,7786 ppm puncak doblet menunjukkan proton-proton dari H-3’ dan H-5’ pada cincin B senyawa flavonoida, hal ini didukung oleh spektrum infra merah pada bilangan gelombang 1512,19 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C=C dari sistem aromatis.
5. Pergeseran kimia pada daerah δ = 3,8653 ppm puncak singlet menunjukkan proton dari –OCH3, hal ini didukung oleh spektrum inframerah pada bilangan gelombang
2939,52-2877,79 cm-1 puncak sedang menunjukkan adanya vibrasi ulur –CH alifatik dan bilangan gelombang 1442,75-1355,96 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk – CH3 dan juga didukung pada bilangan gelombang 1099,43-1026.13 cm-1 puncak sedang
menunjukkan adanya adanya vibrasi ulur dari C-O-C tak simetrik.
6. Pergeseran kimia pada daerah δ = 3,8212 ppm puncak singlet menunjukkan proton dari –OCH3, hal ini didukung oleh spektrum inframerah pada bilangan gelombang
2939,52-2877,79 cm-1 puncak sedang menunjukkan adanya vibrasi ulur –CH alifatik dan bilangan