SKRINING FITOKIMIA DAN UJI EFEKTIVITAS
SEDIAAN GEL EKSTRAK ETANOL DAUN KELAPA SAWIT
(Elaeis guineensis Jacq.) TERHADAP PENYEMBUHAN
LUKA SAYAT
SKRIPSI
OLEH:
CINTA SUCI HASIBUAN
NIM 101501098
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
SKRINING FITOKIMIA DAN UJI EFEKTIVITAS
SEDIAAN GEL EKSTRAK ETANOL DAUN KELAPA SAWIT
(Elaeis guineensis Jacq.) TERHADAP PENYEMBUHAN
LUKA SAYAT
OLEH:
CINTA SUCI HASIBUAN NIM 101501098
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 14 Juli 2014
Pembimbing I, Panitia Penguji,
Dr. Marline Nainggolan, M.S., Apt. Prof. Dr. Karsono, Apt.
NIP 195709091985112001 NIP 195409091982011001
Pembimbing II, Dr. Marline Nainggolan, M.S., Apt. NIP 195709091985112001
Dr. Kasmirul Ramlan Sinaga, M.S., Apt. Dra. Suwarti Aris, M.Si., Apt. NIP 195504241983031003 NIP 195107231982032001
Dr. Edy Suwarso, S.U., Apt. NIP 130953857
Medan, 14 Juli 2014 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
SKRINING FITOKIMIA DAN UJI EFEKTIVITAS
SEDIAAN GEL EKSTRAK ETANOL DAUN KELAPA SAWIT
(Elaeis guineensis Jacq.) TERHADAP PENYEMBUHAN
LUKA SAYAT
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
tera Uta
OLEH:
CINTA SUCI HASIBUAN
NIM 101501098
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala
limpahan rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan
penelitan dan penyusunan skripsi ini. Skripsi ini disusun untuk melengkapi salah
satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas
Sumatera Utara, dengan judul Skrining Fitokimia dan Uji Efektivitas Sediaan Gel
Ekstrak Etanol Daun Kelapa Sawit (Elaeis guineensis Jacq.) Terhadap
Penyembuhan Luka Sayat.
Pada kesempatan ini, dengan kerendahan hati dan hormat, penulis
mengucapkan terima kasih kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt.,
selaku Dekan Fakultas Farmasi USU Medan, yang telah memberikan bimbingan
dan penyediaan fasilitas sehingga penulis dapat menyelesaikan pendidikan.
Penulis juga mengucapkan terima kasih Ibu Dr. Marline Nainggolan, M.S., Apt.,
dan Bapak Dr. Kasmirul Ramlan Sinaga, M.S., Apt., yang telah membimbing
dengan sangat baik, memberikan petunjuk, saran-saran dan motivasi selama
penelitian hingga selesainya skripsi ini, Bapak Prof. Karsono, Apt., selaku ketua
penguji, Ibu Dra. Suwarti Aris, M.Si., Apt., dan Bapak Edy Suwarso, S.U., Apt.,
selaku anggota penguji yang telah memberikan kritik, saran dan arahan kepada
penulis dalam menyelesaikan skripsi ini, dan Ibu Dra. Aswita Hafni Lubis, M.Si.,
Apt., selaku dosen penasehat akademik yang telah banyak membimbing penulis
selama masa perkuliahan hingga selesai, serta Bapak dan Ibu staf pengajar
Penulis mengucapkan terima kasih dan penghargaan yang tiada terhingga
kepada kedua orangtua yang selalu mendukung, mendoakan dan memberikan
semangat secara moral dan moril. Penulis juga mengucapkan terima kasih kepada
keluarga dan teman-teman yang selalu memberikan dukungan. Serta seluruh pihak
yang telah ikut membantu penulis namun tidak tercantum namanya.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan. Oleh karena itu dengan segala kerendahan hati, penulis
menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis
berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 14 Juli 2014 Penulis,
SKRINING FITOKIMIA DAN UJI EFEKTIVITAS SEDIAAN GELEKSTRAK ETANOL DAUN KELAPA SAWIT (Elaeis guineensis
Jacq.) TERHADAP PENYEMBUHAN LUKA SAYAT Abstrak
Kelapa sawit (Elaeis guineensis Jacq.) famili Arecaceae banyak tumbuh di Indonesia, yang terkenal dengan minyaknya. Salah satu penggunaan daunnya adalah sebagai obat luka, juga berkhasiat sebagai hepatoprotektor, antihipertensi, antidiabetes dan dapat mengobati toksisitas akut. Penelitian ini bertujuan untuk melakukan skrining fitokimia dan uji efektivitas sediaan gel ekstrak etanol daun kelapa sawit terhadap penyembuhan luka.
Serbuk daun kelapa sawit dimaserasi dengan pelarut etanol 80% selama 5 hari, serkai, ampasnya dicuci dengan etanol, filtrat didiamkan selama 2 hari kemudian dienap tuangkan. Maserat yang diperoleh diuapkan dengan bantuan rotary evaporator (±50ºC) dan dikeringkan dengan freeze dryer (±-40ºC). Terhadap serbuk simplisia dan ekstrak etanol daun kelapa sawit (EEDKS) dilakukan skrining fitokimia, karakterisasi, dan ekstrak diformulasi menjadi sediaan gel berbasis HPMC dengan konsentrasi 2,5, 5, dan 7,5%. Selanjutnya sediaan gel dievaluasi kemudian diuji efektivitasnya terhadap punggung kelinci yang dibuat menjadi luka sayat dengan diameter 2 cm.
Hasil skrining fitokimia serbuk simplisia dan EEDKS masing-masing mengandung alkaloid, flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid. Hasil karakterisasi simplisia dan ekstrak EEDKS diperoleh kadar air (6,64 dan 2,66%), kadar sari larut air (13,44 dan 20,13%), kadar sari larut etanol (16,85 dan 46,25%), kadar abu total (3,74 dan 2,52%), dan kadar abu yang tidak larut asam (0,76 dan 0,22%). Hasil evaluasi gel EEDKS stabil dalam penyimpanan selama 90 hari. Pemeriksaan homogenitas sediaan gel menunjukkan gel homogen, pH sediaan gel diperoleh nilai 6,0-6,4, nilai viskositas diperoleh 3,7 poise untuk basis gel, 3,4 poise gel 2,5%, 3,1 poise gel 5% dan 2,9 poise gel 7,5%. Hasil pemeriksaan sediaan gel EEDKS mampu menyembuhkan luka sayat dengan konsentrasi 5% (19 hari), 2,5% (20 hari), dan 7,5% (22 hari).
PHYTOCHEMICALS SCREENING AND EFFECTIVENESS TEST ETHANOL EXTRACT GEL OF OIL PALM LEAF (Elaeis guineensis Jacq.)
FOR WOUND HEALING Abstract
Oil palm (Elaeis guineensis Jacq.) leaf family Arecaceae widely growing in Indonesia, which is common known with its oil. One of the medical using is for wound healing, and also effective for hepatoprotective, antihypertensive, antidiabetic, and can heal acut toxicity. The objective of this research is to test phytochemicals screening and effectiveness test ethanol extract gel of oil palm leaf (elaeis guineensis jacq.) for wound healing.
Palm’s leaf powder macerated by ethanol 80% for 5 days, filtered, the residue has extraction by ethanol, then the filtrate leave for 2 days and poured ponder. The maserat has evaporated by using rotary evaporator (±50ºC) and dried by freeze dryer (±-40ºC). Simplicia powder and ethanol extract of palm’s leaf (EEDKS) have executed in phytochemical screening, characteristic, and the extract has formulated to gel preparation that have HPMC 4000 for the basic with its concentration 2.5, 5 and 7,5 %. Subsequently, gel preparations had evaluated then test the effectiveness on rabbit’s back which have wounded 2 cm for the diameter.
The results from phytochemicals screening of simplicia powder and EEDKS respectively have alkaloid, flavonoid, glikosida, saponin, tanin and steroid/triterpenoid. The results from characterization are obtained by water level (6,64 and 2,66%) (6,64 and 2,66%), water-soluble extract’s level (13,44 dan 20,13%), ethanol soluble extract’s level (16,85 dan 46,25%), total ash content (3,74 dan 2,52%), and ash level which insoluble in acid (0,76 dan 0,22%). The evaluated results from Gel EEDKS preparations had been stable for 90 days in storage. Homogeneity examination of gel preparation have showed homogeneous, the value of gel preparation is 6,0-6,4, viscosity value is 3,7 basic gel poise is 3,4 gel poise 2,5%, 3,1 gel poise 5% dan 2,9 gel poise 7,5%. The results of examination have significant correlation to healing the wound with each concentration 5% (19 days), 2,5% (20 days), and 7,5% (22 days).
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR LAMPIRAN ... xii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Habitat ... 6
2.1.2 Morfologi ... 6
2.1.4 Sistematika tumbuhan ... 7
2.1.5 Kandungan Kimia ... 7
2.1.6 Khasiat Tumbuhan ... 7
2.2 Ekstraksi ... 8
2.3 Gel ... 9
2.3.1 Hidroksi propil metil selulosa ... 11
2.3.2 Propilenglikol ... 12
2.3.3 Metil Paraben ... 12
2.3.4 Propil Paraben ... 13
2.4 Kulit ... 14
2.4.1 Epidermis ... 15
2.4.2 Dermis ... 16
2.4.3 Hipodermis ... 16
2.5 Luka ... 17
2.6 Pemberian Obat Melalui Kulit ... 19
2.7 Senyawa Kimia Tumbuhan Berkhasiat Penyembuh Luka ... 20
2.7.1 Alkaloida ... 20
2.7.2 Flavonoida ... 20
2.7.4 Tanin ... 21
2.7.5 Saponin ... 21
2.7.6 Steroid ... 21
BAB III METODE PENELITIAN ... 22
3.1 Alat ... 22
3.3 Pembuatan Pereaksi ... 23
3.3.1 Pereaksi meyer ... 23
3.3.2 Pereaksi dragendroff ... 23
3.3.3 Pereaksi molish ... 23
3.3.4 Pereaksi bouchardat ... 23
3.3.5 Pereaksi lieberman-bourchad ... 23
3.3.6 Pereaksi kloralhidrat ... 24
3.3.7 Pereaksi timbal (II) asetat 0,4 M ... 24
3.3.8 Pereaksi besi (III) klorida 1% (b/v) ... 24
3.3.9 Pereaksi asam klorida 2 N ... 24
3.3.10 Pereaksi asam sulfat 2 N ... 24
3.4 Hewan Percobaan ... 24
3.5 Pengumpulan dan Pengolahan Simplisia ... 25
3.5.1 Pengumpulan sampel ... 25
3.5.2 Identifikasi tumbuhan ... 25
3.5.3 Pengolahan sampel ... 25
3.6 Pembuatan Ekstrak ... 25
3.7 Skrining Fitokimia ... 26
3.7.1 Pemeriksaan alkaloida ... 26
3.7.2 Pemeriksaan flavonoida ... 27
3.7.3 Pemeriksaan tanin ... 27
3.7.4 Pemeriksaan glikosida ... 27
3.7.5 Pemeriksaan saponin ... 28
3.8 Karakterisasi Simplisia dan Ekstrak ... 28
3.8.1 Penetapan kadar air ... 28
3.8.2 Penetapan kadar sari yang larut dalam air ... 29
3.8.3 Penetapan kadar sari yang larut dalam etanol ... 30
3.8.4 Penetapan kadar abu total ... 30
3.8.5 Penetapan kadar abu tidak larut dalam asam ... 30
3.9 Pembuatan Formula Sediaan ... 31
3.9.1 Pembuatan basis gel ... 31
3.9.2 Komposisi formula ... 31
3.10 Evaluasi Formula ... 32
3.10.1 Pemeriksaan stabilitas fisik sediaan ... 32
3.10.2 Pemeriksaan homogenitas sediaan ... 33
3.10.3 Penentuan pH Sediaan ... 33
3.10.4 Penentuan viskositas Sediaan ... 33
3.11. Pengujian Sediaan gel terhadap Penyembuhan Luka Sayat 34 3.12. Analisis Data ... 35
BAB IV HASIL DAN PEMBAHASAN ... 36
BAB V KESIMPULAN DAN SARAN ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 46
DAFTAR PUSTAKA ... 47
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil Identifikasi tumbuhan kelapa sawit ... 53
2 Gambar tumbuhan kelapa sawit . ... 54
3 Gambar simplisia dan serbuk daun kelapa sawit ... 55
4 Perhitungan karakterisasi simplisia dan ekstrak ... 56
5 Perhitungan viskositas ... 61
6 Sedian gel ... 62
7 Homogenitas sediaan ... 63
8 Bagan alur penelitian ... 64
9 Bagan pembuatan gel ... 65
10 Data perubahan diameter luka sayat ... 66
11 Gambar luka sayat ... 67
12 Hasil variansi ANOVA ... 74
DAFTAR TABEL
Tabel Halaman
3.1 Komposisi formula gel ... 32
4.1 Hasil pemeriksaan skrining fitokimia serbuk simplisia dan ekstrak ... 36
4.2 Hasil karakterisasi simplisia dan ekstrak ... 37
4.3 Data pemeriksaan stabilitas fisik sediaan gel ... 38
4.4 Data pengamatan homogenitas sediaan ... 39
4.5 Data pengukuran pH ... 40
4.6 Data pengukuran viskositas ... 40
DAFTAR GAMBAR
Gambar Halaman
1.1 Kerangka pikir penelitian ... 5
2.1 Rumus bangun HPMC ... 11
2.2 Rumus bangun propilenglikol ... 12
2.3 Rumus bangun metil paraben ... 13
2.4 Rumus bangun propil paraben ... 13
2.5 Struktur kulit ... 14
3.1 Gambaran perhitungan diameter luka sayat ... 35
SKRINING FITOKIMIA DAN UJI EFEKTIVITAS SEDIAAN GELEKSTRAK ETANOL DAUN KELAPA SAWIT (Elaeis guineensis
Jacq.) TERHADAP PENYEMBUHAN LUKA SAYAT Abstrak
Kelapa sawit (Elaeis guineensis Jacq.) famili Arecaceae banyak tumbuh di Indonesia, yang terkenal dengan minyaknya. Salah satu penggunaan daunnya adalah sebagai obat luka, juga berkhasiat sebagai hepatoprotektor, antihipertensi, antidiabetes dan dapat mengobati toksisitas akut. Penelitian ini bertujuan untuk melakukan skrining fitokimia dan uji efektivitas sediaan gel ekstrak etanol daun kelapa sawit terhadap penyembuhan luka.
Serbuk daun kelapa sawit dimaserasi dengan pelarut etanol 80% selama 5 hari, serkai, ampasnya dicuci dengan etanol, filtrat didiamkan selama 2 hari kemudian dienap tuangkan. Maserat yang diperoleh diuapkan dengan bantuan rotary evaporator (±50ºC) dan dikeringkan dengan freeze dryer (±-40ºC). Terhadap serbuk simplisia dan ekstrak etanol daun kelapa sawit (EEDKS) dilakukan skrining fitokimia, karakterisasi, dan ekstrak diformulasi menjadi sediaan gel berbasis HPMC dengan konsentrasi 2,5, 5, dan 7,5%. Selanjutnya sediaan gel dievaluasi kemudian diuji efektivitasnya terhadap punggung kelinci yang dibuat menjadi luka sayat dengan diameter 2 cm.
Hasil skrining fitokimia serbuk simplisia dan EEDKS masing-masing mengandung alkaloid, flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid. Hasil karakterisasi simplisia dan ekstrak EEDKS diperoleh kadar air (6,64 dan 2,66%), kadar sari larut air (13,44 dan 20,13%), kadar sari larut etanol (16,85 dan 46,25%), kadar abu total (3,74 dan 2,52%), dan kadar abu yang tidak larut asam (0,76 dan 0,22%). Hasil evaluasi gel EEDKS stabil dalam penyimpanan selama 90 hari. Pemeriksaan homogenitas sediaan gel menunjukkan gel homogen, pH sediaan gel diperoleh nilai 6,0-6,4, nilai viskositas diperoleh 3,7 poise untuk basis gel, 3,4 poise gel 2,5%, 3,1 poise gel 5% dan 2,9 poise gel 7,5%. Hasil pemeriksaan sediaan gel EEDKS mampu menyembuhkan luka sayat dengan konsentrasi 5% (19 hari), 2,5% (20 hari), dan 7,5% (22 hari).
PHYTOCHEMICALS SCREENING AND EFFECTIVENESS TEST ETHANOL EXTRACT GEL OF OIL PALM LEAF (Elaeis guineensis Jacq.)
FOR WOUND HEALING Abstract
Oil palm (Elaeis guineensis Jacq.) leaf family Arecaceae widely growing in Indonesia, which is common known with its oil. One of the medical using is for wound healing, and also effective for hepatoprotective, antihypertensive, antidiabetic, and can heal acut toxicity. The objective of this research is to test phytochemicals screening and effectiveness test ethanol extract gel of oil palm leaf (elaeis guineensis jacq.) for wound healing.
Palm’s leaf powder macerated by ethanol 80% for 5 days, filtered, the residue has extraction by ethanol, then the filtrate leave for 2 days and poured ponder. The maserat has evaporated by using rotary evaporator (±50ºC) and dried by freeze dryer (±-40ºC). Simplicia powder and ethanol extract of palm’s leaf (EEDKS) have executed in phytochemical screening, characteristic, and the extract has formulated to gel preparation that have HPMC 4000 for the basic with its concentration 2.5, 5 and 7,5 %. Subsequently, gel preparations had evaluated then test the effectiveness on rabbit’s back which have wounded 2 cm for the diameter.
The results from phytochemicals screening of simplicia powder and EEDKS respectively have alkaloid, flavonoid, glikosida, saponin, tanin and steroid/triterpenoid. The results from characterization are obtained by water level (6,64 and 2,66%) (6,64 and 2,66%), water-soluble extract’s level (13,44 dan 20,13%), ethanol soluble extract’s level (16,85 dan 46,25%), total ash content (3,74 dan 2,52%), and ash level which insoluble in acid (0,76 dan 0,22%). The evaluated results from Gel EEDKS preparations had been stable for 90 days in storage. Homogeneity examination of gel preparation have showed homogeneous, the value of gel preparation is 6,0-6,4, viscosity value is 3,7 basic gel poise is 3,4 gel poise 2,5%, 3,1 gel poise 5% dan 2,9 gel poise 7,5%. The results of examination have significant correlation to healing the wound with each concentration 5% (19 days), 2,5% (20 days), and 7,5% (22 days).
BAB I PENDAHULUAN
1.1Latar Belakang
Indonesia merupakan salah satu penghasil komoditas kelapa sawit terbesar
di dunia, yang tumbuh dan tersebar di 22 provinsi (Departemen Pertanian, 2005).
Kelapa sawit umumnya hanya digunakan sebagai minyak goreng dan daunnya
sebagai limbah. Penggunaan secara tradisional, daun kelapa sawit diperas dipakai
untuk penyembuhan luka (Irvin, 1985). Ekstrak daun tanaman ini memilki
aktivitas antibakteri dan antioksidan (Sashidaran, dkk., 2009; Manjunatha, dkk.,
2005), antihipertensi (Juliana, 2011), antidiabetes (Varatharajan, 2012), sebagai
hepatoprotektor (Vijayarathna, 2012), serta dapat mengobati toksisitas akut
(Victor, 2013). Menurut Rajoo dan Syahmi, (2010) pada penelitiannya
menyatakan bahwa daun kelapa sawit tidak beracun dan direkomendasikan
sebagai produk alami komersial.
Daun kelapa sawit mengandung senyawa polifenol lebih tinggi dari pada
daun teh (flavonoid, karotenoid, dan katekhin) (Runnie dkk., 2003). Menurut
Sreenivasan (2010) menyebutkan bahwa daun kelapa sawit mengandung alkaloid,
flavonoid, gula reduksi, saponin, steroid, terpenoid, dan tanin. Banyaknya
kandungan senyawa kimia yang dimiliki daun kelapa sawit sangat berpotensi
sebagai obat luka (Sashidaran, dkk., 2009).
Luka adalah keadaan hilang/terputusnya kontinuitas jaringan (Mansjoer,
2000). Menurut Indonesia Enterostomal Therapy Nurse Association (InETNA)
normal. Luka sendiri dapat dibagi menjadi beberapa bagian yang salah satunya
berdasarkan penyebab, yaitu luka sayat (vulnus scisum) yang dapat disembuhkan
dengan pemberian obat penutup luka (Walton, 1990). Tujuan dari kesembuhan
luka adalah penutupan luka dengan cepat dan secara estetik tidak meningggalkan
bekas luka. Terminologi luka yang dihubungkan dengan waktu dapat dibagi
menjadi luka akut contohnya luka sayat (luka eksisi) dan luka kronis contohnya
luka bakar. Proses perbaikan jaringan dapat diurutkan ke dalam tiga fase yakni
hemostasis/inflamasi, proliferasi dan remodeling (Yuliani, 2012). Menurut Simon
dan Kerry (2000) senyawa-senyawa yang biasa digunakan sebagai antiinflamasi,
antibakteri, dan adstringensia adalah senyawa steroid, senyawa flavonoid, dan
tanin.
Dipasaran obat luka telah banyak beredar dalam bentuk gel dan krim, dari
jenis sediaan tersebut bentuk gel lebih banyak digunakan karena rasa dingin
dikulit, mudah mengering membentuk lapisan film sehingga mudah dibersihkan
(Suardi dan Murhayati, 2008). Bahan pembawa yang digunakan untuk sediaan
topikal akan memiliki pengaruh yang sangat besar terhadap absorbsi obat dan
memiliki efek yang menguntungkan jika dipilih secara tepat (Lachman, dkk.,
1994). Pemilihan hidroksi propil metil selulosa (HPMC) sebagai dasar gel karena
tidak berbau dan berasa, mudah larut dalam air panas dan sebagai penstabil pada
sediaan topikal seperti gel dan salep sedangkan propilenglikol dapat digunakan
sebagai pelarut dan pengawet (Rowe, dkk., 2005).
Penelitian sebelumnya telah dilakukan oleh Sashidaran, dkk. (2012), yaitu
formulasi salep ekstrak metanol daun kelapa sawit konsentrasi 10% untuk
mencit. Berdasarkan hal di atas peneliti tertarik melakukan penelitian terhadap
ekstrak etanol daun kelapa sawit (EEDKS) yang diformulasi sediaan gel berbasis
HPMC untuk selanjutnya diuji efektivitasnya terhadap penyembuhan luka sayat.
1.2Perumusan Masalah
a. Apakah golongan senyawa kimia yang terdapat pada simplisia dan ekstrak
daun kelapa sawit?
b. Apakah karakterisasi simplisia dan ekstrak daun kelapa sawit dapat dijadikan
pembanding untuk penelitian selanjutnya?
c. Berapakah konsentrasi yang paling efektif dalam penyembuhan luka sayat?
1.3Hipotesis
a. Golongan senyawa kimia yang terdapat pada simplisia dan ekstrak daun
kelapa sawit adalah golongan alkaloid, flavonoid, glikosida, saponin, tannin
dan steroid/triterpenoid.
b. Karakterisasi simplisia dan ekstrak daun kelapa sawit dapat dijadikan
pembanding untuk penelitian selanjutnya.
c. Konsentrasi yang paling efektif dalam penyembuhan luka sayat.
1.4Tujuan Penelitian
a. Untuk mengetahui golongan senyawa kimia yang terdapat dalam simplisia dan
ekstrak daun kelapa sawit.
c. Untuk mengetahui konsentrasi yang paling efektif dalam penyembuhan luka
sayat.
1.5 Manfaat Penelitian
Manfaat penelitian ini adalah sebagai informasi tentang kandungan
senyawa kimia, karakteristik dan efektivitas penyembuhan luka sayat dari daun
kelapa sawit.
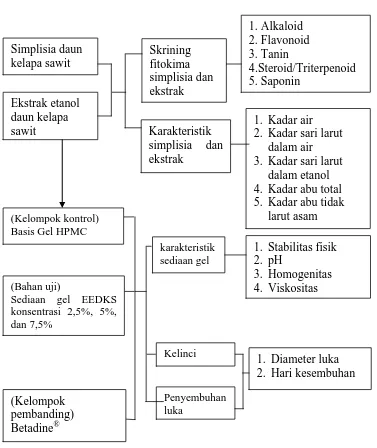
1.6Kerangka Penelitian
Penelitian dilakukan terhadap kelinci jantan yang di buat luka sayat pada
bagian punggung kelinci. Kerangka penelitian ini menjadi variabel bebas dan
variabel terikat. Terdapat 7 variabel bebas yaitu simplisia dan ekstrak etanol daun
kelapa sawit, sediaan gel tanpa EEDKS, sediaan gel EEDKS konsentrasi 2,5%,
5%, 7,5%, dan Betadine®. Variabel terikat meliputi golongan senyawa metabolit
sekunder simplisia dan ekstrak, karakteristik simplisia dan ekstrak, karakteristik
dan kualitas gel serta penyembuhan luka seperti yang ditunjukkan pada Gambar
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka penelitian 1. Alkaloid 2. Kadar sari larut
dalam air 3. Kadar sari larut
dalam etanol
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Habitat
Habitat asli kelapa sawit adalah di hutan dekat dengan sungai di Guinea
Savanna Afrika Barat yang kering. Tumbuhan ini dapat tumbuh baik pada daerah
di luar habitat aslinya, yaitu 16º lintang utara hingga 15º lintang selatan. Di
Indonesia penyebarannya di daerah Aceh, pantai timur Sumatra, Jawa dan
Sulawesi (Adlin, 2008).
2.1.2 Morfologi
Ciri-ciri morfologi tumbuhan kelapa sawit yaitu merupakan pohon yang
tingginya dapat mencapai 24 meter, mempunyai akar serabut yang mengarah ke
bawah dan samping. Selain itu terdapat beberapa akar yang tumbuh mengarah ke
samping atas untuk mendapatkan tambahan aerasi. Daunnya tersusun majemuk
menyirip, berwarna hijau tua dan pelepah berwarna sedikit lebih muda. Batang
tanaman diselimuti bekas pelepah hingga umur 12 tahun dan kemudian pelepah
yang mengering akan terlepas sehingga penampilan menjadi mirip dengan kelapa.
(Sastrosayono, 2008).
2.1.3 Nama daerah
Nama daerah dari tumbuhan kelapa sawit adalah Afrikaanse oliepalm
(Belanda), oelpalme (Jerman), oilpalm (Inggris), kelapa bali (Melayu), salak
2.1.4 Sistematika tumbuhan (Herbarium Medanense)
Sistematika tumbuhan kelapa sawit adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Kelas : Monocotyledoneae
Ordo : Arecales
Famili : Arecaceae
Genus : Elaeis
Spesies : Elaeis guineensis Jacq.
Nama lokal : Kelapa sawit
2.1.5 Kandungan kimia
Daun kelapa sawit mengandung alkaloid, flavonoid, glikosida
steroid/triterpenoid, saponin dan tanin (Sreenivasan, 2010).
2.1.6 Khasiat tumbuhan
Semua bagian tumbuhan ini memiliki manfaat, daunnya merupakan obat
tradisional untuk kanker, sakit kepala dan rematik. Ekstrak daun dan jus dari
tangkai daun muda dapat mengobati luka (Balick, 1996). Daging buahnya
digunakan dapat mengobati infeksi kulit, minyak dari buah dan bijinya digunakan
untuk memasak, membuat sabun, krim, dan kosmetik lainnya. Kayunya sebagai
bahan bangunan rumah, getah digunakan sebagai pencahar (Chong, 2008). Akar
digunakan untuk mengobati sakit kepala di Nigeria. Bubuk akar ditambahkan ke
minuman sebagai obat untuk gonore, menorrhagia, dan bronchitis (Sreenivasan,
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa
aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam
golongan minyak atsiri, alkaloid, flavonoid, dan lain-lain. Simplisia yang lunak
seperti rimpang dan daun mudah diserap oleh pelarut sehingga pada proses
ekstraksi tidak perlu diserbuk sampai halus. Simplisia yang keras seperti biji, kulit
kayu dan kulit akar susah diserap oleh pelarut maka perlu diserbuk sampai halus
(Direktorat Jendral POM, 2000: Departemen Kesehatan, 1979).
Ada beberapa metode ekstraksi yang sering digunakan antara lain yaitu:
1. Maserasi
Maserasi berasal dari kata “macerare” artinya melunakkan. Maserat adalah
hasil penarikan simplisia dengan cara maserasi. Maserasi adalah cara penarikan
simplisia dengan merendam simplisia tersebut dalam cairan penyari (Syamsuni,
2006). Dengan kata lain adalah proses pengekstrakan dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan. Remaserasi pengulangan penambahan pelarut setelah dilakukan
penyaringan maserat pertama dan seterusnya (Direktorat Jendral POM, 2000;
Departemen Kesehatan, 1979).
2. Perkolasi
Perkolasi berasal dari kata “percolare” yang artinya penetesan (Voigt,
1995). Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan. Serbuk simplisia
tetapi dibasahi atau dimaserasi terlebih dahulu dengan cairan penyari
sekurang-kurangnya selama 3 jam. (Departemen Kesehatan, 1979; Direktorat Jendral POM,
2000).
2.3 Gel
Gel suatu sediaan semipadat yang jernih, tembus cahaya dan mengandung
zat aktif yang merupakan dispersi koloid mempunyai kekuatan yang disebabkan
oleh jaringan yang saling berikatan pada fase terdispersi (Ansel, 1989; Aulton,
2007). Secara luas sediaan gel banyak digunakan pada produk obat-obatan,
kosmetik dan makanan juga pada beberapa proses industri (Herdiana, 2007).
Gel dibuat dengan proses peleburan atau diperlukan suatu prosedur khusus
berkenaan dengan sifat mengembang dari gel (Lachman., dkk, 1994). Jika masa
gel terdiri dari kelompok-kelompok partikel kecil yang berbeda, maka gel ini
dikelompokkan dalam sistem dua fase. Makromolekul pada sediaan gel
disebarkan keseluruh cairan sampai tidak terlihat ada batas diantaranya, disebut
dengan gel satu fase. (Ansel, 1989). Polimer-polimer yang biasa digunakan untuk
membuat gel meliputi gom alam, tragakan, pektin, karagen, agar, asam alginat,
serta bahan-bahan sintetis dan semisintetis seperti metil selulosa,
hidroksietilselulosa, karboksimetilselulosa, dan karbopol (Aulton, 2007).
Dasar gel yang umum digunakan adalah gel hidrofobik dan gel hidrofilik.
1. Dasar gel hidrofobik
Dasar gel hidrofobik umumnya terdiri dari partikel-partikel anorganik, bila
ditambahkan ke dalam fase pendispersi, hanya sedikit sekali interaksi antara
spontan menyebar, tetapi harus dirangsang dengan prosedur yang khusus (Ansel,
1989; Aulton, 2007).
2. Dasar gel hidrofilik
Dasar gel hidrofilik umumnya terdiri dari molekul-molekul organik yang
besar dan dapat dilarutkan atau disatukan dengan molekul dari fase pendispersi.
Umumnya daya tarik menarik pada pelarut dari bahan-bahan hidrofilik kebalikan
dari tidak adanya daya tarik menarik dari bahan hidrofobik. Sistem koloid
hidrofilik biasanya lebih mudah untuk dibuat dan memiliki stabilitas yang lebih
besar (Ansel, 1989; Aulton, 2007). Gel hidrofilik umummnya mengandung
komponen bahan pengembang, air, humektan dan bahan pengawet (Voigt, 1995).
Keuntungan sediaan gel :
Beberapa keuntungan sediaan gel (Voigt, 1995) adalah sebagai berikut:
1. kemampuan penyebarannya baik pada kulit
2. efek dingin, yang dijelaskan melalui penguapan lambat dari kulit
3. tidak ada penghambatan fungsi rambut secara fisiologis
4. kemudahan pencuciannya dengan air yang baik
5. pelepasan obatnya baik
Tingginya kandungan air dalam sediaan gel dapat menyebabkan terjadinya
kontaminasi mikrobial, yang secara efektif dapat dihindari dengan penambahan
bahan pengawet. Upaya stabilisasi dari segi mikrobial di samping penggunaan
bahan-bahan pengawet seperti dalam balsam, khususnya untuk basis ini sangat
cocok pemakaian metil dan propil paraben yang umumnya disatukan dalam
terhadap penguapan yaitu untuk menghindari masalah pengeringan (Voigt, 1995;
Aulton, 2007).
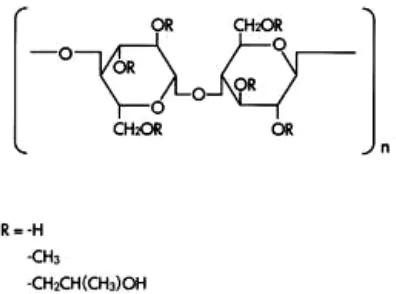
2.3.1 Hidroksi propil metil selulose (HPMC)
HPMC merupakan turunan metilselulosa yang memiliki ciri-ciri serbuk
atau butiran putih, tidak memiliki bau dan rasa. Sangat sukar larut dalam eter,
etanol atau aseton, mudah larut dalam air panas dan segera menggumpal
membentuk koloid. HPMC sebagai pengemulsi, pensuspensi dan sebagai
penstabil pada sediaan topikal seperti gel dan salep mampu menjaga penguapan
air sehingga secara luas banyak digunakan dalam aplikasi produk kosmetik dan
aplikasi lainnya.. (Rowe., dkk, 2005; Reynold, 1989). Rumus bangun HPMC
dapat dilihat pada Gambar 2.1.
Gambar 2.1 Rumus bangun HPMC 2.3.2 Propilen glikol
Propilen glikol adalah cairan kental, jernih, tidak berwarna, tidak berbau,
rasa agak manis. Dapat bercampur dengan air, etanol, kloroform dan minyak
lemak (Departemen Kesehatan, 1979). Propilen glikol telah banyak digunakan
sebagai pelarut dan pengawet dalam berbagai formulasi parental non parental.
Propilen glikol secara umum merupakan pelarut yang lebih baik dari gliserin dan
barbiturat, vitamin A dan D, alkaloid dan banyak anastetik lokal (Rowe., dkk,
2005; Reynold,1989). Rumus bangun propilen glikol dapat dilihat pada Gambar
2.2.
Gambar 2.2 Rumus bangun propilen glikol 2.3.3 Metil paraben
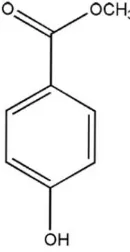
Metil paraben memiliki ciri-ciri serbuk hablur halus, berwarna putih,
hampir tidak berbau dan tidak mempunyai rasa kemudian agak membakar diikiuti
rasa tebal (Departemen Kesehatan, 1979; Rowe., dkk, 2005).
Metil paraben banyak digunakan sebagai pengawet dan antimikroba dalam
kosmetik, produk makanan dan formulasi farmasi, digunakan baik sendiri atau
dalam kombinasi dengan paraben lain atau antimikroba lain. Pada kosmetik, metil
paraben adalah pengawet antimikroba yang paling sering digunakan. Kemampuan
pengawet metil paraben ditingkatkan dengan penambahan propilen glikol (Soni,
2002). Rumus bangun metil paraben dapat dilihat pada Gambar 2.3.
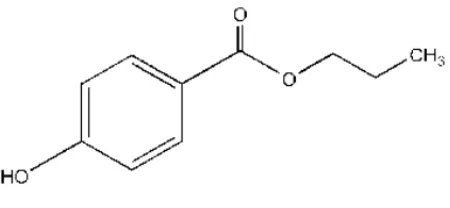
2.3.4 Propil paraben
Propil paraben merupakan serbuk kristalin putih, tidak berbau, dan tidak
berasa serta berfungsi sebagai pengawet (Steinberg, 2005). Konsentrasi propil
paraben yang digunakan pada sediaan topikal adalah 0,01-0,6 %. Propil paraben
efektif sebagai pengawet pada rentang pH 4-8, peningkatan pH dapat
menyebabkan penurunan aktivitas antimikrobanya. Propil paraben sangat larut
dalam aseton dan etanol, larut dalam 250 bagian gliserin dan sukar larut di dalam
air. (Wade, 1994; Reynold, 1989). Rumus bangun propil paraben dapat dilihat
pada Gambar 2.4.
Gambar 2.4 Rumus bangun propil paraben
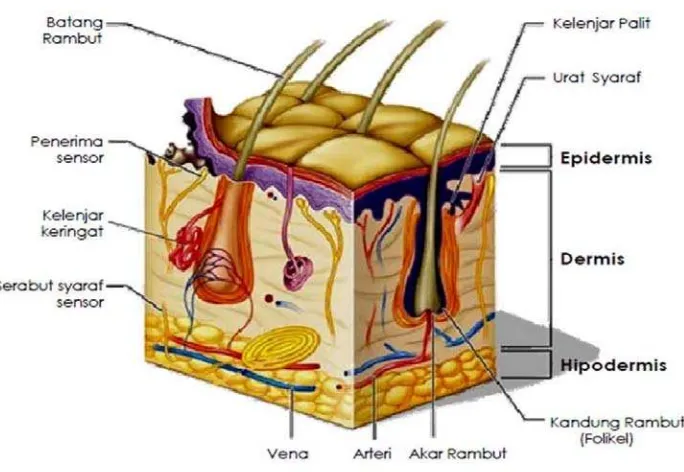
2.4. Kulit
Kulit adalah suatu organ pembungkus seluruh permukaan luar tubuh.
Seluruh kulit beratnya sekitar 16 % berat tubuh, pada orang dewasa sekitar 2,7-3,6
kg dan luasnya sekitar 1,5- 1,9 meter persegi. Tebalnya kulit bervariasi mulai 0,5
mm sampai 6 mm tergantung dari letak, umur dan jenis kelamin (Perdanakusuma,
2007; Handoko, 2010).
Fungsi utama kulit adalah sebagai pelindung, terdiri atas 650 kelenjar
keringat, 20 pembuluh darah, 60.000 melanosit dan ribuan ujung saraf tepi. Kulit
Kulit atau skin terdiri atas dua lapisan utama yaitu epidermis dan dermis.
Beberapa referensi lainnya menyebutkan bahwa hipodermis menjadi bagian dari
kulit sehingga kulit terdiri atas tiga lapisan, yaitu epidermis, dermis, dan
hipodermis (subkutis) (Arisanty, 2013; Wasitaatmadja, 2010). Sruktur kulit dapat
dilihat pada Gambar 2.5.
Gambar 2.5 Struktur kulit 2.4.1 Epidermis
Epidermis adalah lapisan paling luar dan paling tipis dari kulit. Epidermis
tidak memiliki pembuluh darah dan sistem persarafan. Epidermis diperbaharui
setiap 28 hari untuk migrasi ke permukaan, hal ini tergantung letak dan usia.
Tebal epidermis berbeda-beda pada berbagai tempat di tubuh, paling tebal pada
telapak tangan dan kaki. Ketebalan epidermis hanya sekitar 5 % dari seluruh
ketebalan kulit. Terjadi regenerasi setiap 4-6 minggu. (Arisanty, 2013;
Fungsi epidermis antara lain proteksi barier, organisasi sel, sintesis
vitamin D dan sitokin, pembelahan dan mobilisasi sel, pigmentasi (melanosit) dan
pengenalan alergen (Perdanakusuma, 2007).
Berikut ini adalah lapisan epidermis menurut Berger (2007), yaitu:
1. Stratum germinativum atau disebut stratum basale adalah lapisan paling dalam
dari epidermis yang mulai melakukan pembelahan sel (mitosis) pada
regenerasi sel keratinosit epidermis.
2. Stratum spinosum merupakan hasil pembelahan sel yang berikatan dan
melakukan migrasi sel ke arah atas.
3. Stratum granulosum mengandung sel granular dan keratin. Pada lapisan ini,
sel berinti mulai mati dan terus terdorong ke atas.
4. Stratum lusidum hanya ditemukan di telapak tangan dan telapak kaki. Pada
lapisan ini terdapat sel mati yang tidak memiliki inti.
5. Stratum korneum adalah lapisan paling atas memiliki sel keratin mati, tipis,
tidak berinti, dan berfungsi sebagai waterproof (anti air).
2.4.2 Dermis
Dermis adalah lapisan kedua dari kulit yang merupakan jaringan ikat,
memiliki banyak pembuluh darah, sistem persarafan dan kelenjar tubuh. Dermis
terdiri dari dua lapisan:
a. Lapisan papiler: tipis mengandung jaringan ikat jarang.
b. Lapisan retikuler: tebal terdiri dari jaringan ikat padat.
Dermis terdiri atas jaringan ikat, protein kolagen dan elastin, fibroblas,
sistem imun (makrofag, sel mast, limfosit), dan sistem saraf. Lapisan ini tebal
derivat epidermis yaitu folikel rambut dan kelenjar keringat. Fungsi dermis adalah
sebagai struktur penunjang, mechanical strength, suplai nutrisi, menahan shearing
forces dan respon inflamasi (Perdanakusuma, 2007; Hunter, 2003).
2.4.3 Hipodermis
Hipodermis atau lapisan subkutan adalah lapisan paling tebal dari kulit,
terdiri atas jaringan lemak (paling besar), jaringan ikat, fibroblast dan pembuluh
darah. Hipodermis memiliki fungsi sebagai penyimpan lemak, kontrol temperatur,
penyangga organ di sekitarnya dan menunjang suplai darah ke dermis untuk
regenerasi. Hipodermis tebal pada gluteus, abdomen dan mammae (Boyle, 2009;
Handoko, 2010). Hipodermis bukan merupakan bagian dari kulit, tetapi batasnya
tidak jelas yang letaknya di bawah dermis (Arisanty, 2013)
2.5Luka
Luka merupakan suatu gangguan normal lepasnya integritas epitel kulit
diikuti oleh gangguan struktur dari anatomi dan fungsinya (Yuliani, 2012).
Menurut Baroroh (2011) berdasarkan kedalaman dan luasnya luka dapat dibagi
menjadi 4 jenis, yaitu:
a. Stadium I, luka superfisial (Non-Blanching Erithema) : yaitu luka yang
terjadi pada lapisan epidermis kulit.
b. Stadium II, luka partial thickness: yaitu hilangnya lapisan kulit pada lapisan
epidermis dan bagian atas dari dermis.
c. Stadium III, luka full thickness: yaitu hilangnya kulit keseluruhan meliputi
kerusakan jaringan subkutan yang dapat meluas sampai bawah tetapi tidak
melewati jaringan yang mendasarinya. Lukanya sampai pada lapisan
d. Stadium IV, luka full thickness: yang telah mencapai lapisan otot, tendon dan
tulang dengan adanya destruksi/kerusakan yang luas
Penyembuhan luka adalah proses penggantian dan perbaikan fungsi
jaringan yang rusak (Boyle, 2009). Proses penyembuhan luka dibagi menjadi tiga
fase penyembuhan luka, yaitu fase inflamasi, fase proliferasi dan fase remodeling
(Arisanty, 2013).
Pada fase inflamatori atau fase satu, fase ini ditandai dengan adanya
eritrema, hangat pada kulit, udema dan rasa sakit yang berlangsung sampai hari
ke-3 atau hari ke-4 setelah luka dan peningkatan aliran darah ke daerah luka.
Bersamaan dengan aliran darah, terjadi juga aliran fibrin untuk menutup
pembuluh darah yang luka dan melindungi adanya infeksi bakteri. Pada fase ini
juga terjadi pengerahan sel darah putih, monosit, dan makrofag yang berfungsi
untuk memakan mikroorganisme dan sisa sel-sel yang mati (Dewi, dkk., 2013;
Barankin, 2006).
Fase berikutnya adalah fase proliperasi (perlekatan). Fase ini umumnya
berlangsung pada hari ke-5 sampai ke-20. Pada fase ini fibroblas membentuk
kolagen dan jaringan ikat. Di sini juga terjadi pembentukan kapiler baru yang
dimulai saat terjadi peradangan (Dewi, dkk., 2013). Proses ini sangat penting,
karena tidak ada jaringan baru yang dapat dibentuk tanpa suplai oksigen dan
nutrient yang dibawa oleh pembuluh darah yang baru (Boyle, 2009). Proses ini
menandakan terjadinya kesembuhan yang dimulai dari adanya pertumbuhan
kapiler dan pertumbuhan jaringan granula yang dimulai dari dasar luka. Proses
granulasi berjalan seiring dengan proses reepitelisasi. Sampai pada tahap akhir
berkembang menjadi keropeng yang terdiri dari plasma yang bercampur dengan
sel-sel mati (Dewi, dkk., 2013; Hunter, 2003).
Fase selanjutnya adalah fase pematangan atau fase diferensiasi atau fase
remodeling yang dapat berlangsung di atas 21 hari sampai lebih dari 2 bulan
bahkan beberapa tahun setelah luka. Pada fase ini terjadi ikatan kolagen yang
mengawetkan jaringan bekas luka dan proses epitelisasi yang melapisi kulit
(Dewi, dkk., 2013; Morison, 2003). Pada fase ini kolagen bekerja lebih teratur dan
lebih memiliki fungsi sebagai penguat ikatan sel kulit baru, kulit masih rentan
terhadap gesekan dan tekanan sehingga memerlukan perlindungan (Arisanty,
2013).
2.6 Pemberian Obat Melalui Kulit
Tujuan umum penggunaan obat pada terapi dermatologi adalah untuk
menghasilkan efek terapetik pada tempat-tempat spesifik di jaringan epidrrmis.
Absorbsi perkutan didefinisikan sebagai absorbsi yang dapat menembus lapisan
stratum korneum (lapisan tanduk) dan berlanjut menembus lapisan di bawahnya
dan akhirnya masuk ke sirkulasi darah (Lachman., dkk, 1994; Hunter, 2003).
Absorbsi perkutan suatu obat umumnya disebabkan oleh penetrasi obat
melalui stratum korneum. Stratum korneum sebagai jaringan keratin akan berlaku
sebagai membran buatan yang semi permiabel, dan molekul obat berpenetrasi
dengan cara difusi pasif, jadi jumlah obat yang pindah menyebrangi lapisan kulit
tergantung pada konsentrasi obat atau airnya. Bahan-bahan yang mempunyai sifat
larut dalam keduanya, minyak dan air, merupakan bahan yang baik untuk difusi
melalui stratum korneum seperti juga melalui epidermis dan lapisan-lapisan kulit
Prinsip absorbsi obat melalui kulit adalah difusi pasif yaitu proses dimana
suatu substansi bergerak dari daerah suatu sistem ke daerah lain dan terjadi
penurunan kadar gradien yang diikuti bergeraknya molekul. Difusi pasif
merupakan bagian terbesar dari proses trans-membran bagi umumnya obat. Daya
dorong untuk difusi pasif ini adalah perbedaan konsentrasi obat pada kedua sisi
membran sel. Difusi obat berbanding lurus dengan konsentrasi obat, koefisien
difusi, viskositas dan ketebalan membran (Martin., dkk, 1993; Rassner, 1995).
2.7Senyawa Kimia Tumbuhan Berkhasiat Penyembuh Luka
Senyawa kimia tumbuhan yang dapat berkhasiat terhadap penyembuhan
luka antara lain alkaloid, flavonoid, tanin, saponin dan steroid/triterpenoid.
2.7.1Alkaloid
Alkaloid diduga memiliki kemampuan sebagai antibakteri dengan
mekanisme mengganggu komponen penyusun peptidoglikan pada sel bakteri,
sehingga lapisan dinding sel tidak terbentuk secara utuh dan menyebabkan
kematian sel tersebut (Paju, 2013).
2.7.2Flavonoid
Flavonoid bertindak sebagai penampung radikal hidroksi dan
superhidroksi atau memperlambat timbulnya sel nekrosis tetapi juga dengan
meningkatkan vaskularisasi dengan demikian melindungi lipid membran terhadap
reaksi yang merusak. Flavonoid dapat menghambat pendarahan (Robinson, 1995;
Barku, 2013). Flavonoid juga dikenal untuk mempercepat proses penyembuhan
luka terutama karena memiliki aktivitas antimikroba dan astringen, yang memiliki
2.7.3 Tanin
Tanin merupakan komponen yang banyak terdapat dalam ekstrak tanaman
yang berkhasiat sebagai astringen dan mampu menciutkan luka, menghentikan
pendarahan dan mengurangi peradangan (Mun’im, dkk., 2010).
2.7.4 Saponin
Saponin yang terdapat dalam tumbuhan dapat memacu pembentukan
kolagen yang berperan dalam proses penyembuhan luka (Mappa, dkk., 2013).
Menurut Yenti, dkk., (2011), saponin juga memiliki kemampuan sebagai
pembersih dan antiseptik yang berfungsi membunuh atau mencegah pertumbuhan
mikroorganisme yang biasa timbul pada luka sehingga luka tidak mengalami
infeksi yang berat.
2.7.5Steroid/Triterpenoid
Steroid/Triterpenoid dikenal untuk mempercepat proses penyembuhan
luka terutama karena memiliki aktivitas antimikroba dan astringen, yang memiliki
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental dengan tahapan
penelitian yaitu, pengumpulan dan pengolahan sampel, identifikasi sampel,
pembuatan simplisia, skrining fitokimia dan karakterisasi simplisia serta ekstrak,
pembuatan ekstrak, pembuatan sediaan gel dari ekstrak etanol daun kelapa sawit,
evaluasi sediaan gel, pengujiaan sediaan gel terhadap penyembuhan luka sayat.
Pengamatan efek penyembuhan luka sayat dilakukan secara visual terhadap
diameter luka sayat dan analisis statistik.
3.1 Alat - alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, blender, eksikator, gunting bedah, mortir, neraca analitik, penangas
air, pH meter (HANNA instrument), pinset bedah, pisau cukur, pot plastik,
stamfer, spatula, sudip, termometer dan viskometer Brookfiled.
3.2 Bahan-bahan yang digunakan
Bahan uji yang digunakan dalam penelitian adalah daun kelapa sawit, dan
bahan kimia yang digunakan yaitu etanol 96%, kloral hidrat, toluen (p.a), air
suling, kalium iodida, merkuri (II) klorida, bismut nitrat, asam nitrat, iodium,
alpha naftol, asam asetat anhidrat, asam sulfat pekat, kloroform, besi (III)
klorida, timbal (II) asetat, natrium hidroksida, asam klorida pekat, metanol
(teknis), eter minyak tanah (teknis), etil asetat (teknis), serbuk seng, serbuk
air suling, akuades, Lidokain HCl, Betadine salep®, dan larutan dapar pH 4 dan
pH 7.
3.3 Pembuatan Pereaksi 3.3.1 Pereaksi meyer
Campurkan 60 ml larutan Raksa (II) Klorida dan 10 ml larutan Kalium
Iodida, tambahkan air secukupnya hingga 100 ml (Departemen Kesehatan, 1995).
3.3.2 Pereaksi dragendroff
Campur 20 ml larutan Bismuth (III) Nitrat dalam Asam Nitrat lalu
tambahkan dengan 50 ml larutan Kalium Iodida diamkan sampai memisah
sempurna. Ambil larutan jernih dan encerkan dengan air secukupnya hingga 100
ml (Departemen Kesehatan, 1995).
3.3.3 Pereaksi molish
Ditimbang sebanyak 3 g Alfa Naftol dilarutkan dalam Asam Nitrat 0,5 N
secukupnya hingga diperoleh larutan 100 ml (Departemen Kesehatan, 1995).
3.3.4 Pereaksi bouchardat
Sebanyak 4 g Kalium Iodida dilarutkan dalam 20 ml air suling kemudian
ditambah 2 g Iodium sambil diaduk sampai larut, lalu cukupkan dengan air suling
hingga 100 ml (Departemen Kesehatan, 1995).
3.3.5 Pereaksi lieberman-bourchard
Sebanyak 1 g bagian asam asetat anhidrat dicampurkan dengan 1 bagian
asam sulfat pekat (Farnswoth, 1966).
3.3.6 Pereaksi kloralhidrat
Larutkan 50 g Kloralhidrat jenuh dalam 20 ml air (Departemen Kesehatan,
3.3.7 Pereaksi timbal (II) asetat 0,4 M
Ditimbang sebanyak 15,17 g Timbal (II) Asetat dilarutkan dalam air
hingga 100 ml (Departemen Kesehatan, 1995).
3.3.8 Pereaksi besi (III) klorida 1 % (b/v)
Ditimbang sebanyak 1 g Besi (III) Klorida dilarutkan dalam air suling
hingga diperoleh larutan 100 ml kemudian disaring (Departemen Kesehatan,
1995).
3.3.9 Pereaksi asam klorida 2 N
Sebanyak 17 ml Asam Klorida pekat diencerkan dengan air suling hingga
100 ml (Departemen Kesehatan, 1995).
3.3.10 Pereaksi asam sulfat 2 N
Sebanyak 5,5 ml Asam Sulfat pekat diencerkan dengan air suling hingga
100 ml (Departemen Kesehatan, 1995).
3.4 Hewan Percobaan
Hewan yang digunakan pada penelitian ini adalah kelinci jantan dengan
berat 1,5 kg sampai 2 kg. Kelinci ini sebelumnya telah diaklimasi selama
seminggu. Kelinci dipelihara dalam kandang dan diberi makan standar.
3.5 Pengumpulan dan Pengolahan Sampel 3.5.1 Pengumpulan Sampel
Pengambilan sampel dilakukan secara purposif. Bahan diambil dari pohon
yang tumbuh di Perkebunan Kelapa Sawit PT. Perkebunan Nusantara II Tanjung
Morawa – Medan. Daun yang diambil sebagai sampel adalah daun yang masih
3.5.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Laboratorium Herbarium Medanense,
Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universitas Sumatera Utara, Medan.
3.5.3 Pengolahan Sampel
Sampel yang diperoleh dipisahkan dari tulang daunnya, dicuci hingga
bersih kemudian ditiriskan, dirajang dan ditimbang. Berat sampel yang digunakan
adalah 5 kg. Selanjutnya daun tersebut dikeringkan selama 5 hari dalam oven
dengan temperatur ±40oC sampai daun kering (ditandai bila diremas rapuh).
Sampel yang telah kering (rapuh) diserbuk dengan blender dan disimpan dalam
wadah tertutup rapat dan di simpan pada suhu kamar. Kemudian serbuk
ditimbang. Diperoleh berat kering sebesar 1,2 kg.
3.6 Pembuatan Ekstrak
Serbuk simplisia diekstraksi dengan cara maserasi dengan menggunakan
pelarut etanol. Sebanyak 1 kg serbuk simplisia dimasukkan ke dalam sebuah
bejana, dituangi dengan 7,5 L (75 bagian) etanol, ditutup, dibiarkan selama 5 hari
terlindung dari cahaya sambil sering diaduk lalu diserkai. Ampas diremaserasi
dengan etanol secukupnya hingga diperoleh 10 L (100 bagian). Pindahkan
maserat ke dalam bejana tertutup, dibiarkan di tempat sejuk terlindung dari cahaya
selama 2 hari, enap tuangkan. Pemekatan ekstrak dilakukan dengan alat rotary
evaporator pada suhu ±50°C hingga diperoleh ekstrak kental, selanjutnya di
3.7 Skrining Fitokimia
Skrining fitokimia terhadap serbuk simplisia dan ekstrak meliputi
pemeriksaan senyawa alkaloid, flavonoid, tanin, glikosida, saponin,
steroid/triterpenoid.
3.7.1 Pemeriksaan alkaloida
Sebanyak 0,5 g sampel ditimbang kemudian ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit,
didinginkan lalu disaring. Filtrat dipakai untuk percobaan berikut:
a. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Mayer akan
terbentuk endapan berwarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Bouchardat
akan terbentuk endapan berwarna coklat-hitam.
c. Filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Dragendorff
akan terbentuk endapan berwarna merah atau jingga.
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua
atau tiga dari percobaan di atas (Departemen Kesehatan, 1995).
3.7.2 Pemeriksaan flavonoida Larutan Percobaan:
Sebanyak 0,5 g sampel disari dengan 10 ml metanol lalu direfluks selama
10 menit, disaring panas-panas melalui kertas saring berlipat, filtrat diencerkan
dengan 10 ml air suling. Setelah dingin ditambah 5 ml eter minyak tanah, dikocok
hati-hati, didiamkan. Lapisan metanol diambil, diuapkan pada temperatur 40oC.
Satu ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan
dalam 1 ml etanol 96%, ditambahkan 0,1 g magnesium dan 10 ml asam klorida
pekat, terjadi warna merah jingga sampai merah ungu menunjukkan adanya
flavonoida (Departemen Kesehatan, 1995).
3.7.3 Pemeriksaan tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu
filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml
larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi
warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.7.4 Pemeriksaan glikosida
Sebanyak 3 g sampel ditimbang kemudian disari dengan 30 ml campuran
7 bagian volume etanol 96% dan 3 bagian volume air suling, selanjutnya
ditambahkan 10 ml HCl 2 N, direfluks selama 10 menit, didinginkan dan disaring.
Pada 30 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M,
dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali,
tiap kali dengan 20 ml campuran 3 bagian volume kloroform dan 2 bagian volume
isopropanol. Diambil lapisan air kemudian ditambahkan 2 ml air dan 5 tetes
pereaksi Molisch, ditambahkan hati-hati 2 ml asam sulfat pekat terbentuk cincin
warna ungu pada batas kedua cairan menunjukkan adanya ikatan gula
(Departemen Kesehatan, 1995).
3.7.5 Pemeriksaan saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2 N, bila buih tidak hilang
menunjukkan adanya saponin (Departemen Kesehatan, 1995).
3.7.6. Pemeriksaan steroida/triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 ml eter selama 2 jam, lalu
disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa dalam cawan penguap
ditambahkan 2 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat. Timbul
warna ungu atau merah kemudian berubah menjadi hijau biru menunjukkan
adanya steroida triterpenoida (Harborne, 1987).
3.8 Karakterisasi Simplisia dan Ekstrak 3.8.1 Penetapan kadar air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi
toluen). Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung penyambung,
tabung penerima 5 ml berskala 0,05 ml, alat penampung dan pemanas listrik.
Cara kerja :
Dimasukkan 200 ml toluena dan 2 ml air suling ke dalam labu alas bulat,
lalu didestilasi selama 2 jam. Setelah itu, toluena dibiarkan mendingin selama 30
menit, dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 ml.
Kemudian ke dalam labu tersebut dimasukkan 5 g sampel yang telah ditimbang
seksama, labu dipanaskan hati-hati selama 15 menit. Setelah toluena mendidih,
kecepatan tetesan diatur lebih kurang 2 tetes tiap detik sampai sebagian besar air
terdestilasi, kemudian kecepatan tetesan dinaikkan hingga 4 tetes tiap detik.
Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluena.
Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan
air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai
dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air
dihitung dalam persen (WHO, 1992; Departemen Kesehatan, 1995).
3.8.2 Penetapan kadar sari larut air
Sebanyak 5 g sampel dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml air-kloroform dalam air suling sampai 1 liter) dalam labu
bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan
selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai
kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa
dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang
larut dalam air dihitung terhadap bahan yang telah dikeringkan (WHO, 1992;
Departemen Kesehatan, 1995).
3.8.3 Penetapan kadar sari larut etanol
Sebanyak 5 g sampel dimaserasi selama 24 jam dalam 100 ml etanol 96%
dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian
dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan
etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap yang
berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC
sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96%
dihitung terhadap bahan yang telah dikeringkan (WHO, 1992; Departemen
Kesehatan, 1995).
3.8.4 Penetapan kadar abu total
Sebanyak 2 g sampel dimasukkan dalam krus porselin yang telah dipijar
jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui
kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam krus yang sama.
Masukkan filtrat ke dalam krus, uapkan, pijarkan hingga bobot tetap, timbang.
Kadar abu dihitung terhadap bahan yang telah dikeringkan (WHO, 1992;
Departemen Kesehatan, 1995).
3.8.5 Penetapan kadar abu tidak larut asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas,
dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu
yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan
(WHO, 1992; Departemen Kesehatan, 1995).
3.9 Pembuatan Formula Sediaan 3.9.1 Pembuatan basis gel
Basis gel rmenurut Soeratri (2004), adalah sebagai berikut:
R/ Hidroksipropilmetilselulosa (HPMC) 2,75 g
Propilenglikol 20 g
Metil paraben 0,15 g
Propil paraben 0,05 g
Akuades 77,05 g (ad 100 g)
Cara pembuatan: HPMC didispersikan terlebih dahulu dengan cara
menaburkan secara merata dalam air panas, lalu didiamkan selama 24 jam. Metil
sedikit demi sedikit ke dalam HPMC yang terdispersi dengan baik, lalu
ditambahkan dengan akuades hingga 100 g, dan digerus hingga homogen.
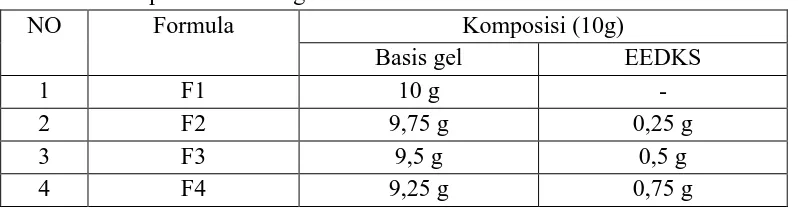
3.9.2 Komposisi formula
Sediaan dibuat dalam 4 formula dengan komposisi masing-masing 10 g
yang terlihat pada Tabel 3.1 dibawah ini.
Tabel 3.1 Komposisi formula gel EEDKS
NO Formula Komposisi (10g)
Basis gel EEDKS
1 F1 10 g -
2 F2 9,75 g 0,25 g
3 F3 9,5 g 0,5 g
4 F4 9,25 g 0,75 g
Keterangan: F1: gel tanpa EEDKS, F2: gel EEDKS 2,5%, F3: gel EEDKS 5%, F4: gel EEDKS 7,5%
Cara pembuatan sediaan gel EEDKS: ke dalam lumpang dimasukkan
EEDKS masing- masing dengan konsentrasi 2,5%, 5%, dan 7,5%, ditambahkan
sedikit demi sedikit basis gel lalu gerus sampai homogen.
3.10 Evaluasi Formula
Evaluasi formula meliputi evaluasi fisik dan biologi. Evaluasi fisik
meliputi pemeriksaan stabilitas sediaan, pemeriksaan homogenitas, pemeriksaan
pH dan viskositas selama 90 hari, yaitu pada hari ke-0, 7, 14, 21, 28 dan 90 hari.
Evaluasi biologi meliputi pemeriksaan efektivitas sediaan gel EEDKS terhadap
penyembuhan luka sayat.
3.10.1 Pemeriksaan stabilitas fisik sediaan
Pemeriksaan stabilitas fisik sediaan meliputi bentuk, warna, dan bau yang
warna, bau, dan penampilan tidak berubah secara visual selama penyimpanan.
pengamatan di lakukan pada suhu kamar pada hari ke-0, 7, 14, 21, 28 dan 90.
3.10.2 Pemeriksaan homogenitas sediaan
Cara: sejumlah tertentu sediaan dioleskan pada dua keping kaca atau
bahan transparan lain yang cocok, sediaan harus menunjukkan susunan yang
homogen dan tidak terlihat adanya butiran kasar (Direktorat Jendral POM, 1985).
Pengamatan di lakukan pada suhu kamar pada hari ke-0, 7, 14, 21, 28 dan 90.
3.10.3 Penentuan pH sediaan
Penentuan pH sediaan dilakukan dengan mengunakan pH meter.
Cara: alat terlebih dahulu dikalibrasi dengan menggunakan larutan dapar standar
pH netral (pH 7,01) dan larutan dapar pH asam (pH 4,01) hingga alat
menunjukkan harga pH tersebut, elektroda dicuci dengan air suling, lalu
dikeringkan dengan kertas tissue. Sampel dibuat dalam konsentrasi 1% yaitu
ditimbang 1 gram sediaan dan dilarutkan dalam 100 ml air suling, kemudian
elektroda dicelupkan dalam larutan tersebut, sampai alat menunjukkan harga pH
yang konstan. Angka yang ditunjukkan pH meter merupakan harga pH sediaan
(Rawlins, 2003). Pengamatan dilakukan pada suhu kamar pada hari ke-0, 7, 14,
21, 28 dan 90.
3.10.4 Penentuan viskositas sediaan
Penentuan viskositas sediaan menggunakan viskometer Brookfield.
Cara: sediaan dimasukkan kedalam gelas sampai mencapai volume 100 ml, lalu
spindel diturunkan hingga spindel tercelup ke dalam formulasi. Selanjutnya alat
dihidupkan dengan menekan tombol ON. Kecepatan spindel diatur, kemudian
Nilai viskositas dalam sentipoise (cps) diperoleh dari hasil perkalian skala baca
(dial reading) dengan faktor koreksi (f) khusus untuk masing- masing kecepatan
spindel. Pengamatan dilakukan pada suhu kamar pada hari ke-0, 7, 14, 21, 28 dan
90.
3.11 Pengujian Sediaan Gel Terhadap Penyembuhan Luka Sayat
Pengujian efek penyembuhan luka sayat dilakukan berdasarkan metode
oleh Stefan Frank and Heiko Kampfer (2000). Pengujian terdiri atas 6 kelompok
yaitu kelompok 1 yang diberi Betadine® (kontrol positif), kelompok 2 diberi gel
tanpa EEDKS (kontrol negatif) (F1), kelompok 3 tanpa diberi perlakuan,
kelompok 4 diberi gel EEDKS 2,5% (F2), kelompok 5 diberi gel EEDKS 5%
(F3), kelompok 6 diberi gel EEDKS 7,5% (F4).
Sebelum pengujian, kelinci dicukur bulu bagian punggungnya, dibuat pola
berbentuk lingkaran diameter ± 2 cm, didesinfikasi kulitnya dengan alkohol 70%,
lalu dianestesi lokal dengan lidokain HCl dengan dosis 1 ml. Kemudian dibuat
luka dengan ukuran tanda yang telah dibuat bentuk lingkaran dengan cara
mengangkat kulit hewan uji dengan pinset lalu digunting dengan gunting bedah,
dihitung diameter awal. Setelah itu, pada kulit yang telah disayat dioleskan ± 0,5 g
sediaan gel yang telah disediakan sesuai dengan kelompok masing-masing.
Pemberian sediaan gel dilakukan secara topikal dengan cara mengoleskannya di
bagian luka sebanyak 1 kali sehari. Pengamatan luka dilakukan setiap hari secara
visual dengan mengukur diameter luka dan hari kesembuhan. Luka dianggap
Diameter luka dihitung dengan rumus:
d = d1 + d2 + d3 + d4 4
Keterangan: d : diameter rata-rata d1 : diameter pertama d2 : diameter kedua d3 : diameter ketiga d4 : diameter keempat
Gambaran perhitungan diameter luka sayat pada punggung kelinci dapat
dilihat pada gambar di bawah ini:
Gambar 3.1 Gambaran perhitungan diameter luka sayat
3.12 Analisis Data
Data hasil penelitian dianalisis dengan menggunakan program SPSS
(Statistical Product and Service Solution) 18. Pertama data dianalisis
menggunakan metode Kolmogorov Smirnov untuk menentukan homogenitas dan
normalitasnya. Kemudian dilanjutkan dianalisis menggunakan metode One Way
ANOVA untuk menentukan perbedaan rata-rata diantara kelompok. Jika terdapat
perbedaan, dilanjutkan dengan menggunakan uji Post Hoc Tukey HSD untuk
melihat perbedaan nyata antar perlakuan. d1
d2
d3
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Identifikasi sampel dilakukan oleh Laboratorium Herbarium Medanense
Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universitas Sumatera Utara, Medan. Hasil identifikasi adalah kelapa sawit (Elaeis
guineensis Jacq.), famili Arecaceae, dapat dilihat pada Lampiran 1 halaman 53.
4.2 Hasil Ekstraksi
Ekstraksi secara maserasi dengan pelarut etanol 80% untuk menarik
senyawa yang terdapat dalam simplisia baik yang bersifat non polar dan polar.
Hasil ekstraksi dari 1 kg simplisia diperoleh ekstrak etanol 152,85 g dan setelah di
freeze dryer pada suhu ±-40ºC diperoleh 39,90 g.
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia simplisia dan ekstrak dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil skrining fitokimia serbuk simplisia dan EEDKS
Keterangan: ( + ) = Positif, ( - ) = Negatif
Pada pemeriksaan skirining alkaloid dengan penambahan pereaksi Mayer
terbentuk endapan putih, Bourchardat terbentuk endapan berwarna coklat
kemerahan dan dengan Dragendroff terbentuk endapan berwarna jingga.
No. Golongan senyawa Hasil
Penambahan pereaksi Molish dan asam sulfat pekat membentuk cincin berwarna
ungu yang menunjukkan adanya senyawa glikosida. Terbentuknya busa yang
stabil dengan pengocokkan dengan air panas dan tidak hilang dengan penambahan
HCl 2 N, ini menunjukkan adanya senyawa saponin (Depkes, 1995). Penambahan
serbuk Mg dan asam klorida pekat menghasilkan larutan berwarna merah dan
penambahan amil alkohol terbentuk warna merah yang menunjukkan adanya
flavonoid. Penambahan FeCl3 memberikan warna biru kehitaman yang
menunjukkan adanya senyawa tanin (Fransworth, 1966). Penambahan pereaksi
Liebermann-Burchad membentuk warna merah ungu yang menunjukkan adanya
senyawa steroid/triterpenoid (Robinson, 1991).
4.4 Hasil Karakterisasi Simplisia dan Ekstrak Daun Kelapa Sawit
Hasil karakterisasi simplisia dan ekstrak dapat dilihat pada Tabel 4.2 dan
contoh perhitungan dapat dilihat pada Lampiran 4 halaman 56. Monografi dari
simplisia daun kelapa sawit tidak ditemukan di buku Materia Medika Indonesia (MMI),
sehingga tidak ada acuan untuk menentukan parameter simplisia tersebut.
Tabel 4.2 Hasil karakterisasi simplisia dan ekstrak
No Parameter
Pada tabel di atas dapat terlihat bahwa kadar air simplisia dan ekstrak
memenuhi persyaratan umu yaitu di bawah 10%. Penetapan kadar air dilakukan
karena air merupakan media yang baik untuk tumbuhnya jamur. Penetapan kadar
dalam simplisia maupun ekstrak. Penetapan kadar sari larut air adalah untuk
mengetahui kadar senyawa yang bersifat polar, sedang kadar sari larut dalam
etanol untuk mengetahui senyawa yang terlarut dalam etanol, baik polar maupun
non polar. Penetapan kadar abu total dilakukan untuk mengetahui kadar senyawa
anorganik dalam simplisia, misalnya logam K, Ca, Na, Pb dan Hg, sedang
penetapan kadar abu tidak larut dalam asam dilakukan untuk mengetahui kadar
senyawa abu yang tidak larut dalam asam, misalnya silika.
4.5 Hasil Evaluasi Sediaan
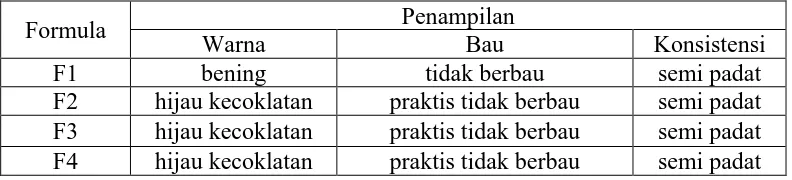
4.5.1 Hasil pemeriksaan stabilitas fisik sediaan
Hasil pemeriksaan stabilitas fisik formulasi sediaan gel EEDKS dapat
dilihat pada Tabel 4.3 dan gambar sediaan gel Lampiran 6 halaman 62.
Tabel 4.3 Data pemeriksaan stabilitas fisik sediaan gel EEDKS
Formula Penampilan
Warna Bau Konsistensi
F1 bening tidak berbau semi padat
F2 hijau kecoklatan praktis tidak berbau semi padat F3 hijau kecoklatan praktis tidak berbau semi padat F4 hijau kecoklatan praktis tidak berbau semi padat
Keterangan: F: Formula, 1: gel tanpa EEDKS, 2: gel EEDKS 2,5%, 3: gel EEDKS 5%, dan 4: gel EEDKS 7,5%
Sediaan formula 2 dan 3 memiliki penampilan sama yaitu warna hijau
kecoklatan sedikit lebih muda dan konsistensi lebih padat dibandingkan formula 4
warnanya lebih pekat dengan konsistensi yang encer. Hasil pemeriksaan stabilitas
fisik sediaan gel menunjukkan bahwa semua sediaan gel tidak mengalami
perubahan yang berarti dari segi penampilan sediaan baik warna, bau maupun
konsistensinya setelah penyimpanan selama 90 hari. Hal ini menunjukkan bahwa
4.5.2 Hasil pengamatan homogenitas sediaan
Hasil pengamatan homogenitas dari semua sediaan adalah homogen,
hasilnya dapat dilihat pada Tabel 4.4 dan gambarnya pada Lampiran 7 halaman
63. Uji homogenitas bertujuan untuk melihat dan mengetahui bahan-bahan
sediaan gel apakah terdistribusi secara merata.
Tabel 4.4 Data pengamatan homogenitas sediaan
Keterangan: F: Formula, 1: gel tanpa EEDKS, 2: gel EEDKS 2,5%, 3: gel EEDKS 5%, dan 4: gel EEDKS 7,5%, (+) = tidak homogen, (−) = homogen 4.5.3 Hasil Penentuan pH Sediaan
Hasil penentuan pH sediaan gel EEDKS dilakukan dengan menggunakan
pH meter untuk seluruh sediaan dapat dilihat pada Tabel 4.5. Nilai pH sediaan gel
EEDKS diperoleh antara 6,0 - 6,4, sediaan tersebut cenderung stabil. Penurunan
nilai pH pada suatu sediaan bisa dipengaruhi oleh lingkungan seperti gas-gas di
udara yang bersifat asam. Kenaikan nilai pH dipengaruhi oleh adanya mikroba di
dalam sediaan (Ida, dkk., 2012).
Tabel 4.5 Data pengukuran pH
Sediaan Nilai pH Rata-rata Pada Hari Ke
0 7 14 21 28 90
F1 6,3 6,3 6,3 6,3 6,3 6,4
F2 6,0 6,0 6,0 6,0 6,0 6,1
F3 6,0 6,0 6,0 6,0 6,0 6,0
F4 6,0 6,0 6,0 6,0 6,2 6,2
Keterangan: F: Formula, 1: gel tanpa EEDKS, 2: gel EEDKS 2,5%, 3: gel EEDKS 5%, 4: gel EEDKS 7,5%.
Sediaan Lama Pengamatan (hari)
0 7 14 21 28 90
F1 - - - - - -
F2 - - - - - -
F3 - - - - - -
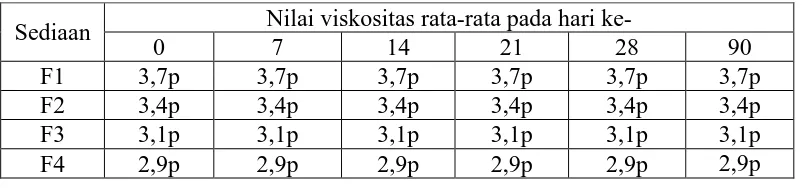
4.5.4 Hasil penentuan viskositas sediaan
Hasil penentuan viskositas gel EEDKS dilakukan menggunakan
viskometer Brookfield pada seluruh sediaan. Hasil penentuan viskositas sediaan
dapat dilihat pada Tabel 4.6 dan contoh perhitungan pada Lampiran 5 halaman 61.
Tabel 4.6 Data pengukuran viskositas
Sediaan Nilai viskositas rata-rata pada hari ke-
0 7 14 21 28 90
F1 3,7p 3,7p 3,7p 3,7p 3,7p 3,7p
F2 3,4p 3,4p 3,4p 3,4p 3,4p 3,4p
F3 3,1p 3,1p 3,1p 3,1p 3,1p 3,1p
F4 2,9p 2,9p 2,9p 2,9p 2,9p 2,9p
Keterangan: F: Formula, p: poise, 1: gel tanpa EEDKS, 2: gel EEDKS 2,5%, 3: gel EEDKS 5%, 4: gel EEDKS 7,5%
Berdasarkan di atas dapat dilihat hasil viskositas sediaan gel stabil dalam
penyimpanan. Nilai viskositas sediaan gel yang baik yaitu 2000-4000 cps (Garg
et, al., 2002) sehingga sediaan gel EEDKS memenuhi persyaratan viskositas gel.
4.6 Hasil Uji Efektivitas Penyembuhan Luka Sayat
Pengujian efektivitas penyembuhan luka sayat dilakukan berdasarkan
metode oleh Stefan Frank and Heiko Kampfer (2000). Pengamatan dilakukan
dilakukan 1 kali sehari secara visual. Hasil pengamatan menunjukkan pemberian
sediaan gel EEDKS dapat mempercepat penyembuhan luka dibandingkan dasar
gel. Luka pada hewan uji dinyatakan sembuh yang ditandai dengan perubahan
diameter luka yaitu semakin mengecil. Data hasil perubahan diameter luka dapat