PRAPERLAKUAN FISIK DAN BIOLOGI TERHADAP
BIOMASSA ECENG GONDOK UNTUK PRODUKSI ENZIM
SELULASE OLEH ASPERGILLUS NIGER DAN TRICHODERMA
REESEI
TESIS
Oleh
FENI AMRIANI
117022003/TK
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
MEDAN
PRAPERLAKUAN FISIK DAN BIOLOGI TERHADAP
BIOMASSA ECENG GONDOK UNTUK PRODUKSI ENZIM
SELULASE OLEH ASPERGILLUS NIGER DAN TRICHODERMA
REESEI
T E S I S
Untuk Memperoleh Gelar Magister Teknik
Pada Program Studi Teknik Kimia
Fakultas Teknik Universitas Sumatera Utara
Oleh
FENI AMRIANI
117022003/TK
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
MEDAN
ABSTRAK
Eceng gondok yang tumbuh dengan cepat menyebabkan eutrofikasi badan air sehingga menghabiskan nutrisi dan oksigen dalam air. Namun, eceng gondok yang merupakan biomassa lignoselulosa berpotensi digunakan untuk produksi enzim selulase oleh beberapa jenis mikroba seperti Aspergillus niger dan Trichoderma reesei. Praperlakuan dilakukan untuk mendegradasi lignin dan meningkatkan aksesibilitas mikroba terhadap selulosa sebelum eceng gondok digunakan sebagai substrat. Pada penelitian ini, praperlakuan fisik dilakukandengan pengurangan ukuran biomassa dan praperlakuan biologi dengan menggunakan jamur pelapuk putih dengan variasi variable waktu fermentasi 3, 5, 7, 8 dan 9 hari, moisture content 65%, 70%, 75%, 80%, dan 85%, dan penggunaan mikroba mono dan mix kultur. Hasil penelitian menunjukkan bahwa eceng gondok mengandung selulosa 27,78%, hemiselulosa 37,50% dan lignin 5,99%, namun setelah dilakukan praperlakuan fisik dan biologi, lignin terdegradasi menjadi 4,63% dan 2,90% untuk masing-masing praperlakuan. Kondisi terbaik fermentasi untuk produksi enzim selulase pada sampel eceng gondok dengan praperlakuan fisik diperoleh pada hari ke-7, moisture content 75%, dan penggunaan mono kultur mikroba Aspergillus niger dengan aktivitas enzim selulase 0,207 IU/ml. Pada sampel eceng gondok dengan praperlakuan biologi kondisi terbaik fermentasi diperoleh pada hari ke-7, moisture content 80%, dan penggunaan mono kultur mikroba Aspergillus niger dengan aktivitas enzim selulase 0,107 IU/ml.
Kata kunci : Aspergillus niger, Eceng Gondok, Enzim Selulase,
ABSTRACT
The Overgrowth of water hyacinth leads to eutrophication of water bodies as it exhausts nutrient and oxygen contents in water. However, it can be potentially used as lignocellulose biomass for cellulase production by several types of microbes such as Aspergillus niger and Trichoderma reesei. Physical pretreatment is conducted by size reduction of biomass and biological pretreatment by relying white rot fungus in which used to degrade lignin and improve accessibility of microbes to the cellulose, using variance of variable fermentation time 3, 5, 7, 8 and 9 days; substrate moisture content 65%, 70%, 75%, 80%, and 85%, and the use of microbes in mono and mix cultures respectively. The result showed that water hyacinth contains cellulose 27.78%, hemicellulose 37.50% and lignin 5.99%. Physical and biological pretreatment to biomass showed lignin degradation to 4.63% and 2.90% respectively. The best conditions for cellulase production on water hyacinth biomass with physical pretreatment were at 7th day incubation period, 75% of moisture content by mono culture Aspergillus niger with cellulase activity 0.207 IU/ ml, and the best conditions for water hyacinth biomass with biological pretreatment were at 7th day incubation period, 80% of moisture content by mono culture Aspergillus niger with cellulase activity 0.107 IU/ml.
KATA PENGANTAR
Alhamdulillah, segala puji syukur kepada Allah SWT atas segala karunia dan
ridho-Nya, sehingga tesis dengan judul “Praperlakuan Fisik dan Biologi Terhadap
Biomassa Eceng Gondok Untuk Produksi Enzim Selulase Oleh Aspergillus niger
dan Trichoderma reesei” ini dapat diselesaikan.
Tesis ini disusun setelah melalui penelitian dan konsultasi untuk memenuhi
salah satu persyaratan memperoleh gelar Magister Teknik (M. T) di Program
Magister Teknik Kimia dengan sumber dana berasal dari Lembaga Pengelola Dana
Pendidikan Jakarta.
Oleh karena itu, pada kesempatan ini penulis menyampaikan rasa hormat dan
dan ucapan terima kasih yang sebesar-besarnya, kepada :
1. Ibu Dr. Fatimah, M. T dan Ibu Dr. Iriany, M. Si atas bimbingan, arahan, dan
waktu yang telah diluangkan kepada penulis untuk berdiskusi selama menjadi
Dosen pembimbing penelitian dan perkuliahan.
2. Bapak Dr. Taslim, M. Si dan Bapak Dr. Irvan, M. Eng yang telah memberikan
masukan dan saran pada saat seminar proposal dan seminar hasil tesis.
3. Ketua Program Studi Magister Teknik Kimia Universitas Sumatera Utara, Dr.
Taslim, M. Si.
4. Sekretaris Program Studi Magister Teknik Kimia Universitas Sumatera Utara,
5. Okta Bani, ST, MT, Ika Herawati Hasibuan, dan Wan Rizky atas banyak
bantuannya dalam penelitian dan penyusunan laporan tesis ini.
6. Ayahanda Alm. Ir. Amrul Ambia dan Ibunda Yeni Afriyani, serta adik-adik Vidi,
Vici, dan Devin yang telah menginspirasi dan segala dukungan dan doanya.
Suami tercinta dr. Rizky Julana dan anak-anak tercinta Harits, Sarah, Hammam,
dan Shafiyyah inspirasi dan semangat terbesar dan ucapan terima kasih atas
segala dukungan, kesabaran, dan doanya selama ini.
7. Rekan-rekan S-2 Teknik Kimia angkatan 2011 dan 2012. Semoga semua bisa
cepat selesai , dan
8. Semua civitas dan staf administrasi Fakultas Teknik Universitas Sumatera Utara.
Dengan keterbatasan pengalaman, pengetahuan maupun pustaka yang
ditinjau, penulis menyadari bahwa tesis ini masih banyak kekurangan dan perlu
pengembangan lebih lanjut agar benar-benar bermanfaat. Oleh sebab itu, penulis
sangat mengharapkan saran dan kritik agar tesis ini lebih sempurna serta sebagai
masukan bagi penulis untuk penelitian dan penulisan karya ilmiah di masa yang akan
datang .
Akhir kata, penulis berharap tesis ini memberikan manfaat bagi kita semua
terutama untuk pengembangan ilmu pengetahuan yang ramah lingkungan.
Medan, November 2013
Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 Februari 1984, dan merupakan
anak pertama dari empat bersaudara dari pasangan Alm. Ir. Amrul Ambia dan Yeni
Afriyani. Pendidikan Sekolah Dasar ditempuh di SDN Pacet II Cipanas, Jawa Barat
lulus tahun 1995, selanjutnya di SLTP Mardi Yuana Santo Yusuf Sindang Laya, Jawa
Barat lulus tahun 1998. Tahun 2001 penulis menamatkan Sekolah Menengah Atas di
SMU N 1 Cianjur.
Pada tahun 2002 penulis melanjutkan pendidikan di Teknik Kimia Universitas
Syiah Kuala Banda Aceh dan lulus pada tahun 2008. Kemudian pada tahun 2011
penulis mengambil program Magister Teknik Kimia di Fakultas Teknik Universitas
Sumatera Utara.
DAFTAR ISI
Halaman
Lembar Pengesahan ... i
Abstrak ... ii
Abstract ... iii
Kata Pengantar ... iv
Riwayat Hidup ... vi
Daftar Isi ... vii
Daftar Tabel ... x
Daftar Gambar ... xi
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 12
1.3 Tujuan Penelitian ... 13
1.4 Manfaat Penelitian ... 13
1.5 Lingkup Penelitian ... 13
II. TINJAUAN PUSTAKA ... 15
2.1 Karakteristik dan Pola Pertumbuhan Eceng Gondok ... 15
2.2 Pengendalian dan Pemanfaatan Eceng Gondok ... 18
2.3 Eceng Gondok dalam Produksi Enzim ... 22
2.4 Selulase ... 24
Halaman
2.5.1 Substrat, Mikroorganisme, dan Praperlakuan ... 27
2.5.2 Fermentasi ... 35
2.6 Produksi Enzim Selulase dengan Substrat Eceng Gondok dan Perkembangannya ... 42
III. METODOLOGI PENELITIAN ... 45
3.1 Lokasi dan Waktu Penelitian ... 45
3.2 Alat dan Bahan ... 45
3.3 Rancangan Percobaan ... 46
3.4 Prosedur Percobaan ... 46
3.4.1 Pembenihan Mikroba ... 46
3.4.2 Praperlakuan Eceng Gondok ... 47
3.4.3 Penyiapan Inokulum Cair ... 50
3.4.4 Produksi Enzim Selulase ... 50
3.4.5 Pengambilan Enzim ... 51
3. 5 Analisa Hasil Penelitian ... 52
3.5.1 Analisa Kadar Lignin dan Selulosa ... 52
3.5.2 Uji Aktivitas Enzim ... 53
IV. HASIL DAN PEMBAHASAN ... 56
4.1 Persiapan Bahan Sampel Biomassa Eceng Gondok dan Mikroba ... 56
4.1.1 Bahan Sampel Biomassa Eceng Gondok ... 56
Halaman
4.2 Produksi Enzim Selulase ... 59
4.3 Pengambilan Enzim dan Pengujian Aktivitas Enzim ... 60
4.4 Hasil Praperlakuan Fisik dan Biologi ... 61
4.4.1 Hubungannya dengan Degradasi Lignin ... 62
4.4.2 Hubungannya dengan Produksi Enzim Selulase ... 65
4.5 Pengaruh Variasi Kultur Mikroba terhadap Aktivitas Enzim Selulase ... 67
4.6 Pengaruh Variasi Moisture Content terhadap Aktivitas Enzim Selulase .... 70
4.7 Pengaruh Variasi Waktu Fermentasi (Incubation Period) terhadap Aktivitas Enzim Selulase ... 71
4.8 Respon Maksimum Aktivitas Enzim Selulase ... 73
4.9 Ringkasan Produksi Enzim Selulase dengan Metode Praperlakuan Fisik dan Biologi ... 75
V. PENUTUP ... 76
5.1 Kesimpulan ... 76
5.2 Saran ... 77
DAFTAR PUSTAKA ... 78
DAFTAR TABEL
Nomor Judul Halaman
1.1 Perkembangan Produksi Selulase dari Bahan Lignoselulosa/
Selulosa ... 4
2.1 Kandungan Lignin, Selulosa, danHemiselulosaEcengGondok ... 17
2.2 Metode Pengendalian dan Kekurangannya ... 20
2.3 Mikroorganisme Penghasil Selulase ... 29
2.4 Teknologi Praperlakuan, Deskripsi, Kekurangan, dan Kelebihan ... 34
2.5 Komposisi Medium Mandel Weber ... 42
2.6 Penelitian Mengenai Produksi Enzim Selulase Dengan Substrat Eceng Gondok ... 44
4.1 Kadar Lignin-Selulosa Biomassa Eceng Gondok ... 62
4.2 Enzim dan Reaksinya yang Terlibat di Dalam Degradasi Lignin ... 64
DAFTAR GAMBAR
Nomor Judul Halaman
2.1 Tanaman Eceng Gondok ... 16
2.2 Skema Utilisasi Eceng Gondok ... 22
2.3 Mekanisme Hidrolisis Selulosa ... 25
2.4 Aspergillus Niger ... 31
2.5 Trichoderma Reesei ... 32
2.6 Skema Tujuan Pretreatment pada Biomassa Lignoselulosa ... 33
3.1 Skema Praperlakuan Fisik ... 48
3.2 Skema Praperlakuan Biologi ... 49
3.3 Diagram Alir Produksi Enzim Selulase ... 55
4.1 Eceng Gondok ... 56
4.2 Sampel Kering Eceng Gondok Hasil Praperlakuan Fisik ... 57
4.3 Pertumbuhan Jamur Pelapuk Putih ... 58
4.4 Aspergillus Niger, Trichoderma Reesei, dan Ganoderma. B ... 58
4.5 Kurva Standar Glukosa ... 61
4.6 Pengaruh Variasi Kultur Mikroba terhadap Aktivitas Enzim Selulase Padat = 7 Hari dan Moisture Content 70% ... 68
Nomor Judul Halaman
4.8 Pengaruh Variasi Waktu Fermentasi terhadap Aktivitas Enzim
Selulase dari Crude Enzim dengan Fermentasi Sampel Moisture
Content 75% untuk Sampel Fisik dan 80% untuk Sampel Biologi. ... 72
I. PENDAHULUAN
1.1 Latar Belakang
Eceng gondok (Eichhornia Crassipes) merupakan gulma air yang telah
banyak dikenal orang. Penyebarannya yang sangat cepat membuat eceng gondok
menjadi sebuah masalah baru perairan yang dapat mengganggu ekosistem. Hal ini
disebabkan eutrofikasi yang terjadi di badan air. Eutrofikasi merupakan peristiwa
meningkatnya bahan organik dan nutrien (terutama unsur nitrogen dan fosfor) yang
terakumulasi di badan air. Peningkatan bahan organik dan nutrien ini berasal dari
limbah domestik, limbah pertanian, dan lain-lain (Merina dkk, 2011).
International Union for Conservation of Nature(IUCN) telah
mengelompokkan eceng gondok sebagai satu dari seratus tanaman yang termasuk
spesies invasif (Te’lezz dkk, 2008), bahkan dikenal sebagai tanaman yang
penyebarannya berdampak buruk di seluruh dunia. Masalah eceng gondok juga telah
menjadi perhatian khusus di Eropa, Afrika, Asia, dan Amerika Utara (Shanab dkk,
2010).
Pada umumnya, penanganan eceng gondok sebagai gulma air di perairan ini
lebih kepada pengendalian secara fisik/konvensional dengan cara dibuang atau
dibakar sehingga menimbulkan masalah lingkungan yang baru. Karena hal tersebut,
maka studi sekarang ini banyak difokuskan untuk memanfaatkan/utilisasi eceng
gondok dengan dasar komponen-komponen yang dimilikinya menjadi produk yang
Salah satu pemanfaatan eceng gondok dengan memperhatikan komponen
organiknyayaitu kontribusinya pada produksienzim yang banyak dimanfaatkan pada
beberapa industri komersial. Kandungan senyawa karbon didalamnyayaitu bahan
lignoselulosa sangat menjanjikan. Ketersediaannya yang melimpah bahkan menjadi
ujung tombak dalam menciptakan sebuah proses hidrolisis enzimatis dari biomassa
selulosa yang ekonomis (Singh dkk, 2009).
Selulase adalah sebuah enzim yang signifikan penggunaannya pada beberapa
industri seperti makanan, tekstil, dan pemrosesan pulp dan kertas (Bhat, 2000).
Penggunaan selulase pada penghilangan kontaminan tinta pada pengolahan kertas
bekas/deinking (Lee dkk, 2007), produksi asam laktat (Gullon dkk, 2008), hidrolisis
selulosa untuk menghasilkan bioethanol (Gray dkk, 2006; Olsson dkk, 1996) dan
produk lainnya dari selulase telah banyak dilaporkan. Harga jual enzim selulase yang
tinggi (Novozyme, NCBE, UK: £12.00/100 mL pada November, 2012;
baku selulosa murni yang mahal pemurniannya membuat para peneliti mencari
sumber karbon dan proses yang lebih efisien, dan ini membawa para peneliti
menginvestigasi beberapa tanaman yang dianggap menyediakan sumber karbon untuk
produksi selulase. Salah satunya adalah eceng gondok yang selama ini menjadi
masalah ekologi (merusak keseimbangan ekosistem dan mengurangi keanekaragaman
aquatik), bahkan telah menjadi masalah sosial ekonomi karena mengganggu
transportasi perairan.Pemanfaatan eceng gondok yang baik ini akan menjadikan
Proses produksi enzim selulase dari bahan lignoselulosa secara singkat
meliputi metode praperlakuan bahan lignoselulosa, pemilihan mikroba, serta
teknologi fermentasi. Metode praperlakuan pada bahan lignoselulosa dalam
memproduksi enzim selulase merupakan salah satu bagian yang mempengaruhi
tingginya biaya, hasil, dan kualitas enzim selulase yang dihasilkan. Metode
praperlakuan yang sering digunakan baik skala kecil (penelitian) maupun industri
dalam mendegradasi lignin dari bahan lignoselulosa ini adalah metode secara kimia
dan fisik-kimia, yang tentu saja memerlukan bahan kimia dengan jumlah dan
konsentrasi yang tinggi agar lignin yang terdegradasi diharapkan lebih besar sehingga
selulosa semakin mudah dihidrolisis oleh mikroba baik untuk pertumbuhannya
maupun untuk produksi enzim selulase (Gunam, 1997; Gunam dkk, 2004; Lee dkk,
2009).
Ketersediaan energi berbahan bakar fosil yang semakin menipis
keberadaannya membuat penelitian semakin dikembangkan untuk mencari alternatif
yang lebih baik atau sebanding nilainya dengan energi yang digunakan saat ini.
Sebagai senyawa yang paling melimpah di muka bumi, selulosa dapat menjadi
sumber energi yang murah dan terbarukan. Di samping sebagai sumber energi,
selulosa dapat juga dimanfaatkan untuk pembuatan sirup glukosa dan protein sel
tunggal.
Perkembangan penelitian produksi enzim selulase dengan bahan
Praperlakuan yang banyak digunakan pada beberapa penelitian yang telah
dilakukan adalah metode secara kimia dan fisik. Dalam skala besar metode secara
kimia dan fisik praktis dan tidak memerlukan waktu yang lama dalam prosesnya
hanya praperlakuan tersebut terkendala pada masalah baru seperti limbah kimia yang
dihasilkan, dan penggunaan energi yang besar. Oleh karenanya pada penelitian ini
praperlakuan secara fisik dan biologi dipilih sebagai metode praperlakuan dalam
produksi enzim selulase karena lebih mungkin mengurangi limbah berbahaya dan
aman bagi lingkungan.
1.2 Perumusan Masalah
Penelitian yang telah dilakukan menunjukkan bahwa praperlakuan memiliki
peranan penting dalam membantu proses produksi enzim selulase menggunakan
mikroba komersial seperti Aspergillus niger dan Trichoderma reesei, maka
perumusan masalah yang digunakan dalam penelitian ini adalah:
a. Bagaimana pengaruh kedua praperlakuan (fisik dan biologi) dalam
mendegradasi lignin sehingga selulosa dapat dihidrolisis mikroba untuk
pertumbuhannya maupun produksi enzim selulase.
b. Bagaimana aktivitas enzim selulase yang dihasilkan dengan dilakukannya
dua praperlakuan (fisik dan biologi) dan monokultur/mix kultur
1.3 Tujuan Penelitian
Pada penelitian yang dilakukan ini diharapkan dapat:
1. Menganalisis keberhasilan metode praperlakuan fisik dan biologi pada
aktivitas mikroba dalam memproduksi enzim selulase.
2. Menentukan kondisi terbaik (kelembaban/moisture content substrat, waktu
fermentasi, mono/mix kultur mikroba) terhadap aktivitas mikroba.
1.4 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai produksi
enzim selulase dengan praperlakuan yang lebih murah sehingga dapat
dimanfaatkan/diaplikasikan oleh masyarakat yang berada di sekitar pertumbuhan
eceng gondok.
1.5 Lingkup Penelitian
Penelitian ini terbatas pada produksi enzim selulase dengan batasan-batasan
masalah:
a. Tahap praperlakuan: melakukan dua metode praperlakuan terhadap eceng
gondok yaitu secara fisik dengan pengecilan ukuran dan biologi dengan
menggunakan jamur pelapuk putih Ganoderma boninense yang berasal
dari Laboratorium Mikrobiologi FMIPA Jurusan Biologi Universitas
Sumatera Utara.
1. Mikroba yang digunakan dalam fermentasi untuk produksi enzim
selulase adalah Aspergillus niger dan Trichoderma reesei.
2. Variabel bebas yang digunakan antara lain: moisture content
(65-85%), waktu fermentasi (3-9 hari), dan pemakaian mono/mix kultur
mikroba.
3. Variabel terikat adalah medium pertumbuhan dan komposisi
nutrisinya, medium fermentasi (medium Mandel Weber), suhu
fermentasi 30oC, dan pH 5 (Oberoi dkk, 2010).
c. Tahap analisis hasil proses: parameter pada penelitian ini adalah kadar
Tabel 1.1 Perkembangan Produksi Enzim Selulase dari Bahan Lignoselulosa/Selulosa
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
Metode praperlakuan Jenis mikroba Hasil
1. Qin Liu-Hui
Serbuk kayu oak dan cedar, sekam padi, tunggul jagung, jerami padi dan kulit biji jarak pada waktu fermentasi 15 hari, T = 30oC, konsentrasi substrat 20 g/L aktivitas enzim selulase tertinggi ditunjukkan oleh T.Koningii > T. viridee > A. Niger > T. Reesei. Walaupun demikian masing-masing fungi unggul dalam satu atau dua bagian enzim sinergis selulase.
- Produksi selulase pada residu furfural : waktu, suhu dan kinsentrasi yang sama menunjukkan T. viridee > A. Niger > T. Koningii > T. Reesei.
Secara umum, aktivitas enzim selulase diperoleh pada waktu maksimum fermentasi hari ke 10-19.
Fermentasi oleh kedua fungi di-lakukan pada suhu 28oC, selama 6-15 hari.
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
Metode praperlakuan Jenis mikroba Hasil
xylanases by the
jerami gandum > tunggul jagung > kulit biji jarak > sekam padi
Waktu optimum fermentasi pada hari ke delapan
aktivitas enzim selulase pada fungi B.adusta : serbuk kayu cedar > jerami gandum > sekam padi > serbuk kayu oak > kulit biji jarak > tunggul jagung
Waktu optimim fermentasi pada hari ke enam
Waktu fermentasi 5 hari, pH 6, T = 30oC
-Penelitian ini memvariasikan antara: 1.substrat(kinnow pulp) (K) + penambahan air(W)
2. K + penambahan mandel weber medium (MW)
3. K + penambahan dedak gandum (WB) + W (K:WB = 4:1)
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
Metode praperlakuan Jenis mikroba Hasil
4. De Castro A.
Fisik : steam dengan tekanan 2 MPa selama 4 menit, dihaluskan
-Penelitian ini memvariasikan media tanpa praperlakuan, dengan satu praperlakuan (asam/basa), dan dua praperlakuan campuran (asam dan basa).
-suhu fermentasi optimum pada 37oC, pH 4,82-4,96, waktu inkubasi 7-8 hari yaitu pada media dengan campuran dua praperlakuan.
Penelitian ini membandingkan aktivitas selulase hasil fermentasi antara lespedeza dengan tiga sumber karbohidrat yaitu Filter paper (FP), microcrystalin selulosa(MCC), dan carboxymethyl selulosa.(CMC)
Aktivitas enzim selulase terbaik adalah FP > lespedeza > MCC > CMC pada T = 30oC waktu fermentasi 7 hari.
Penelitian ini memvariasikan pH (3-8), suhu (20 – 45oC) dan waktu fermentasi (0-7 hari).
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
Metode praperlakuan Jenis mikroba Hasil
from wheat straw
Ampas biji castor (cake)
Dedak gandum,dedak jagung dan kulit jeruk (2:1:2)
Penelitian ini memvariasikan jumlah substrat (5-10 g), kelembaban (15-35%), pH (4-6), suhu (25-35oC) Kondisi terbaik produksi emzim selulase adalah pada substrat 5 gr, kelembaban 15%, pH 6, dan suhu 25oC.
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
Metode praperlakuan Jenis mikroba Hasil
fermentation
Mixed culture of T.Reesei dan A. Niger
Penelitian ini memvariasikan sumber N, moisture content (60-95%), waktu fermentasi (48-192 jam), suhu (25-45oC), dan konsentrasi alkali pada pretreatment kimia.
Hasil terbaik aktivitas enzim selulase ditunjukkan :
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
Metode praperlakuan Jenis mikroba Hasil
11. Devi M.
Fisik : dicuci, kedua substrat
masing-Untuk mendapatkan titik optimum aktivitas enzim selulase penelitian ini memvariasikan suhu (30-50oC), pH (3-8), waktu fermetasi (2-8 hari), dan didapat :
-waktu optimum adalah 7 hari untuk kedua substrat
-pH optimum 4,5 untuk kedua substrat
-suhu optimum 45oC untuk kedua substrat
Penelitian ini memvariasikan pH (4,5–8), konsentrasi NaOH pada praperlakuan (1-5%), suhu fermentasi (25-50oC), konsentrasi substrat (1-8% w/v).
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
Metode praperlakuan Jenis mikroba Hasil
Reesei
Eceng gondok Tidak ada keterangan praperlakuan
NaOH, pH 5 dan diatasnya, temperature inkubasi 30oC, konsentrasi substrat 1% (w/v), dan waktu inokulasi hari ke 7 dan ke 15. Perolehan maksimal aktivitas selulase ±73,3 IU/g selulosa. Aktivitas spesifik enzim 6.25 IU/mg protein. Pada hidrolisis glukosa menggunakan 1,2 IU/g dapat mensakarifikasi 28,7 % dalam 1 jam
Selain memvariasikan fungi, penelitian ini juga memvariasikan sumber nitrogen, pH (3,6-5,2), suhu (20-70oC), konsentrasi substrat (0,4-1,6% w/v)
Peneliti/Judul penelitian
Substrat/media/sumber selulosa
II. TINJAUAN PUSTAKA
2.1 Karakteristik dan Pola Pertumbuhan Eceng Gondok
Eceng gondok di Indonesia pada mulanya diperkenalkan oleh Kebun Raya
Bogor pada tahun 1894, yang akhirnya berkembang di sungai Ciliwung sebagai
tanaman pengganggu (Brij dan Sarma, 1981). Klasifikasi eceng gondok secara umum
adalah (Moenandir, 1990).
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Monocotyledoneae
Suku : Pontederiaceae
Marga : Eichornia
Spesies : Eichornia crassipes Solms
Eceng gondok hidup mengapung bebas bila airnya cukup dalam tetapi berakar di
dasar kolam atau rawa jika airnya dangkal. Tingginya sekitar 0,4 - 0,8 meter. Daunnya
tunggal dan berbentuk oval. Ujung dan pangkalnya meruncing, pangkal tangkai daun
menggelembung. Permukaan daunnya licin dan berwarna hijau. Bunganya termasuk
bunga majemuk, berbentuk bulir, kelopaknya berbentuk tabung. Bijinya berbentuk bulat
dan berwarna hitam. Buahnya kotak beruang tiga dan berwarna hijau. Akarnya
Gambar 2.1 Tanaman Eceng Gondok
Eceng gondok berkembang biak dengan sangat cepat, baik secara vegetatif
maupun generatif. Perkembangbiakan dengan cara vegetatif dapat berlipat ganda dua
kali dalam waktu 7 - 10 hari. Hasil penelitian Badan Pengendalian Dampak
Lingkungan Hidup Sumatera Utara di Danau Toba (2003) melaporkan bahwa satu
batang eceng gondok dalam waktu 52 hari mampu berkembang seluas 1 m2, atau
dalam waktu 1 tahun mampu menutup area seluas 7 m2. Heyne (1987) menyatakan
bahwa dalam waktu 6 bulan pertumbuhan eceng gondok pada areal 1 Ha dapat
mencapai bobot basah sebesar 125 ton.
Perkembangbiakannya yang sangat cepat menyebabkan tanaman eceng
gondok telah berubah menjadi tanaman gulma di beberapa wilayah perairan di
Indonesia. Di kawasan perairan danau, eceng gondok tumbuh pada bibir-bibir pantai
sampai sejauh 5 - 20 m. Perkembangbiakan ini juga dipicu oleh peningkatan
sedimentasi lahan, berbagai aktivitas masyarakat (mandi, cuci, kakus/MCK), budaya
perikanan (keramba jaring apung), limbah transportasi dan limbah pertanian. Oleh
karena itu, eceng gondok sudah menjadi sebuah masalah yang harus dikendalikan
perkembangannya.
Analisis fitokimia dari ekstrak metanolik eceng gondok membuktikan bahwa
metabolit sekunder sebagian besar menjadi alkaloid, komponen fenol, dan terpenoid
(Shanab dkk, 2010). Eceng gondok juga mengandung senyawa flavonoid (luteolin,
apigenin, tricin, chrysoeriol, kaempferol, azaeleatin, gossypetin, dan orientin), asam
amino (metionin, valine, asam teonin glutamate, tryptofan, tyrosin, leusin, dan
lysine), fosfor, protein, komponen organic, dan sianida (Nyananyo dkk, 2007;
Chantiratikul dkk, 2009). Tanaman segar mengandung 95,5% kelembaban, 0,04% N,
1,0% abu, 0,06% P2O5, 0,20% K2O, 3,5% bahan organik. Pada basis kelembaban nol,
terdapat 75,8% bahan organik, 1,5% N dan 24,2% abu. Abu mengandung 28,7%
K2O, 1,8% Na2O, 12,8% CaO, 21,0% Cl, dan 7,0% P2O5. Protein mentah
mengandung, per 100 g, 0,72 g metionin, 4,72 g fenilalanin, 4,32 g treonin, 5,34 g
lisin, 4,32 g isoleusin, 0,27 g valin, dan 7,2 g leusin (Matai dan Bagchi, 1980 dalam
Jafari 2010). Kandungan lignin, selulosa, dan hemiselulosa dari berbagai sumber
ditunjukkan dalam Tabel 2.1.
Tabel 2.1 Kandungan Lignin, Selulosa dan Hemiselulosa Eceng Gondok (Dry Base)
Pola pertumbuhan yang cepat, sehingga keberadaannya melimpah dan
kandungan yang dimilikinya, membuat eceng gondok memiliki potensi yang layak
dikembangkan agar bernilai ekonomis, bernilai jual tinggi dan menjadikan eceng
gondok sebagai tanaman esensi yang patut diperhitungkan keberadaannya, bukan
hanya tanaman hama atau gulma semata.
2.2 Pengendalian dan Pemanfaatan Eceng Gondok
Keberadaannya yang melimpah ruah dan pengaruhnya yang berdampak pada
keberlangsungan ekosistem air, membuat eceng gondok dianggap sebagai tanaman
invasif dan menjadi perhatian para pemerhati lingkungan diseluruh dunia. Eceng
gondok bahkan termasuk dalam daftar karantina karena keberadaannya yang kurang
diinginkan (Patel, 2012).
Pertumbuhannya yang sangat cepat dan penyebaran sporadik telah
mengakibatkan kerusakan secara ekologi dan ekonomi badan air dan wetlands yang
produktif. Eceng gondok sudah menjadi sebaran yang mendunia karena
keberadaannya di beberapa Negara antara lain:
1. Beberapa Negara bagian Afrika: sebaran eceng gondok telah menghampar
hampir menutupi perairan sungai, maupun danau, seperti danau Victoria
di Afrika (Kateregga dkk, 2007), daerah sekitar Winam Gulf dimana
dalam jurnalnya, Opande dkk (2004) menyatakan bahwa kehidupan
2. Spanyol dan Portugal: sungai induk Guadiana di Spanyol baru-baru ini
juga dipenuhi oleh sebaran eceng gondok (Della Greca dkk, 2009).
3. Bangladesh: pengawasan keberadaan sebaran Eceng gondok yang mulai
meluas di hutan bakau Sundarbans (Biswas dkk, 2007).
4. India: pendangkalan berat di wetland taman nasional Kaziranga akibat
invasi Eceng gondok, Deepor beel (danau yang terbentuk dari sungai
Brahmaputra) terancam karena sebaran Eceng gondok.
5. Meksiko: lebih dari 40.000 Ha terdiri dari waduk, danau, kanal, dan
saluran air tertutupi oleh Eceng gondok (Jime’nez dan Balandra, 2007).
6. Cina: Eceng gondok sebagai masalah lingkungan yang sangat serius (Chu
dkk, 2006).
7. Amerika: Eceng gondok juga menyebabkan dampak ekologis yang sangat
parah seperti di delta sungai Sacramento-San Joaquin di California
(Khanna dkk, 2011).
8. Indonesia: Eceng gondok telah tampak mengambang sejak 1990 di daerah
parapat, dan sekarang telah hampir menutupi sebagian besar perairan
Danau Toba Moedjojo dkk, 2006). Waduk Cirata dan Kali banjir Kanal
Timur juga tidak luput dari blooming tanaman gulma ini.
Masalah global yang ditimbulkan akibat pertumbuhan pesat eceng gondok
terutama di perairan tanah air, bukan hanya menjadi masalah ekologi semata bahkan
dilakukan untuk mengatasi masalah ini, diantaranya seperti yang ditabulasikan dalam
Tabel 2.2.
Tabel 2.2 Metode Pengendalian dan Kekurangannya
Metode pengendalian
Langkah-langkah pengendalian Kekurangan
a. Fisik
b. Kimia
c. Biologi
- Drainase perairan daerah setempat
- Secara manual mencabut atau menarik
-Serangga seperti kumbang Neochetina sp yang telah diuji coba pada danau Viktoria di Afrika (Williams dkk, 2007), -Wereng Megamelus
scutellaris dari ordo
Hemiptera (Sosa dkk, 2007), -Jamur cercospora piaropi
- Metode ini dianggap tidak cukup walaupun telah
- Penggunaan mesin seperti pemanen gulma, alat
Telah terbukti efektif, hanya pada penggunaan jangka panjang dapat menurunkan kualitas air serta berisiko tinggi terhadap habitat alami perairan (Malik, 2007)
Metode pengendalian
Langkah-langkah pengendalian Kekurangan
tharp menghasilkan fitotoksin yang dapat menurunkan populasi eceng gondok (Tessman dkk, 2008), -Ekstrak tumbuh-tumbuhan
allelopati.
Ketiga metode penanggulangan tersebut sangat membutuhkan biaya yang
tinggi dan tidak memberikan timbal balik secara ekonomis. Oleh karena itu, para
peneliti terdorong untuk mengembangkan potensi eceng gondok yang banyak ini
menjadi sesuatu/utilisasi yang mempunyai nilai ekonomi tinggi. Pemanfaatan Eceng
gondok antara lain:
1. Kerajinan tangan dan seni.
2. Adsorben untuk logam berat, dan digunakan pada pengolahan air limbah
baik domestik (Alade dan Ojoawo, 2009), maupun limbah industri (Jafari,
2010).
3. Sumber energi bio-listrik (Mohan dkk, 2011).
4. Sebagai bahan kimia berguna bagi industri (Girisuta dkk, 2008).
5. Produksi anti oksidan (Chantiratikul dkk, 2009).
6. Pakan ternak (Aboud dkk, 2005).
7. Pupuk (Chukwuka dan Omotayo, 2008).
8. Produk enzim seperti selulase, protease (Heba dkk, 2012).
9. Sumber bahan baku karbon untuk produk renewable energi, seperti
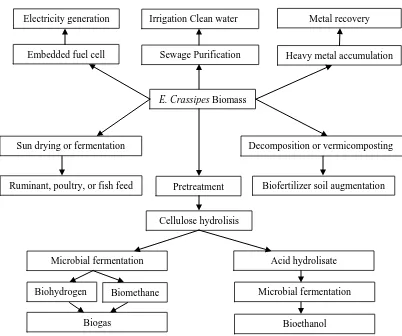
Secara skematis oleh Patel (2012) pemanfaatan Eceng gondok ditunjukkan
pada Gambar 2.2.
Gambar 2.2 Skema Utilisasi Eceng Gondok
2.3 Eceng Gondok dalam Produksi Enzim
Enzim digunakan dalam sebagian besar sektor industri, terutama industri
makanan. Selain itu, enzim juga digunakan dalam industri deterjen, farmasi, pulp and
paper, pakan ternak, tekstil dan laundry (Bhat, 2000). Lebih dari 2000 enzim telah
diisolasi, tetapi hanya 14 enzim yang diproduksi secara komersial. Kebanyakan dari Electricity generation
Embedded fuel cell
Irrigation Clean water
Sewage Purification
Metal recovery
Heavy metal accumulation
E. Crassipes Biomass
Sun drying or fermentation
Ruminant, poultry, or fish feed Biofertilizer soil augmentation Decomposition or vermicomposting
Cellulose hydrolisis Pretreatment
Biohydrogen Biomethane
Biogas
Microbial fermentation
enzim ini adalah hidrolase, misalnya amilase, protease, pektinase, dan selulase.
Enzim penting lainnya adalah glukosa isomerase dan glukosa oksidase. Alasan
digunakannya enzim dalam industri adalah karena enzim mempunyai beberapa
kelebihan antara lain:
a. Kemampuan katalitik yang tinggi, mencapai 109-1012 kali laju reaksi
non-aktivitas enzim.
b. Spesifikasi substrat yang tinggi.
c. Reaksi dapat dilakukan pada kondisi yang lunak, yaitu pada tekanan dan
temperatur rendah (Bhat, 2000).
Enzim yang dihasilkan dari komponen organik juga menjanjikan sebagai
sebuah peluang untuk menciptakan sumber energi baru, semisal komponen selulosa
yang dimanfaatkan sebagai bahan dalam membuat etanol sebagai sumber energi.
Sumber energi dari bahan baku yang terbarukan menjadi salah satu fokus utama
penelitian sejak beberapa dekade yang lalu. Ketersediaan energi berbahan bakar fosil
yang semakin menipis keberadaannya membuat penelitian semakin dikembangkan
untuk mencari alternatif yang lebih baik atau sebanding nilainya dengan energi yang
digunakan saat ini. Sebagai senyawa yang paling melimpah di muka bumi, selulosa
dapat menjadi sumber energi yang murah dan terbarukan. Di samping sebagai sumber
energi, selulosa dapat juga dimanfaatkan untuk pembuatan sirup glukosa dan protein
sel tunggal.
Eceng gondok tersusun dari beberapa komponen organik diantaranya selulosa.
mengkonversi eceng gondok sebagai biomassa/substrat untuk menghasilkan sumber
energi. Tetapi, untuk dapat dimanfaatkan selulosa membutuhkan proses hidrolisis dan
penggunaan enzim selulase menjadi pilihan utama. Peran enzim selulase dalam
industri yang berhubungan dengan selulosa tidak dapat dipisahkan. Oleh karena itu,
produksi enzim selulase perlu dikembangkan untuk menjawab tantangan pemanfaatan
bahan selulosa dalam industri bioproses.
2.4 Selulase
Selulase merupakan kumpulan dari beberapa enzim yang bekerja secara
bersama/sinergis untuk hidrolisis selulosa. Mikroorganisme tertentu menghasilkan
partikel yang dinamakan selulosom. Partikel inilah yang akan terdisintegrasi menjadi
enzim yang secara sinergis mendegradasi selulosa (Belitz dkk, 2008). Sedikitnya ada
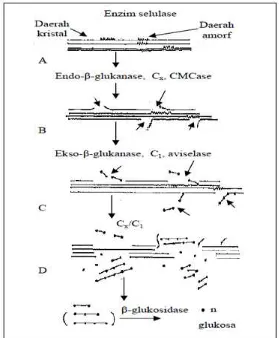
tiga tipe enzim yang terlibat dalam degradasi atau hidrolisis selulosa, yaitu:
1. Endo-1,4-β-D-glucanase (endoselulase, carboxymethylcellulase atau
CMCase), yang mengurai polimer selulosa secara random pada ikatan
internal α-1,4-glikosida untuk menghasilkan oligodekstrin dengan panjang
rantai yang bervariasi.
2. Exo-1,4-β-D-glucanase (cellobiohydrolase), yang mengurai selulosa dari
ujung pereduksi dan non pereduksi untuk menghasilkan selobiosa.
3. β–glucosidase (cellobiase), yang mengurai selobiosa untuk menghasilkan
Mekanisme hidrolisis selulosa oleh enzim selulase dapat dilihat dalam
Gambar 2.3.
Gambar 2.3 Mekanisme Hidrolisis Selulosa (Ghori, 2001)
Pada awalnya selulase diteliti untuk keperluan biokonversi biomassa yang
membuka peluang untuk aplikasi beberapa industri. Beberapa jenis industri yang
memanfaatkan enzim selulase diantaranya industri tekstil, makanan, deterjen, dan
kertas. Tetapi kemudian seiring menipisnya cadangan bahan bakar fosil mendorong
pemanfaatan enzim selulase untuk biokonversi bahan lignoselulosa menjadi sumber
2.5 Teknologi Produksi Enzim Selulase
Dalam memproduksi enzim dibutuhkan teknologi, karena pada umumnya
enzim dihasilkan dari hewan, tumbuhan dan sel mikroba. Dahulu hewan dan
tumbuhan merupakan sumber enzim tradisional, namun dengan berkembangnya ilmu
bioteknologi, masa depan terletak pada sistem mikrobial. Sebagian besar sumber
enzim termasuk enzim selulase dalam skala industri adalah mikroorganisme.
Beberapa alasan digunakan mikroba adalah:
1. Sistem produksi mikrobial mudah dikendalikan.
2. Level/tingkat enzim, sehingga produktivitas enzim dapat dimanipulasi secara
lingkungan dan genetika.
3. Pemilihan metode untuk sistem mikrobial yang cukup sederhana.
Kebanyakan enzim mikroba yang digunakan secara komersial adalah
ekstraseluler, dimana enzim diproduksi dalam sel kemudian dikeluarkan atau berdifusi
keluar sehingga memungkinkan untuk di-recovery. Seleksi organisme adalah kunci
dalam pengembangan proses sistem mikrobial. Berikut ini hal-hal yang perlu
diperhatikan dalam memilih mikroorganisme:
a. Sumber organisme stabil.
b. Mudah tumbuh dan berkembang sehingga biaya produksi rendah.
c. Produktivitas enzim tinggi.
Dari semua hal tersebut, yang paling penting adalah stabilitas strain dan
produktivitas enzim yang tinggi (Heba dkk, 2012).
Penggunaan komponen organik sebagai sumber utama enzim juga tidak lepas
dari perhatian. Pada produksi enzim selulase berbahan dasar selulosa, mikroba
memerlukan selulosa dan nutrien lainnya dalam prosesnya. Proses produksi enzim
selulase ini terangkai sebuah teknologi dari awal hingga akhir produksi.
2.5.1 Substrat, Mikroorganisme dan Praperlakuan
Pada produksi enzim selulase pemilihan bahan baku seperti substrat,
mikroorganisme penghasil enzim sellulase dan metode praperlakuan pada prosesnya
sangat mempengaruhi kualitas maupun kuantitas enzim selulase yang dihasilkan.
Berikut ini adalah uraian tentang bahan baku dan metode praperlakuan:
a. Substrat
Industri fermentasi merupakan industri yang terus mengalami kemajuan
dalam inovasi teknologi produksinya. Salah satunya adalah pada pemilihan substrat
untuk fermentasi. Pada industri enzim, pemilihan substrat sangat kritis untuk bisa
menghasilkan produk enzim dengan harga yang kompetitif tetapi dapat menekan
biaya produksi.
Pada produksi enzim selulase digunakan substrat sumber karbon selulosa
yang dihidrolisis oleh mikroorganisme. Pemilihan substrat sumber karbon selulosa
dan harga yang murah, karenanya limbah agroindustri atau tanaman gulma yang
memiliki kandungan lignoselulosa patut diperhitungkan.
Biomassa eceng gondok tersusun dari lignoselulosa. Lignoselulosa sebagai
penyusun dinding sel tanaman eceng gondok terdiri dari polimer selulosa dan
hemiselulosa yang dilindungi oleh lignin. Lignoselulosa memiliki bagian kristalin dan
amorf. Struktur kristalin lignoselulosa adalah selulosa yang tersusun dari rantai
glukosa yang saling terikat dengan ikatan 1-4 β glikosida dan adanya ikatan hidrogen
antara gugus hidroksil pada rantai yang berdekatan, sehingga strukturnya menjadi
kokoh. Struktur amorf lignoselulosa adalah hemiselulosa yang tersusun dari glukosa,
manosa, galaktosa, xylosa, arabinosa, sejumlah kecil ramnosa dan asam galaktonik.
Struktur amorf ini tidak sekuat struktur kristalin sehingga lebih mudah diuraikan
melalui proses pretreatment.
b. Mikroorganisme
Mikroorganisme penghasil selulase umumnya merupakan pengurai
karbohidrat dan tidak dapat memanfaatkan protein atau lipid sebagai sumber energi.
Mikroba penghasil selulase terutama bakteri Cellulomonas dan Cytophaga serta
kebanyakan fungi dapat mengutilisasi berbagai jenis karbohidrat lainnya selain
selulosa, sedangkan spesies mikroba selulolitik anaerobik terbatas pada selulosa
dan/atau produk hidrolisisnya. Contoh-contoh utama mikroorganisme penghasil
selulase dapat dilihat pada Tabel 2.3.
Tidak semua mikroorganisme yang dapat mengutilisasi selulosa sebagai
strain yang dapat menghasilkan kompleks enzim selulase yang terdiri dari tiga
komponen utama yaitu endo-β-glukanase, ekso-β-glukanase, dan β-glukosidase.
Mikroba yang digunakan secara komersial untuk produksi enzim selulase umumnya
terbatas pada T. reesei, H. insolens, A. niger, Thermomonospora fusca, dan Bacillus
sp. (Sukumaran dkk, 2005).
Tabel 2.3 Mikroorganisme Penghasil Selulase (Sukumaran dkk, 2005)
Kelompok Mikroorganisme
Genus Spesies
Fungi Aspergillus A. niger
A. nidulans Fusarium F. solani
F. oxysporum Humicola H. insolens
H. grisea Melanocarpus M. albomyces Penicillium P. bracillianum
P. occitanis P. decumbans Trichoderma T. reesei
T. longibrachiatum T. harzianum Bacteria Acidothermus A. cellulolycitus
Bacillus Bacillus sp Bacillus subtilis Clostridium C.acetobutylicum
C.thermocellum Pseudomonas P. cellulose Rhodotermas R. Marinus Actinomycetes Cellulomonas C.fimi
Secara luas Aspergillus didefinisikan sebagai suatu kelompok mukosis
penyebab dari macam-macam fotogenosa. Aspergillus niger termasuk ke dalam kelas
Ascomycetes. Di dalam industri Aspergillus niger banyak dipakai dalam proses
produksi asam sitrat, sedangkan di dalam laboratorium spesies ini digunakan untuk
mempelajari tentang metabolisme pada jamur dan kegiatan enzimatis. Pada penelitian
ini digunakan Aspergillus niger karena spesies ini termasuk fungi berfilamen
penghasil selulase dan crude enzyme secara komersial serta penanganannya mudah
dan murah. Fungi-fungi tersebut sangat efisien dalam memproduksi selulase.
Karakteristik umum dari Aspergillus niger antara lain:
a. Warna konidia hitam kelam atau hitam kecoklatan dan berbentuk bulat.
b. Termofilik, tidak terganggu pertumbuhannya karena adanya peningkatan
suhu.
c. Dapat hidup dalam kelembaban nisbi 80 % (Ilyas umbrin dkk, 2011).
d. Dapat menguraikan benzoat dengan hidroksilasi menggunakan enzim
benzoat-4 hidroksilase menjadi 4-hidroksibenzoat.
e. Memiliki enzim 4-hidroksibenzoat hidroksilase yang dapat menghidrolisa
4-hidroksibenzoat menjadi 3,4-dihidroksi benzoat.
f. Menghasilkan lebih banyak enzim endoglukanase dan β-glukosidase dan
sedikit enzim eksoglukanase (Hui-Qin Liu dkk, 2012).
g. Pertumbuhannya dihambat oleh Natrium & Formalin.
h. Dapat merusak bahan pangan yang dikeringkan atau bahan makanan yang
i. Dapat mengakumulasi asam sitrat.
Aspergillus niger tampak pada Gambar 2.4.
Gambar 2.4 Aspergillus niger
Genus Trichoderma mencakup kelompok ascomycetes yang digunakan secara
luas dalam industri karena kemampuannya menghasilkan enzim hidrolase
ekstraselular untuk degradasi lignoselulosa dalam jumlah besar (Miettinen, 2004).
Karakteristik umum Trichoderma reesei (Gambar 2.5) adalah:
a. Dikenal juga sebagai Hypocrea jecorina merupakan fungi mesofilik.
b. Kemampuan tinggi menghasilkan enzim selulase secara efisien. Selulase
yang dihasilkan juga resisten terhadap inhibitor kimia dan stabil di dalam
reaktor tangki berpengaduk pada pH 4,8, 50oC selama 48 jam atau lebih.
c. Lebih banyak menghasilkan enzim eksoglukanase dan endoglukanase,
sedikit menghasilkan enzim β-glukosidase (Hui-Qin Liu dkk, 2012).
d. Strain industrial dari Trichoderma reesei mampu mencapai produksi
e. Mudah dan murah dikultivasi, tergolong mikroorganisme yang aman
karena tidak bersifat patogen dan tidak menghasilkan mycotoksin atau
antibiotik dalam kondisi produksi enzim.
f. Tidak dapat menghidrolisis lignin.
g. Terinhibisi oleh produk (glukosa) dan pelarut organic seperti etanol,
butanol, dan aseton.
h. Inaktivasi pada temperature diatas 50oC (Ryu dkk, 1980).
Gambar 2.5 Trichoderma reesei (sumber:
c. Praperlakuan
Teknologi pretreatment/praperlakuan yang dilakukan pada dasarnya adalah
untuk mengubah atau memindahkan komposisi dan struktur yang menghalangi proses
hidrolisis yang bertujuan untuk meningkatkan laju aktivitas enzimatis dan hasil
fermentasi yang menghasilkan glukosa dari selulosa atau hemiselulosa (Mosier dkk,
Praperlakuan biasanya dibutuhkan untuk membantu hidrolisis enzimatis dan
biasanya dilakukan pada substrat berbahan lignoselulosa. Lignin yang melindungi
selulosa sekaligus sebuah penghalang bagi mikroorganisme untuk memproduksi
enzim khususnya selulase sehingga praperlakuan perlu dilakukan. Praperlakuan yang
dilakukan memberikan beberapa dampak dan persentase keberhasilan yang relatif.
Pada dasarnya, pada produksi enzim selulase yang menginduksi produksi adalah
selulosa, dan substrat lignoselulosa yang tidak hanya terdiri dari selulosa saja, tetapi
juga terdapat komponen lain membuat perolehan enzim selulase rendah dibandingkan
dengan substrat selulosa murni. Ketika perolehan selulosa murni ini menjadi kendala
akibat faktor biaya, dan sebagainya, membuat para peneliti terus mencari cara sebagai
langkah untuk meningkatkan efektifitas produksi enzim dari substrat lignoselulosa
seperti teknologi praperlakuan yang diuji coba skala laboratorium sebelum dapat
digunakan dalam skala industri. Mekanisme praperlakuan ditunjukkan dalam Gambar
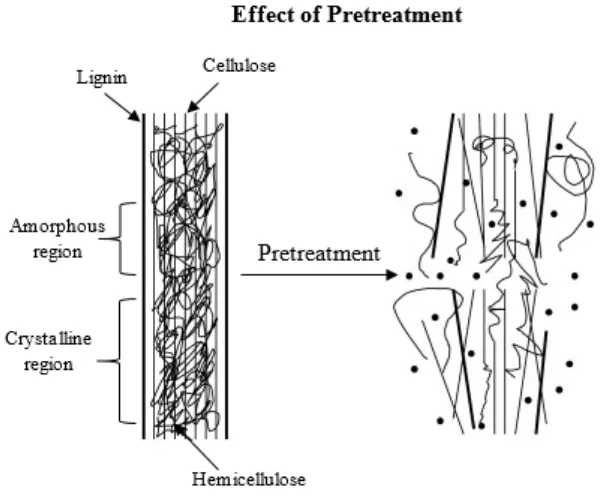
Gambar 2.6 Skema Tujuan Pretreatment pada Biomassa Lignoselulosa (Mosier dkk, 2005)
Pra perlakuan dapat disebut efektif bila memenuhi beberapa kriteria seperti:
1. Keefektifan dalam memecah ukuran biomassa partikel.
2. Tetap menjaga keutuhan komponen tanpa terkonversi dalam bentuk lain.
3. Tidak memberikan batas degradasi yang dapat menghambat pertumbuhan
mikroorganisme.
4. Dapat meminimalkan energi dan biaya (National Resort Council, 1999).
Teknologi praperlakuan dikategorikan dalam praperlakuan fisik dan kimia,
bahkan beberapa metode menggabungkan kedua efek tersebut (McMilan, 1994; Hsu,
1996). Untuk mengklasifikasikan, uap dan air yang digunakan pada praperlakuan
yang ditambahkan pada biomassa. Ringkasan teknologi praperlakuan ditunjukkan
dalam Tabel 2.4.
Tabel 2.4 Teknologi Praperlakuan, Deskripsi, Kekurangan dan Kelebihan
Teknologi praperlakuan
Deskripsi Kekurangan / kelebihan
a. Fisik
b. Kimia
c. Biologi
- Kominusi (pengurangan ukuran partikel dari biomassa secara mekanik). Kominusi kering, basah, dan getaran bola penggilingan (Millet dkk, 1979 ; Rivers, dan Emert, 1987; Sidiras dan Koukios, 1989), dan kompresi penggilingan (Tassinari dkk, 1980)
- Steam explosion - Hidrotermolisis..
- Menggunakan asam atau basa seperti H2SO4 dan NaOH.
(Ladisch dkk, 1978; Hamilton dkk, 1984).
- Menggunakan peroksida, ozon, organosolv (menggunakan asam lewis, FeCl3, Al2SO4 dalam cairan
alcohol), gliserol, dioksan, fenol, atau etilen glikol (Wood dan Saddler, 1988).
- Menggunakan pelarut berbahan amoniak (NH3 dan hidrazin),
pelarut aprotik (DMSO), logam kompleks (Feri sodium tartarate).
- Menggunakan mikroorganisme seperti white root fungi (jamur pelapuk putih) (Blanchette, 1984), semisal elfvingia applanata (Ganoderma applanatum), P. chrysosporium (Boominathan and Reddy. 1992)
- Tidak banyak
mendegradasi lignin. - Efektif, mudah, dan
murah.
- Dapat mengurangi kristalinitas selulosa - Melepas lignin dari
Teknologi praperlakuan
Deskripsi Kekurangan / kelebihan
- Mendegradasi lignin dengan menggunakan enzim yang disebut enzim lignilase yang merupakan sinergis dari lignin peroxidase (LiP), manganese peroxidase (MnP), and laccase (Ohkuma M dkk, 2001 : Lee dkk. 1999 : Rivela dkk, 2000)
2.5.2 Fermentasi
Fermentasi berasal dari kata latin “fervere” yang berarti mendidih. Seiring
perkembangan teknologi, definisi fermentasi meluas, menjadi semua proses yang
melibatkan mikroorganisme untuk menghasilkan suatu produk yang disebut metabolit
primer dan sekunder dalam suatu lingkungan yang dikendalikan. Pada mulanya
istilah fermentasi digunakan untuk menunjukkan proses pengubahan glukosa menjadi
alkohol yang berlangsung secara anaerob. Namun, kemudian istilah fermentasi
berkembang lagi menjadi seluruh perombakan senyawa organik yang dilakukan
mikroorganisme yang melibatkan enzim yang dihasilkannya. Dengan kata lain,
fermentasi adalah perubahan struktur kimia dari bahan-bahan organik dengan
memanfaatkan agen biologis terutama enzim sebagai biokatalis. Produk fermentasi
dapat digolongkan menjadi 4 jenis, yaitu:
1. Produk biomassa.
2. Produk enzim.
4. Produk transformasi.
Pada penelitian ini produk fermentasi yang dihasilkan adalah enzim dengan
memanfaatkan Aspergillus niger dan Trichoderma reesei yang dapat menghasilkan
enzim selulase ketika terinduksi oleh selulosa.
Fermentasi dibagi menjadi 3, yakni:
1. Fermentasi permukaan.
2. Sistem fermentasi cair.
3. Sistem fermentasi padat.
Penelitian yang dilakukan menggunakan metode sistem fermentasi padat.
Sistem fermentasi padat pada umumnya diidentikkan dengan pertumbuhan
mikroorganisme dalam partikel pada substrat dalam berbagai variasi kadar air.
Substrat padat bertindak sebagai sumber karbon, nitrogen, mineral, dan faktor-faktor
penunjang pertumbuhan, dan memiliki kemampuan untuk menyerap air, dan untuk
pertumbuhan mikroba (Tanyildizi dkk, 2007).
Mikroorganisme yang tumbuh melalui sistem fermentasi padat berada pada
kondisi pertumbuhan di bawah habitat alaminya, mikroorganisme tersebut dapat
menghasilkan enzim dan metabolisme yang lebih efisien dibandingkan dengan sistem
fermentasi cair. Sistem fermentasi padat memiliki lebih banyak manfaat
dibandingkan dengan sistem fermentasi cair, diantaranya tingkat produktivitasnya
tinggi, tekniknya sederhana, biaya investasi rendah, kebutuhan energi rendah, jumlah
air yang dibuang sedikit, recovery produknya lebih baik, dan busa yang terbentuk
negara-negara berkembang. Manfaat lain dari sistem fermentasi padat adalah murah dan
substratnya mudah didapat, seperti produk pertanian dan industri makanan
(Tanyildizi dkk, 2007).
Enzim yang dihasilkan melalui proses sistem fermentasi padat baik yang
belum dimurnikan atau yang dimurnikan secara parsial dapat diaplikasikan di industri
(seperti pektinase digunakan untuk klarifikasi jus buah, alpha amilase untuk
sakarifikasi pati). Murahnya harga residu pertanian dan agro-industri merupakan
salah satu sumber yang kaya akan energi yang dapat digunakan sebagai substrat
dalam sistem fermentasi padat. Fakta menunjukkan bahwa residu ini merupakan salah
satu reservoir campuran karbon terbaik yang ada di alam. Dalam sistem fermentasi
padat, substrat padat tidak hanya menyediakan nutrien bagi kultur tetapi juga sebagai
tempat penyimpanan air untuk sel mikroba (Tanyildizi dkk, 2007).
Komposisi dan konsentrasi dari media dan kondisi fermentasi sangat
berpengaruh pada pertumbuhan dan produksi enzim ekstraseluler dari
mikroorganisme. Biaya dan ketersediaan substrat merupakan faktor yang penting
untuk dipertimbangkan, dan karena itulah pemilihan substrat padat memegang
peranan penting dalam menentukan efisiensi sistem fermentasi padat. Untuk biaya
analisa awal, kira-kira 50 - 60% untuk biaya medium fermentasi dan pengaturan
proses down-stream. Sehingga dapat diketahui bahwa sistem fermentasi padat cocok
untuk pengembangan fungi dan tidak cocok untuk proses kultur bakteri karena
membutuhkan air yang lebih banyak (Tanyildizi dkk, 2007).
a. Konsentrasi substrat
Substrat merupakan sumber nutrien utama bagi fungi. Fungi dekomposer
seperti Trichoderma reesei dan Aspergillus niger memiliki kebutuhan nutrien Karbon
dalam jumlah tertentu. Nutrien-nutrien baru dapat dimanfaatkan sesudah fungi
mengeksresi enzim-enzim ekstraselular yang dapat mengurai senyawa-senyawa
kompleks dari substrat tersebut menjadi senyawa-senyawa yang lebih sederhana
(Gandjar, 2006).
b. Sumber nitrogen
Bahan yang banyak sebagai sumber nitrogen adalah ammonium nitrat,
ammonium sulfat, dan urea. Nitrogen diperlukan dalam proses fermentasi karena
dapat mempengaruhi aktivitas dari fungi dalam sintesis protein, dan diperlukan dalam
pembentukan protein sel utama. Pada proses fermentasi untuk menghasilkan enzim
selulase ada beberapa sumber nitrogen yang dapat digunakan dengan urutan
(NH4)2SO4 > urea > NH4NO3 > ekstrak ragi > NH4Cl > (NH4)2PO4 > ekstrak malt >
pepton > tripton > NaNO3 (Ilyas dkk, 2011).
c. Phospat
Kebutuhan phospat dalam proses pertumbuhan fungi tidak banyak dijelaskan
tetapi keseimbangan antara mangan, seng, dan phospat merupakan salah satu faktor
penentu dalam beberapa kasus dimana terjadi kontaminasi ion logam tertentu maka
adanya phospat dapat memberikan keuntungan (Gandjar, 2006).
Magnesium berfungsi sebagai kofaktor dalam mengatur jumlah enzim yang
terlibat dalam reaksi. Dalam sel konsentrasi optimal dari penambahan magnesium
adalah 0,002 - 0,0025% (Gandjar, 2006). Magnesium juga berperan dalam stabilisasi
ribosom, membran dan dindng sel.
e. Aerasi
Dalam media fermentasi padat, aerasi diatur dengan cara memperhatikan
pori-pori bahan yang difermentasikan (Gandjar, 2006). Mikroba yang digunakan tidak
memiliki klorofil sehingga oksigen dan karbondioksida sangat diperlukan sebagai
senyawa pada pertumbuhannya. Lingkungan yang kurang unsur O2 akan
mengakibatkan pertumbuhan buah kecil, abnormal dan mudah layu yang akhirnya
menimbulkan kematian (Djarijah, 2001).
Pertumbuhan miselium membutuhkan kandungan karbondioksida tinggi
sekitar 15 - 20% dari volume udara. Jika kandungan tersebut terlalu tinggi akan
terjadi gangguan pertumbuhan sehingga bentuk tudung jamur akan lebih kecil dari
tangkainya (Adiyuwono, 2001).
f. pH
pH substrat sangat penting untuk pertumbuhan fungi, karena enzim-enzim
tertentu hanya akan mengurai suatu substrat sesuai dengan aktivitasnya pada pH
tertentu. Umumnya fungi menyenangi pH di bawah 7. Jenis-jenis khamir tertentu
seperti selolutik fungal bahkan tumbuh pada pH yang cukup rendah, yaitu pH 4,5 -
5,5. Pengaturan pH sangat penting dalam industri agar fungi yang ditumbuhkan
enzim, produksi antibiotik, dan juga untuk mencegah pembusukan bahan pangan
(Gandjar, 2006).
g. Temperatur inkubasi
Berdasarkan kisaran suhu lingkungan yang baik untuk pertumbuhan, fungi
dapat dikelompokkan sebagai fungi psikrofil, mesofil, dan termofil. Pengetahuan
tentang kisaran temperatur pertumbuhan suatu fungi sangat penting, terutama bila
isolat-isolat tertentu akan digunakan di industri. Misalnya, fungi yang termofil atau
termotoleran (Candida tropicalis, Paecilomyces variotii, dan Mucor miehei), dapat
memberikan produk yang optimal meskipun terjadi peningkatan temperatur, karena
metabolisme funginya, sehingga industri tidak memerlukan penambahan alat
pendingin (Gandjar, 2006).
h. Waktu fermentasi
Pada awal fermentasi aktivitas enzim masih sangat rendah. Aktivitas enzim
akan meningkat sejalan dengan bertambahnya waktu fermentasi dan menurun saat
memasuki fase pertumbuhan lambat ketika nutrisi sudah mulai terbatas. Hal ini
mengikuti pola pertumbuhan mikroorganisme yang mengalami beberapa fase
pertumbuhan yaitu fase adaptasi/lag phase, fase eksponensial, fase pertumbuhan
lambat, fase stasioner, dan fase kematian. Organisme pembentuk spora biasanya
memproduksi enzim pada fase pasca eksponensial. Jadi dapat diduga bahwa pada saat
(Suhartono, 1989). Pada Aspergillus niger waktu fermentasi dengan aktivitas enzim
selulase terbaik antara hari ke-4 sampai hari ke-8 (Ilyas dkk, 2011; Kumar dkk,
2011). Waktu terbaik aktivitas enzim selulase pada Trichoderma Reesei antara 10 -
19 hari (Qin Liu-Hui dkk, 2012).
i. Moisture Content
Moisture content merupakan faktor penting dalam proses sistem fermentasi
padat karena variabel ini dapat berpengaruh pada pertumbuhan mikroorganisme,
biosintesis, dan sekresi enzim. Moisture content yang rendah menyebabkan
berkurangnya kelarutan nutrien di dalam substrat, derajat pertumbuhan rendah, dan
tegangan air tinggi. Sedangkan level moisture content yang lebih tinggi dapat
menyebabkan berkurangnya yield enzim yang dihasilkan karena dapat mereduksi
porositas (jarak interpartikel) pada matriks padatan, sehingga menghalangi transfer
oksigen (Alam dkk, 2005). Moisture content yang optimal untuk pertumbuhan
Aspergillus niger adalah 70% (Ilyas dkk, 2011; Kumar dkk, 2011).
Beberapa medium dengan komposisi nutrisi bervariasi telah banyak diuji coba
pada penelitian-penelitian sebelumnya dan berhasil dengan baik memberikan nutrisi
bagi pertumbuhan mikroba dengan banyaknya jumlah spora mikroba yang terbentuk.
Pada penelitian ini direncanakan menggunakan komposisi medium Mandel Weber
(Oberoi dkk, 2010) untuk medium fermentasi sebagai kebutuhan tambahan nutrisi
bagi mikroba yang digunakan dalam penelitian ini yaitu Aspergillus niger dan
Trichoderma reesei. Komposisi medium Mandel Weber ditunjukkkan dalam
Tabel 2.5 Komposisi Medium Mandel Weber
Komponen Kuantitas (g)
(NH4)2SO4
2.6 Produksi Enzim Selulase dengan Substrat Eceng Gondok dan Perkembangannya
Penelitian mengenai pembuatan enzim selulase dari eceng gondok masih
sangat sedikit. Produksi enzim selulase umumnya menggunakan substrat bahan
lignoselulosa seperti jerami padi, jerami gandum, ampas tebu, limbah kulit jagung,
kinnow peel, dan limbah agro industri lainnya. Tidak sedikit juga yang memanfaatkan
limbah domestik, industri kertas dan lainnya.
Penelitian yang dilakukan oleh Deshpande dkk (2008) menggunakan Eceng
gondok sebagai sumber karbon dan Heba dkk (2012) juga menggunakan Eceng
gondok sebagai substrat dalam memproduksi enzim selulase. Keduanya
menggunakan teknologi fermentasi padat tetapi menggunakan mikroba dan
Tabel 2.6 Penelitian Mengenai Produksi Enzim Selulase dengan Substrat Eceng Gondok
Judul Penelitian Metodologi Hasil
Pradnya Deshpande
- Praperlakuan : NaOH, H2PO4, steam treatment
- variasi : metode 8% w/v), waktu inokulasi
III. METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Operasi Teknik Kimia, Proses
Industri KimiaDepartemen Teknik Kimia. Fakultas Teknik, Universitas Sumatera
Utara, Medan, Laboratorium Politeknik Negeri Lhokseumawe, dan Laboratorium
Mikrobiologi Arun Hospital, Lhokseumawe. Penelitian dilaksanakan pada bulan
April - September 2013.
men-sakarifikasi 28,7 % as a substrate under solid state
fermentation”
- Eceng gondok segar tanpa praperlakuan
- Teknologi fermentasi padat / solid state fer-mentation
- Variasi: mikroorganisme (12 strain fungi), sumber nutrisi nitrogen, pH (3,6-5,2), temperatur inkubasi (20-70oC), konsentrasi substrat (0,4-1,6% w/v),
3.2 Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini adalah oven, inkubator,
timbangan, kawat ose, autoclave, dan alat-alat gelas. Peralatan yang digunakan untuk
analisa adalah condenser refluks, centrifuge, spektrofotometer visibel.
Bahan-bahan yang digunakan adalah eceng gondok, aquadest, Mandels
medium (sukrosa, KH2PO4, dan amonium sulfat), Mandel Weber medium (MgSO4.
7H2O; CaCl2. 2H2O; FeSO4. 7H2O; MnSO4. H2O; ZnSO4. 7H2O; CoCl2. 6H2O;
pepton; tween 80; amonium sulfat), reagen DNS (Na-K-Tartrate; fenol; Na2SO4;
NaOH; DNS), H2SO4, PDA, glukosa, alkohol 96%, dan larutan buffer sitrat fosfat.
Mikroba yang digunakan dalam penelitian ini adalah:
1. Fungi pengurai lignin (Jamur pelapuk putih).
2. Fungi penghasil selulase (Trichoderma reesei, Aspergillus niger).
3.3 Rancangan Percobaan
Pada penelitian ini digunakan beberapa variabel, di antaranya:
a. Moisture content(%) : 65, 70, 75, 80, 85.
b. Waktu fermentasi (hari) : 3, 5, 7, 8, 9.
c. Penggunaan fungi: Trichoderma reesei (T), Aspergillus niger(A),
kombinasi kedua fungi (T&A).
Kondisi yang dipertahankan adalah:
b. Suhufermentasi: ±30°C (Juhasz, 2005; Deshpande dkk, 2012; Ilyas,
2011).
c. pH fermentasi: 5 (Juhasz, 2005).
3.4 Prosedur Percobaan
Penelitian ini terdiri dari beberapa tahapan dimulai dari persiapan bahan baku
dan mikroba, produksi enzim selulase dengan metode fermentasi padat hingga
pengambilan enzim. Berikut ini adalah prosedur sistematis dari pengerjaan
masing-masing tahapan.
3.4.1 Pembenihan Mikroba
Prosedur untuk pembenihan mikroba adalah sebagai berikut:
1. Mikroba yang digunakan adalah Aspergillus niger dan Trichoderma
reesei. Pembenihan dilakukan pada media PDA (Potato Dextrose Agar)
secara zig-zag dengan menggunakan kawat inokulasi di dalam cawan petri
secara aseptik.
2. Mikroba diinkubasi pada suhu ± 30°C selama 72 jam.
3.4.2 Praperlakuan Eceng Gondok
Prosedur praperlakuan eceng gondok adalah sebagai berikut:
1. Praperlakuan fisik
a. Eceng gondok dipotong-potong dengan pisau, dikeringkan dalam
b. Eceng gondok dilumatkan dengan penggerus, diautoclave suhu 120oC
selama 15 menit lalu dikeringkan, lalu dianalisa kadar lignin dan
selulosa akhir.
c. Eceng gondok ditambahkan aquadest untuk diatur kelembabannya.
2. Praperlakuan biologi
a. Eceng gondok dipotong-potong dengan pisau, dilumatkan dengan
penggerus. Dianalisa kadar lignin dan selulosa awal.
b. Eceng gondok disterilkan dengan autoclave suhu 120oC selama 15
menit, lalu didinginkan.
c. Eceng gondok didegradasi lignin dengan jamur pelapuk putihdengan
penambahan nutrisi pada suhu kamar selama 7 hari. Dicuci,
dikeringkan, lalu dianalisa kadar lignin dan selulosa akhir.
d. Eceng gondok diatur kelembabannya.
Skema praperlakuan fisik dan biologi ditunjukkan oleh Gambar 3.1 dan 3.2.
Mulai
Di Cacah
Gambar 3.1 Skema PraperlakuanFisik
Apakah Eceng Gondok
Dilakukan Analisa Kadar Lignin-Selulosa Sampel Fisik
Mulai
Dilakukan Analisa Kadar Lignin-Selulosa Sampel Awal
Disterilkan Bubuk Eceng Gondok pada T = 121oC selama 15 menit
Gambar 3.2 Skema Praperlakuan Biologi
3.4.3 Penyiapan Inokulum Cair
Prosedur penyiapan inokulum cair mikroba adalah sebagai berikut:
1. Seratus mililiter media cair (media cair ini terdiri dari sukrosa 22% (w/v),
(NH4)2SO4 1% (w/v), KH2PO4 1%(w/v)) (Junior dkk, 2009), api bunsen,
dan kawat ose disiapkan.
2. pH media cair diatur dengan HCl hingga pH=3.
Apakah Eceng Gondok Sudah Kering
Tidak
Ya
Dikeringkan pada Suhu 105oC
Data Kadar Lignin-Selulosa Sampel Biologi
3. Ujung kawat ose dicelupkan ke dalam alkohol 96% lalu dipanaskan pada
api bunsen sampai berwarna merah.
4. Biakan Aspergillus nigerdan Trichoderma reeseidari media PDA diambil
dengan menggunakan kawat ose lalu dicelupkan beberapa saat pada media
cair hingga tampak keruh.
5. Media cair ditutup dengan kapas dan diinkubasi pada suhu ± 30°C selama
48 jam.
6. Pekerjaan ini dilakukan di ruang aseptic (Sa’adah Z dkk, 2010).
3.4.4 Produksi Enzim Selulase
Prosedur sistematis fermentasi untuk produksi enzim selulase adalah sebagai
berikut:
1. Eceng gondok dari dua perlakuan berbeda masing-masing diatur
kelembabannya.
2. Aquadest ditambahkan dalam eceng gondok hingga didapat moisture
content 65%, 70%, 75%, 80%, 85%.
3. Eceng gondok 10 gram dimasukkan ke dalam beaker glass 250 ml sesuai
variabel (moisture content/kelembaban yang telah diaturdan waktu
fermentasi) ditambah 30 ml komposisi nutriri medium Mandel Weber.
4. pH diatur hingga pH=5 lalu media disterilkan di dalam autoclave pada
suhu 120ºC selama 15 menit.
6. Suspensi spora ditambahkan dengan konsentrasi 15% (w/w) (Junior dkk,
2009).
7. Media diinkubasi pada suhu ±30oC dengan waktu fermentasi (hari) 3, 5, 7,
8, 9(Oberoi dkk, 2010).
3.4.5 Pengambilan Enzim
Prosedur pengambilan enzim dari hasil fermentasi adalah sebagai berikut:
1. Hasil fermentasi diekstrak dengan aquadest dengan perbandingan 5 bagian
aquadest per 1 bagian massa.
2. Endapan dan cairan hasil fermentasi dipisahkan dengan menggunakan
centrifuge dengan kecepatan 2500 rpm selama 15 menit.
3. Cairan yang diperoleh kemudian diambil untuk diuji aktivitas enzimnya
(Sa’adah Z dkk, 2010).
3.5 Analisis Hasil Penelitian
Keberhasilan suatu penelitian diukur melalui beberapa analisa yang dilakukan
terhadap suatu hasil penelitian. Analisa yang dilakukan dalam penelitian ini untuk
mengetahui keberhasilan metode praperlakuan dalam mendegradasi lignin adalah
fermentasi dalam menghasilkan enzim selulase adalah dengan pengujian aktivitas
enzim selulase.
3.5.1 AnalisisKadar Lignin dan Selulosa
Pengujian kadar lignin dan selulosa menggunakan metode Chesson. Pengujian
ini dilakukan untuk mengetahui jumlah lignin yang terdegradasi serta jumlah selulosa
yang dihasilkan baik dari metode praperlakuan yang dilakukan. Tahapan analisa
sebagai berikut (Isroi, 2011):
1. Satu gram (a) sampel kering ditambahkan 150 mL H2O. direfluks pada suhu
100oC dengan water bath selama 1 jam. Hasilnya disaring, residu dicuci
dengan air panas (300 mL). Residu kemudian dikeringkan dengan oven
sampai konstan kemudian ditimbang (b).
2. Residu ditambahkan 150 mL H2SO4 1 N kemudian direfluks dengan water
bath selama satu jam suhu 100oC. Hasilnya disaring sampai netral (300 mL)
dan dikeringkan (c).
3. Residu kering ditambahkan 10 mL H2SO4 72% dan direndam pada suhu
kamar selama 4 jam. Ditambahkan 150 mL H2SO4 1N dan direfluks pada
water bath selama satu jam pada pendingin balik. Residu disaring dan dicuci
dengan H2O sampai netral (400 mL) kemudian dipanaskan dengan oven
dengan suhu 105oC dan hasilnya ditimbang (d).
Perhitungan untuk mencari kadar selulosa adalah:
kadar selulosa = �−�