TERISOLASI : STUDI IN VITRO DAN IN SILICO
Disusun untuk Memenuhi Sebagian Syarat Memperoleh Derajat Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Muhammadiyah Yogyakarta
Disusun Oleh RATIH DWI AMALIAH
20120350023
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
KARYA TULIS ILMIAH
UJI AKTIVITAS ANTAGONISME ALKALOID LADA (Piper nigrum L.) PADA RESEPTOR HISTAMIN H1 OTOT POLOS ILEUM MARMUT
TERISOLASI : STUDI IN VITRO DAN IN SILICO
Disusun untuk Memenuhi Sebagian Syarat Memperoleh Derajat Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Muhammadiyah Yogyakarta
Disusun Oleh RATIH DWI AMALIAH
20120350023
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS MUHAMMADIYAH YOGYAKARTA
iii PERNYATAAN KEASLIAN
Saya yang bertanda tangan di bawah ini:
Nama : Ratih Dwi Amaliah NIM : 2012 035 0023 Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Menyatakan dengan sebenarnya bahwa Karya Tulis Ilmiah yang saya tulis benar-benar merupakan hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantumkan dalam Daftar Pustaka dibagian akhir Karya Tulis Ilmiah ini.
Apabila dikemudian hari terbukti atau dibuktikan Karya Tulis Ilmiah ini hasil jiplakan, maka saya bersedia menerima sanksi atas perbuatan tersebut.
Yogyakarta, Agustus 2016 Yang membuat pernyataan
iv
MOTTO
“I go to seek the great perhaps” (Francois Rabelais)
“Maka sesungguhnya bersama kesulitan ada kemudahan. Sesungguhnya bersama kesulitan ada kemudahan”
(QS. Al-Insyirah: 5-6)
“Cukuplah Allah sebagai penolong kami, dan Allah sebaik-baiknya pelindung” (QS. Al-Imran :173)
“Man jadda wa jada, barang siapa yang bersungguh-sungguh maka dia akan berhasil”
(Pepatah Arab)
“Its better to fail in the first try than regret for never try” (Ratih Dwi A.)
v
HALAMAN PERSEMBAHAN
Untuk kedua Orang tuaku, Keluarga besarku, Sahabat-sahabatku,
Almamaterku, dan Bangsaku.
vi
KATA PENGANTAR
Assalmu’alaikum Wr. Wb.
Segala puji bagi Allah SWT, Tuhan semesta alam yang telah meridhoi dan memberikan kemudahan kepada hamba-Nya dalam menyelesaikan pembuatan karya tulis ilmiah yang berjudul “UJI AKTIVITAS ANTAGONISME
ALKALOID LADA (Piper nigrum L.) PADA RESEPTOR HISTAMIN H1
OTOT POLOS ILEUM MARMUT TERISOLASI : STUDI IN VITRO DAN IN SILICO “. Sholawat serta salam untuk Nabi Besar Muhammad SAW, beserta
keluarga, sahabat dan pengikutnya yang senantiasa istiqamah di jalan-Nya. Karya tulis ini dibuat sebagai salah satu persyaratan kelulusan mahasiswa Program Sarjana S1 Universitas Muhammadiyah Yogyakarta. Namun, sebaik apapun karya tulis ini. Penulis menyadari bahwa Karya Tulis Ilmiah ini dibuat atas bantuan dari berbagai pihak. Untuk itu sudah sepantasnya penulis mengucapkan terima kasih kepada :
1. dr. Ardi Pramono Sp.An., M.Kes. selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Muhammadiyah Yogyakarta.
2. Ibu Sabtanti Harimurti, S.Si., M.Sc., Ph.D., Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Muhammadiyah Yogyakarta.
4. Bapak Puguh Novi Arsito, M.Sc., Apt selaku dosen pembimbing penulis. Terimakasih untuk kesabaran dalam memberikan bimbingan, ilmu, saran serta kepercayaan selama penelitian dan penulisan karya tulis ini.
5. Bapak Andy Eko Wibowo, M.Sc., Apt dan Bapak Rifki Febriansah., M.Sc., Apt selaku dosen penguji yang telah bersedia memberikan saran dan bimbingan sehingga Karya Tulis ilmiah ini dapat menjadi lebih baik lagi.
6. Bapak/Ibu dosen pengajar yang telah mendidik penulis selama masa perkuliahan.
7. Mas Satria dan Mbak Zelmi yang selalu bersedia membantu selama proses penelitian.
8. Teman seperjuangan penelitian Indah dan Tamam, yang saling membantu serta bahu membahu dalam berjuang menyelesaikan Karya Tulis Ilmiah ini, serta Nazila, Waralita dan temen-teman sepembimbingan lain yang sudah bersedia membantu dan berdiskusi.
9. Mita, Jihan, Anggi, Seftina, Nopril, dan Hida yang selalu memberikan semangat, dukungan dan bantuan kepada penulis.
10. Rekan-rekan ”ASPARTIC” Farmasi 2012 yang selama 4 tahun ini telah bersama dalam menempuh pendidikan.
viii
12.Semua pihak yang terkait dalam penelitian ini. Terimakasih atas dukungan yang diberikan baik yang bersifat material maupun non material, alunan doa, dukungan serta bimbingan selama penulisan Karya Tulis Ilmiah. Penulis menyadari sepenuhnya bahwa penyusunan KTI ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan saran yang bersifat membangun dan mendukung kemanfaatan hasil penelitian ini.
Wassalamu‟alaikum Wr. Wb.
Yogyakarta, 29 Agustus 2016 Penulis
ix
C. Ekstraksi dan Isolasi Senyawa Murni Piperin ... 7
D. Identifikasi Alkaloid Dengan KLT ... 8
E. Fourier Transform Infrared Spectrometer (FTIR) ... 8
F. Spektrofotometer UV-Vis ... 9
G. Titik Lebur ... 10
H. Reseptor Histamin ... 10
I. Interaksi Obat dengan Reseptor ... 12
J. Percobaan dengan Organ Terisolasi ... 13
K. Metode In Silico Menggunakan Molecular Docking... 15
L. Landasan Teori ... 17
M.Kerangka Konsep... 18
x
BAB III METODE PENELITIAN... 21
A. Desain Penelitian ... 21
B. Tempat dan Waktu ... 21
C. Populasi dan Sampel ... 21
D. Identifikasi Variabel ... 21
E. Alat dan Bahan ... 21
F. Prosedur Kerja dan Alur Penelitian ... 22
G. Skema Langkah Kerja... 31
H. Data dan Analisis Data ... 31
BAB IV HASIL DAN PEMBAHASAN ... 35
A. Ekstraksi Kristal Alkaloid Lada... 35
B. Uji In Vitro Aktivitas Alkaloid Lada ... 42
C. Uji In Silico Senyawa Piperin Pada Reseptor H1... 52
BAB V KESIMPULAN DAN SARAN ... 57
A. Kesimpulan ... 57
B. Saran ... 57
DAFTAR PUSTAKA ... 58
xi
DAFTAR TABEL
Tabel 1. Komposisi buffer tyrode... 23
Tabel 2. Cara pemberian dosis agonis histamin... 26
Tabel 3. Kode dan struktur protein Histamin H1... 27
Tabel 4. Visualisasi ligan... 28
Tabel 5. Hasil identifikasi senyawa pada plat KLT... 38
Tabel 6. Nilai rata-rata pD2 histamin karena pengaruh DMSO 100μL... 44
Tabel 7. Pergeseran nilai pD2 histamin karena pengaruh difenhidramin 0,01 dan 0,05 μM... 48
Tabel 8. Pergeseran nilai pD2 histamin karena pengaruh alkaloid lada 1000 dan 5000 μM... 50
Tabel 9. Pergeseran nilai pD2 histamin pada uji reversibilitas alkaloid lada 1000 dan 5000 μM terhadap reseptor H1 ... 52
xii
DAFTAR GAMBAR
Gambar 1. Tanaman Lada (Piper nigrum L.)... 5
Gambar 2. Struktur kimia piperin... 7
Gambar 3. Struktur kimia histamin... 11
Gambar 4. Prinsip Dasar Molecular Docking... 16
Gambar 5. Kerangka konsep... 18
Gambar 6. Skema langkah kerja... 31
Gambar 7. Kristal alkaloid lada... 35
Gambar 8. Uji identifikasi KLT senyawa alkaloid lada sebelum disemprot dragendorff... 37
Gambar 9. Uji identifikasi KLT senyawa alkaloid lada setelah disemprot pereaksi dragendorff... 37
Gambar 10. Reaksi antara piperin dan dragendorff... 38
Gambar 11. FTIR kristal alkaloid lada... 39
Gambar 12. Hasil uji spektrofotometer UV... 40
Gambar 13. Gugus kromofor piperin... 41
Gambar 14. Pengaruh DMSO terhadap respon kontraksi otot polos ileum yang diinduksi histamin... 44
Gambar 15. Kurva hubungan logaritma konsentrasi histamin terhadap % respon kontraksi otot polos ileum marmut terisolasi, baik tanpa atau dengan pemberian difenhidramin 0,01 dan 0,05 μM... 46
Gambar 16. Kurva Schild-Plot perhitungan parameter antagonis (pA2) difenhidramin terhadap reseptor H1 ... 47
Gambar 17. Kurva hubungan logaritma konsentrasi histamin (M) terhadap % respon kontraksi otot polos ileum terisolasi, baik tanpa atau dengan pemberian alkaloid lada 1000 dan 5000 μM... 49
Gambar 18. Kurva hubungan logaritma konsentrasi histamin (M) terhadap % respon kontraksi otot polos ileum terisolasi pada uji reversibilitas alkaloid lada 1000 dan 5000 μM terhadap reseptor H1... 51
Gambar 19. Visualisasi sisi aktif protein reseptor H1 ... 53
Gambar 20. Interaksi doksepin (ligan asli) dan reseptor H1 ... 53
Gambar 21. Interaksi piperin dan reseptor H1 ... 55
xiii
DAFTAR LAMPIRAN
Lampiran 1. Hasil Determinasi Tanaman... 63 Lampiran 2. Hasil FTIR Kristal Alkaloid Lada... 64 Lampiran 3. Hasil ji titik lebur kristal alkaloid lada... 65 Lampiran 4. Perhitungan konsentrasi larutan piperin dalam metanol
dan perhitungan absortivitas molar (ε)... 66 Lampiran 5. Perhitungan Panjang Gelombang Gugus Enon
berdasarkan Woodward’s Rule... 67 Lampiran 6. Data Pengaruh Pelarut DMSO terhadap Kontraksi Otot
Polos ileum... 68 Lampiran 7. Data Pengaruh Alkaloid lada Terhadap Reseptor H1
Otot Polos Ileum... 70 Lampiran 8. Data Uji Reversibilitas Alkaloid lada 1000 μM dan 5000
μM Terhadap Reseptor H1 Otot Polos ileum... 73 Lampiran 9. Data Pengaruh Difenhidramin Terhadap Reseptor H1
Otot Polos Ileum... 76 Lampiran 10. Perhitungan Parameter Antagonis (pA2) difenhidramin
Terhadap Reseptor H1... 79
Lampiran 11. Hasil Uji Statistik Pada Uji Pengaruh Pelarut DMSO
Terhadap Kontraksi Otot Polos Ileum... 80 Lampiran 12. Hasil Uji Statistik Pada Uji Pengaruh alkaloid lada dan
difenhidramin terhadap Kontraksi Otot Polos ileum
yang diinduksi histamin... 81 Lampiran 13. Hasil Uji Statistik Reversibilitas Kontraksi Otot Polos
xiv banyak diteliti dan memiliki efek menjanjikan. Piperin dilaporkan dapat menghambat pelepasan histamin dari sel mast dengan jalan menghambat jalur signal yang dimediasi oleh IgE. Oleh karena itu piperin diduga memiliki aksi antagonisme terhadap reseptor histamin. Tujuan penelitian ini adalah untuk mengekstraksi senyawa alkaloid piperin dari Piper nigrum L. dan mengetahui pengaruhnya terhadap reseptor H1.
Penelitian ini dilakukan dengan mengamati pengaruh alkaloid lada terhadap kontraksi otot polos ileum marmut terisolasi yang diinduksi agonis histamin. Alkaloid diperoleh dari ekstrak buah lada kemudian dilakukan identifikasi piperin menggunakan KLT, FTIR, spektrofotometri UV-Vis dan uji titik lebur. Selanjutnya alkaloid diberikan dengan dosis 1000 µM dan 5000 µM. Pada uji in vitro ini juga akan dipelajari tipe antagonisme dari alkaloid dan sifat reversibilitasnya pada reseptor. Dalam penelitian ini juga dilakukan uji in silico
senyawa piperin terhadap reseptor H1 menggunakan perangkat lunak AutoDock.
Hasil penelitian menunjukkan bahwa alkaloid lada mengandung piperin berdasarkan pada hasil uji FTIR, spektrofotometri UV-Vis dan uji titik lebur. Alkaloid lada juga mampu menghambat kontraksi ileum marmut yang diinduksi agonis histamin. Nilai pD2 pada reseptor H1 bergeser secara signifikan pada dosis
5000 µM (p<0,05) dengan tipe antagonis non-kompetitif dilihat dari bentuk kurva respon kontraksi yang tidak mencapai Emax 100%. Hasil uji reversibilitas menunjukkan dengan penggantian buffer tyrode setiap 5 menit selama 30 menit ikatan alkaloid dengan reseptor H1 dapat terdisosiasi. Uji in silico menunjukkan
bahwa piperin mampu berikatan dengan reseptor H1 (skor docking : -5,70).
Piperin berikatan pada asam amino Lys179 yang merupakan salah satu protein penting dalam aktivitas histaminergik. Kesimpulan penelitian ini adalah alkaloid lada mengandung piperin dan memiliki aktivitas sebagai antagonis non kompetitif pada reseptor H1.
xv Based on the fact, piperin was expected to has the effect of antagonism action at the histamine receptor. The aim of this study was to extracting alkaloid compound from Piper nigrum L. and investigate its effects on H1 receptor.
This research was conducted by investigated the effect of alkaloid of pepper on the guinea pig ileum smooth muscle contraction induced by histamine. Alkaloid was obtained from the pepper extract and then identification of piperin was done by using TLC, FTIR and UV-Vis spectrophotometry and melting point assay. The alkaloid was administered at the doses of 1000 µ M and 5000 µM. On this in vitro study, the type of antagonism and reversibility will be investigated. In this study was also conducted in silico study of piperin using the AutoDock software.
The result showed that alkaloid of pepper containing piperine based on the result of the FTIR, UV-Vis spectrophotometry, and melting point assay. Alkaloid also able to inhibit the contraction of isolated guinea pig ileum smooth muscle induced by histamine. The pD2 values of H1 receptor shifted significantly
on the dose of 5000 µM (p < 0.05) with the types of non-competitive antagonists observed from the shape of the contraction response curve that was not reach 100% Emax. Reversibility assay showed that by replaced buffer tyrode every 5 minutes for 30 minutes , the bond of alkaloid to the receptor able to dissociate. In the in silico study, piperine was observed can be bind to receptors H1 (docking
score :-5.70). Piperine bound at amino acid Lys179 which is one of the important proteins in the histaminergic activity. The conclusion of this research is the alkaloid of pepper containing piperine and has the activity as a non-competitive antagonist at the H1 receptor.
1
BAB I
PENDAHULUAN
A. Latar Belakang
Indonesia dikenal memiliki kekayaan hayati yang sangat beragam, salah satunya adalah rempah. Tidak hanya dijadikan bumbu masakan, rempah juga seringkali digunakan masyarakat sebagai obat tradisonal untuk berbagai macam penyakit. Tersedianya berbagai jenis rempah ini berpotensi untuk diteliti kandungannya dan dijadikan senyawa penuntun (lead compound) ataupun penemuan obat baru.
Salah satu kekayaan rempah yang memiliki potensi besar dijadikan tanaman obat adalah lada (Piper nigrum Linn) famili Piperaceae. Tanaman ini berasal dari India dan tumbuh juga di beberapa negara Asia Tenggara lainnya (Madhavi et al., 2009). Di Indonesia juga sering dikenal dengan sebutan merica dan banyak digunakan sebagai bumbu masak. Lada secara tradisional digunakan sebagai obat analgesik, antipiretik, penekan sistem saraf pusat, antiinflamasi, antioksidan, antikonvulsan, anti bakteri, anti tumor, dan memiliki aktivitas hepatoprotektif (Pei YQ., 1983). Kandungan yang terdapat pada lada antara lain alkaloid piperin (5-9 %), minyak volatil (1-2,5%), resin (6,0%), piperidin dan pati (sekitar 30%) (Madhavi et al., 2009).
2
diinduksi karagenin (Mujumdar, 1990). Pengujian piperin secara in-vivo
menunjukkan bahwa piperin memiliki efek antiinflamasi, antinosiseptif dan antiatritis dengan jalan menghambat beberapa mediator inflamasi (Bang et al., 2009). Selain itu pengujian campuran ekstrak herbal (polyherbal) yang mengandung Piper nigrum L. menunjukkan efek bronkodilatasi pada tikus yang diinduksi ovalbumin (Antony, 2010). Penelitian in-vitro menunjukkan bahwa piperin dapat menghambat degranulasi pada kultur sel mast (RBL-2H3) melalui penghambatan phosphatidylinositol 4-kinase(s) (Bojjireddy et al., 2014). Selain itu Huang J, et al. (2014) juga menemukan adanya penurunan level Ca2+ intraselular yang berperan pada penghambatan degranulasi sel mast.
Penelitian ini bertujuan untuk mengetahui apakah piperin, suatu alkaloid
Piper nigrum Linn. memiliki pengaruh terhadap kontraksi dan relaksasi otot polos ileum. Efek tersebut diamati berdasarkan selektifitasnya terhadap reseptor yang diduduki histamin. Pengujian dilakukan secara in-vitro melalui metode organ ileum marmut terisolasi. Dari penelitian ini diharapkan dapat menghasilkan data-data yang dapat dijadikan acuan untuk penelitian selanjutnya.
Pemanfaatan tumbuhan telah dijelaskan dalam Al-Quran surat Asy- Syu’ara ayat 7 yang berbunyi:
Artinya: “Dan apakah mereka tidak memperhatikan bumi, berapakah banyaknya
ada manfaatnya. Salah satu ciptaan-Nya yaitu tumbuh-tumbuhan yang beraneka ragam hendaknya kita manfaatkan sebaik-baiknya demi kemaslahatan umat.
B. Perumusan Masalah
1. Apakah alkaloid lada (Piper nigrum L.) mengandung senyawa piperin? 2. Apakah alkaloid lada memiliki efek antagonisme terhadap kontraksi otot
polos ileum marmut terisolasi yang diinduksi agonis reseptor histamin? 3. Bagaimanakah tipe antagonisme alkaloid lada terhadap reseptor histamin
H1?
4. Berapakah skor docking piperin apabila dibandingkan dengan ligan asli reseptor H1 dan difenhidramin sebagai antagonis reseptor histamin?
5. Bagaimanakah ikatan antara ligan asli, piperin dan difenhidramin terhadap protein pada reseptor histamin H1?
C. Keaslian Penelitian
Beberapa penelitian terkait Piper nigrum L. dan senyawa alkaloidnya pernah dilakukan. Uji secara in-vivo menunjukkan bahwa piperin (senyawa aktif
4
aktivitasnya terhadap reseptor histamin dengan metode organ ileum marmut terisolasi.
D. Tujuan penelitian
1. Mengetahui kandungan piperin secara kualitatif pada alkaloid lada.
2. Mengetahui pengaruh antagonisme alkaloid lada terhadap kontraksi otot polos ileum marmut terisolasi yang diinduksi agonis reseptor histamin.
3. Mengetahui jenis antagonisme alkaloid lada terhadap reseptor histamin H1.
4. Mengetahui skor docking piperin yang dibandingkan dengan ligan asli, reseptor H1 dan difenhidramin sebagai antagonis reseptor histamin.
5. Mengetahui bagaimana ikatan antara ligan asli, piperin dan difenhidramin terhadap protein pada reseptor histamin H1.
E. Manfaat Penelitian
5
BAB II
TINJAUAN PUSTAKA
A. Tanaman Lada
1. Uraian Tanaman
Kingdom : Plantae (tumbuhan)
Divisio : Spermatophyta (menghasilkan biji) Kelas : Dicotyledonae
Ordo : Piperales Genus : Piper Family : Piperaceae
Species : Piper nigrum Linn(Tjitrosoepomo, 2004)
Gambar 1. Tanaman Lada (Piper nigrum L.)
(Rudi T Setiyono et al., 2014)
6
tunggang. Daun tanaman lada merupakan daun tunggal, berseling dan tersebar (Tjitrosoepomo, 2004). Daun berbentuk bulat telur sampai memanjang dengan ujung meruncing (Rismunandar, 2007). Buah lada memiliki bentuk bulat, biji keras dan kulit lunak. Kulit buah yang masih muda berkulit luar (epikarp) hijau mengkilap dimana ketika masak berubah menjadi kuning dan merah menyala. (Ditjenbun, 2013; Sarpin, 2003). Buah lada umumnya dikenal dalam dua jenis, yaitu lada hitam dan lada putih. Yang membedakan kedua jenis ini adalah proses pembuatannya. Proses pembuatan lada hitam adalah dengan mengambil buah yang masih hijau, diperam, kemudian dijemur sampai kering. Dari penjemuran diperoleh buah lada yang keriput dan berwarna kehitam-hitaman. Sedangkan lada putih diambil dari buah yang hampir masak, direndam, dan dikupas kulitnya yang kemudian dijemur hingga berwarna putih (Rismunandar, 2007).
2. Kandungan dan Manfaat Piper nigrum Linn.
B. Piperin
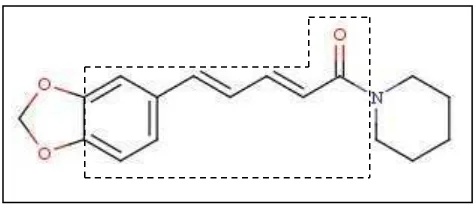
Gambar 2. Struktur kimia piperin
Piperin adalah senyawa golongan alkaloid, dapat diisolasi dari tanaman-tanaman famili Piperaceae, seperti Piper nigrum dan Piper longum (Vasavirama & Mahesh, 2014; Sudjarwo, 2005). Sebanyak 5-9% alkaloid yang terdapat pada lada sebagian besar merupakan senyawa piperin (Epstein et al., 1993). Rumus kimia piperin adalah C17H19NO3. Sruktur kimia piperin dapat dilihat pada gambar
2. Kristal piperin berwarna kuning, larut dalam eter, etanol, metanol, kloroform, sedikit larut dalam air (Kolhe, 2011). Rentang titik lebur piperin adalah 128-130oC (Adosraku, 2013), sedangkan larutan piperin dalam metanol menyerap panjang gelombang maksimal pada 342,5 nm (Vishnath et al., 2011).
C. Ekstraksi dan Isolasi Senyawa murni Piperin
Metode yang umum digunakan untuk mengisolasi kristal piperin adalah dengan cara ekstraksi menggunakan pelarut organik seperti etanol (96%) dan KOH (Ikan R., 1991). Selain itu ekstraksi juga bisa menggunakan beberapa jenis pelarut seperti diklorometan dan asam asetat glasial (Kohle, 2011; Madhavi, 2009). Selanjutnya isolasi dan pemurnian senyawa piperin dapat dilakukan menggunakan kromatografi kolom dengan pelarut toluen dan etil asetat (Shingate
8
D. Identifikasi Alkaloid Dengan KLT
Kromatografi Lapis Tipis (KLT) merupakan bentuk kromatografi planar, selain kromatografi kertas dan elektroforesis. Zat penjerap (fase diam) pada KLT berupa lapisan tipis serbuk halus yang dilapiskan pada lempeng kaca, pelat plastik atau logam secara merata. Fase gerak yang dikenal sebagai pelarut pengembang akan bergerak sepanjang fase diam karena pengaruh kapiler pada pengembangan secara menaik (ascending) atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Farmakope Herbal Indonesia, 2009; Gandjar & Abdul Rohman, 2007). Uji alkaloid dengan metode KLT dapat diamati dengan menggunakan pereaksi dragendorff (Adeanne et al., 2013).
E. Fourier Transform Infrared Spectrometer (FTIR)
Spektrofotometer inframerah merupakan instrumen yang digunakan untuk mengukur resapan radiasi inframerah pada berbagai panjang gelombang (Fessenden, 1982). Radiasi inframerah terletak pada spektrum elektromagnetik antara daerah visibel dan daerah microwave (gelombang mikro). Penggunaannya paling banyak untuk kimia organik pada batas panjang gelombang antara 4000 dan 400 cm-1. Spektrum vibrasi tampak berupa pita. Ada dua tipe vibrasi molekuler yaitu stretching dan bending. Hanya vibrasi yang menghasilkan perubahan secara ritmik pada momen dipol yang diobservasi dalam IR (Silverstein, 2005)
seringkali rumit karena absorpsi disebabkan oleh adanya stretching dan bending. Dalam daerah ini biasanya hubungan antara pita serapan dan gugus fungsional spesifik tidak dapat diamati dengan cermat. Namun, suatu senyawa pasti memiliki resapan tertentu yang unik di daerah ini sehingga disebut dengan fingerprint region (daerah sidik jari). Meskipun pada bagian kiri suatu spektrum sama dengan senyawa-senyawa yang mirip, daerah sidik jari juga penting untuk memutuskan kedua senyawa tersebut sama (Fessenden, 1982).
Instrumen Fourier Transform Infrared Spectrometer (FTIR) berdasarkan pada interferometer yang terdiri dari beam splitter, cermin diam, dan cermin bergerak. Sinar radiasi yang berasal dari sumber melewati beam splitter dan terbagi menjadi dua berkas yang direfleksikan pada cermin yang diam dan berkas lainnya direfleksikan pada cermin yang bergerak tegak lurus. Cermin merefleksikan kembali radiasi pada beam splitter berulang kali menghasilkan satu berkas sampai pada detektor dan berkas yang lain kembali ke sumber (Stuart, 2004).
F. Spektrofotometer UV-Vis
10
diperlukan untuk transisi n π* dan transisi π π* sesuai dengan energi sinar yang terletak diantara panjang gelombang 200-700 nm yang merupakan panjang gelombang pada spektrofotometer UV-Vis (Gandjar & Abdul Rohman, 2007).
Spektra UV-Vis dapat digunakan sebagai informasi kualitatif maupun kuantitatif. Data yang diperoleh dari spektroskopi UV dan Vis adalah panjang gelombang maksimal, intensitas, efek pH, dan pelarut yang dapat dibandingkan dengan data acuan. Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang dengan absorbansi maksimal (Gandjar & Abdul Rohman, 2007).
G. Titik Lebur
Titik lebur senyawa murni organik solid merupakan jarak temperatur ketika bentuk padat setimbang dengan bentuk cairnya. Titik lebur merupakan salah satu karakteristik untuk menentukan kemurnian substansi solid. Titik lebur menunjukkan rentang temperatur dari pertama kali kristal dari substansi solid meleleh hingga kristal tersebut meleleh seluruhnya. Kristal solid yang murni memiliki rentang titik lebur yang sempit yaitu 1-2oC (Hart et al., 2012).
H. Reseptor Histamin
penyembuh diri sendiri yang dilepaskan oleh sel sebagai respon terhadap stimulus, bisa juga dikatakan sebagai hormon lokal (Offerans & Rosenthal, 2006). Histamin hampir tersebar diseluruh tubuh, akan tetapi sebagian besar ditemukan di kulit, saluran pernapasan, saluran pencernaan, dan otak. Histamin tersimpan di dalam tiga tipe sel yaitu sel mast, enterochromaffin-likecell (ECL), dan sel syaraf (Lullman et al., 2000). Pelepasan histamin dari sel mast memicu reaksi alergi (Offerans & Rosenthal, 2006).
Gambar 3. Struktur kimia histamin
Ketika terlepas dari sel mast, histamin akan berikatan dengan reseptor histamin dan selanjutnya akan terjadi tranduksi sinyal. Reseptor histamin tergolong ke dalam famili reseptor terkait protein G (G-protein coupled receptor/GPCR). Hingga saat ini telah ditemukan 4 subtipe reseptor histamin tersebut yakni reseptor H1, H2, H3 dan H4. Reseptor H1 tersebar di otot polos
endotelium, adrenal medula, dan sistem saraf pusat. Reseptor H2 terdapat pada
sel-sel parietal lambung. Reseptor ini berperan dalam sekresi asam lambung, reseptor H3 tedapat pada sel-sel saraf, sedangkan reseptor H4 terdapat pada
12
bekerja dengan cara menduduki reseptor histamin serta mencegah pelepasan histamin melalui degranulasi sel mast (Katzung,1997).
I. Interaksi Obat dengan Reseptor
1. Obat Agonis dan Antagonis
Obat agonis berikatan dengan suatu cara untuk memacu reseptor secara langsung atau tidak hingga memberikan efek. Pada beberapa reseptor, mekanisme yang terjadi melalui satu molekul yang berikatan pada reseptor sehingga memberikan efek langsung. Untuk reseptor lain harus berikatan dengan satu atau lebih molekul pasangan (coupling molecule) yang terpisah dengan molekul yang memberikan efek (Katzung, 1997).
Obat antagonis bekerja dengan cara menghambat reseptor berikatan dengan molekul lain. Misalnya, antihistamin bekerja dengan cara menyekat reseptor histamin sehingga tidak dapat berikatan dengan histamin atau agonis serupa yang dapat berikatan pada reseptor tersebut. Zat-zat antagonis seperti ini mengurangi efek dari histamin (Katzung, 1997).
2. Hubungan Konsentrasi Obat dengan Respon
Dalam pengontrolan sistem in-vitro, hubungan antara konsentrasi obat dan efeknya dapat dijelaskan secara matematik. Hubungan antara konsentrasi dan efek obat dijelaskan oleh suatu kurva hiperbola dengan persamaan sebagai berikut :
Dimana E merupakan efek yang dihasilkan pada konsentrasi C, Emax
merupakan respon maksimal yang dihasilkan obat dan EC50 merupakan
digunakan untuk mencari parameter afinitas agonis terhadap reseptor (pD2). Nilai
pD2 adalah minus logaritma dari EC50. Semakin besar nilai pD2 maka semakin
besar afinitas agonis terhadap reseptor.
Dengan adanya suatu antagonis pada sistem, kurva hubungan konsentrasi agonis dengan respon juga akan berubah. Pada antagonis kompetitif, kurva akan bergeser ke kanan. Sedangkan pada antagonis non-kompetitif, kurva akan bergeser ke bawah (Emax turun). Untuk menentukan sifat kompetitif dari suatu
antagonis dapat digunakan persamaan Schild yang berupa persamaan garis lurus : Log (A’/A – 1) = log [B] – log KB
Keterangan :
(A’/A) : Rasio konsentrasi EC50 dengan pengaruh antagonis terhadap
EC50 tanpa pengaruh antagonis
[B] : Konsentrasi antagonis
KB : Konstanta disosiasi ekuilibrium
Persamaan tersebut merupakan suatu persamaan garis lurus dengan Y= log (A’/A– 1) dan X= log [B]. Sifat kompetitif dari suatu antagonis dilihat dari slope
pada sumbu X (Log [B]). Nilai slope suatu antagonis kompetitif adalah mendekati 1 (satu) (Janković et al., 1999).
J. Percobaan dengan Organ Terisolasi
14
obat pada beberapa dekade belakangan ini, metode organ terisolasi masih dianggap sebagai metode yang baik untuk menelusuri aktivitas farmakologi suatu obat.
Perubahan-perubahan yang terjadi pada tingkat jaringan atau organ karena pengaruh suatu senyawa kimia dapat dipelajari lebih mendalam dan akurat dengan cara mengisolasi suatu organ atau jaringan dari suatu sistem fisiologis. Sebagai contoh, senyawa vasokonstriktor dapat diukur aktivitasnya dengan menggunakan beberapa bagian pembuluh darah terisolasi, seperti vena portal atau vena
saphenous, vena mesentric, arteri koroner dan arteri basiler. Organ atau bagian organ yang diisolasi akan mampu tetap bertahan hidup selama beberapa jam di luar tubuh jika organ dikondisikan tetap berada dalam lingkungan fisiologisnya, yaitu dengan cara pemberian cairan fisiologis dalam temperatur yang sesuai, asupan oksigen dan nutrien yang tepat dari luar. Rangsangan fisiologis dan farmakologis terhadap organ terisolasi selanjutnya dapat tercatat dengan menggunakan alat perekam yang tepat. Efek kontraksi pembuluh darah akan tercatat dengan mengkondisikan pembuluh darah dengan bantuan dua penjepit atau penahan sedemikian rupa dalam alat organ terisolasi dengan sedikit diberi tekanan (Lullmann et al., 2000).
Percobaan dengan menggunakan organ terisolasi memiliki beberapa keuntungan, diantaranya adalah sebagai berikut (Lullman et al., 2000) :
a. Konsentrasi obat pada jaringan bisa diketahui dengan pasti.
c. Jika dibandingkan dengan efek yang terjadi ketika menggunakan organisme utuh, metode organ terisolasi sangat memungkinkan untuk menghindari efek kompensasi yang akan mengurangi efek mencapai separuhnya.
d. Metode organ terisolasi mempunyai kemampuan untuk mengukur efek sampai pada efek dengan intensitas maksimum. Hal ini tidak sepenuhnya dapat dilakukan ketika menggunakan organisme utuh, seperti efek konotropik negatif dari suatu obat tidak bisa dilanjutkan sampai pada efek maksimumnya, karena akan mengakibatkan berhentinya denyut jantung (cardiac arrest) pada organisme hidup sehingga hal ini tidak bisa dilakukan.
Beberapa kelemahan percobaan dengan organ terisolasi (Lullmann et al., 2000; Niemeyer & Bingham, 1972 ) :
a. Kerusakan jaringan selama pembedahan tidak dapat dihindarkan. b. Hilangnya regulasi fisiologis dari fungsi organ terisolasi.
c. Lingkungan fisiologis buatan tidak sepenuhnya sama dengan cairan fisiologis dalam tubuh, sehingga lama kelamaan akan berpengaruh buruk terhadap jaringan.
d. Tidak dapat digunakan pada penelitian yang membutuhkan waktu pengamatan yang relatif lama, sebagai contoh preparat paru-paru dalam alat organ terisolasi hanya mampu bertahan hidup selama 4 jam.
K. Metode In Silico Menggunakan Molecular Docking
Penelitian secara in silico dapat dilakukan dengan penambatan molekul atau
16
interaksi yang terjadi dari suatu kompleks molekul antara biomolekul dengan molekul kecil atau ligan. Interaksi kompleks molekul tersebut berorientasi untuk mencapai kestabilan. Tujuan dari molecular docking adalah pemodelan struktural secara akurat dan memprediksi aktivitasnya secara tepat (Kitchen, 2004). Terdapat dua aspek dalam molecular docking, yaitu fungsi scoring dan penggunaan algoritma. Algoritma docking berfungsi untuk mengidentifikasi energi yang dihasilkan dari konformasi molekular dan kemudian mencari konformasi yang memiliki energi bebas paling rendah dalam sistem. Penambatan molekuler juga digunakan untuk memperoleh nilai energi ikatan konformasi yang paling rendah dengan afinitas yang paling tinggi (Kroemer, 2007). Pada dasarnya cara kerja dari beberapa aplikasi tersebut digambarkan pada gambar 4.
Keterangan :
R : Reseptor
A : Ligan yang cocok dengan reseptor B : Ligan yang tidak cocok dengan reseptor
C : Ligan yang cocok dengan reseptor dalam konformasi yang lain √ : Ikatan ligan cocok dengan reseptor
X : Ikatan ligan tidak cocok dengan reseptor
~ : Ikatan ligan tidak begitu sempurna dengan reseptor
Ada banyak aplikasi yang umum digunakan untuk melakukan virtual screening dengan metode molecular docking, yaitu PLANTS (Protein-Ligand ANT System), MVD (Molegro Virtual Docking), dan AutoDock (Korb et al., 2006).
Autodock merupakan alat docking otomatis yang dirancang untuk memprediksi ikatan molekul berukuran kecil, seperti substrat atau obat (ligan) dengan struktur 3D biomolekuler (Morris, 2013).
Penelitian menggunakan metode in silico pernah dilakukan untuk mengidentifikasi ikatan senyawa-senyawa aktif dari Aegle marmelos C. terhadap reseptor histamin H1. Menurut penelitian tersebut, senyawa yang terdapat pada
tanaman Aegle marmelos C. berpotensi sebagai agen antihistamin melalui interaksi dengan residu protein Asp107, Lys179, Lys191, Asn198, dan Trp428
pada reseptor histamin H1 (Nugroho et al., 2013). L. Landasan Teori
18
histamin melalui penghambatan enzim phosphatidylinositol 4-kinase(s) yang merupakan komponen penting dalam proses menempelnya imunoglobulin E pada reseptor FcεR.
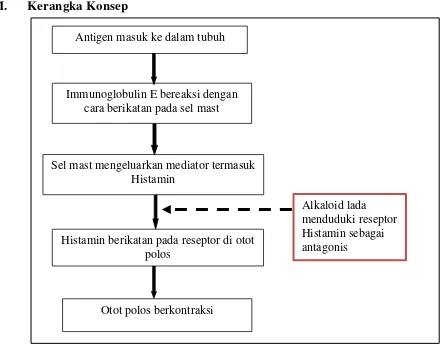
M. Kerangka Konsep
N. Hipotesis
1. Alkaloid lada mengandung senyawa piperin berdasarkan uji FTIR,
spektrofotometri UV-Vis dan uji titik lebur.
2. Alkaloid lada dapat memiliki efek antagonisme terhadap reseptor H1 pada
otot polos ileum marmut terisolasi yang diinduksi agonis histamin.
3. Alkaloid lada dapat bekerja sebagai antagonis kompetitif atau non kompetitif pada reseptor histamin H1.
Otot polos berkontraksi Antigen masuk ke dalam tubuh
Immunoglobulin E bereaksi dengan cara berikatan pada sel mast
Sel mast mengeluarkan mediator termasuk Histamin
Histamin berikatan pada reseptor di otot polos
Alkaloid lada menduduki reseptor Histamin sebagai antagonis
4. Semakin kecil skor docking suatu senyawa berarti semakin kecil energi yang dibutuhkan senyawa untuk berikatan dengan reseptor, maka semakin besar afinitas senyawa tersebut.
5. Piperin dapat berikatan pada residu protein reseptor histamin H1 yang
20
BAB III
METODE PENELITIAN
A. Desain Penelitian
Penelitian ini menggunakan desain penelitian eksperimental laboratorium dengan tema farmakologi molekuler.
B. Tempat Dan Waktu
Penelitian ini dilaksanakan di Laboratorium Penelitian dan Laboratorium Teknologi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Muhammadiyah Yogyakarta. Penelitian ini dilaksanakan pada bulan Februari – Maret 2016.
C. Populasi Dan Sampel
1. Kelompok ileum uji pelarut Dimetil Sulfoksida (DMSO) a. Kelompok uji seri kadar histamin.
b. Kelompok perlakuan (DMSO 100 µL+ seri kadar histamin). 2. Kelompok ileum uji antagonis histamin
a. Kelompok uji seri kadar histamin.
b. Kelompok perlakuan (alkaloid lada + seri kadar histamin). c. Kelompok reversibilitas.
3. Kelompok ileum uji pembanding (kontrol positif) a. Kelompok uji seri kadar histamin.
D. Identifikasi Variabel
1. Variabel Bebas
Konsentrasi alkaloid lada. 2. Variabel Kendali
Jenis kelamin, berat badan, umur, pakan, dan kondisi fisik marmut. 3. Variabel Tergantung
Respon kontraksi otot polos ileum.
E. Alat Dan Bahan
1. Bahan
22
2. Alat
Alat yang digunakan meliputi satu set alat untuk preparasi organ, pengaduk magnet thermostat (Cimarec®), dua set organ bath volume 20 mL (Ugo Basile®), bridge amplifier tipe 336, mikropipet (Socorex®), labu takar (Pyrex®), tabung reaksi (Pyrex®), beker glass (Pyrex®), satu set alat sokhletasi, Rotary Evaporator (IKA®RV10), timbangan analitik (Mettler Toledo®), pengaduk, corong, cawan porselin, penggaris, pipa kapiler, pipet ukur, pipet tetes, kertas saring (Whatman 40), aluminium foil (Brand), plat silika gel 60 GF254 (Merck®), Spektroskopi FTIR 8201PC (Shimadzu®),
Spektrofotometer Uv-Vis mini-1240 (Shimadzu®), komputer yang terinstal software molecular docking Autodock dan LabScribe2.
F. Prosedur Kerja Dan Alur Penelitian
1. Uji identifikasi kristal alkaloid lada menggunakan KLT
Kristal alkaloid lada dilarutkan dengan metanol untuk selanjutnya ditotolkan pada plat Silika dengan fase gerak BAW (4:1:5). Pembanding menggunakan kinin sulfat yang dilarutkan dengan metanol dan ditotolkan pada sisi sebelah kanan tempat penotolan alkaloid lada. Bercak selanjutnya diamati dengan sinar UV 254 nm, UV 366 nm dan pereaksi dragendorff.
2. Identifikasi piperin pada kristal alkaloid lada menggunakan FTIR
3. Identifikasi piperin pada alkaloid lada dengan spektrofotometri UV-Vis Sebanyak 10 mg kristal dilarutkan dalam 10 ml methanol kemudian diencerkan hingga konsentrasi 10µg/ml. Selanjutnya dimasukan ke dalam kuvet dan dianalisis menggunakan spektrofotometer UV-Vis.
4. Identifikasi kemurnian kristal alkaloid lada dengan uji titik lebur
Sampel diletakan pada pipa kapiler pada termometer dan mikroskop diatur hingga sampel tampak jelas. Auto thermal controller diatur pada temperatur yang lebih tinggi dari titik lebur senyawa uji. Alat pengontrol diatur dengan kenaikan temperatur mula-mula kecepatan 5oC/menit, ketika mendekati titik lebur senyawa uji, kecepatan diturunkan menjadi 2oC/menit. Temperatur dicatat saat kristal mulai meleleh hingga semua kristal meleleh.
5. Penyiapan larutan buffer tyrode
Larutan buffer tyrode terdiri atas dua macam larutan, yaitu larutan A dan B. Bahan-bahan larutan A masing-masing ditimbang kemudian dimasukkan ke dalam labu takar, dan dilarutkan dengan akuades hingga volume 1 L . Bahan larutan B ditimbang, kemudian dimasukkan ke labu takar, dan dilarutkan dengan akuades hingga volume 1 L (Tabel1).
. Tabel 1. Komposisi buffer tyrode
Komposisi larutan A Komposisi larutan B
Bahan Jumlah Bahan Jumlah
NaCl 80,0 g NaHCO3 10 g
KCL 2,00 g
MgCl2.6H2O 2,14 g
CaCl2.2H2O 2,64 g
24
Cara membuat larutan buffer tyrode adalah dengan mencampur antara 100 ml larutan A, 100 ml larutan B, 100 gram glukosa, kemudian ditambahkan 800 ml akuades (Anonim, 1986).
6. Penyiapan larutan alkaloid lada (1000 µM dan 5000 µM)
Larutan alkaloid lada dibuat dalam bentuk stok alkaloid lada konsentrasi 2x10-1 M. Alkaloid lada (menggunakan BM piperin : 285,33766 g/mol) ditimbang seberat 285 mg dan dilarutkan ke dalam 5,0 mL DMSO. Selanjutnya larutan alkaloid lada 2x10-1 M ditambahkan sebanyak 100 µL dan 500 µL ke dalam organ bath yang telah berisi organ ileum dan larutan buffer tyrode 20,0 mL untuk mencapai senyawa alkaloid lada konsentrasi 1000 µM dan 5000 µM.
7. Pembuatan larutan histamin
Larutan histamin dibuat dalam bentuk stok histamin konsentrasi 2x10-1 M dalam akuades (BM Histamin : 184,1 g/mol). Pengenceran larutan stok histamin dilakukan dengan cara pengenceran bertingkat dari larutan stok histamin 2x10-1 M, sehingga diperoleh larutan histamin konsentrasi 2x10-2, 2x10-3, 2x10-4, 2x10-5, 2x10-6, 2x10-7 dan 2x10-8 M. Pemberian seri konsentrasi agonis dapat dilihat pada Tabel 2. Konsentrasi histamin sebesar 10-10 diperoleh dengan cara menginjeksikan 100 μL larutan stok histamin 2x10-8 M ke dalam
organ bath yang berisi larutan buffer tyrode 20,0 mL.
[Histamin] =
8. Pembuatan larutan difenhidramin (1x10-8 M dan 5x10-6 M)
Larutan stok dibuat konsentrasi 2x10-2 M. Kemudian dilakukan pengenceran bertingkat hingga konsentrasi larutan difenhidramin 2x10-6 M. Larutan dengan konsentrasi 0,01 µM dan 0,05 µM didapatkan dengan mengambil larutan difenhidramin 2x10-6 M sebanyak 100 µL dan 500 µL kemudian dimasukkan ke dalam organ bath yang berisi 20 mL larutan buffer tyrode.
9. Preparasi organ ileum
Marmut jantan dikorbankan dengan cara dislokasi tulang belakang kepala (cervical) dan dilakukan pembedahan pada bagian abdomen, kemudian bagian ileum dipisahkan. Ileum diambil dari bagian perut sepanjang 2 cm. Ileum yang telah diambil diletakkan di cawan fiksasi dan diisi dengan larutan
buffer tyrode, kemudian dibersihkan dari isi usus dan jaringan-jaringan (lemak) yang masih menempel. Pada kedua ujung usus ini kemudian diikat dengan benang. Ujung bagian bawah benang diikatkan pada tuas organ bath dan ujung bagian atas ileum diikatkan pada transduser. Organ bath dikondisikan terlebih dahulu pada suhu 37˚C.
10. Uji aktivitas alkaloid lada terhadap agonis reseptor fisiologis
26
dalam dua tahap dimana antara pengukuran pertama dan kedua dilakukan pencucian organ selama 30 menit dengan penggantian larutan buffer tyrode
setiap 5 menit. Kontraksi diukur secara bertingkat dengan pemberian seri konsentrasi agonis ke dalam organ bath dan respon kontraksi yang terjadi akan tercatat pada rekorder. Pemberian agonis dilakukan sampai dicapai kontraksi maksimum (100%). Pada pengukuran kontraksi kedua, setelah dilakukan pencucian organ dan kondisi organ telah stabil, dilakukan pemberian alkaloid lada konsentrasi 1000 µL dan 5000 µL. Selanjutnya, diberikan agonis ke dalam organ bath seperti pada pengukuran pertama.
Tabel 2. Cara pemberian dosis agonis histamin
11. Uji in silico
a. Instalasi Sistem Operasi Linux dan Aplikasi Pendukung
Instalasi sistem operasi Linux dilakukan karena aplikasi yang dibutuhkan untuk melakukan penambatan molekul pada umumnya hanya dapat dioperasikan pada Linux. Sistem operasi yang diinstal adalah Linux Ubuntu 12.04 LTS 64-bit. Setelah instalasi Linux, dilakukan instalasi aplikasi pendukung seperti Marvin Sketch untuk preparasi ligan atau senyawa yang akan diuji, AutoDockTools 4.2 untuk melakukan penambatan molekul, dan DS Visualizer untuk preparasi protein dan visualisasi hasil docking dalam bentuk virtual 3D.
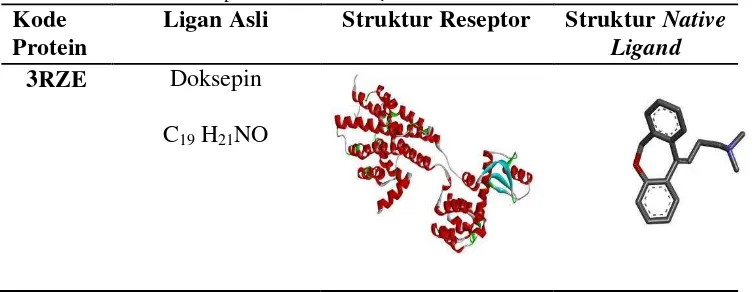
b. Penyiapan Protein Target dalam format PDBQT
Protein yang akan digunakan sebagai reseptor uji diunduh dari situs resmi protein data bank (www.rscb.org) dalam format “.pdb”. Berkas
protein / reseptor yang digunakan adalah reseptor Histamine H1 dengan
kode protein 3RZE.
Tabel 3. Kode dan struktur protein Histamin H1
Kode Protein
Ligan Asli Struktur Reseptor Struktur Native Ligand
3RZE Doksepin
28
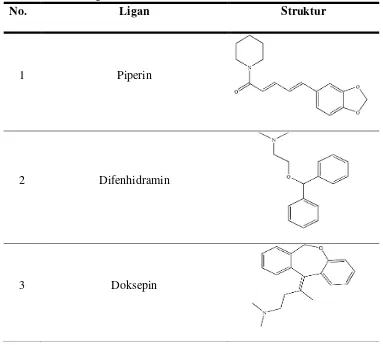
c. Preparasi Ligan dalam Format PDBQT
Ligan yang digunakan dalam uji ini adalah senyawa piperin, doksepin (ligan asli) dan difenhidramin. Data ligan diunduh melalui
major ligand data base seperti Pub Chem
(http://pubchem.ncbi.nlm.nih.gov/) dan dipilih dalam bentuk 3D SDF.
File ligan tersebut dibuka melalui aplikasi Discovery Studio Visualizer
dan disimpan dalam format PDB (*.pdb).
Tabel 4. Visualisasi Ligan
No. Ligan Struktur
1 Piperin
2 Difenhidramin
d. Preparasi Ligan dan Protein Target dalam Format PDBQT
Langkah ini berfungsi untuk mempersiapkan kebutuhan docking
yang meliputi ligan dan protein target dalam format PDBQT. Hasil preparasi protein dilakukan preparasi lebih lanjut dengan aplikasi
AutoDockTools dengan menambahkan atom hidrogen polar yang berfungsi untuk memberikan muatan parsial (partial charges) dalam protein target tersebut. Selain itu target protein perlu ditambahkan muatan melalui pilihan Kollman Charges dan disimpan dalam format *.pdbqt.
Setelah dilakukan preparasi protein target selanjutnya dilakukan
input ligan melalui perintah Open Ligand pada aplikasi AutoDockTools. Ligan yang telah masuk ke dalam protein target kemudian dilakukan preparasi dalam hal Torsion Free dan Aromatic Carbons dan disimpan dalam format *.pdbqt.
e. Preparasi Grid Parameter File
Proses ini merupakan proses lanjutan dari langkah sebelumnya. Aplikasi AutoDock Tools yang masih terbuka kemudian dipilih bagian
Grid dan dipilih ligan melalui fungsi Set Map Types dan dilanjutkan penyiapan Grid Box. Grid Box merupakan penentuan area untuk simulasi
docking. Kemudian hasil grid disimpan dalam format grid parameter file
30
f. Preparasi Docking Parameter File
Proses ini diawali dengan memilih protein target dan ligan melalui pilihan docking pada aplikasi AutoDock Tools. Proses docking dapat dilakukan pengaturan melalui perintah Search Parameters dan Docking Parameters. Selanjutnya pada bagian output dipilih Lamarckian Genetic Algorithm dan disimpan dalam format docking parameter file (*.dpf). g. Simulasi Docking
Proses docking dilakukan dengan menggunakan Auto Grid 4.2 dan
AutoDock 4.2 melalui Cygwin Terminal. File hasil preparasi sebelumnya yang meliputi Target.pdbqt, Ligand.pdbqt, parameter file (*.gpf), dan
docking parameter file (*.dpf) disimpan dalam 1 folder pada Cygwin Terminal. Hasil simulasi docking ini berupa file dengan format *.dlg yang berisi informasi 10 konformasi dan file complex.pdb untuk kebutuhan visualisasi hasil.
h. Visualisasi Hasil Docking
Setelah didapatkan skor penambatan yang terbaik dari beberapa konformasi, dilakukan visualisasi dengan menggunakan aplikasi DS
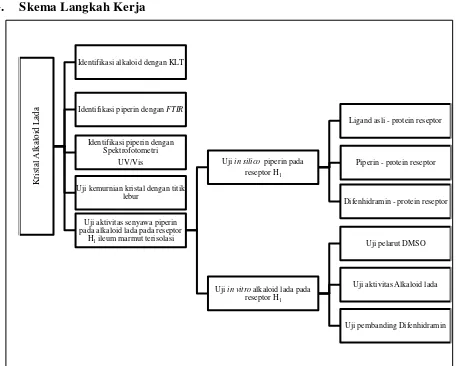
G. Skema Langkah Kerja
Gambar 1. Skema langkah kerja
H. Data Dan Analisis Data
1. Identifikasi kristal alkaloid lada dengan KLT
Hasil KLT yang diperoleh dilihat dibawah sinar tampak, UV 254 nm, UV 366 nm dan disemprotkan dengan pereaksi dragendorff.
2. Identifikasi piperin pada kristal alkaloid lada dengan FTIR
Hasil yang diperoleh adalah berupa spektra serapan. Spektra serapan yang diperoleh kemudian dianalisis dengan melihat pada data daerah gugus fungsi alkaloid lada dengan standar serapan IR pada acuan.
Krista
Identifikasi piperin dengan FTIR
Identifikasi piperin dengan Spektrofotometri
UV/Vis
Uji kemurnian kristal dengan titik lebur
Uji aktivitas senyawa piperin pada alkaloid lada pada reseptor
H1 ileum marmut terisolasi
Uji in silico piperin pada reseptor H1
Ligand asli - protein reseptor
32
3. Identifikasi piperin pada kristal alkaloid dengan spektrofotometer UV-Vis
Hasil yang diperoleh adalah berupa spektra panjang gelombang maksimum. Panjang gelombang yang diperoleh dibandingkan dengan spektra panjang gelombang maksimum dari acuan.
4. Identifikasi kemurnian kristal alkaloid lada dengan uji titik lebur
Hasil yang diperoleh adalah berupa rentang temperatur dari pertama kali kristal dari meleleh hingga kristal tersebut meleleh seluruhnya. Kristal solid yang murni memiliki rentang titik lebur yang sempit yaitu 1-2oC
5. Uji In Vitro alkaloid lada pada reseptor H1
a. Data
Data yang diperoleh dalam penelitian in vitro berupa data kontraksi atau relaksasi otot polos trakea pada rekorder. Data tersebut diubah menjadi data persentase (%) respon terhadap respon maksimum yang dicapai oleh agonis. Selanjutnya, data % respon dibuat kurva hubungan antara logaritma konsentrasi agonis terhadap % respon.
b. Analisis Data
Nilai EC50 (konsentrasi agonis yang dapat menghasilkan respon
sebesar 50% dari respon maksimum) agonis reseptor, dengan atau tanpa pengaruh alkaloid lada dihitung berdasarkan kurva hubungan konsentrasi terhadap % respon. EC50 dihitung berdasarkan Persamaan 1. Nilai EC50 ini
tabel kelompok perlakuan agonis (dengan atau tanpa pengaruh Alkaloid lada) dan nilai rata-rata pD2 agonis ± Standard Error (pD2 ± SE). Pergeseran nilai pD2 dianalisis secara statistik dengan menggunakan uji t berpasangan.
[ ]+ ……….. (1)
Keterangan :
X1 : Log. konsentrasi dengan respon tepat di bawah 50% X2 : Log. konsentrasi dengan respon tepat di atas 50% Y1 : % respon tepat di bawah 50%
Y2 : % respon tepat di atas 50% pD2 = -Log. EC50………. (2)
Alkaloid lada ditetapkan sebagai antagonis reseptor H1 apabila
inkubasi otot polos ileum marmut terisolasi dengan alkaloid lada mengakibatkan penurunan nilai pD2 histamin. Distribusi data pD2 histamin dianalisis dengan menggunakan uji normalitas (metode Shapiro-Wilk). Penurunan nilai pD2 selanjutnya dianalisis dengan metode statistik parametrik, yaitu menggunakan uji one-way ANOVA yang dilanjutkan dengan uji LSD pada taraf kepercayaan 95%.
Determinasi tipe antagonis ditunjukkan menggunakan analisis
34
menjauhi angka satu, maka tipe antagonis alkaloid lada adalah sebagai antagonis non-kompetitif. Harga pA2 (afinitas sebagai antagonis reseptor)
merupakan nilai intersep dari persamaan Schild-Plot yang terbentuk (Janković et al., 1999).
6. Uji in silico (Molecular Docking)
35
BAB IV
HASIL DAN PEMBAHASAN
A. Ekstraksi Kristal Alkaloid Lada
Langkah awal penelitian adalah ekstraksi alkaloid lada menggunakan metode sokhletasi dengan pelarut etilasetat. Pelarut etilasetat merupakan pelarut semipolar dimana berdasarkan tabel solvent miscibility, etilasetat memiliki indeks polaritas 4,4 sehingga diharapkan alkaloid lada yang merupakan senyawa alkaloid piperin yang bersifat semi polar dapat ditarik. Nilai indeks polaritas etilasetat tidak jauh berbeda dengan nilai indeks polaritas 3 pelarut yang digunakan dalam penelitian Shingate et al. (2013) sehingga etilasetat dapat digunakan sebagai pelarut untuk mengekstraksi alkaloid lada. Hasil sokhletasi akan mengendap membentuk kristal yang selanjutnya dicuci menggunakan etanol 96%. Hasil pencucian kristal dapat dilihat pada Gambar 7.
36
1. Uji identifikasi kandungan Alkaloid lada
Analisis dengan KLT digunakan untuk mengidentifikasi kandungan alkaloid lada dalam kristal yang diperoleh. Fase gerak yang digunakan adalah BAW (4:1:5) dan fase diam yang digunakan adalah plat silika gel 60 GF254
yang bersifat polar (Gandjar & Abdul Rohman, 2007). Plat KLT dibuat dengan panjang 10 cm dengan jarak elusidasi 8 cm. Deteksi bercak dilakukan dengan sinar tampak, sinar UV 254 dan UV 366 sebelum dan sesudah disemprot pereaksi dragendorff. Pada fase gerak BAW (n-butanol : asam asetat : air = 4 :1:5), bercak alkaloid berada di atas (Rf= 0,82) sedangkan senyawa pembanding alkaloid kinin sulfat berada di tengah (Rf=0,50). Senyawa yang mempunyai Rf lebih besar berarti mempunyai kepolaran yang lebih rendah, begitu juga sebaliknya. Hal tersebut dikarenakan fase diam bersifat polar. Senyawa yang lebih polar akan tertahan kuat pada fase diam, sehingga menghasilkan nilai Rf yang lebih rendah. Kinin sulfat yang digunakan sebagai pembanding berbentuk garam sehingga bersifat lebih polar dan tertahan pada fase diam dibandingkan alkaloid dalam bentuk bebas.
Selanjutnya dilakukan deteksi alkaloid melalui penampakan bercak menggunakan pereaksi dragendorff. Hasil penampakan bercak pada cahaya tampak dapat dilihat pada Gambar 9. Uji dengan pereaksi dragendorff
A B C
Pada uji alkaloid dengan pereaksi dragendorff, nitrogen membe
A B C
Gambar 2. Uji identifikasi KLT senyawa alkaloid lada sebelum disemprot dragendorff. Keterangan: (A) sinar tampak, (B) sinar UV 254, (C) sinar UV 366, (P) pembanding menggunakan kinin sulfat (Rf=0,5), (S) Alkaloid lada (Rf=0,82)
P S P S
8cm
P S
Gambar 3. Uji identifikasi KLT senyawa alkaloid lada setelah disemprot pereaksi
dragendorff. Keterangan: (A) sinar tampak, (B) sinar UV 254, (C) sinar UV 366. (P) pembanding menggunakan kinin sulfat (Rf=0,5), (S) Alkaloid lada (Rf=0,82)
P S
P S P S
38
Tabel 1. Hasil identifikasi senyawa pada plat KLT
Senyawa
Pada uji alkaloid dengan pereaksi dragendorff, nitrogen membentuk ikatan kovalen koordinat dengan K+ yang merupakan ion logam sehingga terbentuk endapan coklat muda sampai kuning (Marliana et al., 2005) sedangkan pada plat KLT terbentuk bercak coklat muda sampai kuning. Reaksi antara alkaloid lada dengan pereaksi dragendorff dapat dilihat pada Gambar 10.
2. Uji FTIR piperin pada kristal alkaloid lada
Uji FTIR bertujuan untuk mengidentifikasi kandungan piperin pada kristal alkaloid lada berdasarkan serapan inframerah gugus fungsinya. Hasil
FTIR dapat dilihat pada gambar 11.
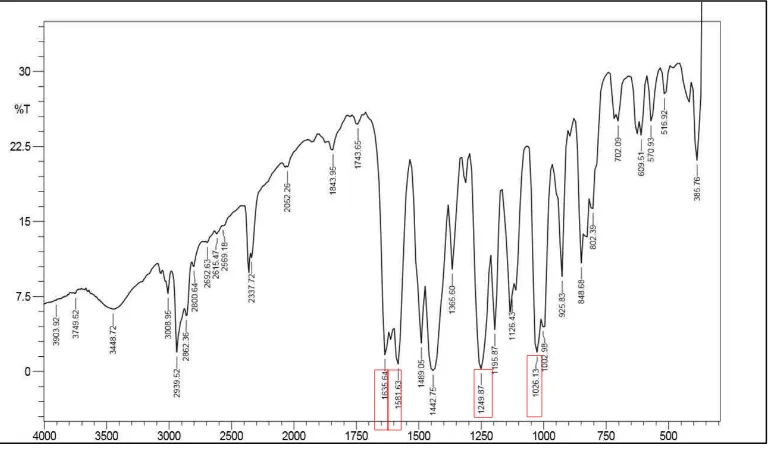
Senyawa piperin merupakan senyawa turunan piperidin yang terdiri dari cincin benzodioxol dan amina tersier alisiklik yang dihubungkan oleh karbonil terkonjugasi α, β, , . Gugus ikatan C=C aromatik pada cincin benzodioxol muncul pada bilangan gelombang 1581,63 cm-1. Selain itu gugus C-O-C asimetrik dan simetrik muncul pada bilangan gelombang 1249,87 cm-1 dan 1026,13 cm-1.Pada spektra serapan yang diperoleh juga memperlihatkan pita absorpsi pada daerah 1635,64 cm-1 yang merupakan pita absorbsi karbonil keton. Keton dalam keadaan normal akan muncul pada daerah 1715 cm-1 (Silverstein et al., 2005). Adanya efek resonansi ikatan α, β unsaturated pada gugus karbonil memunculkan karakteristik menyerupai ikatan tunggal sehingga menggeser absorpsi ke daerah gelombang yang lebih pendek (Pavia et al., 2000). Data spektrum IR tersebut menunjukan bahwa kristal alkaloid yang diperoleh memiliki kesesuaian gugus fungsi senyawa piperin. Namun, terdapat serapan khas gugus N-H pada daerah gelombang 3448,72 cm-1 (Silverstein et
40
al., 2005). Hal tersebut dapat mengindikasikan bahwa kristal alkaloid yang diperoleh masih belum 100% murni mengandung piperin saja.
2. Uji Spektrofotometer UV kristal alkaloid lada
Uji spektrofotometer UV dilakukan untuk mengidentifikasi spektra panjang gelombang maksimum kristal yang diperoleh. Spektra panjang gelombang maksimum yang diperoleh akan dibandingkan dengan spektra panjang gelombang maksimum piperin yaitu 342,5 nm (Vishnath et al., 2011). Hasil uji spektrofotometer UV dapat dilihat pada Gambar 12.
Hasil uji spektrofotometer menunjukkan hasil panjang gelombang maksimal kristal alkaloid lada berada pada = γ4β,5 nm. Hasil tersebut sama dengan panjang gelombang maksimal pada acuan. Selain itu, hasil uji spektrofotometer UV-Vis senyawa alkaloid dalam pelarut metanol (c= 0,001 %, b=1cm) menunjukan 1 pita absorpsi dengan panjang gelombang maksimum 342,5 nm (ε= 30.675,125). Perhitungan absortivitas molar dapat dilihat pada Lampiran 4. Spektrum UV-Vis kristal alkaloid yang diperoleh memperlihatkan 1 pita absorpsi yang menunjukan bahwa hanya terdapat 1 sistem kromofor. Hasil tersebut sesuai dengan struktur piperin yang memiliki satu sistem
kromofor. Sistem kromofor piperin dapat dilihat pada Gambar 13. Konjugasi gugus enon memiliki nilai absortivitas >10.000 (Pavia et al, 2000). Nilai absortivitas (ε) alkaloid lada adalah >10.000 sehingga sistem kromofor yang
terdapat pada struktur piperin termasuk dalam gugus enon.
Gambar 7. Gugus kromofor piperin
Spektra panjang gelombang gugus enon dapat diprediksi dengan menghitung total panjang gelombang berdasarkan Empiric Rules for enon
(Pavia et al., 2000). Total panjang gelombang gugus enon berdasarkan Empiric Rules for enon adalah 345 nm. Perhitungan panjang gelombang dengan berdasarkan Empiric Rules for enon dapat dilihat pada Lampiran 5.
4. Uji Titik Lebur kristal alkaloid lada
42
konsistensi dan bentuk ikatan kristal pada level molekuler. Gangguan tersebut melemahkan struktur ikatan yang menyebabkan ikatan lebih mudah terurai pada saat diberikan energi (panas). Hal tersebut menyebabkan batas bawah temperatur turun dan rentang temperatur menjadi melebar.
B. Uji In Vitro Aktivitas Alkaloid Lada
Piperin merupakan senyawa golongan alkaloid yang diketahui memiliki efek menghambat degranulasi pada kultur sel mast melalui penghambatan
phosphatidylinositol 4-kinase (Bojjireddy et al., 2014). Selain itu, pengujian campuran ekstrak herbal mengandung Piper nigrum L. menunjukkan efek bronkodilatasi pada tikus yang diinduksi ovalbumin (Antony, 2010). Ada kemungkinan piperin juga memiliki mekanisme spasmolitik dengan jalan menghambat aktivasi dari reseptor H1. Oleh karena itu penelitian ini dilakukan
untuk membuktikan aktivitas antagonis alkaloid lada pada reseptor H1.
Mekanisme terjadinya kontraksi oleh histamin ketika berinteraksi dengan reseptor H1 ileum adalah melalui rangsangan pada reseptor H1 yang terhubung
pada protein G atau disebut dengan G-protein-coupled Receptor (GPCR) melalui jalur fosfolipase C (PLC). Selanjutnya PLC yang telah teraktivasi akan mengkatalis reaksi hidrolisis fosfoinositol 4,5-difosfat (PIP2), membentuk inositol
1,4,5-trifosfat (IP3) dan diasil gliserol (DAG). IP3 yang telah terbentuk akan
berikatan dengan reseptor IP3 pada permukaan retikulum endoplasma dan
di permukaan membran sel (Sanders, 2001). Dengan aktifnya kanal kalsium menyebabkan influks Ca2+ ekstraseluler dan secara keseluruhan akan meningkatkan kadar Ca2+ instaseluler yang menginduksi terjadinya kontraksi otot polos (Gosens et al., 2006).
Mekanisme Peningkatan kadar Ca2+ intraseluler yang berasal dari aktivasi
GPCR atau kanal ion dapat meyebabkan kontraksi pada otot polos adalah dengan cara Ca2+ berikatan dengan reseptor calmodulin (CaM). Calmodulin merupakan suatu protein pengikat Ca yang tidak memiliki aktivitas enzim. Calmodulin akan bekerja setelah membentuk kompleks dengan Ca2+/calmodulin. Selanjutnya kompleks tersebut mengaktifkan myosin light-chain kinase (MLCK) yang akan memfosforilasi myosin. Myosin yang terfosforilasi akan berinteraksi dengan filamen aktin sehingga terjadi kontraksi (Lodish, 2000). Alkaloid lada dapat dikatakan memiliki aktivitas sebagai antagonis reseptor H1 apabila dapat
mengurangi potensi histamin dalam menginduksi kontraksi otot polos ileum marmut terisolasi.
1. Uji Pendahuluan Pengaruh DMSO Terhadap Kontraksi Otot Polos Ileum Uji in vitro bertujuan untuk mengetahui aktivitas senyawa piperin pada alkaloid lada yang diduga memiliki efek sebagai antagonis reseptor H1.
44
oleh alkaloid lada saja. DMSO yang digunakan adalah sebesar 100 µL sesuai dengan volume pemberian alkaloid lada pada organ bath.
Gambar 8. Pengaruh DMSO terhadap respon kontraksi otot polos ileum yang diinduksi histamin. Kurva hubungan konsentrasi histamin terhadap respon kontraksi otot polos ileum,
dengan atau tanpa pengaruh DεSO 100 δ (n=5, rata-rata ± SEM).
Hasil uji menunjukkan adanya sedikit pergeseran pada kurva (Gambar 14) disertai dengan penurunan nilai pD2 DMSO (Tabel 6). Namun berdasarkan uji statistik menggunakan paired t-test penurunan tersebut tidak berbeda secara signifikan (p>0,005). Oleh karena itu, DMSO tidak memiliki efek menurunkan kontraksi secara signifikan sehingga dapat digunakan sebagai pelarut alkaloid lada.
Tabel 2. Nilai rata-rata pDβ histamin karena pengaruh DεSO 100 δ (n=5, rata-rata ± SEM).
Keterangan : Berdasarkan uji signifikansi menggunakan paired t-test dengan kepercayaan 95 %,
2. Uji Pembanding Menggunakan Difenhidramin (Kontrol Positif)
Reseptor H1 telah teridentifikasi pada vetebrata dan diketahui banyak
terdistribusi pada permukaan otot polos ileum marmut. Aktivasi reseptor H1
oleh histamin akan mengakibatkan kontraksi otot polos baik di ileum manusia maupun marmut.
Uji pembanding dilakukan menggunakan difenhidramin dengan metode yang sama persis dengan perlakuan menggunakan alkaloid lada. Difenhidramin merupakan antagonis reseptor H1 generasi pertama dengan efek
sedatif dan anti alergi. Difenhidramin secara kompetitif menghambat reseptor H1. Biasanya digunakan untuk gejala-gejala yang diakibatkan histamin
endogen pada bronkus, pembuluh darah dan otot polos pencernaan. Tujuan dilakukannya uji difenhidramin sebagai pembanding adalah untuk melihat apakah alkaloid lada bisa berefek sama dengan difenhidramin sebagai obat antihistamin. Selain itu juga untuk memastikan metode yang digunakan valid
46
Gambar 9. Kurva hubungan logaritma konsentrasi histamin terhadap % respon kontraksi otot polos ileum marmut terisolasi, baik tanpa atau dengan pemberian
difenhidramin 0,01 dan 0,05 ε. Persentase respon kontraksi 100 % diukur berdasarkan kontraksi maksimal yang dicapai oleh seri konsentrasi histamin (kontrol). Persentase respon kontraksi disajikan dalam bentuk rata-rata ± SEM (n
= 5 – 10)
Hasil menunjukkan uji difenhidramin memberikan efek relaksasi dilihat dari pergeseran kurva ke arah kanan (Gambar 15) dan penurunan nilai pD2 (Tabel 7). Bentuk kurva menunjukkan respon kontraksi (Emax) agonis yang kembali mencapai 100% setelah diberi perlakuan dengan antagonis histamin. Posisi antagonis kompetitif yang menduduki sisi aktif yang sama pada reseptor dapat digeser dengan penambahan konsentrasi agonis sehingga EC50 dapat tercapai dengan penambahan konsentrasi agonis yang lebih besar
dan respon maksimal (Emax) dapat kembali 100% seperti sebelum diberikan antagois. Hal tersebut menunjukkan bahwa difenhidramin merupakan antagonis kompetitif terhadap reseptor H1.
Gambar 10. Kurva Schild-Plot perhitungan parameter antagonis (pA2) difenhidramin terhadap reseptor H1. Sebagai sumbu x adalah nilai logaritma konsentrasi difenhidramin (Log
ε) dan sumbu y adalah nilai logaritma ((A’/A)-1), dimana A adalah nilai D50
histamin tanpa pemberian difenhidramin dan A’ adalah nilai D50 histamin dengan
pemberian difenhidramin.
Selain itu, jenis antagonis juga dapat dipastikan melalui analisa
Schild-Plot (Gambar 16). Dari analisis ini didapatkan persamaan Schild-Plot y = 0,7542x + 1,7281. Nilai slope persamaan Schild-Plot adalah sebesar 0,7542 (mendekati angka 1,00) dan intersep (nilai pA2) sebesar 1,7281. Nilai pA2 (parameter afinitas) menunjukan kadar antagonis yang dapat menyebabkan agonis dilipatkan kadarnya menjadi 2 kali untuk mendapatkan efek yang sama dengan efek sebelum diberikan antagonis. Dari uji difenhidramin dapat disimpulkan bahwa difenhidramin bertindak sebagai antagonis kompetitif terhadap reseptor H1.
48
Tabel 3. Pergeseran nilai pDβ histamin karena pengaruh difenhidramin 0,01 dan 0,05 ε.
No Kelompok Perlakuan pD2 Emaks (%)
1 Kontrol Histamin 6,10± 0,16 100 ± 0,00 2 Difenhidramin 0,01 µM 5,67± 0,09 100 ± 0,00 3 Difenhidramin 0,05 µM 5,15± 0,23* 100 ± 0,00
Keterangan : Nilai pD2 disajikan dalam bentuk rata-rata ± SEM (n = 5 – 10). Hasil menunjukkan
adanya perbedaan bermakna (p<0,05) terhadap nilai pD2 histamin/kontrol (*), setelah diuji dengan
ANOVA satu jalan, dilanjutkan dengan uji LSD pada taraf kepercayaan 95 %
3. Pengaruh Alkaloid Lada Terhadap Reseptor H1 Otot Polos Ileum
Pengaruh alkaloid lada terhadap reseptor H1 diuji dengan mengamati
perubahan profil kurva hubungan seri konsentrasi histamin dengan % respon kontraksi otot polos ileum terisolasi dalam media larutan buffer tyrode.
Piperin pada alkaloid lada diduga memiliki potensi sebagai antagonis reseptor H1. Potensi tersebut dapat diukur dengan membandingkan nilai pD2
histamin dengan dan tanpa praperlakuan alkaloid lada. Praperlakuan otot polos ileum dengan beberapa konsentrasi alkaloid lada harus dapat menurunkan nilai pD2 histamin. Selanjutnya, jika tipe antagonis adalah kompetitif maka nilai parameter antagonis (pA2) alkaloid lada terhadap reseptor H1 dapat
diidentifikasi dan diukur dengan menggunakan analisa Schild-Plot.
Histamin dapat memicu kontraksi setelah berikatan dengan reseptor H1 pada otot polos ileum. Pemberian konsentrasi bertingkat histamin eksogen