PENETAPAN KADAR BESI DAN KALSIUM DALAM KACANG HIJAU (Phaseolus radiatus L.) DENGAN DAN TANPA KULIT BIJI
YANG TERDAPAT DI PASARAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
LISDA RIMAYANI NST NIM 081501020
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENETAPAN KADAR BESI DAN KALSIUM DALAM KACANG HIJAU (Phaseolus radiatus L.) DENGAN DAN TANPA KULIT BIJI
YANG TERDAPAT DI PASARAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
LISDA RIMAYANI NST NIM 081501020
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR BESI DAN KALSIUM DALAM KACANG HIJAU (Phaseolus radiatus L.) DENGAN DAN TANPA KULIT BIJI
YANG TERDAPAT DI PASARAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
OLEH:
LISDA RIMAYANI NST NIM 081501020
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 10 April 2012
Pembimbing I, Panitia Penguji,
Drs. Chairul Azhar D, M.Sc., Apt. Dra. Nurmadjuzita, M.Si., Apt.
NIP 194907061980021001 NIP 194809041974122001
Pembimbing II, Drs. Chairul Azhar D, M.Sc., Apt. NIP 194907061980021001
Drs. Fathur Rahman Harun, M.Si., Apt. Dra. Sudarmi, M.Si.,Apt. NIP 195201041980031002 NIP 19540910198332001
Dra. Siti Nurbaya, M.Si., Apt. NIP 195008261974122001
Medan, Mei 2012 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Bismillahirrahmanirrahiim,
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan
rahmat dan karunianya, sehingga penulis dapat menyelesaikan penelitian dan
penyusunan skripsi ini, serta shalawat beriring salam untuk Rasulullah
Muhammad SAW sebagai suri tauladan dalam kehidupan. Skripsi ini disusun
untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas
Farmasi Universitas Sumatera Utara, dengan judul Penetapan Kadar Besi dan
Kalsium dalam Kacang Hijau (Phaseolus radiatus L.) dengan dan tanpa Kulit Biji
yang terdapat di Pasaran secara Spektrofotometri Serapan Atom.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada, Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Medan, yang telah yang
telah memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan.
Bapak Drs. Chairul Azhar Dalimunthe, M.Sc, Apt., dan Bapak Drs. Fathur
Rahman Harun, M.Si., Apt., yang telah membimbing dan memberikan petunjuk
serta saran-saran selama penelitian hingga selesainya skripsi ini. Ibu Dra.
Nurmadjuzita, M.Si., Apt., Ibu Dra. Sudarmi, M.Si., Apt., dan Ibu Dra. Siti
Nurbaya, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran
dan arahan kepada penulis dalam menyelesaikan skripsi ini. Bapak dan Ibu staf
pengajar Fakultas Farmasi USU Medan yang telah mendidik selama perkuliahan
yang selalu memberikan bimbingan, perhatian dan motivasi kepada penulis
selama masa perkuliahan.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada Ayahanda Mukhlis Nst, S.H., Ibunda (Almh) Seriannur Lubis
dan Ibunda Elliwati Hsb, M.Si., yang telah memberikan cinta dan kasih sayang
yang tidak ternilai dengan apapun, pengorbanan baik materi maupun motivasi
beserta doa yang tulus yang tidak pernah berhenti. Adik ku tercinta Ahmad
Dahlan Nst, Fauzan Alamsyah Nst dan seluruh keluarga yang selalu mendoakan
dan memberikan semangat.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis
menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis
berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 10 April 2012 Penulis,
PENETAPAN KADAR BESI DAN KALSIUM DALAM KACANG HIJAU (Phaseolus radiatus L.) DENGAN DAN TANPA KULIT BIJI
YANG TERDAPAT DI PASARAN SECARA SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Kacang hijau (Phaseolus radiatus L.) dianggap sebagai sumber bahan makanan padat gizi yang banyak dikonsumsi rakyat Indonesia. Menurut informasi, kacang hijau dapat dijadikan sebagai tambahan asupan dalam pencegahan anemia (kurang darah) dan osteoporosis (pengeroposan tulang) karena kandungan besi dan kalsium yang cukup tinggi di dalamnya. Di masyarakat dikenal dua bentuk kacang hijau yaitu kacang hijau utuh (dengan kulit biji) dan kacang hijau tanpa kulit biji. Tujuan penelitian ini adalah untuk menetapkan kadar besi dan kalsium dalam kacang hijau dengan kulit biji dan tanpa kulit biji yang terdapat di pasaran.
Penetapan kadar dilakukan menggunakan spektrofotometer serapan atom dengan nyala udara-asetilen. Analisis kuantitatif dilakukan pada panjang gelombang 248,3 nm untuk besi dan 422,7 nm untuk kalsium.
Hasil penelitian menunjukkan bahwa kadar besi dan kalsium yang diperoleh dengan kadar besi dan kalsium yang tercantum pada literatur berbeda. Hasil penelitian juga menunjukkan ada perbedaan kadar besi dan kalsium antara kacang hijau dengan kulit biji dan kacang hijau tanpa kulit biji. Kadar besi pada kacang hijau dengan kulit biji dan tanpa kulit biji berturut-turut yaitu (4,8533 ± 0,5835)mg/100g dan (3,5300 ± 0,2635)mg/100g. Kadar kalsium pada kacang hijau dengan kulit biji dan tanpa kulit biji berturut-turut yaitu (61,0591 ± 5,4910)mg/100g dan (6,8628 ± 0,0652)mg/100g.
DETERMINATION OF LEVELS IRON AND CALCIUM IN GREEN BEANS (Phaseolus radiatus L.) WITH AND WITHOUT SEED COAT ON THE MARKET BY ATOMIC ABSORPTION SPECTROPHOTOMETRY
ABSTRACT
Green beans (Phaseolus radiatus L.) is a solid food nutrient which is most consumpted by Indonesian’s people. Some informed that green beans can be food addition to prevent anemia and osteoporosis cause of its quite high iron and calcium content. Green beans with and without seed coat which is most famous in community. The aim of this research is to have a quantitative levels of iron and calcium in green beans with and without seed coat on the market.
Quantitative analysis was done by atomic absorption spectrophotometer with acetylene-air flame. Iron and calcium was quantitative analyzed at 248.3 nm and 422.7 nm wavelength.
The result of this study showed there are differences levels of iron and calcium found in green beans with level content in literature. The result of this study showed there are differences levels of iron and calcium between green beans with and without seed coat which is (4.8533 ± 0.5835)mg/100g and (3,5300 ± 0,2635)mg/100g. The calcium levels found in green beans with and without seed coat which is (61.0591 ± 5.4910)mg/100g and (6.8628 ± 0.0652)mg/100g.
Key words: Green beans (Phaseolus radiatus L), Iron (Fe), Calcium (Ca), Atomic Absorption Spectrophotometry
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Kacang Hijau ... 4
2.2 Mineral ... 5
2.2.1 Besi ... 6
2.2.2 Kalsium ... 7
2.3.1 Gangguan-gangguan pada Spektrofotometri
Serapan Atom ... 11
2.4 Validasi Metode Analisis ... 11
BAB III METODE PENELITIAN ... 14
3.1 Tempat dan Waktu Penelitian ... 14
3.2 Bahan-bahan ... 14
3.2.1 Sampel ... 14
3.2.2 Pereaksi ... 14
3.3 Alat-alat ... 14
3.4 Pembuatan Pereaksi ... 15
3.4.1 Larutan HNO3 (1:1) ... 15
3.4.2 Larutan H2SO4 1N ... 15
3.4.3 Larutan NH4SCN 1,5N ... 15
3.4.4 Larutan K4[Fe(CN)6] 2N ... 15
3.5 Prosedur Penelitian ... 15
3.5.1 Pengambilan Sampel ... 15
3.5.2 Penyiapan Sampel ... 16
3.5.3 Proses Destruksi ... 16
3.5.4 Pembuatan Larutan Sampel ... 16
3.5.5 Pemeriksaan Kualitatif ... 17
3.5.5.1 Besi ... 17
3.5.5.1.1 Reaksi Kualitatif dengan Larutan K4[Fe(CN)6] 2N ... 17
3.5.5.2 Kalsium ... 17
3.5.5.2.1 Uji Kristal Kalsium dengan Asam Sulfat 1N ... 17
3.5.6 Pemeriksaan Kuantitatif ... 17
3.5.6.1 Pembuatan Kurva Kalibrasi Besi ... 17
3.5.6.2 Pembuatan Kurva Kalibrasi Kalsium ... 18
3.5.6.3 Penetapan Kadar Besi dan Kalsium dalam Sampel ... 18
3.5.6.3.1 Penetapan Kadar Besi dalam Kacang Hijau dengan Kulit Biji... 18
3.5.6.3.2 Penetapan Kadar Besi dalam Kacang Hijau tanpa Kulit Biji ... 19
3.5.6.3.3 Penetapan Kadar Kalsium dalam Kacang Hijau dengan Kulit Biji ... 19
3.5.6.3.4 Penetapan Kadar Kalsium dalam Kacang Hijau tanpa Kulit Biji ... 19
3.5.7 Analisis Data Secara Statistik ... 20
3.5.7.1 Penolakan Hasil Pengamatan ... 20
3.5.7.2 Pengujian Beda Nilai Rata-rata Sampel Dengan Nilai yang Terdapat di dalam Literatur ... 21
3.5.7.3Pengujian Beda Nilai Rata-rata antar Sampel... 21
3.5.8 Uji Perolehan Kembali (Recovery) ... 22
3.5.9 Simpangan Baku Relatif ... 23
3.5.10 Penentuan Batas Deteksi (Limit of Detection) dan Kuantitasi (Limit of Quantitation) ... 24
BAB IV HASIL DAN PEMBAHASAN ... 25
4.2 Analisis Kuantitatif ... 26
4.2.1 Kurva Kalibrasi Besi dan Kalsium ... 26
4.2.2 Analisis Kadar Besi dan Kalsium dalam Kacang Hijau dengan Kulit Biji dan tanpa Kulit Biji ... 27
4.2.3 Uji Perolehan Kembali (Recovery) ... 30
4.2.4 Simpangan Baku Relatif ... 30
4.2.5 Batas Deteksi dan Batas Kuantitasi ... 31
BAB V KESIMPULAN DAN SARAN... 32
5.1 Kesimpulan ... 32
5.2 Saran ... 32
DAFTAR PUSTAKA ... 33
DAFTAR TABEL
Halaman
Tabel 1 Hasil Analisis Kualitatif ... 25
Tabel 2 Hasil Analisis Kadar Besi dan Kalsium
Dalam Sampel ... 28
Tabel 3 Hasil Uji Beda Nilai rata-rata Kadar Besi dan Kalsium
Pada Sampel dengan Nilai pada Literatur ... 29
Tabel 4 Hasil Uji Beda Nilai rata-rata Kadar Besi dan Kalsium
Antar Sampel ... 29
Tabel 5 Persen Uji Perolehan Kembali (recovery) Kadar Besi
DAFTAR GAMBAR
Halaman
Gambar 1 Kurva Kalibrasi Larutan Baku Besi ... 26
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar Kacang Hijau (Phaseolus radiatus L.) ... 35
Lampiran 2. Bagan Alir Proses Destruksi Kering ... 36
Lampiran 3. Bagan Alir Pembuatan Larutan Sampel ... 37
Lampiran 4. Hasil Analisis Kualitatif Besi
dan Kalsium ... 38
Lampiran 5. Data Kalibrasi Besi dengan Spektrofotometer
Serapan Atom, Perhitungan Persamaan Garis Regresi
dan Koefisien Korelasi (r) ... 40
Lampiran 6. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi
dan Koefisien Korelasi (r) ... 41
Lampiran 7. Hasil Analisis Kadar Besi dan Kalsium
dalam Sampel ... 42
Lampiran 8. Contoh Perhitungan Kadar Besi dan Kalsium
dalam Kacang Hijau dengan Kulit Biji ... 43
Lampiran 9. Perhitungan Statistik Kadar Besi dalam Sampel ... 44
Lampiran 10. Perhitungan Statistik Kadar Kalsium dalam Sampel ... 49
Lampiran 11. Pengujian Beda Nilai Rata-Rata Kadar Besi pada Sampel dengan Nilai yang Terdapat dalam Literatur ... 55
Lampiran 12. Pengujian Beda Nilai Rata-Rata Kadar Kalsium pada
Sampel dengan Nilai yang Terdapat dalam Literatur ... 57
Lampiran 13. Pengujian Beda Nilai Rata-Rata Kadar Besi pada
Sampel ... 59
Lampiran 14. Pengujian Beda Nilai Rata-Rata Kadar Kalsium pada
Setelah Penambahan Masing-masing Larutan Baku ... 63 Lampiran 16. Perhitungan Uji Perolehan Kembali Kadar Besi
dan Kalsium dalam Kacang Hijau dengan Kulit Biji ... 64 Lampiran 17. Perhitungan Simpangan Baku Relatif (RSD) Kadar Besi
dan Kalsium dalam Sampel ... 70 Lampiran 18. Perhitungan Batas Deteksi dan Batas Kuantitasi ... 72
Lampiran 19. Gambar Atomic Absorption Spectrophotometre
(AAS) Hitachi Z-2000 dan Tanur Nabertherm ... 74
Lampiran 20. Tabel Distribusi t ... 75
Lampiran 21. Tabel Distribusi F ... 76
BAB I PENDAHULUAN
1.1 Latar Belakang
Kacang hijau (Phaseolus radiatus L.) dianggap sebagai sumber bahan
makanan padat gizi yang banyak dikonsumsi rakyat Indonesia, seperti: bubur, isi
onde-onde, bakpia, es puter, dan sari kacang hijau. Kacang hijau mengandung
vitamin dan mineral. Mineral seperti kalsium, fosfor, besi, natrium dan kalium
banyak terdapat pada kacang hijau (Astawan, 2009).
Selain bisa dimanfaatkan sebagai bahan dasar makanan dan minuman,
kacang hijau juga berguna untuk kesehatan dan kecantikan kulit. Untuk kesehatan
kacang hijau bisa digunakan sebagai tambahan asupan dalam pencegahan kurang
darah (anemia) dan pengeroposan tulang (osteoporosis) (Anonim, 2009).
Di masyarakat dikenal dua bentuk kacang hijau yaitu kacang hijau utuh
(dengan kulit biji) dan kacang hijau tanpa kulit biji. Umumnya kacang hijau utuh
diolah menjadi bubur, sementara kacang hijau tanpa kulit biji diolah untuk
dijadikan isi kue.
Penyebab paling umum dari anemia adalah kekurangan besi untuk sintesa
hemoglobin (Tjay, 2007). Unsur besi yang tergolong mineral mikro merupakan
komponen utama dari hemoglobin (Hb), sehingga kekurangan besi dalam tubuh
akan mempengaruhi pembentukan hemoglobin (Hb).
Pencegahan anemia dapat dilakukan dengan meningkatkan konsumsi zat
yang terdapat di dalam kacang hijau (Rukmana, 1997) diyakini dapat memberikan
kontribusi terhadap pencegahan anemia.
Osteoporosis (pengeroposan tulang) adalah suatu penyakit yang
disebabkan oleh penurunan masa tulang akibat keseimbangan kalsium negatif di
dalam tubuh. Penyakit ini dapat dicegah dengan mengkonsumsi makanan yang
susunannya baik, antara lain banyak kalsium, sebelum usia 35-38 tahun (Tjay,
2007). Kandungan kalsium sebesar 125 mg/100 g yang terdapat di dalam kacang
hijau (Rukmana, 1997) diyakini dapat memberikan kontribusi terhadap
pencegahan osteoporosis.
Zat besi dapat ditetapkan kadarnya dengan beberapa cara antara lain:
metode spektrofotometri sinar tampak, metode titrasi dan metode spektrofotometri
serapan atom, sedangkan, kalsium dapat ditentukan antara lain dengan cara:
metode titrasi, metode gravimetri dan metode spektrofotometri serapan atom
(Bassett, dkk., 1994).
Berdasarkan uraian di atas, penulis tertarik untuk meneliti kandungan besi
dan kalsium yang terdapat pada kacang hijau dengan kulit biji dan tanpa kulit biji
yang dijual di pasar. Metode yang dipilih untuk penetapan kadar besi dan kalsium
adalah metode spektrofotometri serapan atom karena pelaksanaannya relatif
sederhana, mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm),
interferensinya sedikit (Rohman, 2009), jika dibandingkan dengan metode
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian ini dapat
dirumuskan sebagai berikut:
a. Apakah kadar besi dan kalsium pada kacang hijau sesuai dengan literatur?
b. Apakah terdapat perbedaan kadar besi dan kalsium pada kacang hijau
dengan kulit biji dan kacang hijau tanpa kulit biji?
1.3 Hipotesis
Hipotesis dalam penelitian ini adalah:
a. Kadar besi dan kalsium pada kacang hijau sesuai dengan literatur.
b. Terdapat perbedaan kadar besi dan kalsium pada kacang hijau dengan kulit
biji dan kacang hijau tanpa kulit biji.
1.4 Tujuan
Tujuan penelitian ini adalah:
a. Untuk mengetahui kesesuaian kadar besi dan kalsium pada kacang hijau
dengan kadar yang tercantum pada literatur.
b. Untuk mengetahui perbedaan kadar besi dan kalsium pada kacang hijau
dengan kulit biji dan kacang hijau tanpa kulit biji.
1.5 Manfaat
Untuk memberikan informasi kepada masyarakat perbedaan kandungan
kulit biji, sehingga masyarakat dapat memilih kacang hijau mana yang lebih baik
dikonsumsi untuk mencegah anemia dan osteoporosis .
BAB II
TINJAUAN PUSTAKA
2.1 Kacang Hijau
Kacang hijau dikenal dengan beberapa nama, seperti mungo, mung bean,
green bean dan mung. Di Indonesia, kacang hijau juga memiliki beberapa nama
daerah, seperti artak (Madura), kacang wilis (Bali), buwe (Flores), tibowang candi
(Makassar) (Astawan, 2009).
Tanaman kacang hijau termasuk suku (famili) Leguminosae yang banyak
varietasnya. Kedudukan tanaman kacang hijau dalam taksonomi tumbuhan
dikelasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Leguminales
Famili : Leguminosae
Genus : Phaseolus
Spesies : Phaseolus radiatus L. (Rukmana,1997).
Susunan tubuh tanaman (morfologi) kacang hijau terdiri atas akar, batang,
daun, bunga, buah, dan biji. Perakaran tanaman kacang hijau bercabang banyak
dan membentuk bintil-bintil (nodula) akar (Rukmana, 1997).
Batang tanaman kacang hijau berukuran kecil, berbulu, berwarna hijau
30 cm-110 cm dan bercabang menyebar ke semua arah. Daun tumbuh majemuk,
tiga helai anak daun per tangkai. Helai daun berbentuk oval dengan ujung lancip
dan berwarna hijau (Rukmana, 1997).
Bunga kacang hijau berkelamin sempurna (hermaphrodite), berbentuk
kupu-kupu, dan berwarna kuning. Buah berpolong, panjangnya antara 6 cm-15
cm. Tiap polong berisi 6-16 butir biji. Biji kacang hijau berbentuk bulat kecil
dengan bobot (berat) tiap butir 0,5 mg-0,8 mg atau per 1000 butir antara 36 g -78
g, berwarna hijau sampai hijau mengilap. Biji kacang hijau tersusun atas tiga
bagian, yaitu kulit biji, kotiledon, dan embrio (Rukmana, 1997).
Tanaman kacang hijau termasuk multiguna, yakni sebagai bahan pangan
(bijinya), pakan ternak (limbahnya), dan pupuk hijau (limbahnya). Dalam tatanan
makanan sehari-hari, kacang hijau dikonsumsi sebagai bubur , sayur (taoge), dan
kue-kue. Kacang hijau merupakan sumber gizi, terutama protein nabati.
Kandungan gizi kacang hijau cukup tinggi dan komposisinya lengkap.
Kandungan gizi dalam 100 g kacang hijau adalah 345,00 kalori energi; 22,00 g
protein; 1,20 g lemak; 62,90 g karbohidrat; 10,00 g air; 125,00 mg kalsium;
320,00 mg fosfor; 6,70 mg zat besi; 157,00 SI vitamin A; 0,64 mg vitamin B1;
6,00 mg vitamin C (Rukmana, 1997); 6 mg natrium; 1132 mg kalium; 4,4 g serat
(Duke, 1981).
2.2 Mineral
Mineral merupakan bagian dari tubuh dan memegang peranan penting
dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun
mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam
jumlah lebih dari 100 mg sehari, sedangkan mineral mikro dibutuhkan kurang dari
100 mg sehari. Yang termasuk mineral makro antara lain: natrium, klorida,
kalium, kalsium, fosfor, dan magnesium, sedangkan yang termasuk mineral mikro
antara lain: besi, mangan dan tembaga (Almatsier, 2004).
Secara tidak langsung, mineral banyak yang berperan dalam proses
pertumbuhan. Peran mineral dalam tubuh kita berkaitan satu sama lainnya, dan
kekurangan atau kelebihan salah satu mineral akan berpengaruh terhadap kerja
mineral lainnya (Poedjiadi, 2006).
2.2.1 Besi
Besi merupakan mineral mikro yang paling banyak terdapat di dalam
tubuh manusia dan hewan. Besi mempunyai beberapa fungsi esensial di dalam
tubuh : sebagai alat angkut oksigen dari paru-paru ke jaringan tubuh, sebagai alat
angkut elektron di dalam sel, dan sebagai bagian terpadu berbagai reaksi enzim di
dalam jaringan tubuh (Almatsier, 2004).
Pada orang dewasa normal, terdapat 4-5 g besi, 75% berada dalam bentuk
hemoglobin (2,5 g), mioglobin (0,15 g),enzim heme, dan enzim nonheme. Sisanya
disimpan sebagai ferritin dan hemosiderin dalam sistem retikuloendotelial, limfa,
sumsum tulang, dan sel hepatik parenkim (Eastwood, 2003).
Tubuh sangat efisien dalam penggunaan besi. Sebelum diabsorpsi, didalam
lambung besi dibebaskan dari ikatan organik seperti protein. Sebagian besar besi
dalam bentuk feri direduksi menjadi bentuk fero. Hal ini terjadi dalam suasana
makanan. Absorpsi terutama terjadi di bagian atas usus halus (duodenum) dengan
alat angkut protein khusus (Almatsier, 2004).
Ada dua macam bentuk zat besi dalam makanan, yaitu heme dan
nonheme. Zat besi heme berasal dari hewan, penyerapannya tidak tergantung pada
jenis kandungan makanan lain, dan lebih mudah diabsorbsi dibandingkan zat besi
nonheme. Pada umumnya zat besi nonheme terdapat pada pagan nabati, seperti
sayur-sayuran, biji-bijian, kacang-kacangan, dan buah-buahan (Wirakusumah,
1999).
Kebutuhan tubuh untuk unsur besi sehari adalah 8,7 mg bagi pria dan 14,8
mg bagi wanita. Kebutuhan besi selama pertumbuhan meningkat sampai kurang
lebih 0,6 mg, dan waktu kehamilan sampai 1-2 mg/hari (Tjay, 2007).
Kekurangan darah atau anemia adalah sutu keadaan kronis dimana kadar
hemoglobin dan atau jumlah eritrosit berkurang. Penyebab paling umum dari
anemia adalah kekurangan besi untuk sintesa hemoglobin (Tjay, 2007).
2.2.2 Kalsium
Kalsium merupakan mineral yang paling banyak terdapat di dalam tubuh,
yaitu 1,5 – 2% dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg
(Barasi, 2007). Dari jumlah ini, 99% berada didalam jaringan keras, yaitu tulang
dan gigi terutama dalam bentuk hidroksiapatit selebihnya kalsium tersebar luas di
dalam tubuh. Absorpsi kalsium terutama terjadi di bagian atas usus halus yaitu
duodenum. Peningkatan kebutuhan akan kalsium terjadi pada masa pertumbuhan,
kehamilan, dan menyusui. Kacang-kacangan merupakan salah satu sumber
kalsium, seperti kacang kedelai, kacang hijau, kacang merah, dan kacang tanah
Mineral kalsium dibutuhkan untuk perkembangan tulang. Kalsium sangat
penting terutama untuk anak-anak, wanita hamil, dan wanita menyusui. Jumlah
yang dianjurkan per hari untuk anak-anak sebesar 500 mg, remaja 600-700 mg,
dan dewasa sebesar 800 mg (Almatsier, 2004).
Kekurangan kalsium pada masa pertumbuhan dapat menyebabkan
gangguan pertumbuhan. Tulang kurang kuat, mudah bengkok dan rapuh. Semua
orang dewasa, terutama sesudah usia 50 tahun akan kehilangan kalsium dari
tulangnya. Tulang menjadi rapuh dan mudah patah. Ini yang dinamakan
osteoporosis yang dapat dipercepat oleh keadaan stres sehari-hari. Osteoporosis
lebih banyak terjadi pada wanita daripada laki-laki dan lebih banyak pada orang
kulit putih daripada kulit berwarna (Almatsier, 2004).
2.3 Spektrofotometri Serapan Atom
Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar
oleh atom-atom netral, dan sinar yang diserap biasanya sinar tampak atau sinar
ultraviolet (Rohman, 2007)
Spektrofotometri serapan atom digunakan untuk analisis kuantitatif
unsur-unsur mineral dalam jumlah sekelumit (trace) dan sangat sekelumit (ultratrace).
Cara analisis ini memberikan kadar total unsur mineral dalam suatu sampel dan
tidak tergantung pada bentuk molekul mineral dalam sampel tersebut. Cara ini
cocok untuk analisis sekelumit mineral karena mempunyai kepekaan yang tinggi
(batas deteksi kurang dari 1 ppm), pelaksanaanya relatif sederhana, dan
Metode spektrofotometri serapan atom berprinsip pada absorpsi cahaya
oleh atom. Atom-atom menyerap cahaya pada panjang gelombang tertentu,
tergantung pada sifat unsurnya. Cahaya pada panjang gelombang ini mempunyai
cukup energi untuk mengubah tingkat elektronik suatu atom. Transisi elektronik
suatu unsur bersifat spesifik. Dengan absorpsi energi, berarti memperoleh lebih
banyak energi, suatu atom pada keadaan dasar dinaikkan tingkat energinya ke
tingkat eksitasi (Khopkar, 2008).
Bagian instrumentasi spektrofotometer serapan atom adalah sebagai
berikut:
a. Sumber Radiasi
Sumber radiasi yang digunakan adalah lampu katoda berongga (hollow
cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung
suatu katoda dan anoda. Katoda berbentuk silinder berongga yang dilapisi dengan
mineral tertentu (Rohman, 2007).
b. Tempat Sampel
Dalam analisis dengan spektrofotometer serapan atom, sampel yang akan
dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan
azas. Ada berbagai macam alat yang digunakan untuk mengubah sampel menjadi
uap atom-atomnya, yaitu:
1. Dengan nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa cairan menjadi
bentuk uap atomnya dan untuk proses atomisasi. Suhu yang dapat dicapai oleh
nyala tergantung pada gas yang digunakan, misalnya untuk gas asetilen-udara
nyala yang paling banyak digunakan. Pada sumber nyala ini asetilen sebagai
bahan pembakar, sedangkan udara sebagai bahan pengoksidasi (Rohman, 2007).
2.Tanpa nyala (Flameless)
Pengatoman dilakukan dalam tungku dari grafit. Sejumlah sampel diambil
sedikit (hanya beberapa µL), lalu diletakkan dalam tabung grafit, kemudian
tabung tersebut dipanaskan dengan sistem elektris dengan cara melewatkan arus
listrik pada grafit. Akibat pemanasan ini, maka zat yang akan dianalisis berubah
menjadi atom-atom netral dan pada fraksi atom ini dilewatkan suatu sinar yang
berasal dari lampu katoda berongga sehingga terjadilah proses penyerapan energi
sinar yang memenuhi kaidah analisis kuantitatif (Rohman, 2007).
c. Monokromator
Monokromator merupakan alat untuk memisahkan dan memilih spektrum
sesuai dengan panjang gelombang yang digunakan dalam analisis dari sekian
banyak spektrum yang dihasilkan lampu katoda berongga (Rohman, 2007).
d. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui
tempat pengatoman (Rohman, 2007).
e. Amplifier
Amplifier merupakan suatu alat untuk memperkuat signal yang diterima
dari detektor sehingga dapat dibaca alat pencatat hasil (Readout) (Rohman, 2007).
f. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai
pencatat hasil. Hasil pembacaan dapat berupa angka atau berupa kurva yang
Gambar 1. Komponen Spektrofotometer Serapan Atom
2.3.1 Gangguan-gangguan pada Spektrofotometri Serapan Atom
Gangguan-gangguan (interference) pada Spektrofotometri Serapan Atom
adalah peristiwa-peristiwa yang menyebabkan pembacaan absorbansi unsur yang
dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan
konsentrasinya dalam sampel (Rohman, 2007). Secara luas dapat dikategorikan
menjadi dua kelompok, yakni interferensi spektral dan interferensi kimia
(Khopkar, 2008).
Interferensi spektral disebabkan karena tumpangasuh absorpsi antara
spesies pengganggu dan spesies yang diukur. Interfernsi kimia disebabkan adanya
reaksi kimia selama atomisasi, sehingga mengubah sifat absorpsi (Khopkar,
2008).
2.4 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap
parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan
parameter analisis yang harus dipertimbangkan dalam validasi metode analisis
adalah sebagai berikut:
a. Kecermatan
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil
analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai
persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan
ditentukan dengan dua cara, yaitu:
- Metode simulasi
Metode simulasi (Spiked-placebo recovery) merupakan metode yang
dilakukan dengan cara menambahkan sejumlah analit bahan murni ke dalam suatu
bahan pembawa sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan
hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang
sebenarnya) (Harmita, 2004).
- Metode penambahan baku
Metode penambahan baku (standard addition method) merupakan metode
yang dilakukan dengan cara menambahkan sejumlah analit dengan konsentrasi
tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode yang akan
divalidasi. Hasilnya dibandingkan dengan sampel yang dianalisis tanpa
penambahan sejumlah analit. Persen perolehan kembali ditentukan dengan
menentukan berapa persen analit yang ditambahkan ke dalam sampel dapat
ditemukan kembali (Harmita, 2004).
Menurut Ermer (2005) rentang persen perolehan kembali memenuhi syarat
b. Keseksamaan (presisi)
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau
koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan
derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara
berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang
memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan
(Harmita, 2004).
c. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang
hanya mengukur zat tertentu secara cermat dan seksama dengan adanya
komponen lain yang ada di dalam sampel (Harmita, 2004).
d. Linearitas dan rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon
baik secara langsung maupun dengan bantuan transformasi matematika,
menghasilkan suatu hubungan yang proporsional terhadap konsentrasi analit
dalam sampel. Rentang merupakan batas terendah dan batas tertinggi analit yang
dapat ditetapkan secara cermat, seksama dan dalam linearitas yang dapat diterima
(Harmita, 2004).
e. Batas deteksi (Limit of detection) dan batas kuantitasi (Limit of quantitation)
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat
dideteksi yang masih memberikan respon signifikan, sedangkan batas kuantitasi
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Farmasi Kualitatif
Fakultas Farmasi Universitas Sumatera Utara dan di Laboratorium Penelitian
Fakultas Farmasi Universitas Sumatera Utara pada bulan Agustus 2011 – Januari
2012.
3.2 Bahan – bahan 3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah kacang hijau utuh
(dengan kulit biji) dan kacang hijau tanpa kulit biji yang berasal dari Berastagi
Supermarket Jl. Jend. Gatot Subroto, Kecamatan Medan Petisah, Kota Medan
(Gambar dapat dilihat pada Lampiran 1, halaman 37).
3.2.2 Pereaksi
Semua bahan yang digunakan dalam penelitian ini berkualitas pro analisa
keluaran E. Merck kecuali disebutkan lain yaitu akuabides (Laboratorium
Penelitian Fakultas Farmasi USU), ammonium tiosianat, asam nitrat 65% b/v,
asam sulfat 96% v/v, etanol 96% v/v, kalium heksasianoferat (II), larutan baku
3.3 Alat – alat
Spektrofotometer Serapan Atom Hitachi Z-2000 lengkap dengan Lampu
katoda besi dan kalsium, Neraca analitik (AND GF-200), Hot plate (FISONS),
alat tanur Nabertherm, blender, kertas saring Whatman No.42, krus porselen,
spatula dan alat – alat gelas (Pyrex dan Oberol).
3.4 Pembuatan Pereaksi 3.4.1 Larutan HNO3 (1:1)
Sebanyak 500 ml larutan HNO3 65% b/v diencerkan dengan 500 ml
akuabides (Helrich, 1990).
3.4.2 Larutan H2SO4 1 N
Sebanyak 3 ml larutan H2SO4 96% v/v diencerkan dengan akuades hingga
100 ml (Ditjen POM, 1979).
3.4.3 Larutan NH4SCN 1,5 N
Sebanyak 57,09 gram ammonium tiosianat dilarutkan dalam 100 ml
akuades, diencerkan hingga 500 ml (Manan, 2009).
3.4.4 Larutan K4[Fe(CN)6] 2 N
Sebanyak 105,5 gram K4[Fe(CN)6] dilarutkan dalam akuades hingga 500
ml (Manan, 2009).
3.5 Prosedur Penelitian 3.5.1 Pengambilan sampel
Metode pengambilan sampel dilakukan dengan cara sampling purposif
dasar pertimbangan bahwa sampel yang diambil dapat mewakili populasi
(Budiarto, 2004).
3.5.2 Penyiapan Sampel
Sebanyak ±500 gram kacang hijau dengan kulit biji (yang tidak ditentukan
kadar airnya) dibersihkan dari pengotoran, dicuci bersih dengan akuabides,
ditiriskan. Selanjutnya dikeringkan di udara terbuka terhindar dari sinar matahari
langsung, setelah kering, dihaluskan dengan blender. Perlakuan yang sama juga
dilakukan untuk kacang hijau tanpa kulit biji (yang tidak ditentukan kadar airnya).
3.5.3 Proses Destruksi
Sampel yang telah dihaluskan ditimbang seksama sebanyak 50 gram
dalam krus porselen, diarangkan di atas hot plate, lalu diabukan dalam tanur
dengan temperatur awal 100 dan perlahan – lahan temperatur dinaikkan hingga
suhu 600 dengan interval 25 setiap 5 menit. Pengabuan dilakukan selama 60
jam (dihitung saat suhu sudah 600 , lalu setelah suhu tanur krus
porselen dikeluarkan dan dibiarkan hingga dingin pada desikator. Abu
ditambahkan 5 ml HNO3 (1:1), kemudian diuapkan pada hot plate sampai kering.
Krus porselen dimasukkan kembali ke dalam tanur dengan temperatur awal 100
dan perlahan – lahan temperatur dinaikkan hingga suhu 600 dengan interval
25 setiap 5 menit. Pengabuan dilakukan selama 1 jam dan dibiarkan hingga
dingin pada desikator (Horwitz, 2000, dengan modifikasi). Bagan alir proses
destruksi dapat dilihat pada Lampiran 2, halaman 38.
3.5.4 Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 5 ml HNO3 (1:1), lalu
akuabides sebanyak tiga kali dan dicukupkankan dengan akuabides hingga garis
tanda. Kemudian disaring dengan kertas saring Whatman No. 42 dimana 5 ml
filtrat pertama dibuang untuk menjenuhkan kertas saring kemudian filtrat
selanjutnya ditampung ke dalam botol (Horwitz, 2000, dengan modifikasi).
Larutan ini digunakan untuk analisis kualitatif dan kuantitatif. Bagan alir
pembuatan larutan sampel dapat dilihat pada Lampiran 3, halaman 39.
3.5.5 Pemeriksaan Kualitatif 3.5.5.1 Besi
3.5.5.1.1 Reaksi Kualitatif dengan Larutan K4[Fe(CN)6] 2 N
Ke dalam tabung reaksi dimasukkan 2 ml larutan sampel hasil destruksi,
ditambahkan 10 tetes kalium heksasianoferat (II) 2 N. Dihasilkan larutan dengan
endapan berwarna biru tua (Vogel, 1990).
3.5.5.1.2 Reaksi Kualitatif dengan Larutan NH4SCN 1,5 N
Ke dalam tabung reaksi dimasukkan 2 ml larutan sampel hasil destruksi,
ditambahkan 3 tetes amonium tiosianat 1,5 N. Dihasilkan larutan berwarna merah
(Vogel, 1990).
3.5.5.2 Kalsium
3.5.5.2.1 Uji Kristal Kalsium dengan Asam Sulfat 1 N
Larutan sampel hasil destruksi sebanyak 1-2 tetes diteteskan pada object
glass kemudian ditetesi dengan larutan asam sulfat 1 N dan etanol 96% v/v akan
terbentuk endapan putih lalu diamati di bawah mikroskop. Jika terdapat kalsium
3.5.6 Pemeriksaan Kuantitatif
3.5.6.1 Pembuatan Kurva Kalibrasi Besi
Larutan baku besi (konsentrasi 1000 µg/ml) dipipet sebanyak 5 ml,
dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda
dengan akuabides (konsentrasi 50 µg/ml).
Larutan untuk kurva kalibrasi besi dibuat dengan memipet (1; 2; 3; 4 dan
5) ml larutan baku 50 µg/ml, masing-masing dimasukkan ke dalam labu tentukur
25 ml dan dicukupkan hingga garis tanda dengan akuabides (larutan ini
mengandung (2,0; 4,0; 6,0; 8,0 dan 10,0) µg/ml dan diukur absorbansi pada
panjang gelombang 248,3 nm dengan nyala udara-asetilen.
3.5.6.2 Pembuatan Kurva Kalibrasi Kalsium
Larutan baku kalsium (konsentrasi 1000 µg/ml) dipipet sebanyak 1 ml,
dimasukkan ke dalam labu tentukur 100 ml dan dicukupkan hingga garis tanda
dengan akuabides (konsentrasi 10 µg/ml).
Larutan untuk kurva kalibrasi kalsium dibuat dengan memipet (5; 10; 15;
20; dan 25) ml larutan baku 10 µg/ml, masing-masing dimasukkan ke dalam labu
tentukur 50 ml dan dicukupkan hingga garis tanda dengan akuabides (larutan ini
mengandung (1,0; 2,0; 3,0; 4,0 dan 5,0) µg/ml dan diukur absorbansi pada
panjang gelombang 422,7 nm dengan nyala udara-asetilen.
3.5.6.3 Penetapan Kadar Besi dan Kalsium dalam Sampel
Sebelum dilakukan penetapan kadar besi dan kalsium dalam sampel,
terlebih dahulu alat spektrofotometer serapan atom dikondisikan dan di atur
3.5.6.3.1 Penetapan Kadar Besi dalam Kacang Hijau dengan Kulit Biji Larutan sampel hasil destruksi dipipet sebanyak 4 ml dimasukkan ke
dalam labu tentukur 25 ml dan dicukupkan dengan akuabides hingga garis tanda
(Faktor pengenceran = 25 ml/4 ml = 6,25 kali). Lalu diukur absorbansinya dengan
menggunakan spektrofotometer serapan atom yang telah dikondisikan dan di atur
metodenya dimana penetapan kadar besi dilakukan pada panjang gelombang
248,3 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus
berada dalam rentang kurva kalibrasi larutan baku besi. Konsentrasi besi dalam
sampel ditentukan berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.6.3.2 Penetapan Kadar Besi dalam Kacang Hijau tanpa Kulit Biji Larutan sampel hasil destruksi dipipet sebanyak 4 ml dimasukkan ke
dalam labu tentukur 25 ml dan dicukupkan dengan akuabides hingga garis tanda
(Faktor pengenceran = 25 ml/4 ml = 6,25 kali). Lalu diukur absorbansinya
dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan
di atur metodenya dimana penetapan kadar besi dilakukan pada panjang
gelombang 248,3 nm dengan nyala udara-asetilen. Nilai absorbansi yang
diperoleh harus berada dalam rentang kurva kalibrasi larutan baku besi.
Konsentrasi besi dalam sampel ditentukan berdasarkan persamaan garis regresi
dari kurva kalibrasi.
3.5.6.3.3 Penetapan Kadar Kalsium dalam Kacang Hijau dengan Kulit Biji Larutan sampel hasil destruksi dipipet sebanyak 0,1 ml dimasukkan ke
dalam labu tentukur 25 ml dan dicukupkan dengan akuabides sampai garis tanda
(Faktor pengenceran = 25 ml/0,1 ml = 250 kali). Lalu diukur absorbansinya
di atur metodenya dimana penetapan kadar kalsium dilakukan pada panjang
gelombang 422,7 nm dengan nyala udara-asetilen. Nilai absorbansi yang
diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium.
Konsentrasi kalsium dalam sampel ditentukan berdasarkan persamaan garis
regresi dari kurva kalibrasi.
3.5.6.3.4 Penetapan Kadar Kalsium dalam Kacang Hijau tanpa Kulit Biji Larutan sampel hasil destruksi dipipet sebanyak 0,5 ml dimasukkan ke
dalam labu tentukur 25 ml dan dicukupkan dengan akuabides sampai garis tanda
(Faktor pengenceran = 25 ml/0,5 ml = 50 kali). Lalu diukur absorbansinya
dengan menggunakan spektrofotometer serapan atom yang telah dikondisikan dan
di atur metodenya dimana penetapan kadar untuk kalsium dilakukan pada panjang
gelombang 422,7 nm dengan nyala udara-asetilen. Nilai absorbansi yang
diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium.
Konsentrasi kalsium dalam sampel ditentukan berdasarkan persamaan garis
regresi dari kurva kalibrasi.
Kadar mineral besi dan kalsium dalam sampel dapat dihitung dengan cara
sebagai berikut:
n pengencera Faktor
x (g)
Sampel Berat
(ml) Volume x
(µg/ml) i
Konsentras (µg/g)
Logam Kadar
3.5.7 Analisis Data Secara Statistik 3.5.7.1 Penolakan Hasil Pengamatan
Kadar besi dan kalsium yang diperoleh dari hasil pengukuran
masing-masing larutan sampel dianalisis dengan metode standar deviasi dengan rumus
(Sudjana, 2005):
SD =
( )
1 -n
X
-Xi 2
∑
Keterangan : Xi = Kadar sampel
X = Kadar rata-rata sampel −
n = jumlah perlakuan
Untuk mencari t hitung digunakan rumus:
t hitung =
n SD
X Xi
/ −
dan untuk menentukan kadar mineral di dalam sampel dengan interval
kepercayaan 99%, α = 0.01, dk = n-1, dapat digunakan rumus:
Kadar Mineral : µ = X ± (t(α/2, dk) x SD / √n )
Keterangan : X − = Kadar rata-rata sampel
SD = Standar Deviasi
dk = Derajat kebebasan (dk = n-1)
α = interval kepercayaan
3.5.7.2 Pengujian Beda Nilai Rata-Rata Sampel dengan Nilai yang terdapat dalam literatur
Sampel akan diuji rata-ratanya dengan nilai yang terdapat didalam literatur
dengan menggunakan rumus (Sudjana, 2005):
to =
n s x
/ 0
µ
−
Keterangan : x = nilai rata-rata yang pembanding
µo= nilai rata-rata sampel
s = standard deviasi sampel
n =jumlah perlakuan sampel
3.5.7.3 Pengujian Beda Nilai Rata-Rata Antar Sampel
Sampel yang dibandingkan adalah independen dan jumlah pengamatan
masing-masing lebih kecil dari 30 dan variansi (σ) tidak diketahui sehingga
dilakukan uji F untuk mengetahui apakah variansi kedua populasi sama (σ1 = σ2)
atau berbeda (σ1≠ σ2) dengan menggunakan rumus (Sudjana, 2005):
Fo = 2 2 2 1
S S
Keterangan : Fo = Beda nilai yang dihitung
S1 = Standar deviasi terbesar
S2 = Standar deviasi terkecil
Apabila dari hasilnya diperoleh Fo tidak melewati nilai kritis F maka dilanjutkan
(X1 – X2) to =
Sp √1/n1 + 1/n2
Keterangan : X1 = kadar rata-rata sampel 1 n 1 = Jumlah perlakuan sampel 1
X2 = kadar rata-rata sampel 2 n 2 = Jumlah perlakuan sampel 2
Sp = Simpangan baku
jika Fo melewati nilai kritis F, dilanjutkan uji dengan distribusi t dengan rumus :
(X1 – X2) to =
√S12/n1 + S22/n2
Keterangan : X1 = kadar rata-rata sampel 1 S1 = Standar deviasi sampel 1
X2 = kadar rata-rata sampel 2 S2 = Standar deviasi sampel 2
n 1 = Jumlah perlakuan sampel 1 n 2 = Jumlah perlakuan sampel 2
Kedua sampel dinyatakan berbeda apabila to yang diperoleh melewati nilai
kritis t, dan sebaliknya.
3.5.8 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode
penambahan larutan standar (standard addition method). Dalam metode ini, kadar
mineral dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan
penentuan kadar mineral dalam sampel setelah penambahan larutan standar
dengan konsentrasi tertentu (Ermer, 2005). Larutan baku yang ditambahkan yaitu,
5 ml larutan baku besi (konsentrasi 50 µg/ml) dan 5 ml larutan baku kalsium
(konsentrasi 1000 µg/ml) .
Kacang hijau yang telah dihaluskan ditimbang secara seksama sebanyak
50 gram di dalam krus porselen, lalu ditambahkan 5 ml larutan baku besi
dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan
sebelumnya.
Persen perolehan kembali dapat dihitung dengan rumus di bawah ini
(Harmita, 2004):
100% an
ditambahak yang
baku larutan Kadar
awal sampel dalam
logam rata) -Kadar(rata sampel
dalam logam total Kadar
× −
3.5.9 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau
koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan
derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara
berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang
memenuhi persyaratan menunjukkan adanya keseksamaan metode yang
dilakukan.
Adapun rumus untuk menghitung simpangan baku relatif adalah (Harmita,
2004) :
RSD = ×100%
X SD
Keterangan : X − = Kadar rata-rata sampel
SD = Standar Deviasi
RSD = Relative Standard Deviation
3.5.10 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit of Quantitation)
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama.
Batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai
berikut (Harmita, 2004):
Simpangan Baku (
X
SY ) =
(
)
2 2
− −
∑
nYi Y
Batas deteksi (LOD) =
slope X SY x 3
Batas kuantitasi (LOQ) =
BAB IV
HASIL DAN PEMBAHASAN
4.1 Analisis Kualitatif
Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk
mengetahui ada atau tidaknya ion besi dan ion kalsium dalam sampel. Data dapat
[image:42.595.114.514.289.419.2]dilihat pada Tabel 1 dan Lampiran 4, halaman 40, 41.
Tabel 1. Hasil Analisis Kualitatif No. Ion yang
dianalisis
Pereaksi Hasil Reaksi Keterangan
1. Kalsium Asam sulfat 1 N + etanol
96% Kristal jarum
+
2. Besi
Kalium heksasianoferat (II) 2 N
Larutan dengan endapan biru tua
+
Amonium tiosianat 1,5 N Larutan merah + Keterangan :
+ : Mengandung ion
Tabel di atas menunjukkan bahwa larutan sampel yang diperiksa
mengandung ion besi dan ion kalsium. Sampel dikatakan positif mengandung ion
kalsium jika menghasilkan endapan putih berbentuk kristal jarum dengan
penambahan asam sulfat 1 N dan etanol 96% v/v, mengandung ion besi jika
menghasilkan endapan berwarna biru tua dengan penambahan larutan kalium
heksasianoferat (II) 2 N dan larutan merah dengan penambahan amonium
tiosianat 1,5 N. Berdasarkan hasil reaksi warna maupun reaksi kristal dari
masing-masing kedua ion tersebut membuktikan larutan sampel mengandung ion besi dan
ion kalsium.
Hasil absorbansi dengan spektrofotometer serapan atom menunjukkan
422,7 nm. Hal ini juga membuktikan secara kualitatif bahwa sampel mengandung
mineral besi dan mineral kalsium.
4.2 Analisis Kuantitatif
4.2.1 Kurva kalibrasi Besi dan Kalsium
Kurva kalibrasi besi dan kalsium diperoleh dengan cara mengukur
absorbansi dari larutan baku besi dan kalsium pada panjang gelombang
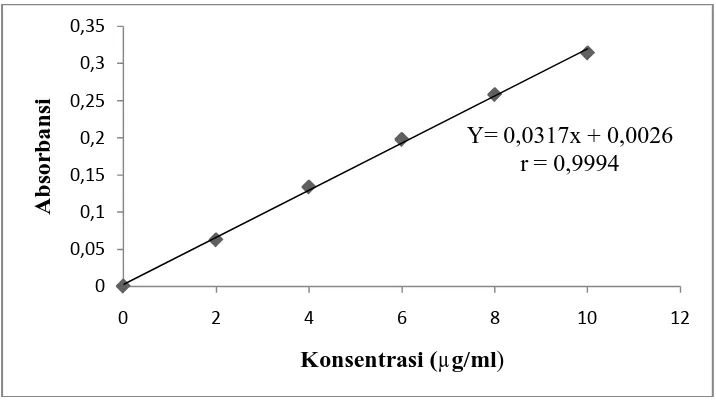
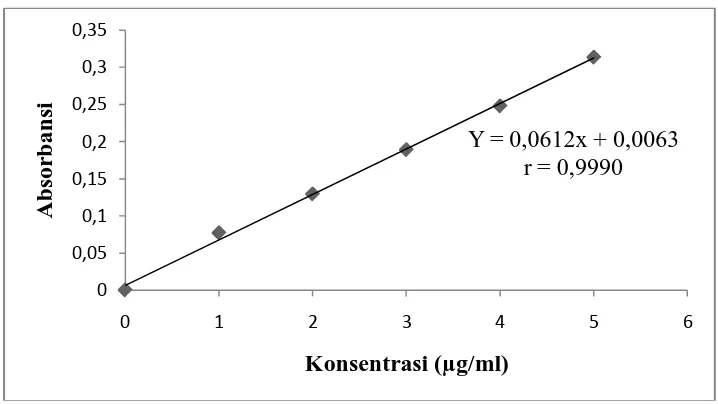
masing-masing. Dari pengukuran kurva kalibrasi untuk kedua mineral tersebut diperoleh
persamaan garis regresi yaitu Y = 0,0317X - 0,0026 untuk besi dan Y = 0,0612X
+ 0,0063 untuk kalsium.
Kurva kalibrasi larutan baku besi dan kalsium dapat dilihat pada Gambar 1
[image:43.595.133.491.414.614.2]dan Gambar 2.
Gambar 1. Kurva Kalibrasi Larutan Baku Besi Y= 0,0317x + 0,0026
r = 0,9994
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35
0 2 4 6 8 10 12
A
bs
or
ban
si
Gambar 2. Kurva Kalibrasi Larutan Baku Kalsium
Berdasarkan kurva di atas diperoleh hubungan yang linear antara
konsentrasi dengan absorbansi, dengan koefisien korelasi (r) besi sebesar 0,9994
dan kalsium sebesar 0,9990. Nilai r ≥ 0,97 menunjukkan adanya korelasi linier
yang menyatakan adanya hubungan antara X (Konsentrasi) dan Y (Absorbansi)
(Ermer, 2005). Data hasil pengukuran absorbansi larutan baku besi dan kalsium
dan perhitungan persamaan garis regresi dapat dilihat pada Lampiran 5 dan
Lampiran 6, halaman 42, 43.
4.2.2 Analisis Kadar Besi dan Kalsium dalam Kacang Hijau dengan Kulit Biji dan tanpa Kulit Biji
Penentuan kadar besi dan kalsium dilakukan secara spektrofotometri
serapan atom. Konsentrasi mineral besi dan kalsium dalam sampel ditentukan
berdasarkan persamaan garis regresi kurva kalibrasi larutan baku masing-masing
mineral. Agar konsentrasi mineral besi dan kalsium dalam sampel berada pada
rentang kurva kalibrasi maka masing-masing sampel diencerkan terlebih dahulu
dengan faktor pengenceran yang berbeda-beda. Faktor pengenceran untuk
penentuan kadar besi pada kacang hijau dengan kulit biji maupun pada kacang Y = 0,0612x + 0,0063
r = 0,9990
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35
0 1 2 3 4 5 6
A
bs
or
ban
si
hijau tanpa kulit biji adalah sebesar 6,25 kali sedangkan faktor pengenceran untuk
penentuan kadar kalsium pada kacang hijau dengan kulit biji adalah sebesar 250
kali, dan faktor pengenceran untuk penentuan kadar kalsium pada kacang hijau
tanpa kulit biji adalah sebesar 50 kali. Data dan contoh perhitungan dapat dilihat
pada Lampiran 7 dan Lampiaran 8, halaman 44, 45.
Analisis dilanjutkan dengan perhitungan statistik (Perhitungan dapat
dilihat pada Lampiran 9 dan Lampiran 10, halaman 46 sampai halaman 56). Hasil
analisis kuantitatif mineral besi dan kalsium pada sampel dapat dilihat pada Tabel
2.
Tabel 2. Hasil Analisis Kadar Besi dan Kalsium dalam Sampel
No. Sampel Kadar Besi
(mg/100g)
Kadar Kalsium (mg/100g)
1. KHDK 4,8533±0,5835 61,0591 ± 5,4910
2. KHTK 3,5300 ± 0,2635 6,8628 ± 0,0652
Keterangan :
KHDK: Kacang Hijau Dengan Kulit Biji KHTK: Kacang Hijau Tanpa Kulit Biji
Data yang didapat kemudian diuji kembali secara statistik untuk
mengetahui beda nilai kadar rata-rata mineral pada sampel dengan kadar yang
tercantum di literatur serta untuk mengetahui beda nilai kadar rata-rata mineral
antar kedua sampel (Perhitungan dapat dilihat pada Lampiran 11 sampai dengan
Lampiran 14, halaman 57 sampai halaman 64). Hasil perhitungan uji statistik
Tabel 3. Hasil Uji Beda nilai rata-rata kadar besi dan kalsium pada sampel dengan Nilai pada Literatur
No. Sampel Kadar t hitung t tabel Hasil
1. Literatur KHDK Besi 12,7494 4,0321 Beda
KHTK 55,2912 4,6041 Beda
2. Literatur KHDK Kalsium 53,5652 4,6041 Beda
KHTK 3704,9482 4,6041 Beda
Keterangan :
KHDK: Kacang Hijau Dengan Kulit Biji KHTK: Kacang Hijau Tanpa Kulit Biji
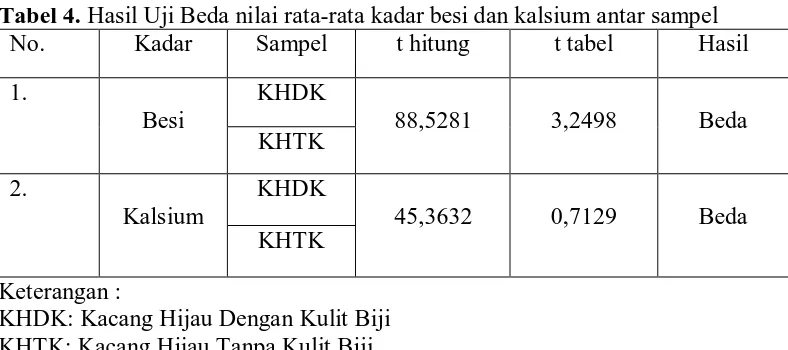
Tabel 4. Hasil Uji Beda nilai rata-rata kadar besi dan kalsium antar sampel
No. Kadar Sampel t hitung t tabel Hasil
1.
Besi
KHDK
88,5281 3,2498 Beda KHTK
2.
Kalsium
KHDK
45,3632 0,7129 Beda KHTK
Keterangan :
KHDK: Kacang Hijau Dengan Kulit Biji KHTK: Kacang Hijau Tanpa Kulit Biji
Berdasarkan Tabel 3 di atas dapat diketahui bahwa kadar besi dan kalsium
pada kacang hijau dengan kulit biji maupun tanpa kulit biji yang diperoleh dari
hasil analisis berbeda dengan kadar besi dan kalsium yang tercantum pada
literatur.
Berdasarkan Tabel 4 di atas dapat diketahui bahwa kadar besi pada
kacang hijau dengan kulit biji lebih besar dibandingkan kadar besi di dalam
kacang hijau tanpa kulit biji. Hal ini kemungkinan karena zat besi di dalam
kacang hijau banyak terdapat pada bagian embrio dan kulit biji (Astawan, 2009).
Jadi, saat kulit bijinya dihilangkan maka kadar besi yang terdapat di dalamnya
berkurang. Selanjutnya, kadar kalsium di dalam kacang hijau dengan kulit biji
[image:46.595.114.508.249.424.2]kemungkinan karena kalsium pada kacang hijau paling banyak terdapat pada
bagian kulit biji (Astawan, 2009). Jadi, saat kulit bijinya dihilangkan maka kadar
mineral kalsium yang terdapat di dalamnya berkurang.
4.2.3 Uji Perolehan Kembali (Recovery)
Hasil uji perolehan kembali (recovery) kadar besi dan kalsium setelah
penambahan masing-masing larutan baku besi dan kalsium dalam sampel dapat
dilihat pada Lampiran 15, halaman 65. Perhitungan persen recovery besi dan
kalsium dalam sampel dapat dilihat pada Lampiran 16, halaman 66 sampai
[image:47.595.115.509.363.480.2]halaman 71. Persen recovery besi dan kalsium dalam sampel dapat dilihat pada
Tabel 5.
Tabel 5. Persen Uji Perolehan Kembali (recovery) Kadar besi dan kalsium No. Mineral yang dianalisis Recovery (%)
Syarat rentang persen recovery (%)
1. Fe 93,32
80-120
2. Ca 90,29
Berdasarkan tabel di atas, dapat dilihat bahwa rata-rata hasil uji perolehan
kembali (recovery) untuk kandungan besi adalah 93,32%, dan untuk kandungan
kalsium adalah 90,29%. Persen recovery tersebut menunjukkan kecermatan kerja
yang memuaskan pada saat pemeriksaan kadar besi dan kadar kalsium dalam
sampel. Hasil uji perolehan kembali (recovery) ini memenuhi syarat akurasi yang
telah ditetapkan, jika rata-rata hasil perolehan kembali (recovery) berada pada
rentang 80-120% (Ermer, 2005).
4.2.4 Simpangan Baku Relatif
Dari perhitungan yang dilakukan terhadap data hasil pengukuran kadar
sebesar 5,88% untuk mineral besi; 3,32% untuk mineral kalsium dan nilai
simpangan baku relatif (RSD) sebesar 6,30% untuk mineral besi; 3,67% untuk
mineral kalsium. Menurut Harmita (2004), nilai simpangan baku relatif (RSD)
untuk analit dengan kadar part per million (ppm) adalah tidak lebih dari 16% dan
untuk analit dengan kadar part per billion (ppb) RSDnya adalah tidak lebih dari
32%. Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan
memiliki presisi yang baik.
4.2.5 Batas Deteksi dan Batas Kuantitasi
Berdasarkan data kurva kalibrasi besi dan kalsium diperoleh batas deteksi
dan batas kuantitasi untuk kedua mineral tersebut. Dari hasil perhitungan
diperoleh untuk pengukuran besi dan kalsium masing-masing sebesar 0,4505
dan 0,2000 , sedangkan batas kuantitasinya sebesar 1,5000 dan
0,8000 .
Dari hasil perhitungan dapat dilihat bahwa semua hasil yang diperoleh
pada pengukuran sampel berada diatas batas deteksi dan batas kuantitasi.
Perhitungan batas deteksi dan batas kuantitasi dapat dilihat pada Lampiran 18
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Terdapat perbedaan kadar kandungan besi dan kalsium di dalam kacang
hijau yang dianalisis dengan kadar yang tercantum di literatur. Kadar besi
dan kalsium yang diperoleh dari hasil analisis lebih kecil (menurun) dari
kadar besi dan kalsium yang tercantum pada literatur.
b. Hasil penetapan kadar besi dan kalsium secara spektrofotometri serapan
atom menunjukkan adanya perbedaan kadar besi pada kacang hijau dengan
kulit biji dan kacang hijau tanpa kulit biji. Kadar besi pada kacang hijau
dengan kulit biji sebesar (4,8533±0,5835) mg/100 g dan pada kacang hijau
tanpa kulit biji sebesar (3,5300 ± 0,2635) mg/100 g. Kadar kalsium pada
kacang hijau dengan kulit biji sebesar (61,0591 ± 5,4910) mg/100 g dan
pada kacang hijau tanpa kulit biji sebesar (6,8628 ± 0,0652) mg/100 g.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk meneliti mineral lain yang
DAFTAR PUSTAKA
Anonim. (2009). Anemia dan Osteoporosis Bisa Dicegah dengan Mengonsumsi
Kacang Hijau. Diakses: 12 Januari 2012.http:// www.woment health
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia Pustaka Utama. Hal. 235, 241, 242, 243, 247, 255.
Astawan, M. (2009). Sehat dengan Hidangan Kacang dan Biji-bijian. Jakarta: Penebar Swadaya. Hal.33-35.
Barasi, M.E. (2007). At a Glance: Ilmu Gizi. Penerjemah: Halim Hermin. Jakarta: Penerbit Erlangga. Hal. 62.
Bassett, J., Denney, R.C., Jeffery, G.H., Mendham, J. (1994). Buku Ajar Vogel
Kimia Analisis Kuantitatif Anorganik. Edisi IV. Penerjemah: Setiono, L.,
Hadiyana Pudjaatmaka. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 372, 512, 973, 463, 516.
Budiarto, E. (2004). Metodologi Penelitian Kedokteran. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 46.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Hal. 744.
Duke, J.A. (1981). Handbook of Legumes of World Economic Importance. New York and London: Plenum Press. Hal. 294.
Eastwood, M. (2003). Principles of Human Nutrition. Edisi II. Edinburgh: Blackwell Science Ltd. Hal. 329,330.
Ermer, J. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Hal. 171.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. 1 (3). 117-119, 121, 122, 127, 128, 130.
Helrich, K. (1990). Official Methods of the Association of Official Analytical
Chemist. Edisi kelimabelas. Viginia: AOAC International. Hal. 42.
Horwitz, K. (2000). Official Methods of the Association of Official Analytical
Chemist. Edisi ketujuhbelas. Arlington: AOAC International. Hal. 42.
Manan, M.H.A. (2009). Membuat Reagen Kimia Di Laboratorium. Jakarta: Bumi Aksara. Hal. 42, 46.
Pudjiadi, S. (2000). Ilmu Gizi Klinis pada Anak. Edisi Keempat. Jakrta: Penerbit FK UI. Hal. 197.
Rohman, A. (2009). Kimia Farmasi Analisis. Cetakan I. Yogyakarta: Pustaka Pelajar. Hal. 298, 305-307, 309, 310-312, 319.
Rukmana, R. (1997). Kacang Hijau Budi Daya dan Pascapanen. Jakarta: Penerbit Kanisius. Hal.16.
Sudjana. (2005). Metode Statistika. Edisi VI. Bandung: Tarsito. Hal. 93, 168, 239.
Tjay, T.H., dan Rahardja, K. (2007). Obat-obat Penting. Edisi VII. Cetakan I Jakarta: PT Elex Media Komputindo Kelompok Kompas-Gramedia. Hal.625, 698.
Vogel, A.I. (1990). Analisis Anorganik Kualitatif Makro dan Semimikro. Bagian I. Penerjemah: Setiono, L., Hadyana Pudjaatmaka. Jakarta: Kalman Media Pustaka. Hal. 262, 263, 303.
Lampiran 1. Gambar Kacang Hijau (Phaseolus radiatus L.)
Gambar 1. Gambar Kacang Hijau (Phaseolus radiatus L.) dengan kulit biji
Lampiran 2. Bagan Alir Proses Destruksi Kering
Kacang Hijau
Ditimbang 50 gram di atas krus porselen Diarangkan di atas hot plate
Diabukan dalam tanur dengan temperatur awal 100◦C dan perlahan – lahan temperatur dinaikkan hingga suhu 600◦C dengan interval 25◦C setiap 5 menit
Ditambahkan 5 ml HNO3 (1:1)
Diuapkan pada hot plate sampai kering
Hasil
Dilakukan selama 60 jam dan dibiarkan hingga dingin pada desikator
Abu
Dilakukan selama 1 jam dan dibiarkan hingga dingin pada desikator
Dibersihkan dari pengotoran
Dimasukkan kembali ke dalam tanur dengan temperatur awal 100˚C dan perlahan – lahan temperatur dinaikkan hingga suhu 600˚C dengan interval 25˚C setiap 5 menit.
Dicuci bersih
Ditiriskan
Dikeringkan di udara terbuka terhindar dari sinar matahari langsung
Dihaluskan dengan blender
Lampiran 3. Bagan Alir Pembuatan Larutan Sampel
Sampel yang telah didestruksi
Dilarutkan dalam 5 ml HNO3 (1:1)
Dipindahkan ke dalam labu tentukur 50 ml
Dipindahkan ke dalam labu tentukur 50 ml, dibiladibila
Dibilas krus porselen sebanyak tiga kali dengan 10 ml akuabides. Dicukupkan dengan akuabides hingga garis tanda
Dimasukkan ke dalam botol
Larutan sampel
Disaring dengan kertas saring Whatman No.42
Filtrat
Dibuang 5 ml untuk menjenuhkan kertas saring
Dilakukan analisis kualitatif
Dilakukan analisis kuantitatif dengan Spektrofotometer Serapan atom pada λ
248,3 nm untuk kadar besi dan pada λ
422,7 nm untuk kadar kalsium
Lampiran 4. Hasil Analisis Kualitatif Besi dan Kalsium
Gambar 3. Gambar Kristal Kalsium sulfat (Perbesaran 10x10)
Gambar 4. Hasil Analisis Kualitatif dengan Larutan Kalium heksasianoferat (II) Kalsium sulfat
Sampel + K4[Fe(CN)6]
[image:55.595.244.382.410.707.2]Gambar 5. Hasil Analisis Kualitatif dengan Larutan Amonum tiosianat
Sampel + NH4SCN
[image:56.595.230.396.83.381.2]Lampiran 5. Data Kalibrasi Besi dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r).
No. Konsentrasi (µg/ml) (X)
Absorbansi (Y)
1. 0,0000 0,0005
2. 2,0000 0,0627
3. 4,0000 0,1338
4. 6,0000 0,1974
5. 8,0000 0,2580
6. 10,0000 0,3149
No. X Y XY X2 Y2
1. 0,0000 0,0005 0,0000 0,0000 0,00000025 2. 2,0000 0,0627 0,1254 4,0000 0,00393129 3. 4,0000 0,1338 0,5352 16,0000 0,01790244 4. 6,0000 0,1974 1,1868 36,0000 0,03912484 5. 8,0000 0,2580 2,0640 64,0000 0,06656400 6. 10,0000 0,3149 3,140 100,0000 0,09859600
∑ 30,0000 X = 5,0000
0,9668 Y= 0,1611
7,0514 220,0000 0,22611882
a =
( )
X nX n Y X XY / / 2 2
∑
∑
∑
∑ ∑
− − =(
)
(
30,0000)
/6 0000 , 220 6 / ) 9668 , 0 ( 0000 , 30 0514 , 7 2 − − = 0,0317Y = a X + b
b = Y − aX
= 0,1611 – (0,0317)(5,0000)
= 0,0026
Maka persamaan garis regresinya adalah: Y = 0,0317X – 0,0026
=
(
)(
)
(
)
{
220 30,0000 /6}
{
0,22611882(
0,9668)
/6}
6 / 9668 , 0 0000 , 30 0514 , 7 2 2 − − − = 2188 , 2 2174 , 2= 0,9994
Lampiran 6. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r).
No. Konsentrasi (µg/ml) (X)
Absorbansi (Y)
1. 0,0000 0,0000
2. 1,0000 0,0765
3. 2,0000 0,1293
4. 3,0000 0,1889
5. 4,0000 0,2478
6. 5,0000 0,3135
No. X Y XY X2 Y2
1. 0,0000 0,0000 0,0000 0,0000 0,00000000 2. 1,0000 0,0765 0,0765 1,0000 0,00585225 3. 2,0000 0,1293 0,2586 4,0000 0,01671849 4. 3,0000 0,1889 0,5667 9,0000 0,56670000 5. 4,0000 0,2478 0,9912 16,0000 0,06140484 6. 5,0000 0,3135 1,5675 25,0000 0,09828225
∑ 15,0000 X = 2,5000
0,9560 Y = 0,1593
3,4605 55,0000 0,21794104
a =
( )
X nX n Y X XY / / 2 2
∑
∑
∑
∑ ∑
− − =(
)(
)
(
15,0000)
/6 0000 , 55 6 / 9560 , 0 0000 , 15 4605 , 13 2 − − = 0,0612Y = a X + b
b = Y − aX
= 0,1593 – (0,0612)(2,5000)
= 0,0063
Maka persamaan garis regresinya adalah: Y = 0,0612X + 0,0063
=
(
)(
)
(
)
{
55,0000 15,0000 /6}
{
0,21794104(
0,9560)
/6}
6 / 9560 , 0 0000 , 15 4605 , 3 2 2 − − − = 0715 , 1 0705 , 1= 0,9990
Lampiran 7. Hasil Analisis Kadar Besi dan Kalsium dalam Sampel 1. Hasil Analisis Kadar Besi dalam Kacang Hijau dengan Kulit Biji
Sampel Berat Sampel (g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100g)
1 50,190 0,2583 8,0662 5,0223
2 50,129 0,2316 7,2239 4,5033
3 50,191 0,2561 7,9968 4,9789
4 50,145 02647 8,2681 5,1526
5 50,193 0,2224 6,9338 4,3543
6 50,196 0,2646 8,2649 5,1457
2.Hasil Analisis Kadar Besi dalam Kacang Hijau tanpa Kulit Biji Sampel Berat Sampel
(g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100g)
1 50,154 0,1776 5,5205 3,4397
2 50,158 0,1935 6,0221 3,7519
3 50,156 0,1851 5,7571 3,5869
4 50,151 0,1435 4,4448 2,7696
5 50,152 0,1794 5,5836 3,4792
6 50,155 0,1752 5,4448 3,3925
3. Hasil Analisis Kadar Kalsium dalam Kacang Hijau dengan Kulit Biji Sampel Berat Sampel
(g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100g)
1 50,190 0,1616 2,5376 63,1998
2 50,129 0,1546 2,4232 60,4241
3 50,191 0,1590 2,4951 62,1401
4 50,145 0,1606 2,5212 62,8477
5 50,193 0,1456 2,2761 56,6837
6 50,196 0,1130 1,7435 43,4173
4.Hasil Analisis Kadar Kalsium dalam Kacang Hijau tanpa Kulit Biji Sampel Berat Sampel
(g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/100g)
1 50,154 0,0917 1,3954 6,9556
2 50,158 0,0890 1,3513 6,7352
3 50,156 0,0907 1,3791 6,8741
4 50,151 0,0906 1,3775 6,8668
5 50,152 0,0857 1,2974 6,4673
Lampiran 8. Contoh Perhitungan Kadar Besi dan Kalsium dalam Kacang Hijau dengan Kulit Biji
1. Contoh Perhitungan Kadar Kadar Besi
Berat sampel yang ditimbang = 50,190 gram
Absorbansi (Y) = 0,2583
Persamaan Regresi:Y= 0,0317X + 0,0026
X = 0317 , 0 0026 , 0 2583 , 0 −
= 8,0662 µg/ml
Konsentrasi Besi = 8,0662 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras (µg/g) Logam
Kadar =
= g mlx mlx g 190 , 50 ) 25 , 6 ( 50 / µ 0662 , 8
= 50,2232 µg/g
= 5,0223 mg/100g
2. Contoh Perhitungan Kadar Kadar Kalsium
Berat sampel yang ditimbang = 50,190 gram
Absorbansi (Y) = 0,1616
Persamaan Regresi:Y= 0,06612X + 0,0063
X = 0612 , 0 0063 , 0 1616 , 0 −
= 2,5376 µg/ml
Konsentrasi Kalsium= 2,5376 µg/ml
(g) Sampel Berat n pengencera Faktor x (ml) Volume x (µg/ml) i Konsentras (µg/g) Logam
Kadar =
= g mlx mlx g 190 , 50 ) 250 ( 50 / µ 5376 , 2
= 631,9984 µg/g
Lampiran 9. Perhitungan Statistik Kadar Besi dalam Sampel
1. Perhitungan Statistik Kadar Besi dalam Kacang Hijau dengan Kulit Biji
No. Xi
Kadar (mg/100g) (Xi-X ) (Xi-X )
2
1. 5,0223 0,1690 0,02855762
2. 4,5033 -0,3500 0,12248670
3. 4,9789 0,1257 0,01579546
4. 5,1526 0,2993 0,08959246
5. 4,3543 -0,5363 0,28765845
6. 5,1457 0,2921 0,08531832
∑ 29,1196
X= 4,8533
0,062940902
SD =
( )
1 -n X -