PERTUMBUHAN DAN REPRODUKSI INDUK IKAN
MAANVIS DISUNTIK HORMON PERTUMBUHAN
REKOMBINAN IKAN KERAPU KERTANG DOSIS BERBEDA
PRASSETYO DWI DHANY WIJAYA
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Pertumbuhan dan Reproduksi Induk Ikan Maanvis Disuntik Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang Dosis Berbeda” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
PRASSETYO DWI DHANY WIJAYA. Pertumbuhan dan Reproduksi Induk Ikan Maanvis Disuntik Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang Dosis Berbeda. Dibimbing oleh MUHAMMAD ZAIRIN JUNIOR dan ALIMUDDIN.
Ikan maanvis (Pterophyllum scalare) merupakan ikan hias yang digemari oleh penghobi, namun ukuran jual yang kecil dan tidak ideal membuat pasar tidak berkembang. Tujuan penelitian ini adalah untuk menguji pengaruh penyuntikan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) terhadap pertumbuhan dan reproduksi induk ikan maanvis. Ikan disuntik rElGH dengan mm) tertinggi, sedangkan pada induk betina (5.7±2.18 mm) diperoleh pada dosis 0.05 µg/g. Frekuensi pemijahan tertinggi terdapat pada perlakuan kontrol. Dosis penyuntikan menunjukkan hubungan negatif dengan frekuensi pemijahan, sementara pada parameter interval pemijahan, derajat penetasan, dan kelangsungan hidup menunjukkan hasil yang beragam.
Kata kunci: Hormon pertumbuhan rekombinan, pertumbuhan, Pterophyllum scalare, reproduksi
ABSTRACT
PRASSETYO DWI DHANY WIJAYA . Growth and Reproduction of Maanvis Broodstock Injected with Different Doses of Recombinant Giant Grouper Growth Hormone. Supervised by MUHAMMAD ZAIRIN JUNIOR and ALIMUDDIN .
Maanvis (Pterophyllum scalare) is an ornamental fish favored by fish lover, however the small market size makes the market is not growing. The purpose of this study was to examine the effect of recombinant giant grouper growth hormone (rElGH) injection on the growth and reproduction of the maanvis broodstok. Broodstok was injected with rElGH at a dose of 0.05, 0.5, 5.0, and 50 µg/g body weights. As control, fish was injected with 100 mL phosphate buffer saline. Results showed that highest absolute body weight growth in male (6.2±2.63 g) and female (3.8±1.71 g) was obtained in injection dose of 0.5 µg/g. In the male broodstock injected with rElGH at dose of 0.5 µg/g had the highest absolute growth of standard body length (4.6±1.92 mm), while the female (5.7±7.218 mm) was at dose of 0.05 µg/g. Spawning frequency was highest in the control treatment. Injection dose showed a negative correlation with the frequency of spawning, while at the interval spawning, hatching and survival rates showed various results.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
PERTUMBUHAN DAN REPRODUKSI INDUK IKAN
MAANVIS DISUNTIK HORMON PERTUMBUHAN
REKOMBINAN IKAN KERAPU KERTANG DOSIS BERBEDA
PRASSETYO DWI DHANY WIJAYA
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji syukur kepada Allah SWT yang telah melimpahkan rahmat, hidayah dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pertumbuhan dan Reproduksi Induk Ikan Maanvis Disuntik Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang Dosis Berbeda”. Penelitian ini dilaksanakan pada bulan Desember 2014 sampai Maret 2015 di Kolam Percobaan Babakan, Dramaga, Bogor.
Penulis mengucapkan terima kasih kepada Bapak Prof. Dr. Ir. Muhammad Zairin Jr, M.Sc dan Dr. Alimuddin, S.Pi, M.Sc selaku dosen pembimbing. Orang tua yang selalu mendoakan dan memberikan dukungan baik dukungan moral maupun materil selama menempuh pendidikan. Kakak dan adik penulis, Mas Ade dan Santi yang selalu mendoakan. Kepada teman seperjuangan BDP 48, terima kasih untuk semangat dan kenangan yang diberikan.
Semoga skripsi ini bermanfaat bagi para pembaca.
DAFTAR ISI
DAFTAR TABEL... vi
DAFTAR GAMBAR... vi
DAFTAR LAMPIRAN...vii
PENDAHULUAN...1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE... 2
Rancangan Percobaan ... 2
Prosedur Penelitian ... 2
Parameter Pengamatan ... 4
HASIL DAN PEMBAHASAN... 6
Hasil ... 6
Pembahasan ... 14
KESIMPULAN DAN SARAN... 16
Kesimpulan ... 16
Saran ... 16
DAFTAR PUSTAKA... 16
LAMPIRAN... 18
DAFTAR TABEL
1 Kisaran kualitas air pemeliharaan ikan maanvis (Pterophyllum scalare) ... 3 2 Kelangsungan hidup dan pemijahan ikan maanvis (Pterophyllum
scalare) selama 2 bulan pertama pengamatan. ... 6 3 Jumlah telur, daya tetas dan kelangsungan hidup larva pada tiap
perlakuan ikan maanvis (Pterophyllum scalare) selama pemeliharaan. ... 12
DAFTAR GAMBAR
1 Sketsa induk ikan maanvis. Panjang baku (a); tinggi badan (b); lebar mata (c); lebar badan (d). ... 5 2 Bobot mutlak induk jantan dengan perlakuan dosis rElGH 0.05 µg/g (A),
dosis rElGH 0.5 µg/g (B), dosis rElGH 5 µg/g (C), dosis rElGH 50 µg/g (D) dan dosis 100 µl PBS (K). ... 7 3 Bobot mutlak induk betina dengan perlakuan dosis rElGH 0.05 µg/g (A),
dosis rElGH 0.5 µg/g (B), dosis rElGH 5 µg/g (C), dosis rElGH 50 µg/g (D) dan dosis 100 µl PBS (K). ... 7 4 Panjang baku mutlak induk jantan dengan perlakuan dosis rElGH 0.05
µg/g (A), dosis rElGH 0.5 µg/g (B), dosis rElGH 5 µg/g (C), dosis 8 Panjang baku mutlak induk betina dengan perlakuan dosis rElGH 0.05
µg/g (A), dosis rElGH 0.5 µg/g (B), dosis rElGH 5 µg/g (C), dosis rElGH 50 µg/g (D) dan dosis 100 µl PBS (K). ... 10 9 Tinggi badan mutlak induk betina dengan perlakuan dosis rElGH 0.05
2
12 Panjang baku larva ikan maanvis berumur 21 hari dengan perlakuan dosis rElGH 0.05 µg/g bobot (A), dosis rElGH 0.5 µg/g bobot (B), dosis rElGH 5 µg/g bobot (C), dosis rElGH 50 µg/g bobot (D) dan dosis 100 µl PBS (K). ... 13 13 Foto induk ikan maanvis jantan (a) dan betina (b) pada semua perlakuan
dan ulangan. Dari atas ke bawah dosis 0.05, 0.5, 5.0 µg/g, dan 100 mL PBS. ... 13
DAFTAR LAMPIRAN
1 Pelaksanaan kegiatan sampling dan penyuntikan induk ikan maanvis (Pterophyllum scalare) ... 19 2 Inkubasi, penetasan telur dan pemeliharaan larva ikan maanvis
PENDAHULUAN
Latar Belakang
Ikan maanvis atau angelfish merupakan ikan hias yang digemari oleh kalangan penghobis. Ikan ini berasal dari sungai Amazon dan memiliki kelebihan pada warna dan gerakannya yang anggun. Ikan maanvis terdiri atas tiga jenis, yaitu Pterophyllum scalare, Pterophyllum dumerilii dan Pterophyllum altum (Lingga dan Susanto 1989). Varietas ikan maanvis banyak jumlahnya, hal ini disebabkan karena hasil perkawinan secara inbreeding dan interbreeding (Susanto 1989). Selain itu, munculnya corak warna baru disebabkan oleh mutasi pada pigmen warna seperti black lace, black ghost, blushing, smokey, marbel, chocolate, zebra, dan gold (Norton 1982).
Maanvis di pasaran dijual berukuran kecil yaitu 2-5 cm serta belum mencapai ukuran ideal. Hal ini membuat pasar tidak berkembang. Maanvis dengan ukuran besar berpotensi membuat permintaan pasar juga meningkat. Ukuran yang besar membuat ikan maanvis dapat dinikmati keindahan warna dan gerakannya di akuarium. Menurut Mills (1986) kriteria ideal ikan maanvis dicapai bila panjang total tubuh 11 cm, bentuk ikan baik, dan tubuh tebal (berisi). Sirip tegak, lurus serta tidak robek. Pola warna pada tubuh dan sirip baik serta jelas. Salah satu teknologi yang telah diterapkan adalah penggunaan hormon pertumbuhan. Penggunaan hormon pertumbuhan diharapkan meningkatkan laju pertumbuhan pada ikan maanvis yang pertumbuhannya mulai melambat serta belum mencapai ukuran ideal. Selain itu, akan menghemat waktu dan biaya pemeliharaan.
Hormon pertumbuhan atau GH merupakan polipeptida esensial yang berfungsi untuk pertumbuhan dan perkembangan organisme secara normal (Anathy et al. 2001), namun ketersediaannya sedikit dan terbatas (Tsai et al. 1997). Selain itu, hormon pertumbuhan mempengaruhi juga osmoregulasi dan reproduksi (Sakamoto et al. 1993). Berdasarkan pendapat Van Der Kraak et al. (1990) hormon pertumbuhan memiliki keterkaitan dalam regulasi fungsi ovarium pada ikan mas koki (Carrasius auratus). Hormon pertumbuhan rekombinan atau rGH dapat menjadi solusi, karena rGH menunjukkan fungsi mirip GH dalam ikan (Moriyama and Kawauchi 1990). Rekombinan GH diproduksi dengan menggunakan bakteri, ragi, dan sel sebagai media perbanyakan (Sekine et al. 1985).
2
ikan mas dengan bobot rerata 5.15 gram, penyuntikan seminggu sekali selama empat minggu dengan dosis 1 µg rElGH ikan mas dalam 10 µl PBS/g bobot tubuh pertumbuhannya meningkatkan sebesar 106.56% (Utomo 2010). Penelitian sebelumnya juga menunjukkan ada keterkaitan GH dengan reproduksi. Berdasarkan percobaan Antharest (2013) ikan sidat (Anguilla bicolor) yang disuntik kombinasi hormon pregnant mare serum gonadotropin (PMSG) 20 IU/kg+ antidopamin 100 ppm/kg+ rGH 10 µg/kg secara intramuskuler sebanyak lima kali dengan interval tujuh hari sekali, dapat menginduksi maturasi ikan sidat. Pada penelitian ini rElGH disuntikkan pada ikan maanvis dengan dosis berbeda.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efek penyuntikan hormon pertumbuhan rekombinan ikan kerapu kertang dosis berbeda terhadap pertumbuhan dan reproduksi induk maanvis.
METODE
Rancangan Percobaan
Penelitian ini menggunakan rancangan acak lengkap (RAL) dengan metode eksperimental. Perlakuan berupa penyuntikan induk ikan maanvis dengan hormon pertumbuhan rekombinan dari ikan kerapu kertang (rElGH), terdiri atas 5 dosis berbeda dan tiga kali ulangan. Setiap ulangan digunakan satu pasang induk maanvis. Perlakuan tersebut adalah :
Perlakuan A : Ikan disuntik rElGH dosis 0.05 µg/g bobot tubuh Perlakuan B : Ikan disuntik rElGH dosis 0.5 µg/g bobot tubuh Perlakuan C : Ikan disuntik rElGH dosis 5 µg/g bobot tubuh Perlakuan D : Ikan disuntik rElGH dosis 50 µg/g bobot tubuh Perlakuan K : Ikan disuntik 100 µl bufer fosfat salin (PBS)
Prosedur Penelitian Persiapan wadah
Wadah penelitian berupa akuarium berukuran 50 cm 60 cm 50 cm dan baskom berdiameter 30 cm dengan volume 8 liter (Lampiran 1). Wadah terlebih dahulu dibersihkan dan diperiksa untuk menghindari adanya kebocoran selama pemeliharaan. Selanjutnya dilakukan pemasangan instalasi aerasi dan diletakkan substrat berupa setengah lingkaran pipa paralon ukuran 2¼ inci dengan tinggi 15 cm dalam akuarium. Akuarium diisi air sampai ketinggian 30 cm.
Ikan Uji
3
gram/ekor dengan panjang baku 54.4±3.92 mm. Sepasang induk maanvis ditempatkan pada sebuah akuarium untuk setiap ulangan. Selanjutnya ikan maanvis dipelihara selama tiga minggu untuk aklimatisasi sebelum penelitian dimulai. Pemijahan dilakukan secara alami dengan perbandingan induk jantan dan betina 1:1. Pemijahan diamati selama dua bulan pertama.
Manajemen pemberian pakan
Pemberian pakan induk ikan maanvis dilakukan secara ad libitum (pakan selalu tersedia) dengan pemberian cacing sutra yang terlebih dahulu dicuci dengan air mengalir sampai bersih. Pemberian pakan larva ikan maanvis secara at satiation (sekenyangnya) dengan naupli artemia, dua kali sehari pada pukul 08.00 dan 15.00 WIB.
Manajemen kualitas air
Pengelolaan kualitas air pada akuarium pemeliharaan induk maanvis dilakukan dengan penyifonan dan pergantian air sebanyak 10% per hari dan 30% setiap dua minggu sekali. Penyifonan dan pergantian air larva dilakukan setiap hari sebanyak 10%. Kandungan oksigen terlarut, suhu, pH, nitrit dan amonia diukur sebelum dan sesudah pergantian air, sedangkan pengukuran suhu dilakukan setiap hari pada pukul 07.00 dan 17.00 WIB (Tabel 1).
Tabel 1 Kisaran kualitas air pemeliharaan ikan maanvis (Pterophyllum scalare)
Parameter Satuan Pengukuran Referensi
Suhu °C 25-26 23-28 (Elena et al. 2010)
pH Unit 7.10-7.98 7-9 (Elena et al. 2010)
DO mg/L 4.50-8.50 > 3 (Elena et al. 2010)
Amonia mg/L 0.001-0.010 <0.1 (Boyd 2001)
Penyuntikan ikan Maanvis
Penyuntikan hormon rElGH dilakukan secara intramuskuler yaitu bagian otot punggung (Lampiran 1). Penyuntikan dilakukan seminggu sekali sebanyak empat kali yaitu pada minggu ke-4 sampai minggu ke-7. Penyuntikan menggunakan syringe ukuran 1 ml. Sehari sebelum penyuntikan ikan dipuasakan, punyuntikan dilakukan pada pukul 16.00 WIB.
Sampling ikan
Pengukuran panjang baku, tinggi badan, lebar mata dan lebar badan (Gambar 1) serta bobot tubuh dilakukan tiga hari sebelum penyuntikan.
Anestesi MS-222 (tricaine methanesulfonate)
4
Inkubasi dan penetasan
Telur dipindahkan bersama substrat paralon pada baskom berisi air 8 liter (Lampiran 1). Media air yang digunakan berasal dari media air induk yang ditambahkan biru metilen sebanyak 2 ppm untuk mencegah timbulnya jamur (Herwig et al. 1979). Daya tetas diamati tiga hari setelah terjadi pemijahan, kelangsungan hidup larva pada umur tujuh hari, dan pengamatan panjang baku larva yang berumur 21 hari.
Parameter Pengamatan Kelangsungan Hidup
Kelangsungan hidup (KH) merupakan persentase ikan yang hidup pada akhir penelitian dari jumlah ikan awal pemeliharaan. Pengamatan KH pada induk ikan maanvis selama penelitian dan larva yang berumur tujuh hari. KH dapat dihitung dengan menggunakan rumus:
KH (%) = NoNt 100 Keterangan: KH = kelangsungan hidup (%)
Nt = jumlah individu pada akhir perlakuan (ekor) No = jumlah individu pada awal pemeliharaan (ekor)
Panjang dan Tinggi Ikan
Panjang baku pengukuran dari ujung kepala terdepan sampai pangkal sirip ekor dan tinggi badan diukur dari tempat tertinggi yaitu antara sirip dorsal terpanjang dan permulaan sirip anal (Affandi et al. 1992). Tinggi badan ikan diukur dari tempat tertinggi yaitu diantara bagian ventral dan bagian dorsal (Saanin 1984). Pengamatan panjang baku dan tinggi badan pada induk ikan maanvis (Gambar 1), sedangkan larva berumur 21 hari hanya diamati panjang bakunya. Pertumbuhan panjang atau tinggi diukur dengan rumus:
P= Pt – Po
Keterangan: P = pertumbuhan panjang atau tinggi (mm) Pt = panjang atau tinggi ikan pada hari ke-t (mm) Po = panjang atau tinggi ikan pada hari ke-o (mm)
Lebar mata
Panjang garis menengah rongga mata atau diameter mata (Affandi et al. 1992). Pengukuran dilakukan pada induk ikan maanvis (Gambar 1).
Lebar badan
5
Gambar 1 Sketsa induk ikan maanvis. Panjang baku (a); tinggi badan (b); lebar mata (c); lebar badan (d).
Frekuensi pijah
Frekuensi pijah diamati selama dua bulan pertama pada minggu ke-4 sampai minggu ke-11 pemeliharaan induk maanvis. Dalam dua bulan pengamatan terjadi berapa kali pemijahan.
Interval pijah
Interval pijah diamati selama dua bulan pertama pemeliharaan induk maanvis, yaitu jarak waktu antar pemijahan.
Jumlah telur yang diovulasi
Jumlah telur yang diovulasikan oleh induk setiap pemijahan. Perhitungan dilakukan dengan menghitung langsung jumlah telur yang menempel pada subtrat pipa paralon (Lampiran 1).
Derajat penetasan (hatching rate/HR)
Daya tetas adalah persentase jumlah telur yang menetas dibagi dengan dengan jumlah telur terbuahi. Pengukuran HR dilakukan pada hari ketiga sedangkan perhitungan jumlah telur terbuahi dilakukan pada hari kedua setelah telur diovulasi. HR diukur dengan menggunakan rumus berikut:
HR (%) = ∑telur menetes
∑telur terbuahi 100
Bobot Mutlak
Pengukuran bobot tubuh digunakan untuk menghitung pertambahan bobot ikan selama pemeliharaan (Zonneveld et al. 1991). Bobot mutlak dihitung dengan rumus berikut:
Wm = Wt – Wo Keterangan: Wm = Bobot mutlak (g)
6
Analisis data
Data yang diperoleh diolah menggunakan Microsoft Excel 2013 dan dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil Frekuensi dan Interval Pijah
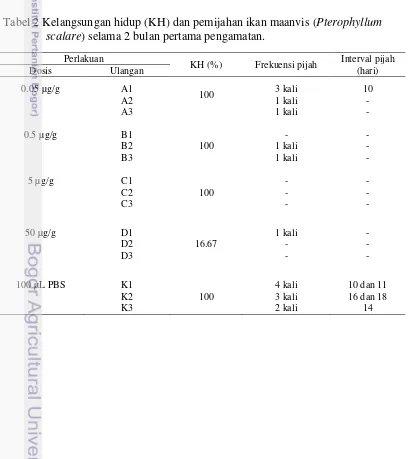
Kelangsungan hidup dan frekuensi pijah induk ikan maanvis setelah empat kali disuntik dengan rElGH disajikan pada Tabel 2. Kelangsungan hidup terendah diperoleh pada perlakuan D (16.67%). Frekuensi pijah ikan perlakuan A adalah 1– 3 kali; perlakuan B 0–1 kali pemijahan; perlakuan C tidak terjadi pemijahan; dan perlakuan D terdapat sekali pemijahan. Sementara itu, ikan perlakuan K terjadi 2-4 kali pemijahan. Pada perlakuan A interval pijah adalah sepuluh hari, interval pijah ikan perlakuan kontrol rata-rata adalah empat belas hari.
Tabel 2 Kelangsungan hidup (KH) dan pemijahan ikan maanvis (Pterophyllum scalare) selama 2 bulan pertama pengamatan.
7
Bobot tubuh induk maanvis Induk Jantan
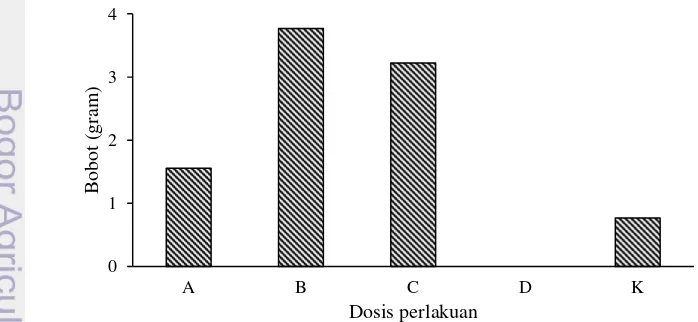
Bobot mutlak induk jantan yang diukur pada minggu ke-11 diperoleh nilai tertinggi pada perlakuan B (6.2±2.63 g) dan terendah pada perlakuan K (0.8±0.28 g). Pada perlakuan D tidak diperoleh nilai bobot mutlak dikarenakan ikan sudah mati terlebih dahulu (Gambar 2).
Induk Betina
Bobot mutlak induk betina yang diukur pada minggu ke-11 diperoleh nilai tertinggi pada perlakuan B (3.8±1.71 g) dan terendah pada perlakuan K (0.8±0.59 g). Pada perlakuan D tidak diperoleh nilai bobot mutlak dikarenakan ikan sudah mati terlebih dahulu (Gambar 3).
8
Parameter morfometrik induk maanvis Panjang baku induk jantan
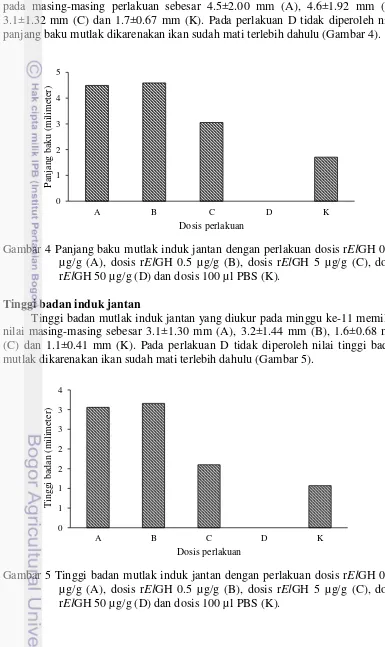
Nilai panjang baku mutlak induk jantan yang diukur pada minggu ke-11 pada masing-masing perlakuan sebesar 4.5±2.00 mm (A), 4.6±1.92 mm (B), 3.1±1.32 mm (C) dan 1.7±0.67 mm (K). Pada perlakuan D tidak diperoleh nilai panjang baku mutlak dikarenakan ikan sudah mati terlebih dahulu (Gambar 4).
Tinggi badan induk jantan
Tinggi badan mutlak induk jantan yang diukur pada minggu ke-11 memiliki nilai masing-masing sebesar 3.1±1.30 mm (A), 3.2±1.44 mm (B), 1.6±0.68 mm (C) dan 1.1±0.41 mm (K). Pada perlakuan D tidak diperoleh nilai tinggi badan mutlak dikarenakan ikan sudah mati terlebih dahulu (Gambar 5).
Gambar 4 Panjang baku mutlak induk jantan dengan perlakuan dosis rElGH 0.05 µg/g (A), dosis rElGH 0.5 µg/g (B), dosis rElGH 5 µg/g (C), dosis rElGH 50 µg/g (D) dan dosis 100 µl PBS (K).
9
Lebar mata induk jantan
Lebar mata induk jantan selama tujuh minggu pengamatan cenderung tetap. Lebar mata sampling minggu kesebelas perlakuan A sebesar 6.9±0.13 mm, perlakuan B 6.8±0.15 mm, perlakuan C 6.9±0.15 mm dan perlakuan K 7.3±0.02 mm (Gambar 6).
Lebar badan induk jantan
Sampling minggu keenam lebar badan induk jantan cenderung menurun pada perlakuan A, B dan C kecuali perlakuan K cenderung stabil. Lebar badan minggu kesebelas perlakuan A sebesar 8.4±0.41 mm, perlakuan B 8.8±0.39 mm, perlakuan C 8.0±0.46 mm dan perlakuan K 8.7±0.28 mm (Gambar 7).
.
10
Panjang baku induk betina
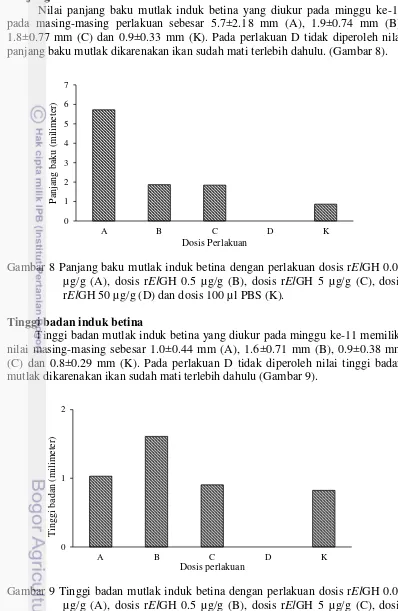
Nilai panjang baku mutlak induk betina yang diukur pada minggu ke-11 pada masing-masing perlakuan sebesar 5.7±2.18 mm (A), 1.9±0.74 mm (B), 1.8±0.77 mm (C) dan 0.9±0.33 mm (K). Pada perlakuan D tidak diperoleh nilai panjang baku mutlak dikarenakan ikan sudah mati terlebih dahulu. (Gambar 8).
Tinggi badan induk betina
Tinggi badan mutlak induk betina yang diukur pada minggu ke-11 memiliki nilai masing-masing sebesar 1.0±0.44 mm (A), 1.6±0.71 mm (B), 0.9±0.38 mm (C) dan 0.8±0.29 mm (K). Pada perlakuan D tidak diperoleh nilai tinggi badan mutlak dikarenakan ikan sudah mati terlebih dahulu (Gambar 9).
0
Gambar 8 Panjang baku mutlak induk betina dengan perlakuan dosis rElGH 0.05 µg/g (A), dosis rElGH 0.5 µg/g (B), dosis rElGH 5 µg/g (C), dosis rElGH 50 µg/g (D) dan dosis 100 µl PBS (K).
11
Lebar mata induk betina
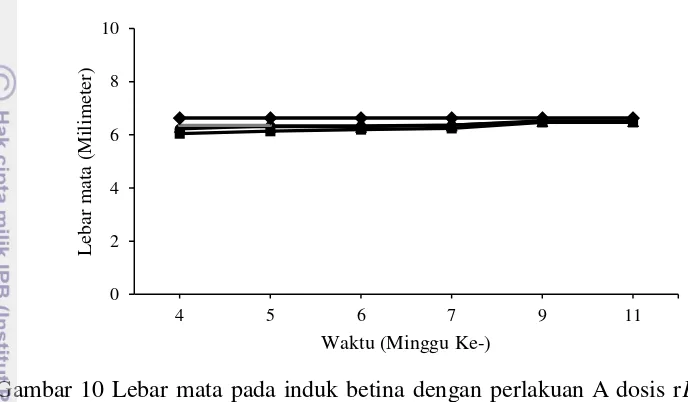
Lebar mata induk betina selama tujuh minggu sampling cenderung tetap. Lebar mata sampling minggu kesebelas perlakuan A sebesar 6.5±0.11 mm, perlakuan B 6.5±0.18 mm, perlakuan C 6.5±0.10 mm dan perlakuan K 6.6±0.00 mm (Gambar 10).
Lebar badan induk betina
Sampling minggu kelima lebar badan induk betina cenderung menurun pada perlakuan A, B dan C sedangkan perlakuan K cenderung stabil. Lebar badan minggu kesebelas perlakuan A sebesar 7.0±0.56 mm, perlakuan B 8.0±0.59 mm, perlakuan C 7.6±0.48 mm dan perlakuan K 8.1±0.29 mm (Gambar 11).
0
Gambar 10 Lebar mata pada induk betina dengan perlakuan A dosis rElGH 0.05 µg/g bobot (▲), B dosis rElGH 0.5 µg/g bobot (■), C dosis rElGH 5 µg/g bobot (●), Ddosis rElGH 50 µg/g bobot (−) dan K dosis 100 µl PBS (♦).
12
Parameter telur induk maanvis
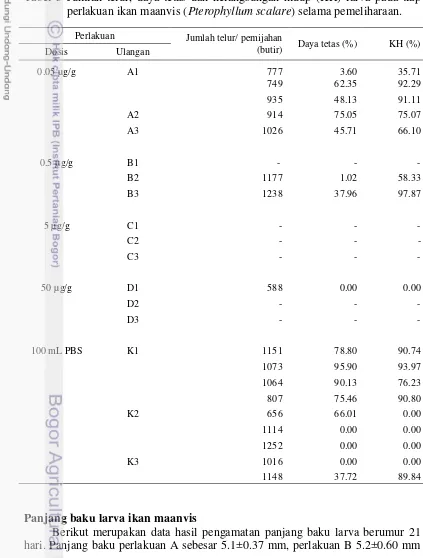
Hasil pengamatan jumlah telur, daya tetas dan kelangsungan hidup larva tiap perlakuan disajikan pada Tabel 3. Pada induk maanvis yang diberi perlakuan maupun tidak, nilai daya tetas, kelangsungan hidup serta jumlah telur yang dihasilkan nilainya beragam tiap perlakuan (Tabel 3).
Tabel 3 Jumlah telur, daya tetas dan kelangsungan hidup (KH) larva pada tiap perlakuan ikan maanvis (Pterophyllum scalare) selama pemeliharaan.
Perlakuan Jumlah telur/ pemijahan
(butir) Daya tetas (%) KH (%)
Panjang baku larva ikan maanvis
13
dan perlakuan K 5.1±0.32 mm (Gambar 12). Pada perlakuan C dan D tidak terdapat pemijahan sehingga tidak diperoleh data panjang baku larva.
Induk Ikan maanvis
14
Pembahasan
Hasil penelitian menunjukkan bahwa penyuntikan dengan rElGH berpengaruh terhadap KH induk ikan maanvis. Penyuntikan dengan dosis 50 µg/g bobot memiliki nilai KH terendah sebesar 16.67% dibandingkan dengan dosis lain 0.05 µg/g bobot, 0.5 µg/g bobot, 5 µg/g bobot dan kontrol yang masing-masing sebesar 100%. Hal ini diduga karena pengaruh pemberian rGH dengan dosis yang terlampau tinggi. Menurut Debnanth (2010) pemberian rGH dengan dosis rendah pada ikan tidak akan memberikan efek positif pada pertumbuhan, sedangkan pemberian dengan dosis yang terlalu tinggi akan memberikan efek negatif dalam regulasinya secara hormonal terhadap ikan.
Pemijahan terjadi pada semua perlakuan kecuali perlakuan C penyuntikan dengan dosis 5 µg/g bobot. Pemijahan lebih dari satu kali terjadi pada perlakuan A dan K yaitu penyuntikan dengan dosis 0.05 µg/g bobot dan kontrol. Frekuensi pemijahan tergantung dari kondisi kesehatan induk ikan maanvis. Interval pemijahan selain dipengaruhi oleh kondisi kesehatan ikan juga dipengaruhi oleh adanya ganguan dari luar yang mengakibatkan penundaan proses pemijahan oleh induk maanvis. Berdasarkan penelitian Muhammad (2014) pemberian dengan dosis 3.00 mg rElGH/kg pakan pada calon induk nila sultana dapat mempercepat pematangan gonad. Semakin tinggi dosis penyuntikan mengakibatkan semakin jarangnya pemijahan terjadi. Pemberian rGH yang tidak tepat akan mengakibatkan umpan balik negatif pada kelenjar untuk tidak menyekresikan GH (Moriyama and Kawauchi 2001). Pada penyuntikan dengan dosis 0.5 µg/g bobot masih terdapat pemijahan namun tidak sebanyak pada perlakuan penyuntikan 0.05 µg/g bobot. Pada penyuntikan dengan dosis 0.5 µg/g bobot diduga sumber energi dari pakan lebih diarahkan untuk pertumbuhan somatik dibandingkan untuk perkembangan gonad. Berdasarkan penelitian NRC (1981) Energi dalam pakan yang dikonsumsi (IE) digunakan untuk energi tercerna (DE), energi untuk metabolisme (ME), energi bersih (NE) dan energi yang dipulihkan (RE). Aliran energi yang digunakan untuk keperluan pertumbuhan somatis dan reproduksi bertolak belakang. Pertumbuhan somatis yang baik akan menghambat reproduksi. Dari hasil penelitian terlihat bahwa penambahan bobot mutlak tidak berkorelasi positif dengan frekuensi pijah. Perbedaan pemijahan yang terjadi diduga karena ada kaitan antara hormon pertumbuhan dengan reproduksi. Sakamoto et al. (1993) menyatakan bahwa hormon pertumbuhan juga berpengaruh pada osmoregulasi dan reproduksi. Selanjutnya menurut Van Der Kraak et al. (1990), ada keterkaitan hormon pertumbuhan dengan regulasi fungsi ovarium pada ikan mas koki Carrasius auratus. Perlakuan D penyuntikan dengan dosis 50 µg/g bobot terjadi pemijahan sekali. Hal ini diduga karena induk betina telah matang gonad selama proses aklimatisasi atau sebelum dilakukan penyuntikan.
15
badan lebar mata baik pengukuran pada induk jantan dan betina cenderung tetap, hal ini diduga karena ukuran induk ikan maanvis yang telah mencapai maksimal. Perbedaan respons pertumbuhan terjadi karena tidak cocoknya jenis rGH yang diberikan terhadap reseptor hormon pertumbuhan yang terdapat di dalam tubuh ikan target. Makin tinggi kecocokan GH yang digunakan dengan GH alami suatu spesies, maka akan semakin tinggi kemampuan reseptor GH untuk mengenali rGH yang diberikan (Birzniece et al.2009).
Pertumbuhan dapat berupa pertambahan ukuran panjang atau bobot dalam satuan waktu, pertumbuhan pada ikan dipengaruhi oleh faktor internal dan eksternal. Faktor internal terdiri dari jenis kelamin, umur, parasit, penyakit dan genetik. Faktor eksternal meliputi sifat fisika dan kimia air serta makanan (Effendie 1985). Nilai bobot mutlak yang lebih tinggi pada induk yang diberi perlakuan dibandingkan kontrol menunjukkan adanya pengaruh penyuntikan dengan rElGH. Hal ini sesuai dengan pendapat Gill et al. (1985) pengujian ikan dengan hormon pertumbuhan dari luar (hormon homolog, rekombinan, mamalia, burung maupun ikan) menstimulasi pertumbuhan somatik. Selanjutnya berdasarkan Matty (1985), hormon pertumbuhan meningkatkan pertumbuhan melalui peningkatan nafsu makan, konversi pakan, sintesis protein, menurunkan ekskresi nitrogen, merangsang metabolisme dan oksidasi lemak, serta memacu sintesis dan pelepasan insulin. Pengukuran lebar induk maanvis baik jantan maupun betina mengalami penurunan pada pengukuran minggu ke tiga. Hal ini diperkirakan karena ikan mengalami stres yang berakibat pada penurunan lebar badan dan bobot tubuh. Menurut Pankhurst & Van Der Kraak (1997) stres pada ikan memberikan efek merugikan berupa penurunan pertumbuhan, disfungsi reproduksi serta timbulnya penyakit. Energi yang diperoleh dari pakan dialokasikan untuk kegiatan reproduksi sehingga tidak terjadi pertumbuhan. Menurut Enberg et al. (2008) energi yang diperoleh digunakan untuk pemeliharaan reproduksi, reproduksi, maupun untuk pertumbuhan bobot tubuh.
Jumlah telur yang diovulasikan oleh induk nilainya beragam, berdasarkan pengamatan pertambahan bobot induk berkorelasi positif terhadap jumlah telur yang dihasilkan tiap pemijahan. Jumlah telur yang dihasilkan dipengaruhi oleh faktor internal berupa genetik dan umur ikan. Faktor eksternal berupa suhu dan makanan (Effendie 1985). Pengamatan HR terdapat nilai yang rendah, hal ini dikarenakan tidak terbuahinya telur yang ditandai dengan warna putih pekat dan telur yang terkena jamur. Nilai HR rendah dapat juga dikarenakan kualitas dari induk jantan yang kurang bagus. Nilai KH larva beragam dan terdapat nilai yang kecil, selama pengamatan dijumpai banyak larva yang cacat (badan bengkok) serta sakit berupa kuning telur yang membengkak. Berdasarkan Hoar and Randall (1969), pada larva terdapat masa kritis. Masa kritis larva terdiri dari penetasan telur tergantung enzim yang dihasilkan oleh larva berupa kitinase, pertama kali pengambilan makanan dari luar setelah kuning telur habis, respirasi awal perkembangan filamen insang, pengisian gelembung renang, dan metamorfosa.
16
KESIMPULAN DAN SARAN
Kesimpulan
Penyuntikan rElGH dengan dosis 0.5 µg/g bobot tubuh pada induk jantan diperoleh bobot mutlak dan panjang baku mutlak tertinggi masing-masing sebesar 6.2±2.63 g dan 4.6±1.92 mm. Sementara penyuntikan rElGH pada induk betina dengan dosis yang sama memberikan bobot mutlak tertinggi sebesar 3.8±1.71 g. Panjang baku mutlak tertinggi pada induk betina diperoleh dengan penyuntikan rElGH dosis 0.05 µg/g bobot tubuh sebesar 5.7±2.18 mm.
Frekuensi pemijahan tertinggi terdapat pada perlakuan kontrol. Semakin tinggi dosis penyuntikan menunjukkan hubungan negatif dengan frekuensi pemijahan, sementara pada parameter interval pemijahan, HR dan KH menunjukkan hasil yang beragam.
Saran
Peningkatan bobot induk maanvis dapat dilakukan melalui penyuntikan rElGH dengan dosis 0.5 µg/gr bobot tubuh. Penelitian perlu dilakukan lebih lanjut terkait dosis optimal untuk reproduksi dan pertumbuhan pada induk maanvis.
DAFTAR PUSTAKA
Abbas BFI. 2013. Pertumbuhan benih ikan betok Anabas testudineus, Bloch yang disuntik hormon pertumbuhan rekombinan ikan kerapu kertang dengan dosis berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Acosta JR, Morales R, Morales M, Alonso M, Estrada MP. 2007. Pichia pastoris expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnol Lett 29:1671-1676.
Affandi R, DS Sjafei, MF Rahardjo, Sulistiono. 1992. Iktiologi. Suatu Pedoman Kerja Laboratorium. Departemen Pendidikan dan Kebudayaan. Direktorat Jenderal Pendidikan Tinggi. Pusat Antar Universitas Ilmu Hayat. Bogor (ID): Institut Pertanian Bogor.
Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faizal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal 5:11-17.
Anathy V, Venugopal T, Koteeswaran R, Pandian TJ, Mathavan S. 2001. Cloning, sequencing and expression of cDNA encoding growth hormone from Indian catfish Heteropneustes fossilis. J Bioscience 26:315-324.
Birzniece V, Sata A, Ho K. 2009. Growth hormone receptor modulators. Clin Endocrinol (Oxf) 71:715. PMID 19170715.
17
Debnanth S. 2010. A review on the physiology of insulin like growth factor-I (IGF-I) peptide in bony fishes and its phylogenetic correlation in 30 different taxa of 14 families of teleosts. Advances in Environmental Biology 5:31-52.
Effendie MI. 1985. Biologi Perikanan. Bagian I: Studi Natural History. Bogor (ID): Fakultas Perikanan. IPB. 43-72.
Elena M, Furnaris F, Tudor L, Simon V, Manascurta S, Mitranescu D, Gonciarov M. 2010. Correlation between water physical chemical parameters and survival rate of Pterophillum scalare aquarium fish. Lucrari Stiintifice Medicina Veterinara. XLIII Timisoara. 170-175.
Enberg K, Dunlop ES, Jergensen C. 2008. Ecological Models Fish Growth. Elsevier 1564-1572 p.
Gill JA, Sumpter JP, Donaldson EM, Dye HM, Souza L, Berg T, Wypych J, Langley K. 1985. Recombinant chicken and bovine growth hormones accelerate growth in aquacultured juvenile Pacific salmon Oncorhynchus kisutch.Biol/Technol 3:643-646.
Herwig N, Garibaldi L, Wolke RE. 1979. Hand-book of Drugs and Chemical Used in The Treatment of Fish Diseases. Charles C. Thomas, editor. USA: Springfield Illinois. 272 p.
Hoar WS, DJ. Randall. 1969. Fish Physiology. Vol III. Reproduction and Growth. USA: Academic Press New York and London. 96-100.
Lesmana I. 2010. Produksi dan bioaktivitas protein rekombinan hormon pertumbuhan dari tiga jenis ikan budidaya [tesis]. Bogor (ID) : Sekolah Pascasarjana, Institut Pertanian Bogor.
Lingga P, H. Susanto. 1989. Ikan Hias Air Tawar. Jakarta (ID): Penebar Swadaya. 236 hlm.
Matty AJ. 1985. Fish Endocrinology. Oregon (US): Croom Helm London and Sydney Timber Pr. 267 p.
Mills D. 1986. You & Your Aquarium. London: Dorling Kindersley Ltd. 288 p. Moriyama S, Kawauchi H. 1990. Growth stimulation of juvenile salmonids by
immersion in recombinant salmon growth hormone. Nipp Suis Gakk 56:31-34.
Moriyama S, Kawauchi H. 2001. Growth regulation by growth hormone and insulin-like growth factor-I in teleosts. Otsuchi Mar Sci. 26:23-27.
Muhammad. 2014. Respon pertumbuhan dan reproduksi ikan nila yang diberi hormon pertumbuhan rekomninan ikan kerapu kertang [tesis]. Bogor (ID) : Sekolah PascaSarjana, Institut Pertanian Bogor.
18
Promdonkoy B, Warit S, Panyim S. 2004. Production of a biologically active growth hormone from giant catfish Pangasianodon gigas in Escherichia coli. Biotechnology Lett 26:649-653.
Saanin H. 1984. Taksonomi dan Kunci Identifikasi Ikan. Jilid 1 dan 2. Jakarta (ID): Bina Cipta.
Sakamoto T, McCormick SD, Hirano T. 1993. Osmoregulatory actions of growth hormone and its mode of action in salmonids: a review. Fish Physiol Biol 11:155-164.
Sekine S, Mizukami T, Nishi T, Kuwana Y, Saito A, Sato M, Itoh S, Kawauchi H. 1985. Cloning and expression of cDNA for salmon growth hormone in Escherichia coli. Proc Nati Acad Sci USA 82:4306-4310.
Susanto H. 1989. Maanvis Edisi Pertama. Jakarta (ID): Penebar Swadaya. 110 hlm.
Tsai HJ, Hsih MH, Kuo JC. 1997. Escherichia coli produced fish growth hormone as a feed additive to enhance the growth of juvenile black seabream Acanthopagrus schlegeli. J Appl Ichthyol 13:78-82.
Utomo DSC. 2010. Produksi dan uji bioaktivitas protein rekombinan hormon pertumbuhan ikan mas [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Van Der Kraak G, Rossenblum PM, Peter RE. 1990. Growth hormone-dependent potentiation of gonadotropin-stimulated steroid production by ovarian follicles of the goldfish. General Comparative Endocrinology 79:233-239. Zonneveld NE, Huisman A, Boon JH. 1991. Prinsip-Prinsip Budidaya Ikan.
19
LAMPIRAN
Lampiran 1 Pelaksanaan kegiatan sampling dan penyuntikan induk ikan maanvis (Pterophyllum scalare)
Anestesi induk Penyuntikan
Sampling bobot Sampling lebar mata
Sampling panjang baku induk Sampling tinggi badan
20
Lampiran 2 Inkubasi, penetasan telur dan pemeliharaan larva ikan maanvis (Pterophyllum scalare)
Akuarium pemeliharaan induk Inkubasi dan penetasan telur
21
RIWAYAT HIDUP
Penulis merupakan anak kedua dari tiga bersaudara, putera pasangan Bapak Soesanto dan Ibu Hendari Rahmawati. Penulis dilahirkan pada tanggal 3 Februari 1993 di Wamena Provinsi Papua Barat.
Penulis menempuh pendidikan dasar pada tahun 1999 sampai dengan tahun 2001 di SD YAPIS 2 Jayapura (Papua Barat), kemudian pada tahun 2001 sampai dengan 2005 di SD Negeri 02 Taman Madiun (Jawa Timur). Penulis melanjutkan pendidikan ke sekolah menengah pertama pada tahun 2005 sampai 2008 di SMP Negeri 3 Nganjuk (Jawa Timur). Selanjutnya penulis melanjutkan pendidikan menengah atas pada tahun 2008 sampai dengan 2011 di SMAN 2 Nganjuk.
Penulis diterima sebagai mehasiswa Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan di Institut Pertanian Bogor pada tahun 2011 melalui jalur Seleksi Masuk Perguruan Tinggi Negeri (SMPTN) Tertulis. Selama menjadi mahasiswa, penulis aktif tergabung ke dalam berbagai kepanitiaan dan organisasi kemahasiswaan yaitu Himpunan Mahasiswa Akuakultur (Himakua) sebagai anggota divisikewirausahaan pada tahun 2013-2014.
Penulis melaksanakan Magang di BBAP Situbondo pada tahun 2012 dan pada tahun 2013 di BBPBL Lampung. Penulis juga melaksanakan Praktek Lapang di Desa Penyabangan, Kecamatan Gerokgak, Kabupaten Buleleng, Bali selama 1.5 bulan terhitung dari tanggal 23 Juni – 2 Agustus 2014.
Penulis untuk menyelesaikan pendidikan sarjana menyusun skripsi berjudul Pertumbuhan dan Reproduksi Induk Ikan Maanvis Disuntik Hormon Pertumbuhan Rekombinan Ikan Kerapu Kertang Dosis Berbeda.