2
LYDIA ULFAH HERODITA. Identifikasi Bovine Leukocyte Adhesion Deficiency (BLAD) pada Peternakan Sapi Friesian'Holstein (FH) di Jawa'Bali. Dibimbing oleh ACHMAD FARAJALLAH dan CECE SUMANTRI.
Bovine Leukocyte Adhesion Deficiency (BLAD) atau sindrom granulosipati merupakan penyakit genetik akibat adanya gen resesif autosomal pada sapi. Defisiensi ini pada sapi bersifat lethal atau mati dini. Mutasi titik pada nukleotida 383 gen CD18 menyebabkan defisiensi β2' integrin pada sel darah putih yang akan menyebabkan berkurangnya jumlah protein yang berperan dalam penempelan sel darah putih pada dinding vaskular untuk masuk kedalam jaringan yang terserang patogen. Kelainan ini bersifat resesif. Penelitian ini bertujuan mengetahui frekuensi alel subunit CD18 yang menyebabkan BLAD pada sapi Friesian'Holstein (FH) dari peternakan di Jawa'Bali menggunakan metode PCR'RFLP. Sebanyak 965 sampel telah diekstraksi dan diisolasi DNAnya. Ruas gen CD18 ekson 2 kromosom 1 berhasil diamplifikasi secara in vitro dengan panjang 106 pb. Analisis RFLP terhadap amplikon CD18 dengan enzim pemotong HaeIII menunjukkan hasil monomorfik, hal ini dapat diartikan bahwa 100% sampel yang telah diidentifikasi memiliki genotipe homozigot dominan ( ) sehingga frekuensi alel sebesar 1 dan alel sebesar 0. Deteksi dini kelainan genetik BLAD perlu dilakukan terutama pada sapi perah pejantan bibit unggul untuk mencegah penyebaran kelainan genetik tersebut.
LYDIA ULFAH HERODITA. Identification of Bovine Leukocyte Adhesion Deficiency (BLAD) on Holstein'Friesian cattle in Java ' Bali. Supervised by ACHMAD FARAJALLAH and CECE SUMANTRI.
9
%/% ,'%3%.0
Kelainan genetik merupakan salah satu kelainan pada ternak yang disebabkan oleh mutasi pada material genetik. Jika ekspresi mutan dalam keadaan heterozigot maka penampilannya tampak normal, keadaan itu disebut sebagai karier, sehingga homozigot resesif yang merugikan dapat muncul sewaktu'waktu jika terjadi perkawinan antar individu heterozigot. Kelainan genetik ini mudah menyebar, mengikuti inseminasi buatan.
Inseminasi buatan (IB) membutuhkan jantan unggul yang telah diseleksi, unggul dalam hal ini hanya berdasarkan karakter unggulnya, misal bobot badan atau produksi susu yang lama kelamaan seleksi hanya terjadi pada sifat unggulnya sehingga muncul mutasi. Mutasi terjadi pada satu alel dan bersifat resesif yang tertutupi oleh alel pasangannya yang normal. Setiap karakter dikendalikan oleh sepasang faktor (hukum mendel) yang memiliki hubungan dominan'resesif.
Pejantan'pejantan unggul hasil seleksi untuk inseminasi buatan (IB) ternyata ada diantaranya yang heterozigot yang menyebabkan bovine leukocyte adhesion deficiency (BLAD). Mutasi tersebut tidak tampak dan tidak mudah diketahui karena bersifat resesif yang tertutupi oleh sifat'sifat unggul lainnya. Inseminasi buatan dilakukan untuk menghindari terjadinya inbreeding dan untuk peningkatan mutu genetik sapi perah FH yaitu penyebaran gen'gen unggul yang memiliki kemampuan produksi susu dan ketahanan terhadap penyakit.
Pertama kali BLAD diketahui di Amerika Utara yang kemudian menyebar ke negara' negara lainnya (Patel et al. 2007). Diterangkan oleh Olson (2002) dalam Čítek and Bláhová (2004) bahwa pejantan yang diketahui berperan sebagai sumber gen mutan penyebab BLAD adalah pejantan unggul yang bernama Carlin'M Ivanhoe Bell berasal dari Amerika Utara. Bell mendapatkan warisan gen mutan dari kakeknya (Osborndale Ivanhoe, lahir 1952) yang mewariskannya ke induk jantan dari Bell (Pennstate Ivanhoe Star, lahir tahun1963).
Bovine Leukocyte Adhesion Deficiency (BLAD) atau sindrom granulosipati merupakan penyakit genetik akibat adanya gen resesif autosomal pada sapi (Paape et al. 2003). Defisiensi ini pada sapi bersifat lethal atau mati dini karena sel darah putih tidak mampu menempel pada dinding vaskular.
Kemampuan sel'sel darah putih menempel ke dinding vaskular salah satunya diatur oleh gen CD18.
Mutasi titik gen CD18 pada nukleotida 383 menyebabkan substitusi asam aspartat menjadi glisin pada asam amino 128 (D128G). Sapi yang memiliki gen homozigot resesif akan mengalami BLAD sedangkan sapi yang memiliki gen heterozigot akan menjadi karier. Mutasi lain juga terjadi pada nukleotida 775 namun bersifat silent (tidak berekspresi) (Čítek & Bláhová, 2004). Mutasi pada nukleotida 383 menyebabkan sapi penderita BLAD mengalami penurunan jumlah ekspresi β2 heterodimeric integrin pada permukaan sel darah putihnya (Čítek and Bláhová, 2004).
Integrin adalah molekul adhesi yang terlibat dalam mekanisme )%2, ,4)4 .,-/ *+)' keluar dari pembuluh darah ke dalam jaringan untuk membunuh patogen yang masuk ke dalam tubuh (Shuster et al., 1992). Tanpa β2 heterodimeric integrin, sel darah putih tidak mampu masuk ke jaringan tubuh dan menghancurkan patogen (Shuster et al. 1992). Sehingga patogen akan hidup terus dalam jaringan tubuh yang akan menyebabkan ternak mati dini ketika dilahirkan.
Sapi yang menderita BLAD mengalami kerusakan pada aktivitas kemotaktis dan pagositis sel'sel darah putihnya yaitu pada β2' integrin (Paape et al. 2003) sehingga mudah terinfeksi bakteri, luka lama sembuh, pertumbuhan terhambat (Nagahata et al. 1997; Ribeiro et al. 2000) dan seringkali mati pada usia muda (Perkins 2001). Hal tersebut bisa mempengaruhi kelangsungan peternakan sapi perah terutama di negara berkembang seperti Indonesia. Dampak nasional yang bisa dirasakan adalah turunnya produksi susu nasional.
Frekuensi ternak sapi FH yang bersifat sebagai karier BLAD di beberapa negara cukup tinggi. Di Indonesia sudah ada laporan penelitian mengenai BLAD di daerah Baturraden pada sapi FH (Muttaqin 2007). Penelitian mengenai kasus ini di Indonesia masih perlu dilakukan di daerah lain. Hal ini dikarenakan sumber sapi FH yang ada di Indonesia merupakan hasil impor dari luar yang sangat terbuka sekali peluang adanya gen mutan penyebab BLAD.
-&-%.
10
%3/- %. ,$2%/
Penelitian dilaksanakan sejak bulan Desember 2008 hingga Mei 2009 di Laboratorium Fungsi Hayati dan Perilaku Hewan Departemen Biologi, FMIPA ' IPB.
%#%.
Sampel darah sapi perah FH yang digunakan berasal dari pusat pembibitan pemerintah dan peternakan sapi perah rakyat sebanyak 965 sampel.
Sampel yang berasal dari pusat pembibitan pemerintah meliputi 5 lokasi yaitu Balai Besar Inseminasi Buatan (BBIB) Singosari – Jawa Timur (32)2, Balai Inseminasi Buatan (BIB) Lembang – Jawa Barat (30)1, Balai Pembibitan Ternak Unggul (BPTU) Baturraden – Jawa Tengah (97)1, Balai Peternakan Fakultas Peternakan (FAPET – IPB) – Jawa Barat (17) 2, Ngantang – Jawa Timur (47)2, Boyolali – Jawa Tengah (49)2, Koperasi Peternakan Susu Bandung Utara (KPSBU) Cilumber – Jawa Barat (98)2, Yayasan Tsukisima Among Tani – Sukabumi (24)2, Peternakan Rakyat Tulung Agung (17)2, Peternakan Rakyat Malang (45)2.
1. Koleksi Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc (2002, 2004, 2006, 2007 FAPET IPB), 2. Koleksi Dr. Ir. R. R. Dyah Perwitasari, M. Sc. 3. Koleksi yang dilakukan pada penelitian ini.
,/* ,
,.0%$5)'%. 4%$2,'!Pengambilan darah yang dijadikan sebagai sumber DNA dilakukan pada leher (vena jugularis) atau pada vena kogsigialis di pangkal ekor bagian bawah (dekat anus) menggunakan tabung vakum (vaccutainer) dengan jarum venoject. Kemudian sampel darah diawetkan dalam alkohol 95% sampai dikerjakan lebih lanjut. Setiap sapi yang disampling, harus dilengkapi
dengan sejarah induk, asal bibit dan sifat'sifat produksi yang lain.
34/ %34) ! Ekstraksi dan isolasi DNA dilakukan menggunakan Genomic DNA Mini Kit for Fresh Blood (GeneAid) yang dimodifikasi. Modifikasi dilakukan untuk membuang etanol dari sampel dan melisis sel menggunakan proteinase K.
Sebanyak ± 200 Ol sampel darah dalam etanol diendapkan dengan disentrifuse pada kecepatan 3500 rpm selama 5 menit. Endapan sel dicuci 2 kali dengan bufer yang mengandung Tris 10mM, EDTA 10mM, pH 8 untuk membersihkan sisa'sisa etanol. Endapan sel'sel darah kemudian disuspensikan dalam bufer 350 Ol. Sel'sel darah dilisis dengan sodium dodesil sulfat 1% dan proteinase'K 0,125 mg/ml. Pelisisan dilakukan dalam inkubator pada suhu 550C selama 2 jam sambil dikocok pelan. Tahap berikutnya mengikuti metode standar Genomic DNA Mini Kit for Fresh Blood (GeneAid) (Lampiran 1).
10
%3/- %. ,$2%/
Penelitian dilaksanakan sejak bulan Desember 2008 hingga Mei 2009 di Laboratorium Fungsi Hayati dan Perilaku Hewan Departemen Biologi, FMIPA ' IPB.
%#%.
Sampel darah sapi perah FH yang digunakan berasal dari pusat pembibitan pemerintah dan peternakan sapi perah rakyat sebanyak 965 sampel.
Sampel yang berasal dari pusat pembibitan pemerintah meliputi 5 lokasi yaitu Balai Besar Inseminasi Buatan (BBIB) Singosari – Jawa Timur (32)2, Balai Inseminasi Buatan (BIB) Lembang – Jawa Barat (30)1, Balai Pembibitan Ternak Unggul (BPTU) Baturraden – Jawa Tengah (97)1, Balai Peternakan Fakultas Peternakan (FAPET – IPB) – Jawa Barat (17) 2, Ngantang – Jawa Timur (47)2, Boyolali – Jawa Tengah (49)2, Koperasi Peternakan Susu Bandung Utara (KPSBU) Cilumber – Jawa Barat (98)2, Yayasan Tsukisima Among Tani – Sukabumi (24)2, Peternakan Rakyat Tulung Agung (17)2, Peternakan Rakyat Malang (45)2.
1. Koleksi Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc (2002, 2004, 2006, 2007 FAPET IPB), 2. Koleksi Dr. Ir. R. R. Dyah Perwitasari, M. Sc. 3. Koleksi yang dilakukan pada penelitian ini.
,/* ,
,.0%$5)'%. 4%$2,'!Pengambilan darah yang dijadikan sebagai sumber DNA dilakukan pada leher (vena jugularis) atau pada vena kogsigialis di pangkal ekor bagian bawah (dekat anus) menggunakan tabung vakum (vaccutainer) dengan jarum venoject. Kemudian sampel darah diawetkan dalam alkohol 95% sampai dikerjakan lebih lanjut. Setiap sapi yang disampling, harus dilengkapi
dengan sejarah induk, asal bibit dan sifat'sifat produksi yang lain.
34/ %34) ! Ekstraksi dan isolasi DNA dilakukan menggunakan Genomic DNA Mini Kit for Fresh Blood (GeneAid) yang dimodifikasi. Modifikasi dilakukan untuk membuang etanol dari sampel dan melisis sel menggunakan proteinase K.
Sebanyak ± 200 Ol sampel darah dalam etanol diendapkan dengan disentrifuse pada kecepatan 3500 rpm selama 5 menit. Endapan sel dicuci 2 kali dengan bufer yang mengandung Tris 10mM, EDTA 10mM, pH 8 untuk membersihkan sisa'sisa etanol. Endapan sel'sel darah kemudian disuspensikan dalam bufer 350 Ol. Sel'sel darah dilisis dengan sodium dodesil sulfat 1% dan proteinase'K 0,125 mg/ml. Pelisisan dilakukan dalam inkubator pada suhu 550C selama 2 jam sambil dikocok pelan. Tahap berikutnya mengikuti metode standar Genomic DNA Mini Kit for Fresh Blood (GeneAid) (Lampiran 1).
11
%$2,'!Satu pool DNA sampel terdiri dari 6'10 sampel DNA dengan konsentrasi yang terukur. Beberapa sampel (antara 6'10 sampel) dengan proporsi yang sama dicampur menjadi satu sampel. Untuk menjamin kepastian semua sampel DNA tercampur rata maka pool diinkubasi 370C selama satu jam.
Metode pool DNA merupakan metode yang sangat praktis untuk mengurangi besarnya biaya dalam proses deteksi kelainan genetik ini, karena salah satu masalah dalam melakukan deteksi penyakit ini adalah besarnya jumlah sampel dan peluang munculnya kelainan tersebut relatif kecil. Pool DNA sampel adalah metode pengelompokan DNA hasil ekstraksi dari sampel yang digunakan menjadi satu sampel (pool). Pool DNA ini kemudian dianalisis lebih lanjut dan jika dalam pool DNA sampel ditemui mutan, maka semua anggota pool tersebut diperiksa satu persatu (Mahfud 2009). Dengan demikian waktu deteksi lebih singkat (Churchill et al. 1993), hasil deteksi lebih cepat diketahui dan akurat.
$2')+)3%4) ! Amplifikasi gen CD18 dilakukan secara in vitro melalui teknik PCR' DNA dengan menggunakan forward primer 5´'TCA ACG TGA CCT TCC GGA GG'3´ dNTP masing'masing 120OM, MgCl2 100OM, dan Taq polymerase 1 unit beserta bufernya (RBC) dan masing'masing primer 1OM. Reaksi PCR berlangsung dalam mesin thermocycler TaKaRa PCR Thermal Cycler MP4 dengan kondisi yang telah diatur yaitu pradenaturasi pada suhu 94oC selama 5 menit yang dilanjutkan dengan 30 siklus (denaturasi 94oC selama 1 menit,
annealing atau penempelan primer pada suhu 57oC selama 1 menit, dan ekstensi DNA yaitu pemanjangan primer atau polimerase pada suhu 72oC selama 1 menit), dan diakhiri dengan ekstensi akhir DNA pada suhu 72oC selama 10 menit.
,/,34) $-/%4)!Deteksi mutasi gen CD18 alel D128G pada nukleotida 383 dilakukan melalui teknik RFLP menggunakan enzim restriksi endonuklease HaeIII (GG↓CC) (Čítek & Bláhová 2004, Shuster et al. 1992, Zsolnai dan Fésüs 1996). Hasil amplifikasi sampel yang mengalami mutasi akan terpotong pada asam amino 128 (D128G) menyebabkan substitusi asam aspartat menjadi glisin. Sedangkan sampel yang
normal tidak akan terpotong oleh enzim HaeIII karena tidak memiliki situs pemotong. Mutasi lain juga terjadi pada nukleotida 775 namun bersifat silent (tidak berekspresi) (Čítek & Bláhová, 2004). Sebanyak 3 ul produk PCR dicampur dengan 0,4 ul bufer enzim HaeIII, 0,3 ul enzim HaeIII, dan 0,3 ul air steril. Campuran tersebut diinkubasi pada suhu 38oC selama semalam.
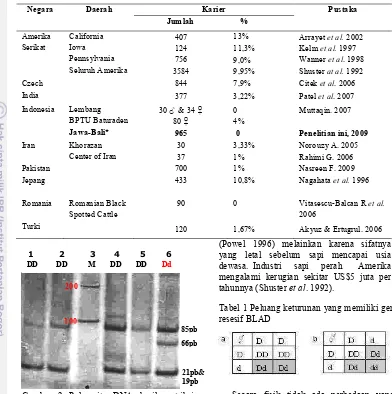
Jika produk PCR yang dipotong dengan enzim HaeIII menghasilkan potongan pita DNA sebesar 21 pb dan 85 pb berarti tidak mengalami mutasi (sapi normal, homozigot DD). Jika produk PCR yang dipotong dengan enzim HaeIII menghasilkan potongan pita DNA sebesar 21 pb, 19 pb, dan 66 pb berarti terjadi mutasi basa digantikan (sapi BLAD, homozigot resesif dd). Sedangkan jika produk PCR yang dipotong dengan enzim HaeIII menghasilkan potongan pita DNA sebesar 21 pb, 19 pb, 66 pb dan 85 pb berarti sapi karier (heterozigot Dd).
Visualisasi produk PCR dan hasil restriksi dilakukan menggunakan metode polyacrilamide gel electroforesis (PAGE) 6% yang dilanjutkan dengan pewarnaan perak mengikti metode Tegelstrom (1986) yang dimodifikasi oleh Farajallah et al. (1998). Modifikasi dilakukan terhadap volume pereaksi dan optimasi waktu'waktu reaksi. Elektroforesis dijalankan pada tegangan 180 Volt selama 40 menit dalam bufer 1x TBE (Tris 0,5 M, asam borat 0,65 M, EDTA 0,02 M).
,6% .%%. 2, %3! Bahan'bahan yang digunakan dalam pewarnaan perak adalah larutan fiksasi CTAB 0,1% (b/v), larutan perak, larutan pengembang dan larutan asam asetat 0,1% (v/v). Larutan perak dibuat segar dengan mencampurkan AgNO3 0,23 g , NaOH 10N 10 Ol, dan ammonia 25% 0,8 ml. Larutan pengembang dibuat dengan mencampurkan Na2CO3 4 g dan formaldehida 100 Ol dalam air destilata 200 ml.
.%')4)4 + ,3-,.4) %','. Analisis frekuensi alel mutan dilakukan dengan cara mengurangkan satu dengan banyaknya alel normal. Alel normal dihitung dari dua kali sampel normal homozigot ditambah dengan banyaknya sampel karier kemudian dibagi dengan dua kali jumlah total sampel yang teramplifikasi.
Rumus yang digunakan memakai hukum
% 1 ,).5, 0 sebagai berikut:
12
dimana :
p = frekuensi alel normal q = frekuensi alel mutan/BLAD DD = jumlah ternak normal Dd = jumlah ternak carier BLAD
Dd = jumlah ternak mutan/menderita BLAD N = jumlah seluruh sampel
setelah terlebih dahulu dilakukan pengelompokan hasil elektroforesis menjadi tiga kelompok yaitu normal (homozigot dominan, DD), karier (heterozigot, Dd), dan menderita BLAD/mutan (homozigot resesif, dd).
Sebanyak 965 sampel telah diekstraksi dan diisolasi DNAnya. Ruas gen CD18 ekson 2 kromosom 1 berhasil diamplifikasi secara in vitro menggunakan pasangan primer RRMB'F (B11) & RRMB'F (B12) dengan panjang 106 pb (Gambar 1). Persentase keberhasilan amplifikasi adalah 100% (Lampiran 2).
Analisis RFLP terhadap amplikon CD18 dengan enzim pemotong HaeIII menunjukkan hasil yang monomorfik. Pita'pita hasil visualisasi tersebut menggambarkan alel homozigot normal yang menghasilkan potongan pita DNA sebesar 21 pb dan 85 pb (Gambar 2).
Amplikon yang monomorfik menunjukkan bahwa tidak terjadi mutasi basa menjadi
basa , hal ini dapat diartikan bahwa 100% sampel yang telah diidentifikasi memiliki genotipe homozigot dominan ( ) sehingga frekuensi alel sebesar 1 dan alel sebesar 0.
Produk PCR menggunakan BLAD'FW dan BLAD'RV sesuai dengan Zsolnai dan Fésüs (1996) menghasilkan ruas DNA sebesar 106 pb. Seluruh sampel yang berhasil diamplifikasi PCR menghasilkan pita tunggal, sehingga tidak dapat dibedakan sampel DNA mana yang menggunakan metode manual maupun menggunakan DNA'extraction kit. Beberapa kelebihan menggunakan kit yaitu waktu kerja yang lebih singkat.
Tingkat keberhasilan amplifikasi DNA ditentukan oleh konsentrasi sampel DNA, taq polymerase, dinukleotida, ion Mg, dan primer (Muladno 2002). selain itu suhu annealing juga memegang peranan penting dalam keberhasilan amplifikasi karena pemanjangan DNA dimulai dari penempelan primer.
Selanjutnya, 965 produk PCR tersebut direstriksi dengan menggunakan satu enzim restriksi yaitu HaeIII (Zsolnai dan Fésüs 1996) untuk mendeteksi adanya mutasi pada subunit CD18 alel D128G (Lampiran 3).
Teknik visualisai DNA hasil PCR dan Hae III menggunakan PAGE 6% yang dilanjutkan dengan pewarnaan perak karena mempunyai resolusi yang memadai untuk konsentrasi DNA < 10 ng/pita (Sambrook et al. 1989). Sedangkan jika menggunakan agarosa dengan pewarnaan ethidium bromide membutuhkan konsentrasi DNA > 100 ng/pita.
Semua sampel asal Jawa'Bali (62 ekor jantan dan 903 betina) yang telah dianalisis mempunyai genotipe homozigot dominan yang normal. Dengan begitu frekuensi sapi pembawa alel BLAD (mutasi pada CD18) atau heterozigot di Jawa'Bali adalah 0%.
Sapi yang bergenotipe (BLAD) tidak ditemukan karena sapi yang diambil darahnya sebagai sampel adalah sapi dewasa. Hal ini wajar karena sapi dengan genotip homozigot resesif akan mengalami kematian sebelum dewasa (Perkin 2001).
<
; ; = 25
; > ?
12
dimana :
p = frekuensi alel normal q = frekuensi alel mutan/BLAD DD = jumlah ternak normal Dd = jumlah ternak carier BLAD
Dd = jumlah ternak mutan/menderita BLAD N = jumlah seluruh sampel
setelah terlebih dahulu dilakukan pengelompokan hasil elektroforesis menjadi tiga kelompok yaitu normal (homozigot dominan, DD), karier (heterozigot, Dd), dan menderita BLAD/mutan (homozigot resesif, dd).
Sebanyak 965 sampel telah diekstraksi dan diisolasi DNAnya. Ruas gen CD18 ekson 2 kromosom 1 berhasil diamplifikasi secara in vitro menggunakan pasangan primer RRMB'F (B11) & RRMB'F (B12) dengan panjang 106 pb (Gambar 1). Persentase keberhasilan amplifikasi adalah 100% (Lampiran 2).
Analisis RFLP terhadap amplikon CD18 dengan enzim pemotong HaeIII menunjukkan hasil yang monomorfik. Pita'pita hasil visualisasi tersebut menggambarkan alel homozigot normal yang menghasilkan potongan pita DNA sebesar 21 pb dan 85 pb (Gambar 2).
Amplikon yang monomorfik menunjukkan bahwa tidak terjadi mutasi basa menjadi
basa , hal ini dapat diartikan bahwa 100% sampel yang telah diidentifikasi memiliki genotipe homozigot dominan ( ) sehingga frekuensi alel sebesar 1 dan alel sebesar 0.
Produk PCR menggunakan BLAD'FW dan BLAD'RV sesuai dengan Zsolnai dan Fésüs (1996) menghasilkan ruas DNA sebesar 106 pb. Seluruh sampel yang berhasil diamplifikasi PCR menghasilkan pita tunggal, sehingga tidak dapat dibedakan sampel DNA mana yang menggunakan metode manual maupun menggunakan DNA'extraction kit. Beberapa kelebihan menggunakan kit yaitu waktu kerja yang lebih singkat.
Tingkat keberhasilan amplifikasi DNA ditentukan oleh konsentrasi sampel DNA, taq polymerase, dinukleotida, ion Mg, dan primer (Muladno 2002). selain itu suhu annealing juga memegang peranan penting dalam keberhasilan amplifikasi karena pemanjangan DNA dimulai dari penempelan primer.
Selanjutnya, 965 produk PCR tersebut direstriksi dengan menggunakan satu enzim restriksi yaitu HaeIII (Zsolnai dan Fésüs 1996) untuk mendeteksi adanya mutasi pada subunit CD18 alel D128G (Lampiran 3).
Teknik visualisai DNA hasil PCR dan Hae III menggunakan PAGE 6% yang dilanjutkan dengan pewarnaan perak karena mempunyai resolusi yang memadai untuk konsentrasi DNA < 10 ng/pita (Sambrook et al. 1989). Sedangkan jika menggunakan agarosa dengan pewarnaan ethidium bromide membutuhkan konsentrasi DNA > 100 ng/pita.
Semua sampel asal Jawa'Bali (62 ekor jantan dan 903 betina) yang telah dianalisis mempunyai genotipe homozigot dominan yang normal. Dengan begitu frekuensi sapi pembawa alel BLAD (mutasi pada CD18) atau heterozigot di Jawa'Bali adalah 0%.
Sapi yang bergenotipe (BLAD) tidak ditemukan karena sapi yang diambil darahnya sebagai sampel adalah sapi dewasa. Hal ini wajar karena sapi dengan genotip homozigot resesif akan mengalami kematian sebelum dewasa (Perkin 2001).
<
; ; = 25
; > ?
13
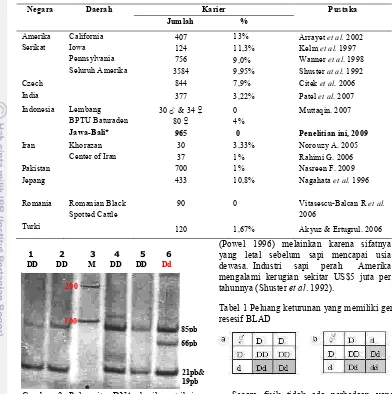
Tabel 2 Persentase ternak karier BLAD hasil uji PCR di beberapa negara
beberapa negara banyak dilaporkan dengan persentase yang berbeda'beda (Tabel 2). Pada penelitian ini tidak ditemukan populasi sapi baru karena pada pengambilan sampel di tahun 2002 merupakan koleksi sapi di bawah tahun 1999.
Kasus BLAD dapat menimbulkan kerugian yang besar terhadap industri sapi perah. Kerugian timbul apabila terjadi perkawinan antar individu karier yang berpeluang 25% anak sapi mengalami mati dini (Tabel 1). Kerugian bukan karena produksi susu yang rendah, karena sifat karier tidak mempengaruhi produksi susu
(Powel 1996) melainkan karena sifatnya yang letal sebelum sapi mencapai usia dewasa. Industri sapi perah Amerika mengalami kerugian sekitar US$5 juta per tahunnya (Shuster et al. 1992).
Tabel 1 Peluang keturunan yang memiliki gen resesif BLAD
Secara fisik tidak ada perbedaan yang mencolok untuk membedakan sapi FH normal dan karier. Sifat karier BLAD tidak memiliki pengaruh terhadap produksi susu (Powell 1996). Secara morfometrik, lebar kepala dan panjang metacarpal sapi FH carrier sedikit lebih kecil dibanding sapi FH normal tetapi tidak signifikan (Arrayet et al. 2002).
Persebaran BLAD pada sapi FH di dunia berkaitan erat dengan program inseminasi buatan (IB) yang mentransfer sumber nutfah dari pejantan unggul ke induk'induk betina di peternakan, yang pada awalnya tidak ada kekhawatiran menyebarnya penyakit genetik ini oleh sapi'sapi heterozigot BLAD sebagai pembawa. Penerapan inseminasi buatan dalam manajemen perkawinan di peternakan' peternakan dapat mempercepat perolehan ternak unggul yang diinginkan. Namun, efek samping yang timbul adalah makin cepatnya perkembangan penyakit atau kelainan akibat
,0% % %, %# % ), -4/%3%
14
ekspresi alel resesif. Salah satu pejantan unggul yang paling banyak digunakan dan ternyata heterozigot BLAD adalah Ivanhoe Bell dari Amerika Utara (Shuster et al. 1992). Sejak itu alel BLAD masuk ke berbagai negara yang mengembangkan peternakan sapi dengan jenis Friesian'Holstain.
Salah satu upaya untuk meningkatkan populasi dan produktifitas sapi perah domestik adalah melalui program pemuliaan yang dapat ditempuh melalui perbaikan mutu genetik ternak dengan menerapkan suatu pola perkawinan yang direncanakan dan diikuti tindakan seleksi untuk memilih pejantan dan betina unggul sebagai sumber utama materi genetik generasi berikutnya (Rahmani 2003). Manajemen perkawinan dilakukan dengan tidak mengawinkan induk unggul yang diketahui sebagai karier BLAD dengan induk lain terutama yang bersifat karier pula. Metode PCR'RFLP merupakan aplikasi yang praktis dalam perbaikan mutu genetik ternak.
Sapi yang terbukti memiliki alel heterozigot dapat dibiarkan saja, karena memang mutasi dengan alel resesif yang terjadi tidak terekspresi sebagai defect. Selain itu juga tidak terbukti dengan adanya alel resesif itu dapat menurunkan produktifitas peternakan. Mutasi BLAD justru muncul pada sapi elit Ivanhoe Bell, walaupun belum diketahui efek pleitropi dari alel ini terhadap produktifitas kebutuhan produksi. Namun jalan keluar yang paling aman ditempuh untuk memperbaiki manajemen perkawinan adalah tidak mempergunakan sapi yang terbukti memiliki alel heterozigot.
Teknik pool DNA dapat digunakan secara efektif untuk mendeteksi kelainan genetik BLAD dengan baik dan akurat. Deteksi dini dapat dilakukan dengan metode PCR'RFLP, sehingga kontrol genetik dengan metode molekuler seperti uji PCR'RFLP dapat mencegah perkembangan BLAD lebih luas. Hasil deteksi menunjukkan bahwa semua sampel yang berhasil di amplifikasi bebas dari kelainan genetik BLAD.
Sebagai saran, Pemeriksaan sejak dini kelainan genetik BLAD perlu dilakukan terutama pada sapi perah pejantan bibit unggul untuk mencegah penyebaran kelainan genetik tersebut. Sertifikasi bebas BLAD di pusat IB dan pada betina bibit unggul melalui metode analisis PCR'RFLP wajib dilakukan untuk menurunkan frekuensi alel resesif pada sapi perah di Indonesia.
Akyüz B and O Ertugrul. 2006. Detection of bovine leukocyte adhesion deficiency (BLAD) in Turkish native and holstein cattle. Acta Veterinaria Hungarica. Vol 54. 2:173'178.
Arrayet JL, Oberbauer AM, Famula TR, Garnett I, Oltjen JW, Imhoof J, Kehrli ME, Jr, Graham TW. 2002. Growth of holstein calves from birth to 90 days : the influence of dietary zinc and BLAD status. J Anim Sci. 80:545'552. Čítek J & Barbora Bláhová. 2004. Recessive
disorders – a serious health hazard?. J Appli Biomedic 2: 187'194.
Citek J, V Rehout, J Hajkova, J Pahkova. 2006. Monitoring of the genetic health of cattle in the Czech Republik. Veterinarni Medicina 51: 333'339. Churchill GA, Giovannoni JJ, Tanksley SD.
1993. Pooled'sampling makes high' resolution mapping practical with DNA markers. Proc NatL Acad Sci 90:16'20. Farajallah A, B Suryobroto, O Takenaka.
1998. Nucleotide Sequence of Whole Mitochondrial DNA of a Soft'shelled Turtle, Dogania, and PCR RFLP Analyses of Cytochrome b Gene. Proceeding of The Tokyo International Forum on Conservation and Sustainable Use of Tropical Bioresource. New Energy and Industrial Technology Development Organization (NEDO) and Japan Bioindustry Association (JBA). Kelm SC, Detilleux JC, Freeman AE, Kehrli
ME, Jr, Dietz AB, Fox LK, Butler JE, Kasckovics I, Kelley DH. 1997. Genetic association between parameters of innate immunity and measures of mastitis in periparturient holstein cattle. J Dairy Sci. 80 : 1767' 1775.
Mahfud K. 2009. Deteksi dini kelainan genetic Complex Vertebral Malformation dan Factor XI Deficiency pada sapi perah Friesian'Holstain. [tesis]. Bogor : Program Pascasarjana IPB.
Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor: Pustaka Wirausaha Muda.
14
ekspresi alel resesif. Salah satu pejantan unggul yang paling banyak digunakan dan ternyata heterozigot BLAD adalah Ivanhoe Bell dari Amerika Utara (Shuster et al. 1992). Sejak itu alel BLAD masuk ke berbagai negara yang mengembangkan peternakan sapi dengan jenis Friesian'Holstain.
Salah satu upaya untuk meningkatkan populasi dan produktifitas sapi perah domestik adalah melalui program pemuliaan yang dapat ditempuh melalui perbaikan mutu genetik ternak dengan menerapkan suatu pola perkawinan yang direncanakan dan diikuti tindakan seleksi untuk memilih pejantan dan betina unggul sebagai sumber utama materi genetik generasi berikutnya (Rahmani 2003). Manajemen perkawinan dilakukan dengan tidak mengawinkan induk unggul yang diketahui sebagai karier BLAD dengan induk lain terutama yang bersifat karier pula. Metode PCR'RFLP merupakan aplikasi yang praktis dalam perbaikan mutu genetik ternak.
Sapi yang terbukti memiliki alel heterozigot dapat dibiarkan saja, karena memang mutasi dengan alel resesif yang terjadi tidak terekspresi sebagai defect. Selain itu juga tidak terbukti dengan adanya alel resesif itu dapat menurunkan produktifitas peternakan. Mutasi BLAD justru muncul pada sapi elit Ivanhoe Bell, walaupun belum diketahui efek pleitropi dari alel ini terhadap produktifitas kebutuhan produksi. Namun jalan keluar yang paling aman ditempuh untuk memperbaiki manajemen perkawinan adalah tidak mempergunakan sapi yang terbukti memiliki alel heterozigot.
Teknik pool DNA dapat digunakan secara efektif untuk mendeteksi kelainan genetik BLAD dengan baik dan akurat. Deteksi dini dapat dilakukan dengan metode PCR'RFLP, sehingga kontrol genetik dengan metode molekuler seperti uji PCR'RFLP dapat mencegah perkembangan BLAD lebih luas. Hasil deteksi menunjukkan bahwa semua sampel yang berhasil di amplifikasi bebas dari kelainan genetik BLAD.
Sebagai saran, Pemeriksaan sejak dini kelainan genetik BLAD perlu dilakukan terutama pada sapi perah pejantan bibit unggul untuk mencegah penyebaran kelainan genetik tersebut. Sertifikasi bebas BLAD di pusat IB dan pada betina bibit unggul melalui metode analisis PCR'RFLP wajib dilakukan untuk menurunkan frekuensi alel resesif pada sapi perah di Indonesia.
Akyüz B and O Ertugrul. 2006. Detection of bovine leukocyte adhesion deficiency (BLAD) in Turkish native and holstein cattle. Acta Veterinaria Hungarica. Vol 54. 2:173'178.
Arrayet JL, Oberbauer AM, Famula TR, Garnett I, Oltjen JW, Imhoof J, Kehrli ME, Jr, Graham TW. 2002. Growth of holstein calves from birth to 90 days : the influence of dietary zinc and BLAD status. J Anim Sci. 80:545'552. Čítek J & Barbora Bláhová. 2004. Recessive
disorders – a serious health hazard?. J Appli Biomedic 2: 187'194.
Citek J, V Rehout, J Hajkova, J Pahkova. 2006. Monitoring of the genetic health of cattle in the Czech Republik. Veterinarni Medicina 51: 333'339. Churchill GA, Giovannoni JJ, Tanksley SD.
1993. Pooled'sampling makes high' resolution mapping practical with DNA markers. Proc NatL Acad Sci 90:16'20. Farajallah A, B Suryobroto, O Takenaka.
1998. Nucleotide Sequence of Whole Mitochondrial DNA of a Soft'shelled Turtle, Dogania, and PCR RFLP Analyses of Cytochrome b Gene. Proceeding of The Tokyo International Forum on Conservation and Sustainable Use of Tropical Bioresource. New Energy and Industrial Technology Development Organization (NEDO) and Japan Bioindustry Association (JBA). Kelm SC, Detilleux JC, Freeman AE, Kehrli
ME, Jr, Dietz AB, Fox LK, Butler JE, Kasckovics I, Kelley DH. 1997. Genetic association between parameters of innate immunity and measures of mastitis in periparturient holstein cattle. J Dairy Sci. 80 : 1767' 1775.
Mahfud K. 2009. Deteksi dini kelainan genetic Complex Vertebral Malformation dan Factor XI Deficiency pada sapi perah Friesian'Holstain. [tesis]. Bogor : Program Pascasarjana IPB.
Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor: Pustaka Wirausaha Muda.
14
ekspresi alel resesif. Salah satu pejantan unggul yang paling banyak digunakan dan ternyata heterozigot BLAD adalah Ivanhoe Bell dari Amerika Utara (Shuster et al. 1992). Sejak itu alel BLAD masuk ke berbagai negara yang mengembangkan peternakan sapi dengan jenis Friesian'Holstain.
Salah satu upaya untuk meningkatkan populasi dan produktifitas sapi perah domestik adalah melalui program pemuliaan yang dapat ditempuh melalui perbaikan mutu genetik ternak dengan menerapkan suatu pola perkawinan yang direncanakan dan diikuti tindakan seleksi untuk memilih pejantan dan betina unggul sebagai sumber utama materi genetik generasi berikutnya (Rahmani 2003). Manajemen perkawinan dilakukan dengan tidak mengawinkan induk unggul yang diketahui sebagai karier BLAD dengan induk lain terutama yang bersifat karier pula. Metode PCR'RFLP merupakan aplikasi yang praktis dalam perbaikan mutu genetik ternak.
Sapi yang terbukti memiliki alel heterozigot dapat dibiarkan saja, karena memang mutasi dengan alel resesif yang terjadi tidak terekspresi sebagai defect. Selain itu juga tidak terbukti dengan adanya alel resesif itu dapat menurunkan produktifitas peternakan. Mutasi BLAD justru muncul pada sapi elit Ivanhoe Bell, walaupun belum diketahui efek pleitropi dari alel ini terhadap produktifitas kebutuhan produksi. Namun jalan keluar yang paling aman ditempuh untuk memperbaiki manajemen perkawinan adalah tidak mempergunakan sapi yang terbukti memiliki alel heterozigot.
Teknik pool DNA dapat digunakan secara efektif untuk mendeteksi kelainan genetik BLAD dengan baik dan akurat. Deteksi dini dapat dilakukan dengan metode PCR'RFLP, sehingga kontrol genetik dengan metode molekuler seperti uji PCR'RFLP dapat mencegah perkembangan BLAD lebih luas. Hasil deteksi menunjukkan bahwa semua sampel yang berhasil di amplifikasi bebas dari kelainan genetik BLAD.
Sebagai saran, Pemeriksaan sejak dini kelainan genetik BLAD perlu dilakukan terutama pada sapi perah pejantan bibit unggul untuk mencegah penyebaran kelainan genetik tersebut. Sertifikasi bebas BLAD di pusat IB dan pada betina bibit unggul melalui metode analisis PCR'RFLP wajib dilakukan untuk menurunkan frekuensi alel resesif pada sapi perah di Indonesia.
Akyüz B and O Ertugrul. 2006. Detection of bovine leukocyte adhesion deficiency (BLAD) in Turkish native and holstein cattle. Acta Veterinaria Hungarica. Vol 54. 2:173'178.
Arrayet JL, Oberbauer AM, Famula TR, Garnett I, Oltjen JW, Imhoof J, Kehrli ME, Jr, Graham TW. 2002. Growth of holstein calves from birth to 90 days : the influence of dietary zinc and BLAD status. J Anim Sci. 80:545'552. Čítek J & Barbora Bláhová. 2004. Recessive
disorders – a serious health hazard?. J Appli Biomedic 2: 187'194.
Citek J, V Rehout, J Hajkova, J Pahkova. 2006. Monitoring of the genetic health of cattle in the Czech Republik. Veterinarni Medicina 51: 333'339. Churchill GA, Giovannoni JJ, Tanksley SD.
1993. Pooled'sampling makes high' resolution mapping practical with DNA markers. Proc NatL Acad Sci 90:16'20. Farajallah A, B Suryobroto, O Takenaka.
1998. Nucleotide Sequence of Whole Mitochondrial DNA of a Soft'shelled Turtle, Dogania, and PCR RFLP Analyses of Cytochrome b Gene. Proceeding of The Tokyo International Forum on Conservation and Sustainable Use of Tropical Bioresource. New Energy and Industrial Technology Development Organization (NEDO) and Japan Bioindustry Association (JBA). Kelm SC, Detilleux JC, Freeman AE, Kehrli
ME, Jr, Dietz AB, Fox LK, Butler JE, Kasckovics I, Kelley DH. 1997. Genetic association between parameters of innate immunity and measures of mastitis in periparturient holstein cattle. J Dairy Sci. 80 : 1767' 1775.
Mahfud K. 2009. Deteksi dini kelainan genetic Complex Vertebral Malformation dan Factor XI Deficiency pada sapi perah Friesian'Holstain. [tesis]. Bogor : Program Pascasarjana IPB.
Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor: Pustaka Wirausaha Muda.
15
Pengetahuan Alam. Institut Pertanian Bogor.
Nagahata H, Miura T, Tagaki K, Ohtake M, Noda H, Yasuda T, Nioka K. 1997. Prevalence and allel frequency estimation of bovine leukocyte adhesion deficiency (BLAD) in Holstein'Fresian cattle in Japan. J Vet Med Sci 59:233'238.
Nasreen F. Malik N. A, Riaz M. N. and Qureshi J. A. 2009. Detection and screening of bovine leukocyte adhesion deficiency in Pakistan using molecular methods. – Hereditas (Sweden)00:1'5. ISSN 1601'5223.
Norouzy A, Nassiry MR, Shahrody FE, et al. 2005. Identification of bovine leucocyte adhesion deficiency (BLAD) carriers in Holstein and Brown Swiss AI bulls in Iran. Genetika.41:1697'701 Paape MJ, Bannerman DD, Zhao X, Lee Jai' Wei. 2003. The bovine neutrophil: Structure and function in blood and milk. Vet Res 34:597–627.
Patel KR, Singh KM, Soni KJ, Chauhan JB, S Krothapalli R, Rao S. 2007. Low incidence of bovine leukocyte adhesion deficiency (BLAD) carriers in Indian cattle and buffalo breeds. J Appl Genet 48.pp.153'155
Perkins KH, MJ VandeHaar, RJ Tempelman, JL Burton. 2001. Negative energy balance does not decrease expression of leukocyte adhesion or antigen' presenting molecules in cattle.J Dairy Sci84:421–428.
Rahimi G, A.Nejati'Javaremi, K. Olek. 2006. Genotyping BLAD, DUMPS, and k' CSN Loci in Holstein Young Bulls of the National Breeding Center of Iran. J Dairy Sci. 9:1389'1392.
Rahmani N. 2003. Analisis hubungan polimorfisme gen bovine Growth Hormone (bGH) exon III'exon IV dan gen Ornithine Decarboxylase (ODC) intron 8'exon IX dengan produksi dan kualitas susu pada sapi perah Fresian' Holstein di BPTU Baturraden. [tesis]. Bogor : Program Pascasarjana IPB. Ribeiro LA, Baron EE, Martinez ML,
Coutinho LL. 2000. PCR screening and allel frequency estimation of bovine leukocyte adhesion deficiency in Holstein and Gir cattle in Brazil. Genet and MolecBiol 23:831'834.
Sambrook J, Fritsch EF, Miniatis T. 1989. Molecular Clooning: A Laboratory
Manual. Ed ke'8. New York: Cold Spring Harbor Laboratory Press. Sham P, Bader J, Craig I, O’Donovan M,
Owen M. 2002. DNA pooling: a tool for large'scale association studies. Nat Rev Genet 3:862'871.
Shuster DE, Kehrli ME, Jr, Ackermann MR, Gilbert RO. 1992. Identification and prevalence of a genetic defect that causes leukocyte adhesion deficiency in Holstein cattle. Proc Nati Acad Sci USA Vol. 89: 9225'9229.
Tegelstrom H. 1986. Mitochondrial DNA in natural populations : An improved routine for the screening of genetic variation based on sensitive silver staning. Electrophoresis. 7: 226'229. Vatasescu'Balcan R, E Georgescu S, Adina
MM, Mariana R, Anca D, Marieta C . 2006. Incidence of BLAD and DUMPS carriers in Romanian cattle breeds. Roumanian Biotechnological Letters. vol 11 no 5. pp2881'2884.
Wanner JM, GW Rogers, ME Kehrli & JB Cooper. 1998. Intramammary infections in primiparous Holsteins: heritabilities and comparisons of bovine leukocyte adhesion deficiency carriers and noncarriers. J Dairy Sci. 81:3293'3299.
Yang Y, Zhang J, Hoh J, Matsuda F, Xu P, Lathrop M, Jurg O. 2003. Efficiency of single'nucleotide polymorphism haplotype estimation from pooled DNA. Proc NatL Acad Sci 100:7225' 7230.
2
LYDIA ULFAH HERODITA. Identifikasi Bovine Leukocyte Adhesion Deficiency (BLAD) pada Peternakan Sapi Friesian'Holstein (FH) di Jawa'Bali. Dibimbing oleh ACHMAD FARAJALLAH dan CECE SUMANTRI.
Bovine Leukocyte Adhesion Deficiency (BLAD) atau sindrom granulosipati merupakan penyakit genetik akibat adanya gen resesif autosomal pada sapi. Defisiensi ini pada sapi bersifat lethal atau mati dini. Mutasi titik pada nukleotida 383 gen CD18 menyebabkan defisiensi β2' integrin pada sel darah putih yang akan menyebabkan berkurangnya jumlah protein yang berperan dalam penempelan sel darah putih pada dinding vaskular untuk masuk kedalam jaringan yang terserang patogen. Kelainan ini bersifat resesif. Penelitian ini bertujuan mengetahui frekuensi alel subunit CD18 yang menyebabkan BLAD pada sapi Friesian'Holstein (FH) dari peternakan di Jawa'Bali menggunakan metode PCR'RFLP. Sebanyak 965 sampel telah diekstraksi dan diisolasi DNAnya. Ruas gen CD18 ekson 2 kromosom 1 berhasil diamplifikasi secara in vitro dengan panjang 106 pb. Analisis RFLP terhadap amplikon CD18 dengan enzim pemotong HaeIII menunjukkan hasil monomorfik, hal ini dapat diartikan bahwa 100% sampel yang telah diidentifikasi memiliki genotipe homozigot dominan ( ) sehingga frekuensi alel sebesar 1 dan alel sebesar 0. Deteksi dini kelainan genetik BLAD perlu dilakukan terutama pada sapi perah pejantan bibit unggul untuk mencegah penyebaran kelainan genetik tersebut.
LYDIA ULFAH HERODITA. Identification of Bovine Leukocyte Adhesion Deficiency (BLAD) on Holstein'Friesian cattle in Java ' Bali. Supervised by ACHMAD FARAJALLAH and CECE SUMANTRI.
3
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
4
Judul : Identifikasi Bovine Leukocyte Adhesion Deficiency (BLAD) pada Peternakan Sapi Friesian'Holstein di Jawa'Bali
Nama : Lydia Ulfah Herodita
NRP : G34052372
Menyetujui:
Pembimbing I, Pembimbing II,
! ! "#$% % %&%''%#( ! )! *+! ! ! ,", -$%./ )( ! 0 ! "!
NIP. 19650427 199002 1 002 NIP. 19591212 198603 1 004
Mengetahui, Kepala Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
! ! .", % $* %1% -2,.%
NIP. 19641002 198903 1 002
5
Penulis merupakan sulung dari dua bersaudara yang lahir tanggal 10 November 1987 di Jakarta dari pasangan Alm. Didiek Eko Tri Isdriyanto dan Elly Rositha.
Pendidikan dasar diselesaikan pada tahun 1999 di SDN Citeureup IV. Pendidikan lanjutan menengah pertama diselesaikan pada tahun 2002 di SMPN 1 Cibinong, dan pendidikan lanjutan menengah atas diselesaikan pada tahun 2005 di SMAN 6 Bogor.
6
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia'Nya sehingga karya ilmiah ini berhasil diselesaikan. Sholawat dan salam selalu terlimpahkan kepada Nabi Muhammad SAW, sahabat dan keluarganya. Penelitian yang berjudul Identifikasi Bovine Leukocyte Adhesion Deficiency (BLAD) pada Peternakan Sapi Friesian'Holstein (FH) di Jawa' Bali dilaksanakan sejak bulan Desember 2008 hingga Mei 2009 di Laboratorium Fungsi Hayati Hewan, Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Achmad Farajallah, M.Si. dan Bapak Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. atas segala bimbingan, saran dan ilmu yang diberikan, serta dukungan dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Disamping itu, terima kasih penulis sampaikan kepada Ibu Dr. R.R. Dyah Perwitasari Farajallah dan Bapak Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. atas izin penggunaan sampel darah sapi Friesian'Holstein dalam penelitian. Rasa terima kasih penulis sampaikan pula kepada Bapak Drh. I Wayan Widana di PT. Puri Purnama Bangli'Bali, Bapak Drh. Asep di KPS Kunak Bogor, Bapak Andhi di KPBS Bandung, dan Bapak Drh. Rahmat di Sukabumi yang telah membantu dalam pengambilan sampel.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penyelesaian karya ilmiah ini, antara lain kepada seluruh dosen dan staf Laboratorium Zoologi IPB atas saran dan perhatiannya, kepada Bapak, Ibu dan Teman'teman laboratorium zoologi selama penelitian berlangsung: Pak Khoirul, Ibu Bibah yang selalu mendampingi dan memberi masukan, Mba Tini, Mba Ani, Kak Sipri, Kak Wildan, Ibu Eka, Pak Adi, Pak Agus, Pak Jhonny. Teman' teman Fapet, Restu, Kak Eryx, Liput, Mira, Tak lupa teman'teman Biologi 42 atas segala bantuan dan doanya.
Rasa hormat dan sayang ananda haturkan kepada Mama, Alm.Papa yang telah membesarkan, mengasuh, dan mendidik, memberikan perhatian, dan mencurahkan kasih sayang. Kepada adikku tercinta Syifa yang telah memberikan kasih sayang dan dukungan, keluarga besar Citeureup dan Solo, Kang Tatan Hardian, adikku Suri, sepupuku Widyaningsih, keluarga besar GMNI UPI Bandung (Deden, Adi, Agi, Yuslih, Rusdi, Sani) terima kasih atas do’a nya, kebersamaan, dan perhatiannya.
Kepada teman baikku Shitta, Riesni, Anjel, Lena, Wiwied, terima kasih atas do’a dan dukungannya, teman'teman Merpati Putih yang selalu memberi semangat, dan tak lupa kepada Bpk Ampuh, Bpk Bambang Adi Wijaya, Mba Rizka yang selalu menyemangati dalam menyelesaikan karya ilmiah ini.
Penulis berharap semoga ilmu yang tertuang dalam karya ilmiah ini bermanfaat. Amin.
Bogor, Agustus 2009
7
Halaman
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN
Latar Belakang 1
Tujuan 1
Waktu dan Tempat 2
METODE
Bahan 2
Metode 2
Pengambilan Sampel 2
Ekstraksi DNA 2
Pool DNA Sampel 3
Amplifikasi DNA 3
Deteksi Mutasi 3
Pewarnaan Perak 3
Analisis Frekuensi Alel 3
HASIL 4
PEMBAHASAN 4
KESIMPULAN DAN SARAN 6
DAFTAR PUSTAKA 6
8
Halaman
1 Peluang keturunan yang memiliki gen resesif BLAD 5
2 Persentase ternak carrier BLAD hasil uji PCR di beberapa negara 5
Halaman
1 Tampilan pita sekuen DNA produk PCR 4
2 Tampilan pita sekuen DNA hasil restriksi enzim HaeIII pada gel polyakrilamid 5
Halaman
1 Modifikasi metode isolasi DNA menggunakan Genomic DNA Mini Kit (GeneAid) 10
2 Persentase sampel DNA normal dan karier BLAD 11
3 Urutan basa nukleotida subunit CD18 ekson 2 12
9
%/% ,'%3%.0
Kelainan genetik merupakan salah satu kelainan pada ternak yang disebabkan oleh mutasi pada material genetik. Jika ekspresi mutan dalam keadaan heterozigot maka penampilannya tampak normal, keadaan itu disebut sebagai karier, sehingga homozigot resesif yang merugikan dapat muncul sewaktu'waktu jika terjadi perkawinan antar individu heterozigot. Kelainan genetik ini mudah menyebar, mengikuti inseminasi buatan.
Inseminasi buatan (IB) membutuhkan jantan unggul yang telah diseleksi, unggul dalam hal ini hanya berdasarkan karakter unggulnya, misal bobot badan atau produksi susu yang lama kelamaan seleksi hanya terjadi pada sifat unggulnya sehingga muncul mutasi. Mutasi terjadi pada satu alel dan bersifat resesif yang tertutupi oleh alel pasangannya yang normal. Setiap karakter dikendalikan oleh sepasang faktor (hukum mendel) yang memiliki hubungan dominan'resesif.
Pejantan'pejantan unggul hasil seleksi untuk inseminasi buatan (IB) ternyata ada diantaranya yang heterozigot yang menyebabkan bovine leukocyte adhesion deficiency (BLAD). Mutasi tersebut tidak tampak dan tidak mudah diketahui karena bersifat resesif yang tertutupi oleh sifat'sifat unggul lainnya. Inseminasi buatan dilakukan untuk menghindari terjadinya inbreeding dan untuk peningkatan mutu genetik sapi perah FH yaitu penyebaran gen'gen unggul yang memiliki kemampuan produksi susu dan ketahanan terhadap penyakit.
Pertama kali BLAD diketahui di Amerika Utara yang kemudian menyebar ke negara' negara lainnya (Patel et al. 2007). Diterangkan oleh Olson (2002) dalam Čítek and Bláhová (2004) bahwa pejantan yang diketahui berperan sebagai sumber gen mutan penyebab BLAD adalah pejantan unggul yang bernama Carlin'M Ivanhoe Bell berasal dari Amerika Utara. Bell mendapatkan warisan gen mutan dari kakeknya (Osborndale Ivanhoe, lahir 1952) yang mewariskannya ke induk jantan dari Bell (Pennstate Ivanhoe Star, lahir tahun1963).
Bovine Leukocyte Adhesion Deficiency (BLAD) atau sindrom granulosipati merupakan penyakit genetik akibat adanya gen resesif autosomal pada sapi (Paape et al. 2003). Defisiensi ini pada sapi bersifat lethal atau mati dini karena sel darah putih tidak mampu menempel pada dinding vaskular.
Kemampuan sel'sel darah putih menempel ke dinding vaskular salah satunya diatur oleh gen CD18.
Mutasi titik gen CD18 pada nukleotida 383 menyebabkan substitusi asam aspartat menjadi glisin pada asam amino 128 (D128G). Sapi yang memiliki gen homozigot resesif akan mengalami BLAD sedangkan sapi yang memiliki gen heterozigot akan menjadi karier. Mutasi lain juga terjadi pada nukleotida 775 namun bersifat silent (tidak berekspresi) (Čítek & Bláhová, 2004). Mutasi pada nukleotida 383 menyebabkan sapi penderita BLAD mengalami penurunan jumlah ekspresi β2 heterodimeric integrin pada permukaan sel darah putihnya (Čítek and Bláhová, 2004).
Integrin adalah molekul adhesi yang terlibat dalam mekanisme )%2, ,4)4 .,-/ *+)' keluar dari pembuluh darah ke dalam jaringan untuk membunuh patogen yang masuk ke dalam tubuh (Shuster et al., 1992). Tanpa β2 heterodimeric integrin, sel darah putih tidak mampu masuk ke jaringan tubuh dan menghancurkan patogen (Shuster et al. 1992). Sehingga patogen akan hidup terus dalam jaringan tubuh yang akan menyebabkan ternak mati dini ketika dilahirkan.
Sapi yang menderita BLAD mengalami kerusakan pada aktivitas kemotaktis dan pagositis sel'sel darah putihnya yaitu pada β2' integrin (Paape et al. 2003) sehingga mudah terinfeksi bakteri, luka lama sembuh, pertumbuhan terhambat (Nagahata et al. 1997; Ribeiro et al. 2000) dan seringkali mati pada usia muda (Perkins 2001). Hal tersebut bisa mempengaruhi kelangsungan peternakan sapi perah terutama di negara berkembang seperti Indonesia. Dampak nasional yang bisa dirasakan adalah turunnya produksi susu nasional.
Frekuensi ternak sapi FH yang bersifat sebagai karier BLAD di beberapa negara cukup tinggi. Di Indonesia sudah ada laporan penelitian mengenai BLAD di daerah Baturraden pada sapi FH (Muttaqin 2007). Penelitian mengenai kasus ini di Indonesia masih perlu dilakukan di daerah lain. Hal ini dikarenakan sumber sapi FH yang ada di Indonesia merupakan hasil impor dari luar yang sangat terbuka sekali peluang adanya gen mutan penyebab BLAD.
-&-%.
10
%3/- %. ,$2%/
Penelitian dilaksanakan sejak bulan Desember 2008 hingga Mei 2009 di Laboratorium Fungsi Hayati dan Perilaku Hewan Departemen Biologi, FMIPA ' IPB.
%#%.
Sampel darah sapi perah FH yang digunakan berasal dari pusat pembibitan pemerintah dan peternakan sapi perah rakyat sebanyak 965 sampel.
Sampel yang berasal dari pusat pembibitan pemerintah meliputi 5 lokasi yaitu Balai Besar Inseminasi Buatan (BBIB) Singosari – Jawa Timur (32)2, Balai Inseminasi Buatan (BIB) Lembang – Jawa Barat (30)1, Balai Pembibitan Ternak Unggul (BPTU) Baturraden – Jawa Tengah (97)1, Balai Peternakan Fakultas Peternakan (FAPET – IPB) – Jawa Barat (17) 2, Ngantang – Jawa Timur (47)2, Boyolali – Jawa Tengah (49)2, Koperasi Peternakan Susu Bandung Utara (KPSBU) Cilumber – Jawa Barat (98)2, Yayasan Tsukisima Among Tani – Sukabumi (24)2, Peternakan Rakyat Tulung Agung (17)2, Peternakan Rakyat Malang (45)2.
1. Koleksi Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc (2002, 2004, 2006, 2007 FAPET IPB), 2. Koleksi Dr. Ir. R. R. Dyah Perwitasari, M. Sc. 3. Koleksi yang dilakukan pada penelitian ini.
,/* ,
,.0%$5)'%. 4%$2,'!Pengambilan darah yang dijadikan sebagai sumber DNA dilakukan pada leher (vena jugularis) atau pada vena kogsigialis di pangkal ekor bagian bawah (dekat anus) menggunakan tabung vakum (vaccutainer) dengan jarum venoject. Kemudian sampel darah diawetkan dalam alkohol 95% sampai dikerjakan lebih lanjut. Setiap sapi yang disampling, harus dilengkapi
dengan sejarah induk, asal bibit dan sifat'sifat produksi yang lain.
34/ %34) ! Ekstraksi dan isolasi DNA dilakukan menggunakan Genomic DNA Mini Kit for Fresh Blood (GeneAid) yang dimodifikasi. Modifikasi dilakukan untuk membuang etanol dari sampel dan melisis sel menggunakan proteinase K.
Sebanyak ± 200 Ol sampel darah dalam etanol diendapkan dengan disentrifuse pada kecepatan 3500 rpm selama 5 menit. Endapan sel dicuci 2 kali dengan bufer yang mengandung Tris 10mM, EDTA 10mM, pH 8 untuk membersihkan sisa'sisa etanol. Endapan sel'sel darah kemudian disuspensikan dalam bufer 350 Ol. Sel'sel darah dilisis dengan sodium dodesil sulfat 1% dan proteinase'K 0,125 mg/ml. Pelisisan dilakukan dalam inkubator pada suhu 550C selama 2 jam sambil dikocok pelan. Tahap berikutnya mengikuti metode standar Genomic DNA Mini Kit for Fresh Blood (GeneAid) (Lampiran 1).
11
%$2,'!Satu pool DNA sampel terdiri dari 6'10 sampel DNA dengan konsentrasi yang terukur. Beberapa sampel (antara 6'10 sampel) dengan proporsi yang sama dicampur menjadi satu sampel. Untuk menjamin kepastian semua sampel DNA tercampur rata maka pool diinkubasi 370C selama satu jam.
Metode pool DNA merupakan metode yang sangat praktis untuk mengurangi besarnya biaya dalam proses deteksi kelainan genetik ini, karena salah satu masalah dalam melakukan deteksi penyakit ini adalah besarnya jumlah sampel dan peluang munculnya kelainan tersebut relatif kecil. Pool DNA sampel adalah metode pengelompokan DNA hasil ekstraksi dari sampel yang digunakan menjadi satu sampel (pool). Pool DNA ini kemudian dianalisis lebih lanjut dan jika dalam pool DNA sampel ditemui mutan, maka semua anggota pool tersebut diperiksa satu persatu (Mahfud 2009). Dengan demikian waktu deteksi lebih singkat (Churchill et al. 1993), hasil deteksi lebih cepat diketahui dan akurat.
$2')+)3%4) ! Amplifikasi gen CD18 dilakukan secara in vitro melalui teknik PCR' DNA dengan menggunakan forward primer 5´'TCA ACG TGA CCT TCC GGA GG'3´ dNTP masing'masing 120OM, MgCl2 100OM, dan Taq polymerase 1 unit beserta bufernya (RBC) dan masing'masing primer 1OM. Reaksi PCR berlangsung dalam mesin thermocycler TaKaRa PCR Thermal Cycler MP4 dengan kondisi yang telah diatur yaitu pradenaturasi pada suhu 94oC selama 5 menit yang dilanjutkan dengan 30 siklus (denaturasi 94oC selama 1 menit,
annealing atau penempelan primer pada suhu 57oC selama 1 menit, dan ekstensi DNA yaitu pemanjangan primer atau polimerase pada suhu 72oC selama 1 menit), dan diakhiri dengan ekstensi akhir DNA pada suhu 72oC selama 10 menit.
,/,34) $-/%4)!Deteksi mutasi gen CD18 alel D128G pada nukleotida 383 dilakukan melalui teknik RFLP menggunakan enzim restriksi endonuklease HaeIII (GG↓CC) (Čítek & Bláhová 2004, Shuster et al. 1992, Zsolnai dan Fésüs 1996). Hasil amplifikasi sampel yang mengalami mutasi akan terpotong pada asam amino 128 (D128G) menyebabkan substitusi asam aspartat menjadi glisin. Sedangkan sampel yang
normal tidak akan terpotong oleh enzim HaeIII karena tidak memiliki situs pemotong. Mutasi lain juga terjadi pada nukleotida 775 namun bersifat silent (tidak berekspresi) (Čítek & Bláhová, 2004). Sebanyak 3 ul produk PCR dicampur dengan 0,4 ul bufer enzim HaeIII, 0,3 ul enzim HaeIII, dan 0,3 ul air steril. Campuran tersebut diinkubasi pada suhu 38oC selama semalam.
Jika produk PCR yang dipotong dengan enzim HaeIII menghasilkan potongan pita DNA sebesar 21 pb dan 85 pb berarti tidak mengalami mutasi (sapi normal, homozigot DD). Jika produk PCR yang dipotong dengan enzim HaeIII menghasilkan potongan pita DNA sebesar 21 pb, 19 pb, dan 66 pb berarti terjadi mutasi basa digantikan (sapi BLAD, homozigot resesif dd). Sedangkan jika produk PCR yang dipotong dengan enzim HaeIII menghasilkan potongan pita DNA sebesar 21 pb, 19 pb, 66 pb dan 85 pb berarti sapi karier (heterozigot Dd).
Visualisasi produk PCR dan hasil restriksi dilakukan menggunakan metode polyacrilamide gel electroforesis (PAGE) 6% yang dilanjutkan dengan pewarnaan perak mengikti metode Tegelstrom (1986) yang dimodifikasi oleh Farajallah et al. (1998). Modifikasi dilakukan terhadap volume pereaksi dan optimasi waktu'waktu reaksi. Elektroforesis dijalankan pada tegangan 180 Volt selama 40 menit dalam bufer 1x TBE (Tris 0,5 M, asam borat 0,65 M, EDTA 0,02 M).
,6% .%%. 2, %3! Bahan'bahan yang digunakan dalam pewarnaan perak adalah larutan fiksasi CTAB 0,1% (b/v), larutan perak, larutan pengembang dan larutan asam asetat 0,1% (v/v). Larutan perak dibuat segar dengan mencampurkan AgNO3 0,23 g , NaOH 10N 10 Ol, dan ammonia 25% 0,8 ml. Larutan pengembang dibuat dengan mencampurkan Na2CO3 4 g dan formaldehida 100 Ol dalam air destilata 200 ml.
.%')4)4 + ,3-,.4) %','. Analisis frekuensi alel mutan dilakukan dengan cara mengurangkan satu dengan banyaknya alel normal. Alel normal dihitung dari dua kali sampel normal homozigot ditambah dengan banyaknya sampel karier kemudian dibagi dengan dua kali jumlah total sampel yang teramplifikasi.
Rumus yang digunakan memakai hukum
% 1 ,).5, 0 sebagai berikut:
12
dimana :
p = frekuensi alel normal q = frekuensi alel mutan/BLAD DD = jumlah ternak normal Dd = jumlah ternak carier BLAD
Dd = jumlah ternak mutan/menderita BLAD N = jumlah seluruh sampel
setelah terlebih dahulu dilakukan pengelompokan hasil elektroforesis menjadi tiga kelompok yaitu normal (homozigot dominan, DD), karier (heterozigot, Dd), dan menderita BLAD/mutan (homozigot resesif, dd).
Sebanyak 965 sampel telah diekstraksi dan diisolasi DNAnya. Ruas gen CD18 ekson 2 kromosom 1 berhasil diamplifikasi secara in vitro menggunakan pasangan primer RRMB'F (B11) & RRMB'F (B12) dengan panjang 106 pb (Gambar 1). Persentase keberhasilan amplifikasi adalah 100% (Lampiran 2).
Analisis RFLP terhadap amplikon CD18 dengan enzim pemotong HaeIII menunjukkan hasil yang monomorfik. Pita'pita hasil visualisasi tersebut menggambarkan alel homozigot normal yang menghasilkan potongan pita DNA sebesar 21 pb dan 85 pb (Gambar 2).
Amplikon yang monomorfik menunjukkan bahwa tidak terjadi mutasi basa menjadi
basa , hal ini dapat diartikan bahwa 100% sampel yang telah diidentifikasi memiliki genotipe homozigot dominan ( ) sehingga frekuensi alel sebesar 1 dan alel sebesar 0.
Produk PCR menggunakan BLAD'FW dan BLAD'RV sesuai dengan Zsolnai dan Fésüs (1996) menghasilkan ruas DNA sebesar 106 pb. Seluruh sampel yang berhasil diamplifikasi PCR menghasilkan pita tunggal, sehingga tidak dapat dibedakan sampel DNA mana yang menggunakan metode manual maupun menggunakan DNA'extraction kit. Beberapa kelebihan menggunakan kit yaitu waktu kerja yang lebih singkat.
Tingkat keberhasilan amplifikasi DNA ditentukan oleh konsentrasi sampel DNA, taq polymerase, dinukleotida, ion Mg, dan primer (Muladno 2002). selain itu suhu annealing juga memegang peranan penting dalam keberhasilan amplifikasi karena pemanjangan DNA dimulai dari penempelan primer.
Selanjutnya, 965 produk PCR tersebut direstriksi dengan menggunakan satu enzim restriksi yaitu HaeIII (Zsolnai dan Fésüs 1996) untuk mendeteksi adanya mutasi pada subunit CD18 alel D128G (Lampiran 3).
Teknik visualisai DNA hasil PCR dan Hae III menggunakan PAGE 6% yang dilanjutkan dengan pewarnaan perak karena mempunyai resolusi yang memadai untuk konsentrasi DNA < 10 ng/pita (Sambrook et al. 1989). Sedangkan jika menggunakan agarosa dengan pewarnaan ethidium bromide membutuhkan konsentrasi DNA > 100 ng/pita.
Semua sampel asal Jawa'Bali (62 ekor jantan dan 903 betina) yang telah dianalisis mempunyai genotipe homozigot dominan yang normal. Dengan begitu frekuensi sapi pembawa alel BLAD (mutasi pada CD18) atau heterozigot di Jawa'Bali adalah 0%.
Sapi yang bergenotipe (BLAD) tidak ditemukan karena sapi yang diambil darahnya sebagai sampel adalah sapi dewasa. Hal ini wajar karena sapi dengan genotip homozigot resesif akan mengalami kematian sebelum dewasa (Perkin 2001).
<
; ; = 25
; > ?
13
Tabel 2 Persentase ternak karier BLAD hasil uji PCR di beberapa negara
beberapa negara banyak dilaporkan dengan persentase yang berbeda'beda (Tabel 2). Pada penelitian ini tidak ditemukan populasi sapi baru karena pada pengambilan sampel di tahun 2002 merupakan koleksi sapi di bawah tahun 1999.
Kasus BLAD dapat menimbulkan kerugian yang besar terhadap industri sapi perah. Kerugian timbul apabila terjadi perkawinan antar individu karier yang berpeluang 25% anak sapi mengalami mati dini (Tabel 1). Kerugian bukan karena produksi susu yang rendah, karena sifat karier tidak mempengaruhi produksi susu
(Powel 1996) melainkan karena sifatnya yang letal sebelum sapi mencapai usia dewasa. Industri sapi perah Amerika mengalami kerugian sekitar US$5 juta per tahunnya (Shuster et al. 1992).
Tabel 1 Peluang keturunan yang memiliki gen resesif BLAD
Secara fisik tidak ada perbedaan yang mencolok untuk membedakan sapi FH normal dan karier. Sifat karier BLAD tidak memiliki pengaruh terhadap produksi susu (Powell 1996). Secara morfometrik, lebar kepala dan panjang metacarpal sapi FH carrier sedikit lebih kecil dibanding sapi FH normal tetapi tidak signifikan (Arrayet et al. 2002).
Persebaran BLAD pada sapi FH di dunia berkaitan erat dengan program inseminasi buatan (IB) yang mentransfer sumber nutfah dari pejantan unggul ke induk'induk betina di peternakan, yang pada awalnya tidak ada kekhawatiran menyebarnya penyakit genetik ini oleh sapi'sapi heterozigot BLAD sebagai pembawa. Penerapan inseminasi buatan dalam manajemen perkawinan di peternakan' peternakan dapat mempercepat perolehan ternak unggul yang diinginkan. Namun, efek samping yang timbul adalah makin cepatnya perkembangan penyakit atau kelainan akibat
,0% % %, %# % ), -4/%3%
14
ekspresi alel resesif. Salah satu pejantan unggul yang paling banyak digunakan dan ternyata heterozigot BLAD adalah Ivanhoe Bell dari Amerika Utara (Shuster et al. 1992). Sejak itu alel BLAD masuk ke berbagai negara yang mengembangkan peternakan sapi dengan jenis Friesian'Holstain.
Salah satu upaya untuk meningkatkan populasi dan produktifitas sapi perah domestik adalah melalui program pemuliaan yang dapat ditempuh melalui perbaikan mutu genetik ternak dengan menerapkan suatu pola perkawinan yang direncanakan dan diikuti tindakan seleksi untuk memilih pejantan dan betina unggul sebagai sumber utama materi genetik generasi berikutnya (Rahmani 2003). Manajemen perkawinan dilakukan dengan tidak mengawinkan induk unggul yang diketahui sebagai karier BLAD dengan induk lain terutama yang bersifat karier pula. Metode PCR'RFLP merupakan aplikasi yang praktis dalam perbaikan mutu genetik ternak.
Sapi yang terbukti memiliki alel heterozigot dapat dibiarkan saja, karena memang mutasi dengan alel resesif yang terjadi tidak terekspresi sebagai defect. Selain itu juga tidak terbukti dengan adanya alel resesif itu dapat menurunkan produktifitas peternakan. Mutasi BLAD justru muncul pada sapi elit Ivanhoe Bell, walaupun belum diketahui efek pleitropi dari alel ini terhadap produktifitas kebutuhan produksi. Namun jalan keluar yang paling aman ditempuh untuk memperbaiki manajemen perkawinan adalah tidak mempergunakan sapi yang terbukti memiliki alel heterozigot.
Teknik pool DNA dapat digunakan secara efektif untuk mendeteksi kelainan genetik BLAD dengan baik dan akurat. Deteksi dini dapat dilakukan dengan metode PCR'RFLP, sehingga kontrol genetik dengan metode molekuler seperti uji PCR'RFLP dapat mencegah perkembangan BLAD lebih luas. Hasil deteksi menunjukkan bahwa semua sampel yang berhasil di amplifikasi bebas dari kelainan genetik BLAD.
Sebagai saran, Pemeriksaan sejak dini kelainan genetik BLAD perlu dilakukan terutama pada sapi perah pejantan bibit unggul untuk mencegah penyebaran kelainan genetik tersebut. Sertifikasi bebas BLAD di pusat IB dan pada betina bibit unggul melalui metode analisis PCR'RFLP wajib dilakukan untuk menurunkan frekuensi alel resesif pada sapi perah di Indonesia.
Akyüz B and O Ertugrul. 2006. Detection of bovine leukocyte adhesion deficiency (BLAD) in Turkish native and holstein cattle. Acta Veterinaria Hungarica. Vol 54. 2:173'178.
Arrayet JL, Oberbauer AM, Famula TR, Garnett I, Oltjen JW, Imhoof J, Kehrli ME, Jr, Graham TW. 2002. Growth of holstein calves from birth to 90 days : the influence of dietary zinc and BLAD status. J Anim Sci. 80:545'552. Čítek J & Barbora Bláhová. 2004. Recessive
disorders – a serious health hazard?. J Appli Biomedic 2: 187'194.
Citek J, V Rehout, J Hajkova, J Pahkova. 2006. Monitoring of the genetic health of cattle in the Czech Republik. Veterinarni Medicina 51: 333'339. Churchill GA, Giovannoni JJ, Tanksley SD.
1993. Pooled'sampling makes high' resolution mapping practical with DNA markers. Proc NatL Acad Sci 90:16'20. Farajallah A, B Suryobroto, O Takenaka.
1998. Nucleotide Sequence of Whole Mitochondrial DNA of a Soft'shelled Turtle, Dogania, and PCR RFLP Analyses of Cytochrome b Gene. Proceeding of The Tokyo International Forum on Conservation and Sustainable Use of Tropical Bioresource. New Energy and Industrial Technology Development Organization (NEDO) and Japan Bioindustry Association (JBA). Kelm SC, Detilleux JC, Freeman AE, Kehrli
ME, Jr, Dietz AB, Fox LK, Butler JE, Kasckovics I, Kelley DH. 1997. Genetic association between parameters of innate immunity and measures of mastitis in periparturient holstein cattle. J Dairy Sci. 80 : 1767' 1775.
Mahfud K. 2009. Deteksi dini kelainan genetic Complex Vertebral Malformation dan Factor XI Deficiency pada sapi perah Friesian'Holstain. [tesis]. Bogor : Program Pascasarjana IPB.
Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor: Pustaka Wirausaha Muda.