ANALISIS HISTOLOGI DAN FISIOLOGI LATISIFER PADA
TANAMAN KARET (Hevea brasiliensis)
HASIL PENELITIAN
VAHNONI LUBIS 100805040
Usulan penelitian ini diajukan sebagai salah satu syarat untuk mendapatkan Gelar Sarjana Sains Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara Medan
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ANALISIS HISTOLOGI DAN FISIOLOGI LATISIFER PADA
TANAMAN KARET (Hevea brasiliensis)
HASIL PENELITIAN
VAHNONI LUBIS 100805040
Usulan penelitian ini diajukan sebagai salah satu syarat untuk mendapatkan Gelar Sarjana Sains Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara Medan
Disetujui oleh:
Pembimbing 2 Pembimbing 1
KATA PENGANTAR
Puji dan syukur penulis ucapkan ke hadirat Allah SWT yang telah memberikan
ridho dan syafa’at-Nya sehingga penulis dapat menyelesaikan proposal penelitian
ini.
Proposal penelitian yang berjudul Analisis Histologi dan Fisiologi
Latisifer Pada Tanaman Karet (Hevea brasiliensis) dibuat sebagai salah satu
syarat untuk meraih gelar sarjana Biologi Fakultas Matematikan dan Ilmu
Pengetahuan Alam, Universtas Sumatera Utara, Medan.
Pada kesempatan ini penulis ingin mengucapkan terimakasih kepada ibu
Dr. Isnaini Nurwahyuni, M.Sc selaku dosen pembimbing I dan bapak Dr. Radite
Tistama, M.Si selaku dosen pembimbing II yang telah banyak memberikan
bimbingan dan saran kepada penulis dalam penyusunan proposal penelitian ini.
Penulis menyadari sepenuhnya bahwa dalam pembuatan proposal
penelitian ini masih banyak kekurangan. Oleh karena itu, penulis mengharapkan
kritik dan saran yang bersifat membangun demi kesempurnaan proposal penelitian
ini.
Medan, Mei 2014
ANALISIS HOSTOLOGI DAN FISIOLOGI LATISIFER PADA
TANAMAN KARET (Hevea brasiliensis)
ABSTRAK
Tanaman karet (Hevea brasiliensis) merupakan sumber penghasil karet alam yang
ikut berkontribusi dalam peningkatan devisa negara. Berdasarkan peran ini,
berbagai proses peningkatan kualitas produksi dilakukan baik dalam skala
pertanian maupun dalam skala biologi. Penelitian tentang analisis histologi dan
fisiologi latisifer pada tanaman karet (Hevea brasiliensis) telah dilakukan di Balai
Penelitian Sungei Putih dengan menggunakan rancangan Nested Split Plot. Zat
pengatur tumbuh JA, NAA dan kombinasinya telah diaplikasikan kepada klon PB
260 dan IRR 42 untuk peningkatan parameter histologi dan fisiologi yang
dianggap penting dalam hal peningkatan produksi karet. Parameter histologi
meliputi tebal kulit, jumlah latisifer dan diameter latisifer. Sedangkan parameter
fisiologi meliputi kadar fosfat anorganik, kadar sukrosa dan produksi
karet/sadap/tunas lateral. Hasil penelitian menunjukkan bahwa jenis klon
berpengaruh nyata terhadap tebal kulit dan produksi karet/sadap/tunas lateral
setalah diberi perlakuan zat pengatur tumbuh JA, NAA dan kombinasinya.
Sedangkan zat pengatur tumbuh berpengaruh terhadap keseluruhan parameter
histologi dan fisiologi meskipun tidak memberikan pengaruh yang nyata.
Kata kunci: JA, NAA, latisifer, kadar fosfat anorganik, kadar sukrosa, produksi
HISTOLOGICAL AND PHYSIOLOGICAL ANALYSYS OF LATICIFER
IN RUBBER TREE (Hevea brasiliensis)
ABSTRACT
Rubber tree (Hevea brasiliensis) is the source of natural rubber which contributed
a great deal in terms of the increase in Indonesia foreign exchange. Based on this
contribution, many effort have been done to increasing the quality of production
in agricultural or biological aspects. Study of histology and physiology analisys in
rubber tree (Hevea brasiliensis) has been conducted. The plant growth regulator
JA, NAA and their combination applied in two kinds of Hevea clones, there are
PB 260 and IRR 42 to induce the histological and physiological pharameters
which important to increase rubber production. The histological pharameters are
the thickness of bark, amount of laticifers and diameter of laticifers and the
physiological parameters are inorganic phosphate level, sucrose level and the total
of rubber product in one tapping. The result showed the type of the clones have a
significant response in bark thickness and the rubber production/tapping/lateral
buds and the plant growth regulators affects of all histogycal and physiological
pharameters although the differences were not significant.
DAFTAR ISI
DAFTAR GAMBAR Vii
DAFTAR LAMPIRAN Viii
BAB 1. PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan Penelitian 3
1.4 Manfaat 3
1.5 Hipotesis 3
BAB 2. TINJAUAN PUSTAKA
2.1 Tanaman Karet (Hevea brasiliensis) 5
BAB 3. METODOLOGI PENELITIAN
3.1 Waktu dan Tempat 13
3.4.2 Analisis Fisiologi 15 3.4.2.1 Analisis Kandungan Fosfat Anorganik 15 3.4.2.2 Pembuatan Kurva Standar Fosfat Anorganik 16 3.4.2.3 Perhitungan Konsentrasi Fosfat Anorganik 16
3.4.2.4 Analisis Kandungan Sukrosa 16
3.4.2.5 Pembuatan Kurva Standar Sukrosa 16
3.4.2.6 Perhitungan Konsentrasi Sukrosa 17
3.4.2.7 Pengukuran Kandungan Total Solid Content Lateks 17 3.4.2.8 Perhitungan Kandungan Total Solid Content Lateks 17
BAB 4. HASIL DAN PEMBAHASAN
4.1 Analisis Histologi
4.1.1 Tebal Kulit Tanaman 18
4.1.2 Jumlah Latisifer 20
4.1.3 Diameter Latisifer 22
4.2 Analisis Fisiologi
4.2.1 Kadar Sukrosa Lateks 24
4.2.2 Kadar Fosfat Anorganik Lateks 26
4.2.3 Produksi Karet/Sadap/Tunas Lateral 28
BAB 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan 31
5.2 Saran 31
DAFTAR PUSTAKA 32
DAFTAR TABEL
No. Judul Halaman
1 Pengaruh pemberian JA, NAA dan kombinasinya terhadap tebal kulit pada klon karet PB 260 dan IRR 42
19
2 Pengaruh pemberian JA, NAA dan kombinasinya terhadap jumlah latisifer pada klon karet PB 260 dan IRR 42
21
3 Pengaruh pemberian JA, NAA dan kombinasinya terhadap diameter latisifer pada klon karet PB 260 dan IRR 42
23
4 Pengaruh pemberian JA, NAA dan kombinasinya terhadap kadar fosfat anorganik pada klon karet PB 260 dan IRR 42
24
5 Pengaruh pemberian JA, NAA dan kombinasinya terhadap jumlah latisifer pada klon karet PB 260 dan IRR 42
27
6 Pengaruh pemberian JA, NAA dan kombinasinya
terhadap produksi karet pada klon karet PB 260 dan IRR 42
DAFTAR LAMPIRAN
No. Judul Halaman
1 Lay out penelitian 36
2 Bagan alir penelitian 37
3 Alur kerja pemangkasan tanaman klonA 38
4 Alur kerja perlakuan tunas lateral klon 39
5 Alur kerja pembuatan preparat 40
6 Alur kerja penghitungan jumlah latisifer 41
7 Alur kerja pengukuran diameter latisifer 42
8 Alur kerja pengukuran tebal kulit 43
9 Alur kerja pengukuran kadar sukrosa lateks 44
10 Alur kerja pembuatan kurva standart sukrosa 45
11 Alur kerja pengukuran kadar fosfat anorganik lateks 46
12 Alur kerja pembuatan kurva standart fosfat anorganik 47 13 Alur kerja pengukuran produksi karet/sadap/tunas lateral 48
14 Rataan tebal kulit 49
15 Sidik ragam tebal kulit 50
16 Rataan jumlah latisifer 51
17 Sidik ragam jumlah latisifer 51
18 Rataan diameter latisifer 53
19 Sidik ragam diameter latisifer 54
20 Rataan kadar sukrosa 55
21 Sidik ragam kadar sukrosa 56
22 Rataan kadar fosfat anorganik 57
23 Sidik ragam kadar fosfat anorganik 58
24 Rataan produksi karet/sadap/tunas lateral 59
25 Sidik ragam pengukuran produksi karet/sadap/tunas lateral 60
ANALISIS HOSTOLOGI DAN FISIOLOGI LATISIFER PADA
TANAMAN KARET (Hevea brasiliensis)
ABSTRAK
Tanaman karet (Hevea brasiliensis) merupakan sumber penghasil karet alam yang
ikut berkontribusi dalam peningkatan devisa negara. Berdasarkan peran ini,
berbagai proses peningkatan kualitas produksi dilakukan baik dalam skala
pertanian maupun dalam skala biologi. Penelitian tentang analisis histologi dan
fisiologi latisifer pada tanaman karet (Hevea brasiliensis) telah dilakukan di Balai
Penelitian Sungei Putih dengan menggunakan rancangan Nested Split Plot. Zat
pengatur tumbuh JA, NAA dan kombinasinya telah diaplikasikan kepada klon PB
260 dan IRR 42 untuk peningkatan parameter histologi dan fisiologi yang
dianggap penting dalam hal peningkatan produksi karet. Parameter histologi
meliputi tebal kulit, jumlah latisifer dan diameter latisifer. Sedangkan parameter
fisiologi meliputi kadar fosfat anorganik, kadar sukrosa dan produksi
karet/sadap/tunas lateral. Hasil penelitian menunjukkan bahwa jenis klon
berpengaruh nyata terhadap tebal kulit dan produksi karet/sadap/tunas lateral
setalah diberi perlakuan zat pengatur tumbuh JA, NAA dan kombinasinya.
Sedangkan zat pengatur tumbuh berpengaruh terhadap keseluruhan parameter
histologi dan fisiologi meskipun tidak memberikan pengaruh yang nyata.
Kata kunci: JA, NAA, latisifer, kadar fosfat anorganik, kadar sukrosa, produksi
HISTOLOGICAL AND PHYSIOLOGICAL ANALYSYS OF LATICIFER
IN RUBBER TREE (Hevea brasiliensis)
ABSTRACT
Rubber tree (Hevea brasiliensis) is the source of natural rubber which contributed
a great deal in terms of the increase in Indonesia foreign exchange. Based on this
contribution, many effort have been done to increasing the quality of production
in agricultural or biological aspects. Study of histology and physiology analisys in
rubber tree (Hevea brasiliensis) has been conducted. The plant growth regulator
JA, NAA and their combination applied in two kinds of Hevea clones, there are
PB 260 and IRR 42 to induce the histological and physiological pharameters
which important to increase rubber production. The histological pharameters are
the thickness of bark, amount of laticifers and diameter of laticifers and the
physiological parameters are inorganic phosphate level, sucrose level and the total
of rubber product in one tapping. The result showed the type of the clones have a
significant response in bark thickness and the rubber production/tapping/lateral
buds and the plant growth regulators affects of all histogycal and physiological
pharameters although the differences were not significant.
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Latisifer merupakan sel khusus yang terdapat pada lebih dari 20 kelompok
tanaman angiospermae. Pembentukan latisifer bergantung pada indikator
morfologi dari masing-masing spesies (Hagel et al., 2008). Berdasarkan
morfologinya, latisifer dikategorikan kedalam 2 tipe yaitu articulated dan
non-articulated. Kehadiran kedua tipe latisifer ini ditemukan pada Hevea brasiliensis.
Latisifer pada H. brasiliensis ditemukan pada kotiledon, daun, bunga buah, akar,
batang dan floem sekunder pada kulit (Sando et al., 2009).
Sebagian besar latisifer juga dibedakan berdasarkan karakter anatomi dan
perbedaan kandungan sitoplasma latisifer yang diketahui sebagai lateks.
Komponen yang dihasilkan latisifer (lateks) berupa senyawa bioaktif yang pada
dasarnya berperan sebagai toksin yang memberikan efek sitotoksik terhadap
musuhnya musuhnya (Hagel et al., 2008).
Lateks mengandung sekitar 25-40% bahan karet mentah (Fachry et. al.,
2011). Bahan karet inilah yang diolah dan dimanfaatkan untuk menghasilkan
produk untuk kebutuhan manusia dan menjadikan karet sebagai salah satu
komoditas penting baik di Amerika maupun negara lainnya (Onokpise & Louime,
2012). Menurut Anwar dalam Nasarudin & Maulana (2009), di Indonesia
pendapatan devisa dari komoditi karet pada tahun 2004 mencapai US$ 2.25
milyar yang bernilai setara dengan 5% dari pendapatan negara. Kebutuhan inilah
yang mendorong dilakukannya usaha-usaha peningkatan produksi lateks pada
tanaman penghasil lateks khususnya Hevea brasiliensis.
Selama ini telah banyak usaha yang dilakukan untuk meningkatkan
produksi lateks dari tanaman karet. Peningkatan produksi lateks pada tanaman
karet tersebut dilaksanakan melalui berbagai usaha antara lain teknik budidaya
yang baik seperti menanam klon unggul, pemupukan dengan dosis tepat dan
penelitian peningkatan produksi lateks tersebut dilakukan dalam aspek pertanian
dan perkebunan saja, namun aspek biologinya belum banyak diteliti.
Teknik perakitan klon-klon unggul pada tanaman karet, ketebalan kulit,
jumlah latisifer dan diameter latisifer merupakan faktor yang penting diamati
karena lateks dihasilkan oleh latisifer yang didapati dalam jumlah tinggi pada
bagian kulit disamping faktor genetik dan faktor lingkungan yang juga
mempengaruhinya (Woelan & Sayurandi, 2009; Aidi & Daslin, 2006).
Aplikasi stimulan pada tanaman karet, tidak semua memberikan respon
yang diharapkan. Hal ini tergantung pada setiap klon karet (Nasaruddin &
Maulana, 2009). Klon karet yang berbeda kemungkinan memberikan respon yang
berbeda terhadap stimulan yang diperlakukan.
Stimulasi lateks umumnya dilaksanakan pada tanaman karet yang telah
dewasa. Tujuannya untuk mendapatkan kenaikan hasil lateks sehingga diperoleh
tambahan keuntungan bagi pengusaha perkebunan karet. Pemberian stimulan
tanpa menurunkan intensitas sadapan akan berpengaruh terhadap pertumbuhan
tanaman, terutama tanaman yang masih muda. Oleh karena itu tanaman karet
hanya bisa dipacu produksinya dengan stimulan jika telah berumur 10 tahun atau
15 tahun. Pemberian stimulan berfungsi memperpanjang masa pengaliran lateks
sehingga produksi yang diperoleh pada penyadapan lebih tinggi apalagi jika
didukung dengan dosis yang tepat (Nasaruddin & Maulana, 2009).
Zat pengatur tumbuh mempunyai peranan dalam pertumbuhan dan
perkembangan bagi tumbuhan (Abidin, 1983). Penelitian tentang asam jasmonat
(JA) dalam mempengaruhi diferensiasi latisifer telah dilakukan pada klon tertentu
yang berasal dari kebun percobaan di Kepulauan Hainan, Cina. Perlakuan
diberikan pada tanaman yang telah menghasilkan 2-4 unit pemanjangan, tepatnya
pada bagian pucuk teratas dari setiap unit pemanjangan klon karet yang digunakan
(Hao & Wu, 2000). Disisi lain auksin merupakan salah satu hormon tumbuh yang
tidak terlepas dari proses pertumbuhan dan perkembangan suatu tanaman. NAA
ditemukan mampu menginduksi penebalan kulit pada tanaman karet (Abidin,
1983; Koryati, 2004).
Oleh karena itu, pada penelitian ini digunakan JA dan NAA untuk menguji
latisifer pada beberapa klon karet yang berasal dari kebun percobaan Balai
Penelitian Karet Sungei Putih.
1.2.Rumusan Permasalahan
a. Bagaimana pengaruh jenis klon terhadap kondisi histologi dan fisiologi latisifer
pada tanaman karet.
b. Bagaimana pengaruh jenis zat pengatur tumbuh terhadap terhadap kondisi
histologi dan fisiologi latisifer pada tanaman karet.
c. Bagaimana interaksi klon dan zat pengatur tumbuh terhadap terhadap kondisi
histologi dan fisiologi latisifer pada tanaman karet.
1.3.Tujuan Penelitian
a. Mengetahui pengaruh jenis klon terhadap kondisi histologis dan fisologis
tanaman karet.
b. Mengetahui pengaruh jenis zat pengatur tumbuh terhadap kondisi histologis
dan fisologis tanaman karet.
c. Mengetahui pengaruh interaksi antara klon dan zat pengatur tumbuh terhadap
kondisi histologis dan fisologis tanaman karet.
1.4.Hipotesis
a. Terdapat pengaruh jenis klon terhadap kondisi histologis dan fisologis tanaman
karet.
b. Terdapat pengaruh jenis zat pengatur tumbuh terhadap kondisi histologis dan
fisologis tanaman karet.
c. Terdapat interaksi klon dan zat pengatur tumbuh terhadap kondisi histologis
dan fisologis tanaman karet.
1.5. Manfaat
Keberadaan latisifer merupakan salah satu faktor penting yang
mempengaruhi produksi lateks dari kelompok Hevea. JA yang selama ini
digunakan sebagai komponen pembasmi patogen dan gangguan serangga pada
2000). Sampai sekarang ini, belum banyak ditemukan substansi tumbuh yang
mampu menginduksi diferensiasi latisifer pada tanaman karet. Oleh karena itu,
kombinasi JA dan NAA sebagai agen diferensiasi ini diharapkan dapat
memberikan informasi bagi petani karet untuk dapat meningkatkan produksi dan
menjadi teknologi terbarukan dalam hal peningkatkan produksi lateks pada
BAB 2
TINJAUAN PUSTAKA
2.1. Tanaman Karet (Hevea brasiliensis)
2.1.1. Biologi Karet
Tanaman karet berasal dari bahasa latin Hevea yang berasal dari Negara Brazil.
Karet merupakan kebutuhan vital bagi kehidupan manusia sehari-hari, hal ini
terkait dengan mobilitas manusia dan barang yang memerlukan komponen yang
terbuat dari karet seperti ban kendaraan, conveyor belt, sabuk transmisi, dock
fender, sepatu dan sandal karet. Karet merupakan salah satu komoditas pertanian
di Indonesia. Komoditas ini relatif lebih lama di budidayakan daripada komoditas
perkebunan lainnya. Tanaman ini di introduksi pada tahun 1864 (Nasaruddin &
Maulana, 2009).
Pada awal abad ke 19 dalam berbagai eksplorasi yang dilakukan oleh
orang Eropa, ditemukan pula tumbuhan-tumbuhan lain yang menghasilkan getah
selain Hevea brasiliensis Muell Arg.. Tumbuhan tersebut antara lain adalah Ficus
elastic Roxb, Funtumina elastic Stapf, Willughbeia sp., Palaquiun gutta BurckI,
Parthenium agenatum Gray, Saladigo sp., dan Manihot glazziovii (Setyamidjaja,
1986).
2.1.2. Morfologi Tanaman Karet (Hevea brasiliensis)
2.1.2.1 Bunga, Buah dan Biji
Taksa kehidupan hewan maupun tumbuhan ditempatkan berdasarkan banyaknya
jumlah kekerabatan yang dipelajari untuk menggali potensi yang lebih baik lagi.
Termasuk tanaman karet yang juga mengalami aturan seperti itu (Obouayeba et
al, 2012).
Tanaman karet adalah tanaman berumah satu (monoecious). Pada satu
tangkai bunga yang berbentuk bunga majemuk, terdapat bunga betina dan bunga
jantan. Pembungaan pada tanaman karet dimulai setelah selesai masa gugur daun
yang terdapat dalam malai payung tambahan yang jarang. Pangkal tenda bunga
berbentuk lonceng. Pada ujungnya terdapat lima tajuk yang sempit. Panjang tenda
bunga berkisar 4-8 mm. Bunga betina berambut vilt dan memiliki ukuran yang
lebih besar dibandingkan bunga jantan. Bunga betina mengandung bakal buah
yang beruang tiga. Bunga jantan memiliki 10 benang sari yang tersusun menjadi
satu tiang (Tim Penulis PS, 2011). Walaupun demikian penyerbukan dapat terjadi
secara sendiri maupun secara silang (Setyamidjaja, 1986).
Buah karet memiliki pembagian ruang yang jelas. Masing-masing ruang
membentuk setengah bola. Jumlah ruang biasanya tiga, kadang-kadang sampai
enam ruang. Garis tengah buah 3-5cm. Bila buah sudah masak, maka akan pecah
dengan sendirinya. Pemecahan terjadi dengan kuat menurut ruang-ruangnya (Tim
Penulis PS, 2011). Setiap pecahan akan tumbuh menjadi individu baru jika jatuh
ketempat yang tepat (Setiawan & Andoko, 2007).
Proses pemasakan buah berlangsung selama 5½-6 bulan. Musim panen
biji berlangsung pendek. Hanya sekitar 1½ bulan. Sedangkan daya kecambah bij
sangat cepat berkurang, terutama bila penanganannya kurang baik. Berdasarkan
proses pembuahannya, dikenal tiga golongan biji pada karet yaitu biji legitim,
prope legitim dan ilegitim (Setyamidjaja, 1986).
2.1.2.2 Akar, Batang dan Daun
Karet merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Tinggi
pohon dewasa mencapai 15-25 meter. Batang tanaman biasanya tumbuh lurus dan
memiliki percabangan yang tinggi. Dibeberapa kebun karet terdapat kecondongan
arah tumbuh tanamanya agak miring ke arah utara (Nugroho, 2010). Dibatang
inilah terkandung getah yang dikenal dengan nama lateks (Setiawan & Andoko,
2007).
Sebagai tanaman berbiji belah akar pohon karet berupa akar tunggang
yang mampu menopang batang tanaman yang tumbuh tinggi keatas. Dengan akar
yang seperti itu pohon karet bisa berdiri kokoh meskipun tingginya mencapai 25
meter (Setiawan & Andoko, 2007).
Daun karet berwarna hijau. Apabila akan rontok berubah warna menjadi
utama dan tangkai anak daun. Panjang tangkai utama 3-20 cm, sedangkan panjang
tangkai anak daun antara 3-10 cm. Anak daun berbentuk memanjang elips,
memanjang dengan ujung runcing (Nugroho, 2010).
Dalam pertumbuhan karet diketahui bahwa menjelang berakhirnya musim
hujan, pohon karet mulai menggugurkan daunnya (Setyamidjaja, 1986). Daun
karet ini berwarna hijau dan menjadi kuning atau merah menjelang rontok. Seperti
kebanyakan tanaman tropis, daun-daun karet akan rontok pada puncak musim
kemarau untuk mengurangi penguapan (Setiawan & Andoko, 2007), tetapi masa
gugur daun pada tanaman tidak terjadi dalam waktu yang bersamaan. Masa gugur
daun dipengaruhi oleh jenis klon dan keadaan iklim setempat (Setyamidjaja,
1986).
2.2. Lateks
2.2.1. Latisifer
Lateks sewaktu keluar dari latisifer masih dalam keadaan steril (Fachry et al.,
2011). Lateks Hevea brasiliensis merupakan getah/cairan sel yang berbentuk
suspensi yang terdiri dari partikel-partikel karet dan non karet seperti protein,
karbohidrat, lipid, asam nukleat, karotenoid, dan lain-lain. Adanya beberapa
protein spesifik yang terdapat di dalam lateks, yang diduga memiliki peranan
penting dalam proses aliran lateks (Soedjanaatmadja, 2008; Fachry et. al., 2011).
Lateks terdapat pada suatu rongga dan sel sejenis yang bergabung yang
dikenal sebagai latisifer (Fachry et al., 2011; Gomez, 1982). Latisifer biasanya
memiliki struktur berongga dengan cabang ataupun tidak. Pada beberapa spesies,
latisifer yang sangat kompleks dihubungkan oleh anastomosis antara yang satu
dengan yang lainnya. Berdasarkan ontogeninya, latisifer dapat dibedakan menjadi
tipe articulatedi dan non-articulated yang kebanyakan orang menyebutnya
sebagai pembuluh (Gomez, 1982).
2.2.2. Fisiologi Lateks
Menurut Sando et al (2009), Hevea brasiliensis Muell Arg. merupakan tanaman
tropik yang memproduksi karet alami dengan rumus kimia cis-1,4-polyisoprene.
brasiliensis yang digunakan dibeberapa daerah karena memiliki produktivitas
yang tinggi dan kualitas karet yang baik. Berat molekul karet yang dihasilkan
Hevea brasiliensis telah diketahui. Karet alami yang dihasilkan Hevea brasiliensis
menarik perhatian tinggi sebagai industri polimer yang sangat bermanfaat karena
tidak ada komponen fisik buatan yang dapat menggantikannya.
Partikel karet merupakan suatu komponen koloidal yang terdapat dalam
lateks. Di dalam lateks, karet mengisi sekitar 30-45% dari keseluruhan komposisi.
Partikel karet memiliki ukuran yang sangat bervariasi, dari mulai 0,02 sampai 3
µm dengan distribusi maksimum 0,1 µm (Wititsuwannakul et. al., 2008).
Lateks adalah hasil fotosintesis dalam bentuk sukrosa yang
ditranslokasikan dari daun melalui pembuluh tapis kedalam latisifer. Didalam
latisifer terdapat enzim seperti invertase yang akan mengatur proses perombakan
sukrosa untuk dapat membentuk karet. Lateks terdiri dari komponen karet dan
bukan karet yang mana memiliki komposisi berbeda pada masing-masing pohon.
Komposisi lateks tersebut dipengaruhi oleh banyak faktor. Faktor yang paling
berperan adalah faktor lingkungan dan faktor genetik (Dalimunthe, 2004).
Penurunan kondisi fisiologis tanaman karet dapat diketahui dengan
mengamati kadar karet kering lateks dan diagnosis lateks. Bila terjadi cekaman
eksploitasi yang berat, maka kadar karet kering lateks akan menurun secara
drastis. Kadar sukrosa lateks berkaitan erat dengan penerapan eksploitasi terhadap
tanaman karet karena hasil fotosintesis yang ditranslokasikan kebagian tanaman
yang lain dalam bentuk sukrosa. Fosfat anorganik merupakan indikator aktifitas
metabolik yang menggambarkan kemampuan tanaman karet untuk mengubah
sukrosa menjadi partikel karet didalam lateks (Junaidi et al., 2010).
2.3. Asam Jasmonat
2.3.1. Biosintesis
Jasmonat merupakan kelompok senyawa yang diketahui sebagai oksilipin yang
berperan dalam regulasi pertumbuhan tanaman dan pertahanan. Jasmonat
memiliki distribusi yang luas dalam tubuh tanaman, aktif dalam konsentrasi yang
Secara umum, mekanisme biosintesis JA terbentuk setelah terjadi
pelukaan pada bagian tanaman tertentu. Pelukaan yang terjadi pada bagian
tersebut melepaskan suatu hormone polipeptida yang disebut sistemin. Hormon
sistemin kemudian berikatan dengan reseptor hormon yang terdapat pada
membran plasma. Pelekatan hormon sistemin dengan reseptor melepaskan enzim
lipase yang kemudian didistribusikan menuju ke membrane lipida. Pada
membrane lipida, lipase mengaktifkan asam linolenat bebas (18:3) yang
merupakan prekursor utama pembentukan JA. Asam linolenat berubah menjadi
12-Oxophytodienoic acid. Dari 12-Oxophytodienoic acid inilah kemudian
terbentuk JA (Taiz & Zeiger, 2002).
2.3.2. Manfaat
Jasmonat merupakan salah satu komponen tumbuh dari suatu sinyal molekul dan
hormon tanaman. Jasmonat merupakan turunan dari asam lemak polyunsaturated
yang terbentuk melalui jalur octadecanoid. JA merupakan produk akhir dari jalur
tersebut dan berperan sebagai hormon bioaktif. Ciri utama jasmonat yang paling
mudah dilihat adalah sturktur cincin pentasiklik. Meskipun aktivitas biologis
tanaman tidak memiliki batasan untuk menghasilkan JA, tetapi JA merupakan
suatu metabolit yang berbeda dan memiliki sifat yang tidak sebaik prekursor
biosintesisnya (Schaller and Stinzi, 2008).
JA dan metil jasmonat memiliki fungsi penting dalam respon pertahanan
tanaman yang disebabkan karena adanya pelukaan mekanik maupun pelukaan
oleh serangga herbivora dan gangguan patogen. Jasmonat juga diikutsertakan
dalam pembentukan vegetative storage proteins (VSPs) pada bagian vegetatif
tanaman. Jasmonat dan turunannya berperan dalam menstimulasi bentuk dari
tuber atau bulbus. Jamonat dapat bertindak seperti ABA. Jasmonat dapat
menghambat pertumbuhan dalam cekaman osmotik yang kurang baik. JA dapat
menghambat pertumbuhan dan germinasi akar dan tunas pada biji yang tidak
dalam keadaan dormansi (Srivastava, 2002).
Seperti hormon tumbuhan yang lain, JA memiliki peranan yang cukup
besar dalam hal aktifitas fisiologis, perkecambahan biji, perkembangan organ
sebagai molekul yang memberikan sinyal pertahanan tumbuhan dari serangga
pemakan tanaman dan pathogen nekrotrop (Schaller and stinzi, 2008).
JA dan metil jasmonat merupakan turunan dari asam linolenat. Telah
diketahui bahwa kelompok jasmonat ini memberikan sinyal respon terhadap
gangguan biotik maupun abiotik pada berbagai tanaman yang sama baiknya pada
masing-masing tahapan perkembangan. Sepanjang tahun 1990, banyak indikasi
yang mengatakan bahwa jasmonat juga berperan dalam pengaturan morfogenesis
organ tanaman (Wei-Min et al., 2003).
2.4. Auksin
2.4.1. Biosintesis
Went mempelajari suatu senyawa yang dapat mempengaruhi sinyal pertumbuhan
dengan mendifusikan senyawa tersebut pada bagian ujung koleoptil kedalam blok
agar. Faktanya senyawa tersebut dibentuk pada suatu bagian dan ditransportasikan
dalam jumlah tertentu ke bagian yang mampu memberikan respon (Taiz & Zeiger,
2004).
Menurut Abidin (1983), IAA merupakan auksin endogen yang terbentuk
dari triptofan yang merupakan suatu senyawa dengan inti indole dan selalu
terdapat dalam jaringan tanaman. Dalam biosintesisnya IAA dapat berasal dari 3
jenis prekursor yaitu:
1. Tryptophan berubah menjadi Indole pyruvic Acid, kemudian indole
3-Acetaldehyde dan pada akhirnya membentuk Indole-3-Acetic-Acid (IAA).
2. Tryptamine berubah menjadi Indole-3-acetaldehyde dan selanjutnya
menjadi Indole-3-Acetic-Acid (IAA).
3. Indole-3-Acetonitrile menjadi Indole-3-Acetic-Acid (IAA) melalui
bantuan enzim nitrilase yang mana prosesnya belum diketahui.
Asam amino aromatik triptofan termasuk dalam jalur utama biosintesis
IAA. Hasil intermediet yang terdapat dalam triptofan dan IAA adalah asam indol
piruvat, triptoamin dan indol asetaldehida. Triptofan sendiri terbentuk dari PEP
(fosfo enol piruvat) dan eritrosa-4-fosfat (Wattimena, 1988).
Pemecahan IAA dapat pula terjadi secara alami akibat berlangsungnya
riboflavin dan ß-karoten pada tanaman akan menyerap cahaya. Energi yang
dihasilkan dari proses penyerapan ini dapat mengoksidasi IAA. Sedangkan
oksidasi enzim yang terjadi pada IAA dilakukan oleh enzim hidrogen peroksidase
yang mampu menghasilkan indolaldehid yang bersifat inaktif. Terdapat hubungan
antoagonis antara aktivitas oksidase IAA dengan kandungan IAA didalam
tanaman. Apabila kandungan IAA didalam tanaman tinggi maka aktivitas IAA
oksidase menjadi rendah, begitu pula sebaliknya (Abidin 1983).
2.4.2. Manfaat
Auksin merupakan hormon pertumbuhan pertama yang ditemukan pada tumbuhan
dan banyak aksi komponen fisiologis pada sel tumbuhan bergantung pada
aktivitas auksin tersebut. Auksin dan sitokinin berbeda dengan hormon tumbuhan
yang lain. Auksin dan sitokinin merupakan agen sinyal sangat penting dalam
mempengaruhi viabilitas tanaman. Auksin mengontrol bermacam-macam proses
perkembangan tanaman diantaranya perpanjangan batang, dominansi apikal,
inisiasi akar, perkembangan buah dan pertumbuhan (Taiz dan Zeiger, 2002).
Ditambahkan oleh Abidin (1983), dari segi fisiologisnya auksin berpengaruh
terhadap perkembangan sel, fototropisme, geotropisme, partenokarpi, absisi,
pembentukan kalus dan respirasi.
Zat pengatur tumbuh IAA berperan dalam pembentukan akar pada
potongan jaringan dan juga pembentukan tunas pada beberapa jaringan tanaman
yang diperbanyak melalui teknik kultur jaringan (Fatrurrahman, 2011). Hasil
penelitian terhadap metabolisme auksin menunjukkan bahwa konsentrasi auksin
didalam tanaman, mempengaruhi pertumbuhan tanaman (Abidin, 1983). Aplikasi
campuran hormon IAA dengan kinetin mampu mempercepat pertambahan lilit
batang dan tebal kulit pada pohon karet (Koryati, 2004).
Setelah diketahui IAA merupakan salah satu fitohormon yang penting,
maka disintesis senyawa serupa yang telah teruji keaktifannya secara biologis.
Senyawa sintetik tersebut diantaranya asam indol-3 propionat, asam indole-3
butirat, asam naftalenasetat, asam 2,4 diklorofenoksi asetat dan asam
S-karboksimetil-N. Golongan senyawa sintetik yang pertama dibuat adalah
yang tidak tanpa cirri indol tetapi mempunyai aktifitas biologis seperti IAA. NAA
digunakan sebagai hormon akar (Wattimena, 1988).
NAA dan 2,4 D pada umumnya digunakan pada konsentrasi rendah untuk
mengenali tipe respon auksin dalam pertumbuhan sel, pembelahan sel,
pembuahan dan perakaran meskipun efek yang ditimbulkan bervariasi. NAA lebih
aktif dibandingkan IAA dalam menginduksi pertumbuhan akar pada stek batang.
BAB 3
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini akan dilaksanakan pada bulan Juli sampai dengan Oktober
2014 di Balai Penelitian Karet Sungei Putih, Kecamatan Galang, Kabupaten Deli
Serdang dan Laboratorium Ilmu Dasar, Universitas Sumatera Utara, Medan,
Sumatera Utara.
3.2 Alat dan Bahan
Alat yang akan digunakan adalah botol sampel, mikro pipet, pisau silet,
waterbath, neraca analitik, erlenmeyer, gelas ukur, oven, pipet tetes, pisau cutter,
object glass, cover glass, pinset, gunting, tabung reaksi dan shacker.
Bahan yang digunakan adalah tunas lateral tanaman Hevea brasiliensis
klon jenis IRR 42 dan PB 260, JA, asam naftalenat, whatman, parafilm, anthrone,
TCA 2,5%, KH2PO4, H2SO4, heptamolibdat, NaCl 0,9%, HNO3, formalin, asam
asetat, akuades, alkohol 70%, alkohol absolut, sudan 3, aseton dan gliserin.
3.3. Metode Penelitian
Penelitian menggunakan rancangan petak tersarang (RPT) split plot dengan 2
petak, yaitu:
a. Petak utama (Klon) yaitu: PB260, IRR 42
b. Anak petak (Zat pengatur tumbuh) yaitu: kontrol, JA, NAA dan JA+NAA
Dengan kombinasi perlakuan :
PB260K PB260JA PB260NAA PB260JA+NAA
IRR42K IRR42JA IRR42NAA IRR42JA+NAA
Dengan demikian diperoleh 8 kombinasi perlakuan dengan jumah ulangan
sebanyak 3 ulangan. Sehingga jumlah keseluruhan tanaman yang digunakan
Hasil penelitian dianalisis menggunakan sidik ragam dengan model linear
sebagai berikut :
Y
ijk= µ +
ʈ
i+
β
j(i)+ €
(ij)kData yang diperoleh dianalisis dengan sidik ragam dan perlakuan yang
menunjukkan perbedaan nyata dilanjutkan dengan uji jarak Duncan Multiple
Range Test (DMRT) pada taraf 5% (Gomez dan Gomez, 2007).
3.4 Prosedur Penelitian 3.4.1 Analisis Histologi 3.4.1.1 Pemangkasan Klon
Proses pemangkasan dilakukan pada klon jenis IRR 42 dan PB 260 usia
1-2 tahun. Pemangkasan dilakukan secara bersamaan dan perkembangan dikontrol
setiap minggu sampai muncul tunas lateral berumur 50 hari.
3.4.1.2 Perlakuan Tunas Lateral Klon
Perlakuan terhadap tunas lateral pada klon menggunakan metode Hao
dan Wu (2000) yang telah dimodifikasi. Tunas lateral berumur 50 hari dari setiap
jenis klon dibalut dengan whatman sepanjang 10 cm yang telah ditetesi 0,5 ml
larutan JA 1000 ppm, larutan NAA 1000 ppm dan kombinasi larutan JA dengan
NAA 1000 ppm pada bagian 10 cm dari batang utama terhadap tunas lateral.
Whatman pada tunas lateral ditutup dengan parafilm. Setiap satu minggu sekali,
whatman diganti dan diberi perlakuan yang sama (ditetesi 0,5 ml larutan JA 1000
ppm, NAA 1000 ppm dan kombinasi larutan JA dengan NAA 1000 ppm).
Setelah 50 hari tunas lateral dipotong sepanjang 10 cm di bagian perlakuan.
3.4.1.3 Pembuatan Preparat
Pembuatan preparat jaringan menggunakan metode Gomez et al (1972)
yang telah dimodifikasi. Sampel jaringan diambil pada bagian batang yang diberi
perlakuan dengan menggunakan sampler bast dan langsung dimasukkan kedalam
larutan NaCl fisiologis. Sampel jaringan kemudian difiksasi selama satu malam.
Sampel jaringan yang telah difiksasi dimasukkan kedalam larutan KOH 15%
selama 2 jam. Sebelum masuk pada tahapan pewarnaan, sampel jaringan
dimasukkan kedalam alkohol 70%. Setelah 15 menit, sampel jaringan dimasukkan
kedalam pewarna sudan III selama 30 menit. Sampel jaringan diiris secara
melintang atau membujur menggunakan silet dan diamati dibawah mikroskop.
3.4.1.4 Pengukuran Tebal Kulit Tanaman
Tebal kulit tanaman dihitung dibawah mikroskop cahaya dengan
perbesaran 4 X 10. Tebal kulit tanaman dihitung pada penampang preparat yang
dilakukan pada 3 titik (kanan, tengah, kiri). Tebal kulit tanaman yang terukur
dicatat dan dihitung rata-ratanya.
3.4.1.5 Penghitungan Jumlah Latisifer
Jumlah latisifer dihitung dibawah mikroskop cahaya dengan perbesaran 4
X 10. Latisifer dihitung pada penampang preparat sepanjang 500 µm yang
dilakukan pada 3 titik. Latisifer yang terhitung dicatat dan dihitung rata-ratanya.
Jumlah latisifer yang terlihat dan terhitung menunjukkan diferensiasi latisifer
yang terjadi.
3.4.1.6 Pengukuran Diameter Latisifer
Diameter latisifer dihitung dibawah mikroskop cahaya dengan perbesaran
4 X 10. Diameter latisifer dihitung pada penampang preparat sepanjang 500 µm
yang dilakukan pada 3 titik. Diameter latisifer yang terukur dicatat dan dihitung
rata-ratanya.
3.4.2 Analisis Fisiologi
3.4.2.1 Analisis Kandungan Fosfat Anorganik
Analisis kandungan fosfat anorganik dilakukan dengan menggunakan
metode Taussky & Shorr (1953) yang telah dimodifikasi. Sebanyak 0,3 ml sampel
lateks dimasukkan kedalam tabung reaksi dan ditambahkan TCA 2,5% hingga
volume 1,5 ml. Sampel ditambahkan 1 ml pereaksi campur (Fe2SO4 + Akuades +
Larutan Molibdat) dan divorteks. Sampel didiamkan selama 10 menit pada suhu
3.4.2.2 Pembuatan Kurva Standar Fosfat Anorganik
Pembuatan kurva standar fosfat dilakukan dengan membuat seri larutan
standar sebagai berikut:
Ditambahkan 1 ml pereaksi campur dan divorteks. Sampel didiamkan selama 10
menit pada suhu kamar. Absorbansi sampel diukur pada panjang gelombang 750
nm.
3.4.2.3 Perhitungan Konsentrasi Fosfat Anorganik
Konsentrasi fosfat dihitung dengan menggunakan rumus:.
3.4.2.4 Analisis Kandungan Sukrosa
Analisis kandungan sukrosa lateks menggunakan metode Dische (1962)
yang telah dimodifikasi. Sebanyak 150 µL sampel lateks dimasukkan ke dalam
tabung reaksi. Sampel ditambahkan 350 µL TCA 2,5% dan 3 ml pereaksi
anthrone kemudian divorteks. Sampel dimasukkan kedalam waterbath selama 15
menit dan dipindahkan ke dalam air biasa hingga dingin. Absorbansi sampel
diukur pada panjang gelombang 627 nm.
3.4.2.5 Pembuatan Kurva Standar Sukrosa
Pembuatan kurva standar sukrosa dilakukan dengan membuat seri larutan
standar sebagai berikut:
Konsentrasi Akhir (mM) 0 0,15 0,3 0,45 0,6 0,9 1,2
Volume Sukrosa 2 mM (µL) 0 37,5 75 112,5 150 225 300
Volume TCA 2,5% (µL) 500 463 425 387,5 350 275 200
Ditambahkan 3 ml pereaksi anthrone dan divorteks. Sampel dimasukkan kedalam
waterbath selama 15 menit dan dipindahkan ke dalam air biasa. Absorbansi
sampel diukur pada panjang gelombang 627 nm.
Konsentrasi Akhir (mM) 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
Volume KH2PO4 2 mM (µL) 0 15 30 45 60 75 90 105
Volume TCA 2,5% (µL) 1500 1485 1470 1455 1440 1425 1410 1395
3.4.2.6 Perhitungan Konsentrasi Sukrosa
Konsentrasi sukrosa dihitung dengan menggunakan rumus:
3.4.2.7Analisis Produksi Karet/Sadap/Tunas Lateral
Analisis produksi karet dilakukan dengan menggunakan metode Balai
Penelitian Sungei Putih yang telah dimodifikasi. Tunas lateral tanaman disayat
pada bagian yang diberi perlakuan. Tetesan lateks yang keluar ditampung
menggunakan kertas saring yang telah ditimbang beratnya hingga lateks berhenti
mengalir. Lateks yang tertampung diatas kertas saring ditimbang untuk mendapati
berat basah lateks. Lateks yang tertampung pada kertas saring dikeringkan
didalam oven selama 1 jam pada suhu 100-105ºC. Ditimbang berat kering lateks
dan dipersentasekan kandungan karet yang terdapat pada lateks.
3.4.2.8Persentase Produksi Karet/Sadap/Tunas Lateral
Persentase produksi karet dihitung dengan menggunakan rumus:
Produksi Karet (%) = (Berat kering / Berat basah) X 100%
BAB 4
HASIL DAN PEMBAHASAN
Berdasarkan analisis yang telah dilakukan tentang pengamatan histologis
yang meliputi tebal kulit, jumlah latisifer dan diameter latisifer dan pengamatan
fisiologis yang meliputi kandungan fosfat, kandungan sukrosa dan produksi karet
pada tanaman karet (Hevea brasiliensis) didapatkan hasil sebagai berikut:
4.1 Analisis Histologi 4.1.1 Tebal Kulit
Pengukuran tebal kulit tanaman dilakukan secara mikroskopis menggunakan
mikroskop cahaya. Klon PB 260 merupakan tipe klon penghasil lateks dengan
tingkat metabolisme yang tinggi. Sedangkan klon IRR 42 merupakan tipe klon
penghasil lateks dan kayu dengan tingkat metabolisme yang cenderung lebih
rendah jika dibandingkan dengan klon PB260. Hasil data perhitungan dan sidik
ragam menunjukkan bahwa tebal kulit tanaman dipenaruhi oleh jenis klon
(Lampiran 18, 19).
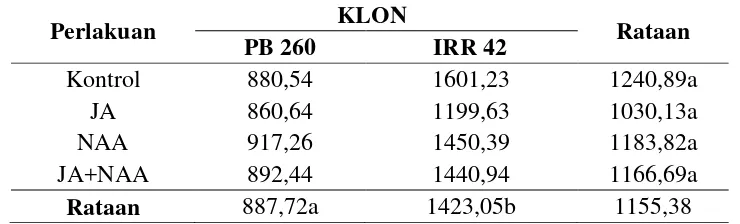
Pengaruh faktor perlakuan jenis klon berpengaruh nyata terhadap tebal
kulit tanaman (Tabel 1). Secara visual terlihat bahwa klon IRR 42 pada umumya
memiliki ukuran lilit batang yang lebih besar dibandingkan klon PB 260. Tebal
kulit tanaman ini mungkin disebabkan oleh perbedaan genetik antara kedua klon
dan ukuran lilit batang pada masing-masing klon. Terjadi pengalihan
substansi-substansi tanaman tertentu kedalam mekanisme pembentukan sel-sel pada
jaringan kulit sehingga terjadi penebalan pada bagian kulit.
Pada pengaruh faktor perlakuan jenis zat pengatur tumbuh JA, NAA dan
kombinasinya tidak berpengaruh nyata terhadap tebal kulit tanaman karet.
Pemberian JA pada klon PB 260 dan IRR 42 justru menyebabkan penurunan tebal
kulit tanaman. JA diduga mengalihkan proses metabolik tanaman dalam
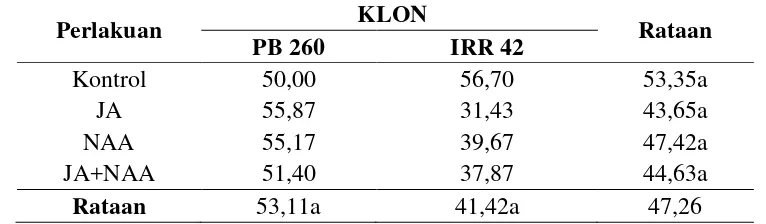
Tabel 1. Pengaruh pemberian JA, NAA dan kombinasinya terhadap tebal kulit tanaman pada klon karet PB 260 dan IRR 42.
Perlakuan KLON Rataan
PB 260 IRR 42
Kontrol 880,54 1601,23 1240,89a
JA 860,64 1199,63 1030,13a
NAA 917,26 1450,39 1183,82a
JA+NAA 892,44 1440,94 1166,69a
Rataan 887,72a 1423,05b 1155,38
Keterangan: Angka-angka yang diikuti huruf yang sama pada kelompok perlakuan yang sama menunjukkan tidak berbeda nyata menurut Uji Duncan's Multiple Range Test pada
taraf α 5%
Karakteristik pada kulit karet yang memiliki pengaruh terhadap potensi
produksi lateks adalah tebal kulit dan jumlah cincin pembuluh lateks (Dalin et al.,
2010). Kulit merupakan faktor yang sangat penting diamati terutama ketebalannya
karena latisifer yang mengandung lateks terdapat pada kulit (Woelan dan
Sayurandi, 2009).
Jumlah baris latisifer berkurang seiring dengan peningkatan pengambilan
sampel dengan jarak yang tidak teratur. Baris-baris latisifer yang satu dengan
yang lain memiliki korelasi positif terhadap ketebalan kulit tanaman (Gomez,
1982). Biasanya pertumbuhan tebal kulit akan mengikuti pertumbuhan lilit batang
(Woelan dan Sayurandi, 2009).
Kulit berkembang dengan cara yang sama dalam setiap kasus meskipun
kecepatannya berbeda dibawah pengaruh intensitas stimulasi ethrel dan auksin
(2,4 D) (d’Auzac et al, 1989). Pada penelitian ini, auksin (dalam bentuk NAA)
pada konsentrasi 1000 ppm juga menghasilkan pertambahan tebal kulit paling
besar meskipun dengan perbedaan yang tidak nyata jika dibandingkan dengan
perlakuan yang lain pada klon PB 260. Auksin secara eksogen akan
mempengaruhi kadar auksin endogen. Pemberian ZPT pada konsentrasi tertentu
akan menstimulasi pertumbuhan tanaman, karena meningkatkan level hormon
endogen (Wattimena, 1982). Auksin (dalam bentuk IAA) pada konsentrasi 50
ppm menyebabkan pertambahan tebal kulit yang nyata pada klon PB 260 tanaman
Hevea brasiliensis (Koryati, 2004). Dibutuhkan konsentrasi zpt yang tepat untuk
diperlukan beberapa tingkatan konsentrasi NAA untuk menghasilkan
pertambahan tebal kulit yang lebih besar.
Ketebalan kulit bertambah seiring dengan pertambahan usia tanaman.
Pertumbuhan tebal kulit merupakan karakteristik spesifik pada klon tertentu.
Tujuan melakukan evaluasi ketebalan kulit adalah untuk mendapatkan tanaman
yang mempunyai kulit yang cukup tebal sehingga diharapkan menghasilkan
baris-baris latisifer yang lebih banyak. Tanaman dengan kulit yang terlalu titpis tidak
diharapkan karena berpotensi besar untuk terjadi pelukaan kambium pada saat
penyadapan (Kurnia, 2011).
Menurut Woelan dan Sayurandi (2009), anatomi kulit saat tanaman belum
menghasilkan juga perlu diketahui. Kesalahan dalam mengeksploitasi kulit akan
mengganggu produksi lateks selama umur ekonomi tanaman.
4.1.2 Jumlah Latisifer
Analisis histologi latisifer pada klon PB 260 dan IRR 42 dilakukan pada tunas
lateral berumur 50 hari dari tanaman muda (usia 4 tahun). Diferensiasi latisifer
dapat dilihat dari pertambahan jumlah latisifer yang dipengaruhi oleh banyak
faktor antara lain faktor musim, faktor genetik dan zat pengatur tumbuh. Hasil
analisis data penghitungan dan hasil sidik ragam jumlah latisifer (Lampiran 14,
15) menunjukkan bahwa faktor perlakuan jenis klon dan faktor perlakuan jenis zat
pengatur tumbuh berpengaruh nyata terhadap jumlah latisifer.
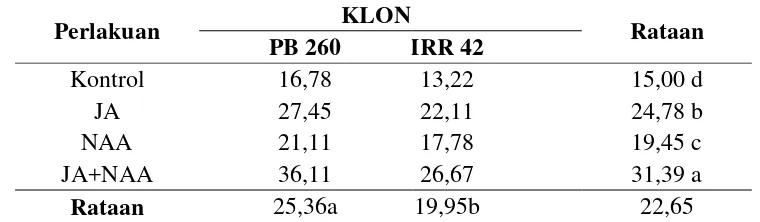
Jenis klon dan zat pengatur tumbuh yang diberikan berpengaruh nyata
terhadap jumlah latisifer (Tabel 2). Respon klon PB 260 terhadap perlakuan
berbeda nyata dengan klon IRR 42 dan perlakuan JA, NAA dan kombinasinya
berbeda nyata terhadap kontrol perlakuan. JA, NAA dan kombinasinya
menyebabkan pertambahan jumlah latisifer pada kedua klon. Perlakuan yang
paling baik dalam menginduksi diferensiasi latisifer pada kedua klon adalah
kombinasi JA+NAA diikuti oleh JA dan NAA dengan jumlah latisifer
berturut-turut 31,39, 24,78 dan 19,45. Pertambahan jumlah pembuluh lateks
mengindikasikan terjadinya peningkatan aktivitas diferensiasi sel-sel parenkim
Tabel 2. Pengaruh pemberian JA, NAA dan kombinasinya terhadap diferensiasi latisifer pada klon karet PB 260 dan IRR 42.
Perlakuan KLON Rataan
PB 260 IRR 42
Keterangan: Angka-angka yang diikuti huruf yang sama pada kelompok perlakuan yang sama menunjukkan tidak berbeda nyata menurut Uji Duncan's Multiple Range Test pada
taraf α 5%
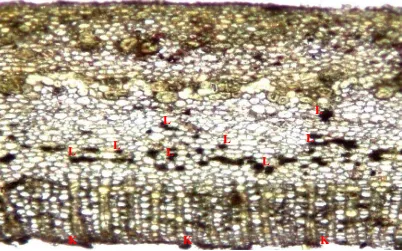
Pada Hevea, latisifer diketahui terdapat didalam semua organ tanaman
termasuk batang, daun, bunga dan buah (Gomez, 1982). Latisifer pada Hevea
brasiliensis tergolong kedalam tipe saluran getah berbuku dan beranastomosis
yang saling berartikulasi dengan susunan yang spesifik dimana masing-masing
saluran getah berbuku mengadakan hubungan lateral satu sama lain dan
membentuk stuktur seperti jala atau retikulum (Setjo dkk, 2004; Priyadarshan,
2011; Gomez, 1982). Pada sayatan melintang kulit dari hevea, latisifer memiliki
bentuk agak bundar yang terletak berdekatan dengan parenkim. Latisifer disusun
pada baris-baris yang teratur sejajar dengan kambium. Hevea memiliki cincin
latisifer yang konsentris. Masing-masing cincin atau baris dipisahkan oleh sieve
elements dan parenkim floem (Gomez, 1982).
Berdasarkan penelitian Hao & Wu (2000) dan Wijayati (2005), JA dan
auksin merupakan zat pengatur tumbuh yang menginduksi pertambahan jumlah
sel-sel sekretori tanaman. Kombinasi JA dan auksin dalam konsentrasi 1000 ppm
merupakan kombinasi yang bekerja secara searah dan memberikan respon balik
yang positif terhadap pertambahan jumlah latisifer pada tanaman Hevea
brasiliensis.
Menurut Hao & Wu (2000), pada batang aplikasi JA menginduksi
pembentukan baris-baris latisifer pada floem sekunder. Ini membuktikan bahwa
laju diferensiasi latisifer dari kambium vaskuler dipengaruhi oleh JA. Hao & Wu
melakukan penelitian lanjutan menggunakan JA dalam beberapa tingkatan
konsentrasi dan beberapa tingkatan pertumbuhan batang dan daun. Diketahui
masing-masing tingkatan pertumbuhan batang dan daun pada konsentrasi 0,005%.
Penelitian yang hampir serupa dilakukan oleh Wei-Min et al (2003), aplikasi JA
menginduksi baris latisifer sekunder pada floem sekunder yang dilukai. Baris
latisifer sekunder yang terbentuk sangat dekat dengan kambium, berjumlah lebih
banyak, berukuran lebih kecil dan berisi sedikit karet yang ditandai dengan warna
coklat yang terang.
Dari berbagai proses, jasmonat eksogen juga menghambat perkecambahan
biji, pertumbuhan kalus, pertumbuhan akar, fotosintesis, dan biosintesis dari
ribulosabifosfat karboksilase. Beberapa efek mungkin terjadi karna respon stres
akibat pemberian jasmonat dengan konsentrasi yang terlalu tinggi. Sifat sistemik
Jasmonat pada tanaman masih belum dapat dijelaskan secara pasti. Jasmonat
mungkin merupakan salah satu substansi yang diangkut dalam tanaman. Tidak
diketahui apakah jasmonat mengalami mobilisasi atau tidak didalam tubuh
tumbuhan (Davies, 1995).
Inisiasi latisifer dari kambium pada pohon yang matang sadap merupakan
suatu proses yang teratur (Gomez, 1982). Menurut Wattimena (1988), auksin
berperan pada pertumbuhan sekunder tanaman termasuk pembelahan sel-sel
didaerah kambium. Ditambahkan dalam penelitian wijayati (2005), konsentrasi
auksin (dalam bentuk IAA) sebesar 300 ppm memberikan efek yang signifikan
terhadap jumlah sel sekretori pada rimpang C. domestica yang terletak menyebar
baik diantara jaringan dasar dari parenkim korteks maupun jaringan dasar stele.
4.1.3 Diameter Latisifer
Pengukuran diameter latisifer dilakukan pada penampang melintang kulit batang
tanaman. Besarnya diameter diukur searah dengan sintesis latisifer dari kambium
menuju bagian epidermis. Hasil analisis data penghitungan dan hasil sidik ragam
diameter latisifer (Lampiran 16, 17) menunjukkan bahwa faktor perlakuan jenis
zat pengatur tumbuh berpengaruh terhadap diameter latisifer.
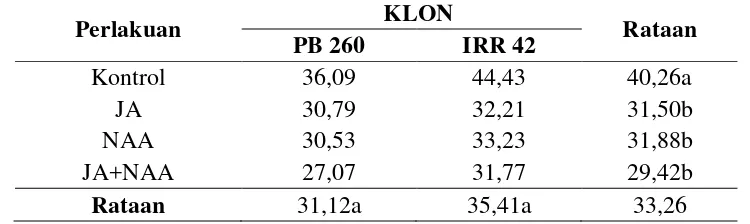
Jenis klon yang digunakan tidak berpengaruh nyata terhadap diameter
latisifer, sedangkan jenis perlakuan yang diberikan berpengaruh nyata terhadap
diameter latisifer (Tabel 3.). Respon perlakuan JA, NAA dan JA+NAA berbeda
besar jika dibandingkan perlakuan JA, NAA dan kombinasinya pada kedua klon.
Jika dikaitkan dengan parameter sebelumnya, perlakuan kontrol memiliki jumlah
latisifer yang sedikit dan memiliki diameter yang besar. Dengan demikian induksi
zat pengatur tumbuh yang diberikan mengakibatkan pertambahan jumlah latisifer
dan membuat ukurannya semakin kecil. Diameter latisifer yang bertambah kecil
diduga karena aktifitas pembelahan sel-sel latisifer yang meningkat.
Tabel 3. Pengaruh pemberian JA, NAA dan kombinasinya terhadap ukuran diameter pada klon karet PB 260 dan IRR 42.
Perlakuan KLON Rataan
PB 260 IRR 42
Keterangan: Angka-angka yang diikuti huruf yang sama pada kelompok perlakuan yang sama menunjukkan tidak berbeda nyata menurut Uji Duncan's Multiple Range Test pada taraf α 5%
Parameter-parameter histologi merupakan komponen yang penting untuk
menentukan karakter produksi pada beberapa progeni tanaman Hevea brasiliensis.
Menurut Sethuraj & Mathew (1992), salah satu parameter histologi yang juga
penting adalah diameter latisifer. Besaran diameter pembuluh lateks sangat
dipegaruhi oleh umur tanaman (Woelan dan Sayurandi, 2009).
Menurut Evans et al. (1984), dua hormon yang digabungkan dan
diaplikasikan mungkin bekerja secara masing-masing atau mungkin berinteraksi
dalam mempengaruhi proses yang sama. Ketika dua hormon memberikan
pengaruh yang sebanding saat diperlakukan secara tunggal, dapat diartikan bahwa
gabungan dari kedua hormon tersebut bekerja secara masing-masing dalam
mempengaruhi suatu proses, tetapi ketika gabungan hormon menunjukkan hasil
yang lebih besar atau lebih sedikit dibandingkan jumlah respon yang ditimbulkan
pada masing-masing hormon maka proses tersebut dipengaruhi oleh interaksi dari
kedua hormon.
Karakteristik auksin terhadap jaringan batang adalah sebagai promotor
pemanjangan sel dalam 10 sampai 20 menit setelah aplikasi yang diikuti dengan
hidrogen. Stimulasi pemanjangan sel pada batang terjadi pada sebagian besar
tanaman dikotil (Evans et al, 1984). Tetapi mungkin Hevea brasiliensis tidak
mengalami aturan demikian. Dijelaskan oleh Koryati (2004) melalui penelitiannya
bahwa, auksin (dalam bentuk IAA) tidak memberikan perbedaan yang nyata
terhadap jumlah dan diameter latisifer.
4.2 Analisis Fisiologi
4.2.1 Kadar Sukrosa Lateks
Perhitungan sukrosa dilakukan pada 20 kali pengenceran didalam larutan asam
triklorat (TCA). Konsentrasi sukrosa diukur menggunakan sprektrofotometer pada
panjang gelombang 627 nm. Dari data penghitungan dan hasil sidik ragam kadar
sukrosa (Lampiran 20, 21) menunjukkan bahwa jenis klon dan jenis zat pengatur
tumbuh yang diperlakukan tidak memberikan pengaruh yang signifikan terhadap
kadar sukrosa pada tanaman muda (usia 4 tahun).
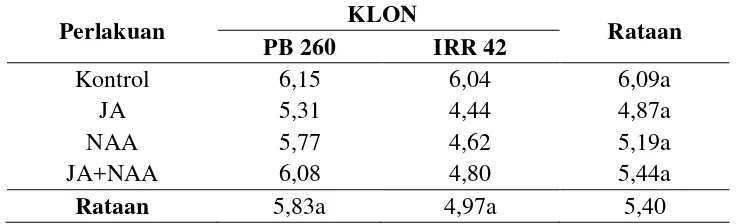
Jenis klon dan jenis perlakuan yang diberikan tidak berpengaruh nyata
terhadap kadar sukrosa. Terjadi penurunan kadar sukrosa pada klon PB 260 dan
IRR 42 jika dibandingkan oleh kontrol perlakuan (Tabel 4). Kadar sukrosa yang
dihasilkan berkisar antara 4-6 mM tergolong kedalam kategori rendah-sedang (d’
Auzac, 1989). Hal ini mungkin disebabkan karena tanaman yang digunakan
merupakan tanaman muda dan merupakan tanaman belum meghasilkan sehingga
proses pertumbuhan dan perkembangan tanaman masih aktif seperti pembentukan
latisifer. Latisifer membutuhkan sukrosa dalam jumlah yang banyak sebagai
substansi utama yang dimafaatkan dalam pembentukannya.
Tabel 4. Pengaruh pemberian JA, NAA dan kombinasinya terhadap ukuran kadar sukrosa lateks pada klon karet PB 260 dan IRR 42.
Perlakuan KLON Rataan
PB 260 IRR 42
Keterangan: Angka-angka yang diikuti huruf yang sama pada kelompok perlakuan yang sama menunjukkan tidak berbeda nyata menurut Uji Duncan's Multiple Range Test pada
Regulasi hormon terhadap pertumbuhan dan perkembangan bergantung
pada respon aplikasi hormon kepada tanaman. Pertumbuhan dan perkembangan
merupakan hal yang dapat membatasi produktivitas tanaman. Beberapa proses
penting seperti fotosintesis, metabolisme nitrogen dan berbagai proses yang lain
mungkin tidak menyebabkan produktivitas tanaman meningkat karena hasil dari
proses-proses tersebut digunakan untuk proses pertumbuhan dan perkembangan
(Evans et al, 1984).
Perbedaan antar spesies dapat dipahami setelah ditemukan bahwa
fotosintesis itu sendiri adalah sistem reaksi enzimatik yang cenderung dipengaruhi
oleh keseluruhan sistem metabolisme sel (Steward, 1960). Fotosintesis merupakan
suatu proses pembentukan karbohidrat (sakarida) dari senyawa anorganik dengan
bantuan cahaya matahari (Ai, 2012).
Menurut d’Auzac et al. (1989), regenerasi lateks dikontrol oleh 4
mekanisme yakni:
1. Ketersediaan sukrosa
2. Regulasi aktivitas enzimatik
3. Ketersediaan energi biokimia dan regenerasi insitu
4. Reaksi yang menginduksi fenomena penuaan dan reaksi anioksidan yang
melawan molekul oksigen toksik atau detoksifikasi latisifer.
Latisifer merupakan tempat utama dari biosintesis karet (Priyadarshan,
2011). Sakarida didalam latisifer terutama hadir dalam bentuk sukrosa. Sukrosa
tersebut merupakan prekursor dalam pembentukan partikel karet. Alokasi sukrosa
kelatisifer didasari pada keseimbangan antara sukrosa yang dihasilkan dan yang
dimanfaatkan (d’Auzac et al., 1989).
Perubahan kadar sukrosa pada lateks setelah diberi perlakuan seperti
auksin sintetik dan etephon sangat dipengaruhi oleh tingkat metabolisme dalam
jaringan (d’Auzac et al., 1989). Kadar sukrosa rendah (< 5 mM) memberikan
indikasi penggunaan bahan asimilat menjadi lateks sangat intensif atau dapat
dikatakan tanaman mengalami lelah fisiologi dengan kemampuan produksi yang
semakin menurun (Sumarmadji dkk, 2006).
Kadar sukrosa yang terukur dalam lateks merupakan selisih antara influks
Kadar sukrosa lateks yang tinggi tidak mutlak memberikan gambaran pada
potensi produksinya tetapi justru dapat menggambarkan produksi aktual yang
rendah, karena produksi lateks dan pertumbuhan berkompetisi dengan kuat dalam
hal penggunaan sukrosa (Sumarmadji, 2000). Tetapi kemudian dijelaskan oleh
Priyadarshan (2011), kehadiran gula pada latisifer merupakan atribut utama
pengatur metabolisme lateks, yang bergantung pada ketersediaan karbohidrat pada
jaringan latisifer dan kegunaannya dalam tingkatan sel. Katabolisme sukrosa
menghasilkan molekul asetat yang menginisiasi rantai isoprene dan menghasilkan
energi yang penting untuk memanfaatkan latisifer. Konsentrasi gula yang tinggi
memiliki korelasi yang positif terhadap produksi lateks.
4.2.2 Kadar Fosfat Anorganik Lateks
Perhitungan kadar fosfat anorganik dilakukan pada 20 kali pengenceran
didalam larutan asam triklorat (TCA). Konsentrasi fosfat anorganik diukur
menggunakan spektrofotometer pada panjang gelombang 750 nm. Data
penghitungan dan hasil sidik ragam kadar fosfat anorganik (Lampiran 22, 23)
menunjukkan bahwa jenis klon dan jenis zat pengatur tumbuh yang diperlakukan
tidak memberikan pengaruh yang signifikan terhadap kadar fosfat anorganik pada
tanaman muda (usia 4 tahun).
Pada masing-masing klon kandungan fosfat anorganik adalah tinggi
(>10mM) (Tabel 5). Hal ini mungkin disebabkan karena pada penelitian ini
tanaman yang digunakan adalah tanaman yang belum menghasilkan dan belum
mengalami penyadapan. Lateks yang dihasilkan oleh tanaman muda (usia 4 tahun)
berjumlah sedikit sehingga tidak terdapat substansi sukrosa yang cukup untuk
dapat diubah menjadi partikel karet. Perubahan sukrosa menjadi partikel karet
memerlukan kehadiran fosfat anorganik sebagai penyedia energi. Diduga terjadi
akumulasi fosfat anorganik pada lateks karena tidak dimanfaatkan dalam proses
perubahan sukrosa menjadi partikel karet sehingga menyebabkan fosfat anorganik
terakumulasi dan kadarnya meningkat.
Meskipun kadar fosfat anorganik tergolong kedalam tingkatan yang tinggi,
tetapi ditemukan penurunan kadar fosfat anorganik pada klon IRR 42 jika
mungkin berkaitan dengan bertambahnya tebal kulit tanaman pada klon IRR 42.
Diduga pemanfaatan fosfat anorganik sebagai penyedia energi dalam proses
diferensiasi sel-sel pada jaringan kulit lebih tinggi pada klon IRR 42 sehingga
kadar fosfat anorganik mengalami penurunan yang signifikan.
Tabel 5. Pengaruh pemberian JA, NAA dan kombinasinya terhadap ukuran kadar fosfat anorganik lateks pada klon karet PB 260 dan IRR 42.
Perlakuan KLON Rataan
PB 260 IRR 42
Keterangan: Angka-angka yang diikuti huruf yang sama pada kelompok perlakuan yang sama menunjukkan tidak berbeda nyata menurut Uji Duncan's Multiple Range Test pada
taraf α 5%
Karakter fisiologi lateks seperti kadar sukrosa, fosfat anorganik,
magnesium, tiol, pH dan potensial redoks merupakan hal yang penting dalam
biosintesis karet. Fosfat anorganik dan sukrosa merupakan dua parameter fisiologi
yang didiagnosa dari lateks. Stimulasi pada tanaman karet dapat mempengaruhi
perubahan karakter fisiologi lateks tersebut (Sethuraj & Mathew, 1992;
Sumarmadji, 2000; Silpi et al., 2006).
Korelasi diantara kedua parameter (fosfat dan sukrosa) dapat digunakan
untuk menetapkan tipe metabolisme dari tanaman (Silpi et al., 2006). Kehadiran
fosfat anorganik menunjukkan metabolisme energi lateks. Fosfat mempengaruhi
sintesis nukleotida, transfer energi dan sintesis isopren melalui ikatan adenosin
fosfat dan pirofosfat (Sethuraj & Mathew, 1992; Sumarmadji, 2000).
Pada tanaman muda (usia 3-4 tahun), kadar fosfat anorganik yang sangat
rendah berkisar antara 2-6 mM merupakan suatu tanda peringatan bahwa tanaman
sedang mengalami kelelahan dalam menyediakan energi untuk metabolisme.
Suplai fosfat anorganik kurang mencukupi untuk membantu sel-sel pembuluh
lateks dalam mengubah sukrosa menjadi partikel karet (Rachmawan &
Sumarmadji, 2007).
Pada tanaman yang telah disadap, kisaran optimal kadar fosfat anorganik
optimal tersebut berarti kemampuan tanaman dalam melakukan metabolisme juga
semakin berkurang. Sebaliknya, semakin tinggi kadar fosfat anorganik dari
kisaran optimalnya, mengindikasikan bahwa tanaman mengalami over eksploitasi
atau mengindikasikan tanaman terserang penyakit (d’ Auzac et al., 1989).
Fosfat anorganik memiliki muatan negatif yang membantu menstabilkan
partikel karet sehingga memperlambat koagulasi lateks dan memperlama waktu
aliran lateks. Tanaman dengan kadar fosfat yang tinggi mendukung
berlangsungnya proses metabolisme yang aktif dalam sitosol sel latisifer terutama
biosintesis lateks (Kurnia, 2011; Sumarmadji, 2000).
4.2.3 Produksi Karet/Sadap/Tunas lateral
Analisis produksi karet dilakukan dengan cara menampung tetesan lateks pada
kertas saring dan melakukan pemanasan lateks didalam oven hingga diperoleh
berat karet kering. Dari data penghitungan dan hasil sidik ragam kadar sukrosa
(Lampiran 25, 26) menunjukkan bahwa jenis klon yang diperlakukan memberikan
pengaruh yang signifikan terhadap produksi karet pada tanaman muda (usia 4
tahun).
Diketahui bahwa faktor perlakuan jenis klon berbeda nyata terhadap
produksi karet, sedangkan pengaruh faktor perlakuan jenis zat pengatur tumbuh
tidak berbeda nyata terhadap produksi karet (Tabel 6). Hal ini mungkin
disebabkan karena perbedaan tingkat metabolisme tanaman dalam merubah
sukrosa menjadi partikel karet dengan suplai energi yang berasal dari fosfat.
Beberapa parameter histologi seperti jumlah dan diameter latisifer juga diduga
memberikan kontribusi terhadap produksi karet yang dihasilkan oleh klon PB 260
dan IRR 42.
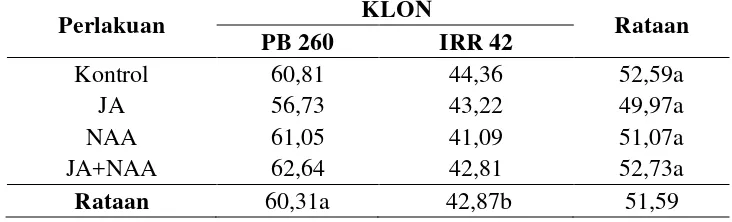
Tabel 6. Pengaruh pemberian JA, NAA dan kombinasinya terhadap produksi karet/sadap/tunas lateral pada klon karet PB 260 dan IRR 42.
Perlakuan KLON Rataan
Keterangan: Angka-angka yang diikuti huruf yang sama pada kelompok perlakuan yang sama menunjukkan tidak berbeda nyata menurut Uji Duncan's Multiple Range Test pada taraf α 5%
Hasil karet kering/pohon/sadap suatu klon karet bergantung pada ukuran
lilit batang. Pada klon yang sama produksi akan lebih besar pada tanaman dengan
lilit batang yang besar (Oktavia & Lasminingsih, 2010). Tetapi dari hasil
penelitian ini didapati bahwa tebal kulit tidak memiliki korelasi yang positif
terhadap produksi karet. Klon IRR 42 yang memiliki kulit yang lebih tebal
memiliki produksi karet yang lebih rendan dibandingkan dengan klon PB 260
yang memiliki kulit lebih tipis.
Lateks umumnya mengandung 25-40% bahan karet mentah yang
mengandung senyawa kimia kompleks antara lain karet hidrokarbon, protein,
lipid, karbohidrat, garam anorganik dan lain lain. Kandungannya bergantung pada
jenis tanaman dan cara penyadapan. Pada tanaman yang belum disadap
kandungan karet pada tanaman mampu mencapai 60% atau lebih (Sethuraj &
Mathew, 1992; Fachry et al., 2012). Tingkat aliran lateks dan perubahan dari
tekanan turgor memiliki hubungan langsung terhadap aspek anatomi pada sistem
latisifer (Priyadarshan, 2011).
Tingginya nilai koefesien keragaman produksi karet kering pada tanaman
disebabkan banyaknya faktor produksi yang mempengaruhi seperti genetik, lilit
batang, tebal kulit, jumlah latisifer, diameter latisifer dan lingkungan yang
masing-masing komponennya juga memiliki keragaman (Akbar et al., 2013).
Pada penelitian ini ditunjukkan bahwa, klon PB 260 yang memiliki tebal
kulit lebih kecil memiliki produksi lateks yang lebih tinggi. Produksi lateks yang
tinggi tidak ditunjukkan dari seberapa besar ukuran lilit batang dan tebal kulit.
Produksi lateks mungkin dipengaruhi oleh tingkat metabolisme yang terjadi pada
masing-masing tanaman. Menurut Sethuraj & Mathew (1992), metabolisme
mengambil peranan penting dalam bidang produksi melalui pembentukan lateks
didalam jaringan latisifer. Kandungan sukrosa yang tinggi mengindikasikan
adanya ketersediaan prekursor karet yang banyak didalam latisifer dan diikuti
dengan metabolisme yang aktif.
Menurut Rachmawan & Sumarmadji (2007), kadar karet kering diukur
bobot basah tetesan lateks. Fluktuasi kadar karet kering tidak hanya dipengaruhi
oleh faktor umur tanaman tetapi juga dipengaruhi oleh respon tanaman terhadap
penyadapan. Tanaman yang telah disadap cenderung memiliki nilai kadar karet
kering yang lebih tinggi dibandingkan tanaman yang baru saja disadap.
Peningkatan kadar karet kering menunjukkan adanya semacam adaptasi tanaman
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Jenis klon berpengaruh terhadap kondisi histologis latisifer berupa tebal kulit,
jumlah latisifer dan diameter latisifer dan berpengaruh terhadap kondisi
fisiologis latisifer berupa produksi karet.
b. Zat pengatur tumbuh berpengaruh terhadap kondisi histologis latisifer berupa
jumlah latisifer dan diameter latisifer dan tidak berpengaruh terhadap kondisi
fisiologis latisifer.
c. Interaksi antara zat pengatur tumbuh dan klon berpengaruh terhadap kondisi
histologi latisifer berupa tebal kulit, jumlah latisifer dan diameter latisifer dan
berpengaruh terhadap kondisi fisiologis latisifer berupa kadar fosfat, kadar
sukrosa dan produksi karet.
5.2 Saran
a. Diperlukan metode pembuatan preparat yang lebih baik untuk menghitung
jumlah diameter latisifer, mengukur diameter latisifer dan mengukur tebal kulit
tanaman.
b. Diperlukan pengujian zat pengatur tumbuh pada klon yang berbeda untuk
DAFTAR PUSTAKA
Abidin, Z. 1983. Dasar-Dasar Pengetahuan Tentang zat Pengatur Tumbuh. Bandung: Angkasa.
Ai, N, S. 2012. The Evolution Of Photosynthesis in Plant. Scientific Journal Of Science. Manado: University of Sam ratulangi. 12(1): pg. 1
Dailin, A., Sayurandi, Pasaribu, S. A., 2010. Potensi keunggulan klon karet harapan IRR seri 200 dari hasil seleksi pohon induk. Jurnal penelitian karet. 28(1): pg. 5
Dalimunthe, A. 2004. Biosintesis lateks. Medan: USU Digital Library.
d’ Auzac ???????????
Davies, P, J. 1995. Plant Hormones: Phisiology, biochemistry and molecular biology. Second Edition. Netherlands: Kluwer Academic Publishers. Pg. 179.
Dische, Z. M. 1962. Carbohydrate Chemistry. New York: Acad Press.
Evans et al. 1984. Editor (Scott, T. K.). Hormonal Regulation Of Development II. Berlin-Heidelberg: Springer-Verlag. Pg 6, 24, 48
Fachry, A. R., Sari, T. I., Putra, B. A., Kristianto, D. A. 2012. Pengaruh penambahan filler kaolin terhadap elastisitas dan kekerasan produk souvenir dari karet alam (Hevea brasiliensis). Prosiding STNK TOPI: hal. 205-210. Pekanbaru.
Faturrahman. 2011. Multiplikasi Eksplan Anthurium (anthurium sp.) Dengan Pemberian Benzil Amino Purin (BAP) dan Indole Acetic Acid (IAA) Secara Kultur Jaringan. Jurnal Agroekoteknologi. 2(1): hal. 25-33.
Gomez, J. B., 1982. Anatomy of Hevea and Its Influence On Latex Production. Kuala Lumpur: Malaysian rubber research and development board. Pg 1-2, 15-21.
Gomez,K.A dan Gomez, A.A. 2007. Prosedur Statistik Untuk Penelitian Pertanian. Edisi Kedua.Universitas Indonesia. Jakarta.