OPTIMASI DAN PENETAPAN KADAR BETAMETASON DAN
DEKSKLORFENIRAMIN MALEAT DENGAN METODE
SPEKTROFOTOMETRI DERIVATIF
DALAM SEDIAAN TABLET
SKRIPSI
OLEH:
Aisyah
NIM 121524104
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
OPTIMASI DAN PENETAPAN KADAR BETAMETASON DAN
DEKSKLORFENIRAMIN MALEAT DENGAN METODE
SPEKTROFOTOMETRI DERIVATIF
DALAM SEDIAAN TABLET
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
AISYAH
NIM 121524104
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
OPTIMASI DAN PENETAPAN KADAR BETAMETASON DAN
DESKLORFENIRAMIN MALEAT DENGAN METODE
SPEKTROFOTOMETRI DERIVATIF DALAM
SEDIAAN TABLET
OLEH:
AISYAH
NIM 121524104
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 08 Mei 2015 Disetujui oleh:
Pembimbing I, Panitia Penguji,
Prof. Dr. UripHarahap, Apt Prof. SumadioHadisahputra, Apt.
NIP 195301011983031004 NIP 1 11281983031002
Pembimbing II, Prof
NI195
Medan, Juni 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
Prof. Dr. Julia Reveny, M.Si., Apt. NIP 195807101986012001
Pembimbing I,
Prof. Dr. Muchlisyam, M.Si., Apt. NIP 195006221980021001
Panitia Penguji,
Prof. Dr. Siti Morin Sinaga, M.Sc., Apt. NIP 195008281976032002
Pembimbing II,
Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195401101980032001
Dra. Sudarmi, M.Si., Apt. NIP 195409101983032001
Dr. Masfria, M.S., Apt. NIP 195707231986012001
iv
KATA PENGANTAR
Bismillahirrahmanirrahim,
Puji syukur penulis ucapkan kehadirat Allah SWT atas segala limpahan rahmat dan karunianya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini. Shalawat beriring salam untuk Rasulullah Muhammad SAW sebagai suri tauladan dalam kehidupan penulis. Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul “Optimasi dan Penetapan kadar pada Betametason dan Deksklorfeniramin maleat dengan Metode Spektrofotometri Derivatif dalam Campuran Tablet”.
v
Rosmanidar yang telah memberikan cinta dan kasih sayang yang tidak ternilai dengan apapun, motivasi beserta doa yang tulus dan tak pernah henti. Saudaraku tercinta Muhammad Ramli, Rabi’atul Hadawiyah, Hayatun Nufus dan Zahara Thalita dan seluruh keluarga besar yang selalu setia memberikan doa dan dukungan penuh kepada penulis. Buat teman-teman seperjuangan di Laboratorium Penelitian: Kak Uti, Kak tina, Kak Atika, Husna, Kak Ulul dan Dadang serta sahabat-sahabat terbaikku: Fina, Kak Ama, Kak Aida Kak Delvi, Kak Hikmah, Kak Widya dan Aah dan teman-teman stambuk 2012 lainnya yang tidak dapat penulis sebutkan satu-persatu namanya, terima kasih telah memberi bantuan, dukungan dan motivasi dalam menyelesaikan penulisan skripsi ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, Juni 2015 Penulis,
vi
OPTIMASI DAN PENETAPAN KADAR BETAMETASON DAN DEKSKLORFENIRAMIN MALEAT DENGAN METODE
SPEKTROFOTOMETRI DERIVATIF DALAM SEDIAAN TABLET
ABSTRAK
Saat ini banyak beredar sediaan obat dengan lebih dari satu komponen zat aktif. Salah satu kombinasi yang sering digunakan adalah deksklorfeniramin maleat dan betametason yang tersedia dalam bentuk sediaan tablet dan beredar dengan berbagai merek dagang.
Tujuan penelitian ini adalah untuk mengoptimasi pelarut dengan metode spektrofotometri derivatif dalam penetapan kadar betametason dan deksklorfeniramin maleat dalam sediaan tablet.
Pengambilan sampel secara purposif terhadap campuran tablet betametason dan deksklorfeniramin maleat dengan spektrofotometri derivatif metode zero crossing pada serapan derivat kedua dalam pelarut metanol.
Hasil penelitian menunjukkan bahwa kadar betametason dan desklorfeniramin maleat pada tablet Celestamin® (Schering-plough) berturut-turut (94,64 ± 2,4980)% dan (94,06 ± 0,5959)%; dari sampel Ocuson® (Sanbe) berturut-turut ( 94,75 ± 2,2378)% dan (95,64 ± 0,3245)%; Polacel (Medikon) berturut-turut (92,18 ± 1,9620)% dan (94,24 ± 0,5709)%. Penetapan kadar campuran desklorfeniramin maleat dan betametason yang dianalisis dalam tablet di pasaran menunjukkan bahwa semua memenuhi persyaratan sesuai dengan persyaratan yang tertera pada USP (United States Pharmacopoeia) XXX tahun 2007. Hasil uji validasi yang dilakukan terhadap tablet Ocuson® (Sanbe) memenuhi persyaratan validasi metode, untuk desklorfeniramin maleat diperoleh % Perolehan kembali = 100,07%, simpangan baku relatif (RSD) = 0,8664% dan untuk betametason diperoleh % Perolehan kembali = 100,07%, simpangan baku relatif (RSD) = 0,34948%.
Kata-kata kunci : Desklorfeniramin maleat, Betametason, Spektrofotometri
vii
OPTIMIZATION AND DETERMINATION OF BETAMETHASONE AND DEXCHLORPHENIRAMINE MALEATE LEVEL USING DERIVATIVE
SPECTROPHOTOMETRY METHOD ON MIXED TABLET
ABSTRACT
Nowadays, medicines in marketing area have more one component active substances in it. One of combination which commonly used is betamethasone and dexchlorpheniramine maleate were available in tablet forms and various trademarks.
The objective of this study is to optimize the solvent of betamethasone and dexchlorpheniramine maleate in tablet mixed.
Sampling area of betamethasone and dexchlorpheniramine maleate used purposively sample. It used derivative spectrophotometry by using zero crossing method on second derivative absorption in methanol solvent.
The results showed that the levels of betamethasone and dexchlorpheniramine maleate in Celestamin® (Schering-plough) tablet respectively (94.64 ± 2.4980)% and (94.06 ± 0.5959)%; Ocuson® (Sanbe) respectively (94.75 ± 2.2378)% and (95.64 ± 0.3245)%; Polacel (Medikon) respectively (92.18 ± 1.9620)% and (94.24 ± 0.5709)%.
The determination of betamethasone and dexchlorpheniramine maleate mixture level which had analyzed showed all of those various tablet had accomplished the requirements in accordance by using USP (United States Pharmacopoeia) XXX 2007. The results of validation tests were conducted on Ocuson® tablets (Sanbe) had accomplished the requirements of validation methods, for dexchlorpheniramine maleate obtained a % Recovery = 100.07%, relative standard deviation (RSD) = 0.8664% and for betamethasone obtained a % recovery = 100.07%, relative standard deviation (RSD) = 0.4948%.
Keywords: Dexchlorpheniramine maleate, Betamethasone, Derivative
viii
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Betametason ... 6
2.2 Deksklorfeniramin maleat ... 7
2.3 Spektrofotometri Ultraviolet ... 8
2.3.1 Penyerapan Radiasi ... 9
2.3.2 Hukum Lambert-Beer ... 10
ix
2.3.4 Komponen Spektrofotometer Derivatif ... 12
2.4 Spektrofotometri Derivatif ... 13
2.4.1 Pengertian Spektrofotometri Derivatif ... 13
2.4.2 Metode Spektrofotometri Derivatif ... 15
2.4.3 Penggunaan Spektrofotometri Derivatif ... 17
2.5 Validasi Metode analisis ... 17
2.5.1 Akurasi (Kecermatan) ... 18
2.5.2 Presissi (Keseksamaan) ... 18
2.5.3 Batas Deteksi dan Batas Kuantitasi ... 19
2.5.4 Linearitas ... 19
2.5.5 Rentang ... 19
BAB III METODELOGI PENELITIAN ... 21
3.1 Waktu dan Tempat Penelitian ... 21
3.2 Alat ... 21
3.3 Bahan ... 21
3.4 Pengambilan Sampel ... 21
3.5 Prosedur Penelitian ... 22
3.5.1 Pembuatan Larutan Induk ... 22
3.5.1.1 Pembuatan Larutan Induk Baku Desklorfeniramin maleat ... 22
3.5.1.2 Pembuatan Larutan Induk Baku Betametason ... 22
3.5.2. Pembuatan Spektrum Serapan Maksimum ... 23
x
3.5.2.2 PembuatanSpektrumSerapanMaksimum
Betametason ... 23
3.6 Pembuatan Spektrum Serapan Derivatif ... 23
3.6.1 Pembuatan Spektrum Serapan Derivatif Deksklorfeniramin maleat ... 23
3.6.2 Pembuatan Spektrum Serapan Derivatif Betametason ... 24
3.6.3 Pembuatan Zero Crossing ... 24
3.6.4. Penentuan Panjang gelombang (λ) Analisis ... 24
3.7 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi ... 24
3.7.1 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi Deksklorfeniramin maleat ... 25
3.7.2 Pembuatan dan Penentuan Linieritas Kurva Kalibrasi Betametason ... 26
3.8 Penentuan Kadar Betametason dan Deksklorfeniramin maleat dalam Sediaan Tablet ... 27
3.9 Uji Validasi ... 28
3.9.1 Uji Akurasi ... 28
3.9.2 Uji Presisi ... 28
3.10 Analisis Data Statistik ... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
4.1 Penentuan Kurva Serapan Maksimum ... 30
4.2 Hasil Penentuan Kurva Serapan ... 31
4.2.1 Hasil Penentuan Kurva Serapan Betametason ... 31
4.3.2 Hasil Penentuan Kurva Serapan Deksklorfeniramin maleat ... 32
xi
4.3.1 Zero Crossing Derivat Pertama dan Kedua
Betametason
... 35
4.3.2 Zero Crossing Derivat Pertama dan Kedua Deksklorfeniramin ... 35
4.4 Hasil Penentuan Panjang Gelombang Analisis ... 36
4.5 Hasil Penentuan Linieritas Kurva Kalibrasi ... 42
4.5.1 Kurva Kalibrasi ... 42
4.5.2 Batas Deteksi dan Batas Kuantitasi ... 43
4.6 Hasil Penentuan Kadar Deksklorfeniramin maleat dan Betametason dalam Sediaan Tablet ... 44
4.7 Hasil Uji Validasi ... 45
4.8.1 Hasil Uji Akurasi ... 45
4.8.2 Hasil Uji Presisi ... 47
BAB V KESIMPULAN DAN SARAN ... 48
5.1 Kesimpulan ... 48
5.2 Saran ... 49
xii
DAFTAR TABEL
Halaman Tabel 4.1 Panjang Gelombang Analisis Spektrum Derivat Kedua ... 41 Tabel 4.2 Kadar Betametason dan Deksklorfeniramin maleat dalam
Sampel ... 45 Tabel 4.3 Hasil Perolehan Kembali Betametason dan
Deksklorfeniramin maleat dengan Metode Penambahan
xiii
DAFTAR GAMBAR
Halaman Gambar 2.1 Rumus Struktur Betametason ... 6 Gambar 2.2 Rumus Struktur Deksklorfeniramin maleat ... 7 Gambar 2.3 Spektrum Serapan normal sampai Derivat ke-empat .... 15 Gambar 2.4 Kurva Sederhana Aplikasi Zero Crossing... 16 Gambar 4.1 Kurva Serapan Maksimum Betametason 11 µg/mL ... 31 Gambar 4.2 Kurva Serapan Maksimum Deksklorfeniramin maleat
12 µg/mL ... 31 Gambar 4.3 Kurva Tumpang Tindih Serapan Betametason dalam
berbagai konsentrasi ... 32 Gambar 4.4 Kurva Tumpang Tindih Serapan derivat pertama
Betametason dalam berbagai konsentrasi ... 32 Gambar 4.5 Kurva Tumpang Tindih Serapan Derivat Kedua
Betametason dalam berbagai konsentrasi ... 33 Gambar 4.6 Kurva Tumpang Tindih Serapan Deksklorfeniramin
maleat dalam berbagai konsentrasi ... 33 Gambar 4.7 Kurva Tumpang Tindih Serapan Derivat Pertama
Deksklorfeniramin maleat dalam berbagai konsentrasi ... 34 Gambar 4.8 Kurva Tumpang Tindih Serapan Derivat Kedua
Deksklorfeniramin maleat dalam berbagai konsentrasi ... 34 Gambar 4.9 Zero Crossing Betametason Derivat Pertama dalam
Berbagai Konsentrasi ... 35 Gambar 4.10 Zero Crossing Deksklorfeniramin maleat Derivat
Pertama dalam Berbagai Konsentrasi ... 35 Gambar 4.11 Zero Crossing Betametason Derivat Kedua dalam
Berbagai Konsentrasi ... 36 Gambar 4.12 Zero Crossing Deksklorfeniramin maleat Derivat
xiv
Gambar 4.13 Kurva Tumpang Tindih Serapan Betametason 6
µg/mL dan Deksklorfeniramin maleat 12 µg/mL ... 37 Gambar 4.14. Kurva Tumpang Tindih Serapan Derivat Pertama
Betametason 6 µg/mL dan Deksklorfeniramin maleat
12 µg/mL ... 38 Gambar 4.15. Kurva Tumpang Tindih Serapan Derivat Kedua
Betametason 6 µg/mL dan Deksklorfeniramin maleat
12 µg/mL ... 38 Gambar 4.16. Kurva Tumpang Tindih Serapan Betametason 6
µg/mL dan Deksklorfeniramin maleat 12 µg/mL dan
Campuran Betametason dan Desklorfeniramin maleat . 39 Gambar 4.17. Kurva Tumpang Tindih Serapan Derivat Kedua
Betametason 6 µg/mL dan Deksklorfeniramin maleat 12 µg/mL dan Campuran Betametason dan Deksklorfeniramin maleat ... 40 Gambar 4.18 Zero Crossing Derivat kedua Betametason λ = 219,4
nm
... 40 Gambar 4.19 Zero Crossing Derivat kedua Deksklorfeniramin
maleat λ = 249,6 nm ... 41 Gambar 4.20 Kurva Kalibrasi Betametason pada λ = 219,4 nm ... 43 Gambar 4.21 Kurva Kalibrasi Deksklorfeniramin maleat pada λ =
xv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Daftar SpesifikasiSediaan tablet Celestamin®, Ocuson®,
dan Polacel® ... 52
Lampiran 2. Gambar Sediaan Tablet ... 53
Lampiran 3. Gambar Alat ... 54
Lampiran 4. Bagan Alir prosedur Penelitian... . 56
Lampiran 5. Kurva Serapan Betametason pada Berbagai konsentrasi ... 61
Lampiran 6. Kurva Serapan Deksklorfeniramin maleat pada Berbagai konsentrasi ... 63
Lampiran 7. Kurva Serapan Derivat Pertama Betametason pada Berbagai Konsentrasi ... 65
Lampiran 8. Kurva Serapan Derivat Pertama Deksklorfeniramin maleat pada Berbagai Konsentrasi ... 67
Lampiran 9. Kurva Serapan Derivat Kedua Betametason pada Berbagai Konsentrasi ... 69
Lampiran 10. Kurva Serapan Derivat Kedua Deksklorfeniramin maleat pada Berbagai Konsentrasi ... 71
Lampiran 11. Kurva Serapan Panjang Gelombang Analisis ... 73
Lampiran 12. Perhitungan Regresi Kalibrasi Betametason ... 74
Lampiran 13. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Betametason ... 76
Lampiran 14. Perhitungan Regresi Kalibrasi Deksklorfeniramin maleat ... 77
Lampiran 15. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Deksklorfeniramin maleat ... 79
Lampiran 16. Kurva Serapan Derivat Kedua Penetapan Sampel ... 80
xvi
Lampiran 18. Contoh Perhitungan Penetapan Kadar Betametason
dan Deksklorfeniramin maleat dalam Sampel ... 88
Lampiran 19. Perhitungan Statistik Deksklorfeniramin maleat pada Tablet Celestamin® ... 92
Lampiran 20. Perhitungan Statistik Betametason pada Tablet Celestamin® ... 96
Lampiran 21. Perhitungan Statistik Deksklorfeniramin maleat pada Tablet Ocuson® ... 98
Lampiran 22. Perhitungan Statistik Betametason pada Tablet Ocuson® ... 102
Lampiran 23. Perhitungan Statistik Betametason pada Tablet Polacel® ... 106
Lampiran 24. Perhitungan Statistik Deksklorfeniramin maleat pada Tablet Polacel® ... 108
Lampiran 25. Kurva Serapan Ocuson® pada uji Perolehan Kembali ... 110
Lampiran 26. Data Hasil Persen Perolehan Kembali Deksklorfeniramin Maleat pada Tablet Ocuson® dengan Metode Penambahan Baku (Standard Addition Method) ... 113
Lampiran 27. Data Hasil Persen Perolehan Kembali Betametason pada Tablet Ocuson® dengan Metode Penambahan Baku (Standard Addition Method) ... 114
Lampiran 28. Contoh Perhitungan Persentase Perolehan Kembali (%recovery) ... 115
Lampiran 29. Perhitungan Rata-rata, Standar Deviasi dan Relatif Standar deviasi Perolehan Kembali Deksklorfeniramin Maleat pada Tablet Ocuson® ... 120
Lampiran 30. Perhitungan Rata-rata, Standar Deviasi dan Relatif Standar deviasi Perolehan Kembali Betametason pada Tablet Ocuson® ... 121
Lampiran 31. Daftar Nilai Distribusi t ... . 122
Lampiran 32. Sertifikat Pengujian Betametason ... . 123
vi
OPTIMASI DAN PENETAPAN KADAR BETAMETASON DAN DEKSKLORFENIRAMIN MALEAT DENGAN METODE
SPEKTROFOTOMETRI DERIVATIF DALAM SEDIAAN TABLET
ABSTRAK
Saat ini banyak beredar sediaan obat dengan lebih dari satu komponen zat aktif. Salah satu kombinasi yang sering digunakan adalah deksklorfeniramin maleat dan betametason yang tersedia dalam bentuk sediaan tablet dan beredar dengan berbagai merek dagang.
Tujuan penelitian ini adalah untuk mengoptimasi pelarut dengan metode spektrofotometri derivatif dalam penetapan kadar betametason dan deksklorfeniramin maleat dalam sediaan tablet.
Pengambilan sampel secara purposif terhadap campuran tablet betametason dan deksklorfeniramin maleat dengan spektrofotometri derivatif metode zero crossing pada serapan derivat kedua dalam pelarut metanol.
Hasil penelitian menunjukkan bahwa kadar betametason dan desklorfeniramin maleat pada tablet Celestamin® (Schering-plough) berturut-turut (94,64 ± 2,4980)% dan (94,06 ± 0,5959)%; dari sampel Ocuson® (Sanbe) berturut-turut ( 94,75 ± 2,2378)% dan (95,64 ± 0,3245)%; Polacel (Medikon) berturut-turut (92,18 ± 1,9620)% dan (94,24 ± 0,5709)%. Penetapan kadar campuran desklorfeniramin maleat dan betametason yang dianalisis dalam tablet di pasaran menunjukkan bahwa semua memenuhi persyaratan sesuai dengan persyaratan yang tertera pada USP (United States Pharmacopoeia) XXX tahun 2007. Hasil uji validasi yang dilakukan terhadap tablet Ocuson® (Sanbe) memenuhi persyaratan validasi metode, untuk desklorfeniramin maleat diperoleh % Perolehan kembali = 100,07%, simpangan baku relatif (RSD) = 0,8664% dan untuk betametason diperoleh % Perolehan kembali = 100,07%, simpangan baku relatif (RSD) = 0,34948%.
Kata-kata kunci : Desklorfeniramin maleat, Betametason, Spektrofotometri
vii
OPTIMIZATION AND DETERMINATION OF BETAMETHASONE AND DEXCHLORPHENIRAMINE MALEATE LEVEL USING DERIVATIVE
SPECTROPHOTOMETRY METHOD ON MIXED TABLET
ABSTRACT
Nowadays, medicines in marketing area have more one component active substances in it. One of combination which commonly used is betamethasone and dexchlorpheniramine maleate were available in tablet forms and various trademarks.
The objective of this study is to optimize the solvent of betamethasone and dexchlorpheniramine maleate in tablet mixed.
Sampling area of betamethasone and dexchlorpheniramine maleate used purposively sample. It used derivative spectrophotometry by using zero crossing method on second derivative absorption in methanol solvent.
The results showed that the levels of betamethasone and dexchlorpheniramine maleate in Celestamin® (Schering-plough) tablet respectively (94.64 ± 2.4980)% and (94.06 ± 0.5959)%; Ocuson® (Sanbe) respectively (94.75 ± 2.2378)% and (95.64 ± 0.3245)%; Polacel (Medikon) respectively (92.18 ± 1.9620)% and (94.24 ± 0.5709)%.
The determination of betamethasone and dexchlorpheniramine maleate mixture level which had analyzed showed all of those various tablet had accomplished the requirements in accordance by using USP (United States Pharmacopoeia) XXX 2007. The results of validation tests were conducted on Ocuson® tablets (Sanbe) had accomplished the requirements of validation methods, for dexchlorpheniramine maleate obtained a % Recovery = 100.07%, relative standard deviation (RSD) = 0.8664% and for betamethasone obtained a % recovery = 100.07%, relative standard deviation (RSD) = 0.4948%.
Keywords: Dexchlorpheniramine maleate, Betamethasone, Derivative
1
BAB I
PENDAHULUAN
1.1Latar Belakang
Dalam sediaan obat terdapat lebih dari satu komponen zat aktif. Salah satu kombinasi yang sering digunakan adalah betametason dan deksklorfeniramin maleat yang tersedia dalam bentuk sediaan tablet dengan berbagai merek dagang. Betametason adalah obat kortikosteroid dan deksklorfeniramin maleat adalah salah satu obat antihistamin (Moffat, dkk., 2005).
Bentuk sediaan farmasi seperti tablet harus memenuhi beberapa persyaratan sesuai dengan standar yang ada pada acuan misalnya pada farmakope. Salah satu persyaratan tersebut adalah persyaratan kadar. Persyaratan kadar untuk sediaan tablet campuran deksklorfeniramin maleat dan betametason menurut (USP 30 NF 25, 2007) yaitu mengandung betametason dan deksklorfeniramin maleat tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket.
Betametason adalah obat kortikosteroid yang mengandung fluor, mempunyai daya kerja yang besar. Akan tetapi penggunaan obat kortikosteroid yang mengandung fluor dalam jangka waktu lama, dapat menyebabkan pelebaran kapiler dan pembuluh nadi halus yang bersifat permanen sampai terjadi atropi kulit (Sartono, 1996).
Betametason dapat ditentukan kadarnya dengan Spektrofotometri UV pada pelarut etanol panjang gelombang 240 nm (A11=390a) dan natrium fosfat: air
2
Deksklorfeniramin maleat merupakan suatu antihistamin yang dapat mencegah gejala-gejala alergi, yang di sebabkan sebagian besar oleh histamin (H1). Deksklorfeniramin maleat berkerja dengan menghambat reseptor H1, pada pembuluh darah, bronkus, dan berbagai otot polos. Selain itu juga dapat mengatasi reaksi hipersensitivitas atau keadaan lain yang disertai pelepasan histamin endogen yang berlebihan (Harkness, 1984).
Deksklorfeniramin dapat ditentukan kadarnya dengan Spektrofotometri UV pada pelarut asam panjang gelombang 265 (A11=302a) dan basa panjang
gelombang 262 nm (A11=205a) (Moffat, dkk., 2005).
Telah dilakukan penelitian untuk tujuan mengetahui kondisi analisis betametason dan deksklorfeniramin maleat pada tablet mengunakan metode kromatografi cair kinerja tinggi (KCKT) dengan dapar metanol pH 7,2 (45:55) sebagai fase gerak (Mustarichie, dkk., 2014).
Metode spektrofotometri derivatif atau metode kurva turunan adalah salah satu metode spektrofotometri yang dapat digunakan untuk analisis campuran beberapa zat secara langsung tanpa harus melakukan pemisahan terlebih dahulu walaupun dengan panjang gelombang yang berdekatan (Nurhidayati, 2007).
Spektrofotometri derivatif merupakan metode manipulatif terhadap spektrum pada spektrofotometri ultraviolet (Connors, 1982). Pada spektrofotometri konvensional, spektrum serapan merupakan plot serapan (A)
terhadap panjang gelombang (λ). Pada spektrofotometri derivatif, plot A lawan λ,
ditransformasikan menjadi plot dA / dλ lawan λ untuk derivatif pertama, dan d2
A /
dλ2lawan λ untuk derivati
3
derivatisasi adalah menghilangkan dasar pita-pita serapan luas yang terjadi terhadap perubahan bertahap panjang gelombang (Watson, 2005).
Spektrofotometri derivatif dapat digunakan untuk analisis kuantitatif zat-zat yang spektrumnya saling tumpang tindih dan atau spektrumnya mungkin tersembunyi dalam suatu bentuk spektrum besar. Panjang gelombang pada spektrofotometri derivatif yaitu panjang gelombang zero crossing dimana senyawanya mempunyai serapan nol dan menjadi panjang gelombang analisis untuk zat lain dalam campurannya (Connors, 1982).
Beberapa keuntungan dari spektrofotometri derivatif antara lain yaitu spektrum derivatif memberikan gambaran struktur yang terinci dari spektrum serapan derivatif pertama sampai ke derivatif keempat. Selain itu dapat dilakukan analisis kuantitatif suatu komponen dalam campuran dengan zat yang panjang gelombangnya saling berdekatan. Bila dibandingkan dengan kromatografi cair kinerja tinggi (KCKT), metode spektrofotometri derivatif relatif lebih sederhana, alat dan biaya operasionalnya relatif lebih murah dan waktu analisisnya lebih cepat (Nurhidayati, 2007).
Menurut Ermer dan McB. Miller (2005), validasi merupakan suatu bagian dari prosedur analisis yang tidak dapat dipisahkan. Menurut Harmita (2004), untuk menguji validasi metode dilakukan uji akurasi (ketepatan) dengan parameter persen perolehan kembali dan metode penambahan baku (standard addition method) dan uji presisi (ketelitian) dengan parameter Relative Standard
Deviation (RSD).
4
kadar kandungan betametason dan deksklorfeniramin maleat dalam sediaan tablet.
1.2 Perumusan Masalah
1. Apakah metode spektrofotometri derivatif dengan cara penentuan zero crossing dapat digunakan untuk menganalisa kadar betametason dan
deksklorfeniramin maleat dalam sediaan tablet?
2. Apakah kadar betametason dan deksklorfeniramin maleat dalam sediaan tablet memenuhi persyaratan (USP 30 NF 25, 2007).
3. Apakah uji validasi terhadap metode spektrofotometri pada betametason dan deksklorfeniramin maleat dalam sediaan tablet memenuhi persyaratan pengujian validasi?
1. 3 Hipotesis
Berdasarkan perumusan masalah diatas, maka dibuat hipotesis sebagai berikut:
1. Metode spektrofotometri derivatif dengan cara penentuan zero crossing dapat digunakan untuk menganalisa kadar betametason dan deksklorfeniramin maleat dalam sediaan tablet.
2. Kadar betametason dan deksklorfeniramin maleat dalam sediaan tablet memenuhi persyaratan (USP 30 NF 25, 2007).
5
1. 4 Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah:
1. Untuk mengetahui metode spektrofotometri derivatif dengan cara penentuan zero crossing dapat digunakan untuk menganalisa kadar betametason dan deksklorfeniramin maleat dalam sediaan tablet.
2. Untuk mengetahui kadar betametason dan deksklorfeniramin maleat dalam sediaan tablet memenuhi persyaratan (USP 30 dan NF 25, 2007).
3. Untuk mengetahui uji validasi terhadap metode spektrofotometri derivatif pada betametason dan deksklorfeniramin maleat dalam sediaan tablet memenuhi persyaratan pengujian validasi.
1.5 Manfaat Penelitian
Adapun manfaat penelitian ini adalah untuk mengetahui bahwa penggunaan metode spektrofotometri derivatif dengan cara penentuan zero crossing dapat dilakukan untuk menganalisa kadar betametason dan
6
BAB II
TINJAUAN PUSTAKA
2.1 Betametason
Betametason mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Menurut Ditjen POM, (1995) betametason mempunyai struktur dengan rumus bangun dan rumus molekul seperti yang tersebut dibawah ini :
Gambar 2.1 Rumus struktur betametason (Ditjen POM, 1995).
Rumus molekul Berat molekul
Nama kimia : 9-Fluoro-11β,17,21-trihidroksi-16β -metilpregna-1,4-diena- 3,20-dion
Pemerian : Serbuk, putih sampai praktis putih; tidak berbau
Kelarutan : Praktis tidak larut dalam air, mudah larut dalam aceton dan dalam kloroform; larut dalam etanol; sukar larut dalam eter dan benzen. (Ditjen POM, 1995)
: C22H29FO5
: 392,47
: 9-Fluoro-11 β, 17, 21- trihidroksi -16 β-metilpregna-1,4-diena 3,20-dion
: Serbuk, putih sampai praktis putih; tidak berbau
: Praktis tidak larut dalam air, mudah larut dalam aceton dan dalam kloroform; larut dalam etanol; sukar larut dalam eter dan benzen
: Alergi dan peradangan lokal CH3 CH3 CH3 O OH OH OH O H
7
Indikasi : Alergi dan peradangan lokal
Efek samping : Atropi lokal, gatal-gatal, hipopigmentasi, dermatitis perioral dan alergi, serta infeksi sekunder (Sartono,1996).
Semua kortikosteroid secara oral di absorpsi dengan langsung efeknya baru tampak setelah 4 - 6 jam, maka untuk efek cepat hendaknya digunakan injeksi dari derivat yang mudah larut. Masa paruhnya berkisar antara 1,5 dan 5 jam, tetapi bertahan jauh lebih lama. Misalnya: deksametason dan betametason (Tan dan Rahardja, 2007).
2.2 Deksklorfeniramin maleat
Deksklorfeniramin maleat mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Menurut Ditjen POM, 1995 deksklorfeniramin maleat mempunyai struktur dengan rumus bangun dan rumus molekul seperti yang tersebut dibawah ini :
8 Rumus molekul : C16H19ClN2. C4H4O6
Berat molekul : 390,87
Nama kimia : (+)-2-[p-Kloro α-[(Dimetilamino)etil]benzil] piridina maleat
Pemerian : Serbuk hablur putih tidak berbau
Susut pengeringan : Lakukan pengeringan pada suhu 65oC selama 4 jam sebelum digunakan.
Kelarutan : Mudah larut dalam air, larut dalam etanol dan dalam kloroform, sukar larut dalam benzen dan dalam eter
Indikasi : Antihistamin
Efek samping : Vertigo, tinitus, lelah, penat, inkoordinasi, kabur, diplopia, euforia, gelisah, tremor, mulut kering, disuria, palpitasi, hipotensi, sakit kepala, rasa berat dan lemah pada tangan (Tan dan Rahardja, 2007).
Deksklorfeniramin maleat setelah pemberian oral atau parenteral, AH1 diabsorpsi secara baik. Efeknya timbul 15-30 menit setelah pemberian oral dan maksimal 1-2 jam. Lama kerja AH1 setelah pemberian dosis tunggal kira-kira 4-6 jam. Kadar tertinggi terdapat pada paru-paru, sedangkan pada limpa, ginjal, otak, otot dan kulit kadarnya lebih rendah (Tan dan Rahardja, 2007).
2.3 Spektrofotometri Ultraviolet-Visibel (UV-Vis)
9
menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer sebagai alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi (Gandjar dan Rohman, 2007). Pada spektrofotometer, panjang gelombang yang benar-benar terseleksi dapat diperoleh dengan bantuan alat pengurai cahaya seperti prima. Suatu spektrofotometer tersusun dari spektrum tampak yang kontinu, monokromator, sel pengabsorpsi untuk larutan sampel atau blangko dan suatu alat untuk mengukur perbedaan absorpsi antara sampel dan pembanding (Khopkar, 1985).
2.3.1 Penyerapan Radiasi
Jika suatu molekul sederhana dikenakan radiasi ultraviolet maka molekul tersebut akan menyerap radiasi ultraviolet. Interaksi antara molekul dengan radiasi ultraviolet ini akan meningkatkan energi dari tingkat dasar ke tingkat tereksitasi. Apabila pada molekul yang sederhana tadi hanya terjadi transisi elektronik pada satu macam gugus yang terdapat pada molekul, maka hanya akan terjadi satu absorpsi yang merupakan garis spektrum. Terjadinya dua atau lebih pita spektrum diberikan oleh molekul dengan struktur yang lebih kompleks karena terjadi beberapa transisi sehingga mempunyai lebih dari satu panjang gelombang (Gandjar dan Rohman, 2007).
Sebagai contoh, molekul organik sederhana yang mempunyai dua jenis ikatan karbon-karbon seperti pada etilen. Ikatan π lebih lemah dari ikatan σ dan akibatnya elektron π lebih tinggi energinya dari elektron σ (Munson, 1984).
10
merupakan kromofor yang dapat menyerap radiasi ultraviolet. Salah satu kromofor yang paling sederhana adalah benzen (Watson, 2005).
Gugus fungsi seperti –OH, -O, -NH2, dan –OCH3 yang memberikan
transisi n → π* disebut gugus auksokrom. Gugus ini adalah gugus yang tidak dapat menyerap radiasi ultraviolet-sinar tampak, tetapi apabila gugus ini terikat pada gugus kromofor mengakibatkan pergeseran panjang gelombang ke arah yang lebih besar (efek batokromik atau pergeseran merah) dan disertai peningkatan intensitas (efek hiperkromik) (Gandjar dan Rohman, 2007).
2.3.2 Hukum Lambert-Beer
Menurut Gandjar dan Rohman (2007) Hukum Lambert, serapan berbanding lurus terhadap ketebalan sel yang disinari. Sedangkan menurut Beer, serapan berbanding lurus dengan konsentrasi. Kedua pernyataan ini dapat dijadikan satu dalam Hukum Lambert-Beer, sehingga diperoleh bahwa serapan berbanding lurus terhadap konsentrasi dan ketebalan sel, yang dapat ditulis dengan persamaan :
A = a.b.c (g/liter) atau A = ε. b. c (mol/liter) atau A = A1
1.b.c (g/100 ml)
Dimana: A = serapan a = absorptivitas b = ketebalan sel c = konsentrasi
11
Menurut Denney dan Sinclair (1991) hukum Lambert-Beer terdapat beberapa pembatasan yaitu:
1. Larutan yang menyerap cahaya adalah campuran yang homogen. 2. Menggunakan sinar monokromatis.
3. Rendahnya konsentrasi dari senyawa yang menyerap cahaya.
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,6. Anjuran ini berdasarkan anggapan bahwa pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi adalah paling minimal (Gandjar dan Rohman, 2007).
Parameter kekuatan energi radiasi yang diabsorpsi oleh molekul adalah absorbansi (A) yang dalam batas konsentrasi tertentu nilainya sebanding dengan banyaknya molekul yang mengabsorpsi radiasi. Senyawa yang tidak mengabsorpsi radiasi ultraviolet - sinar tampak dapat juga ditentukan dengan spektrofotometri ultraviolet - sinar tampak, apabila ada reaksi kimia yang dapat mengubahnya menjadi kromofor atau dapat disambungkan dengan suatu pereaksi kromofor (Gandjar dan Rohman, 2007).
2.3.3 Kegunaan Spektrofotometri Ultraviolet - Visibel (UV-Vis)
Kegunaan spektrofotometri ultraviolet dalam analisis kualitatif sangat terbatas karena rentang daerah radiasi yang relatif sempit hanya dapat mengakomodasi sedikit sekali puncak absorpsi maksimum dan minimum, karena itu identifikasi senyawa yang tidak diketahui tidak memungkinkan untuk dilakukan (Satiadarma, dkk., 2004).
12
(Cairns, 2008), dimana menurut Holme dan Peck (1983) konsentrasi sampel dalam senyawa dihitung dengan rumus sebagai berikut:
Ct Cs At As =
Keterangan: As = Absorbansi baku pembanding At = Absorbansi zat dalam sampel Cs = Konsentrasi baku pembanding Ct = Konsentrasi zat dalam sampel
Metode spektrofotometri memiliki beberapa keuntungan antara lain kepekaan yang tinggi, ketelitian yang baik, mudah dilakukan, cepat pengerjaannya dan dapat digunakan untuk menentukan senyawa campuran (Munson, 1984).
Penentuan kadar senyawa organik yang mempunyai struktur kromofor atau mengandung gugus kromofor, serta mengabsorpsi radiasi ultraviolet penggunaanya cukup luas (Satiadarma, dkk., 2004).
2.3.4 Komponen Spektrofotometer Derivatif
Komponen-komponen pada spektrofotometer UV-Vis biasa sama dengan komponen pada spektrofotometer derivatif. Alat spektrofotometer harus dilengkapi dengan peralatan sedemikian rupa untuk dapat menghasilkan spektrum derivatif (Ditjen POM, 1995). Biasanya spektrofotometer telah mempunyai software untuk mengolah data yang dapat dioperasikan melalui komputer yang
13
Menurut Day dan Underwood (1998), unsur -unsur terpenting suatu spektrofotometer adalah sebagai berikut:
1. Sumber-sumber lampu: lampu deuterium digunakan untuk daerah Ultraviolet pada panjang gelombang dari 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visibel pada panjang gelombang antara 350- 900 nm.
2. Monokromotor: digunakan untuk memperoleh sumber sinar yang monokromatis. Alatnya berupa prisma untuk mengarahkan sinar monokromatis yang diinginkan dari hasil penguraian.
3. Kuvet (sel): digunakan sebagai wadah sampel untuk menaruh cairan ke dalam berkas cahaya spektrofotometer. Kuvet itu haruslah meneruskan energi radiasi dalam daerah spektrum yang diinginkan. Pada pengukuran di daerah sinar tampak, kuvet dapat digunakan, tetapi untuk pengukuran pada daerah ultraviolet kita harus menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini. Kuvet tampak dan ultraviolet yang khas mempunyai ketebalan 1 cm, namun tersedia kuvet dengan ketebalan yang sangat beraneka, mulai dari ketebalan kurang dari 1 mm sampai 10 cm bahkan lebih.
14
2.4 Spektrofotometri Derivatif
2.4.1 Pengertian Spektrofotometri Derivatif
Spektofotometri derivatif adalah metode spektrofotometri ultraviolet yang mentransformasikan spektrum serapan biasa menjadi spektrum derivatif pertama, kedua atau spektrum derivatif dengan order yang lebih tinggi (Ditjen POM, 1995). Pada spektrofotometri konvensional, spektrum serapan merupakan plot serapan (A) terhadap panjang gelombang (λ). Pada spektrofotometri derivatif, plot serapan terhadap panjang gelombang dimana:
A = f (λ), order nol
dA / dλ = f ′ (λ), order pertama d2A / dλ2 = f ″ (λ), order kedua dan seterusnya (Owen, 1995).
Menurut Talsky (1994) sesuai dengan hukum Lambert-Beer, maka ada hubungan linier antara konsentrasi dengan absorbansi untuk semua orde pada spektrofotometri derivatif adalah:
dA / dλ = �� ( 1%,1��)
d� x bc
d²A / dλ² = �²� ( 1%,1��)
d�² x bc
d A / dλ = �˟� ( 1%,1��)
15
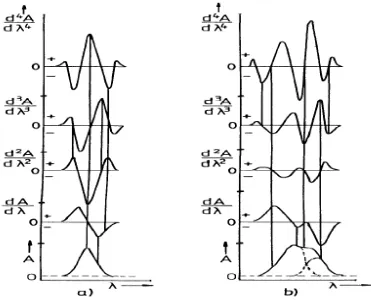
Gambar 3. Spektrum serapan normal (derivat ke-nol) sampai derivat ke-empat
(Talsky, 1994). Gambar (a) menunjukkan spektrum serapan normal (satu peak) yang diderivatisasi sampai spektrum derivat ke-empatnya, sedangkan Gambar (b) menunjukkan spektrum yang saling overlapping yang diderivatisasi mulai dari spektrum serapan normal hingga spektrum derivat ke empat (Talsky, 1994).
Konsep derivatif telah diperkenalkan pertama kali pada tahun 1950, dimana terlihat memberikan banyak keuntungan. Aplikasi utama spektrofotometri derivatif ultraviolet - cahaya tampak adalah untuk identifikasi kualitatif dan analisis sampel. Metode spektrofotometri derivatif sangat cocok untuk analisis pita absorpsi yang tumpang tindih (Owen, 1995).
[image:33.596.126.497.84.384.2]16
Spektrofotometri derivatif yang dikombinasikan dengan teknik zero crossing atau transformasi Fourier untuk teknik pemrosesan data telah banyak
dikembangkan untuk analisis kuantitatif senyawa aktif pada formulasi obat (Batubara, dkk., 2005).
2.4.2 Metode SpektrofotometriDerivatif
Ada tiga metode spektrofotometri derivatif yang sering digunakan dalam analisa kuantitatif antara lain metode zero crossing, metode peak to peak dan metode multivariate spectrophotometric calibration (Talsky, 1994). Metode zero-crossing memisahkan campuran biner dari spektrum derivatifnya di panjang
gelombang pada saat satu komponen tidak ada sinyal. Pengukuran zero crossing tiap komponen dalam campuran merupakan fungsi tunggal konsentrasi dari yang lainnya (Nurhidayati, 2007).
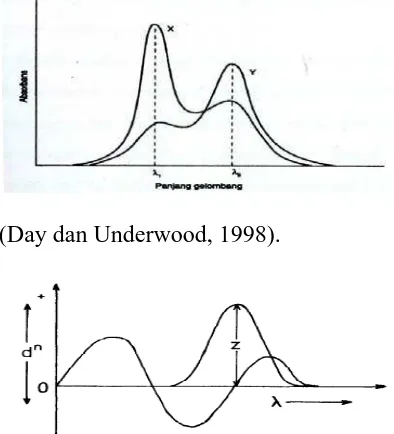
Kurva sederhana aplikasi zero crossing dapat dilihat pada Gambar 2.3.
(Day dan Underwood, 1998).
[image:34.596.114.311.448.665.2](Talsky, 1994).
17
Bila campuran analit memiliki panjang gelombang zero-crossing lebih dari satu, maka yang dipilih untuk dijadikan panjang gelombang analisis adalah panjang gelombang zero crossing yang serapan pasangannya dan campurannya persis sama, karena pada panjang gelombang tersebut dapat secara selektif mengukur serapan senyawa pasangannya dan memiliki serapan yang paling besar. Pada serapan yang paling besar, serapannya lebih stabil sehingga kesalahan analisis dapat diperkecil (Nurhidayati, 2007).
Panjang gelombang serapan maksimum suatu senyawa pada spektrum normal akan menjadi panjang gelombang zero crossing pada spektrum derivat
pertama, panjang gelombang tersebut tidak mempunyai serapan atau dA/dλ = 0
(Munson,1984).
Prinsip utama derivatisasi adalah menghilangkan dasar pita-pita serapan luas yang terjadi terhadap perubahan bertahap panjang gelombang. Spektrum derivatif pertama di peroleh dengan memplot misalnya kemiringan sekmen spektrum sebesar 2 nm, dalam spektrum yang kemiringannya 0 pada puncak maksimum dan kemiringannya maksimum pada sekitar separuh dari tinggi puncak (Watson, 2005).
2.4.3 Penggunaan Spektrofotometri Derivatif
18
Spektrofotometri derivatif banyak digunakan untuk zat-zat dalam suatu campuran yang spektrumnya saling mengganggu atau tumpang tindih (overlapping) dan dimana zat-zat tersebut dapat larut dalam pelarut yang sama serta memiliki serapan maksimum pada panjang gelombang yang berdekatan (Mulja dan Suharman, 1995).
2.5 Validasi Metode Analisis
Validasi metode adalah suatu proses yang menunjukkan bahwa prosedur analitik telah sesuai dengan penggunaan yang dikehendaki. Validasi merupakan persyaratan mendasar yang diperlukan untuk menjamin kualitas dan hasil dari semua aplikasi analitik (Ermer dan McB. Miller, 2005). Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi, limit deteksi, limit kuantitasi, kelinieran, dan rentang (Gandjar dan Rohman, 2007).
2.5.1 Akurasi (Kecermatan)
Akurasi adalah kedekatan antara nilai hasil uji yang diperoleh melalui metode analitik dengan nilai sebenarnya. Akurasi dinyatakan dalam persen perolehan kembali (% recovery). Akurasi dapat ditentukan dengan dua metode, yakni spiked – placebo recovery dan standard addition method. Pada spiked – placebo recovery atau metode simulasi, analit murni ditambahkan (spiked) ke
19
2.5.2 Presisi (Keseksamaan)
Presisi adalah ukuran keterulangan metode analitik, termasuk di antaranya kemampuan instrumen dalam memberikan hasil analitik yang reprodusibel. Berdasarkan rekomendasi ICH (the International Conference on the Harmonisation), karakteristik presisi dilakukan pada 3 tingkatan, yakni
keterulangan (repeatability), presisi antara (intermediate precision) dan reprodusibilitas (reproducibility). Keterulangan dilakukan dengan cara menganalisis sampel yang sama oleh analis yang sama menggunakan instrumen yang sama dalam periode waktu singkat. Presisi antara dikerjakan oleh analis yang berbeda. Sedangkan reprodusibilitas dikerjakan oleh analis yang berbeda dan di laboratorium yang berbeda (USP 30 NF 25, 2007).
2.5.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi. Sedangkan batas kuantitasi adalah konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan (Harmita, 2004).
2.5.4 Linearitas
20
Linieritas dapat diukur dengan melakukan pengukuran tunggal pada konsentrasi yang berbeda-beda. Data yang diperoleh selanjutnya diproses untuk selanjutnya dapat ditentukan nilai kemiringan (slope), intersep dan koefisien korelasinya (Gandjar dan Rohman, 2007).
2.5.6 Rentang
21
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini termasuk jenis penelitian deskriptif dan penelitian ini dilaksanakan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan September 2014 sampai dengan November 2014.
3.2 Alat
Alat–alat yang digunakan dalam penelitian adalah spektrofotometer ultraviolet (UV-1800 Shimadzu) double beam yang dilengkapi dengan komputer, sonikator (Branson 1510), neraca analitik (Mettler Toledo), kuvet, lumpang dan alu, alat-alat gelas dan alat-alat lainnya yang diperlukan dalam penyiapan sampel dan larutan. Gambar alat dapat dilihat pada Lampiran 3 halaman 54.
3.3 Bahan
Bahan–bahan yang digunakan dalam penelitian adalah metanol (E-Merck), Betametason baku (CV. Anugrah cipta) sertifikat pengujian betametason dapat dilihat pada Lampiran 30 halaman 121, Deksklorfeniramin maleat baku (BPFI) sertifikat pengujian deksklorfeniramin maleat dapat dilihat pada Lampiran 31 halaman 122, tablet merek dagang Celestamin® (Schering-plough), Ocuson® (Sanbe) dan Polacel® (Medikon).
3.4 Pengambilan Sampel
22
digunakan adalah tiga tablet merek dagang yaitu Celestamin® (Schering-plough), Ocuson® (Sanbe) dan Polacel® (Medikon). Data spesifikasi sediaan tablet Celestamin®, Ocuson® dan Polacel® dapat dilihat pada Lampiran 1 halaman 52.
3.5 Prosedur Penelitian
3.5.1 Pembuatan Larutan Induk Baku
3.5.1.1 Pembuatan Larutan Induk Baku Betametason
Ditimbang 50 mg betametason, dimasukkan ke dalam labu tentukur 50 mL, ditambahkan metanol dikocok hingga larut, lalu dicukupkan sampai garis tanda dengan metanol sehingga diperoleh larutan dengan konsentrasi 1000 μg/mL, larutan ini disebut larutan induk baku I (LIB I). Dari larutan ini dipipet 12,5 mL, dimasukkan ke dalam labu tentukur 25 mL, diencerkan dengan metanol sampai garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 500 μg/mL (LIB II). Dari larutan ini dipipet 2,25 mL, dimasukkan kedalam labu tebtukur 100 mL, diencerkan dengan metanol sampai garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 11,25 μg/mL (LIB III) (Ditjen POM, 1995).
3.5.1.2 Pembuatan Larutan Induk Baku Deksklorfeniramin maleat
23
metanol sampai garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 500 μg/mL (LIB II) (Ditjen POM, 1995).
3.5.2 Pembuatan Spektrum Serapan Maksimum
3.5.2.1 Pembuatan Spektrum Serapan Maksimum Betametason
Dipipet 1,1 mL Larutan Induk Baku II (LIB II) betametason (konsentrasi = 500 μg/mL), dimasukkan ke dalam labu tentukur 50 mL, diencerkan dengan metanol hingga garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 11 μg/mL, kemudian diukur serapan pada panjang gelombang 200 – 400 nm. Kurva serapan maksimum betametason dapat dilihat pada Gambar 4.1 halaman 30.
3.5.2.2 Pembuatan Spektrum Serapan Maksimum Deksklorfeniramin maleat
Dipipet 1,2 mL Larutan Induk Baku II (LIB II) deksklorfeniramin maleat (konsentrasi = 500 μg/mL), dimasukkan ke dalam labu tentukur 50 mL, diencerkan dengan metanol hingga garis tanda, lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 12 μg/mL, kemudian diukur serapan pada panjang gelombang 200 – 400 nm. Kurva serapan maksimum desklorfeniramin maleat dapat dilihat pada Gambar 4.2 halaman 31.
3.6 Pembuatan Spektrum Serapan Derivatif
3.6.1 Pembuatan Spektrum Serapan Derivatif Betametason
Dipipet Larutan Induk Baku II betametason (konsentrasi = 500
24
konsentrasi 6; 9; 12; 15; dan 18 μg/mL. Kemudian dibuat spektrum serapan biasa (tanpa diderivatkan), spektrum serapan derivat pertama dan derivat kedua pada panjang gelombang 200-400 nm dengan ∆λ = 2 nm. Kurva serapan betametason dapat dilihat pada halaman 62 - 63.
3.6.2 Pembuatan Spektrum Serapan Derivatif Deksklorfeniramin maleat
Dipipet Larutan Induk Baku II deksklorfeniramin maleat (500 μg/mL) sebanyak 0,7 mL; 1,0 mL; 1,3 mL; 1,6 mL; dan 1,9 mL. Masing-masing dimasukkan ke dalam labu tentukur 50 ml, diencerkan dengan metanol hingga garis tanda. Lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 7; 10; 13; 16; dan 19 μg/mL. Kemudian dibuat spektrum serapan biasa (tanpa diderivatkan), spektrum serapan derivat pertama dan derivat kedua pada panjang gelombang 200-400 nm dengan ∆λ = 2 nm. Kurva serapan deksklorfeniramin maleat dapat dilihat pada halaman 63 - 64.
3.6.3 Penentuan Zero Crossing
Penentuan zero crossing diperoleh dengan menumpang tindihkan atau mengoverlappingkan spektrum serapan pada masing-masing derivat dari berbagai konsentrasi larutan. Zero crossing derivat pertama dan derivat kedua betametason dapat dilihat pada Gambar 13 - 14 halaman 34. Zero crossing derivat pertama dan derivat kedua deksklorfeniramin maleat dapat dilihat pada Gambar 4.15 – 4.16 halaman 35 - 36.
3.6.4 Penentuan Panjang Gelombang (λ) Analisis
25
μg/mL dan deksklorfeniramin maleat dengan konsentrasi 12,1 μg/mL. Kemudian dibuat spektrum serapan derivat pertama dari masing-masing larutan zat tunggal dan dari campuran zat. Spektrum serapan derivat pertama dari larutan zat tunggal dan campuran keduanya ditumpang tindihkan. Demikian juga untuk spektrum serapan derivat kedua. Yang dipilih untuk menjadi panjang gelombang analisis adalah panjang gelombang zero crossing yang serapan pasangannya dan campurannya persis sama, kerena pada panjang gelombang tersebut dapat secara selektif mengukur serapan pasangannya dan memiliki serapan paling besar. Panjang gelombang analisis dapat dilihat pada Gambar 4.17 – 4.19 halaman 37.
3.7 Pembuatan dan Penentuan Linieritas Kurva Kalibrasi
3.7.1 Pembuatan Kurva Kalibrasi dan Penentuan Linearitas Kurva Kalibrasi Betametason
26
Untuk menentukan batas deteksi (LOD) dan batas kuantitasi (LOQ) dapat digunakan rumus :
Keterangan :
SB = simpangan baku LOD = batas deteksi
LOQ = batas kuantitasi
3.7.2.1Pembuatan Kurva Kalibrasi dan Penentuan Linearitas Kurva Kalibrasi Deksklorfeniramin maleat
Dipipet Larutan Induk Baku II deksklorfeniramin maleat (konsentrasi = 500 μg/mL) sebanyak 0,7 mL; 1,0 mL; 1,3 mL; 1,6 mL; dan 1,9 mL. Masing-masing dimasukkan ke dalam labu tentukur 50 mL, diencerkan dengan metanol hingga garis tanda. Lalu dikocok sampai homogen sehingga diperoleh larutan dengan konsentrasi 7; 10; 13; 16; dan 19 μg/mL. Kemudian diukur serapan pada derivat kedua (∆λ = 2 nm) pada panjang gelombang 249,6 nm. Kemudian dilakukan analisis hubungan antara konsentrasi dengan serapan, sehingga diperoleh persamaan regresi linear y = ax + b, dan berdasarkan nilai serapan pada panjang gelombang 249,6 nm, dilakukan pula perhitungan limit deteksi/limit of
2 ) ( 2 − − =
∑
n Yi Y SB Slope SB x LOD=327
detection (LOD) dan limit kuantitasi/limit of quantitation (LOQ) seperti rumus di
atas.
3.8.1 Penentuan Kadar Betametason dan Deksklorfeniramin maleat dalam Sediaan Tablet
28
Konsentrasi betametason dan deksklorfeniramin maleat dapat dihitung dengan rumus:
Konsentrasi (µg / ml) =
3.9 Uji Validasi
3.9.1 Uji Akurasi
Menurut Harmita (2004) uji akurasi dilakukan dengan metode penambahan baku (Standard Addition Method), yaitu dengan membuat 3 konsentrasi analit sampel dengan rentang spesifik 80 %, 100 %, 120 %, dimana masing-masing dilakukan sebanyak 3 kali replikasi. Setiap rentang spesifik mengandung 70 % analit dan 30 % baku pembanding, kemudian dianalisa dengan perlakuan yang sama seperti pada penetapan kadar sampel.
Persen perolehan kembali (% recovery) dapat dihitung dengan rumus sebagai berikut :
% perolehan kembali = CF−CA
C∗A x 100 %
Keterangan :
CF = konsentrasi sampel yang diperoleh setelah penambahan baku
CA = konsentrasi sampel sebelum penambahan baku
C*A = konsentrasi baku yang ditambahkan
29
3.9.2 Uji Presisi
Menurut Sudjana (2005) untuk uji presisi (keseksamaan) ditentukan dengan parameter RSD (Relative Standard Deviasi) dengan rumus :
RSD =
Mencari standar deviasi (SD) digunakan rumus:
Keterangan :
RSD = standar deviasi relatif SD = standar deviasi
X = kadar rata-rata sampel
3.10 Analisis Data Statistik
Menurut Sudjana (2005) analisis data secara statistik menggunakan uji t. Untuk mengetahui apakah data diterima atau ditolak digunakan rumus seperti di bawah ini :
t hitung =
n SD X X / −
Dasar penolakan data jika thitung ≥ ttabel dan thitung≤ -ttabel.
Untuk mencari kadar sebenarnya dengan taraf kepercayaan 99% dengan derajat kebebasan dk = n-1, digunakan rumus :
30 µ = interval kepercayaan X = kadar rata-rata sampel X = kadar sampel
t = harga t tabel sesuai dengan dk = n-1
31
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Kurva Serapan Maksimum
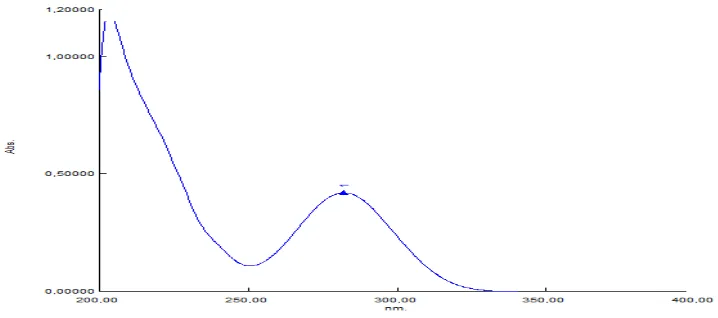
Penentuan kurva serapan maksimum dilakukan pada panjang gelombang 200-400 nm untuk betametason dilakukan pada konsentrasi 11 μg/mL, sedangkan untuk deksklorfeniramin maleat pengukuran dilakukan pada konsentrasi 12
[image:49.596.115.474.551.710.2]μg/mL. Berdasarkan hasil penelitian diperoleh kurva serapan maksimum pada λ = 239 nm untuk betametason dan pada λ = 282 nm untuk deksklorfeniramin maleat dapat dilihat pada Gambar 4.1 dan 4.2.
Gambar 4.1 Kurva serapan maksimum betametason 11 μg/mL
32
4.2 Hasil Penentuan Kurva Serapan Kurva Serapan
4.2.1 Hasil Penentuan Kurva Serapan Betametason
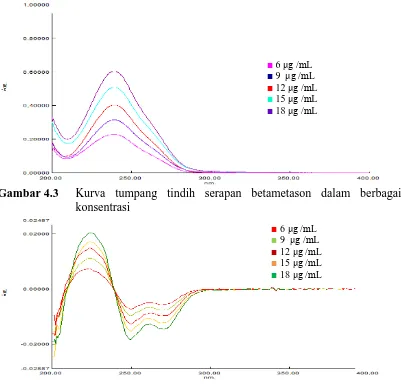
[image:50.596.116.517.302.687.2]Telah didapatkan serapan dari larutan betametason dibuat dalam konsentrasi 6; 9; 12; 15; dan 18 μg /mL pada panjang gelombang 200-400 nm. Kurva serapan yang telah diperoleh selanjutnya ditransformasikan menjadi kurva serapan derivat pertama dan derivat kedua dengan ∆λ = 2 nm, Kurva tumpang tindih serapan, derivat pertama, dan derivat kedua betametason dalam berbagai konsentrasi dapat dilihat pada Gambar 4.3 – 4.5.
Gambar 4.3 Kurva tumpang tindih serapan betametason dalam berbagai konsentrasi
Gambar 4.4 Kurva tumpang tindih serapan derivat pertama betametason dalam
berbagai konsentrasi
■ 6 μg /mL
■ 9 μg /mL
■ 12 μg /mL ■ 15 μg /mL
■ 18 μg /mL
■6 μg /mL
■9 μg /mL ■12 μg /mL
■ 15 μg /mL
33
Gambar 4.5 Kurva tumpang tindih serapan derivat kedua betametason dalam
berbagai konsentrasi
4.2.2 Hasil Penentuan Kurva Serapan Deksklorfeniramin maleat
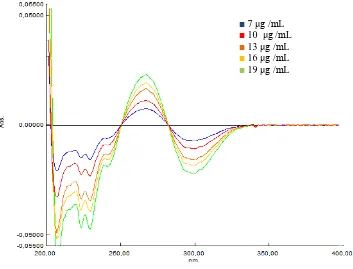
Telah didapatkan kurva serapan dari larutan deksklorfeniramin maleat dibuat dalam konsentrasi 7; 10; 13; 16; dan 19 μg /mL pada panjang gelombang 200-400 nm. Kurva serapan yang telah diperoleh selanjutnya ditransformasikan menjadi kurva serapan derivat pertama dan derivat kedua dengan ∆λ = 2 nm, Kurva tumpang tindih serapan, derivat pertama, dan derivat kedua deksklorfeniramin maleat dalam berbagai konsentrasi dapat dilihat pada Gambar 4.6 dan 4.8.
Gambar 4.6 Kurva tumpang tindih serapan deksklorfeniramin maleat dalam
berbagai konsentrasi
■6 μg /mL
■9 μg /mL
■12 μg /mL ■ 15 μg /mL
■ 18 μg /mL
■ 7 μg /mL
■ 10 μg /mL
■ 13 μg /mL ■ 16 μg /mL
34
Gambar 4.7 Kurva tumpang tindih serapan derivat pertama deksklorfeniramin
maleat dalam berbagai konsentrasi
Gambar 4.8 Kurva tumpang tindih serapan derivat kedua deksklorfeniramin
maleat dalam berbagai konsentrasi
■ 7 μg /mL
■ 10 μg /mL
■13 μg /mL
■ 16 μg /mL
■ 19 μg /mL
■ 7 μg /mL
■ 10 μg /mL
■13 μg /mL
■ 16 μg /mL
[image:52.596.123.476.92.361.2] [image:52.596.121.497.403.689.2]35
4.3 Hasil Penentuan Zero crossing
4.3.1 Zero Crossing Derivat Pertama dan Kedua Betametason
Penentuan zero crossing pada derivat pertama dan kedua diperoleh dengan menumpangtindihkan spektrum serapan derivat pertama dan kedua pada masing-masing zat dari berbagai konsentrasi larutan, ditunjukkan oleh panjang gelombang yang memiliki serapan nol pada berbagai konsentrasi. Zero crossing derivat pertama dan kedua betametason dalam berbagai konsentrasi dapat dilihat pada Gambar 4.9 dan 4.10.
Gambar 4.9 Zero Crossing derivat pertama betametason dalam berbagai konsentrasi
Gambar 4.10 Zero Crossing derivat kedua betametason dalam berbagai konsentrasi
209,07 238,88 305,83
260,48 249,6
8
271,71 ■■ 6 9 μg /mμg /mL L
■12 μg /mL ■ 15 μg /mL
36
4.3.2 Zero Crossing Derivat Pertama dan Kedua Deksklorfeniramin maleat
Penentuan zero crossing pada derivat pertama dan kedua diperoleh dengan menumpangtindihkan spektrum serapan derivat pertama dan kedua pada masing-masing zat dari berbagai konsentrasi larutan, ditunjukkan oleh panjang gelombang yang memiliki serapan nol pada berbagai konsentrasi. Zero crossing derivat pertama dan kedua deksklorfeniramin maleat dalam berbagai konsentrasi dapat dilihat pada Gambar 4.11 dan 4.12.
Gambar 4.11 Zero Crossing derivat pertama deksklorfeniramin maleat dalam
berbagai konsentrasi
Gambar 4.12 Zero Crossing derivat kedua deksklorfeniramin maleat dalam
berbagai konsentrasi 219,44 229,37
239,3
266,95
241,47
■ 7 μg /mL
■ 10 μg /mL
■13 μg /mL
■ 16 μg /mL
37
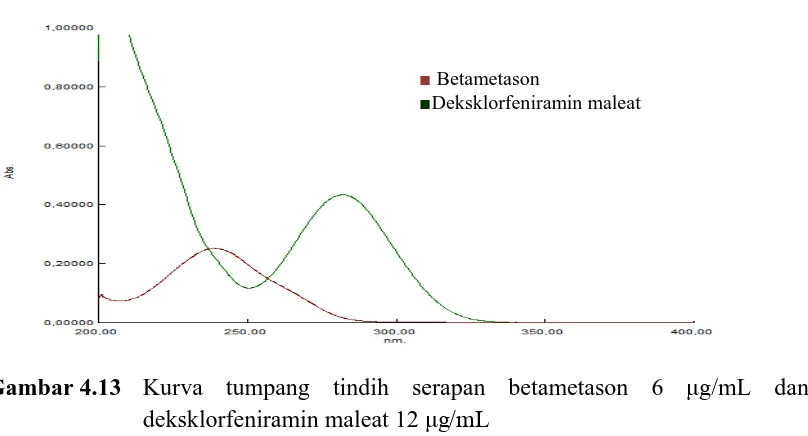
4.4 Hasil Penentuan Panjang Gelombang Analisis
[image:55.596.120.524.492.710.2]Penentuan panjang gelombang analisis dilakukan dengan cara membuat larutan betametason dengan konsentrasi 6 μg/mL, deksklorfeniramin maleat dengan konsentrasi 12 μg/mL, dan larutan campuran kedua zat itu sehingga di dalamnya terdapat betametason dengan konsentrasi 6 μg/mL dan deksklorfeniramin maleat dengan konsentrasi 12 μg/mL. Kemudian dibuat spektrum serapan derivat pertama dari masing-masing larutan zat tunggal dan dari campuran zat. Spektrum serapan derivat pertama dari larutan zat tunggal dan campuran keduanya di tumpangtindihkan. Demikian juga untuk spektrum serapan derivat kedua. Penentuan panjang gelombang analisis dilakukan berdasarkan pengamatan pada kurva serapan masing-masing derivat, kemudian dilanjutkan pengukuran absorbansi pada masing-masing zero crossing. Kurva tumpang tindih serapan, derivat pertama, derivat kedua betametason dan deksklorfeniramin maleat dapat dilihat pada Gambar 4.13 – 4.15.
Gambar 4.13 Kurva tumpang tindih serapan betametason 6 μg/mL dan deksklorfeniramin maleat 12 μg/mL
■ Betametason
38
Gambar 4.14 Kurva tumpang tindih serapan derivat pertama betametason 6 μg/mL dan deksklorfeniramin maleat 12 μg/mL
Gambar 4.15 Kurva tumpang tindih serapan derivat kedua betametason 6 μg /mL
dan deksklorfeniramin maleat 12 μg/mL
Dari gambar diatas diperoleh hasil bahwa pada kurva tumpang tindih serapan betametason 6 μg /mL dan deksklorfeniramin maleat 12 μg/mL tidak ditemukan zero crossing (Gambar 4.14) maka dilanjutkan ke derivat kedua. Jika dilihat hanya dari zero crossing senyawa tunggalnya saja, pada serapan derivat pertama, zero crossing untuk betametason yaitu pada 209,07 nm; 238,88 nm; dan 305,83 nm. Sedangkan untuk deksklorfeniramin maleat pada 250,54 nm; 282,51 nm; dan 338,23 nm.
■ Betametason
■Deksklorfeniramin maleat
■Betametason
[image:56.596.119.477.289.488.2]39
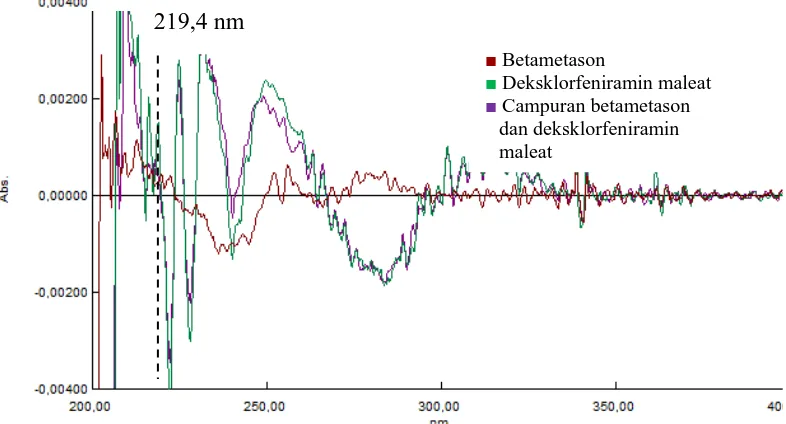
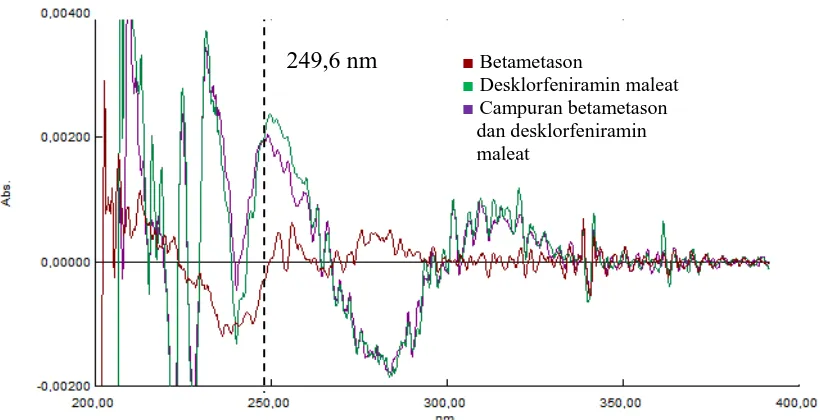
Namun jika kita lihat pada gambar 4.15, diperoleh panjang gelombang yang dapat dipakai adalah pada serapan derivat kedua. Oleh karenanya dibuat spektrum serapan derivat kedua untuk mendapatkan panjang gelombang analisis betametason dan deksklofeniramin maleat.
Bila kedua pita serapan mempunyai panjang gelombang yang hampir sama akan terjadi pelebaran pita, maka kurva derivatif pertama tidak akan membantu pemisahan spektranya. Pada situasi tersebut maka dicoba derivatif kedua (Nurhidayati, 2007).
Dari spektrum derivat kedua, didapatkan zero crossing untuk betametason dan deksklorfeniraamin maleat. Maka, pengukuran akan dilakukan pada derivat kedua dengan panjang gelombang analisis yang diperoleh. Kurva tumpang tindih serapan dan derivat kedua betametason 6 μg/mL, deksklorfeniramin maleat 12
μg/mL dan campuran betametason dan deksklorfeniramin maleat dapat dilihat pada gambar 4.16 dan 4.17.
Gambar 4.16 Kurva tumpang tindih serapan betametason 6 μg/mL, deksklorfeniramin maleat 12 μg/mL dan campuran betametason dan deksklorfeniramin maleat
■ Betametason
■ Deksklorfeniramin maleat
40
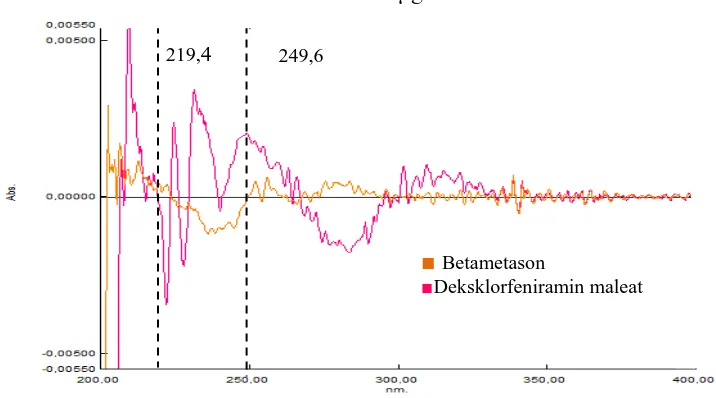
Gambar 4.17 Kurva tumpang tindih serapan derivat kedua betametason 6 μg/mL, deksklorfeniramin maleat 12 μg/mL dan campuran betametason dan deksklorfeniramin maleat
Zero crossing derivat kedua betametason dan Zero crossing derivat kedua
desklorfeniramin maleat dalam berbagai konsentrasi dapat dilihat pada Gambar 4.18 dan 4.19.
Gambar 4.18 Zero crossing derivat kedua betametason λ = 219,4 nm
219,4 249,6
219,4 nm
■ Betametason
■ Deksklorfeniramin maleat
■ Campuran betametason dan deksklorfeniramin maleat
■ Betametason
■ Deksklorfeniramin maleat
[image:58.596.118.511.511.723.2]41
Gambar 4.19 Zero crossing derivat kedua deksklorfeniramin maleat λ = 249,6
nm
Dari gambar diatas diperoleh panjang gelombang analisis untuk penetapan kadar campuran betametason dan deksklorfeniramin maleat adalah pada serapan derivat kedua. Hal ini diketahui berdasarkan zero crossing pada setiap derivat. Panjang gelombang analisis didapat dengan menentukan zero crossing untuk masing-masing zat di mana ditentukan panjang gelombang dengan absorbansi salah satu zat berada pada nilai nol sedangkan pada zat lain memiliki nilai positif.
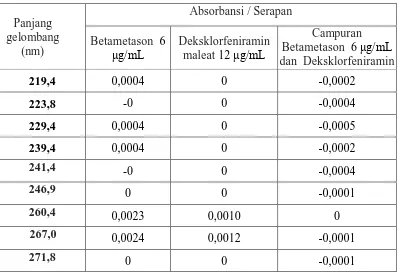
Dari hasil spektrum serapan derivat kedua, diketahui bahwa zero crossing untuk betametason berada pada panjang gelombang 223,76 nm; 249,68 nm; 260,48 nm; dan 271,1 nm. Sedangkan zero crossing untuk deksklorfeniramin maleat adalah pada panjang gelombang 219,44 nm; 229,37 nm; 239,3 nm; 241,47 nm; dan 266,95 nm. Setelah spektrum serapan derivat kedua dari kedua zat ditumpang tindihkan, diperoleh beberapa panjang gelombang analisis. Panjang gelombang analisis spektrum derivat kedua dapat dilihat pada Tabel 4.1.
249,6 nm ■ Betametason
■ Desklorfeniramin maleat
42
Tabel 4.1 Panjang Gelombang Analisis Spektrum Derivat Kedua
Dari Tabel 4.1 diperoleh panjang gelombang analisis yang paling tepat digunakan untuk menentukan kadar sampel adalah pada 219,4 nm untuk betametason dan 249,6 nm untuk deksklorfeniramin maleat. Penentuan panjang gelombang analisis untuk betametason adalah pada 219,4 nm, karena pada panjang gelombang ini serapan deksklorfeniramin maleat adalah nol, sedangkan betametason dan campuran keduanya mempunyai nilai serapan sama dan maksimum yaitu 0,0004. Demikian juga panjang gelombang analisis untuk deksklorfeniramin maleat adalah pada 249,6 nm , karena pada panjang gelombang ini serapan betametason adalah nol, sedangkan deksklorfeniramin maleat dan campuran keduanya mempunyai nilai serapan yang hampir sama dan maksimum yaitu 0,0023 untuk betametason dan campuran (betametason dan deksklorfeniramin maleat) yaitu 0,0024.
Panjang gelombang
(nm)
Absorbansi / Serapan
Betametason 6
μg/mL Deksklorfeniramin maleat 12 μg/mL
Campuran
Betametason 6 μg/mL
dan Deksklorfeniramin
219,4 0,0004 0 -0,0002
223,8 -0 0 -0,0004
229,4 0,0004 0 -0,0005
239,4 0,0004 0 -0,0002
241,4 -0 0 -0,0004
246,9 0 0 -0,0001
260,4 0,0023 0,0010 0
267,0 0,0024 0,0012 -0,0001
43
4.5 Hasil Penentuan Linearitas Kurva Kalibrasi
4.5.1 Kurva Kalibrasi
[image:61.596.114.544.500.707.2]Penentuan linieritas kurva kalibrasi menunjukkan hubungan yang linier antara absorbansi dengan konsentrasi, untuk betametason (gambar 24) dengan koefisien korelasi, r = 0,9996 dan persamaan regresi Y = (6,82X + 1,43).10-5; untuk deksklorfeniramin maleat (gambar 25) dengan koefisien korelasi, r = 0,9997 dan persamaan regresi Y = (20,3X +2,09).10-5. Nilai r˃ 0,99 menunjukkkan adanya korelasi linier hubungan antara X dan Y (Watson, 2010). Data kalibrasi betametason dan deksklorfeniramin maleat dapat dilihat pada lampiran 10 dan 12. Hal ini menunjukkan bahwa konsentrasi kerja betametason 6 μg/mL dan deksklorfeniramin maleat 12 μg/mL dapat terdeteksi dan terkuantitasi dengan metode spektrofotometri derivatif yang digunakan. Kurva kalibrasi betametason derivat kedua pada gelombang 219,4 nm dan desklorfeniramin maleat derivat kedua pada panjang gelombang 249,6 nm dapat dilihat pada Gambar 4.20 dan 4.21.
Gambar 4.20. Kurva kalibrasi betametason derivat kedua pada gelombang
219,4 nm.
Y = (6,82X + 1,43).10-5 r = 0,9999
44
Gambar 4.21 Kurva kalibrasi deksklorfeniramin maleat derivat kedua pada
panjang gelombang 249,6 nm.
4.5.2 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi dihitung dari persamaan regresi yang diperoleh dalam kurva kalibrasi. Batas deteksi dan batas kuantitasi analisis betametason yang diperoleh secara berturut-turut adalah 0,5745μg/mL dan 1,9152
μg/mL. Sedangkan untuk deksklorfeniramin maleat, batas deteksi dan batas kuantitasi yang diperoleh berturut-turut adalah 0,4688μg/mL dan 1,5629μg/mL. Perhitungan batas deteksi dan batas kuantitasi ini dapat dilihat pada Lampiran 11 dan 13 halaman 76 dan 79.
Hal ini menunjukkan bahwa pengukuran kadar betametason dengan konsentrasi 6 μg/mL dan deksklorfeniramin maleat dengan konsentrasi 12 μg/mL dapat terdeteksi dan terkuantitasi menggunakan metode spektrofotometri derivatif.
Batas deteksi merupakan parameter uji batas yang dilakukan untuk mendeteksi jumlah terkecil analit dalam sampel yang masih memberikan respon signifikan dengan blanko. Sedangkan batas kuantitasi merupakan kuantitas
Y = (20,3X +2,09).10-5 r = 0,9997
45
terkecil analit yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
4.6 Hasil Penentuan Kadar Deksklorfeniramin maleat dan Betametason dalam Sediaan Tablet
Penentuan penetapan kadar deksklorfeniramin maleat dan betametason dalam tablet yang beredar diapotik mengandung masing-masing deksklorfeniramin maleat 2 mg dan betametason 0,25 mg. Sedangkan pengukuran deksklorfeniramin maleat dan betametason baku pada sediaan kedua masing-masing deksklorfeniramin maleat 12,1 μg/mL dan betametason 6 μg/mL. Agar tercapainya uji perbandingan tersebut maka dilakukan addisi dengan baku pembanding sebanyak 4 mL dari larutan induk baku III setelah itu dapat dilakukan pengukuran pada metode spektrofotometri derivatif.
Sampel yang telah dipreparasi kemudian diukur pada panjang gelombang 200 – 400 nm. Selanjutnya spektrum hasil serapan ditransformasikan menjadi
spektrum serapan derivat kedua dengan Δλ = 2 nm. Berdasarkan spektrum tersebut dapat ditentukan absorbansi deksklorfeniramin maleat dan betametason pada panjang gelombang analisis yang telah diperoleh sebelumnya, yaitu panjang gelombang 249,6 nm dan 219,4 nm. Contoh perhitungan penetapan kadar betametason dan deksklorfeniramin maleat dapat dilihat pada lampiran 18 halaman 89.
46
[image:64.596.112.516.196.312.2]Polacel® setelah dilakukan analisa secara statistik (data dan perhitungan pada Lampiran 19 – 24 halaman 93-109) Kadar betametason dan deksklorfeniramin dalam sampel dapat dilihat pada tabel di bawah ini :
Tabel 4.2 Kadar betametason dan deksklorfeniramin dalam sampel
No Nama Sediaan Kadar Betametason (%)
Kadar Deksklorfeniramin maleat (%)
1. Celestamin® 94,64 ± 2,4980 94,06 ± 0,5959
2. Ocuson® 94,75 ± 2,2378 95,64 ± 0,3245
3. Polacel® 92,18 ± 1,9620 94,24 ± 0,5709
Berdasarkan tabel 4.2, diperoleh kadar deksklorfeniramin maleat dan betametason pada kedua sediaan memenuhi persyaratan menurut USP 30 NF 25 2007 yaitu mengandung betametason dan deksklorfeniramin maleat tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket.
4.7 Hasil Uji Validasi
4.7.1 Hasil Uji Akurasi
Parameter validasi yang diuji adalah akurasi (kecermatan), presisi (keseksamaan), batas deteksi dan batas kuantitasi. Akurasi (kecermatan) metode dinyatakan dalam persen perolehan kembali (% recovery) yang ditentukan dengan menggunakan metode penambahan baku.
47
Uji akurasi dengan parameter per