Lampiran 1. Sampel Grafasma® dan Ifasma® Tablet
1. Merek Grafasma®
Gambar 1. Grafasma® tablet
2. Merek Ifasma®
Lampiran 2. Komposisi Tablet Grafasma® dan Ifasma®
Daftar Spesifikasi Sampel
1. Grafasma® (PT. Graha Farma) No. Reg : DKL9231102410A1 Expire Date : September 2017
Komposisi : Theophylline…………... 130 mg Efedrine HCl……….………. 10 mg
2. Ifasma® (PT. Ifars)
No. Reg : DKL7609203410A1 Expire Date : Oktober 2015
Lampiran 3. Gambar Alat
Gambar 3. Spektrofotometer UV-Vis (Shimadzu 1800)
Gambar 4. Neraca analitik (Mettler Toledo)
Lampiran 4. Perhitungan Pembuatan HCl 0,1N
HCl pekat = 37% setara dengan 12 N V1 x N1 = V2 x N2
V1 x 12 N = 1000 mL x 0,1 N
V1 = 12N
N 1 , 0
ml 1000
x
Lampiran 5. Bagan Alir Prosedur Penelitian
Dimasukkan ke labu 10mL dan
dicukupkan dengan HCl 0,1 N sampai garis tanda
Dimasukkan ke labu 10mL dan
dicukupkan HCl 0,1 N sampai garis tanda Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda diambil 2,5 mL
dimasukkan ke dalam labu tentukur 25 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
LIB II Teofilin 100 μg/mL
4 μg/mL 8 μg/mL 10 μg/mL 12 μg/mL
diambil 0,4 mL diambil 0,8 mL diambil 1 mL
diambil 0,6 mL
Diambil 1,2 mL
diukur serapan maksimum
pada λ 200 -400 nm Serapan
Maksimum Teofilin
ditimbang 50 mg
dimasukkan ke dalam labu tentukur 50 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
Lampiran 5. (Lanjutan)
Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda Dimasukkan ke labu 10mL dan dicukupkan HCl 0,1 N sampai garis tanda
diambil 2,5 mL
dimasukkan ke dalam labu tentukur 25 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
LIB II Efedrin HCl 100 μg/mL
2 μg/mL 5 μg/mL 4 μg/mL 6 μg/mL
diambil 0,2 mL diambil 0,5 mL diambil 0,4 mL
diambil 0,3mL
Diambil 0,6 mL
diukur serapan maksimum
pada λ 200 -400 nm Serapan
Maksimum Efedrin HCl
ditimbang 50 mg
dimasukkan ke dalam labu tentukur 50 mL
dilarutkan dan dicukupkan dengan HCL 0,1N
Lampiran 5. (Lanjutan)
Persamaan Regresi
dibuat kurva kalibrasi Larutan Standar Teofilin
(4; 6; 8; 10; 12 μg/mL )
diukur serapan pada λ 200-400 nm ditransformasikan ke serapan derivat pertama
ditransformasikan ke serapan derivat kedua
ditentukan zero crossing ditentukan panjang gelombang analisis
Lampiran 5. (Lanjutan)
Persamaan Regresi
dibuat kurva kalibrasi Larutan Standar Efedrin HCl
(2; 3; 4; 5; 6 μg/mL)
diukur serapan pada λ 200-400 nm ditransformasikan ke serapan derivat pertama
ditransformasikan ke serapan derivat kedua
ditentukan zero crossing ditentukan panjang gelombang analisis
Lampiran 5. (Lanjutan)
ditimbang
digerus dalam lumpang sampai halus dan homogen
ditimbang setara 50 mg teofilin
dihitung kesetaraan efedrin HCl yang terkandung didalamnya (penimbangan dilakukan sebanyak 6 kali pengulangan)
dimasukkan kedalam labu tentukur 50 mL dilarutkan dengan HCl 0,1N
dihomogenkan dengan sonikator selama 15 menit dicukupkan dengan HCl 0,1N sampai garis tanda dihomogenkan
disaring
dibuang ± 10 mL filtrat pertama filtrat selanjutnya ditampung dipipet 0,08 mL
ditambahkan 0,44 mL larutan efedrin HCl (untuk adisi)
dimasukkan kedalam labu tentukur 10 mL
dicukupkan dengan HCl 0,1 N sampai garis tanda diukur pada λ 244,2 nm untuk teofilin dan 213,8 nm untuk efedrin HCl
dihitung Nilai Absorbansi
Kadar 20 tablet
Lampiran 6. Spektrum Serapan Teofilin Baku dan Efedrin HCl Baku
a. Teofilin
nm.
200.00 250.00 300.00 350.00 400.00
A
bs.
0.80000
0.60000
0.40000
0.20000
Lampiran 6. (Lanjutan)
nm.
200.00 250.00 300.00 350.00 400.00
A
b
s.
1.80000
1.50000
1.00000
0.50000
Lampiran 6. (Lanjutan)
b. Efedrin HCl
nm.
200.00 250.00 300.00 350.00 400.00
A
b
s.
0.25000
0.20000
0.10000
0.00000
Lampiran 6. (Lanjutan)
nm.
200.00 250.00 300.00 350.00 400.00
A
b
s.
0.50000
0.40000
0.20000
Lampiran 7. Spektrum Serapan Derivat Pertama Teofilin dan Efedrin HCl
a. Teofilin
nm.
200.00 250.00 300.00 350.00 400.00
A
bs.
0.04000
0.02000
0.00000
-0.02000
Lampiran 7. (Lanjutan)
nm.
200.00 250.00 300.00 350.00 400.00
A
b
s.
0.12000 0.10000
0.05000
0.00000
-0.05000
Lampiran 7. (Lanjutan)
b. Efedrin HCl
nm.
200.00 250.00 300.00 350.00 400.00
A
bs.
0.00300
0.00000
-0.00500
Lampiran 7. (Lanjutan)
nm .
200.00 250.00 300.00 350.00 400.00
A
bs.
0.00900
0.00000
-0.01000
-0.02000
Lampiran 8. Spektrum Serapan Derivat Kedua Teofilin dan Efedrin HCl
a. Teofilin
nm .
200.00 250.00 300.00 350.00 400.00
A
bs.
0.00600 0.00500
0.00000
-0.00500
Lampiran 8. (Lanjutan)
nm .
200.00 250.00 300.00 350.00 400.00
A
bs.
0.01500
0.00000
-0.02000
-0.04000
Lampiran 8. (Lanjutan)
b. Efedrin HCl
nm.
200.00 250.00 300.00 350.00 400.00
A
bs.
0.00400
0.00200
0.00000
Lampiran 8. (Lanjutan)
nm .
200.00 250.00 300.00 350.00 400.00
A
bs.
0.00700
0.00500
0.00000
Lampiran 9. Spektrum Serapan Panjang Gelombang Analisis Teofilin dan
Efedrin HCl
nm .
200.00 250.00 300.00 350.00 400.00
A
bs.
0.01500
0.01000
0.00000
-0.01000
-0.02000
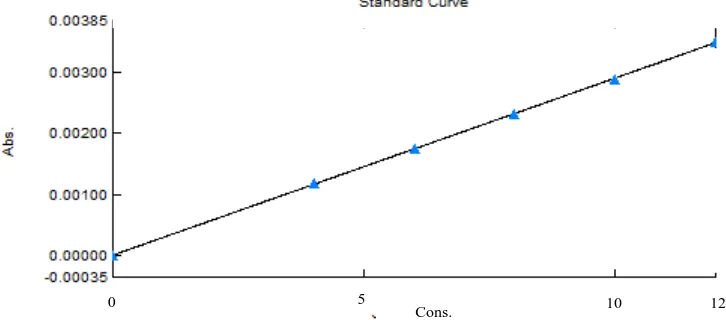
Lampiran 10. Data Kalibrasi Teofilin BPFI, Persamaan Regresi dan Koefisien
Korelasi
Kalibrasi serapan derivat kedua teofilin pada panjang gelombang 244,20 nm
No. Konsentrasi (μg/mL) (X) Absorbansi (Y)
1. 0,0000 0,00000
2. 4,0000 0,00119
3. 6,0000 0,00175
4. 8,0000 0,00232
5. 10,0000 0,00289
6. 12,0000 0,00350
Perhitungan persamaan garis regresi
No. X Y XY X2` Y2
1. 0,00000 0,00000 0,00000 0,00000 0,0000000000 2. 4,00000 0,00119 0,00476 16,00000 0,0000014161 3. 6,00000 0,00175 0,01050 36,00000 0,0000030625 4. 8,00000 0,00232 0,01856 64,00000 0,0000053824 5. 10,00000 0,00289 0,02890 100,00000 0,0000083521 6. 12,00000 0,00350 0,04200 144,00000 0,0000122500
ΣX = 40 =6,666667
ΣY = 0,01165 = 0,00194
ΣXY = 0,10472 ΣY
2
= 360 Σ Y
2
= 0,0000304631
Lampiran 10. (Lanjutan)
Perhitungan Koefisien Korelasi ( )
=
0,9999
Lampiran 11. Data Kalibrasi Efedrin HCl, Persamaan Regresi dan Koefisien
Korelasi
Kalibrasi serapan derivat kedua efedrin HCl pada panjang gelombang 213,80 nm
No. Konsentrasi (μg/mL) (X) Absorbansi (Y)
1. 0,00000 0,00000
2. 2,00000 0,00124
3. 3,00000 0,00182
4. 4,00000 0,00231
5. 5,00000 0,00290
6. 6,00000 0,00348
Perhitungan Persamaan Garis Regresi
No. X Y XY` X2 Y2
1. 0,00000 0,00000 0,00000 0,00000 0,00000
2. 2,00000 0,00124 0,00248 4,00000 1,5376.10-6 3. 3,00000 0,00182 0,00546 9,00000 3,3124.10-6 4. 4,00000 0,00231 0,00924 16,00000 5,3361.10-6 5. 5,00000 0,00290 0,01450 25,00000 8,41.10-6 6. 6,00000 0,00348 0,02088 36,00000 12,1104.10-6
ΣX = 20
=3,333
ΣY = 0,01175
= 0,00196
ΣXY =
0,05256 ΣX
2
= 90 ΣY
2
= 30,7065.10-6
Lampiran 11. (Lanjutan)
Perhitungan Koefisien Korelasi ( )
Lampiran 12. Perhitungan Batas Deteksi (Limit of Detection, LOD) dan Batas
Kuantitasi (Limit of Quantitation, LOQ) Teofilin
Persamaan garis regresi teofilin adalah
No. X Y Yi Y-Yi (10-5) (Y-Yi)2 (10-10)
1 0,00000 0,00000 0,00001 -1 1
2 4,00000 0,00119 0,00117 2 4
3 6,00000 0,00175 0,00175 0 0
4 8,00000 0,00232 0,00233 -1 1
5 10,00000 0,00289 0,00291 -2 4
6 12,00000 0,00350 0,00349 1 1
Σ(Y-Yi)2 11
1,6583.10-5
0,1715 μg/mL
Lampiran 13. Perhitungan Batas Deteksi (Limit of Detection, LOD) dan Batas
Kuantitasi (Limit of Quantitation, LOQ) Efedrin HCl
Persamaan garis regresi efedrin HCl adalah Y = 0,00057X + 0,00005
No. X Y Yi Y-Yi (10-5) (Y-Yi)2 (10-10)
1 0,00000 0,00000 0,00005 -5 25
2 2,00000 0,00124 0,00119 5 25
3 3,00000 0,00182 0,00176 6 36
4 4,00000 0,00231 0,00233 -2 4
5 5,00000 0,00290 0.00290 0 0
6 6,00000 0,00348 0,00347 1 1
Σ (Y-Yi)2 102 5,0498 .10-5
0,2658 μg/mL
Lampiran 14. Spektrum Serapan Derivat Kedua Sampel
nm .
200.00 250.00 300.00 350.00 400.00
Ab
s.
0.04000
0.03000
0.02000
0.01000
0.00000
Lampiran 14. (Lanjutan)
nm .
200.00 250.00 300.00 350.00 400.00
Ab
s.
0.04000
0.03000
0.02000
0.01000
0.00000
Lampiran 14. (Lanjutan)
nm .
200.00 250.00 300.00 350.00 400.00
Ab
s.
0.04000
0.03000
0.02000
0.01000
0.00000
Lampiran 14. (Lanjutan)
nm .
200.00 250.00 300.00 350.00 400.00
Ab
s.
0.02000
0.01000
0.00000
Lampiran 15. Hasil Analisis Kadar Teofilin dan Efedrin HCl dalam Tablet
1. Kadar teofilin dalam sediaan tablet (mengandung 130 mg teofilin dalam satu tablet) Nama Sediaan Penimba-ngan (g) Setara (mg) Absorbansi pada λ = 244,2 nm
Konsentra- si teoritis
(μg/mL)
Konsentra-si teofilin (μg/mL)
Kadar % Kadar (mg) G R A F A S M A® (PT. GraHa Farma)
0,0811 49,5197 0,00232 7,9232 7,9655 100,45 130,58 0,0819 50,0082 0,00234 8,0013 8,0345 100,33 130,43 0,0820 50,0693 0,00232 8,0111 7,9655 99,35 129,15 0,0819 50,0082 0,00232 8,0113 7,9655 99,47 129,31 0,0817 49,8861 0,00229 7,9818 7,8621 98,42 127,95 0,0825 50,3746 0,00238 8,0599 8,1724 101,31 131,70
I F A S M A® (PT. Ifars)
Lampiran 15. (Lanjutan)
2. Kadar efedrin HCl dalam sediaan tablet (mengandung 10 mg efedrin HCl dalam satu tablet) Nama Sediaan Penimban-gan (g) Setara (mg) Absorban- si pada λ=213,8 nm Konsentra-si teoritis (μg/mL)
Konsentrasi efedrin HCl
(μg/mL)
Kadar % Kadar (mg) G R A F A S M A® (PT. GraHa Farma)
0,0811 3,8092 0,00222 3,9958 3,8070 95,97 9,59 0,0819 3,8468 0,00231 4,0007 3,9649 97,66 9.76 0,0820 3,8515 0,00231 4,0055 3,9649 98,86 9,88 0,0819 3,8468 0,00231 4,0007 3,9649 99,43 9,94 0,0817 3,8374 0,00232 3,9909 3,9825 99,65 9,96 0,0825 3,8750 0,00239 4,0300 4,1052 101,73 10,17
I F A S M A® (PT. Ifars)
Lampiran 16. Contoh Perhitungan Kadar Teofilin dan Efedrin HCL dalam
Sediaan Tablet
i.) Perhitungan volume analisis untuk teofilin dan efedrin HCl
Sediaan tablet yang digunakan tablet Grafasma® dan Ifasma® yang mengandung teofilin 130 mg dan efedrin HCl 10 mg
Berat 20 tablet Grafasma® = 4,2581 g
Ditimbang serbuk setara dengan 50 mg teofilin, maka jumlah serbuk yang ditimbang adalah;
x
1 x 4,2581g= 0,0819 g
Kemudian dihitung kesetaraan efedrin HCl yang terkandung dalam 0,0819 g serbuk.
x
2 x (20 x 10 mg)= 3,8468 mg
Dilarutkan 0,0819 g serbuk dalam HCl 0,l N dalam labu tentukur 50 mL sampai garis tanda. Larutan kemudian dihomogenkan, disaring, lebih kurang 10 mL filtrat pertama dibuang. Filtrat selanjutnya ditampung (larutan A).
Konsentrasi teofilin larutan A x 1000 μg = 1000 μg/mL
Konsentrasi efedrin HCl larutan A x 1000 μg = 77 μg/mL
Lampiran 16. (Lanjutan)
Konsentrasi teofilin larutan B = = 8 μg/mL
Konsentrasi efedrin HCl larutan B = = 0,616 μg/mL
Konsentrasi analisis untuk efedrin HCl 4 μg/mL, sedangkan konsentrasi dalam larutan B adalah 0,616 μg/mL. Maka untuk mendapatkan konsentrasi analisis dilakukan penambahan baku efedrin HCl untuk metode adisi. Penambahan baku dilakukan dengan pembuatan LIB konsentrasi 77 μg/mL.
Konsentrasi yang dibutuhkan dari adisi = 4 μg/mL - 0,616 μg/mL = 3,384 μg/mL
Volume efedrin HCl dari LIB = = 0,44 mL
Maka volume analisis untuk efedrin HCl adalah
= Volume efedrin HCl larutan B + Volume efedrin HCl dari LIB = 0,08 mL+ 0,44 mL
= 0,52 mL
Jadi konsentrasi Efedrin HCl = = 4 μg/mL
ii.) Contoh perhitungan kadar teofilin dan efedrin HCl dari tablet Grafasma®:
Berat serbuk tablet yang ditimbang adalah 0,0820 g, maka terlebih dahulu dihitung kesetaraan dengan teofilin dan efedrin HCl.
Lampiran 16. (Lanjutan)
Konsentrasi teofilin = x 1000 μg = 1001,3858 μg/mL
Konsentrasi teoritis teofilin = x 0,08 mL = 8,0111 μg/mL
Kesetaraan efedrin HCl = x (20 x 10 mg) = 3,8515 mg
Konsentrasi efedrin HCl = x 1000 μg = 77,03 μg/mL
Konsentrasi teoritis efedrin HCl = x0,52 mL = 4,0055 μg/mL
Absorbansi teofilin pada derivat kedua pada panjang gelombang 244,20 nm adalah 0,00232
Kadar teofilin dihitung dari persamaan regresi pada panjang gelombang analisis teofilin Y= 0,00029X + 0,00001
Konsentrasi teofilin: Y = 0,00029X + 0,00001 0,00232 = 0,00029X + 0,00001 0,00232 - 0,00001 = 0,00029X
X =
X = 7,9655 μg/mL Kadar teofilin = x 99,92 %
Lampiran 16. (Lanjutan)
Absorbansi efedrin HCl pada derivat kedua pada panjang gelombang 213,80 nm adalah 0,00231.
Kadar efedrin HCl dihitung dari persamaan regresi pada panjang gelombang analisis efedrin HCl Y = 0,00057X + 0,00005
Konsentrasi efedrin HCl : Y = 0,00057X + 0,00005 0,00231 = 0,00057X + 0,00005
0,00231-0,00005 = 0,00057X
X =
X = 3,9649 μg/mL Kadar efedrin HCl = x 99,87 %
Lampiran 17. Perhitungan Statistik Teofilin pada Tablet Grafasma®
SD =
=
=
= 1,0151
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel
t hitung 1 = =
t hitung 2 = = 1,0617
t hitung 3 = = 1,3030
No. X Kadar (%)
2
1 100,45 0,56 0,3136
2 100,33 0,44 0,1936
3 99,35 -0,54 0,2916
4 99,47 -0,42 0,1764
5 98,42 -1,47 2,1609
6 101,31 1,42 2,0164
Lampiran 17. (Lanjutan)
t hitung 4 = = 1,0135
t hitung 5 = = 3,5472
t hitung 6 = = 3,4265
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar teofilin dalam tablet Grafasma® :
μ
= ± (t
α/2, dk) x SD/√n)= 99,89 ± (4,0321 x 1,0151/√6) = (99,89 ± 1,67)%
Kandungan teofilin dalam tablet Grafasma® = x 130 mg
Lampiran 18. Perhitungan Statistik Efedrin HCl pada Tablet Grafasma®
SD =
=
=
= 1,9485
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel
t hitung 1 = =
t hitung 2 = = 1,5337
t hitung 3 = = 0,1257
No. X
Kadar (%) 2
1 95,57 -2,91 8,4681
2 97,66 -1,22 1,4884
3 98,86 0,1 0,01
4 99,43 0,55 0,3025
5 99,65 0,77 0,5929
6 101,73 2,85 8,1225
Lampiran 18. (Lanjutan)
t hitung 4 = = 0,6914
t hitung 5 = = 0,9680
t hitung 6 = = 3,5828
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima
Kadar efedrin HCl dalam tablet Grafasma® :
μ
= ±(t
α/2, dk) x SD/√n)= 98,88 ± (4,0321 x 1,9485/√6) = (98,88± 3,21) %
Lampiran 19. Perhitungan Statistik Teofilin pada Tablet Ifasma®
SD =
=
=
= 1,6651
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel
t hitung 1 = =
t hitung 2
=
= 3,0893t hitung 3 = = 0,3236
t hitung 4 = = 0,8385
No. X
Kadar (%)
2
1 100,43 1,08 1,1664
2 101,45 2,1 4,41
3 99,57 0,22 0,0484
4 99,92 0,57 0,3249
5 97,18 -2,17 4,7089
6 97,56 -1,79 3,2041
Lampiran 19. (Lanjutan)
t hitung 5 = = 3,1922
t hitung 6 = = 2,5891
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar teofilin dalam tablet Ifasma® :
μ
= ± (t
α/2, dk) x SD/√n)= 99,35 ± (4,0321 x 1,6651/√6) = (99,35 ± 2,7409)%
Kandungan teofilin dalam tablet Ifasma® = x 130 mg
Lampiran 20. Perhitungan Statistik Efedrin HCl pada Tablet Ifasma®
SD =
=
=
= 1,41
Pada interval kepercayaan 99% dengan nilai α = 0,01, dk = n-1= 5, maka t(α/2,dk) = 4,0321
Data diterima jika t hitung < t tabel
t hitung 1 = =
t hitung 2 = = 1,1514
t hitung 3 = = 2,5364
No. X
Kadar (%)
1 97,76 1,17 1,3689
2 95,72 -0,87 0,7569
3 95,13 -1,46 2,1316
4 95,93 -0,66 0,4359
5 98,84 2,25 5,0625
6 96,16 -0,43 0,1849
Lampiran 20. (Lanjutan)
t hitung 4 = = 1,1465
t hitung 5 = = 3,9088
t hitung 6 = = 0,7470
Dari hasil perhitungan tersebut diperoleh bahwa semua t hitung < t tabel, maka semua data tersebut diterima.
Kadar Efedrin HCl dalam Tablet Ifasma® :
μ
= ±(t
α/2, dk) x SD/√n)= 96,59 ± (4,0321 x 1,41/√6) = (96,59 ± 2,3210) %
Lampiran 21. Spektrum Serapan Grafasma® pada Uji Perolehan Kembali
Gambar 51. Spektrum serapan perolehan kembali 80%-1 pada tablet Grafasma®
Gambar 52. Spektrum serapan perolehan kembali 80%-2 pada tablet Grafasma®
[image:47.596.116.515.324.499.2] [image:47.596.116.513.543.716.2]Lampiran 21. (Lanjutan)
[image:48.596.115.501.532.694.2]Gambar 54. Spektrum serapan perolehan kembali 100%-1 pada tablet Grafasma®
Gambar 55. Spektrum serapan perolehan kembali100%-2 pada tablet Grafasma®
Lampiran 21. (Lanjutan)
[image:49.596.116.511.327.501.2]Gambar 57. Spektrum serapan perolehan 120%-1 pada tablet Grafasma®
Gambar 58. Spektrum serapan perolehan kembali 120%-2 pada tablet Grafasma®
[image:49.596.120.504.534.706.2]Lampiran 22. Data Hasil Persen Perolehan Kembali Teofilin pada Tablet
Grafasma® dengan Metode Penambahan Baku (Standard Addition Method)
No. Kon- sen-trasi (%) Penim-bangan (mg) Absor-bansi pada λ= 244,20 nm
Konsentrasi Baku yang ditambahkan (mg) % peroleh-an kembali Setelah penambahan baku (mg) Sebelum penambaha n baku (mg) 1. 80
0,0460 0,00187 40,0863 28,0301 11,9904 100,55
2. 0,0459 0,00186 39,8707 27,9692 11,9904 99,26
3. 0,0462 0,00188 40,3017 28,1521 11,9904 101,33
4.
100
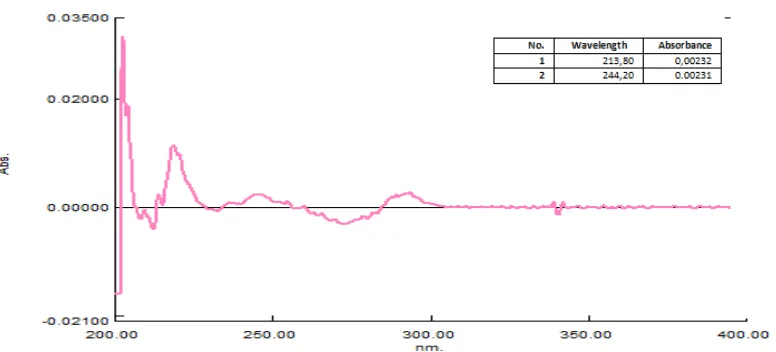
0,0574 0,00232 49,7845 35,0225 14,9880 98,49
5. 0,0575 0,00233 50,0000 35,0835 14,9880 99,93
6. 0,0573 0,00232 49,7845 34,9615 14,9880 98,90
7.
120
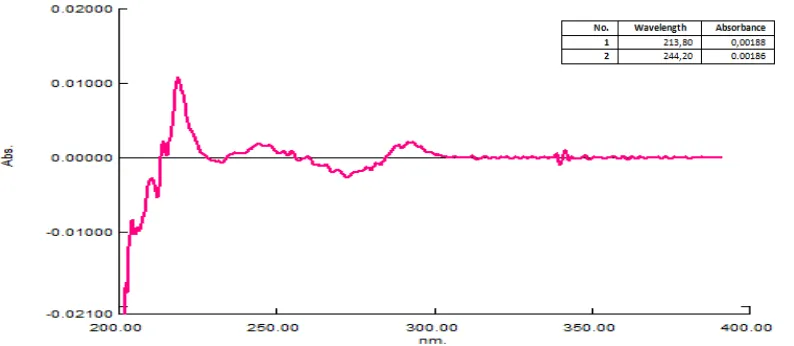
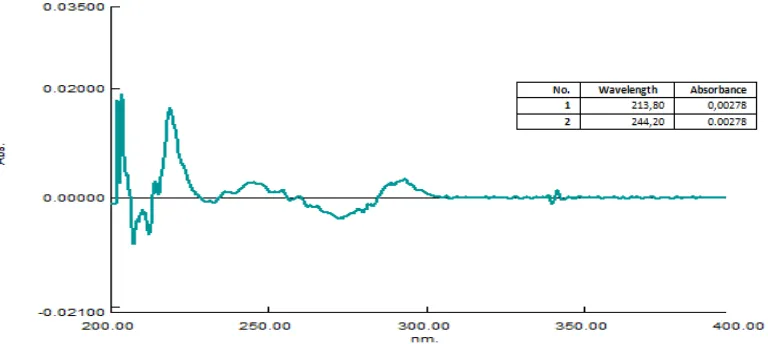
0,0692 0,00281 60,3448 42,1977 17,9856 100,90
8. 0,0688 0,00279 59,9138 41,9538 17,9856 99,86
9. 0,0689 0,00278 59,6983 42,0148 17,9856 98,32
Lampiran 23. Data Hasil Persen Perolehan Kembali Efedrin HCl pada Tablet
Grafasma® dengan Metode Penambahan Baku (Standard AdditionMethod)
No. Kon- sen-trasi (%) Penim-bangan (mg) Absor-bansi pada λ= 213,80 nm
Konsentrasi Baku yang ditambahkan (mg) % peroleh-an kembali Setelah penambahan baku (mg) Sebelum penambaha n baku (mg) 1. 80
0,0460 0,00186 3,0533 2,1364 0,9219 99,46
2. 0,0459 0,00186 3,0533 2,1318 0,9219 99,96
3. 0,0462 0,00186 3,0533 2,1457 0,9219 98,45
4.
100
0,0574 0,00231 3,8124 2,6658 1,1523 99,51
5. 0,0575 0,00231 3,8124 2,6704 1,1523 99,11
6. 0,0573 0,00232 3,8293 2,6612 1,1523 101,37
7.
120
0,0692 0,00280 4,6390 3,2527 1,3828 100,25
8. 0,0688 0,00277 4,5884 3,1943 1,3828 100,82
9. 0,0689 0,00278 4,6053 3,1990 1,3828 101,70
Lampiran 24.Contoh Perhitungan Persentase Perolehan Kembali (%recovery)
Sampel yang digunakan adalah tablet Grafasma® Berat 20 tablet Grafasma® = 4,2581 g
Berat kesetaraan penimbangan sampel pada penetapan kadar = 50 mg
Perolehan 80%
Teofilin 80% = x 50 mg = 40 mg
Serbuk teofilin 70% = x 40 mg = 28 mg Penimbangan serbuk setara 28 mg teofilin
Sampel yang ditimbang x 4,2581 = 0,0459 g
Baku teofilin 30% = x 40 = 12 mg
Jumlah efedrin HCl dalam serbuk yang ditimbang : = x (20 x 10 mg) = 2,1559 mg
Baku efedrin HCl yang ditambahkan : =
= 0,9231 mg
Perolehan100%
Teofilin 100% = x 50 mg = 50 mg
Serbuk teofilin 70% = x 50 mg = 35 mg
mg mg mgx
130 40 10
Lampiran 24. (Lanjutan)
Penimbangan serbuk setara 35 mg teofilin
Sampel yang ditimbang x 4,2581 = 0,0573 g
Baku teofilin 30% = x 50 = 15 mg
Jumlah efedrin HCl dalam serbuk yang ditimbang : = x (20 x 10 mg) = 2,6913 mg
Baku efedrin HCl yang ditambahkan :
= = 1,1538 mg
Perolehan 120%
Teofilin 120% = x 50 mg = 60 mg
Serbuk teofilin 70% = x 60 mg = 42 mg Penimbangan serbuk setara 42 mg teofilin
Sampel yang ditimbang x 4,2581 = 0,0688 g
Baku teofilin 30% = x 60 = 18 mg
Jumlah efedrin HCl dalam serbuk yang ditimbang : = x (20 x 10 mg) = 3,2305 mg
Baku efedrin HCl yang ditambahkan :
= = 1,3846 mg
Lampiran 24. (Lanjutan)
Contoh perhitungan % perolehan kembali pada perolehan 80%
Misalnya absorbansi analisis (Y) : Penimbangan sampel = 0,0460 Teofilin (244,20 nm) = 0,00187
Efedrin HCl (213,80 nm) = 0,00186
A. Teofilin
Persamaan regresi pada panjang gelombang analisis teofilin (λ=244,20 nm): Y = 0,00029X + 0,00001
Konsentrasi teofilin (X):
Y = 0,00029X + 0,00001 0,00187 = 0,00029X + 0,00001 0,00187 – 0,00001 = 0,00029X
X =
X = 6,4138 μg/mL Konsentrasi sampel setelah penambahan bahan baku (CF):
= x faktor pengenceran
= x 6250
= 40,0863 mg
Konsentrasi sampel sebelum penambahan bahan baku (CA):
(CA)
=
Lampiran 24. (Lanjutan)
A = Berat sampel yang akan ditimbang setara 28 mg serbuk teofilin 70% B = Serbuk Teofilin 70%
C = Kadar rata-rata sampel
(CA) =
x (28 mg x 99,89%) = 28,0301 mg
Jumlah baku yang ditambahkan ( ) = D x E Keterangan :
D = Baku teofilin 30% (yang ditambahkan) E = % kadar baku teofilin dari sertifikat analisis
( ) = 12 mg x 99,92% = 11,9904 mg Maka % perolehan kembali teofilin:
% perolehan kembali = x 100 %
% perolehan kembali = x 100%
= 100,55%
B. Efedrin HCl
Persamaan regresi pada panjang gelombang analisis efedrin HCl (λ= 213,80 nm): Y= 0,00057X + 0,00005
Konsentrasi efedrin HCl (X): Y = 0,00057X + 0,00005 0,00186 = 0,00057X + 0,00005 0,00186 – 0,00005 = 0,00057X
Lampiran 24. (Lanjutan)
Konsentrasi awal setelah penambahan bahan baku (CF):
= x faktor pengenceran
= x 961,5385
= 3,0533 mg
Konsentrasi sampel sebelum penambahan bahan baku (CA):
= Keterangan :
A = Berat sampel yang akan ditimbang setara 28 mg serbuk teofilin 70% B = Jumlah efedrin HCl dalam 0,0460 g berat sampel yang akan ditimbang C = Kadar rata-rata sampel
=
x (2,1599 mg x 98,88%) = 2,0529 mg
Jumlah baku yang ditambahkan ( ) = D x E Keterangan :
D = Baku efedrin HCl 30% (yang ditambahkan) E = % kadar baku efedrin HCl dari sertifikat analisis
( ) = 0,9231 mg x 99,87% = 0,9219 mg
Maka % perolehan kembali efedrin HCl
% perolehan kembali = x 100 %
Lampiran 25. Perhitungan Rata-Rata, Standar Deviasi dan Relatif Standar deviasi
Perolehan Kembali Teofilin pada Tablet Grafasma®
SD =
=
= 1,07
RSD =
x
100%
=
x 100%= 1,07%
No KadarPerolehan
Kembali[X](%) Xi-X (Xi–X)2
1. 100,55 -0,88 0,7744
2. 99,26 0,38 0,1444
3. 101,33 -1,66 2,7556
4. 98,49 1,18 1,3924
5. 99,93 -0,26 0,0676
6. 98,90 0,77 0,5929
7. 100,90 -1,23 1,5129
8. 99,86 -0,19 0,0361
9. 98,32 1,35 1,8225
Lampiran 26. Perhitungan Rata-Rata, Standar Deviasi dan Relatif Standar deviasi
Perolehan Kembali Efedrin HCl pada Tablet Grafasma®
SD =
=
= 1,07
RSD
=
x
100%= x 100%
= 1,07%
No Kembali [X] (%) KadarPerolehan Xi-X (Xi–X)2
1. 99,46 0,61 0,3721
2. 99,96 0,11 0,0121
3. 98,45 1,62 2,6244
4. 99,51 0,56 0,3136
5. 99,11 0,96 0,9216
6. 101,37 -1,30 1,69
7. 100,25 -0,18 0,0324
8. 100,82 -0,75 0,5625
9. 101,70 -1,63 2,6569
DAFTAR PUSTAKA
Cairns, D. (2008). Essentials of Pharmaceutical Chemistry. Third Edition. London: Pharmaceutical Press. Halaman 177 - 179.
Charles, E., Sims, M.D., dan G.A. Do Pico, M.D. (1978). Bronchodilator Effect of Ephedrine and Theophylline after Two to Four Weeks of Repeated Dosing. Journal Publications. 73(6): 1019 - 1020.
Connors, K.A. (1982). Textbook of Pharmaceutical Analysis. Third Edition. New York: Willey - VCH. Halaman 171 - 222.
Day, R.A., dan Underwood, A.L. (1998). Quantitative Analysis Sixtth Edition. Penerjemah: Sopyan, I. (2002). Analisis Kimia Kuantitatif Edisi Ke Enam. Jakarta: Penerbit Erlangga. Halaman 413.
Ditjen POM. (1979). Farmakope Indonesia edisi III. Jakarta : Departemen Kesehatan RI. Halaman 53.
Ditjen POM. (1995). Farmakope Indonesia edisi IV. Jakarta : Departemen Kesehatan RI. Halaman 1067.
Ditjen BKAK. (2014). Farmakope Indonesia edisi V. Jakarta : Kementerian Kesehatan RI. Halaman 362-364, 1250, 1251.
El-Sayed, A.Y., Yehia Z., dan Montaser A.M. (2001). Simultaneous Determination of Phosphate and silicate by First-Derivative Spectrophotometry. Analytical Science. The Japan Society for Analytical Chemistry. 17: 1461-1464.
Ermer, J., dan McB. Miller, J. H.. (2005). Method Validation in Pharmaceutical
Analysis, A Guide to Best Practice. Weinheim: Wiley-Vch Verlag GmbH &
Co. KGaA. Halaman 16.
Setiawati, A., dan Gan, S. (1995). Penghambat Adrenergik. Dalam: Ganiswarna, S.G. (1995). Farmakologi dan Terapi Edisi IV. Jakarta: Fakultas Kedokteran Universitas Indonesia. Halaman 77-78.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Majalah Ilmu Kefarmasian. I(3):117-135.
Khopkar, S.M. (1990). Konsep Dasar Kimia Analitik. Penerjemah ; A. Saptorahardjo. Jakarta : Universitas Indonesia (UI Press). Halaman 202 dan 217.
Moffat, A.C., Osselton, M.D., dan Widdop, B. (2005). Clarke’s Analysis of Drug and Poisons. Third Edition. London: Pharmaceutical Press. Halaman 324 -326.
Munson, J.W. (1984). Pharmaceutical Analisis: Part B Modern Methods. Penerjemah: Harjana (1991). Analisis Farmasi Metode Modern. Surabaya: Erlangga University Press. Halaman 369-385.
Nurhidayati L. (2007). Spektrofotometri Derivatif dan Aplikasinya dalam Bidang Farmasi. Jurnal Ilmu Kefarmasian Indonesia 5(2) : 93-99.
Owen, A.J. (1995). Uses of Derivative Spectroscopy Aplication Note UV - Visible Spectroscopy. HP Way: Agilent Technologies.
Pratiwi, P. (2011). Optimasi Fase Gerak Metanol dan Laju Alir Pada Penetapan Kadar Campuran Teofilin dan Efedrin HCl Dalam Tablet Dengan Metode Kromatografi Cair Kinerja Tinggi (KCKT). Skripsi 2011. Medan : Fakultas Farmasi Universitas Sumatera Utara.
Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan pertama. Yogyakarta: Pustaka Pelajar. Halaman 235-236, 240-243 dan 464.
Satiadarma, K., Mulja, M., Tjahjono, D.H., Kartasasmita, R.E. (2004). Asas Pengembangan Prosedur Analisis. Edisi Pertama. Surabaya: Airlangga University Press. Halaman 49, 87 - 93.
Senturk, Z., Erk, N., Ozkan, S.A., Akay, C., dan Cevheroglu, S. (2002). Determination of Theophylline and Ephedrine HCl in Tablets by Ratio-spectra Derivative Spectrophotometry and LC. Journal of Pharmaceutical and Biomedical Analysis. 29: 291-298.
Siswandono, dan Soekardjo, B. (2000). Kimia Medisinal 2. Surabaya: Airlangga University Press. Halaman 400-402.
Skujins, S., dan Varian, A.G. (1986). Applications of UV - Visible Derivative Spectrophotometry. Switzerland: CH 6300 Zug. Halaman 1 - 30.
Sudjana. (2005). Metode Statistika. Bandung: Penerbit Tarsito. Halaman 93, 145, 201, 225.
Sweetman, S. C. (2005). Martindale The Extra Pharmacopoeia. 34th Edition. London:
Pharmaceutical Press. Page 1120.
Tan, T.H. dan Rahardja, K. (2007). Obat-Obat Penting Khasiat, Penggunaan, dan
Efek-Efek Sampingnya. Edisi Keenam. Jakarta: PT. Elex Media Komputindo.
Hal. 646-650.
USP 30-NF 25. (2007). The United States Pharmacopoeia 30 and The National Formulary. 30th edition : The United States Pharmacopoeial Convention. Halaman 2035, 2036, 3319, 3323.
Watson, D.G. (2005). Pharmaceutical Analysis: A Textbook for Pharmacy Students and Pharmaceutical Chemists. 2 edition. Penerjemah: Syarief, W.R. (2007). Analisis Farmasi: Buku Ajar Untuk Mahasiswa Farmasi dan Praktisi Kimia Farmasi. Edisi Kedua. Jakarta: EGC. Hal. 126.
BAB III
METODE PENELITIAN
3.1 Jenis Penelitian
Penelitian ini termasuk jenis penelitian deskriptif dengan metode spektrofotometri derivatif terhadap analisa campuran teofilin dan efedrin HCl yang terkandung pada dua sediaan tablet.
3.2 Tempat dan Waktu Penelitian
Penelitian ini dilakukan pada bulan Februari sampai dengan Maret 2015 di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.3 Alat
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometer UV-Visible (dapat dilihat pada Lampiran 3 halaman 54), Personal Computer (PC) yang dilengkapi software UV Probe 2.42 (UV-1800 Shimadzu), neraca analitik (Mettler Toledo), kuvet, kertas saring, bola karet, spatula, alat gelas dan alat-alat lainnya yang diperlukan dalam penyiapan sampel.
3.4 Bahan
Bahan yang digunakan adalah HCl 0,1 N, teofilin BPFI, efedrin HCl BPFI (sertifikat pengujian dapat dilihat pada Lampiran 28 dan 29 halaman 111 dan 112), Grafasma® (PT. Graha Farma) dan Ifasma® (PT.Ifars).
3.5 Pengambilan Sampel
dengan yang diteliti (Sudjana, 2005). Sampel yang digunakan yaitu tablet Grafasma® (PT. Graha Farma) dan Ifasma® (PT.Ifars) yang mengandung teofilin 130 mg dan efedrin HCl 10 mg. Gambar sediaan dan daftar spesifikasi sediaan tablet dapat dilihat pada Lampiran 1 dan 2 halaman 52 dan 53.
3.6 Prosedur Penelitian
3.6.1 Pembuatan Pelarut
Diencerkan 8,3 mL HCl 37% dengan 1 liter akuades (Ditjen POM, 1979).Perhitungan pembuatan pereaksi dapat dilihat pada Lampiran 4 halaman 55.
3.6.2 Pembuatan Larutan Induk Baku dan Larutan Standar
3.6.2.1 Pembuatan Larutan Induk Baku Teofilin
Ditimbang dengan seksama 50 mg baku pembanding teofilin BPFI kemudian dimasukkan ke dalam labu tentukur 50 mL, dilarutkan dengan HCl 0,1N hingga larut, dicukupkan volume dengan HCl 0,1 N sampai garis tanda sehingga didapatkan larutan dengan konsentrasi 1000 μg/mL (LIB I). Dari larutan LIB I dipipet 2,5 mL dimasukkan ke dalam labu tentukur 25 mL, dicukupkan dengan HCl 0,1 N sampai garis tanda sehingga didapatkan larutan dengan
konsentrasi 100 μg/mL (LIB II). Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 56.
3.6.2.2 Pembuatan Larutan Baku Pembanding Efedrin HCl
tentukur 25 mL, dicukupkan dengan HCl 0,1 N sampai garis tanda sehingga didapatkan larutan dengan konsentrasi 100 μg/mL (LIB II). Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 57.
3.6.2.3 Pembuatan Larutan Standar Teofilin
Larutan standar dibuat dalam 5 labu tentukur 10 mL yang memiliki konsentrasi masing-masing 4 μg/mL, 6 μg/mL, 8 μg/mL, 10 μg/mL, dan 12
μg/mL, dengan cara mengencerkan sebanyak 0,4 mL; 0,6 mL; 0,8 mL; 1,0 mL; dan 1,2 mL secara berurutan dari LIB II teofilin menggunakan pelarut HCl 0,1 N. Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 58.
3.6.2.4 Pembuatan Larutan Standar Efedrin HCl
Diambil sebanyak 0,2 mL; 0,3 mL; 0,4 mL; 0,5 mL; dan 0,6 mL dari LIB II efedrin HCl. Kemudian masing-masing dimasukkan ke dalam 5 labu tentukur 10 mL. Dilarutkan dengan pelarut HCl 0,1 N. Kemudian dicukupkan dengan pelarut yang sama untuk membuat larutan standar dengan konsentrasi 2 μg/mL; 3 µg/ml, 4 μg/mL; 5 µg/ml; dan 6 μg/mL. Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 59.
3.6.3 Pembuatan Spektrum Serapan Maksimum
3.6.3.1 Pembuatan Spektrum Serapan Maksimum Teofilin
200-400 nm. Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 56.
3.6.3.2 Pembuatan Spektrum Serapan Maksimum Efedrin HCl
Diambil sebanyak 0,5 mL dari LIB II efedrin HCl (konsentrasi = 100
μg/mL) kemudian dimasukan ke dalam labu tentukur 10 mL untuk diencerkan dengan pelarut HCl 0,1 N hingga garis tanda, lalu dikocok sampai homogen untuk memperoleh larutan dengan konsentrasi 5 μg/mL. Diukur serapannya pada panjang gelombang 200-400 nm. Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 57.
3.6.4 Pembuatan Spektrum Serapan Derivatif
3.6.4.1 Pembuatan Spektrum Serapan Derivatif Teofilin
Dibuat spektrum serapan (tanpa diderivatkan) dari larutan standar teofilin dengan konsentrasi 4 μg/mL, 6 μg/mL, 8 μg/mL, 10 μg/mL, dan 12 μg/mL pada panjang gelombang 200-400 nm. Kemudian spektrum ditransformasikan menjadi spektrum serapan derivat pertama dan kedua dengan Δλ = 2 nm. Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 58.
3.6.4.2 Pembuatan Spektrum Serapan Derivatif Efedrin HCL
Dibuat spektrum serapan (tanpa diderivatkan) dari larutan standar Efedrin HCL dengan konsentrasi 2 μg/mL; 3 μg/mL; 4 μg/mL; 5 μg/mL; dan 6 μg/mL pada panjang gelombang 200 – 400 nm. Kemudian spektrum ditransformasikan menjadi spektrum serapan derivat pertama dan kedua dengan Δλ = 2 nm. Bagan alir prosedur penelitian dapat dilihat pada Lampiran 5 halaman 59.
Penentuan zero crossing diperoleh dengan menumpangtindihkan spektrum serapan masing-masing derivat dalam berbagai konsentrasi larutan. Zero crossing masing-masing zat ditunjukkan oleh panjang gelombang yang memiliki serapan nol pada berbagai konsentrasi.
3.6.6 Penentuan Panjang Gelombang Analisis
Dibuat larutan teofilin dengan konsentrasi 8 μg/mL, larutan efedrin HCl dengan konsentrasi 4 μg/mL, dan larutan campuran teofilin 8 μg/mL dan efedrin HCl 4 μg/mL. Kemudian ketiga larutan ini diukur serapannya pada panjang gelombang 200 – 400 nm.Selanjutnya ditransformasikan menjadi spektrum serapan derivat pertama dan kedua dari masing-masing zat tunggal dan dari campuran teofilin dan efedrin HCl. Spektrum serapan derivat kedua dari larutan zat tunggal dan campuran keduanya ditumpangtindihkan. Yang dipilih untuk menjadi panjang gelombang analisis adalah yang pada panjang gelombang tertentu, serapan tunggal salah satu senyawa nol sedangkan serapan tunggal senyawa pasangannya dan campuran keduanya hampir sama atau persis sama. Karena pada panjang gelombang tersebut dapat secara selektif mengukur serapan salah satu senyawa tanpa diganggu oleh serapan senyawa pasangannya.
3.6.7 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi
3.6.7.1 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi Teofilin
Dibuat larutan standar teofilin dengan konsentrasi 4 μg/mL; 6 μg/mL; 8
gelombang analisis, dilakukan pula perhitungan limit deteksi / limit of detection (LOD) dan limit kuantitasi / limit of quantitation (LOQ).Untuk menentukan batas
deteksi (LOD) dan batas kuantitasi (LOQ) dapat digunakan rumus :
Keterangan : SB = Simpangan baku LOD = Limit of Detection
LOQ = Limit of Quantitation
3.6.7.2 Pembuatan dan Penentuan Linearitas Kurva Kalibrasi Efedrin HCl
Dibuat larutan standar Efedrin HCl dengan konsentrasi 2 μg/mL; 3 μg/mL; 4 μg/mL; 5 μg/mL dan 6 μg/mL, kemudian diukur serapan derivat kedua (Δλ = 2 nm) pada panjang gelombang analisis yang telah ditentukan. Kemudian dilakukan analisis hubungan antara konsentrasi dan nilai serapan sehingga diperoleh persamaan regresi linear y = ax + b.Dan berdasarkan nilai serapan pada panjang gelombang analisis, dilakukan perhitungan limit deteksi / limit of detection (LOD) dan limit kuantitasi / limit of quantitation (LOQ). Perhitungan untuk menentukan LOD dan LOQ seperti rumus sebelumnya.
3.6.8 Penentuan Kadar Teofilin dan Efedrin HCl dalam Sediaan Tablet
dihitung kesetaraan efedrin HCl yang terkandung di dalamnya (penimbangan serbuk dilakukan sebanyak 6 kali pengulangan). Selanjutnya dimasukkan ke dalam labu tentukur 50 mL, dan dilarutkan dengan HCl 0,1 N (dengan sonikator selama 15 menit), kemudian dicukupkan dengan HCl 0,1 N sampai garis tanda, dikocok sampai homogen. Larutan tersebut kemudian disaring, lebih kurang 10 mL filtrat pertama dibuang. Filtrat selanjutnya ditampung. Kemudian dari filtrat ini dipipet sebanyak 0,08 mL, ditambahkan 0,44 mL larutan efedrin HCl (untuk adisi), dimasukkan ke dalam labu tentukur 10 mL, dicukupkan dengan HCl 0,1 N sampai garis tanda sehingga diperoleh larutan yang didalamnya terdapat teofilin konsentrasi 8 μg/mL dan efedrin HCl konsentrasi 4 μg/mL. Diukur serapan pada panjang gelombang 200−400 nm, selanjutnya spektrum serapan ditransformasikan menjadi spektrum serapan derivat kedua dengan Δλ 2 nm pada panjang gelombang analisis teofilin dan efedrin HCl masing-masing 244,2 nm dan 213,8 nm. Bagan alir prosedur penelitian penentuan kadar teofilin dan efedrin HCl dapat dilihat pada lampiran 5 halaman 60.
3.6.9 Analisis Data Penetapan Kadar Secara Statistik
Data perhitungan kadar teofilin dan efedrin HCl dianalisis secara statistik dengan menggunakan uji T.Tabel distribusi t dapat dilihat pada Lampiran 27 halaman 110.
Rumus yang digunakan adalah :
SD =
( )
1 -nX
-Xi 2
∑
t hitung = SD n
X Xi
/
−
Data diterima jika -ttabel < thitung < ttabel pada interval kepercayaan 99%
dengan nilai α = 0,001. Keterangan :
SD = standard deviation / simpangan baku Xi = kadar dalam satu perlakuan
−
X = Kadar rata-rata dalam satu sampel (mg/100g) n = jumlah pengulangan
α = tingkat kepercayaan
Untuk menghitung kadar teofilin dan efedrin HCl sebenarnya dalam sampel secara statistik, menurut Sudjana (2005) dapat digunakan rumus:
µ = X ± (t(α/2, dk) x SD / √n )
Keterangan : SD = standard deviation / simpangan baku
−
X = Kadar rata-rata dalam satu sampel n = jumlah pengulangan
t = harga ttabel sesuai dengan derajat kepercayaan
3.6.10 Uji Validasi
3.6.10.1 Uji Akurasi
Kemudian campuran sampel dan baku diukur serapannya pada panjang gelombang 200 – 400 nm, selanjutnya spektrum serapan ditransformasikan
menjadi spektrum serapan derivat kedua dengan Δλ 2 nm pada panjang gelombang analisis teofilin dan efedrin HCl masing-masing 244,2 nm dan 213,8 nm. Persen perolehan kembali dapat dihitung dengan rumus:
% perolehan kembali =
100 %
Keterangan:
CF = Konsentrasi sampel setelah penambahan bahan baku
CA = Konsentrasi sampel sebelum penambahan bahan baku
C*A = Jumlah baku yang ditambahkan
3.6.10.2 Uji Presisi
Presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan (Harmita, 2004). Simpangan baku relatif dapat dihitung dengan rumus berikut ini :
RSD =
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penentuan Spektrum Serapan Maksimum
Penentuan spektrum serapan maksimum dilakukan pada panjang gelombang 200–400 nm. Pengukuran teofilin pada konsentrasi 8 μg/mL,
sedangkan untuk efedrin HCl pada konsentrasi 5 μg/mL. Berdasarkan hasil
penelitian, diperoleh panjang gelombang maksimum teofilin pada 272,40 nm dan efedrin HCl pada 206,80 nm. Spektrum serapan maksimum teofilin konsentrasi 8
[image:74.596.133.515.360.528.2]μg/mL dan efedrin HCl konsentrasi 5 μg/mL masing-masing dapat dilihat pada Gambar 4.1 dan 4.2.
nm .
200.00 250.00 300.00 350.00 400.00
Ab
s.
1.50000
1.00000
0.50000
nm .
200.00 250.00 300.00 350.00 400.00
Ab
s.
1.50000
1.00000
0.50000
nm .
200.00 250.00 300.00 350.00 400.00
Ab
s.
1.50000
1.00000
0.50000
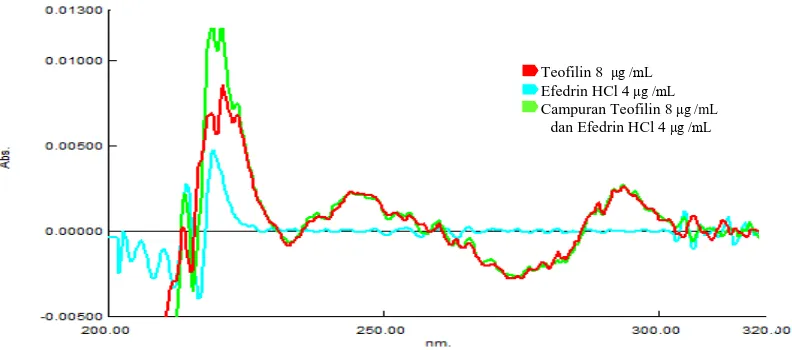
Dari gambar 4.6 dapat dilihat bahwa hasil tumpang tindih serapan teofilin 8 µg/mL dan efedrin HCl 4 µg/mL terdapat serapan yang berimpit. Maka dilakukan derivatisasi untuk memperoleh zero crossing terhadap masing-masing komponen.
4.3 Penentuan Zero crossing pada Serapan Derivat
4.3.1 Penentuan Zero crossing pada Serapan Derivat Pertama
Spektrum serapan teofilin konsentrasi 8 µg/mL dan efedrin HCl konsentrasi 4 µg/mL ditransformasikan menjadi spektrum serapan derivat pertama dengan Δλ = 2 nm. Hasil penentuan zero crossing pada derivat pertama diperoleh dengan menumpangtindihkan spektrum serapan derivat pertama pada masing zat. Zero crossing pada spektrum derivat pertama dari masing-masing zat ditunjukkan oleh panjang gelombang yang memiliki serapan nol. Spektrum teofilin dan efedrin HCl pada spektrum serapan derivat pertama masing-masing dapat dilihat pada gambar 4.7 dan 4.8. Spektrum tumpang tindih serapan teofilin dan efedrin HCl dapat dilihat pada gambar 4.9.
nm.
200.00 250.00 300.00 350.00 400.00
A
bs.
0.10000
0.05000
0.00000
-0.05000
nm.
200.00 250.00 300.00 350.00 400.00
A
b
s.
0.01000
0.00000
-0.01000
konsentrasi 8 µg/ml dan larutan efedrin HCl dengan konsentrasi 4 µg/ml pada panjang gelombang 200-400 nm. Spektrum serapan yang telah diperoleh ditransformasikan menjadi spektrum serapan derivat kedua dengan ∆λ 2 nm. Spektrum serapan derivat kedua dari masing-masing zat tersebut ditumpangtindihkan. Spektrum teofilin dan efedrin HCl pada serapan derivat kedua dapat dilihat pada gambar 4.10 dan 4.11. Spektrum tumpang tindih teofilin dan efedrin HCl pada serapan derivat kedua pada Gambar 4.12.
nm.
200.00 250.00 300.00 350.00 400.00
A
b
s.
0.01000
0.00000
-0.01000
-0.02000
nm.
200.00 250.00 300.00 320.00
A
b
s.
0.01000
0.00000
-0.01000
-0.02000
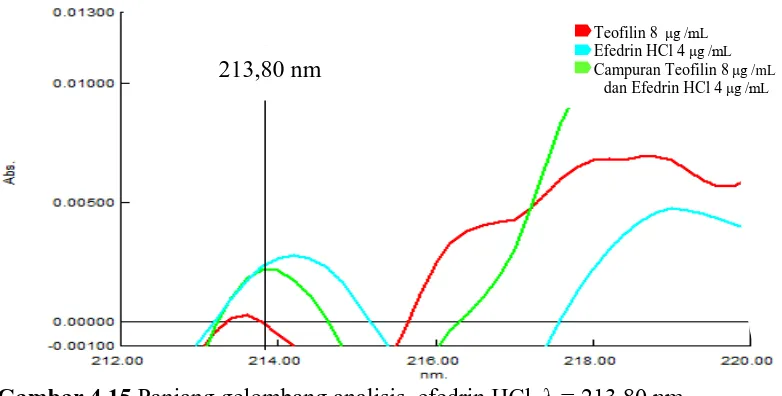
menentukan panjang gelombang analisis pada spektrum serapan pada masing-masing derivat dilakukan dengan mengamati panjang gelombang yang menunjukkan serapan senyawa pasangannya nol dan serapan senyawa lain dan campurannya memiliki nilai serapan sama atau hampir sama. Spektrum tumpang tindih serapan teofilin 8 μg/mL, efedrin HCl 4 μg/mL dan campuran teofilin 8
[image:81.596.117.513.311.486.2]μg/mL dan efedrin HCl 4 μg/mL pada spektrum serapan derivat kedua dapat dilihat pada Gambar 4.14. Spektrum panjang gelombang analisis teofilin dan efedrin HCl dapat dilihat pada Gambar 4.14 dan 4.15.
Gambar 4.13 Spektrum tumpang tindih serapan derivat kedua teofilin, efedrin
HCl dan campuran teofilin dan efedrin HCl
Gambar 4.14 Panjang gelombang analisis teofilin λ 244,20
244,20 nm Teofilin 8 μg /mL Efedrin HCl 4μg /mL
Campuran Teofilin 8μg /mL
dan Efedrin HCl 4μg /mL Teofilin 8 μg /mL
Efedrin HCl 4μg /mL Campuran Teofilin 8μg /mL
[image:81.596.116.518.524.718.2]Gambar 4.15 Panjang gelombang analisis efedrin HCl λ = 213,80 nm
Berdasarkan Gambar 4.13, diperoleh panjang gelombang yang dapat dipakai untuk penentuan kandungan campuran teofilin dan efedrin HCl adalah pada serapan derivat kedua. Hal tersebut diketahui berdasarkan pemilihan panjang gelombang analisis pada setiap derivat. Panjang gelombang analisis didapatkan dengan menentukan zero crossing untuk teofilin dan efedrin HCl.
Panjang gelombang analisis ditentukan dengan cara menumpangtindihkan spektrum serapan masing-masing derivat dari teofilin, efedrin HCl dan campuran teofilin dan efedrin HCl. Selanjutnya ditentukan panjang gelombang dimana absorbansi salah satu zat berada pada nilai nol, sedangkan zat lain memiliki nilai serapan hampir sama. Pada serapan derivat pertama, panjang gelombang analisis untuk efedrin HCl dapat ditemukan. Namun panjang gelombang analisis untuk teofilin tidak ditemukan, sehingga penetapan kadar campuran teofilin dan efedrin HCl pada sediaan tablet tidak bisa dilakukan pada derivat pertama. Oleh karena itu dibuat spektrum serapan derivat kedua, kemudian dilakukan penentuan panjang gelombang analisis dengan cara yang sama seperti pada derivat pertama.
213,80 nm
Teofilin 8 μg /mL
Efedrin HCl 4μg /mL
Campuran Teofilin 8μg /mL
Berdasarkan hasil spektrum serapan derivat kedua, diketahui bahwa zero crossing untuk teofilin berada pada panjang gelombang 213,80 nm; 305,20 nm
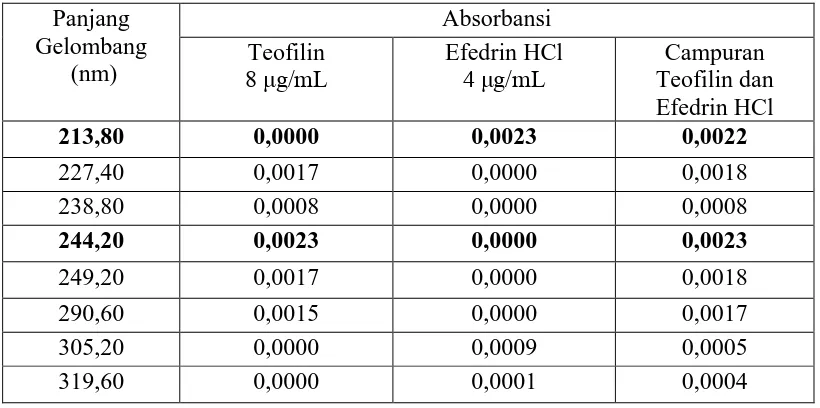
[image:83.596.108.518.332.536.2]dan 319,60 nm dan efedrin HCl pada panjang gelombang 227,40 nm; 238,80 nm; 244,20 nm; 249,00 nm; 252,20 nm; 288,00 nm dan 290,60 nm. Setelah spektrum serapan derivat kedua dari kedua zat dan campuran ditumpangtindihkan, didapatkan panjang gelombang analisis untuk teofilin pada 244,20 nm dan efedrin HCl pada 213,80 nm. Panjang gelombang analisis dan absorbansi pada derivat kedua dapat dilihat pada Tabel 4.1.
Tabel 4.1 Panjang Gelombang Analisis dan Absorbansi pada Derivat Kedua
Panjang Gelombang
(nm)
Absorbansi Teofilin
8 μg/mL Efedrin HCl 4 μg/mL Teofilin dan Campuran Efedrin HCl
213,80 0,0000 0,0023 0,0022
227,40 0,0017 0,0000 0,0018
238,80 0,0008 0,0000 0,0008
244,20 0,0023 0,0000 0,0023
249,20 0,0017 0,0000 0,0018
290,60 0,0015 0,0000 0,0017
305,20 0,0000 0,0009 0,0005
319,60 0,0000 0,0001 0,0004
Berdasarkan Tabel 4.1 diperoleh panjang gelombang analisis teofilin dan efedrin HCl yang digunakan masing-masing adalah 244,20 nm dan 213,80 nm. Penentuan panjang gelombang analisis didasarkan pada nilai absorbansi ketiga larutan pada panjang gelombang tersebut.
panjang gelombang analisisnya adalah pada 244,20 nm. Panjang gelombang analisis efedrin HCl yang dipakai adalah 213,80 nm karena pada panjang gelombang tersebut, nilai absorbansi dari teofilin adalah nol, sedangkan untuk efedrin HCl dan larutan campuran teofilin dan efedrin HCl memiliki nilai serapan hampir sama yaitu 0,0023 untuk efedrin HCl dan 0,0022 untuk campuran. Spektrum serapan penentuan panjang gelombang analisis teofilin dan efedrin HCl dapat dilihat pada Lampiran 9 halaman 73.
4.5 Hasil Penentuan Linearitas Kurva Kalibrasi
4.5.1 Kurva Kalibrasi
[image:84.596.123.486.558.718.2]Linearitas kurva kalibrasi menunjukkan hubungan yang linier antara absorbansi dengan konsentrasi. Persamaan regresi teofilin, Y = 0,00029X + 0.00001 dengan korelasi r = 0,9999 dan efedrin HCl, Y = 0.00057X + 0,00005 dengan korelasi r = 0,9993. Nilai r > 0,995 menunjukkan adanya korelasi linier antara X dan Y (Moffat, 2005). Kurva kalibrasi teofilin dan efedrin HCl pada masing-masing panjang gelombang 244,20 nm dan 213,80 nm dapat dilihat pada Gambar 26 dan 27. Data kalibrasi, persamaan regresi dan koefisien korelasi dapat dilihat pada Lampiran 10 halaman 74-75 dan Lampiran 11 halaman 76-77.
Gambar 4.16 Kurva kalibrasi teofilin pada panjang gelombang 244,20 nm
0 5 12
Gambar 4.17 Kurva kalibrasi efedrin HCl pada panjang gelombang 213,80 nm
4.5.2 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi dihitung dari persamaan regresi yang diperoleh dari kurva kalibrasi. Batas deteksi teofilin dan efedrin HCl adalah 0,1715 μg/mL dan 0,2658 μg/mL secara berturut-turut dan batas kuantitasi teofilin dan efedrin HCl adalah 0,5718 μg/mL dan 0,8859 μg/mL secara berturut-turut. Perhitungan batas deteksi dan batas kuantitasi tersebut dapat dilihat pada Lampiran 12 halaman 78 dan Lampiran 13 halaman 79.
Hal tersebut menunjukkan bahwa penentuan kadar teofilin dengan
konsentrasi 8 μg/mL danefedrin HCl dengan konsentrasi 4 μg/mL dapat dideteksi
dan diukur menggunakan metode spektrofotometri derivatif.
Batas deteksi adalah konsentrasi analit terendah dalam sampel yang masih dapat dideteksi. Batas kuantitasi didefenisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Rohman, 2007).
4
4.6 Hasil Penentuan Kadar Teofilin dan Efedrin HCl dalam Sediaan Tablet
Penentuan penetapan kadar teofilin dan efedrin HCl dalam tablet yang beredar diapotik mengandung masing-masing teofilin 130 mg dan efedrin HCl 10 mg. Sedangkan pengukuran teofilin dan efedrin HCl baku pada keduasediaan masing-masing teofilin 8 μg/mL dan efedrin HCl 4 μg/mL.
Sampel yang telah dipreparasi kemudian diukur pada panjang gelombang 200 – 400 nm. Selanjutnya spektrum hasil serapan ditransformasikan menjadi
spektrum serapan derivat kedua dengan Δλ = 2 nm. Berdasarkan spektrum tersebut dapat ditentukan absorbansi teofilin dan efedrin HCl pada panjang gelombang analisis yang telah diperoleh sebelumnya, yaitu panjang gelombang 244,20 nm dan 213,80 nm.
Absorbansi efedrin HCl dalam sampel yang dianalisis didapat nilai negatif, serapan ini disebut sebagai serapan background. Absorbansi efedrin HCl pada sampel berbeda dengan absorbansi efedrin HCl baku, dimana absorbansi efedrin HCl baku yang diukur memiliki nilai positif. Hal tersebut kemungkinan disebabkan karena:
(i) Tidak terdapat kandungan efedrin HCl dalam tablet yang diuji.
(ii) Terdapatnya gangguan matriks dengan konsentrasi lebih besar sehingga menutupi
spektrum absorbansi efedrin HCl dalam sampel.
(iii) Gangguan dari matriks ini mungkin juga bereaksi dengan sebagian efedrin HCl
dalam proses kesetimbangan membentuk senyawa lain sehingga terbentuk molekul
yang lebih besar. Molekul yang lebih besar mengarahkan kepada efek batokromik
yaitu pada peningkatan panjang gelombang senyawa ke arah yang lebih besar.
sehingga pengukuran jumlah zat pada panjang gelombang awal tidak bisa
dilakukan.
Absorbansi teofilin dan efedrin HCl sebelum penambahan baku efedrin HCl dapat dilihat pada Tabel 4.2. Spektrum tumpang tindih teofilin konsentrasi 8
[image:87.596.114.511.291.521.2]μg/ml dan efedrin HCl 4 μg/ml pada tablet sebelum penambahan baku dapat dilihat pada Gambar 4.18 dan Gambar 4.19.
Tabel 4.2 Absorbansi teofilin dan efedrin HCl sebelum penambahan baku efedrin
HCl pada derivat kedua
Sampel Absorbansi Teofilin pada λ 244,20 nm
Absorbansi Efedrin HCl sebelum penambahan baku
pada λ 213,80 nm
Grafasma® 0,00232 -0,00013
Ifasma® 0,00234 -0,00017
nm .
200.00 210.00 220.00 230.00 240.00 250.00
Ab
s.
0.01500
0.01000
0.00500
0.00000
-0.00500
Menurut Nurhidayati (2007), kontribusi gangguan serapan background, yang dapat digambarkan sebagai polynomial derivatif kedua dan ketiga hilang pada derivatif keempat. Pada prakteknya, matriks pengganggu tidak selalu bisa dihilangkan dengan menaikkan orde. Pada kondisi tertentu metode standar adisi perlu digunakan untuk mengkompensasikan pengaruh matriks, oleh karena itu penetapan kadar efedrin HCl dalam sampel dilanjutkan dengan teknik adisi yaitu penambahan sejumlah baku ke dalam sampel dan diukur secara spektrofotometri derivatif ultraviolet pada panjang gelombang analisisnya.
Prinsip adisivitas menurut hukum Lambert-Beer adalah absorbansi sebanding dengan jumlah molekul yang menyerap radiasi pada panjang gelombang tertentu. Prinsip ini berlaku jika ada lebih dari satu senyawa yang dapat menyerap radiasi. Semua metode kuantitatif multikomponen didasarkan pada prinsip bahwa absorbansi pada setiap panjang gelombang campuran adalah sama dengan jumlah absorbansi dari masing-masing komponen dalam campuran pada panjang gelombangnya (Owen, 1995).
Tabel 4.3 Absorbansi teofilin dan efedrin HCl setelah penambahan baku efedrin
HCl pada derivat kedua
Sampel Absorbansi Teofilin
pada λ 244,20 nm
Absorbansi Efedrin HCl setelah penambahan baku
pada λ 213,80 nm
Grafasma® 0,00232 0,00222
Ifasma® 0,00234 0,00228
nm .
200.00 210.00 220.00 230.00 240.00 250.00
Ab
s.
0.01500
0.01000
0.00500
0.00000
-0.00500
HCl pada sediaan dengan nama dagang Grafasma® dan Ifasma® setelah dilakukan analisa secara statistik (data dan perhitungan pada Lampiran 14 – Lampiran 20) dapat dilihat pada Tabel 4.4.
Tabel 4.4 Kadar teofilin dan efedrin HCl dalam tablet
No Kadar Grafasma® Ifasma® Persyaratan
1. Teofilin (%) 99,89 ± 1,67 99,35 ± 2,74 94,00-106,00 2. Efedrin HCl (%) 98,88± 3,21 96,59 ± 2,32 92,50-107,50
Dapat dilihat pada Tabel 4.4 kadar teofilin dan efedrin HCl dalam tablet Grafasma® dan Ifasma® memenuhi persyaratan.
4.7 Hasil Uji Validasi
3.7.1 Hasil Uji Akurasi
Uji akurasi dengan parameter persen perolehan kembali dilakukan dengan menggunakan tablet Grafasma®. Metode penambahan baku dilakukan dengan menambahkan sejumlah tertentu larutan baku ke dalam sampel yang telah diadisi. Kemudian larutan diukur serapannya sesuai panjang gelombang analisis yang digunakan. Spektrum serapan uji perolehan kembali teofilin dan efedrin HCl dalam tablet Grafasma® dapat dilihat pada Lampiran 21 halaman 98-100. Sedangkan data dan perhitungan uji perolehan kembali teofilin dan efedrin HCl dalam tablet dapat dilihat pada Lampiran 22 halaman 101 dan Lampiran 23 halaman 102.
prosedur analitik karena rata-rata berada di antara rentang 98-102% (Harmita, 2004).
Tabel 4.5 Hasil perolehan kembali teofilin dan efedrin HCl dengan metode
penambahan baku standar (standard addition method) pada tablet Grafasma® Rentang Spesifik % Perolehan kembali Teofilin (%) Perolehan kembali Efedrin HCl (%) 80
100,55 99,46
99,26 99,96
101,33 98,45
100
98,49 99,51
99,93 99,11
98,90 101,37
120
100,90 100,25
99,86 100,82
98,32 101,70
Rata-rata (% recovery)
Standard Deviation (SD) Relative Standard Deviation (RSD) (%)
99,67 1,07 1,07 100,07 1,07 1,07
3.7.2 Hasil Uji Presisi
[image:91.596.114.512.190.432.2]BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang dilakukan, maka dapat disimpulkan:
a. Metode spektrofotometri derivatif dengan zero crossing dapat digunakan untuk menetapkan kadar campuran teofilin dan efedrin HCl, dimana diperlukan metode tambahan untuk menetapkan kadar efedrin HCl menggunakan teknik adisi.
b. Kadar teofilin pada tablet Grafasma® dan Ifasma® memenuhi persyaratan pada USP 30-NF 25 (2007) dan efedrin HCl pada tablet Grafasma® dan Ifasma® memenuhi persyaratan Farmakope Indonesia edisi V (2014).
c. Uji validasi yang dilakukan pada tablet Grafasma® menunjukkan bahwa metode spektrofotometri derivatif memenuhi persyaratan validasi.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Bahan
2.1.1 Teofilin
Menurut Ditjen BKAK (2014): Rumus struktur :
O
CH3
N
NH
O
N
N
CH3
Gambar 2.1 Struktur Teofilin
Nama Kimia : 1,3-dimethyl-1H-purine-2,6-dione Rumus Molekul : C7H8N4O2
Berat Molekul : 180,17
Pemerian : Serbuk hablur, putih, tidak berbau, rasa pahit, stabil di udara Kelarutan : Sukar larut dalam air, tetapi lebih mudah larut dalam air panas,
mudah larut dalam larutan alkali hidroksida dan dalam amonium hidroksida, agak sukar larut dalam etanol, dalam kloroform dan dalam eter.
Teofilin mempunyai efek samping berupa mual dan muntah, baik pada penggunaan oral maupun parenteral. Pada overdose terjadi efek sentral (gelisah, sukar tidur, tremor dan konvulsi) serta gangguan pernafasan, juga efek kardiovaskuler, seperti tachycardia, aritmia dan hipotensi (Tan dan Rahardja, 2007).
2.1.2 Efedrin Hidroklorida
Menurut Ditjen BKAK (2014): Rumus Struktur :
H OH
NH
CH3
.
HClH CH3
Gambar 2.2 Struktur Efedrin Hidroklorida
Nama Kimia : (1R,2S)-2-(methylamino)-1-phenylpropan-1-ol hydrochloride Rumus Molekul : C10H15NO.HCl
Berat Molekul : 201,70
Pemerian : Serbuk atau hablur halus, putih, tidak berbau.
Kelarutan : Mudah larut dalam air, larut dalam etanol, tidak larut dalam eter.
Efek samping dari efedrin HCl yaitu pada orang yang peka terhadap efedrin HCl, dalam dosis rendah sudah dapat menimbulkan gelisah, tremor, dan gangguan berkemih. Sedangkan pada efek sentral yaitu insomnia yang sering terjadi pengobatan kronik dan palpitasi. Saat ini, sangat banyak beredar produk obat yang mengandung kombinasi dua atau lebih bahan aktif. Kombinasi dimaksudkan agar obat dapat lebih efektif mencapai sasaran terapi. Salah satunya adalah kombinasi antara teofilin dan efedrin HCl, yang digunakan untuk meringankan gejala gangguan saluran pernapasan seperti asma bronkial, kejang bronkus dan alergi (Tan dan Rahardja, 2007).
2.2. Spektofotometri
Spektrofotometer adalah alat untuk mengukur transmitan atau serapan suatu sampel sebagai fungsi panjang gelombang. Spektrofotometer merupakan penggabungan dari dua fungsi alat yang terdiri dari spektrometer yang menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer sebagai alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi. Jika suatu molekul sederhana dikenakan radiasi elektromagnetik maka molekul tersebut akan menyerap radiasi elektromagnetik. Interaksi antara molekul dengan radiasi elektromagnetik ini akan meningkatkan energi dari tingkat dasar ke tingkat tereksitasi (Rohman, 2007).
Bagian molekul yang bertanggung jawab terhadap penyerapan cahaya disebut kromofor dan terdiri atas ikatan rangkap dua atau rangkap tiga, terutama jika ikatan rangkap tersebut terkonjugasi. Semakin panjang ikatan rangkap dua atau rangkap tiga terkonjugasi di dalam molekul, molekul tersebut akan lebih mudah menyerap cahaya (Cairns, 2008).
Gugus fungsi seperti –OH, -O, -NH2 dan –OCH3 yang memberikan transisi n → π* disebut gugus auksokrom. Gugus ini adalah gugus yang tidak dapat menyerap radiasi ultraviolet-sinar tampak, tetapi apabila gugus ini terikat pada gugus kromofor mengakibatkan pergeseran panjang gelombang ke arah yang lebih besar atau pergeseran batokromik (Rohman, 2007). Efek hipsokromik atau pergeseran biru adalah pergeseran panjang gelombang kearah yang lebih pendek. Efek hipokromik adalah efek yang menyebabkan penurunan intensitas serapan (Sudjadi dan Rohman, 1985).
Radiasi ultraviolet diabsorpsi oleh molekul organik aromatik, molekul yang mengandung elektron-π terkonjugasi atau atom yang mengandung elektron -n, menyebabkan transisi elektron di orbit terluarnya dari tingkat energi elektron dasar ke tingkat energi tereksitasi lebih tinggi. Besarnya absorbansi radiasi tersebut berbanding dengan banyaknya molekul analit yang mengabsorpsi dan dapat digunakan untuk analisis kuantitatif (Satiadarma, dkk., 2004).
2.2.1. Hukum Lambert-Beer
Lambert-Beer, sehingga diperoleh bahwa serapan berbanding lurus terhadap konsentrasi dan ketebalan sel, hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan (Rohman, 2007).
Hukum Lambert-Beer umumnya dikenal dengan persamaan sebagai berikut:
A = abc
Dimana: A = absorbansi a = absorptivitas b = tebal kuvet (cm) c = konsentrasi
Absorptivitas (a) merupakan suatu konstanta yang tidak tergantung pada konsentrasi, tebal kuvet dan intensitas radiasi yang mengenai larutan sampel. Absorptivitas tergantung pada suhu, pelarut, struktur molekul dan panjang gelombang radiasi (Rohman, 2007).
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,6. Anjuran ini berdasarkan anggapan bahwa pada kisaran nilai absorbansi tersebut kesalahan fotometrik yang terjadi adalah paling minimal (Rohman, 2007).
2.2.2. Kegunaan Spektofotometri
dilakukan (Satiadarma, dkk., 2004). Akan tetapi, jika digabung dengan cara lain seperti spektroskopi inframerah, resonansi magnet inti dan spektroskopi massa, maka dapat digunakan untuk identifikasi atau analisis kualitatif senyawa tersebut (Rohman, 2007).
Metode spektrofotometri memiliki beberapa keuntungan antara lain kepekaan yang tinggi, ketelitian yang baik, mudah dilakukan, cepat pengerjaannya dan dapat digunakan untuk menentukan senyawa campuran (Munson, 1991).
Pada analisis kuantitatif dengan cara penetapan kadar, larutan standar obat yang akan dianalisis disiapkan, serapan sampel dan standar dapat ditentukan (Cairns, 2008), dimana konsentrasi zat dalam sampel dihitung dengan rumus sebagai berikut:
Ct
Cs
At
As
=
Keterangan: As = Absorbansi baku pembanding At = Absorbansi zat dalam sampel Cs = Konsentrasi baku pembanding Ct = Konsentrasi zat dalam sampel
Penentuan kadar senyawa organik yang mempunyai struktur kromofor atau mengandung gugus kromofor, serta mengabsorpsi radiasi ultraviolet penggunaanya cukup luas (Satiadarma, dkk., 2004).
2.3. Spektrofotometri Derivatif
dengan panjang gelombang, derivat kedua dibuat dengan memplotkan d2A / dλ2 dengan panjang gelombang dan seterusnya (Ditjen POM, 1995).
Konsep derivatif telah diperkenalkan pertama kali pada tahun 1950, dimana terlihat memberikan banyak keuntungan. Aplikasi utama spektrofotometri derivatif ultraviolet – visibel adalah untuk identifikasi kualitatif dan analisis sen