UJI EFEKTIFITAS CHITOSAN UNTUK MENGENDALIKAN
PENYAKIT JAMUR UPAS (Upasia salmonicolor (B. et Br.) Tjokr.,)
PADA TANAMAN KARET (Hevea brasiliensis Muell. Arg.)
SKRIPSI
Oleh :
VIVI ENDRIYATI
040302011
HPT
DEPARTEMEN ILMU HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI EFEKTIFITAS CHITOSAN UNTUK MENGENDALIKAN
PENYAKIT JAMUR UPAS (Upasia salmonicolor (B. et Br.) Tjokr.,)
PADA TANAMAN KARET (Hevea brasiliensis Muell. Arg.)
SKRIPSI
Oleh : VIVI ENDRIYATI
040302011 HPT
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana di Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian
Universitas Sumatera Utara Medan
DEPARTEMEN ILMU HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
SkripsiJudul: UJI EFEKTIFITAS CHITOSAN UNTUK
MENGENDALIKAN PENYAKIT JAMUR UPAS
(Upasia salmonicolor (B. et Br.)Tjokr.,) PADA
TANAMAN KARET (Hevea brasiliensis Muell. Arg.)
Nama
: Vivi Endriyati
Nim
: 040302011
Departemen : Hama dan Penyakit Tumbuhan
Disetujui Oleh :
Komisi Pembimbing
(Ir. Mukhtar Iskandar Pinem.M.Agr.) Ketua
(Ir. Kasmal Arifin, MSi.) (Ir. Aidi Daslin Sagala, MS.) Anggota Pembimbing lapangan
ABSTRACT
Vivi Endriyati “ Chitosan Effectiveness Test to Conteol the Upas fungus (Upasia salmonicolor (B. et Br.) Tjokr,.) on Rubber Tree ( Hevea brasiliensis Muell. Arg) “under the supervision of conceling team Ir. Mukhtar Iskandar Pinem, M.Agr, as a chairman, Ir. Kasmal Arifin, MSi, as
ABSTRAK
Vivi Endriyati “ Uji Efektifitas Chitosan Untuk Mengendalikan Penyakit JamurUpas
( Upasia salmonicolor (B. et Br.) Tjokr,.) Pada Tanaman Karet ( Hevea brasiliensis Muell. Arg.) “ dengan komisi pembimbing Bapak Ir. Mukhtar Iskandar Pinem M. Agr, selaku ketua, Bapak Ir. Kasmal Arifin MSi,
RIWAYAT HIDUP
“ Vivi Endriyati ” dilahirkan di Banyumas pada tanggal 1 januari 1986 dari Ayahanda Zuhardi dan Bunda Sri Murdiati, Penulis merupakan putri pertama dari 3 (tiga) bersaudara.
Pendidikan yang pernah di tempuh penulis adalah tahun 1998 lulus dari SD 1 Takengon Aceh Tengah, tahun 2001 lulus dari SMP 1 Takengon Aceh Tengah, tahun 2004 lulus dari SMU 1 Bebesen Aceh Tengah, dan tahun 2004 diterima sebagai mahasiswa di Departemen Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Sumatera Utara Medan melalui jalur SPMB.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT, karena atas berkat dan rahmat-Nya lah penulis dapat menyelesaikan skripsi ini dengan sebaik-baiknya.
Adapun judul dari skripsi ini adalah “ UJI EFEKTIFITAS CHITOSAN UNTUK MENGENDALIKAN PENYAKIT JAMUR UPAS ( Upasia salmonicolor (B. et Br.) Tjokr,.) PADA TANAMAN KARET ( Hevea brasiliensis Muell. Arg.) “ yang disusun sebagai salah satu syarat untuk dapat
memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis tidak lupa mengucapkan terimakasih kepada Bapak Ir. Mukhtar Iskandar Pinem M. Agr, selaku ketua komisi pembimbing, Bapak Ir. Kasmal Arifin, MSi, selaku anggota komisi pembimbing dan Bapak Ir. Aidi Daslin Sagala, MS, selaku pembimbing lapangan yang telah banyak memberikan saran dan arahan sehingga penulis dapat menyusun skripsi ini dengan baik.
Penulis menyadari bahwa skripsi ini belum sempurna, untuk itu penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skipsi ini dan semoga skripsi ini bermanfaat bagi pihak-pihak yang membutuhkan.
Akhir kata penulis mengucapkan terima kasih .
DAFTAR ISI 1.Biologi Penyebab Penyakit ... 5
1.1 Biologi ... 5 1.Tempat dan Waktu Penelitian ... 15
2.Bahan dan Alat ... 15
3.Metode Penelitian... 15
4.Pelaksanaan Penelitian ... 16
4.1 Persiapan Chitosan ... 16
4.2 Isolat Jamur Upas ... 18
4.3 Medium PDA yang Terdapat Senyawa Alami Chitosan... …... 19
4.4 Pelaksanaan inokulasi ... 19
5.Parameter Pengamatan ... 19
5.1 Luas Pertumbuhan Koloni U. salmonicolor... 19
5.2 Perhitungan kerapatan konidia jamur... 21
IV.HASIL DAN PEMBAHASAN 1.Luas Pertumbuhan Koloni U. salmonicolor... 22
2.Perhitungan kerapatan konidia jamur... 26
2.Saran... 30 DAFTAR PUSTAKA ... 31
DAFTAR TABEL
No. Judul Halaman
1. Uji beda rataan luas pertumbuhan koloni jamur U. salmonicolor... . 22
2. Uji beda rataan jumlah konidia jamur U. salmonicolor ... 26
3. Data luas pertumbuhan koloni jamur U. Salmonicolor... 36
4. Data luas pertumbuhan jamur U. salmonicolor 2 HSI ... 37
5. Data luas pertumbuhan jamur U. salmonicolor 4 HSI ... 39
6. Data luas pertumbuhan jamur U. salmonicolor 6 HSI ... 41
7. Data Perhitungan kerapatan konidia jamur U. Salmonicolor... 43
DAFTAR GAMBAR
No Judul Halaman
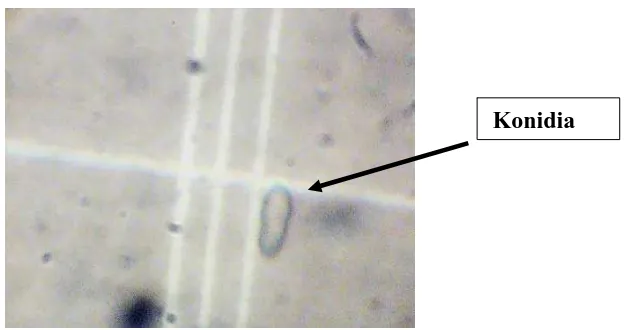
1. Konidia Jamur Upasia salmonicolor... 6
2. Himenium dan pada stadium teleomorf ... 7
3. Sporodokium pada stadium anamorf... 7
4. Batang karet yang telah mati ... 8
5. Gejala serangan jamur upas... 9
6. Bubuk chitosan ... 14
7. Foto pertumbuhan luas koloni jamur pada pengamatan hari 2,4, dan 6.. 20
8. Alat planimeter ... 21
9. Histogram pengaruh luas pertumbuhan koloni jamur ... 25
DAFTAR LAMPIRAN
No Judul Halaman
1. Bagan penelitian di laboratorium ... 33
2. Perhitungan kerapatan konidia jamur dengan alat haemocytometer... 34
3.. Data luas pertumbuhan koloni jamur U. salmonicolor... 36
4. Data pengamatan luas pertumbuhan jamur 2 HSI... 37
5. Data pengamatan pertumbuhan jamur 4 HSI ... 39
6. Data pengamatan pertumbuhan jamur 6 HSI ... 41
7. Data perhitungan kerapatan konidia jamur ... 43
8. Data perhitungan kerapan konidia jamur dengan daftar sidik ragam... 44
ABSTRACT
Vivi Endriyati “ Chitosan Effectiveness Test to Conteol the Upas fungus (Upasia salmonicolor (B. et Br.) Tjokr,.) on Rubber Tree ( Hevea brasiliensis Muell. Arg) “under the supervision of conceling team Ir. Mukhtar Iskandar Pinem, M.Agr, as a chairman, Ir. Kasmal Arifin, MSi, as
ABSTRAK
Vivi Endriyati “ Uji Efektifitas Chitosan Untuk Mengendalikan Penyakit JamurUpas
( Upasia salmonicolor (B. et Br.) Tjokr,.) Pada Tanaman Karet ( Hevea brasiliensis Muell. Arg.) “ dengan komisi pembimbing Bapak Ir. Mukhtar Iskandar Pinem M. Agr, selaku ketua, Bapak Ir. Kasmal Arifin MSi,
PENDAHULUAN
1.Latar Belakang
Karet merupakan salah satu komoditi perkebunan penting, baik sebagai sumber pendapatan, kesempatan kerja dan devisa, pendorong pertumbuhan ekonomi sentra-sentra baru di wilayah sekitar perkebunan karet maupun pelestarian lingkungan dan sumberdaya hayati (Suryana, 2005).
Namun sebagai negara dengan luas areal terbesar dan produksi kedua terbesar dunia, Indonesia masih menghadapi beberapa kendala, yaitu rendahnya produktivitas, terutama karet rakyat yang merupakan mayoritas (91%) areal karet nasional dan ragam produk olahan yang masih terbatas, yang didominasi oleh karet remah (crumb rubber) (Anonimous, 2006). Rendahnya produktivitas kebun karet rakyat disebabkan oleh banyaknya areal tua, rusak dan tidak produktif, penggunaan bibit bukan klon unggul, kondisi kebun yang menyerupai hutan serta penyakit dan hama yang menyerang. Oleh karena itu perlu upaya percepatan peremajaan karet rakyat, penanaman klon unggul disertai kultur tekhnis yang memadai dan penanggulangan hama dan penyakit (Sianturi, 1996).
Di dalam budidaya karet, penyakit jamur upas (Pink disease) terutama merugikan karet muda, yang berumur 3-8 tahun. Jamur juga dapat menyerang tanaman yang lebih tua, tetapi kerugian yang ditimbulkannya tidak berarti. Pada karet muda jamur dapat mematikan batang atau cabang yang menyebabkan tajuk kurang berkembang, sehingga tanaman lambat dapat disadap dan hasilnya pun kurang (Semangun, 2000).
penyakit kurang merugikan. Sedangkan di Cina dan negara-negara penghasil karet di Afrika dan Amerika Selatan jamur upas bukan penyakit yang penting (Allen,1994 dan Semangun,2000).
Pengendalian jamur upas hanya perlu dilakukan pada musim hujan. Diusahakan agar infeksi dapat diketahui sedini mungkin, sehingga jamur dapat dimatikan dengan fungisida yang efektif sebelum batang atau cabang yang terserang mati, dan untuk mencegah agar jamur tidak berspora, perawatannya dengan melumasi atau menyemprotkan fungisida (Semangun, 2000).
Pelumasan dilakukan memakai kuas dengan memanjat pohon, lebih-lebih jika di kebun terdapat serangan yang meluas, fungisida yang baik untuk mengendalikan jamur upas adalah bubur Bordeaux 1 % (1 kg sulfat tembaga, 1.25 kg kapur tohor, 100 liter air), Tridemorf (Calixin 5%) dalam lateks pekat (60% kadar karet kering) (Semangun, 2000).
Untuk mengurangi bahan kimia yang berbahaya yang ada pada fungisida kimia seperti sulfat tembaga, yang berbahaya pada kesehatan maka digunakan pengendalian secara alami dengan menggunakan fungisida alami
(Wilson et al. 1994; Wilson and El Ghaouth, 1993).
al.,1994). Aktifitas antifugal dan merangsang ketahanan dari chitosan menjanjikan kemungkinan yang baik untuk pengendalian penyakit tanaman ( Pamekas, 2007).
Sejauh ini belum ada laporan tentang penggunaan chitosan untuk mengendalikan penyakit jamur upas pada tanaman karet. Hanya ada laporan pada tanaman pasca panen pada tanaman cabai (Pamekas, 2007). Untuk itu, sebuah penelitian untuk mengetahui efektifitas penggunaan chitosan dalam pengendalian penyakit jamur upas pada tanaman karet perlu dilakukan. Diharapkan chitosan mampu mengahambat pertumbuhan dan perkembangan penyakit jamur upas pada batang tanaman karet.
2.Tujuan Penelitian
Untuk mengetahui efektifitas chitosan terhadap penyakit jamur upas (Upasia
salmonicolor (B et Br) Tjokr.,) dan untuk mendapatkan fungisida alami dalam
mengendalikan jamur upas.
3.Hipotesis Penelitian
Penggunaan chitosan yang dicampurkan pada media agar dapat menekan
pertumbuhan jamur upas di laboratorium.
Penggunaan berbagai tingkat konsentrasi chitosan mempengaruhi dalam
menghambat pertumbuhan jamur U. salmonicolor pada tanaman karet. 4.Kegunaan Penelitian
Sebagai bahan informasi bagi peneliti dan pihak yang berkepentingan dalam
mengendalikan jamur upas pada tanaman karet.
Sebagai bahan penelitian skripsi untuk melengkapi persyaratan dalam
II. TINJAUAN PUSTAKA
1.Biologi Penyebab Penyakit 1.1 Biologi
Penyakit jamur upas ( Pink disease ) disebabkan oleh jamur
Upasia salmonicolor (B et Br.) Tjokr., meskipun sampai sekarang masih banyak dikenal
dengan nama Corticium salmonicolor (B. et Br). Oleh Burdsall (1985) jamur juga disebut
Erythricium salmonicolor (B et Br.) Burdsall. (Tjokrosoedarmo,1983 ).
Jamur ini di klasifikasikan sebagai berikut: Kingdom : Fungi
telah mati karena serangan cendawan ini. Bintil-bintil tersebut merupakan tubuh buah cendawan (Riyaldi, 2004).
Pada Stadium teleomorf (III) yang berwarna merah jambu, jamur upas membentuk lapisan himenium yang mengandung banyak basidium berbentuk gada. Basidiospora tidak berwarna, berbentuk buah per (pyriform) dengan ujung runcing, 9-12 x 6-7 μm, sterigma panjang 4-5 μm. Pada bagian cabang yang tidak terlindung, kebanyakan pada sisi atas,
stadium rumah laba-laba (I) akan berkembang menjadi stadium bongkol (IV), yang akhirnya
membentuk sporodokium merah, disebut stadium anamorf (V). Sporodokium tadi membentuk spora yang lain, yaitu konidium (Semangun, 2000). Sporodokium pada stadium
anamorf (V) berwarna merah bata sampai merah tua, 0.5-1.5 mm, menghasilkan konidium
berbentuk jorong tidak teratur, dan ukuranya tidak tertentu (Semangun, 2000).
Stadium anamorf jamur upas ini dahulu dikira jamur lain yang diberi nama tersendiri, yaitu Necator decretus Mass (Semangun, 2000).
Gambar 1. Jamur Upasia Salmonicolor (B.et Br) Tjokr. (Sumber : Foto langsung)
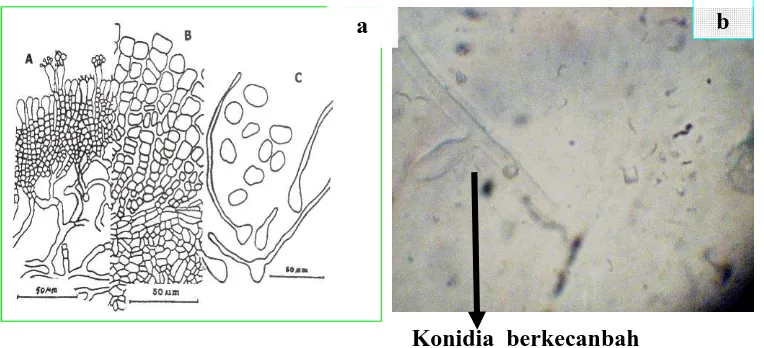
Konidia berkecanbah
Gambar 2.a. (A) Himenium pada stadium teleomorf. (B) Sporodokium pada stadium anamorf. (C) konidia yang berkecambah.
Sumber : a. Tjokrosoedarmo (1983) dalam Semangun (2000)
1.2 Gejala Serangan
Jamur upas timbul pada batang atau cabang yang kulitnya sudah berwarna cokelat, tetapi belum membentuk lapisan gabus yang tebal. Umumnya jamur mulai berkembang dari pangkal cabang atau sisi bawah cabang, karena disini keadaannya lebih lembab ketimbang di bagian lain (Semangun, 2000).
Pada bagian yang terserang mula-mula jamur membentuk miselium tipis seperti perak atau sutera. Stadium ini disebut stadium rumah laba-laba (I): pada waktu ini jamur belum masuk ke dalam kulit. Pada bagian yang terlindung, sebelum masuk ke dalam jaringan, jamur membentuk gumpalan-gumpalan hifa di depan lentisel: stadium ini disebut
stadium bongkol semu (II), setelah itu jamur membentuk kerak merah jambu (pink) atau
berwarna seperti ikan salem (salmon), stadium ini disebut stadium teleomorf (III), kulit dibawah kerak merah jambu sudah membusuk. Pembusukan kulit dan kayu yang meluas sering mengakibatkan kematian. Pada stadium ini jamur membentuk banyak basidium yang menghasilkan basidiospora (Riyaldi, 2004).
A B
Gambar 3. (A) Batang karet yang mati terserang jamur. (B) Batang karet yang terlihat gejala
Sumber : Tjokrosoedarmo (1983) dalam Semangun (2000)
Kulit yang terinfeksi jamur mengeluarkan lateks yang meleleh, yang setelah mengering tampak seperti garis-garis hitam. Ini merupakan salah satu tanda yang mudah terlihat (Semangun, 2000).
Pada tingkat yang lanjut daun-daun pada batang atau cabang yang sakit layu dan mengering. Mata-mata tidur di bawah bagian yang terserang berkembang menjadi tunas (Semangun, 2000).
Gambar 4. (A) Gejala serangan jamur upas,batang yang telah mati, (B) Cabang dan daun yang layu yang terkena jamur upas Sumber : Hohn dan Litsch (1907).
1.3 Perkembangan Penyakit Iklim
Jamur upas dibantu kelembapan tinggi. Kebun yang mempunyai curah hujan tinggi mendapat banyak gangguan penyakit ini. Demikian pula kebun yang lembab karena jarak tanam yang terlalu rapat, terletak di lembah, di dekat rawa atau persawahan, atau yang tanaman penutup tanahnya tidak terpelihara (Semangun, 2000).
Kondisi iklim yang sesuai pada saat terjadinya infeksi sangat menentukan terjadinya epidemik. Kondisi lingkungan dengan kelembaban 96%-100% atau adanya titik air, suhu 28-30º C dan cahaya terang biasa ataupun gelap adalah kondisi yang sangat sesuai dengan perkecambahan konidia U. salmonicolor. Dan serangan akan terjadi bila kondisi iklim atau cuaca sangat mendukung yaitu cuaca yang lembab atau mendung dengan curah hujan yang relatif tidak terlalu tinggi dan merata sepanjang hari (Situmorang, 2004).
Ketinggian Tempat
Kebun yang terletak pada tempat yang lebih tinggi dari 300 m dpl mendapat serangan jamur yang lebih berat, dibandingkan dengan kebun–kebun yang terletak di tempat yang lebih rendah. Hal ini karena Jamur upas kurang terdapat di kebun karet di tanah alluvial dekat pantai yang mempunyai kelembapan rendah. Mungkin ini disebabkan karena adanya pertukaran udara yang baik (Semangun, 2000).
Faktor kesuburan tanah dan tempat
Kebun-kebun yang terdapat pada lahan yang kurang subur atau tanpa diberi pupuk sehingga kondisi tanaman menjadi lemah (Situmorang,2004).
Di daerah dekat persawahan atau rawa dan sungai merupakan daerah yang selalu lembab. Penyakit jamur upas biasanya berjangkit pada musim hujan atau pada keadaan yang sangat lembab atau berkabut (Semangun, 2000).
1.4 Resistensi Klon Karet
Klon-klon karet mempunyai ketahanan yang berbeda terhadap jamur upas. Mungkin ini disebabkan karena perbedaan morfologi klon, yang menyebabkan terjadinya perbedaan kelembapan dalam kebun, dan karena adanya perbedaan dalam ketebalan jaringan kulitnya. Di Sumatera Utara klon PR107, AVROS 1734, dan RRIM 600 adalah rentan. GT 1 dan AVROS 2037 mempunyai ketahanan sedang (Basuki,1982 dan Semangun, 2000).
Penyakit jamur upas banyak dijumpai pada klon-klon yang bertajuk rindang, dan pada tanaman muda berumur 4-12 tahun yang ditanam pada areal yang selalu lembap (Semangun, 2000).
1.5 Pengendalian Penyakit
kelembapan tinggi). Di daerah ini hendaknya ditanami klon yang tahan, misalnya AVROS 2037. Untuk mencegah terjadinya kelembaban yang tinggi sebaiknya jarak tanam dibuat tidak terlalu rapat (Pinem dan Yusuf, 2004).
Pengobatan harus dilaksanakan seawal mungkin, yaitu pada saat terlihat gejala awal atau tingkat sarang laba-laba. Pengobatan untuk tanaman sakit dilakukan dengan melumaskan fungisida tridemorf (Calixin 5 %) dalam lateks pekat (60 % kadar karet kering). Calixin RM (ready mixed), Dowco 262 atau bubur bordo pada bagian yang terkena serangan hingga 30 cm ke atas dan kebawahnya. Namun, pelumas ini juga tergantung pada berat ringannya serangan. Bubur bordo tidak dibenarkan diberikan pada tanaman yang sudah disadap karena bisa merusak mutu lateks (Pinem dan Yusuf, 2004). Fungisida lain yang dapat dipakai untuk jamur upas adalah klorotalonil dan thiram. Klorotalonil 3 % b.a. dapat disemprotkan setiap dua minggu. Klorotalonil dan thiram dapat juga dicampur dengan bitumen (ter) atau bahan lain yang dipakai sebagai pelumas (Allen, 1994).
Karena pengobatan dengan cara pelumasan sangat lambat, maka ditempuh cara pengobatan dengan penyemprotan. Alat semprot yang digunakan harus bertangkai panjang (Pinem dan Yusuf, 2004).
Bila percabangan sudah terkena serangan lanjut (tingkat kortisium atau nekator), maka pengendalianya dilakukan dengan cara mengupas kulit yang busuk. Kemudian, kulit batang yang tersisa dilumaskan dengan Calixin RM secukupnya (Pinem
dan Yusuf, 2004).
Untuk mengurangi bahan kimia yang berbahaya yang ada pada fungisida kimia seperti sulfat tembaga, yang berbahaya pada kesehatan maka digunakan pengendalian secara alami dengan menggunakan fungisida alami salah satunya yang ingin dicoba adalah chitosan, salah satu bahan alami yang telah direkomendasikan sebagai elicitor resistensi pada produk pasca panen (Wilson et al., 1994). Yang dihasilkan dari proses deasetilasi chitin cangkang kepiting atau eksokleleton udang (Wilson and Ell Ghaouth, 1993). Chitosan melindungi buah dan sayuran melalui dua mekanisme: fisik dan kimiawi. Secara fisik, chitosan membentuk lapisan film yang membungkus permukaan produk dan mengatur pertukaran gas dan kelembaban. Secara kimiawi, chitosan bersifat fungisidal dan merangsang respon resistensi pasca panen pada jaringan tanaman aktifitas antifugal dan merangsang ketahanan dari chitosan menjanjikan kemungkinan yang baik untuk pengendalian penyakit tanaman (Pamekas, 2007).
2.Chitosan
chitosan pertama kali ditemukan oleh ilmuwan Perancis, Ojier, pada tahun 1823. Ojier meneliti chitosan hasil ekstrak kerak binatang berkulit keras, seperti udang, kepiting,
dan serangga (Luthfi, 2006). chitosan merupakan
produk turunan dari polymer chitin, yakni produk limbah dari pengolahan industri perikanan, khususnya udang dan rajungan. Limbah kepala udang mencapai 35-50 persen dari total berat udang. chitosan, mempunyai bentuk mirip dengan selulosa, dan bedanya terletak pada gugus rantai C-2 (Bima, 2006).
dapat mengikat muatan negatif dari senyawa lain, gugus amino menjadikan chitosan bermuatan positif kuat dapat mengikat lemak dan protein, serta tidak mudah mengalami degradasi secara biologis dan tidak beracun (Bima, 2006).
Chitosan mengandung enzim β-1.3 glukanase yang dapat menyebabkan penurunan jumlah kitin pada dinding hifa cendawan sehingga dapat mengurangi pertumbuhan koloni jamur (El Ghaouth et al.,1992).
Proses pembuatan chitosan pertama-tama kulit udang atau kepiting dicuci dengan larutan alkali encer untuk menghilangkan protein (deproteinisasi). Selanjutnya bahan dicuci dengan larutan asam hidroklorik encer untuk menghilangkan kerak kapur (demineralisasi). Proses deproteinisasi dan demineralisasi usai, yang tersisa adalah zat kerak (crust) (Bima, 2006).
Chitosan ternyata digunakan untuk kesehatan untuk penyakit diabetes dan hipertensi. Ternyata di dalam zat kerak udang terdapat unsur butylosar yang bermanfaat bagi tubuh manusia. Butylosar yang telah didapatkan itu hanya larut dalam asam encer dan cairan tubuh manusia. Dengan demikian, butylosar dapat diserap oleh tubuh, zat ini juga mempunyai muatan positif yang kuat, dan dapat mengikat muatan negatif dari senyawa lain. Selain itu, zat ini tidak mudah mengalami degradasi secara biologis dan tidak beracun (Linawati, 2008).
Pada penyakit di tanaman chitosan bersifat fungisidal dan merangsang resistensi dari jaringan tanaman. Aktifitas antifugal dan rangsangan ketahanan dari chitosan menjanjikan kemungkinan yang baik untuk perlindungan tanaman (Pamekas, 2007).
Fungsi fungisidal pada chitosan yang ada pada ekstrak cangkang udang sebagaimana yang pernah dilaporkan oleh El Ghaouth et al. (1992), pada pathogen R. stolonifer dan B.
dinding sel inang serta menyebabkan kerusakan sel cendawan. Pemeberian chitosan akan menghambat pertumbuhan hifa cendawan patogen dengan adanya aktifitas dari enzim-enzim
chitinase, glukanase, serta senyawa antifugal yang lain yang didukung oleh chitosan
(Hadwiger et al.,1989) Chitosan juga
dijadikan pengawet makanan. Mekanisme yang dilakukan yaitu chitosan ini melapisi bahan yang diawetkan (menyelubungi), sehingga bahan itu terhindar dari kontaminasi luar (Anonimous, 2006)
Gambar 5. Bubuk Chitosan
(Sumber : Foto langsung)
III.BAHAN DAN METODE
1.Tempat dan Waktu Penelitian
Penelitian dilakukan di laboraturium Proteksi Tanaman Balai Penelitian Tanaman
Karet Sungai Putih, dengan ketinggian ± 80 meter dari permukaan laut. Penelitian
dilaksanakan pada tgl 12 Agustus sampai dengan 11 Nopember 2008.
2.Bahan dan Alat
Adapun bahan yang digunakan adalah Isolat U. salmonicolor , bahan-bahan kimia
seperti alkohol 96 %, chlorox 0.2 %, aquadest steril, PDA (Potato Dektrose Agar), kulit
udang , air, HCl 1 N, NaOH 3,5 % dan 50 %, Tridemorf, streptomycin.
Adapun alat yang digunakan adalah autoclave untuk sterilisasi alat, becker glass,
gelas ukur, gunting, erlenmeyer, deck glass, blender, hand spayer, hot plate,
haemocytometer, incubator, panci, timbangan, kompor, oven, lampu bunsen, mikroskop,
cork borer (pelubang gabus), jarum inokulasi, batang pengaduk, saringan 40-60 mesh,
cawan petri 9 cm, parapilon, alumunium foil, karet, mikropipet 100 µl, kotak penyinaran
sinar ultra violet, stirrer, sheker, kain muslim, planimeter, penggaris.
3.Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) Non
faktorial yang terdiri dari 6 perlakuan dan 4 ulangan.
Perlakuan yang diuji adalah :
C0 = Kontrol (tanpa perlakuan)
C1 = Chitosan dengan konsentrasi 10 mg/ml aquadest
C3 = Chitosan dengan konsentrasi 30 mg/ml aquadest
C4 = Chitosan dengan konsentarsi 40 mg/ml aquadest
C5 = Tridemorf (Calixin) 750 EC 5 %, dengan 0.25 ml/ Cawan Petri.
Jumlah ulangan adalah :
Jumlah keseluruhannya = 24
4.Pelaksanaan Penelitian 4.1 Persiapan Chitosan
Chitosan dibuat berdasarkan metode yang digunakan oleh Prasetiyo dan Yusuf
(2005) yaitu :
a. Demineralisasi
Kulit udang dicuci dengan air mengalir sampai air cuciannya menjadi bening,
kemudian dikeringkan di bawah sinar matahari. Selanjutnya kulit udang tadi dicuci
menggunakan air panas sebanyak 2 kali sambil diaduk, kemudian direbus selama 10 menit.
Setelah direbus, kulit udang ditiriskan dan dikeringkan. Kulit udang yang sudah kering
Setelah itu, serbuk kulit udang dicampur dengan asam klorida (HCL) 1 N dengan
perbandingan 10 : 1, Dengan konsentrasi HCL yang diketahui 37 %, BJ HCL 1.19, Mr HCL
36.5, maka dihitung 1N HCL:
Diketahui Konsentrasi HCl = 37 % BJ HCl = 1.19
Diketahui 1 N = 12.06 jadi 3500/12.06 = 290 ml HCl yang digunakan
Suspensi tersebut diaduk secara merata selama 1 jam, lalu dipanaskan pada suhu 90
0
C selama 1 jam. Residu berupa padatan dicuci dengan air sampai pH netral. Selanjutnya,
residu padatan ini dikeringkan dalam oven pada suhu 80 0C selama 24 jam atau dijemur
sampai kering. Ditimbang 250 gr hasilnya.
b. Deproteinasi
Kulit udang yang telah dimineralisasi (residu padatan yang sudah kering) dicampur
dengan larutan NaOH 3.5 % dengan perbandingan pelarut dan kulit udang sebesar (6 : 1) .
Diketahui NaOH 3.5 %
BJ NaOH = 40 gr/mol
Ditanya : gram dalam larutan ?
6 : 1 1500 ml : 250 gr 1.5 L
1.4 gr x 1.5 L = 2.1 gr
Suspensi tadi diaduk secara merata selam 1 jam, lalu dipanaskan pada suhu 90 0C
selama 1 jam. Setelah itu, larutan disaring dan didinginkan hingga diperoleh residu padatan,
residu padatan ini dicuci dengan air sampai pH netral dan dikeringkan pada suhu 80 0C
selama 24 jam atau dijemur sampai kering.
c. Deasetilisasi Khitin Menjadi Chitosan
chitosan dibuat dengan menambahkan NaOH (50 %) dengan perbandingan 20 : 1
(pelarut berbanding khitin). Suspensi tersebut diaduk selama 1 jam, lalu dipanaskan selama
90 menit pada suhu 120-140 0C. larutan tadi disaring hingga diperoleh residu berupa
padatan. Residu padatan tadi dicuci dengan air sampai pH netral, lalu dikeringkan dalam
oven pada suhu 70 0C selama 24 jam atau dijemur sampai kering.
4.2 Isolat Jamur upas
Isolat U. salmonicolor diperoleh dari isolasi langsung tanaman karet yang terserang
pathogen jamur upas, ditumbuhkan dalam medium PDA, hingga jadi isolat murni.
Kemudian isolat murni diperbanyak dengan cara mengabil biakan murni menggunakan cork
borer dan jarum inokulasi diletakkan ditengah PDA hingga berumur 7 hari.
4.3 Medium PDA yang terdapat senyawa alami chitosan dan tridemorf.
Untuk perlakuan dilakukan dengan cara mengabil senyawa alami chitosan sesuai
dengan konsentrasi 10 mg/ml, 20 mg/ml, 30 mg/ml, dan 40 mg/ml menggunakan micropipet
100 цL, setiap perlakuan masing-masing sebanyak 400 цL/cawan petri, dan tridemorf 0.25
dituangkan streptomycin sebanyak 0.01 g. Kemudian PDA cair (suhu 40º C) sebanyak 15
ml/cawan petri, dan cawan petri digoyang-goyang agar chitosan tercampur rata dengan
PDA. Campuran PDA, streptomycin dan chitosan dibiarkan beku hingga 2 hari.
4.4 Pelaksanaan Inokulasi
Setelah itu pada medium PDA tersebut ditumbuhkan cendawan U.
salmonicolor yang berasal dari biakan murni U. salmonicolor berumur 7 hari dengan
menggunakan cork borer dan jarum inokulasi. Setelah semua perlakuan selasai, cawan petri
penutup antara bagian atas dan bawah diberi parapilon agar tidak terjadi kontaminasi,
kemudian diinkubasikan dalam incubator suhu 26º C selama 7 hari kemudian.
5.Parameter Pengamatan
5.1 Luas Pertumbuhan Koloni U. salmonicolor
Pengukuran pertumbuhan jamur U.salmonicolor dilakukan dengan:
a. Diamati pertumbuhan luas koloni jamur U. salmonicolor secara periodik pada
perlakuan kontrol, perlakuan chitosan, dan fungisida dosis anjuran. Diukur pada hari
Foto hari ke 2
Foto hari ke 4
Foto hari ke 6
Gambar 6. Foto pertumbuhan luas koloni Jamur pada pengamatan hari 2,4, dan 6 (Sumber : Foto langsung).
b. Kemudian digambar di cawan Petri menggunakan spidol permanent pertumbuhan
jamur U.salmonicolor pada hari ke 2, 4, dan ke 6
c. Hasilnya di gambar ke kertas minyak transparan .
d. Setelah itu dihitung luas pertumbuhan koloni jamur menggunakan alat planimeter.
Gambar 7. Alat Planimeter
(Sumber : Foto langsung)
5.2 Perhitungan Kerapatan konidia Jamur
Perhitungan kerapatan konidia jamur menggunakan alat Haemocytometer.
IV.HASIL DAN PEMBAHASAN
1.Luas pertumbuhan koloni jamur U.salmonicolor.
Data pengamatan luas pertumbuhan koloni jamur U.salmonicolor dapat ilihat pada
lampiran 4 sampai dengan lampiran 7. Dari hasil analisa sidik ragam dapat dilihat bahwa
perlakuan dengan pemberian chitosan kurang efektif pada setiap perlakuan kecuali
berbanding dengan perlakuan kontrol, dan perlakaun fungisida pada media PDA
berpengaruh sangat nyata dalam menghambat pertumbuhan diameter koloni jamur U.
salmonicolor. Untuk mengetahui mana perlakuan yang berbeda sangat nyata dilakukan Uji
Jarak Duncan (UJD). Hasilnya dapat dilihat pada tabel 1.
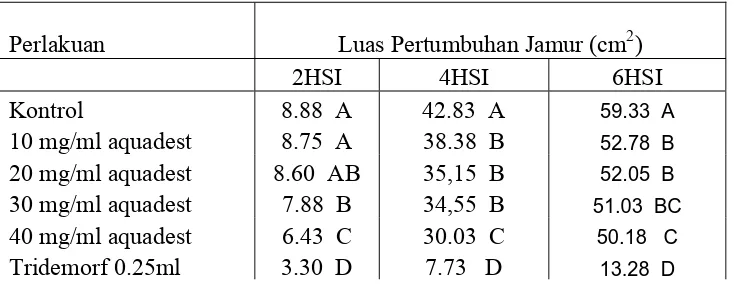
Tabel 1. Uji Beda Rataan Luas Pertumbuhan Koloni Jamur U. salmonicolor pada Pengamatan hari ke 2, ke 4, dan ke 6 HSI.
Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 0.01 menurut Uji jarak Duncan.
HSI : Hari setelah inokulasi.
Dari tabel 1 dapat dilihat bahwa pada pengamatan 2 HSI perlakuan
kontrol yang luasnya 8.88 cm2, tidak berbeda nyata dengan perlakuan chitosan 10 mg/ml
aquadest yang luasnya 8.75 cm2, dan chitosan 20 mg/ml aquadest yang luasnya 8.60 cm2.
Perlakuan Luas Pertumbuhan Jamur (cm2)
Tetapi berbeda sangat nyata dengan chitosan 30 mg/ml aquadest yang luasnya 7.88 cm2.
chitosan 40 mg/ml aquadest luasnya 6.43 cm2, dan Tridemorf 0.25 ml luasnya 3.30 cm2.
Perlakuan chitosan 20 mg/ml aquadest tidak berbeda nyata dengan chitosan 30 mg/ml
aquadest tetapi berbeda nyata dengan chitosan 40 mg/ml aquadest dan Tridemorf 0.25 ml.
Perlakuan chitosan 30 mg/ml aquadest berbeda nyata dengan chitosan 40 mg/ml aquadest
dan Tridemorf 0.25 ml, dan perlakuan chitosan 40 mg/ml aquadest berbeda sangat nyata
dengan Tridemorf 0.25 ml. Pada pengamatan 4 HSI perlakuan kontrol yang luas
konidianya 42.83 cm2, berbeda sangat nyata dengan chotosan 10 mg/ml aquadest yang
lusnya 38.38 cm2, chitosan 20 mg/ml aquadest luasnya 35.15 cm2, chitosan 30 mg/ml
aquadest luasnya 34.55 cm2, chitosan 40 mg/ml aquadest luasnya 30.03 cm2, dan Tridemorf
0.25 ml luasnya 7.73 cm2. Kemudian chitosan 10 mg/ml aquadest tidak berbeda nyata
dengan chitosan 20 mg/ml aquadest, dan chitosan 30 mg/ml aquadest, tetapi berbeda sangat
nyata dengan chitosan 40 mg/ml aquadest dan Tridemorf 0.25 mg/ml, dan chitosan 40
mg/ml aquadest berbeda sangat nyata dengan Tridemorf 0.25 ml. Pada pengamatan 6 HSI,
perlakuan kontrol yang luasnya 59.33 cm2 ,berbeda sangat nyata dengan chitosan 10 mg/ml
aquadest luasnya 52.78 cm2, chitosan 20 mg/ml aquadest luasnya 52.05 cm2, chitosan 30
mg/ml aquadest luasnya 51.03 cm2, chitosan 40 mg/ml aquadest 50.18 cm2, dan Tridemorf
0.25 ml luasnya 13.28 cm2. Kemudian chitosan 10 mg/ml aquadest tidak berbeda nyata
dengan chitosan 20 mg/ml aquadest dan chitosan 30 mg/ml aquadest, tetapi berbeda sangat
nyata dengan chitosan 40 mg/ml aquadest dan Tridemorf 0.25 ml, dan chitosan 30 mg/ml
aquadest tidak berbeda nyata dengan chitosan 40 mg/ml aquadest tetapi
berbeda nyata dengan Tridemorf 0.25 ml, dan chitosan 40 mg/ml aquadest berbeda sangat
Dari tabel 1 diketahui bahwa pemberian chitosan pada PDA tidak berpengaruh nyata
pada pengamatan 2, 4, dan 6 hari pada setiap perlakuan kecuali berbanding dengan
perlakuan kontrol. Pada setiap perlakuan tidak berbeda nyata yaitu pada perlakuan 10
mg/ml aquadest, 20 mg/ml aquadest, 30 mg/ml aquadest hasilnya tidak berbeda nyata, pada
perlakuan 40 mg/ml aquadest terdapat pengahambatan.
Hasil penelitian ini menegaskan bahwa memang adanya fungsi fungisidal pada
chitosan yang ada pada ekstrak cangkang udang sebagaimana yang pernah dilaporkan oleh
El Ghaouth et al. (1992), pada patogen R. stolonifer dan B. cinerea, dengan
menghambat proliferasi B. cinerea, mengurangi degradasi komponen dinding sel inang serta
menyebabkan kerusakan sel cendawan. Tetapi pada penelitian yang saya lakukan
perbedanya kurang efektif pada setiap perlakuan, bila dibandingkan perlakuan kontrol
memang terdapat penghambatan, ini disebabkan chitosan mengandung enzim β-1.3
glukanase yang dapat menurunkan jumlah kitin pada dinding hifa cendawan sehingga dapat
mengurangi pertumbuhan koloni jamur karena chitosan sifatnya menghambat sehingga
pertumbuhan koloni jamur tetap tumbuh hingga memenuhi cawan petri dan hanya
mengurangi pertumbuhanya.
Adapun pengaruh luas pertumbuhan koloni jamur terhadap pemberian chitosan dapat
36
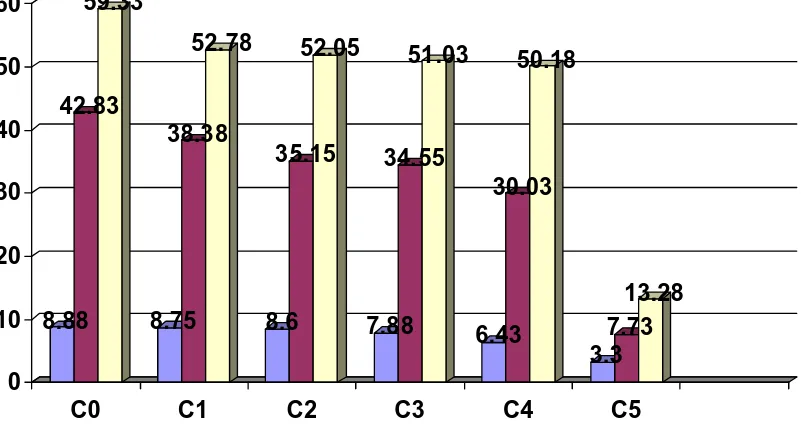
Gambar 9. Pengaruh Luas Pertumbuhan Koloni Jamur U. salmonicolor Terhadap Pemberian Chitosan Pada Pengamatan 2 HSI, 4 HSI, dan 6 HSI
Dari gambar histogram diatas dapat dilihat bahwa dari pengamatan yang paling
tinggi luas pertumbuhan koloni jamur adalah pada pengamatan 6 HSI dan untuk luas
pertumbuhan koloni yang terendah terdapat pada pengamatan 2 HSI.
Berdasarkan pengamatan histogram diatas juga dilihat pertumbuhan jamur setiap
harinya terus tumbuh, namun terdapat perbedaan pertumbuhan jamur yang diberi perlakuan
dengan chitosan dan fungisida, tidak sama dengan pertumbuhan kontrol.
Dari gambar histogram juga dilihat Perlakuan dengan chitosan sesuai konsentrasi
terdapat perbedaan pertumbuhan koloni jamur, tetapi tidak begitu besar. Bila dibandingkan
dengan perlakuan kontrol dan fungisida terdapat perbedaan yang besar.
2.Perhitungan Kerapatan Konidia Jamur U. salmonicolor.
Dari hasil perhitungan kerapatan konidia jamur U. salmonicolor dan analisis sidik
ragamnya dapat dilihat pada lampiran 8. Hasil analisa sidik ragam menunjukkan pengaruh
pemberian chitosan dan fungisida terhadap jumlah konidia jamur berpengaruh sangat nyata,
tetapi setiap perlakuan dengan konsentrasi tidak menunjukkan pengaruh yang nyata.
Hasilnya dapat dilihat pada tabel 2.
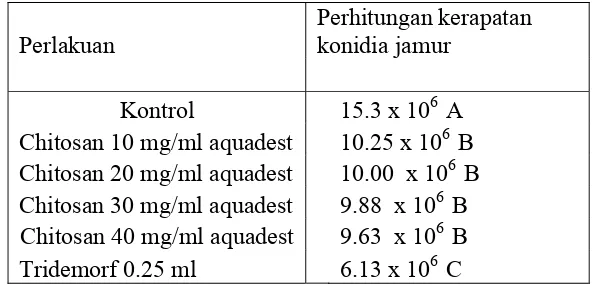
Tabel 2. Uji Beda Rataan Perhitungan Jumlah Kerapatan Konidia Jamur U. salmonicolor dengan Menggunakan Alat Haemocytometer.
Perlakuan
Keterangan:Angka yang diikuti huruf yang sama pada kolom yang sama pada kolom yang sama tidak berbeda nyata pada taraf 0.01
Dari tabel 2 diatas dapat dilihat bahwa jumlah konidia yang paling tinggi yaitu pada
perlakuan kontrol ( 15.3 x 106) hal ini karena tanpa perlakuan. Dan yang paling terendah
dengan perlakuan fungisida (6.13 x 106) . Perlakuan kontrol ( 15.3 x 106) berbeda sangat
nyata dengan perlakuan chitosan 10 mg/ml aquadest ( 10.25 x106), chitosan 20 mg/ml
aquadest ( 10 x 106), chitosan 30 mg/ml aquadest (9.88 x 106), chitosan 40 mg/ml aquadest
(9.63 x 106), dan tridemorf 0.25 ml (6.13 x 106). Tetapi chitosan 10 mg/ml aquadest ( 10.25
x106), chitosan 20 mg/ml aquadest ( 10 x 106) , chitosan 30 mg/ml aquadest (9.88 x 106),
chitosan 40 mg/ml aquadest (9.63 x 106) , tidak berbeda nyata. Tetapi berbeda sangat nyata
dengan tridemorf (6.13 x 106).
Pada setiap perlakuan chitosan untuk jumlah konidia jamur tidak berbeda nyata,
kecuali perlakuan kontrol yang berbeda nyata, chitosan dengan dengan setiap perlakuan
kurang efektif.
Adapun pengaruh perlakuan chitosan dan fungisida terhadap jumlah konidia jamur
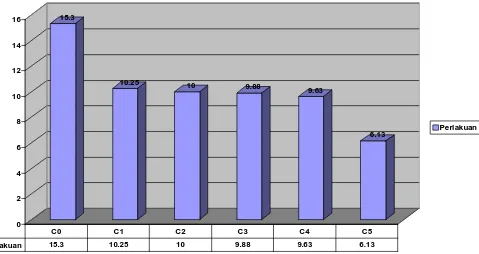
Gambar 10.Pengaruh Perlakuan Chitosan dan Fungisida Terhadap Jumlah Konidia Jamur U. salmonicolor .
Dari gambar histogram dilihat bahwa jumlah konidia yang paling tertinggi adalah
perlakuan kontrol yaitu sebasar 15.3 x 106 dan yang paling terendah pada perlakuan
fungisida yaitu sebesar 6.13 x 106 . Dilihat juga semakin tinggi konsentrasi chitosan yang
diberikan semakin sedikit jumlah konidianya walaupun tidak berbeda nyata. Dan chitosan
dapat mengurangi jumlah konidianya.
Perlakuan 15.3 10.25 10 9.88 9.63 6.13
1. Pada pengamatan luas koloni jamur U. salmonicolor perlakuan chitosan tidak
berpengaruh nyata dengan tiap perlakuan tetapi berpengaruh terhadap kontrol, dan
perlakuan fungisida berpengaruh nyata.
2. Dari hasil pada semua pengamatan luas pertumbuhan koloni jamur U.
salmonicolor pada 2 HSI yang tertinggi pada perlakuan kontrol (8.88 cm2 ), yang
terendah pada perlakuan fungisida tridemorf (3.30 cm2), pada 4 HSI yang
tertinggi pada perlakuan kontrol (42.82 cm2), yang terendah pada perlakuan
fungisida tridemorf (7.73 cm2), dan pada 6 HSI yang tertinggi pada perlakuan kontrol
(59.33 cm2), yang terendah pada perlakuan fungisida tridemorf (13.28 cm2).
3. Dari perhitungan jumlah konidia berpengaruh sangat nyata terhadap perlakuan
chitosan dan fungisida tridemorf. Yang paling tinggi jumlah konidia pada
perlakuan kontrol yaitu sebesar (15.3 x 106), dan yang paling terendah pada
perlakuan fungisida tridemorf yaitu sebesar (6.13 x 106).
4. Dari pengamatan ini chitosan kurang efektif menghambat pertumbuhan konidia
jamur dan jumlah konidia pada setiap konsentrasi tetapi dapat mengurangi luas
permukaan koloni pertumbuhan dan megurangi jumlah konidia.
2.Saran
Perlu dilakukan penelitian lanjutan mengenai mekanisme kerja dari chitosan dalam
ekstrak cangkang udang, meliputi reaksi fisiologis, kimiawi, anatomis, dan organoleptik.
DAFTAR PUSTAKA
______________. Haemocytometer For Quantification.Departement of Plant Pathology
University of Hawaii at Hilo, Hawaii Available. ttp://www.ilpi.org/infoserywebpub/fulldocs.
_______________. Karet Merupakan Salah Satu Komoditi Perkebunan Penting,Badan
Penelitian dan Pengembangan Pertanian, Jakarta.
http:/
______________. Chitosan Sebagai Pengawet Makanan, Ciptapangan, Jakarta.
http:/
Allen, P. W. 1994. Indentification and Treatment of Disease of Havea Brasiliensis,
Internet. Rubb.Res.Dev.Board (IRRDB). Hertford.UK
Basuki, 1967. Pengujian Efektifitas Fungisida Terhadap Mouldy Rot. BPU-PPN
Karet,Jakarta.
Bima, 2006, Karakteristik Chitosan, Institut Pertanian Bogor, Jakarta.
El Ghaouth.A.,J Arul, J.Granier, and Asselin. 1992a. Antifungal Activity of Chitosan On
Two Postharvest pathogens of strawberry fruits. Phytopathology.
El Ghaouth. A,J Arul, A. Asselin,and N. Benhamou.1992b. Antifungal activity of chitosan
on two postharvest pathogens : Introduction of morphological and cytological alteration in rhizophus stolonifer. Mycol.Res.
Hohn dan Litsch, 1907, Corticium Subcoronatum, Departemen de Entomologi,
Fitopatologia e Zoologia. Agricultur University, De Sao Paolo, Brazil.
Linawati, 2008, Chitosan, Limbah Kulit Udang Untuk Diabetes dan Hipertensi. Artikel ,
Kompas, Diakses tanggal 10 Januari 2008.
Luthfi, 2006, Chitosan dan Cara Pembuatanya,http// luthfi. web.id/2006/12/01/ chitosan.
part.2.
Nazir,. M. Ph. D, 2003. Metode Penelitian, Ghalia Indonesia, Pejaten Barat Jakarta.
Pamekas. T,. 2007.Potensi Ekstrak Cangkang Kepiting Untuk Mengendalikan Penyakit
Pinem,. M. S. I. dan S. Yusuf, 2004. Buku Ajar Penyakit Tanaman Perkebunan. Fakultas Pertanian, Universitas Sumatera Utara, Medan.5-6.
Prasetyo dan Yusuf, 2005. Khitosan Alternatif Pengendali Rayap Ramah Lingkungan,
Rineka Cipta, Jakarta.
Riyaldi, 2004. Alih Teknologi dan Kebijakan Pengendalian Penyakit di Perkebunan
Karet di Indonesia, Prosiding Pertemuan Teknis Strategi Pengelolaan Penyakit Tanaman Karet Untuk Mempertahankan Potensi Produksi Mendukung Industri Perkebunan Indonesia Tahun 2020. Palembang, 6-7 Oktober 2004, Pusat Penelitian Karet, Sumbawa.
Semangun. H,.2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia, Fakultas
Pertanian, Gadjah Mada University Press, Yogyakarta.
Sianturi.H.S.D, 1996, Budidaya Tanaman Karet, Fakultas Pertanian Universitas Sumatera
Utara, Medan.
Situmorang, A., M.S Sinaga, R. Suseno, S. H. Hidayat, Siswanto, dan A. Darussamin.2004.
Status dan Menejemen Pengendalian Penyakit Jamur Upasia Salmonicolor di Perkebunan Karet. Prosiding Pertemuan Teknis Strategi Pengelolaan Penyakit Tanaman Karet untuk Mempertahankan Potensi Produksi Mendukung Industri Perkaretan Indonesia tahun 2020. Palembang 6-7 Oktober 2004, Pusat Penelitian Karet, Sembawa.
Tjokrosoedarmo,. A.H.1983, Biologi Jamur Upas, Disertasi Universitas Gadjah Mada,
Yogyakarta.
Wastie,.R.L. 1975, Diseases of Robber and Their Control PANS .
Wilson, C. L., A. El Ghaouth, E. Chalutz., S.Droby.,C.Stevens,J. Y. Lu, V. Khan, and J.
Arul, 1994. Potensial of induced resistace to control postharvest disesase of fruit
and vegetables. Plant Dis.
Wilson, C.L. and A. El Ghaouth, 1993. Multificated biological contol of fruits and
Lampiran 1.
Bagan Penelitian di Laboratorium
Keterangan :
C0 = Kontrol
C1 = Chitosan 10 mg/ml aquadest
C2 = Chitosan 20 mg/ml aquadest
C3 = Chitosan 30 mg/ml aquadest
C4 = Chitosan 40 mg/ml aquadest
C0 C1 C2 C3 C4 C5
C1 C2 C3 C4 C5 C0
C2 C3 C4 C5 C0 C1
C5 = Tridemorf (Calixin) 750 EC dengan 0,25ml/cawan petri
Lampiran 2.
Perhitungan kerapatan konidia jamur U. salmonicolor untuk setiap perlakuan dengan menggunakan alat haemocytometer.
Gambar 11. Alat untuk menghitung konidia (Haemocytometer) Sumber : http//www.wikimedia.co.id
Kotak c, d, e, f, dan o ditengahnya yang dilingkari adalah kotak yang dihitung
jumlah konidianya.
Adapun cara kerjanya sebagai berikut :
Bersihkan permukaan kamar hitung dengan air mengalir dan kemudian keringkan
dengan tissue atau kain yang lembut.
Tempatkan gelas penutup di atas slide, kemudian dijepit dengan penjepit yang ada di
sebelah kiri dan kanan.
Siapkan suspensi konidia yang di hitung, usahakan konidia yang tersuspensi dalam
cairan menyebar merata.
Ambil sedikit suspensi konidia dengan pipet tetes dan teteskan sebanyak 2 tetes di
tepi gelas penutup. Suspensi akan masuk ke kamar hitung dan mengisi seluruh
ruangan yang ada pada bilik tersebut.
Biarkan selama 1-2 menit,agar sel yang ada di dalam bilik stabil.
Tempatkan haemocytometer pada meja mikroskop dan hitung jumlah sel yang ada
dengan rumus sebagai berikut :
Contoh perhitungan perlakuan control ulangan 1
Kotak contoh Jumlah kotak kecil Jumlah konidia
Lampiran. 3. Tabel 3.
Data Luas Pertumbuhan Koloni Jamur U. salmonicolor.
4 8.9 cm2 40.0 cm2 58.1 cm2
Data luas Pertumbuhan Jamur U. salmonicolor Pada Uji Efektifitas Chitosan 2HSI
Uji Jarak Duncan
Sy 0,19
P 2 3 4 5 6 7 8
SSR 0.01 4.1 4.27 4.38 4.46 4.53 4.59 4.64
LSR 0.01 0.77 0.81 0.83 0.85 0.86 0.87 0.88
Perlakuan C5 C4 C3 C2 C1 C0
3.30 6.43 7.88 8.60 8.75 8.88
A B
C
D
Lampiran 5. Tabel 5.
Data Pengamatan Pertumbuhan Luas Jamur U. salmoniclor Pada Uji efektifitas Chitosan 4 HSA
Uji Jarak Duncan
Sy 0.67
P 2 3 4 5 6 7 8
SSR 0.01 4.1 4.27 4.38 4.46 4.53 4.59 4.64
LSR 0,01 2.73 2.86 2.93 2.99 3.04 3.08 3.11
Perlakuan C5 C4 C3 C2 C1 C0
7.73 30.03 34.55 35.15 38.38 42.83
A
B
C
Lampiran 6. Tabel 6.
Data Pengamatan Pertumbuhan Luas Jamur U. salmonicolor Pada Uji efektifitas Chitosan 6 HSI
Perlakuan Ulangan Total Rataan
Perlakuan 5 5490.07 1098.01
Uji Jarak Duncan
Sy 0,39
P 2 3 4 5 6 7 8
SSR 0.01 4.1 4.27 4.38 4.46 4.53 4.59 4.64
LSR 0,01 1.59 1.67 1.71 1.74 1.77 1.79 1.81
Perlakuan C5 C4 C3 C2 C1 C0
13.28 50.18 51.03 52.05 52.78 59.33
A
B
D C
Perlakuan
Luas Pertumbuhan
jamur (cm²)
2HSI 4HSI 6HSI
C0 8.88 A 42.83 A 59.33 A
C1 8.75 A 38.38 B 52.78 B
C2 8.60 AB 35.15 B 52.05 B
C3 7.88 B 34.55 B 51.03B C
C4 6.43 C 30.03 C 50.18 C
Lampiran 7.
Konsentrasi Ulangan Kandungan Spora
Lampiran 8. Tabel 8.
Uji Jarak Duncan
Sy 0.24
P 2 3 4 5 6 7 8
SSR 0,01 4.1 4.27 4.38 4.46 4.53 4.59 4.64
LSR 0,01 0.98 1.02 1.05 1.07 1.09 1.10 1.11
Perlakuan C5 C4 C3 C2 C1 C0
6.13 9.63 9.88 10.00 10.25 15.13
A
B
C
Perlakuan Perhitungan kerapatan konidia jamur
C0 15.3 x 106 A
C1 10.25 x 106 B
C2 10.00 x 106 B
C3 9.88 x 106 B
C4 9.63 x 106 B
Lampiran 9
Foto-foto pertumbuhan luas koloni jamur U. salmonicolor.
Gambar 12. Pertumbuhan Jamur U. salmonicolor pada pertumbuhan 1 hari setelah inokulasi.
Gambar 13. Pertumbuhan Jamur U. salmonicolor pada waktu 2 hari setelah inokulasi.
(Sumber : Foto langsung)
Gambar 14. Pertumbuhan Jamur U. salmonicolor pada waktu 3 hari setelah inokulasi
Gambar 15. Pertumbuhan Jamur U. salmonicolor pada waktu 4 hari setelah inokulasi
(Sumber : Foto Langsung)
Gambar 16. Pertumbuhan Jamur U. salmonicolor pada waktu 5 hari setelah
Inokulasi
Gambar 17. Pertumbuhan Jamur U. salmonicolor pada waktu 6 hari setelah inokulasi. ( Sumber : Foto Langsung)
Gambar 18. Pertumbuhan Jamur U. salmonicolor pada pertumbuhan 7 hari setelah inokulasi