PERLAKUAN AGENS HAYATI UNTUK MENGENDALIKAN
HAWAR DAUN BAKTERI, MENINGKATKAN PERTUMBUHAN
TANAMAN DAN PRODUKSI BENIH PADI
AHMAD ZAMZAMI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Perlakuan Agens Hayati untuk Mengendalikan Hawar Daun Bakteri, Meningkatkan Pertumbuhan Tanaman dan Produksi Benih Padi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Ahmad Zamzami
ii
RINGKASAN
AHMAD ZAMZAMI. Perlakuan Agens Hayati untuk Mengendalikan Hawar Daun Bakteri, Meningkatkan Pertumbuhan Tanaman dan Produksi Benih Padi. Dibimbing oleh SATRIYAS ILYAS dan MUHAMMAD MACHMUD.
Produksi benih padi sehat (bebas Xanthomonas oryzae pv. oryzae (Xoo)) dapat diupayakan dengan mencegah infeksi Xoo pada benih sumber dan tanaman padi. Xanthomonas oryzae pv. oryzae menyebabkan penyakit hawar daun bakteri (HDB) pada padi. Penelitian ini bertujuan menguji perlakuan agens hayati dalam mengendalikan penyakit HDB, meningkatkan pertumbuhan tanaman dan produksi benih padi. Penelitian terdiri atas dua bagian. Bagian pertama bertujuan mendapatkan agens hayati rizosfir dan filosfir yang mampu mengendalikan Xoo.
Percobaan pertama pada bagian pertama dilakukan untuk mengisolasi Xoo yang virulen yang berasal dari daun bergejala HDB dan ooze pada pertanaman padi yang bergejala HDB. Percobaan kedua merupakan uji ulang antagonisme rizobakteri koleksi terhadap Xoo (hasil isolasi percobaan sebelumnya) yang akan digunakan pada perlakuan benih. Percobaan ketiga merupakan isolasi dan uji antagonisme bakteri filosfir terhadap Xoo yang akan digunakan pada penyemprotan tanaman. Bagian kedua dari penelitian ini adalah evaluasi pengaruh perlakuan agens hayati (perlakuan benih dan penyemprotan tanaman) dalam mengendalikan penyakit HDB dan meningkatkan produksi benih padi sehat. Percobaan pertama dilakukan di rumah kaca dan percobaan kedua di lapangan dengan menggunakan rancangan yang sama yaitu rancangan acak kelompok (RAK), dua faktor dan tiga ulangan. Perlakuan benih (faktor pertama): kontrol negatif, kontrol positif, streptomisin sulfat 0.2%, Pseudomonas diminuta A6 +
Bacillus subtilis 5B, matriconditioning + streptomisin sulfat 0.2%, dan
matriconditioning + P. diminuta A6 + B. subtilis 5B. Penyemprotan tanaman (faktor kedua): kontrol, streptomisin sulfat 0.2%, agens hayati F112, agens hayati F57, dan agens hayati F198.
Percobaan pertama dari bagian pertama penelitian menghasilkan Xoo virulen yang diisolasi dari ooze. Percobaan kedua mengkonfirmasi bahwa P. diminuta A6 + B. subtilis 5B memiliki antagonisme tinggi terhadap Xoo. Sementara percobaan ketiga menghasilkan isolat bakteri filosfir F112, F198, dan F57 yang memiliki antagonisme yang tinggi terhadap Xoo. Percobaan pertama pada bagian kedua penelitian menunjukkan bahwa matriconditioning + P. diminuta A6 + B. subtilis 5B meningkatkan perkecambahan benih dari 93.6% menjadi 96.9%, tinggi tanaman dari 70.9 cm sampai 76 cm, bobot kering tanaman dari 1.35 g menjadi 1.91 g dibandingkan kontrol positif. Penyemprotan tanaman menggunakan agens hayati F112 meningkatan bobot kering tanaman dari 1.40 g menjadi 1.78 g. Sementara itu, perlakuan matriconditioning + P. diminuta A6 + B. subtilis 5B yang diikuti dengan penyemprotan tanaman dengan agens hayati F112 mengurangi keparahan HDB. Percobaan kedua menunjukkan bahwa perlakuan
meningkatkan pertumbuhan tanaman padi. Akan tetapi, semua perlakuan yang dilakukan pada tanaman padi belum dapat meningkatkan produksi benih sehat karena diduga populasi agens hayati yang diaplikasikan belum optimum.
iv
SUMMARY
AHMAD ZAMZAMI. Biological agent Treatments to Control Bacterial Leaf Blight and to Improve Plant Growth and Production of Rice. Supervised by SATRIYAS ILYAS and MUHAMMAD MACHMUD.
Healthy rice seed (free of Xanthomonas oryzae pv. oryzae (Xoo)) could be produced by prevention of Xoo infection from the seed source and the plant.
Xanthomonas oryzae pv. oryzae causes bacterial leaf blight (BLB) in rice. The objectives of the research were to evaluate biological agent treatments in controlling BLB and increasing plant growth and seed production of rice. The research consisted of two parts. The first part was aim to obtain the rhizosphere and phyllosphere biological agents capable of controlling Xoo.
The first experiment in the first part conducted to isolate the virulent Xoo. The second experiment was a retest for antagonism of rhizobacteria collection against the isolated Xoo which would be used in seed treatments. The third experiment was isolation and antagonism test of phyllosphere bacteria against Xoo to be used in spraying the plants. The second part of this study was the evaluation of biological agent treatment (seed treatment and plants spraying) effects in controlling BLB disease and improving plant growth and seed production. The first experiment was conducted in the greenhouse and the second one in the field using the same experimental design (randomized block design with two factors) and three replications. Seed treatments (first factor) consisted of negative control, positive control, streptomycin sulfate 0.2%, Pseudomonas diminuta A6 + Bacillus subtilis 5B, matriconditioning + streptomycin sulphate 0.2%, and matriconditioning + P. diminuta A6 + B. subtilis 5B. Spraying plants (second factor) consisted of untreated control, streptomycin sulphate 0.2%, biological agent F112, biological agent F198, and biological agent F57.
The first experiment from the first part of these studies resulted virulent Xoo isolated from ooze. The second experiment confirmed that P. diminuta A6 + B. subtilis 5B indicated high antagonism against the Xoo. The third experiment produced phyllosphere isolates F112, F198, and F57 showing high antagonism against the Xoo. The first experiment in the second part of these studies showed that matriconditioning + P. diminuta A6 + B. subtilis 5B improved seed germination from 93.6% to 96.9%, plant height from 70.9 cm to 76 cm, plant dry weight from 1.35 g to 1.91 g as compared to positive control. Spraying plants using biological agent F112 increased plant dry weight from 1.40 g to 1.78 g as compared untreated control. Meanwhile, matriconditioning + P. diminuta A6 + B. subtilis 5B followed by spraying plants with biological agent F112 reduced the BLB severity. The second experiment showed that matriconditioning + P. diminuta A6 + B. subtilis 5B improved seedling dry weight. Matriconditioning +
P. diminuta A6 + B. subtilis 5B and spraying plants with biological agents F112 controlled BLB and increased plant growth. However, all treatments were not able to increase healthy seed production, these may be due to population of the biological agents applied was not optimum yet.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu dan Teknologi Benih
PERLAKUAN AGENS HAYATI UNTUK MENGENDALIKAN
HAWAR DAUN BAKTERI, MENINGKATKAN
PERTUMBUHAN TANAMAN DAN PRODUKSI BENIH PADI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
ii
Judul Tesis : Perlakuan Agens Hayati untuk Mengendalikan Hawar Daun Bakteri, Meningkatkan Pertumbuhan Tanaman dan Produksi Benih Padi
Nama : Ahmad Zamzami NIM : A251110031
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Satriyas Ilyas, MS Ketua
Dr Drs Muhammad Machmud, MSc, APU Anggota
Diketahui oleh
Ketua Program Studi Ilmu dan Teknologi Benih
Prof Dr Ir Satriyas Ilyas, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
iv
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT karena atas rahmat-Nya sehingga penulis dapat menyelesaikan penyusunan tesis ini. Tesis ini sedikit menyumbangkan pengetahuan tentang pemanfaatan agens hayati rizosfir (melalui perlakuan benih) dan filosfir (melalui penyemprotan tanaman) dalam mengendalikan hawar daun bakteri, meningkatkan pertumbuhan tanaman dan produksi benih padi. Benih padi bermutu merupakan harapan untuk peningkatan produktivitas, pencegahan penyebaran patogen, dan pengendalian dini penyakit di lapangan. Penulis menyampaikan terimakasih atas bimbingan Prof Dr Ir Satriyas Ilyas, MS dan Dr Drs Muhammad Machmud, MSc, APU yang telah memberikan arahan dalam pelaksanaan penelitian dan penyusunan tesis ini. Sebagian penelitian dalam tesis ini dibiayai dari Hibah Kompetensi 2013 Dijten DIKTI KEMENDIKBUD yang diketuai oleh Prof Dr Ir Satriyas Ilyas, MS, untuk itu penulis menyampaikan terimakasih. Penulis juga menyampaikan terimakasih kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) atas Beasiswa Unggulan yang telah penulis terima selama ini. Semoga tesis ini bermanfaat bagi masyarakat dan perkembangan ilmu pengetahuan.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
2 AGENS HAYATI RIZOSFIR DAN FILOSFIR UNTUK
MENGENDALIKAN Xanthomonas oryzae pv. oryzae 4
Pendahuluan 4
Tujuan 5
Bahan dan Metode 5
Hasil dan Pembahasan 7
Simpulan 10
3 PERLAKUAN BENIH DAN PENYEMPROTAN TANAMAN
MENGGUNAKAN AGENS HAYATI UNTUK MENGENDALIKAN HAWAR DAUN BAKTERI DAN MENINGKATKAN
PERTUMBUHAN SERTA PRODUKSI BENIH PADI SEHAT 11
Pendahuluan 11
Tujuan 11
Bahan dan Metode 12
Hasil dan Pembahasan 17
Simpulan 24
4 PEMBAHASAN UMUM 25
5 SIMPULAN UMUM DAN SARAN 28
Simpulan Umum 28
Saran 28
DAFTAR PUSTAKA 29
LAMPIRAN 32
ii
DAFTAR TABEL
1. Tingkat keparahan HDB yang dihasilkan isolat Xoo pada tanaman
padi varietas IR64 umur 21 hari 8
2. Pembentukan zona hambatan oleh isolat rizobakteri koleksi pada
biakan patogen Xoo 8
3. Zona hambat oleh isolat bakteri filosfir hasil isolasi pada biakan
patogen Xoo 9
4. Pengaruh perlakuan benih terhadap daya tumbuh benih 17 5. Pengaruh perlakuan benih dan penyemprotan tanaman terhadap bobot
kering tanaman (g per tanaman) pada 8 MSS 18
6. Pengaruh perlakuan benih dan penyemprotan tanaman terhadap tinggi
tanaman (cm) pada 8 MSS 18
7. Pengaruh interaksi antara perlakuan benih dan penyemprotan tanaman terhadap tingkat keparahan HDB (%) pada 8 MSS 19 8. Pengaruh perlakuan benih terhadap bobot kering bibit 3 MSS 20 9. Pengaruh perlakuan benih dan penyemprotan tanaman terhadap bobot
kering brangkasan (g per rumpun) 21
10. Pengaruh perlakuan benih dan penyemprotan tanaman terhadap
produksi benih (g per m2) 21
11. Pengaruh perlakuan benih dan penyemprotan tanaman terhadap
tingkat keparahan HDB (%) pada 12 MST 22
12. Pengaruh perlakuan benih dan penyemprotan tanaman terhadap Xoo
terbawa benih (x 107 cfu ml-1) 23
DAFTAR GAMBAR
1. Bagan alir penelitian 3
2. Pembentukan zona hambat oleh rizobakteri koleksi pada biakan Xoo. Tanda panah: (a) patogen Xoo, (b) kertas saring, (c) rizobakteri, dan
(d) zona hambat rizobakteri terhadap Xoo 9
3. Pembentukan zona hambat bakteri filosfir pada biakan Xoo 10
DAFTAR LAMPIRAN
1. Deskripsi varietas padi IR64 32
2. Komposisi media YDCA 33
4. Komposisi media King’s B 33
5. Komposisi media NA 33
6. Isolasi Xoo dari daun 34
7. Isolasi Xoo dari ooze 34
8. Inokulasi Xoo terhadap tanaman padi 34
9. Isolasi bakteri filosfir dari daun padi 35
1
PENDAHULUAN
Latar Belakang
Penggunaan benih bermutu dapat memberikan kontribusi yang besar dalam mengefisienkan kegiatan pertanian. Keserempakan tumbuh dari benih bermutu dapat memudahkan pengelolaan tanaman secara umum. Penyulaman dapat ditekan melalui penggunaan benih dengan daya berkecambah yang tinggi. Sementara itu, pengendalian gulma lebih mudah dilakukan karena tidak dominannya gulma akibat bibit yang tumbuh lebih cepat. Namun, pengendalian penyakit tanaman melalui penggunaan benih sehat yang merupakan salah satu efisiensi penggunaan benih bermutu belum banyak dilakukan. Padahal, benih berpotensi menjadi media penyebaran patogen penyakit tanaman (Sutakaria 1984). Selain itu, peraturan di Indonesia belum menjadikan kesehatan benih sebagai syarat peredaran benih.
Salah satu penyakit utama tanaman padi adalah hawar daun bakteri (HDB) yang disebabkan oleh Xanthomonas oryzae pv. oryzae (Xoo). Bakteri Xoo merupakan patogen terbawa benih padi (Ilyas et al. 2007; Vikal et al. 2007) yang dapat menurunkan mutu benih dan produksi padi hingga 50% (Vikal et al. 2007) bahkan sampai 60% (Deptan 2008). Bakteri Xoo terdapat pada benih padi dan berkorelasi dengan intensitas penyakit HDB di lapang (BBPPMBTPH 2007). Hal ini diduga menjadi salah satu sebab luasnya serangan HDB pada periode Maret sampai September 2011 di 33 provinsi yang mencapai 56.987 ha dan 38 ha di antaranya mengalami puso (Ditjen Tanaman Pangan 2012). Dengan demikian, penyediaan benih sehat (bebas Xoo) dapat menjadi salah satu strategi penting untuk mengendalikan HDB dan meningkatkan produksi benih padi sehat.
Penyediaan benih sehat harus dimulai dari kegiatan produksi benih. Produksi benih padi bebas Xoo harus dilakukan melalui pencegahan infeksi Xoo pada tanaman dengan fase-fase pertumbuhan berbeda. Benih sumber dan permukaan tanaman selama pertumbuhan dapat diinfeksi oleh Xoo dan mempengaruhi kejadian HDB dan kesehatan benih padi yang dihasilkan.
Kesehatan benih sumber sangat penting dalam produksi benih sehat. Pada lahan yang telah terkontaminasi Xoo, keberadaan patogen ini pada benih akan menambah investasi inokulum Xoo yang dapat meningkatkan intensitas HDB. Sementara itu, pada lahan yang masih sehat, keberadaan Xoo terbawa benih dapat menjadi sumber inokulum awal patogen di lahan tersebut.
2
Salah satu usaha pencegahan atau pengendalian infeksi Xoo pada benih sumber dan pertumbuhan tanaman dapat dilakukan dengan memanfaatkan agens hayati. Akhir-akhir ini, penggunaan agens hayati untuk mengendalikan penyakit tanaman mulai populer dilakukan karena alasan keamanan lingkungan. Pada benih padi, pencegahan atau pengendalian infeksi Xoo dapat dilakukan dengan perlakuan benih menggunakan agens hayati. Perlakuan benih menggunakan campuran bakteri Pseudomonas diminuta dan Bacillus subtilis dapat mengendalikan Xoo pada benih padi (Ilyas et al. 2009). Perlakuan benih dengan agens hayati dapat dikombinasikan dengan matriconditioning. Matriconditioning
merupakan perlakuan imbibisi benih dengan memanfaatkan potensial matriks dari media yang digunakan (Khan et al. 1990) dengan tujuan meningkatkan vigor benih melalui proses metabolisme yang terkendali, sehingga dapat memperbaiki kerusakan-kerusakan dalam benih. Menurut Ilyas et al. (2009), matriconditioning
plus B. subtilis menghasilkan pertumbuhan bibit padi dan penurunan populasi Xooyang lebih baik daripada perlakuan lain.
Sementara itu, pencegahan infeksi Xoo atau pengendalian HDB pada fase pertumbuhan tanaman padi dapat dilakukan dengan penyemprotan tanaman menggunakan agens hayati. Menurut Jeyalakshmi et al. (2010), penyemprotan daun dengan P. fluorescens dapat menurunkan HDB dan meningkatkan hasil padi dibanding kontrol. Selain aplikasi agens hayati P. fluorescens pada benih, aplikasi melalui penyemprotan daun juga dibutuhkan untuk mempertahankan populasi agens hayati agar tetap efektif mengendalikan penyakit blas (Krishnamurthy dan Gnanamanickam 1998).
Ilyas et al. (2009) telah mendapatkan beberapa isolat agens hayati rizosfir yang efektif mengendalikan Xoo pada benih. Benih padi yang mendapat perlakuan agens hayati dan ditanam di lapangan, menunjukkan pertumbuhan yang baik pada fase bibit, tidak menunjukkan gejala HDB. Hal ini diduga karena dampak perlakuan benih masih terjadi. Namun, ketika memasuki fase generatif terjadi serangan HDB, sehingga tanaman menghasilkan benih yang terinfeksi Xoo. Hal ini menunjukkan bahwa infeksi Xoo terjadi pada fase pertumbuhan sampai panen. Hal ini juga berkaitan dengan kemampuan Xoodapat bertahan hidup pada gulma tertentu, dalam jerami tanaman yang terinfeksi, dan akar tanaman yang terinfeksi yang dapat menjadi sumber inokulum patogen pada musim selanjutnya. Xoo dapat bertahan hidup 42 hari pada benih padi selama penyimpanan (suhu ruang) dan pada jerami padi selama 28 hari (kondisi lapangan) sehingga dapat menjadi sumber inokulum penyakit untuk tanaman selanjutnya (Mary et al. 2001). Demikian juga dengan saluran irigasi pada lahan sawah yang terinfeksi akan menjadi media penyebaran patogen ke lahan sawah yang lain (Suparyono et al. 2003).
Tujuan
1. Mendapatkan isolat Xoo yang mampu menghasilkan gejala HDB dan memiliki virulensi yang tinggi.
2. Mendapatkan isolat rizobakteri koleksi yang masih memiliki tingkat antagonisme tinggi terhadap Xoo.
3. Mendapatkan isolat bakteri filosfir yang memiliki tingkat antagonisme yang tinggi terhadap Xoo.
4. Mengevaluasi pengaruh perlakuan benih, penyemprotan tanaman, dan interaksinya untuk mengendalikan HDB dan meningkatkan pertumbuhan tanaman padi di rumah kaca.
5. Mengevaluasi pengaruh perlakuan benih, penyemprotan tanaman, dan interaksinya untuk mengendalikan HDB dan meningkatkan produksi benih padi sehat di lapangan.
Tujuan: Mendapatkan isolat Xoo yang digunakan pada penelitian selanjutnya Luaran: Isolat Xooyang virulen
4
2 AGENS HAYATI RIZOSFIR DAN FILOSFIR UNTUK
MENGENDALIKAN Xanthomonas oryzae pv. oryzae
Pendahuluan
Salah satu patogen utama tanaman padi adalah Xanthomonas oryzae pv.
oryzae (Xoo) penyebab penyakit hawar daun bakteri (HDB). Swing et al. (1990) mendeskripsikan Xoo sebagai sel berbentuk lurus batang, berukuran 0.4 – 0.8 μm dan 1.5 – 2.9 μm, gram negatif dan bergerak dengan flagela kutub tunggal. Hawar daun bakteri dapat terjadi pada fase bibit sampai tanaman panen. Gejala penyakit HDB dapat dibedakan dalam tiga jenis yaitu gejala layu (kresek) pada tanaman muda atau tanaman dewasa yang peka, gejala hawar, dan daun kuning pucat (Balitbang Tanaman Pangan 1991).
Pengendalian patogen Xoo dapat dilakukan secara biologi dengan memanfaatkan agens hayati. Agens hayati merupakan makhluk hidup yang dimanfaatkan untuk mengendalikan organisme lain yang merugikan. Agens hayati dapat berupa bakteri. Bakteri sebagai agens hayati telah banyak dilaporkan manfaatnya. Fernando et al. (2005) melaporkan bahwa bakteri yang diisolasi dari tanaman canola dan kedelai dapat menghasilkan senyawa anti-fungi. Senyawa ini mampu menghambat perkecambahan sclerotia dan ascospore serta menghambat pertumbuhan mycelia Sclerotinia sclerotiorum.Nair et al. (2002) juga melaporkan bahwa Bacillus mojavensis (strain AB1) dari filosfir kopi menghasilkan senyawa anti-fungi dengan spektrum yang luas. Sementara itu, Hastuti et al. (2012) melaporkan bahwa pelapisan benih dan perendaman bibit padi dengan isolat
Streptomyces sangat efektif mengendalikan HDB selama musim hujan dan kemarau.
Selain mampu mengendalikan patogen, agens hayati juga dapat meningkatkan pertumbuhan. Velusamy et al. (2013) melaporkan bahwa P. fluorescens yang diisolasi dari rizosfir tanaman padi selain berpotensi untuk mengendalikan Xoo juga dapat berfungsi sebagai biofertilizer dengan memproduksi IAA sehingga mampu memacu pertumbuhan tanaman padi. Hastuti
et al. (2012) sebelumnya juga melaporkan bahwa isolat Streptomyces dapat meningkatkan pertumbuhan dan hasil tanaman padi. Sementara itu, pemanfaatan bakteri endofit dapat memacu pertumbuhan dan hasil dan sekaligus mampu mengendalikan patogen (Robert et al. 2008). Agens hayati dapat menekan patogen dengan berbagai mekanisme diantaranya produksi antibiotik, persaingan ruang tumbuh, parasit, bahkan menginduksi ketahanan tanaman terhadap patogen (Pal dan Gardener 2006).
yang berada di permukaan tanaman sebelum menginfeksi tanaman akan dikendalikan dengan agens hayati filosfir.
Tujuan
1. Mendapatkan isolat bakteri Xoo yang mampu menghasilkan gejala HDB dan memiliki virulensi yang tinggi.
2. Mendapatkan agens hayati rizosfir yang tinggi tingkat antagonismenya terhadap Xoo dari koleksi (Agustiansyah et al. 2010).
3. Mendapatkan agens hayati filosfir tanaman padi yang memiliki antagonisme yang tinggi terhadap patogen Xoo.
Bahan dan Metode
Waktu dan Tempat Percobaan
Percobaan ini dilakukan pada November 2012 sampai Februari 2013 di Laboratorium Fisiologi dan Kesehatan Benih Departemen Agronomi dan Hortikultura dan Rumah Kaca Kebun Percobaan Cikabayan, Fakultas Pertanian, Institut Pertanian Bogor.
Percobaan 1. Isolasi dan Uji Patogenisitas Xoo
1. Isolasi Xoo
Isolasi Xoo dilakukan dari daun padi varietas Ciherang bergejala HDB; pada sebagian daun terdapat eksudat (ooze) bakteri Xoodari pertanaman padi di Kecamatan Darmaga Kabupaten Bogor Jawa Barat. Bakteri Xoo diisolasi dari daun dan eksudat Xoo. Isolasi dari daun dilakukan dengan mencacah daun bergejala HDB sebanyak 2 g, kemudian cacahan daun direndam dalam botol steril yang berisi 10 ml akuades steril dan dibiarkan selama 10 menit dan dikocok. Suspensi disebar sebanyak 200 µl pada cawan petri berisi media
yeast extract dextrose calcium carbonate agar (YDCA). Isolasi Xoo dari
ooze dilakukan dengan mengambil ooze secara aseptik dari sampel daun menggunakan ose dan menggoreskannya pada cawan petri berisi media YDCA (Lampiran 2). Selanjutnya, cawan petri diinkubasi pada suhu kamar (± 25 °C) selama 5 hari. Koloni satu sel bakteri yang tumbuh pada permukaan media YDCA diamati berdasarkan warna dan karakter morfologi koloninya. Koloni yang diduga Xoo memiliki ciri-ciri koloni berbentuk bulat, tepi rata permukaan cembung, dan berwarna kuning. Kemudian, beberapa koloni satu sel dibiakkan pada cawan petri YDCA yang baru untuk diuji patogenisitasnya. 2. Uji Patogensitas
6
Xoo dari pencacahan daun). Jika terdapat pengaruh nyata faktor yang diuji pada analisis ragam (taraf kepercayaan 95%), maka dilakukan uji lanjut dengan duncan multiple range test (DMRT).
Benih padi IR64 yang rentan terhadap Xoo digunakan sebagai bahan uji. Benih yang digunakan disterilisasi permukaan dengan merendamnya pada larutan natrium hipoklorit 1% selama 1 menit (Ilyas et al. 2007), kemudian ditanam langsung pada ember plastik berisi tanah yang sudah dilumpurkan (1 tanaman per ember). Masing-masing isolat yang akan diuji patogenisitasnya dibiakkan pada cawan petri berisi medium YDCA selama 48 jam. Isolat berumur 48 jam tersebut disuspensikan ke akuades steril 50 ml dan kepekatannya diukur sekitar 108 cfu ml-1 menggunakan spektrofotometer SHIMADZU UV-1201 [optical density (OD600) = 0.5]. Inokulasi tanaman dilakukan pada bibit tanaman umur 21 hari dengan metode gunting. Masing-masing inokulum bakteri diinokulasikan dengan menggunting daun ke-2 dan-3 yang telah membuka sempurna (2 daun per inokulum) dengan gunting yang telah dicelupkan pada suspensi bakteri.
Pengamatan dilakukan setiap hari dengan melihat perkembangan gejala HDB pada tanaman yang diinokulasi hingga 14 hari setelah inokulasi. Gejala HDB diamati dengan membandingkan luas daun terserang pada dua daun yang digunting (diinokulasi Xoo) dengan total luas daun.
Percobaan 2. Uji Ulang Antagonisme Isolat Rizobakteri Koleksi terhadap Xanthomonas oryzae pv. oryzae
1. Rancangan Percobaan
Percobaan ini menggunakan RAL satu faktor dengan empat ulangan. Faktor yang diuji adalah isolat rizobakteri koleksi yang terdiri atas isolat B. subtilis 11/C, isolat B. subtilis 5B, isolat P. diminuta A6, dan isolat P. aeruginosa A54. Jika terdapat pengaruh nyata faktor yang diuji pada analisis ragam (taraf kepercayaan 95%), maka dilakukan uji lanjut dengan DMRT. 2. Pelaksanaan
3. Pengamatan
Pengamatan dilakukan setiap hari untuk melihat terbentuknya zona hambatan pertumbuhan Xoo oleh agens hayati, dan diameter zona hambat diukur lima hari setelah inkubasi. Selanjutnya dipilih satu isolat agens hayati risosfir yang memiliki potensi antagonisme tertinggi terhadap Xoo.
Percobaan 3. Isolasi dan Uji Potensi Antagonisme Bakteri Filosfir terhadap Xanthomonas oryzae pv. oryzae
1. Isolasi Bakteri Filosfir dari Daun Padi
Contoh daun padi diambil dari pertanaman padi di Kecamatan Darmaga Kabupaten Bogor Jawa Barat Contoh daun dibedakan dalam dua kategori, yaitu daun padi yang sehat (tidak bergejala HDB) dan daun yang bergejala HDB. Isolasi bakteri filosfir dilakukan dengan mencacah sebanyak 2 g masing-masing contoh daun padi, secara terpisah dimasukkan ke dalam botol berisi 20 ml aquades steril. Botol yang berisi cacahan daun tersebut dikocok dan dibiarkan selama 3 jam. Suspensi yang didapatkan diencerkan secara bertingkat dari 10-1 sampai dengan 10-6 dan setiap tahap pengenceran dihomogenisasi dengan vortex. Enceran 10-5 dan 10-6 dari suspensi disemaikan pada cawan media King’s B (KBA) (Lampiran 4) dan nutrient agar (NA) (lampiran 5) dengan metode cawan sebar. Setelah itu, cawan kultur bakteri diinkubasi dalam ruangan bersuhu kamar (± 25 °C) selama satu minggu. Kemudian, setiap koloni bakteri yang tumbuh diisolasi, dan masing-masing dimurnikan dengan menumbuhkan pada cawan media KBA atau NA dan diberi kode.
2. Uji Daya Hambat Bakteri Filosfir terhadap Xoo
Uji daya hambat terhadap Xoo (hasil percobaan 1) digunakan untuk melihat potensi bakteri yang didapatkan sebagai agens hayati. Masing-masing isolat bakteri filosfir diuji tingkat antagonismenya terhadap Xoo dengan metode Agustiansyah et al. (2010) seperti pada Percobaan 2a. Dari hasil uji dipilih tiga isolat yang paling tinggi potensi antagonismenya terhadap Xoo
untuk digunakan pada percobaan selanjutnya. Hasil dan Pembahasan
Percobaan 1. Isolasi dan Uji Patogenisitas Xanthomonas oryzae pv. oryzae
8
dihasilkan berbeda. Tabel 1 menunjukkan bahwa tingkat keparahan HDB tertinggi dihasilkan oleh isolat yang diperoleh dari metode isolasi ooze (X2) yaitu sebesar 10.5 %. Hasil ini sangat berbeda dengan isolat yang dihasilkan dari metode
Isolat Xoo Tingkat keparahan HDB (%)
X0 0 b
kolom yang sama tidak berbeda nyata uji DMRT pada α = 0.05.
Percobaan 2. Uji Ulang Antagonisme Isolat Rizobakteri Koleksi yang Mampu Mengendalikan Xanthomonas oryzae pv. oryzae
Uji antagonisme rizobakteri koleksi terhadap Xoo hasil percobaan 1 (X2) menunjukkan bahwa isolat P. diminuta A6 memiliki tingkat antagonisme tertinggi dengan zona hambat terbesar yaitu 3.3 cm. Selanjutnya diikuti oleh isolat B.
Tabel 2 Pembentukan zona hambatan oleh isolat rizobakteri koleksi pada biakan patogen Xoo
Rizobakteri koleksi Diameter zona hambat (cm)
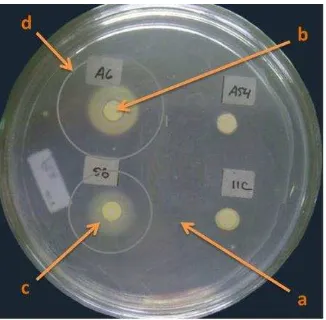
Gambar 2 Pembentukan zona hambat oleh rizobakteri koleksi pada biakan Xoo. Tanda panah: (a) patogen Xoo, (b) kertas saring, (c) rizobakteri, dan (d) zona hambat rizobakteri terhadap Xoo
Secara umum, hasil pengujian ini memastikan bahwa isolat koleksi yang akan digunakan masih memiliki antagonisme yang tinggi terhadap Xoo. Palupi (2012) melakukan uji kompatibilitas pada isolat koleksi tersebut. Hasil pengujian menunjukkan bahwa isolat P. diminuta A6 dan B. subtilis 5B kompatibel sehingga dapat digunakan secara bersamaan untuk mendapatkan efek positif yang maksimal. Menurut Mishra et al. (2013), aplikasi campuran agens hayati fungi dan bakteri yang kompatibel memiliki keunggulan variasi mekanisme pengendalian patogen yang handal dan berpotensi menekan penyakit. Dengan demikian, percobaan-percobaan selanjutnya akan menggunakan kombinasi isolat
P. diminuta A6 dan B. subtilis 5B sebagai agens hayati rizosfir.
Percobaan 3. Isolasi dan Uji Potensi Antagonisme Bakteri Filosfir terhadap Xanthomonas oryzae pv. oryzae
Isolasi menghasilkan 250 isolat. Sebanyak 199 isolat didapatkan dari media NA dan 51 isolat dari media King’s B. Isolasi yang dilakukan tanpa sterilisasi permukaan daun sehingga diduga isolat yang didapatkan dapat berupa bakteri epifit maupun endofit. Isolasi bakteri filosfir dari daun padi dapat dilakukan dengan sterilisasi permukaan untuk mendapatkan bakteri endofit maupun tanpa sterilisasi permukaan untuk mendapatkan bakteri epifit (Santosa et al. 2003). Tabel 3 Zona hambat isolat bakteri filosfir hasil isolasi pada biakan patogen Xoo
Bakteri filosfir Diameter zona hambatan (cm)
F112 2.4 a
F198 2.1 ab
F57 2.0 ab
F108 1.9 abc
F89 1.6 bc
F54 1.5 bc
Bakterisida streptomisin sulfat 0.2% 1.5 bc
F129 1.3 c
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak
10
Gambar 3 Pembentukan zona hambat bakteri filosfir pada biakan Xoo Uji daya hambat terhadap Xoo hasil percobaan 1 (X2) dilakukan dua tahap yaitu tahap pertama untuk seleksi cepat sifat antagonisme terhadap Xoo dan tahap kedua untuk pengujian tingkat antagonisme isolat yang potensial. Hasil pengujian menunjukkan bahwa isolat F112 memiliki antagonisme tertinggi terhadap Xoo yang ditunjukkan dengan diameter zona hambat terbesar dibanding isolat lainnya yaitu 2.4 cm. Zona hambat terbesar berikutnya secara berurutan adalah isolat F198, F57, F108, F89, F54, bakterisida streptomisin sulfat 0.2%, dan F129 dengan diameter secara berurutan 2.1 cm, 2.0 cm, 1.9 cm, 1.6 cm, 1.5 cm, 1.5 cm, dan 1.3 cm (Tabel 3 dan Gambar 3).
Simpulan
1. Isolat Xoo yang diisolasi dari ooze (X2) mampu menghasilkan gejala HDB dengan tingkat keparahan 10.5%.
2. Isolat P. diminuta A6 dan B. subtilis 5B memiliki tingkat antagonisme yang tinggi terhadap Xoo dengan zona hambat masing-masing 3.3 cm dan 2.5 cm. 3. Isolat bakteri filosfir F112, F198, dan F57 memiliki tingkat antagonisme yang
3 PERLAKUAN BENIH DAN PENYEMPROTAN TANAMAN
tanaman padi. Hal ini disebabkan luas serangan dan kerugian terhadap produksi tanaman padi masih sangat besar. Penyebarannya di Indonesia juga sangat luas yaitu di 33 provinsi dengan luas serangan mencapai 56.987 ha dan 38 ha di antaranya mengalami puso pada periode Maret sampai September 2011 (Ditjen Tanaman Pangan 2012). Oleh karena itu, pengendalian HDB merupakan tantangan dan peluang untuk meningkatkan produksi benih padi.Penyakit HDB disebabkan oleh Xanthomonas oryzae pv. oryzae (Xoo). Penyakit ini dapat dibedakan dalam tiga jenis yaitu gejala layu (kresek) pada tanaman muda atau tanaman dewasa yang peka, gejala hawar, dan daun kuning pucat (Balitbang Tanaman Pangan 1991). Kejadian penyakit HDB menjelang panen sudah sangat biasa bagi petani dan sering dianggap pertanda waktu panen. Padahal, penurunan produksi tanaman padi dapat mencapai 61.75% akibat HDB pada tanaman rentan (Kumar et al. 2013).
Pengendalian HDB dapat dilakukan dengan mengendalikan Xoo sebagai patogen penyebabnya. Xoo sendiri dilaporkan merupakan patogen terbawa benih padi (Ilyas et al. 2007; Vikal et al. 2007) sehingga dapat menyebar ke pertanaman melalui penggunaan benih padi yang telah terinfeksi. Selain itu, Xoo juga dilaporkan dapat bertahan hidup di tanah (Ou 1985), gulma tertentu (Mizukami dan Wakimoto 1969), dan jerami tanaman padi (Mary et al. 2001). Penyebaran Xoo dapat dibantu oleh angin (Dath dan Devadath 1983) dan gesekan antar tanaman. Dengan demikian, pengendalian Xoo harus memperhatikan sumber-sumber inokulumnya sehingga dapat dilakukan pengendalian secara efektif.
Fokus pada penelitian ini adalah pengendalian Xoo pada Xoo terbawa benih dan pencegahan infeksi Xoo terhadap tanaman akibat penyebaran Xoo selama masa pertumbuhan tanaman padi. Pengendalian Xoo pada benih padi akan dilakukan dengan perlakuan agens hayati menggunkan bakteri rizosfir yang telah diisolasi oleh Agustiansyah et al. (2010). Sementara itu, pengendalian potensi infeksi Xoo melalui daun akan dilakukan dengan penyemprotan tanaman padi menggunakan agens hayati filosfir. Agens hayati filosfir yang digunakan merupakan hasil isolasi pada percobaan sebelumnya. Keberadaan bakteri filosfir yang antagonis terhadap Xoo pada permukaan tanaman melalui penyemprotan diharapkan mampu mencegah infeksi Xoo yang disebarkan oleh angin dan gesekan tanaman pada tanaman padi.
Tujuan
12
agens hayati filosfir) dalam mengendalikan HDB dan meningkatkan produksi benih padi sehat (bebas Xoo).
Bahan dan Metode
Waktu dan Tempat Percobaan
Percobaan ini dilakukan pada bulan Februari sampai dengan Mei 2013 di Laboratorium Fisiologi dan Kesehatan Benih Departemen Agronomi dan Hortikultura dan Rumah Kaca Kebun Percobaan Cikabayan, Fakultas Pertanian, Institut Pertanian Bogor dan sawah di daerah Bubulak, Kabupaten Bogor, Jawa Barat.
Sumber Benih Padi
Benih padi IR64 yang digunakan adalah benih penjenis berasal dari BB Padi, Balai Penelitian Muara Bogor Jawa Barat. Sebelum digunakan, benih telah disimpan di balai tersebut dalam kemasan karung dan ditempatkan pada ruangan dengan suhu konstan 16 0C selama 8 bulan. Berdasarkan pengujian mutu fisiologis, benih padi IR64 yang digunakan mempunyai daya berkecambah 97% dan indeks vigor 61%.
Percobaan 1. Perlakuan Agens Hayati untuk Mengendalikan Hawar Daun Bakteri dan Meningkatkan Pertumbuhan Tanaman Padi di Rumah Kaca
1. Rancangan Percobaan
Percobaan menggunakan rancangan acak kelompok (RAK) dengan dua faktor dan tiga ulangan. Faktor pertama adalah perlakuan benih yang terdiri atas: A0 (kontrol negatif, benih bebas Xoo), A1 (kontrol positif, benih diinokulasi Xoo), A2 (bakterisida streptomisin sulfat 0.2%), A3 (P. diminuta
A6 + B. subtilis 5B), A4 (matriconditioning + bakterisida streptomisin sulfat 0.2%), dan A5 (matriconditioning + P. diminuta A6 + B. subtilis 5B). Faktor kedua adalah penyemprotan tanaman padi yang terdiri atas: P0 (tanaman tidak disemprot, kontrol), P1 (tanaman disemprot bakterisida streptomisin sulfat 0.2%), P2(tanaman disemprot dengan agens hayati F112), P3 (tanaman disemprot dengan agens hayati F57), dan P4 (tanaman disemprot dengan agens hayati F198). Jika terdapat pengaruh nyata perlakuan pada analisis ragam (taraf kepercayaan 95%), maka dilakukan uji lanjut dengan DMRT. 2. Perlakuan Benih
sulfat 0.2% (A2) dilakukan dengan merendam benih pada larutan bakterisida streptomisin sulfat 0.2%. Perlakuan P. diminuta A6 + B. subtilis 5B (A3) dilakukan dengan merendam benih pada suspensi bakteri tersebut (108 cfu ml -1
). Perlakuan matriconditioning + bakterisida streptomisin sulfat 0.2% (A4) dilakukan dengan melembabkan benih pada media arang sekam dengan perbandingan antara benih : arang sekam : larutan pelembab (larutan bakterisida streptomisin sulfat 0.2%) yaitu 1 : 0.8 : 1.2 (g : g : ml). Sementara itu, perlakuan benih matriconditioning + P. diminuta A6 + B. subtilis 5B (A5) dilakukan dengan melembabkan benih pada media arang sekam dengan perbandingan antara benih : arang sekam : larutan pelembab (suspensi P. diminuta A6 + B. subtilis 5B) yaitu 1 : 0.8 : 1.2 (g : g : ml). Inkubasi dilakukan selama 30 jam pada suhu 25 0C kecuali perlakuan streptomisin sulfat 0.2% yang hanya diinkubasi selama 6 jam.
3. Penanaman dan Pemeliharaan Tanaman
Penanaman dilakukan setelah perlakuan benih. Penanaman dilakukan pada ember plastik berisi tanah lumpur sebanyak 20 butir benih per ember. Pemupukan dilakukan setara dengan dosis 200 kg ha-1 Urea, 50 kg ha-1 SP-36, dan 100 kg ha-1 KCl. Pengairan dilakukan secukupnya agar media tanah tetap macak-macak.
4. Penyemprotan Tanaman dengan Agens Hayati dan Bakterisida
Penyemprotan dilakukan pada 4 dan 5 minggu setelah semai (MSS) terhadap tanaman menggunakan hand sprayer. Penyemprotan dilakukan pada pagi hari sampai seluruh daun terbasahi dan hampir menetes dari daun (1-2 ml per tanaman). Penyemprotan daun terdiri atas P0 (tanaman tidak disemprot, kontrol), P1 (tanaman disemprot bakterisida streptomisin sulfat 0.2%), P2 (tanaman disemprot dengan agens hayati F112), P3 (tanaman disemprot dengan agens hayati F57), dan P4 (tanaman disemprot dengan agens hayati F198).
5. Pengamatan
Pengamatan dilakukan terhadap pertumbuhan tanaman (daya tumbuh benih, bobot kering tanaman, dan tinggi tanaman) dan serangan HDB (tingkat keparahan HDB).
1. Daya tumbuh benih (%)
Daya tumbuh diamati pada 2 minggu setelah semai (MSS) yang dihitung dengan membandingkan jumlah benih yang tumbuh menjadi bibit dengan total benih yang disemai. Daya tumbuh dihitung dengan rumus sebagai berikut:
14
2. Bobot kering tanaman (g per rumpun)
Bobot kering tanaman diamati pada 2 MSS, 4 MSS, 6 MSS, dan 8 MSS. Tanaman dicabut sampai ke akarnya dan dibersihkan dari tanah yang menempel. Tanaman yang sudah dibersihkan kemudian dioven dengan suhu 80 °C selama 24 jam. Setelah dioven, tanaman yang sudah mengering dimasukkan ke dalam desikator selama 30 menit, kemudian ditimbang bobotnya.
3. Tinggi tanaman (cm)
Tinggi tanaman diamati setiap minggu sampai 8 MSS. Pengukuran tinggi tanaman dilakukan dari pangkal batang sampai ujung daun tertinggi.
4. Tingkat keparahan HDB (%)
Tingkat keparahan HDB diamati berdasarkan persentase luas daun terserang dibandingkan luas total permukaan daun.
Percobaan 2. Perlakuan Agens Hayati untuk Mengendalikan Hawar Daun Bakteri dan Meningkatkan Produksi Benih Padi Sehat di Lapangan
1. Rancangan Percobaan
Percobaan menggunakan RAK dengan dua faktor dan tiga ulangan. Faktor pertama adalah perlakuan benih yang terdiri atas: A0 (kontrol negatif, tanpa inokulasi Xoo), A1 (kontrol positif, diinokulasi Xoo), A2 (benih dengan perlakuan bakterisida streptomisin sulfat 0.2%), A3 (benih dengan perlakuan agens hayati P. diminuta A6 + B. subtilis 5B), A4 (benih dengan perlakuan
matriconditioning + bakterisida streptomisin sulfat 0.2%), dan A5 (benih dengan perlakuan matriconditioning + P. diminuta A6 + B. subtilis 5B). Faktor kedua adalah penyemprotan tanaman yang terdiri atas: P0 (tanaman tidak disemprot, kontrol), P1 (tanaman disemprot streptomisin sulfat 0.2%), P2(tanaman disemprot dengan agens hayati F112), P3 (tanaman disemprot dengan agens hayati F57), dan P4 (tanaman disemprot dengan agens hayati F198). Jika terdapat pengaruh nyata perlakuan pada analisis ragam (taraf kepercayaan 95%), maka dilakukan uji lanjut dengan DMRT.
2. Pengolahan Lahan
3. Perlakuan Benih
Benih padi disterilisasi permukaan dengan merendamnya selama 1 menit pada larutan natrium hipoklorit 1% (Ilyas et al. 2007). Kontrol negatif (A0) adalah benih yang tidak diinokulasi Xoo (hasil percobaan 1) setelah disterilisasi. Sementara itu, perlakuan lainya diinokulasi Xoo dengan metode Agustiansyah et al. (2010). Kontrol positif (A1) merupakan benih yang tidak diberi perlakuan setelah inokulasi Xoo. Perlakuan bakterisida streptomisin sulfat 0.2% (A2) dilakukan dengan merendam benih pada larutan bakterisida streptomisin sulfat 0.2%. Perlakuan P. diminuta A6 + B. subtilis 5B (A3) dilakukan dengan merendam benih pada suspensi bakteri tersebut (108 cfu ml-1). Perlakuan matriconditioning + bakterisida streptomisin sulfat 0.2% (A4) dilakukan dengan melembabkan benih pada media arang sekam dengan perbandingan antara benih : arang sekam : larutan pelembab (larutan bakterisida streptomisin sulfat 0.2%) yaitu 1 : 0.8 : 1.2 (g : g : ml). Sementara itu, perlakuan benih matriconditioning + P. diminuta A6 + B. subtilis 5B (A5) dilakukan dengan melembabkan benih pada media arang sekam dengan perbandingan antara benih : arang sekam : larutan pelembab (suspensi P. diminuta A6 + B. subtilis 5B) yaitu 1 : 0.8 : 1.2 (g : g : ml). Inkubasi dilakukan selama 30 jam pada suhu 25 0C kecuali perlakuan streptomisin sulfat 0.2% yang hanya diinkubasi selama 6 jam.
4. Penyemaian, Penanaman, dan Pemeliharaan
Benih padi sebanyak 0.8 kg per perlakuan benih disemai pada petak persemaian hingga bibit berumur 3 MSS. Penanaman bibit dilakukan pada setiap petakan dengan jarak tanam 25 cm x 25 cm. Jumlah bibit yang digunakan adalah tiga bibit per lubang tanam. Pemeliharaan tanaman yang dilakukan meliputi penyulaman, penyiangan, pengairan, dan pemupukan. Penyulaman dilakukan paling lambat 2 minggu setelah pindah tanam (MST). Penyiangan dilakukan pada saat gulma telah mempengaruhi pertumbuhan tanaman. Pengairan dibagi dalam beberapa tahapan, yaitu: 1) pada saat tanam sampai dengan 3 MST, petakan dibuat macak-macak; 2) pada tanaman umur 4-10 MST, petakan diairi setinggi 2 - 5 cm; 3) pada 11 MST sampai dengan fase pembentukan primordia bunga, petakan diairi setinggi 5 cm, dibiarkan mengering sendiri, kemudian diairi kembali, demikian berulang-ulang; 4) pada fase berbunga sampai 10 hari sebelum panen (HSP), petakan diairi terus-menerus setinggi 5 cm, dan 5) pada 10 HSP sampai panen, petakan tidak diairi.
16
5. Penyemprotan Tanaman dengan Agens Hayati dan Bakterisida
Penyemprotan tanaman dengan agens hayati dimaksudkan untuk pencegahan infeksi Xoo terhadap tanaman padi. Oleh karena itu, penyemprotan tanaman dilakukan pada 7 dan 9 MST (gejala HDB belum muncul) menggunakan sprayer ukuran 10 liter sesuai dengan masing-masing perlakuan. Penyemprotan dilakukan sampai seluruh daun terbasahi dan hampir menetes dari daun (dosis 519 L ha-1). Penyemprotan daun terdiri atas P0 (tanaman tidak disemprot, kontrol), P1 (tanaman disemprot bakterisida streptomisin sulfat 0.2%), P2(tanaman disemprot dengan agens hayati F112), P3 (tanaman disemprot dengan agens hayati F57), dan P4 (tanaman disemprot dengan agens hayati F198).
6. Pengamatan
Pengamatan dilakukan terhadap pertumbuhan tanaman (bobot kering bibit, bobot kering brangkasan), hasil (produksi benih per rumpun), kesehatan tanaman (tingkat keparahan HDB), dan kesehatan benih (Xoo terbawa benih).
1. Bobot kering bibit (g per bibit)
Bobot kering bibit diamati pada 3 MSS. Bibit dicabut sampai ke akarnya dan dibersihkan dari tanah yang menempel masing-masing 15 bibit per perlakuan benih. Bibit yang sudah bersih kemudian dioven dengan suhu 80 °C selama 24 jam. Setelah dioven, bibit yang sudah mengering dimasukkan ke dalam desikator selama 30 menit. Setelah itu ditimbang bobotnya dan dirata-ratakan.
2. Bobot kering brangkasan (g per rumpun)
Bobot kering brangkasan diamati saat panen (15 HST). Tanaman dicabut sampai ke akarnya dan dibersihkan dari tanah yang menempel masing-masing lima rumpun per satuan percobaan. Tanaman yang sudah bersih kemudian dioven dengan suhu 80 °C selama 24 jam. Setelah dioven, tanaman yang sudah mengering dimasukkan ke dalam desikator selama 30 menit. Setelah itu ditimbang bobotnya dan dirata-ratakan. 3. Produksi benih (g per m2)
Produksi benih per m2 diamati pada saat panen (14 MST) dengan menimbang gabah bernas (GKG) per rumpun dari rumpun contoh dan dikonversi ke m2 dengan mengkalikannya dengan jumlah rumpun per m2. 4. Tingkat keparahan HDB (%)
5. Patogen terbawa benih (cfu ml-1)
Patogen terbawa benih diuji setelah panen terhadap keberadaan
Xoo menggunakan metode grinding. Metode grinding dilakukan dengan terlebih dahulu 400 butir benih (setara dengan 10 g) disterilisasi permukaan dengan merendamnya selama 1 menit pada larutan natrium hipoklorit 1%. Setelah itu, 400 butir benih ditambahkan aquades steril 90 ml, kemudian digerus. Suspensi hasil gerusan diinkubasi pada suhu 15 °C selama 2 jam. Supernatan diencerkan secara bertingkat sampai 10-5. Kemudian suspensi yang telah diencerkan (10-5) dituangkan dan disebar merata sebanyak 200 µl ke cawan petri yang telah berisi media PSA. Setelah seminggu diinkubasi pada suhu kamar (± 25 °C), koloni Xoo yang terbentuk diamati dan dihitung jumlah koloni yang terbentuk.
Hasil dan Pembahasan
Percobaan 1. Perlakuan Agens Hayati untuk Mengendalikan Hawar Daun Bakteri dan Meningkatkan Pertumbuhan Tanaman Padi di Rumah Kaca
Perlakuan benih memperbaiki daya tumbuh benih. Perlakuan benih dengan
matriconditioning + P. diminuta A6 + B. subtilis 5B meningkatkan daya tumbuh benih secara nyata dibanding kontrol negatif, kontrol positif maupun perlakuan benih lainya. Perlakuan benih matriconditioning + P. diminuta A6 + B. subtilis 5B menghasilkan daya tumbuh benih sebesar 96.9%, sementara kontrol negatif 91.3% dan kontrol positif 93.6% (Tabel 4). Peningkatan daya tumbuh benih pada perlakuan matriconditioning + P. diminuta A6 + B. subtilis 5B disebabkan oleh kombinasi antara agens hayati dan matriconditioning. Agens hayati yang digunakan menghasilkan hormon IAA (Agustiansyah et al. 2010) yang meningkatkan perkecambahan. Hormon IAA mampu meningkatkan perkecambahan (Afifah et al. 2010). Sementara itu, Hacisalihoglu dan White (2006) melaporkan bahwa matriconditioning merupakan perlakuan yang disarankan untuk meningkatkan performa perkecambahan cabai.
Tabel 4 Pengaruh perlakuan benih terhadap daya tumbuh benih
Perlakuan benih Daya tumbuh benih 2 MSS (%)
A0 91.3 bc
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak
18
Benih yang diberi perlakuan matriconditioning + P. diminuta A6 + B. subtilis 5B menghasilkan bobot kering tanaman terbaik yaitu 1.91 g (Tabel 5) daripada perlakuan lain. Hal ini karena agens hayati pada perlakuan tersebut berkembang sehingga memberikan dukungan pertumbuhan yang semakin baik bagi tanaman. Dugaan tersebut mendasari perlakuan P. diminuta A6 + B. subtilis
5B yang walaupun tidak berbeda nyata dengan perlakuan lainnya, namun menunjukkan kecenderungan meningkatkan bobot kering tanaman terbaik setelah
matriconditioning+ P. diminuta A6 + B. subtilis 5B. Sementara itu, penyemprotan tanaman menunjukkan pengaruhnya terhadap bobot kering tanaman secara signifikan. Penyemprotan tanaman tanaman dengan agens hayati F112 dan agens hayati F57 meningkatkan bobot kering tanaman dan merupakan yang terbaik dibandingkan penyemprotan lainnya, masing-masing sebesar 1.78 g dan 1.77 g. Tabel 5 Pengaruh perlakuan benih dan penyemprotan tanaman terhadap bobot
kering tanaman (g per tanaman) pada 8 MSS Perlakuan
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. P0 = kontrol, P1 = bakterisida streptomisin sulfat 0.2%, P2 = agens hayati F112,
P3 = agens hayati F57,P4 = agens hayati F198. Angka yang diikuti huruf yang sama
pada kolom atau baris yang sama menunjukkan tidak berbeda nyata berdasarkan uji
DMRT pada α = 0.05.
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. P0 = kontrol, P1 = bakterisida streptomisin sulfat 0.2%, P2 = agens hayati F112,
P3 = agens hayati F57,P4 = agens hayati F198. Angka yang diikuti huruf yang sama
pada kolom atau baris yang sama menunjukkan tidak berbeda nyata berdasarkan uji
Benih yang diberi perlakuan matriconditioning + P. diminuta A6 + B. subtilis 5B menghasilkan laju pertumbuhan tertinggi dengan menghasilkan tinggi tanaman tertinggi yang lebih baik dibandingkan perlakuan lainnya yaitu sebesar 76 cm (Tabel 6). Sementara itu, pengaruh penyempotan tanaman masih bersifat kecenderungan. Tanaman yang disemprot dengan agens hayati F198 menunjukkan kecenderungan yang lebih baik meningkatkan tinggi tanaman dengan tinggi 73.7 cm. Tidak berpengaruhnya penyemprotan tanaman kemungkinan karena perlakuan agens hayati membutuhkan waktu untuk memberikan dampak positif bagi tanaman. Hal ini terkait dengan adaptasi dan perkembangan agens hayati itu sendiri. Agens hayati membutuhkan waktu untuk beradaptasi dan berkembang mencapai populasi yang optimum untuk dapat mengkolonisasi tanaman. Hal ini terlihat pada penyemprotan tanaman dengan agens hayati F112 dan F57 yang menunjukkan pengaruh setelah 8 MSS terhadap bobot kering tanaman. Sementara itu, matriconditioning + P. diminuta A6 + B. subtilis 5B yang dari awal pertumbuhan telah secara nyata menunjukkan daya dukung terhadap pertumbuhan disebabkan karena efek kombinasi yang saling menguatkan antara matriconditioning dan agens hayati.
Tabel 7 Pengaruh interaksi antara perlakuan benih dan penyemprotan tanaman terhadap tingkat keparahan HDB (%) pada 8 MSS
Perlakuan
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. P0 = kontrol, P1 = bakterisida streptomisin sulfat 0.2%, P2 = agens hayati F112,
P3 = agens hayati F57,P4 = agens hayati F198. Angka dalam satu kolom atau baris
yang diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji
DMRT pada α = 0.05. Huruf kapital ke samping (dalam satu baris) menunjukkan
pengaruh perlakuan benih sedangkan huruf kecil ke bawah (dalam satu kolom) menunjukkan pengaruh penyemprotan tanaman.
20
sulfat 0.2% maupun agens hayati F112. Integrasi plant growth promotion rizobacteria dengan penyemprotan agens hayati lebih efektif untuk mengendalikan bercak bakteri tomat daripada aplikasi secara tunggal (Ji et al.,
2006). Menurut Mishra et al. (2013), aplikasi campuran agens hayati fungi dan bakteri yang kompatibel memiliki keunggulan variasi mekanisme pengendalian patogen yang handal dan berpotensi menekan penyakit.
Percobaan 2. Perlakuan Agens Hayati untuk Mengendalikan Hawar Daun Bakteri dan Meningkatkan Produksi Benih Padi Sehat di Lapangan
Benih padi yang dimatriconditioning dengan bahan pelembab larutan bakterisida streptomisin sulfat 0.2% maupun suspensi P. diminuta A6 + B. subtilis
5B meningkatkan bobot kering bibit. Kedua perlakuan tersebut menghasilkan bobot kering bibit masing-masing 0.22 g dan 0.21 g (Tabel 8) dan merupakan yang terbaik dibandingkan dengan perlakuan lainnya. Hasil ini menunjukkan kecenderungan yang sama dengan bobot kering bibit 2 MSS pada percobaan 1 dimana matriconditioning + bakterisida streptomisin sulfat 0.2% dan
matriconditioning + P. diminuta A6 + B. subtilis 5B juga mampu menghasilkan bobot kering bibit tertinggi dibanding perlakuan lainnya (Tabel 1).
Matriconditioning mempercepat laju perkecambahan (Ilyas 2006) sehingga pertumbuhan lebih cepat. Penambahan agens hayati pada matriconditioing
menambah efektivitas perlakuan benih dalam memacu pertumbuhan karena menghasilkan hormon tumbuh tanaman. Yarnia et al. (2012) melaporkan aplikasi hormon tumbuh tanaman dapat memacu perkecambahan dan pertumbuhan bibit bawang.
Tabel 8 Pengaruh perlakuan benih terhadap bobot kering bibit 3 MSS Perlakuan Bobot kering bibit (g per bibit)
A0 0.14 b
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak
berbeda nyata berdasarkan uji DMRT pada α = 0.05.
Bobot kering brangkasan yang dihasilkan oleh semua perlakuan benih, penyemprotan tanaman, dan interaksinya tidak berpengaruh nyata (Tabel 9). Perlakuan benih matriconditioning + bakterisida streptomisin sulfat 0.2% dan
tersebut sehingga tidak terlihat pada fase pertumbuhan selanjutnya. Pengamatan terhadap bobot kering brangkasan menunjukkan kecenderungan penyemprotan tanaman dengan agens hayati F112 menghasilkan bobot kering brangkasan tertinggi yaitu 56.5 g. Data percobaan 1 yang menunjukkan bahwa penyemprotan tanaman padi dengan agens hayati F112 meningkatkan bobot kering tanaman pada 8 MSS memperkuat kecenderungan ini walaupun pada fase pertumbuhan yang lebih awal. Santosa et al. (2003) melaporkan bahwa bakteri filosfir dapat meningkatkan bobot kering tanaman padi varietas IR64.
Tabel 9 Pengaruh perlakuan benih dan penyemprotan tanaman terhadap bobot kering brangkasan (g per rumpun)
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. P0 = kontrol, P1 = bakterisida streptomisin sulfat 0.2%, P2 = agens hayati F112, P3 = agens hayati F57,P4 = agens hayati F198.
Tabel 10 Pengaruh perlakuan benih dan penyemprotan tanaman terhadap produksi benih (g per m2)
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. P0 = kontrol, P1 = bakterisida streptomisin sulfat 0.2%, P2 = agens hayati F112, P3 = agens hayati F57,P4 = agens hayati F198.
22
Epidemi HDB yang terjadi sebelum inisiasi malai secara nyata menurunkan hasil panen, fertilitas malai, dan berat gabah (Reddy et al. 1979). Namun, kecenderungan data menunjukkan bahwa benih yang diberi perlakuan
matriconditioning + streptomisin sulfat 0.2% menghasilkan produksi benih tertinggi yaitu 361 g per m2 (Tabel 10). Sementara itu, tanaman yang disemprot dengan agens hayati A112 cenderung menghasilkan produksi benih terbanyak daripada perlakuan lainnya yaitu 337 g per m2. Moubark dan Abdel-monaim (2011) melaporkan bahwa perlakuan benih dan tanah dengan B. subtilis dan B. megaterium meningkatkan produksi benih gandum.
Tingkat keparahan HDB terjadi cukup tinggi dan semua perlakuan tidak berpengaruh (Tabel 11). Hal ini menunjukkan bahwa serangan patogen Xoo yang bersumber dari lapangan sangat tinggi dan belum mampu dikendalikan oleh perlakuan yang diberikan. Selain itu, banyaknya sumber inokulum Xoo di lapangan menjadi faktor penting yang menyebabkan Xoo mampu menginfeksi tanaman sampai panen. Saluran irigasi pada lahan sawah yang terinfeksi akan menjadi media penyebaran patogen ke lahan sawah yang lain (Suparyono et al. 2003). Selain itu, pemupukan N juga dapat memicu tingginya keparahan HDB yang terjadi. Pemupukan N mampu meningkatkan tingkat keparahan HDB pada tanaman padi (Myint et al. 2007).
Pengaruh perlakuan benih dan penyemprotan tanaman yang belum terlihat mengindikasikan bahwa baik bakterisida streptomisin sulfat maupun P. diminuta
A6 + B. subtilis 5B yang digunakan belum mampu menekan populasi patogen Xoo yang tinggi di lapangan. Selain itu, faktor kompetisi P. diminuta A6 + B. subtilis 5B dengan mikroorganisme indegenous di lapangan tersebut juga diduga menyebabkan pengendalian P. diminuta A6 + B. subtilis 5B terhadap Xoo tidak maksimal. Hal ini dikarenakan P. diminuta A6 + B. subtilis masih harus berkompetisi mendapatkan nutrisi dan ruang tumbuh sehingga perkembangan populasinya menjadi lambat dan pada akhirnya gagal mengkolonisasi tanaman padi. Kondisi ini kemungkinan dapat diatasi dengan peningkatan frekuensi aplikasi agens hayati di lapangan tersebut.
Tabel 11 Pengaruh perlakuan benih dan penyemprotan tanaman terhadap tingkat keparahan HDB (%) pada 12 MST
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
Pada kondisi lapangan yang tidak sehat (inokulum patogen banyak), pengendalian secara langsung pada patogen target kemungkinan tidak akan efektif. Hal ini dikarenakan sumber inokulum dan tanaman inang sekunder (gulma) masih akan tetap hidup dan terus mendukung perkembangan patogen tersebut. Oleh karena itu, pada konteks lapangan yang seperti ini seharusnya pengendalian patogen baik secara hayati maupun kimiawi harus diintegrasikan dalam pengendalian hama penyakit terpadu. Aplikasi agens hayati untuk mengendalikan penyakit seharusnya diintegrasikan dengan kultur teknis (pemilihan lahan, rotasi tanaman, pengolahan lahan, penggunaan pupuk secara tepat, pengaturan air) dan tanaman yang tahan terhadap penyakit (Pal et al. 2006).
Jika dilihat dari segi perbaikan kesehatan lahan, perlakuan agens hayati rizosfir perlu dilakukan terus menerus agar mampu bersaing dengan patogen Xoo dan mampu lebih maksimal mendukung pertumbuhan tanaman padi pada musim-musim selanjutnya. Sementara itu, aplikasi agens hayati filosfir melalui penyemprotan tanaman kemungkinan terkendala ektrimnya ekologi filosfir daun padi. Peluang tercuci, sedikit nutrisi, paparan ultraviolet merupakan kendala perkembangan agens hayati filosfir. Pada konteks ini, penyemprotan agens hayati filosfir dapat dipandang sebagai metode pencegahan dan pelengkap pengendalian HDB oleh agens hayati rizosfir. Keberhasilan agens hayati filosfir dalam mendukung pengendalian HDB terletak pada kesiapan agens hayati filosfir dalam mengkolonisasi tanaman sebelum Xoo menginfeksi tanaman padi.
Tabel 12 Pengaruh perlakuan benih dan penyemprotan tanaman terhadap Xoo
terbawa benih (x 107 cfu ml-1)
Keterangan: A0 = kontrol negatif, A1 = kontrol positif, A2 = bakterisida streptomisin sulfat 0.2%, A3 = isolat P. diminuta A6 + B. subtilis 5B, A4 = matriconditioning + bakterisida streptomisin sulfat 0.2%, A5 = matriconditioning + P. diminuta A6 + B. subtilis
5B. P0 = kontrol, P1 = bakterisida streptomisin sulfat 0.2%, P2 = agens hayati F112, P3 = agens hayati F57,P4 = agens hayati F198.
24
padi yang tumbuh dari benih yang terinfeksi Xoo. Dengan demikian, untuk mendapatkan benih yang sehat, tanaman padi harus bebas dari serangan HDB.
Simpulan
1. Hasil percobaan di rumah kaca menunjukkan, perlakuan benih dengan
matriconditioning + P. diminuta A6 + B. subtilis 5B di rumah kaca meningkatkan daya tumbuh benih dari 93.6% menjadi 96.9%, tinggi tanaman dari 70.9 cm menjadi 76 cm, bobot kering tanaman dari 1.35 g menjadi 1.91 g. Penyemprotan tanaman padi menggunakan agens hayati A112 meningkatkan bobot kering tanaman dari 1.40 g menjadi 1.78 g. Sementara itu, benih yang diberi perlakuan matriconditioning + P. diminuta A6 + B. subtilis 5B diikuti dengan penyemprotan tanaman pada umur 4 dan 5 MSS dengan agens hayati F112 menurunkan tingkat keparahan HDB pada padi dari 10% menjadi 1.3%.
2. Hasil percobaan di lapangan menunjukkan, perlakuan benih dengan
4 PEMBAHASAN UMUM
Penelitian ini diawali dengan isolasi patogen Xoo penyebab HDB. Isolasi dilakukan pada tanaman padi bergejala HDB di daerah Darmaga, Bogor Jawa Barat. Isolat yang didapatkan berasal dari dua sumber yaitu Xoo yang diisolasi dari pencacahan daun bergejala HDB dan dari ooze yang disekresikan tanaman padi pada pagi hari. Kedua isolat tersebut kemudian diuji patogenisitasnya dalam menghasilkan gejala HDB yang dibandingkan dengan isolat Xoo dari BB Padi dan kontrol (aquades). Hasil penelitian menunjukkan bahwa ooze yang diisolasi dari tanaman padi dapat dijadikan inokulum Xoo dan mampu menghasilkan gejala HDB melalui uji patogenisitas metode gunting dan merupakan yang terbaik daripada isolat lainnya. Gejala yang dihasilkan berciri bagian daun yang terluka akan berlendir, daun layu dan berwarna hijau keabu-abuan, pada tahap akhir, daun yang terserang akan mengering dan berwarna kuning keabua-abuan seperti daun tua (Suparyono et al. 2003). Pada media YDCA Xoo menunjukkan ciri berwarna kuning, bulat, tepi rata, permukaan cembung, dan kental (Jabeen et al. 2012).
Pengujian ulang antagonisme isolat bakteri rizosfir koleksi Agustiansyah et al. (2010) terhadap Xoo dari ooze dilakukan untuk mengkonfirmasi kemampuan isolat bakteri koleksi untuk menghambat pertumbuhan Xoo yang telah diisolasi. Percobaan ini juga dilakukan untuk mengantisipasi tidak antagonisnya isolat koleksi karena perbedaan asal Xoo dan kemungkinan patotipe yang berbeda. Hasil pengujian menunjukkan bahwa bakteri rizosfir koleksi masih memiliki antagonisme terhadap Xoo hasil isolasi. Isolat P. diminuta A6 dan B. subtilis 5B merupakan isolat tertinggi antagonismenya terhadap Xoo. Pengujian kompatibiltas kedua isolat tersebut telah dilakukan oleh Palupi (2012) yang menyatakan bahwa kedua isolat tersebut kompatibel untuk digunakan bersamaan. Dengan demikian, pemanfaatan kedua isolat tersebut secara bersamaan dalam perlakuan benih untuk mengendalikan Xoo terbawa benih dapat dilakukan pada percobaan selanjutnya (Bab 3 Percobaan di rumah kaca dan di lapangan).
Filosfir tanaman merupakan salah satu ekologi bakteri. Bakteri yang mampu hidup pada filosfir tanaman biasanya harus adaptif terhadap kurangnya nutrisi dan paparan sinar ultraviolet. Permukaan tanaman sendiri merupakan salah satu pintu masuk bagi patogen untuk menginfeksi tanaman. Stomata, hidatota, maupun luka merupakan pintu masuk bagi patogen untuk masuk ke tanaman melalui daun (Baker et al. 2010). Oleh karena itu, pada penelitian ini dilakukan isolasi bakteri filosfir yang mampu mengendalikan Xoo sehingga tidak menginfeksi tanaman padi. Isolasi dilakukan dengan dua kategori daun berbeda. Pertama, daun bergejala HDB. Pada daun tersebut diduga ada persaingan infeksi antara Xoo dengan bakteri agens hayati pada batas antara bagian yang sehat dan bergejala HDB pada daun tersebut. Pada kondisi tersebut, diharapkan bakteri yang antagonis terhadap Xoo dapat diisolasi. Kedua, daun sehat pada hamparan tanaman padi yang bergejala HDB. Pada kondisi ini diduga ada mekanisme pertahanan tanaman tersebut sehingga tidak begejala HDB. Mekanisme tersebut diharapkan merupakan interaksi antara bakteri filosfir dengan tanaman padi untuk menghabat Xoo menginfeksi tanaman. Isolasi pada tanaman tersebut diharapkan mendapatkan bakteri filosfir yang antagonis terhadap Xoo.
26
kemungkinan bahwa yang diisolasi dapat berupa bakteri endofit maupun epifit. Suspensi dari perendaman cacahan daun disebar pada dua media pertumbuhan bakteri yaitu nutrient agar (NA) dan King’s B agar (KBA). Media NA digunakan untuk menumbuhkan bakteri-bakteri dengan spektrum yang luas karena NA merupakan media yang sesuai untuk banyak spesises bakteri. Sementara itu, media KBA digunakan untuk mengisolasi spesies Pseudomonas yang mampu berfluorescens. Spesies Pseudomonas yang mampu berfluorescens telah banyak dilaporkan kemampuanya sebagai agens hayati.
Isolasi menghasilkan 250 isolat. Sebanyak 199 isolat didapatkan dari media NA dan 51 isolat dari media KBA. Keseluruhan isolat tersebut diuji antagonismenya terhadap Xoo yang menghasilkan tujuh isolat potensial. Ketujuh isolat dan bakterisida strepsomisin sulfat 0.2% (kontrol) kemudian diuji dan bandingkan antagonismenya terhadap Xoo. Hasil pengujian menghasilkan bahwa agens hayati filosfir F112, F198, dan F57 secara berurutan merupakan isolat dengan antagonisme tertinggi terhadap Xoo. Dengan demikian, ketiga isolat tersebut akan diuji efektivitasnya dalam mengendalikan Xoo pada skala rumah kaca dan lapang pada percobaan selanjutnya.
Pemanfaatan bakteri rizosfir pada perlakuan benih dan bakteri filosfir pada penyemprotan daun untuk mengendalikan HDB dan meningkatkan pertumbuhan bibit padi dilakukan di rumah kaca. Benih yang digunakan adalah benih padi varietas IR64 yang rentan terhadap HDB. Hal ini dimaksudkan agar gejala HDB dan efektivitas perlakuan dapat teramati dengan jelas. Benih yang akan digunakan sebelumnya diinokulasi dengan Xoo (hasil isolasi dari ooze) dengan metode Agustiansyah et al. (2010). Kemudian benih tersebut diberi perlakuan benih sesuai dengan rancangan menggunakan agens hayati rizosfir. Setelah berumur 4 dan 5 MSS dilakukan penyemprotan tanaman menggunakan agens hayati filosfir hasil isolasi.
Hasil penelitian menunjukkan bahwa daya tumbuh benih dapat ditingkatkan dengan perlakuan matriconditioning + P. diminuta A6 + B. subtilis 5B. Peningkatan daya tumbuh ini hampir mencapai nilai daya berkecambah benih tersebut di laboratorium. Peningkatan tersebut merupakan kombinasi efek perbaikan performa perkecambahan dan penekanan Xoo. Perbaikan performa perkecambahan didapatkan melalui perlakuan matriconditioning yang mampu memperbaikan kondisi internal benih melalui imbibisi terkendali. Selain itu, produksi IAA oleh P. diminuta A6 + B. subtilis 5B yang sebelumnya telah dilaporkan oleh Agustiansyah et al. (2010) juga berperan dalam memacu perkecambahan benih. Sementara itu, penekanan Xoo oleh agens hayati mengurangi dampak Xoo pada fase perkecambahan sehingga perkecambahan dapat ditingkatkan.
Bobot kering tanaman juga dapat ditingkatkan melalui perlakuan benih