KONDISI SANITASI PERALATAN DAN AIR PADA
TAHAPAN PRODUKSI KEJU MELALUI PENGUJIAN
JUMLAH TOTAL MIKROORGANISME DAN KOLIFORM
ICA ANTIKA
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kondisi Sanitasi Peralatan dan Air pada Tahapan Produksi Keju Melalui Pengujian Jumlah Total Mikroorganisme dan Koliform adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Ica Antika
NIM B04090197
ABSTRAK
ICA ANTIKA. Kondisi Sanitasi Peralatan dan Air pada Tahapan Produksi Keju Melalui Pengujian Jumlah Total Mikroorganisme dan Koliform. Dibimbing oleh HERWIN PISESTYANI.
Sanitasi peralatan dan air sangat penting dalam industri pangan. Sanitasi peralatan dan air yang buruk dapat menjadi sumber kontaminasi pada produk akhir sehingga terjadi penurunan mutu dan kualitas produk pangan. Tujuan dari penelitian ini adalah mengetahui kondisi sanitasi peralatan dan air yang digunakan dalam produksi keju berdasarkan jumlah total mikroorganisme dan jumlah koliform. Sampel terdiri dari 18 peralatan, air dan larutan air garam, yang diambil 5 kali selama 5 minggu. Pemeriksaan jumlah total mikroorganisme dan jumlah koliform menggunakan metode hitungan cawan, sedangkan pemeriksaan jumlah koliform dalam air menggunakan metode most probable number. Jumlah total mikroorganisme dan jumlah koliform tertinggi pada tahapan sebelum pasteurisasi terdapat pada mangkuk separator (85679.4 ± 143127.6 cfu/cm2 dan 7564.1 ± 1490.9 cfu/cm2). Pada tahapan pasteurisasi dan pembentukan bakal keju, jumlah total mikroorganisme dan jumlah koliform tertinggi terdapat pada ember air panas (54096.6 ± 76801.7 cfu/cm2 dan 12950.0 ± 17726.1 cfu/cm2). Tahapan pencetakan dan penggaraman menunjukkan jumlah total mikroorganisme (20722.0 ± 30613.7 cfu/cm2) dan jumlah koliform (2881.7 ± 4875.3 cfu/cm2) tertinggi pada keranjang keju. Pada tahapan pemeraman, jumlah total mikroorganisme tertinggi terdapat pada bak coating (18150.0 ± 33448.5 cfu/cm2), sedangkan jumlah koliform tertinggi terdapat pada rak pemeraman keju (2728.7 ± 4908.8 cfu/cm2). Larutan air garam memiliki jumlah total mikroorganisme dan jumlah koliform lebih tinggi daripada air (45123.6 ± 88988.1 cfu/ml dan 11.0 ± 0.0 MPN/ml). Jumlah total mikroorganisme dan jumlah koliform yang tinggi pada peralatan dan air dalam tahapan produksi keju perlu mendapat perhatian yang lebih serius dari produsen keju. Sanitasi peralatan dan air yang buruk dapat menjadi sumber kontaminasi mikroorganisme patogen pada produk pangan yang dapat menyebabkan kejadian infeksi ataupun keracunan makanan pada konsumen.
Kata kunci: air, keju, peralatan, sanitasi
ABSTRACT
ICA ANTIKA. Condition of Equipment and Water Sanitation in Cheese Production Through Detection of Total Microorganism and Coliform. Supervised by HERWIN PISESTYANI.
Total plate count method (pour plate method) was used to detect the total of microorganisms and coliforms, but the detection of coliform in the water was using the most probable number method. The highest number of total microorganisms and coliforms in separation process was found in separator bowl (85679.4 ± 143127.6 cfu/cm2 and 7564.1 ± 1490.9 cfu/cm2). In the process of pasteurization and formation of cheese curd, the highest number of total microorganisms and coliforms were found in a bucket of hot water (54096.6 ± 76801.7 cfu/cm2 and 12950.0 ± 17726.1 cfu/cm2). The pressing and salting process showed that the highest number of total of microorganisms (20722.0 ± 30613.7 cfu/cm2) and coliforms (2881.7 ± 4875.3 cfu/cm2) were found in cheese basket. During the ripening process, the highest number of total microorganisms was found in the coating tub (18150.0 ± 33448.5 cfu/cm2), whereas the highest number of coliforms was found in the cheese ripening rack (2728.7 ± 4908.8 cfu/cm2). Solution of salt water had the highest total number of microorganisms and coliforms (45123.6 ± 88988.1 cfu/ml and 11.0 ± 0.0 MPN/ml). It is very important to keep monitoring the total number of microorganisms and coliforms found in water and equipments used during the process of cheese production since it could be the sources of pathogen contamination to the food which may cause foodborne illness.
KONDISI SANITASI PERALATAN DAN AIR PADA
TAHAPAN PRODUKSI KEJU MELALUI PENGUJIAN
JUMLAH TOTAL MIKROORGANISME DAN KOLIFORM
ICA ANTIKA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kondisi Sanitasi Peralatan dan Air pada Tahapan Produksi Keju Melalui Pengujian Jumlah Total Mikroorganisme dan Koliform
Nama : Ica Antika
NRP : B04090197
Disetujui oleh
drh Herwin Pisestyani, MSi Pembimbing
Diketahui oleh
drh Agus Setiyono, MS, PhD, APVet Wakil Dekan
PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan YME atas rahmat dan karuniaNya, sehingga skripsi dengan judul Kondisi Sanitasi Peralatan dan Air pada Tahapan Produksi Keju Melalui Pengujian Jumlah Total Mikroorganisme dan Koliform dapat diselesaikan.
Terimakasih penulis sampaikan kepada ibu drh Herwin Pisestyani, MSi selaku dosen pembimbing skripsi yang telah tanpa lelah dan penuh kesabaran membimbing penulis untuk menyelesaikan penulisan ini dengan baik. Tidak lupa juga penulis mengucapkan banyak terimakasih kepada Dr drh Ni Wayan KK, MP selaku dosen pembimbing akademik, Dr drh Denny W. Lukman, MSi; Prof Dr drh Hj Mirnawati B Sudarwanto; Dr drh Hadri Latif, MSi dan Dr drh Trioso Purnawarman, MSi atas dukungan dan bimbingannya selama penelitian. Penulis juga ingin menyampaikan terima kasih kepada Bapak Yuhendra yang telah banyak membantu penelitian ini. Kepada teman-teman satu penelitian (Ka Riris, Puri, dan Anggina) penulis berterima-kasih atas kerjasama dan bantuannya selama penelitian.
Ucapan terima kasih juga disampaikan kepada papa, mama, kakak-kakak, dan keponakan tersayang, serta keluarga besar atas doa, semangat, dan cinta yang telah diberikan. Selanjutnya ucapan terimakasih penulis ucapkan kepada keluarga Geochelone 46 dan Puri Mawar yang sama-sama berjuang dalam menempuh pendidikan di IPB. Penulis menyadari penulisan skripsi ini tidak luput dari kekurangan, untuk itu penulis sangat berterimakasih atas kritik dan saran-saran yang bersifat membangun dari semua pihak demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 1
Manfaat Penelitian ... 1
TINJAUAN PUSTAKA ... 2
Keju ... 2
Tahapan Pembuatan Keju ... 3
Sanitasi Peralatan pada Industri Pangan ... 5
Kualitas Air untuk Industri Pangan ... 6
Jumlah Total Mikroorganisme ... 7
Koliform ... 8
BAHAN DAN METODE PENELITIAN ... 9
Waktu dan Tempat Penelitian ... 9
Alat dan Bahan ... 9
Metode Penelitian ... 9
Jumlah dan jenis sampel ... 9
Cara pengambilan sampel ... 9
Metode Pengujian ... 10
Metode penghitungan ... 11
Penghitungan jumlah total mikroorganisme dan jumlah koliform dengan metode hitungan cawan ... 11
Uji sanitasi dengan swab ... 11
Penghitungan jumlah koliform dengan metode MPN ... 12
Analisis Data ... 12
HASIL DAN PEMBAHASAN ... 12
Sanitasi Peralatan pada Tahapan Produksi Keju ... 12
Kondisi Sanitasi Peralatan pada Tahapan Sebelum Pasteurisasi ... 12
Kondisi Sanitasi Peralatan pada Tahapan Pasteurisasi dan Pembentukan Bakal Keju 13 Kondisi Sanitasi Peralatan pada Tahapan Pencetakan dan Penggaraman Keju ... 14
SIMPULAN DAN SARAN ... 17 DAFTAR PUSTAKA ... 17 RIWAYAT HIDUP ... 20
DAFTAR TABEL
1 Kandungan gizi keju 2
2 Standar keju olahan menurut SNI 01-2980-1992 3 3 Syarat mutu air minum menurut SNI 01-3553- 1996 7
4 Jumlah total mikroorganisme dan jumlah koliform pada peralatan yang
digunakan sebelum pasteurisasi 12
5 Jumlah total mikroorganisme dan jumlah koliform pada peralatan
pasteurisasi dan pembentukan bakal keju 13
6 Jumlah total mikroorganisme dan jumlah koliform pada peralatan
pencetakan dan penggaraman keju 14
7 Jumlah total mikroorganisme dan jumlah koliform pada peralatan
pemeraman 15
8 Jumlah total mikroorganisme dan jumlah koliform dalam air dan larutan air
garam 16
DAFTAR GAMBAR
1 Biakan mikroorganisme pada media PCA 10
PENDAHULUAN
Latar Belakang
Susu adalah produk pangan asal hewan yang mengandung nutrisi, seperti protein, karbohidrat, lemak, vitamin, dan mineral. Selain memiliki banyak manfaat untuk manusia karena nilai gizinya yang tinggi, susu dapat menjadi media pertumbuhan yang ideal untuk berbagai jenis mikroorganisme (Griffith 2000). Kesadaran akan kesehatan dan gizi yang baik menjadikan susu banyak diminati oleh masyarakat di Indonesia sebagai alternatif untuk memenuhi kebutuhan gizi. Konsumsi susu di Indonesia pada tahun 2010 adalah 8.90 kg/kapita/tahun (Ditjennak 2010).
Susu tidak hanya dikonsumsi secara segar, namun juga dapat diolah menjadi berbagai produk olahan seperti susu bubuk, mentega, krim, es krim, yogurt, dan keju (Griffith 2000). Keju adalah salah satu produk olahan susu yang telah digumpalkan atau dikentalkan melalui berbagai tahapan pematangan (Teuber 2000). Kandungan gizi yang terdapat dalam keju antara lain, energi, protein, lemak, kalsium, mineral, vitamin, karbohidrat, folat, dan thiamin (Miller et al. 2007). Keju memiliki beragam jenis antara lain, cottage cheese,
emmenthal, gouda, cheddar, limburger, feta, dan gorgonzola (Produksi keju 2007).
Keju dapat tercemar oleh mikroorganisme patogen selama proses pembuatannya. Cemaran tersebut dapat berasal dari beberapa sumber seperti bahan baku, pekerja, peralatan, ruang produksi, dan sumber air. Cemaran ini dapat pula terjadi pada produk akhir melalui kontaminasi silang dari bahan mentah kepada produk akhir atau terjadi saat distribusi kepada konsumen (Worsfold dan Griffith 2003). Oleh karena itu, diperlukan perhatian lebih untuk menjaga sanitasi peralatan dan air dalam produksi keju, karena peralatan dan air dapat menjadi sumber kontaminasi mikroorganisme patogen yang dapat menyebabkan kejadian infeksi ataupun keracunan makanan pada konsumen.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kondisi sanitasi peralatan dan air yang digunakan pada tahapan produksi keju di salah satu produsen keju lokal di Provinsi Jawa Barat, melalui pengujian jumlah total mikroorganisme dan jumlah koliform.
Manfaat Penelitian
2
TINJAUAN PUSTAKA
Keju
Keju merupakan salah satu bahan pangan yang berasal dari susu. Keju memiliki beberapa jenis, seperti cottage cheese, emmenthal, gouda, cheddar,
limburger, feta, dan gorgonzola (Produksi keju 2007). Tekstur keju dipengaruhi oleh lama waktu penyimpanan, semakin lama disimpan maka tekstur keju menjadi lebih keras. Salah satu jenis keju adalah keju Gouda. Keju Gouda dapat disimpan dalam jangka waktu yang lama, dengan memberi lapisan parafin yang biasanya berwarna kuning atau putih setelah proses pematangan.
Mayoritas keju Belanda memiliki kadar lemak kering 40% dan kadar garam 2.2%. Keju biasanya dibuat melalui proses pasteurisasi, penambahan susu skim, pembekuan susu sapi dengan penambahan rennet dan bakteri starter ( mixed-strain) (Dusterhoft dan van den Berg 2007). Keju memiliki daya simpan yang baik dan kandungan gizi yang lengkap. Kandungan gizi keju disajikan pada Tabel 1.
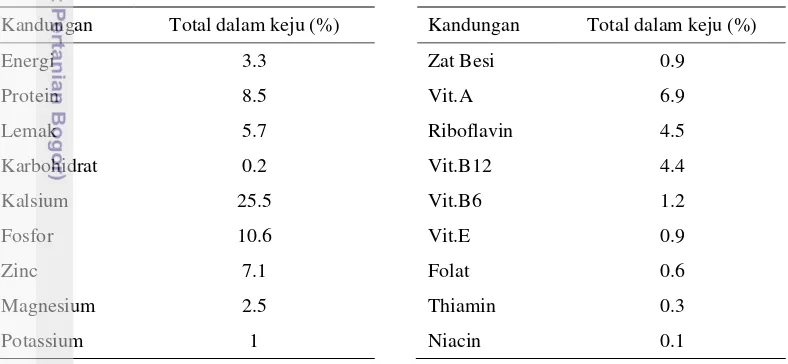
Tabel 1 Kandungan gizi keju (Miller et al. 2007)
Kandungan Total dalam keju (%) Kandungan Total dalam keju (%)
Energi 3.3 Zat Besi 0.9
Protein 8.5 Vit.A 6.9
Lemak 5.7 Riboflavin 4.5
Karbohidrat 0.2 Vit.B12 4.4
Kalsium 25.5 Vit.B6 1.2
Fosfor 10.6 Vit.E 0.9
Zinc 7.1 Folat 0.6
Magnesium 2.5 Thiamin 0.3
Potassium 1 Niacin 0.1
3
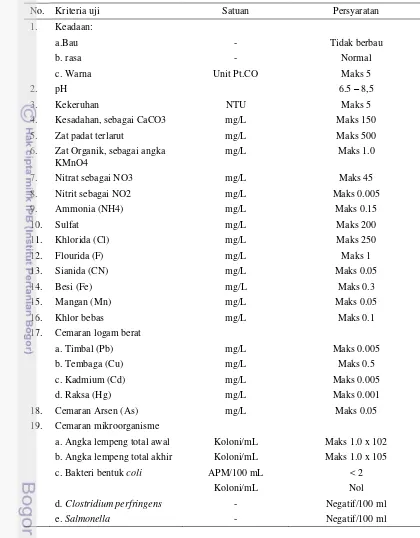
Tabel 2 Standar keju olahan menurut SNI 01-2980-1992 tentang persyaratan kandungan keju (BSN 1992)
No Kandungan Persyaratan
1. Air Maks 45%
2. Protein Min 19.5%
3. Lemak Min 25%
4. Jumlah bakteri Maks 300 koloni/gram
Koliform Maks – 3 APM
Khamir dan kapang Tidak ada
5. Abu Maks 5.5%
6. Bahan tambahan Sesuai yang diijinkan
Tahapan Pembuatan Keju
Pembuatan keju dapat dilakukan dengan atau tanpa pasteurisasi. Pembuatan keju yang dilakukan tanpa pasteurisasi harus dimatangkan dengan cara diperam minimal selama 60 hari pada suhu kurang dari 4 °C. Hal ini dilakukan untuk mencegah terjadinya kontaminasi dari mikroorganisme patogen. Pada tahapan pembuatan keju, susu diberi perlakuan awal berupa pemanasan. Pemberian rennet dan bakteri starter dilakukan setelah susu dingin (Tekno pangan dan agroindustri 1990).
Susu segar yang berasal dari peternak ditampung terlebih dahulu dalam
cooling unit. Susu dipisah menjadi skim dan krim menggunakan separator. Setelah susu diseparasi, susu dialirkan ke wadah untuk dilakukan pasteurisasi. Pasteurisasi dilakukan dengan pemanasan menggunakan suhu 60–65 °C selama 30 menit (low temperature long time/LTLT). Pasteurisasi diharuskan dapat membunuh bakteri yang dapat mempengaruhi kualitas keju, seperti koliform, yang dapat merusak tekstur lebih dini dan rasa tidak enak. Pada tahapan pasteurisasi, bakteri pembentuk spora dapat tahan dan menyebabkan masalah selama proses pematangan. Perlakuan panas dapat mengurangi masalah tersebut, tetapi dapat merusak sifat-sifat umum keju. Salah satu cara yang digunakan untuk mengurangi masalah tersebut, adalah dengan menambahkan bahan kimia (Produksi keju 2007).
4
Bakteri starter yang digunakan dalam pembuatan keju adalah biakan turunan campuran (mixed strain), yaitu dua atau lebih turunan bakteri mesophilik dan thermophilik berada dalam simbiosis mutualisme yang saling menguntungkan. Bakteri starter ini menghasilkan asam laktat, komponen aroma dan karbondioksida (CO2). Karbondioksida sangat penting untuk membuat rongga-rongga di tipe keju butiran (granule) dan tipe mata bundar (round eyed), seperti pada keju Gouda. Secara umum fungsi bakteri starter adalah mengembangkan asam dalam bakal keju dan menahan bakteri yang tahan pasteurisasi (Produksi keju 2007).
Penambahan karbondioksida dilakukan apabila karbondioksida alami hilang saat pemrosesan. Bakal keju yang terlalu halus biasa ditambahkan kalsium klorida (CaCl2). Kalsium klorida yang cukup dapat mengeraskan bakal keju, namun bila berlebihan akan membuat keju sangat keras dan sulit dipotong. Masalah fermentasi juga dapat ditimbulkan apabila keju mengandung bakteri koliform. Bakteri koliform dapat dihambat dengan penambahan garam dengan konsentrasi yang tepat. Konsentrasi garam yang berlebih akan menghambat pertumbuhan bakteri starter dan mempengaruhi proses pematangan serta warna keju. Penambahan pewarna alami pada keju juga dapat dilakukan, seperti karoten, orleana, dan anatto alami (Produksi keju 2007).
Tahapan dari pemberian rennet sampai terbentuknya bakal keju berlangsung selama 30 menit. Uji sederhana dilakukan sebelum bakal keju dipotong, dengan cara menusukkan pisau pada permukaan bakal keju lalu ditarik perlahan sampai timbul retakan. Bakal keju dianggap siap untuk dilakukan pemotongan apabila retakan yang terjadi jelas seperti gelas pecah. Setelah itu dilakukan pengadukan secara lembut, tetapi cukup cepat untuk menjaga agar butiran tidak tercampur dengan whey (Murti 2008).
Pengeringan whey merupakan tahapan lanjutan dari pengadukan. Keju diharuskan tidak mengandung butiran yang banyak terdapat whey, sehingga terkadang dapat ditambahkan langsung air panas ke dalam bakal keju yang masih mengandung whey. Perlakuan panas dilakukan untuk mengatur ukuran dan pengasaman bakal keju. Pemanasan dapat dilakukan dengan tiga cara, yaitu (1)
steam di dalam bak besar, (2) steam di dalam bak besar dengan penambahan air panas, dan (3) penambahan air panas saja. Pemanasan dilakukan dengan suhu 40 °C. Pengadukan dan pemanasan dilakukan selama 1 jam (Blom dan Wereen 2002).
Setelah bakal keju bersih dari whey, bakal keju diberi berbagai macam perlakuan, yaitu dipindahkan langsung ke cetakan dan dilanjutkan dengan proses pengepresan. Pengepresan bertujuan membantu pengeluaran whey akhir, memberikan tekstur, membentuk keju, dan memberi kulit/lapisan pada keju dengan waktu pematangan yang panjang. Tahapan selanjutnya adalah penggaraman (Blom dan Wereen 2002).
5
Penyimpanan merupakan tahapan yang dilakukan setelah penirisan. Pada ruang penyimpanan harus diperhatikan suhu dan kelembabannya, karena setiap jenis keju memiliki suhu dan kelembaban (relative humidity) yang berbeda. Keju disimpan untuk pertama kali di ruang keju “hijau” pada suhu 10–12 °C dan RH sekitar 75%. Setelah itu periode pematangan sekitar 3–4 minggu pada suhu 12– 18 °C dengan RH 80%. Keju dipindahkan ke ruang penyimpanan pada suhu 10–
12 °C dan RH sekitar 75% dan karakteristik keju telah terbentuk (Produksi keju 2007).
Sanitasi Peralatan pada Industri Pangan
Sanitasi berasal dari kata Latin “sanitas” yang berarti sehat. Saniter adalah
ungkapan untuk menyatakan sifat yang berhubungan dengan kesehatan. Sanitasi dalam industri pangan adalah suatu tindakan yang mengarah pada pemeliharaan kondisi sehat. Kondisi tersebut meliputi kondisi yang bukan hanya bebas kontaminan dan dapat menyebabkan keadaan sehat, tetapi juga bebas dari berbagai faktor yang memacu pada keadaan tidak bebas seperti kondisi tempat kerja yang memacu terjadinya penyakit akibat kerja. Aplikasi sanitasi dalam industri pangan meliputi pengendalian terhadap lingkungan produksi, peralatan, proses, dan bahan agar tetap dalam kondisi bersih dan sehat sehingga tidak memfasilitasi terciptanya produk yang berbahaya bagi kesehatan konsumen (Soekidjo 2010).
Pentingnya sanitasi peralatan dan air dalam menjaga keamanan dan kualitas keju menjadikan sanitasi peralatan dan air memiliki pengaruh cukup besar dalam penentuan kualitas produk. Upaya untuk mengurangi jumlah mikroorganisme adalah menjaga sanitasi peralatan yang digunakan, dengan melakukan pencucian dan disinfeksi. Peralatan yang digunakan harus selalu dibersihkan setelah digunakan dan bila perlu menggunakan air panas. Pada beberapa industri, khususnya industri pengolahan susu dan produk lanjutan susu, pipa-pipa saluran atau selang dibuat permanen dengan tersusun rapi dan dibersihkan atau dicuci langsung di tempat dengan sistem cleaning in place (CIP). Sistem CIP digunakan secara optimal untuk membersihkan saluran-saluran, tangki, mesin sentrifugasi, dan homogenisasi. Sistem tersebut kemungkinan akan mempermudah proses disinfeksi peralatan selama proses produksi. Bahan-bahan yang digunakan untuk disinfeksi peralatan yang terbuat dari stainless steel seperti, asam nitrat, asam fosfat, dan golongan alkalin (Susanti 1999).
6
sehingga penggunaan disinfektan menjadi aman, efisien, dan efektif. Perlakuan fisik untuk sanitasi peralatan pada proses pemeraman dapat dilakukan dengan radiasi UV. Waktu kontak radiasi UV harus lebih dari 2 menit, digunakan untuk sanitasi wadah pengemas dan ruang penyimpanan dari kontaminasi mikroorganisme dan virus, sedangkan untuk disinfeksi peralatan kecil (kuas dan pelapis) dapat diberi perlakuan panas 77 °C selama 2 menit dan 77 °C selama 5 menit untuk peralatan pengolahan (Susiwi 2009).
Kualitas Air untuk Industri Pangan
Fungsi air bagi kehidupan tidak dapat digantikan oleh senyawa lain dan air adalah senyawa kimia yang sangat penting bagi kehidupan makhluk hidup. Penggunaan air yang utama dan sangat vital bagi kehidupan adalah sebagai air minum (Sutrisno dan Suciastuti 2002). Dalam UU RI No.7 Tahun 2004 dan Keputusan Menteri Kesehatan Nomor 907 Tahun 2002, air bersih (clean water) adalah air yang digunakan untuk keperluan sehari-hari yang kualitasnya memenuhi syarat kesehatan dan dapat diminum apabila telah dimasak. Syarat air minum, yaitu harus bebas bakteri, zat kimia, racun, limbah berbahaya, dan lain sebagainya. Parameter kualitas air minum yang berhubungan langsung dengan kesehatan adalah uji kualitas mikrobiologik, seperti bakteri E. coli dan total koliform (Susiwi 2009).
Berbagai mikroorganisme patogen seringkali ditularkan melalui air yang tercemar sehingga dapat menimbulkan penyakit pada manusia maupun hewan. Mikroorganisme asal feses yang sering menyebabkan penyakit dan ditularkan melalui air (water-borne disease) adalah E. coli. Selain bakteri, virus dan protozoa dapat ditularkan melalui air, sehingga koliform biasa digunakan sebagai indikator adanya mikroorganisme patogen dalam air (Lay 1994).
Air merupakan bahan penting dalam proses pembuatan keju. Bakteri dalam air dapat mencemari keju, salah satunya melalui penggunaan air untuk mencuci peralatan. Bakteri koliform dalam air dikategorikan menjadi tiga golongan, yaitu koliform total, koliform fekal, dan E. coli. Masing-masing memiliki tingkat risiko yang berbeda. Koliform kemungkinan bersumber dari lingkungan dan tidak mungkin berasal dari pencemaran feses. Sementara itu, koliform fekal dan E. coli
terindikasi kuat diakibatkan oleh pencemaran feses, keduanya memiliki risiko lebih besar menjadi patogen di dalam air.
7
Tabel 3 Syarat mutu air minum menurut SNI 01-3553-1996 (BSN 1996)
No. Kriteria uji Satuan Persyaratan
1. Keadaan:
Jumlah Total Mikroorganisme atau Total Plate Count (TPC)
8
bahan pangan atau peralatan yang diuji. Pengujian jumlah mikroorganisme tersebut bertujuan untuk: (1) mengetahui kualitas mikrobiologik bahan baku (bahan mentah) dan produk akhir, (2) mengetahui kondisi higiene selama proses produksi, (3) menentukan apakah bahan pangan ditangani atau disimpan pada suhu yang tidak sesuai selama proses produksi, transportasi dan penyimpanan, (4) menentukan masa simpan produk, (5) menentukan apakah produk telah sesuai dengan kriteria, spesifikasi atau standar produk, (6) menentukan tingkat pencemaran lingkungan produksi (Lukman et al. 2009).
Ketepatan (accurancy) metode penghitungan ini dipengaruhi beberapa faktor, antara lain: (1) media dan kondisi inkubasi (ketersediaan oksigen, suhu dan waktu inkubasi), (2) kondisi sel mikroorganisme (cedera atau injured cell), (3) adanya zat penghambat pada peralatan atau media yang dipakai, atau yang diproduksi oleh mikroorganisme lainnya, (4) kemampuan pemeriksa untuk mengenal koloni, (5) lelah (fatigue), (6) peralatan, pelarut dan media yang kurang steril, ruang kerja atau bench yang tercemar, (7) pengocokan pada saat pengenceran yang kurang sempurna, (8) adanya artifak yang sulit dibedakan dengan koloni, (9) kesalahan menghitung koloni dan penghitungan yang kurang tepat terhadap koloni yang menyebar atau yang sangat kecil (Lukman et al. 2009).
Koliform
Koliform merupakan bakteri Gram negatif, berbentuk batang, bersifat aerobik atau anaerobik fakultatif. Koliform dibagi menjadi dua kelompok, yaitu koliform fekal seperti Escherichia coli dan non-fekal seperti Enterobacter aerogenes, Klebsiella, dan Serratia (Kornacki dan Johnson 2001). Habitat alami dari koliform adalah di dalam saluran pencernaan dan di lingkungan (tanah dan air). Bakteri ini sering mengontaminasi bahan makanan. Keberadaannya lebih merupakan indikator dari proses pengolahan atau sanitasi yang kurang baik dan keberadaannya dalam jumlah tinggi dalam makanan olahan menunjukkan adanya kemungkinan pertumbuhan dari Salmonella, Shigella, dan Staphylococcus
(BPOM 2008).
Koliform biasa digunakan sebagai indikator kebersihan, karena densitasnya berbanding lurus dengan tingkat pencemaran air. Selain itu, bakteri ini juga memiliki daya tahan yang lebih tinggi daripada bakteri patogen lainnya serta lebih mudah diisolasi dan ditumbuhkan. Berdasarkan Surat Keputusan Dirjen POM Nomor 03726/B/SK/VII/89, angka kuman yang diperbolehkan pada makanan untuk koliform adalah 1 x 102 MPN/g sampel dan E. coli adalah 0 (nol). Keberadaan bakteri E. coli pada makanan menunjukkan bahwa makanan tersebut tercemar kotoran akibat pengolahan dan kebersihan pengolah makanan yang kurang baik. Bakteri E. coli merupakan bakteri patogen yang sering dijadikan indikator sanitasi (BPOM 2008).
9
penelitian, koliform menghasilkan zat etionin yang dapat menyebabkan kanker. Bakteri pembusuk ini dapat memproduksi bermacam-macam racun seperti indol dan skatol yang dapat menimbulkan penyakit bila jumlahnya berlebih di dalam tubuh (Donelly 2007).
BAHAN DAN METODE
Waktu dan Tempat
Penelitan dilakukan pada bulan Maret–September 2012. Pemeriksaan mikrobiologi dilakukan di Laboratorium Kesehatan Masyarakat Veteriner (Kesmavet), Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Sampel swab
peralatan dan air berasal dari produsen keju lokal di wilayah Jawa Barat.
Alat dan Bahan
Alat yang digunakan dalam pengujian adalah cawan petri, Erlenmeyer, botol sampel, cool box, rak dan tabung reaksi, pipet volumetrik ukuran 1 ml, kertas label, spidol marker, kain lap, bunsen, inkubator, cotton swab, jendela swab, dan
vortex.
Bahan yang digunakan adalah plate count agar (PCA Acumedia 7157A),
violet red bile agar (VRB Himedia M049S), buffered pepton water (BPW) 0.1% (Pronadisa 1402.00), Lauryl sulfat triptose broth, dan alkohol 70%.
Metode Penelitian
Jumlah dan Jenis Sampel
Sampel berupa swab peralatan, air, dan larutan air garam yang digunakan dalam proses produksi keju. Jumlah sampel ditentukan secara purposive. Sampel diambil sebanyak 5 kali selama 5 minggu berturut-turut. Swab peralatan, terdiri dari cooling unit, selang transfer susu, bak besar, pengaduk, pisau pemotong bakal keju, ember untuk tempat air panas, saringan pemisahan air whey, cetakan keju, tutup cetakan keju, saringan cetakan keju, kayu tempat penirisan, alas keju fiber, kuas, wadah coating, keranjang untuk membawa keju, dan rak penyimpanan keju.
Cara Pengambilan Sampel
Swab Peralatan
10
Sampel Air dan Larutan Air Garam
Sebanyak 500 ml dari masing-masing sampel dimasukkan ke dalam botol steril. Botol diberi label dan dimasukkan ke dalam cool box, kemudian sampel
swab peralatan dan air dibawa dalam keadaan dingin (suhu 4–10 °C) menuju laboratorium pengujian. Pengujian dilakukan maksimum 24 jam setelah pengambilan sampel.
Metode Pengujian
Jumlah Total Mikroorganisme dan Koliform (Swanson et al. 2001)
Metode yang digunakan dalam menentukan jumlah total mikroorganisme dan jumlah koliform adalah hitungan cawan. Sampel swab peralatan dihomogenkan dalam tabung reaksi berisi 10 ml BPW 0.1% dan dihitung sebagai pengenceran 10-0, sedangkan sampel air dihitung sebagai pengenceran 10-0. Masing-masing sampel dibuat pengenceran 10-1 dan 10-2. Setiap pengenceran ditanam sebanyak 1 ml ke dalam cawan petri, kemudian media agar yang digunakan dituang ke dalam cawan petri tersebut. Sampel dan media dihomogenkan dengan cara memutar cawan petri membentuk angka 8. Setelah media memadat kemudian diinkubasi pada suhu 37 °C selama 24–48 jam. Media agar yang digunakan adalah PCA untuk jumlah total mikroorganisme dan VRB untuk jumlah koliform. Pada pengujian koliform, VRB dituang kembali setelah agar memadat (double layer).
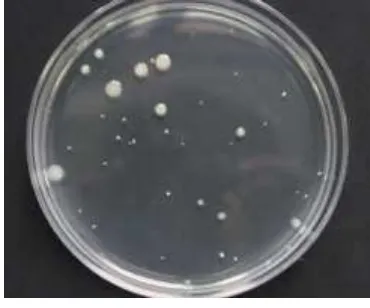
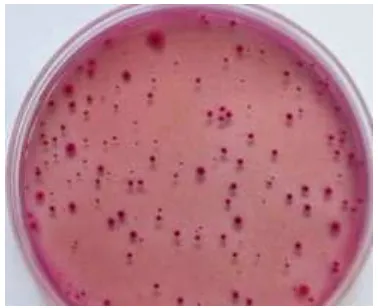
Semua koloni yang tumbuh pada PCA dihitung tanpa terkecuali (Gambar 1). Koloni koliform yang dihitung adalah koloni berbentuk bulat dan berwarna merah muda dengan diameter 0.5 mm (Gambar 2).
11
Gambar 2 Biakan koliform pada media VRB.
Metode yang digunakan untuk menghitung jumlah koliform dalam air dan larutan air garam adalah most probable number (MPN). Metode MPN merupakan metode untuk memperkirakan jumlah mikroorganisme dalam bahan pangan, dengan memupuk suatu tingkat pengenceran ke dalam 3 tabung berisi media cair (lauryl sulfat triptose broth). Tingkat pengenceran yang dipupuk minimal 3 tingkat secara berurutan. Pengenceran dilakukan sama seperti pengenceran pada metode hitungan cawan. Setiap tingkat pengenceran diinokulasi ke dalam media cair steril dengan rasio volume sampel dan volume media adalah 1:10. Setelah itu tabung diinkubasi dalam waterbath dengan suhu 37 °C selama 24–48 jam. Reaksi positif dapat dilihat dari kekeruhan media dan timbulnya gas pada tabung durham.
Metode Penghitungan
Penghitungan Jumlah Total Mikroorganisme dan Jumlah Koliform dengan Metode Hitungan Cawan
Koloni yang tumbuh pada agar diambil datanya apabila jumlah koloni antara 25–250. Apabila koloni yang tumbuh kurang dari 25 dan lebih dari 250, maka penghitungan dilanjutkan pada pengenceran yang lebih tinggi. Koloni yang tumbuh kurang dari 25, dicatat jumlah sebenarnya dari tingkat pengenceran terkecil.
Rumus penghitungan jumlah mikroorganisme:
Jumlah mikroorganisme (cfu/ml) = jumlah koloni x faktor pengenceran
Faktor pengenceran = 1
Tingkat pengenceran
Uji Sanitasi dengan Swab
12
Jumlah mikroorganisme (cfu/cm2) =
hitungan jumlah mikroorganisme (a cfu/ml) x jumlah larutan pengencer (10 ml) luasan contoh (10 cm2)
Penghitungan Jumlah Koliform dengan Metode MPN
Reaksi positif yang didapatkan dari 3 tingkat pengenceran yang berurutan dicatat dan ditentukan nilai MPN dari tabel dengan selang kepercayaan 95%. Nilai MPN diperoleh dengan penghitungan menggunakan rumus (MPN/ml):
MPN/ml = Angka MPN Tabel x Faktor pengenceran tabung di tengah 100
Analisis Data
Data yang diperoleh dari penelitian ini dianalisis secara deskriptif, meliputi jumlah total mikroorganisme dan jumlah koliform.
HASIL DAN PEMBAHASAN
Sanitasi Peralatan pada Tahapan Produksi Keju
Tingkat sanitasi peralatan dari suatu proses produksi pangan dapat dilihat dari kualitas mikrobiologi, diantaranya jumlah total mikroorganisme dan jumlah koliform. Dalam penelitian ini, sampel berasal dari 18 peralatan yang digunakan selama proses produksi keju. Peralatan tersebut dibagi ke dalam empat bagian menurut tipe prosesnya, yaitu sebelum pasteurisasi, pasteurisasi dan pembentukan bakal keju, pencetakan dan penggaraman, serta pemeraman.
Kondisi Sanitasi Peralatan pada Tahapan Sebelum Pasteurisasi
Berdasarkan hasil pemeriksaan mikrobiologik pada peralatan tahapan sebelum pasteurisasi didapatkan jumlah total mikroorganisme dan jumlah koliform tertinggi berturut-turut terdapat pada mangkuk separator (85679.4 ± 143127.6 cfu/cm2 dan 7564.1 ± 1490.9 cfu/cm2). Pada tahapan ini, peralatan yang digunakan adalah cooling unit, mangkuk separator, wadah hasil separator, dan selang susu. Hasil pemeriksaan mikrobiologik pada peralatan yang digunakan dalam proses separasi disajikan pada Tabel 4.
Tabel 4 Jumlah total mikroorganisme dan jumlah koliform pada peralatan yang digunakan sebelum pasteurisasi
Mangkuk separator 85679.4 ± 143127.6 7564.1 ± 1490.9
Wadah hasil separator 13944.0 ± 29772.7 201.0 ± 239.4
Selang susu 14338.6 ± 26569.9 1235.8 ± 2719.1
13
Susu yang digunakan sebagai bahan baku pembuatan keju sebelum dipasteurisasi harus melewati tahapan separasi. Separasi merupakan proses pemisahan susu menjadi skim dan krim dengan sentrifugasi dan menaikkan suhu menggunakan alat separator (Adnan 1984). Peningkatan suhu dalam separator memungkinkan mikroorganisme dalam susu mati, sehingga separasi merupakan salah satu proses yang dapat mengurangi jumlah mikroorganisme. Hasil yang diperoleh dari penelitian ini menunjukkan bahwa jumlah mikroorganisme cukup tinggi pada alat separasi. Separasi dapat menurunkan jumlah mikroorganisme dalam bahan pangan, namun sanitasi dari peralatan yang buruk dapat menyebabkan kontaminasi pada produk akhir.
Pada Tabel 4 terlihat bahwa terdapat pertambahan jumlah total mikroorganisme dan jumlah koliform pada selang susu. Selang susu berfungsi untuk mengalirkan susu yang telah diseparasi menuju bak besar. Jumlah mikroorganisme yang tinggi ini kemungkinan disebabkan selang susu hanya dibersihkan menggunakan air tanpa didisinfeksi lebih lanjut, misalnya menggunakan air panas atau disinfektan. Selang susu yang tidak dibersihkan dengan benar dapat menjadi sumber kontaminasi bagi susu yang telah diseparasi.
Kondisi Sanitasi Peralatan pada Tahapan Pasteurisasi dan Pembentukan Bakal Keju
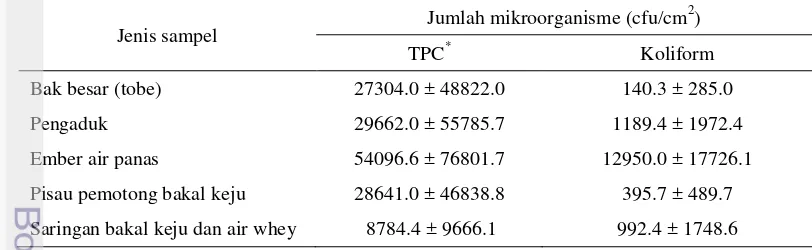
Hasil pemeriksaan ini didapatkan bahwa angka tertinggi jumlah total mikroorganisme dan jumlah koliform terdapat pada ember air panas (54096.6 ± 76801.7 cfu/cm2 dan 12950.0 ± 17726.1 cfu/cm2). Hasil pemeriksaan mikrobiologik pada peralatan pasteurisasi dan pembentukan bakal keju disajikan pada Tabel 5.
Tabel 5 Jumlah total mikroorganisme dan jumlah koliform pada peralatan pasteurisasi dan pembentukan bakal keju
Pengaduk 29662.0 ± 55785.7 1189.4 ± 1972.4
Ember air panas 54096.6 ± 76801.7 12950.0 ± 17726.1
Pisau pemotong bakal keju 28641.0 ± 46838.8 395.7 ± 489.7
Saringan bakal keju dan air whey 8784.4 ± 9666.1 992.4 ± 1748.6
14
Sanitasi yang tidak baik dapat menyebabkan peralatan pasteurisasi dapat terkontaminasi dan mengontaminasi bakal keju.
Pengambilan sampel swab dilakukan sebelum peralatan tersebut digunakan. Jumlah total mikroorganisme dan jumlah koliform yang tinggi pada permukaan ember dimungkinkan karena proses pembersihan tidak dilakukan dengan baik setelah dan sebelum digunakan. Pada penelitian ini, ember digunakan untuk menuang air panas ke dalam bakal keju, seharusnya jumlah mikroorganisme yang terdapat pada permukaan ember dapat dieliminasi dengan adanya air panas. Hal ini kemungkinan dapat mencegah terjadinya kontaminasi silang dari peralatan ke produk.
Proses pencucian atau pembersihan peralatan sangat memengaruhi tingkat kontaminan yang terkandung. Peralatan yang berkontak langsung maupun tidak langsung dengan bahan pangan harus selalu dibersihkan dan didisinfeksi untuk mencegah berkembangnya mikroorganisme. Peralatan yang tidak dibersihkan dengan benar mungkin meninggalkan sisa-sisa bahan pangan yang dapat menjadi media pertumbuhan mikroorganisme (Hayes dan Boor 2001).
Kondisi Sanitasi Peralatan pada Tahapan Pencetakan dan Penggaraman Keju
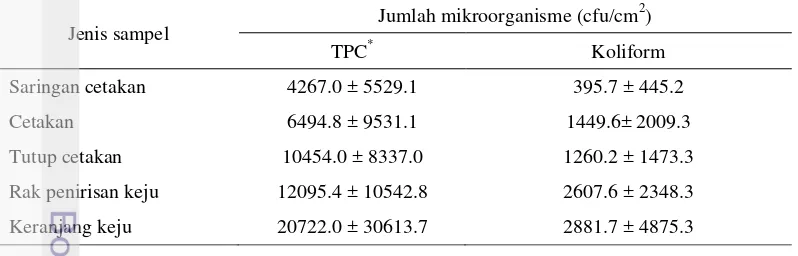
Hasil yang didapatkan dari pemeriksaan mikrobiologik pada peralatan pencetakan dan penggaraman adalah keranjang keju menempati angka tertinggi untuk jumlah total mikroorganisme (20722.0 ± 30613.7 cfu/cm2) dan jumlah koliform (2881.7 ± 4875.3 cfu/cm2). Hasil pemeriksaan mikrobiologik pada peralatan yang digunakan dalam proses pencetakan dan penggaraman keju disajikan pada Tabel 6.
Tabel 6 Jumlah total mikroorganisme dan jumlah koliform pada peralatan pencetakan dan penggaraman keju
Jenis sampel Jumlah mikroorganisme (cfu/cm
2
)
TPC* Koliform
Saringan cetakan 4267.0 ± 5529.1 395.7 ± 445.2
Cetakan 6494.8 ± 9531.1 1449.6± 2009.3
Tutup cetakan 10454.0 ± 8337.0 1260.2 ± 1473.3
Rak penirisan keju 12095.4 ± 10542.8 2607.6 ± 2348.3
Keranjang keju 20722.0 ± 30613.7 2881.7 ± 4875.3
Tahapan pencetakan dan penggaraman merupakan tahapan lanjutan dari tahapan pasteurisasi dan pembentukan bakal keju. Bakal keju dimasukkan ke dalam cetakan dan di-press untuk membentuk tekstur akhir. Proses dilanjutkan dengan perendaman bakal keju di larutan garam 20% selama 24 jam. Selama perendaman, bakal keju dibalik 1 kali sehingga semua permukaan terendam air garam secara merata. Penirisan dilakukan dengan meletakan bakal keju di atas rak yang terbuat dari kayu, kemudian dibawa ke tempat pemeraman menggunakan keranjang keju.
15
sering berkontak langsung dengan pekerja dan lingkungan luar. Keranjang keju terbuat dari kayu, peralatan yang yang terbuat dari kayu mempunyai lekukan dan pori-pori yang banyak sehingga tidak dapat dibersihkan dengan baik, dan mikroorganisme dapat berkembang serta mengontaminasi bahan pangan (Utama 2001). Menurut Rahayu (2006), bahan yang baik digunakan untuk peralatan produksi bahan pangan adalah stainless steel.
Kondisi Sanitasi Peralatan pada Tahapan Pemeraman Keju
Jumlah total mikroorganisme dan jumlah koliform tertinggi berturut-turut terdapat pada bak coating (18150.0 ± 33448.5 cfu/cm2) dan rak pemeraman keju (2728.7 ± 4908.8 cfu/cm2). Jumlah total mikroorganisme pada peralatan pemeraman memiliki angka yang hampir merata. Hasil pemeriksaan mikrobiologik pada peralatan yang digunakan selama proses pemeraman disajikan pada Tabel 7.
Tabel 7 Jumlah total mikroorganisme dan jumlah koliform pada peralatan pemeraman
Jenis sampel Jumlah mikroorganisme (cfu/cm
2
)
TPC* Koliform
Rak pemeraman keju 13322.0± 20290.5 2728.7 ± 4908.8
Kuas coating 18072.0 ± 30041.4 2228.1 ± 3713.4
Bak coating 18150.0 ± 33448.5 298.6 ± 380.7
Pelapis keju 11514.0 ± 20823.4 341.3 ± 360.0
Pemeraman merupakan proses penyimpanan bakal keju dalam tempat penyimpanan khusus. Tempat penyimpanan berisi rak-rak kayu untuk menyimpan keju dan memiliki suhu 14 °C dengan kelembaban 80–84 RH. Sebelum bakal keju diperam, terlebih dahulu dilapisi dengan pelapis keju (parafin). Adanya kontak langsung dengan pekerja, suhu, pH, dan kelembaban sangat mempengaruhi perkembangan mikroorganisme.
Lapisan parafin pada keju berfungsi sebagai pelindung keju dari mikroorganisme yang terdapat di lingkungan luar dan membantu agar keju dapat disimpan lebih lama. Lamanya pemeraman, kelembaban dan perbedaan suhu akan berpengaruh dalam pembentukan keju, sehingga dapat ditentukan jenis keju yang dihasilkan (Produksi keju 2007). Pemeraman merupakan tahap akhir dari proses produksi keju, sehingga banyaknya mikroorganisme pada peralatan tersebut sangat menentukan banyaknya mikroorganisme yang terkandung dalam produk akhir keju. Hal tersebut menunjukkan bahwa pada proses ini sanitasi peralatan yang digunakan harus lebih diperhatikan.
Sanitasi Air dan Larutan Air Garam pada Tahapan Produksi Keju
16
0.0 MPN/ml). Hasil pemeriksaan mikrobiologik pada air dan larutan air garam disajikan pada Tabel 8.
Tabel 8 Jumlah total mikroorganisme dan jumlah koliform dalam air dan larutan air garam
Jenis sampel TPC* (cfu/ml) Koliform (MPN/ml)
Air 354.7 ± 75.0 2.5 ± 4.8
Air garam 45123.6 ± 88988.1 11.0 ± 0.0
Air merupakan bahan penting dalam proses pembuatan keju. Koliform biasa digunakan sebagai indikator adanya mikroorganisme patogen dalam air (Lay 1994). Garam berfungsi sebagai penambah rasa, menghilangkan air yang berlebihan, mengeraskan permukaan keju, melindungi keju agar tidak kering, serta mengawetkan dan memurnikan keju pada saat pemeraman (Produksi keju 2007). Data yang didapatkan dari hasil pemeriksaan mikrobiologik, terlihat bahwa larutan air garam memiliki jumlah total mikroorganisme sangat tinggi. Hal tersebut mungkin terjadi apabila sanitasi wadah larutan air garam buruk, larutan air garam terlalu banyak terpapar lingkungan luar dan penggantian larutan air garam yang tidak sering dilakukan.
Pentingnya Sanitasi Peralatan dan Air dalam Menjaga Keamanan dan Kualitas Keju
Mutu dan keamanan pangan menjadi topik pembicaraan penting bagi kesehatan masyarakat. Kasus keracunan makanan banyak dilaporkan di seluruh dunia, tidak terkecuali di Indonesia. Keamanan pangan sangat terkait dengan praktik sanitasi peralatan dan air di industri pangan. Pentingnya sanitasi peralatan dan air dalam menjaga keamanan dan kualitas keju menjadikan sanitasi peralatan dan air memiliki pengaruh cukup besar dalam penentuan kualitas produk. Peralatan dapat menjadi sumber kontaminasi mikroorganisme patogen ke dalam produk yang dapat menyebabkan foodborne illness.
17
SIMPULAN
DAN SARAN
Simpulan
Pada penelitian ini, tingkat cemaran mikrobiologis pada peralatan yang digunakan untuk produksi keju berbeda di setiap tahapan. Jumlah total mikroorganisme dan koliform tertinggi pada tahapan sebelum pasteurisasi terdapat pada mangkuk separator. Ember air panas merupakan peralatan yang memiliki jumlah total mikroorganisme dan koliform tertinggi pada tahapan pasteurisasi dan pembentukan bakal keju. Jumlah tertinggi dari total mikroorganisme dan koliform pada tahapan pencetakan dan penggaraman terdapat pada keranjang keju. Pada tahapan pemeraman, jumlah total mikroorganisme tertinggi terdapat pada bak coating, sedangkan jumlah koliform tertinggi terdapat pada rak pemeraman keju. Larutan air garam memiliki jumlah total mikroorganisme dan koliform lebih tinggi dari air. Sanitasi peralatan dan air sangat penting dalam produksi keju, dari penelitian ini didapatkan hasil bahwa tahapan yang paling kritis adalah pemeraman keju.
Saran
Upaya dalam menekan kontaminasi dari pekerja dan peralatan adalah dengan meningkatkan higiene pekerja dan sanitasi peralatan. Perlunya pelatihan pada pemilik dan pekerja industri pangan terhadap pentingnya sanitasi peralatan dan air untuk meningkatkan kualitas produk pangan, serta adanya pemantauan sanitasi peralatan dan air secara berkala. Kondisi dan kualitas dari larutan air garam yang digunakan dalam proses penggaraman harus lebih diperhatikan dengan cara: melakukan penggantian larutan air garam secara teratur, sehingga dapat mengurangi jumlah mikroorganisme dan dapat mencegah terjadinya kontaminasi silang.
DAFTAR PUSTAKA
Adnan M. 1984. Kimia dan Teknologi Pengolahan Air Susu. Yogyakarta (ID): Andi Offset.
Blom UKN, Wereen P. 2002. Cheese and cheese-making, with special emphasis on Swedish cheese [Internet]. [diunduh 2013 Apr 10]. Tersedia pada: http://bioscience-explained.org
[BPOM] Badan Pengawas Obat dan Makanan. 2008. Pengujian mikrobiologi pangan Info POM Vol 9:2 [Internet]. [diunduh 2012 Apr 29]. Tersedia pada: http://perpustakaan.pom.go.id/KoleksiLainnya/InfoPOM/0208.pdf.
18
[BSN] Badan Standarisasi Nasional. 1996. SNI 01-3553-1996 tentang Syarat Mutu Air Minum. Jakarta (ID): Badan Standarisasi Nasional.
[Ditjennak] Direktorat Jenderal Peternakan. 2010. Statistik Peternakan 2010
[Internet]. [diunduh 2012 Jul 4]. Tersedia pada: http://www.ditjennak.go.id.
Donelly CW. 2007. Pathogens and food poisoning bacteria. Di dalam McSweeney PLH, editor. Cheese Problems Solved. New York (US): CRC Pr.
Dusterhoft EM and van den Berg G. 2007. Dutch-type cheese. Di dalam McSweeney PLH, editor. Cheese Problems Solved. New York (US): CRC Pr. hlm 230–245.
Griffith MW. 2000. Milk and unfermented milk products. Di dalam: Lund BM, Baird-Parker TC, Gould GW, editor. The Microbiological Safety and Quality of Food. Ed ke-1. Maryland (US): Aspen Pub.
Hayes MC, Boor K. 2001. Raw milk and fluid milk products. Di dalam Marth EH, Steele JL, editor. Applied Diary Microbiology. Ed ke-2, New York (US): Marcell Dekker. hlm 56-76.
Hill AR. 2006. Cheese Technology. Canada (US): Academic Pr.
Kornacki JL, Johnson JL. 2001. Enterobacteriaceae, Colifoms, and Escherichia coli as quality and safety indicators. Di dalam Downess FP, Ito K, editor.
Microbiological Examination of Foods. USA (US): American Public Health Association.
Lay BW. 1994. Analisis Mikroorganisme di Laboratorium. Jakarta (ID): PT Raja Grafindo Persada.
Leclercq AC, Wanegue and Baylac P. 2002. Comparison of fecal Coliform agar and violet red bile lactose agar for fecal coliform enumeration in foods.
Appl Environ Microb. 68(4):1631–1638.
Lukman DW,Sudarwanto M, Sanjaya AW, Purnawarman T, Latif H, Soejoedono RR. 2009. Higiene Pangan. Bogor (ID): KESMAVET FKH IPB. komposisi kimia whey keju. J Indon Trop Agric. 33(2) June 2008.
Produksi keju. 2007 [Internet]. [diunduh 2012 Apr 28]. Netherlands (NL): Wageningen University. Tersedia pada: http://www.food-info.net/id/dairy/cheese-production.htm.
19
Soekidjo N. 2010. Metodologi Penelitian Kesehatan. Jakarta (ID) : Rineka Cipta.
Susanti Y. 1999. Studi pencucian peralatan dan sterilisasi alat produksi susu kental manis di PT. Indomilk, Jakarta [Skripsi]. Bogor (ID): Jurusan Gizi Masyarakat dan Sumberdaya Keluarga Fakultas Pertanian, Institut Pertanian Bogor.
Susiwi S. 2009. Regulasi Pangan. Di dalam: Susiwi S, editor. Dokumentasi SSOP. Bandung (ID): Universitas Pendidikan Indonesia.
Sutrisno T, Suciastuti E. 2002. Teknologi Penyediaan Air Bersih. Jakarta (ID): Rineka Cipta.
Swanson KMJ, Petran RL, Hanlin JH. 2001. Culture methods for enumeration of microorganisms. Dalam Downes FP, Ito K, ed, Compendium of Methods for the Microbiological Examinations of Food. Ed ke–4. Washington, DC (US): APHA.
Tekno pangan dan agroindustri. 1990. Bogor (ID): Jurusan Teknologi Pangan dan Gizi Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Teuber M. 2000. Fermented milk products. Di dalam: Lund BM, Baird-Parker TC, Gould GW, editor. The Microbiological Safety and Quality of Food. Ed ke–1. Maryland (US): Aspen Pub. hlm 535–589.
Utama IMS. 2001. Good Manufacturing Practices. Bali (ID): Dinas Perindustrian dan Perdagangan, Pemerintah Propinsi Bali
20
RIWAYAT HIDUP
Penulis lahir di Bandung, Jawa Barat pada tanggal 3 Juni 1991 sebagai anak kelima dari lima bersaudara dari pasangan Bapak Iwan dan Ibu Roesningsih. Tahun 2009 penulis lulus dari SMA Negeri 5 Bandung dan pada tahun yang sama diterima sebagai mahasiswa Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).