Lampiran 3. (Lanjutan)
Lampiran 4. Gambar tanaman dan daun pugun tanoh [Curanga fel-terrae (Lour.) Merr.]
Tanaman pugun tanoh
Lampiran 5. Gambar simplisia daun pugun aanoh dan serbuk simplisia daun pugun tanoh
Simplisia daun pugun tanoh
Lampiran 6. Hasil pemeriksaan mikroskopik daun pugun tanoh
Keterangan:
a. Kristal kalsium oksalat bentuk prisma b. Tulang daun
c. Rambut berkelenjar
d. Pembuluh angkut bentuk spiral e. Stomata tipe anomositik
f.lStomata tipe diasitik g. Sel tetangga
h. Epidermis bergaris i. Trikoma
a
Lampiran 7. Gambar seperangkat alat sokslet
Lampiran 8. Ekstrak etanol daun pugun tanoh
Lampiran 10. Uji pengaruh etanol terhadap Pheretima posthuma
Cacing Pheretima posthuma
Tanpa perlakuan 0,5 % Hidup 1% Hidup 2% Mati
Lampiran 11. Uji aktivitas antelmintik terhadap Pheretima posthuma
Keterangan : 1: dalam salin (cacing hidup), 2: dalam etanol 0,5 % (cacing hidup), 3: dalam EEDPT 5 mg/ml (cacing mati), 4: dalam EEDPT 10 mg/ml (cacing mati), 5: dalam EEDPT 20 mg/ml (cacing mati), 6: dalam EEDPT 30 mg/ml (cacing mati), 7: Albendazole 20 mg/ml (cacing mati).
1 2
3 4
5 6
Lampiran 12. Larutan uji aktivitas antelmintik terhadap Pheretima posthuma
Lampiran 16. Perhitungan kadar abu total simplisia daun pugun tanoh
% Kadar abu total = x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,0011 0,0498
2. 2,0004 0,0547
3. 2,0057 0,0586
a. % Kadar abu total = x 100% 2,49%
2,0011
0,0498
b. % Kadar abu total = x100% 2,73%
2,0004 0,0547
c. % Kadar abu total = x 100% 2,92%
2,0057 0,0586
Lampiran 17. Perhitungan kadar abu tidak larut asam simplisia daun pugun tanoh
% Kadar abu total = x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,0011 0,0096
2. 2,0004 0,0089
3. 2,0057 0,0077
a. % Kadar abu total = x 100% 0,48%
2,0011 0,0096
b. % Kadar abu total = x100% 0,44%
2,0004
0,0089
c. % Kadar abu total = x 100% 0,38%
2,0057
0,0077
% Rata-rata kadar abu total = 0,43%
3
0,38% 0,44%
Lampiran 21. Perhitungan kadar abu total EEDPT
% Kadar abu total = x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,0050 0,0384
2. 2,0032 0,0366
3. 1,9979 0,0313
a. % Kadar abu total =
1,91% 100%
x 2,0050 0,0384
b. % Kadar abu total = x100% 1,83%
2,0032
0,0366
c. % Kadar abu total = x100% 1,57%
1,9979 0,0313
Lampiran 22. Perhitungan kadar abu tidak larut asam EEDPT
% Kadar abu total = x 100%
No. Berat sampel (g) Berat abu (g)
1. 2,0050 0,0070
2. 2,0032 0,0052
3. 1,9979 0,0074
a. % Kadar abu total = x 100% 0,35%
2,0050 0,0070
b. % Kadar abu total = x100% 0,25%
2,0032
0,0052
c. % Kadar abu total = x100% 0,37%
1,9979
0,0074
% Rata-rata kadar abu total = 0,32%
3
0,37% 0,25%
Lampiran 23. Perhitungan pengenceran etanol
0,1 ml etanol 96% diencerkan dengan 19,9 ml aquadest
-Etanol 1 % = 0,2 ml
0,2 ml etanol 96% diencerkan dengan 19,8 ml aquadest
-Etanol 2% = 0,4 ml
0,4 ml etanol 96% diencerkan dengan 19,6 ml aquadest
-Etanol 4 % = 0,8 ml
0,8 ml etanol 96% diencerkan dengan 19,2 ml aquadest
-Etanol 6 % = 1,25 ml
1,25 ml etanol 96% diencerkan dengan 18,75 ml aquadest
-Etanol 8% = 1,6 ml
1,6 ml etanol 96% diencerkan dengan 18,4 ml aquadest
-Etanol 10% = 2 ml
Lampiran 24. Uji aktivitas antelmintik EEDPT
Waktu Paralisis Pheretima posthuma
Konsentrasi (mg/ml)
Waktu paralisis uji aktivitas
antelmintik (menit) Rata-rata
(menit) SD
I II II
Ekstrak 5 162 158 152 157,33 5,033
Ekstrak 10 88 95 82 88,33 6,506
Ekstrak 20 45 49 48 47,33 2,082
Ekstrak 30 50 47 51 49,33 2,082
Albendazole
20 74 78 80 77,33 3,005
Waktu kematian Pheretima posthuma
Konsentrasi (mg/ml)
Waktu kematian uji aktivitas
antelmintik (menit) Rata-rata
(menit) SD
I II II
Ekstrak 5 238 245 232 238,33 6,506
Ekstrak 10 160 162 152 158 5,292
Ekstrak 20 82 92 86 86,67 5,033
Ekstrak 30 56 51 58 55 3,605
Lampiran 25. Perhitungan penyiapan ekstrak
Perhitungan konsentrasi ekstrak kental daun pugun tanoh dalam 20 ml:
- EEDPT 5 mg/ml = 5 mg/ml x 20 ml = 100 mg
- EEDPT 10 mg/ml = 10 mg/ml x 20 ml = 200 mg
- EEDPT 20 mg/ml = 20 mg/ml x 20 ml = 400 mg
- EEDPT 30 mg/ml = 30 mg/ml x 20 ml = 600 mg
- Albendazole 20 mg/ml = 20 mg/ml x 20 ml = 400 mg
- 0,5 Tween 80 = 0,5 % x 20 ml = 0,1 ml
Kolmogorov-ekstrak 5 mg/ml
ekstrak 10 mg/ml 69,00000* 3,37968 ,000 57,8772 80,1228
ekstrak 20 mg/ml 110,00000* 3,37968 ,000 98,8772 121,1228
ekstrak 30 mg/ml 108,00000* 3,37968 ,000 96,8772 119,1228
albendazole 20 mg/ml 80,00000* 3,37968 ,000 68,8772 91,1228
ekstrak 10 mg/ml
ekstrak 5 mg/ml -69,00000* 3,37968 ,000 -80,1228 -57,8772
ekstrak 20 mg/ml 41,00000* 3,37968 ,000 29,8772 52,1228
ekstrak 30 mg/ml 39,00000* 3,37968 ,000 27,8772 50,1228
albendazole 20 mg/ml 11,00000 3,37968 ,053 -,1228 22,1228
ekstrak 20 mg/ml
ekstrak 5 mg/ml -110,00000* 3,37968 ,000 -121,1228 -98,8772
ekstrak 10 mg/ml -41,00000* 3,37968 ,000 -52,1228 -29,8772
ekstrak 30 mg/ml -2,00000 3,37968 ,973 -13,1228 9,1228
albendazole 20 mg/ml -30,00000* 3,37968 ,000 -41,1228 -18,8772
ekstrak 30 mg/ml
ekstrak 5 mg/ml -108,00000* 3,37968 ,000 -119,1228 -96,8772
ekstrak 10 mg/ml -39,00000* 3,37968 ,000 -50,1228 -27,8772
ekstrak 20 mg/ml 2,00000 3,37968 ,973 -9,1228 13,1228
albendazole 20 mg/ml -28,00000* 3,37968 ,000 -39,1228 -16,8772
albendazole
*. The mean difference is significant at the 0.05 level.
Tukey HSDa
albendazole 20 mg/ml 3 77,3333
ekstrak 10 mg/ml 3 88,3333
ekstrak 5 mg/ml 3 157,3333
Sig. ,973 ,053 1,000
Means for groups in homogeneous subsets are displayed.
Lampiran 27. Data statistik kematian Pheretima posthuma
ekstrak 10 mg/ml Mean 158,0000 3,05505
Konsentrasi
Sig >0,05 maka dapat disimpulkan bahwa data kematian berdistribusi normal
Deskriptif
albendazole 20 mg/ml 3 205,0000 9,53939 5,50757 181,3028 228,6972 196,00 215,00
Total 15 148,6000 71,79017 18,53614 108,8439 188,3561 51,00 245,00
Between Groups 71754,267 4 17938,567 449,213 ,000
Tukey HSD
151,66667* 5,15967 ,000 -168,6476 -134,6858
ekstrak 10 mg/ml -71,33333* 5,15967 ,000 -88,3142 -54,3524
ekstrak 30 mg/ml 31,66667* 5,15967 ,001 14,6858 48,6476
albendazole 20 mg/ml
-118,33333* 5,15967 ,000 -135,3142 -101,3524
ekstrak 30 mg/ml
ekstrak 5 mg/ml
-183,33333* 5,15967 ,000 -200,3142 -166,3524
ekstrak 10 mg/ml
-103,00000* 5,15967 ,000 -119,9809 -86,0191
ekstrak 20 mg/ml -31,66667* 5,15967 ,001 -48,6476 -14,6858
albendazole 20 mg/ml
-150,00000* 5,15967 ,000 -166,9809 -133,0191
albendazole
*. The mean difference is significant at the 0.05 level.
Tukey HSDa
DAFTAR PUSTAKA
Agung dan Tinton (eds). (2008). Buku Pintar Tanaman Obat. Cetakan 1, Jakarta : Agromedia Pustaka. Halaman 64-65.
Asih, A. (2014). Antihelmintik Infusa Daun Andong (Cordyline fruticosa) Terhadap Ascaridia galli secara in vitro. Jurnal. Universitas Atma Jaya Yogyakarta. Halaman 1-10.
Albonico, M., Bickle, Q., Ramsan, M., Montresor, A., Savioli, L., Taylor, M. (2003). Efficacy of Mebendazole and Levamisole Alone or In Combination Against Intestinal Nematode Infections After Repeated Targeted Mebendazole Treatment In Zanzibar. Bull. World Health Organanization. 1(81): 343–352.
Bairagi, A.O., Kabra, dan R.J., Mandade. (2011). Anthelmintic Activity of
Lawsonia inermis L. Leaves in Indian Adult Earthworm. Int of Res Pharm Biol Sci. 2(01): 237-240.
Bhawan, S., Hemalata, S., Sarla, S., Prakash, C.B., Somesh, T. (2011). Anthelmintic Potential of Certain Ethano Medical Plants of Uttarakhand State, India. J Chem Pharm Res. 3(5): 465-467.
Bidkar, J.S., Bhujbal, M.D., Ghanwa, D.D., Dama, G. Y. (2011). Antihelmintic Activity of Citras aurantium Linn. Int J Pharm Res Dev. 3(3): 67-72.
Borah, S., Kakoti, B. B., Mahato, K., dan Kumar, M. (2013). Investigation of in-vitro Anthelmintic Acitivity of Calamus leptospadix Griff. Shoot in Indian Adult Earthworm (Pheretima posthuma).J App Sci 3(06): 156-159.
Budiyanti, R.T. (2010). Efek Antihelmintik Infusa Herba Sambiloto (Andrographis paniculata, Nees) Terhadap Ascaris suum Secara In vitro.Skripsi. Universitas Sebelas Maret, Surakarta. Halaman 1-56.
Choudhary, G.P. (2013). Anthelmintic Activity of Leaves of Coleus aromaticus Benth. Int. J Adv Pharm Bio Chem. 2(4): 609-610.
Dhaked, P.S., Ponigrahy, R.N., Kshirsagar, S. (2011). In-vitro Evaluation of Anthelmintic Activity of Caesalpinia pulcherima (Linn.) Flowers Extracts in Indian Earth Worms. Int J Pharm Sci Rev Res. 7(1): 89-91.
Data, SC. (2003). Fourth Edition Sistematic Botany. New Delhi: New age international (P) ltd. Publishers. Halaman 446.
Direktorat Jenderal Pengawasan Obat dan Makanan. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 319-320.
Direktorat Jenderal Pengawasan Obat dan Makanan. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI.Halaman 3, 7-8, 10, dan 11.
Djatmiko, M., Purnowati, L.D., dan Suhardjono. (2009). Uji Daya Antelmintik Biji Waluh (Cucurbita moschata Durch) Terhadap Cacing Ascaridia galli
Secara In Vitro. Jurnal Ilmu Farmasi dan Farmasi Klinik. 6(1): 12-17.
Dorland, W.A.N (2012). Kamus Saku Kedokteran Dorland Edisi Ke XXVII. Jakarta: Penerbit Buku Kedokteran EGC. Halaman 581.
Entjang, I. (2003). Mikrobiologi dan Parasitologi untuk Akademi Keperawatan dan Sekolah Tenaga Kesehatan yang Sederajat. Bandung: PT. Citra Aditya Bakti. Halaman 229-230.
Fang, H, Ning, D.S., and Liang, X.Y. (2009). Studies on Technology Optimization for Extracting Triterpenoid Saponins from Picria felterrae by Multi-target Grading Method. Zhong Yao Cai. 32(12): 1902-1905.
Fithra, R.S. (2013). Efek Penyembuhan Luka Bakar dari Sediaan Gel Ekstrak Etanol Daun Puguh Tanoh (Curanga fel-terrae (Lour.) Merr.). Skripsi. Medan: Fakultas Farmasi USU. Halaman 10-12.
Fitri, Sri, A. (2005). Uji In Vivo Efek Antelmintik Serbuk Kulit Buah Nanas Bogor Tua Terhadap cacing Lambung Domba. Seminar Nasional Teknologi Peternakan dan Veteiner. Halaman 724-731.
Flohr, C., Tuyen, L.N., Lewis, S., Minh, T.T., Campbell, J., Britton, J., Williams, H., Hien, T.T., Farrar, J., Quinnell, R.J. (2007). Low Efficacy of Mebendazole Against Hook Worm in Vietnam: Two Randomized Controlled Trials. Am. J. Trop. Med. Hyg. Halaman 76, 732–736.
Farnsworth, N.R. (1966). Biological and phytochemical screening of plants. J Pharm Sci. 55(3): 99; 225-276.
Githiori, J.B., Athanasiadou, S., Thamsborg, S.M. (2006). Use of Plants in Novel Approaches for Control of Gastrointestinal Helminths in Livestock with Emphasis on Small Ruminants. Veterinary Parasitology. 139:308-20.
Globinmed. (2015). Detil Data Picria fel-terrae. [Diakses 15 Maret 2015]; Diambil dari file:///H:/penelitian/web/Globinmed%20%20Globinmed.htm.
Harahap, U., Patilaya, P., Marianne, Yuliasmi, S., Husori, D.I., Prasetyo, B.E., Laila, L., Sumantri, I.B., dan Wahyuni, H.S. (2013). Profil Fitokimia Ekstrak Etanol Daun Puguntano [Curanga fel-terrae (Merr.) Lour.)] yang Berpotensi Sebagai Antiasma. Prosiding Seminar Nasional Sains dan Teknologi V Lembaga Penelitian Universitas Lampung.Halaman422-426.
Harborne, J.B. (1987). Metode Fitokimia. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Edisi II. Bandung: Penerbit ITB. Halaman 102-103, 152.
Harfina, F., Bahri, S., dan Saragih, A. (2012). Pengaruh Serbuk Daun Puguntano (Curanga fel-terrae Merr.) Pada Pasien Diabetes Mellitus. Journal of Pharmaceutics and Pharmacology. 2(1): 112-118.
Hoste, H., Jackson, F., Athanasiadou, S., Thamsborg, S.M., dan Hoskin, S.O. (2006). The Effects of Tannin-rich Plants on Parasitic Nematodes in Ruminants. Trends in Parasitology. 22:253-61.
Huang Y, de Bruyne T, Apers S, Ma Y, Claeys M, Pieters L, Vlietinck A. (1999). Flavonoid Glucuronides from Picria fel-terrae. Phytochemistry. 62(8): 1701- 1703.
Huang Y, de Bruyne T, Apers S, Ma Y, Claeys M, van den Berghe D, Pieters L, Vlietinck, A. (1998). Complement-Inhibiting Cucurbitacin Glycosides from Picriafelterrae. Journal of Natural Products. 61(6): 757-761.
Humphries, D., Mosites, E., Otchere, J., Twum, W.A., Woo, L., Jones-Sanpei, H., Harrison, L.M., Bungiro, R.D., Benham-Pyle, B., Bimi, L., Edoh, D., Bosompem, K., Wilson, L.M., Cappello, M.. (2011). Epidemiology of Hookworm Infection in Kintampo North Municipality, Ghana: Patterns of Malaria Coinfection, Anaemia, and Albendazole Treatment Failure. Am. J. Trop. Med. Hyg. Halaman 84, 792–800.
Irianto, K. (2013). Parasitologi Medis. Bandung: Alfabeta. Halaman 350-351.
Jie, M.Z., Li, S.W., Ya, J.G., Zheng, W., and Rui, Z.W., A. (2005). New Picfeltarraenone Glycoside from Picria fel-terrae Merr. Guilin Sanjin Pharmaceutical Co. Ltd. 3:12.
Jeyathilakan, N., Murali, K., Anandaraj, A., Latha, B.R. dan Basith, S.A. (2010). Anthelmintic Activity of Essential Oils of Cymbopogan nardus and
Azadirachta indica on Fasciola gigantica. Tamilnadu J Veterinary and Animal Sciences.6(5): 204-209.
Juwita, N. A. (2009). Karakterisasi simplisia dan uji efek antiinflamasi ekstrak etanol daun pugun tanoh (Curanga fel-terrae Merr.) terhadap mencit jantan. Skripsi. Medan: Fakultas Farmasi USU. Halaman 43-46.
Katikia, L.M., Chagasb, A.C.S., Bizzoc, H.R. (2011). Anthelmintic Activity of
Cymbopogon martini, Cymbopogon schoenanthus and Mentha piperita
Essential Oils Evaluated in Four Different In Vitro Test. Veterinary Parasitology. 183: 103-108.
Kementrian Kesehatan Republik Indonesia. (2015). Kemenkes Berkomitmen Eliminasi Filariasis dan Kecacingan. [diakses 6 Agustus 2015]; Diambil dari :http://www.depkes.go.id/article/view/2382/kemenkes-berkomitmen- eliminasi-filariasis-dan-kecacingan.html.
Kotze, A.C., Cowling, K., Bagnall, N.H., Hines, B.M., Ruffell, A.P., Hunt, P.W., Coleman, G.T. (2009). Relative level of thiabendazole resistance associated with the E198A and F200Y SNPs in larvae of a multi-drug resistant isolate of Haemonchus contortus. Int. J. Parasitol. Drugs Drug. Resist. Halaman 2, 92–97.
Lalchhandama, K. (2010). Anthelmintic Resistance: The Song Remains The Same. Research Review Sa Vis, 10(4): 111-122.
Lansdown, R.V. (2011). Curanga amara. The IUCN Red List of Threatened Species:http://dx.doi.org/10.2305/IUCN.UK.20112.RLTS.T199703A9120 155.en.
Lewis, W. (2003). Medical botany. Plants affecting human health. John Wiley and sons, Inc, Halaman 515.
Leo, L.X. and Weller, P.F. (1996). An update on antiparasitic drugs. N Engl J Med, 334(18): 1178-1184.
Makkar, H. P. S. (1993). Antinutritional Factor in Food for Livestock in Animal Producting inDeveloping Country. British Society of Animal Production. 16: 69-85.
Nitave, S.A., Patil, V.A. (2014). Comparative Evaluation of Anthelmintic Activity of Nerium indicum, Mill Flower Extract and Punica granatum, Linn peel and seed eztract in 1:1 Ratio and their Phytochemical Screening. Wrld J Pharm Pharm Sci. 3(06): 1438-1447.
Padal, S.B., Satyavathi, D. Sandhyadeepika. (2014). Ethnomedical Plants Used For Anthelmintic/Helminthiasis in Visakhapatnam District, Andhrapradesh, India. Int J Ethno Ethno. 1(02): 1-5.
Pagariya, A., Chatur, S., dan Nawab, F. (2013). In Vitro anthelmintic activity of root extract of Murraya koenigii (Linn) Spreng. Int J Pharmaceut Innov.
3(1): 111-114.
Patilaya, P., Husori, D.I. (2015). Preliminary Study on the Anthelmintic Activity of the leaf ethanolic extract of Indonesian Curanga fe-terrae (Lour.) Merr. Int J PharmTech Res. 8(3): 347-351.
Perry, L.M. (1980). Medicinal Plants of East and Southeast Asia. London: The MIT Press. Halaman 384.
Prichard, R.K. (2007). Parasitology: Markers for benzimidazole resistance in human parasitic nematodes?. United Kingdom: Cambridge University Press. 134: 1087-1092.
Prohati. (2015). Detil Data Picria fel-terrae Lour. [Diakses 6 Maret 2015]; Diambil dari http://www.proseanet.org/prohati2/browser.php?docsid=459.
Quattrocchi, F.L.S., Umberto. (2012). CRC World Dictionary of Medicinal and Poisonous Plants, Common Names, Scientific Names, Eponyms, Synonyms, and Etymology. Francis: CRC Press. Halaman 2925.
Ramadhani, D. (2014). Efek relaksasi ekstrak etanol daun pugun tanoh (Curanga fel-terrae (Lour.) Merr.) terhadap otot polos trakea marmut terisolasi dan pengaruhnya pada fosfodiesterase. Skripsi. Medan: Fakultas Farmasi USU. Halaman 36-38.
Rajani, A., Hemamalini, K., Satyavati, D., Begum, A.S.K., Saradhi., N.D.V.R. (2013). Anthelmintic Activity of Methanolic Extract of Rhizomes of
Picrorrhiza kurroa Royal Ex. Benth. Int Res J Pharm 4(8): 143-144.
Ratnawati, D., Supriyati, R., dan Ispamuji, D. (2013). Aktivitas antelmintik ekstrak tanaman putri malu (Mimosa pudicia L) terhadap cacing gelang babi (Ascaris suum L). Posiding Semirata FMIPA Universitas Lampung: Halaman 87-91.
hookworm infections (Ancylostoma duodenale) in the Kimberley region of North West Australia. Acta Trop. Halaman 68, 301-312.
Sanbayu, M.N.F. (2005) Efek Anthelmintik Ekstrak Air Kulit Buah Delima (Punica granatum L.) Terhadap Cacing Gelang (Ascaris Lumbricoides var. suum) Secara In Vitro dan In Vivo.Tesis. Universitas Surabaya. Halaman 19.
Senja, R.Y., Issusilaningtyas, E., Nugroho, A.K., Setyowati, E.P. (2014). The Comparison of Extraction Method and Solvent Variation on Yield and Antioxidant Activity of Brassica oleracea L. Var capitata f. Rubra Extract.
Trad Med J. 19(1): 43-48. (2011). Anthelmintic Activity of Roots and Rhizomes of Corallocarpus epigaeus. J Nat Prod Plant Resour. 1(1): 81-84.
Sitorus, P., Harahap, U., Pandapotan, M., dan Barus, T. (2014). Isolation Of β -Sitosterol From n-Hexane of Picria fel-terrae Lour. Leave and Study Of Its Antidiabetic Effect in Alloxan Induced Diabetic Mice. International Journal of PharmTech Research. 6(1): 137-141.
Soedarto. (2008). Parasitologi Klinik. Surabaya: Airlangga University Press. Halaman 11.
Subash, K.R., Rao, N.J., Cheriyan, B.V., Bhaarati, G.M., Kumar, K. S. (2012). The Antelmintic Activity of Eupatorium triplinerve and Alpinia galanga
in Pheretima posthuma and Ascardia galli: A Comparative Study. J Clin Diag Res. 6(06): 947-950.
Sutherland, I.A., Leathwick, D.M. (2011). Anthelmintic Resistance in Nematode Parasites of Cattle: A Global Issue? Trends Parasitol. Halaman 27, 176–
Tiwow, D., Bodhi, W., dan Kojong, N.S. (2013). Uji Efek Antelmintik Ekstrak Etanol Biji Pinang (Areca catechu) Terhadap Cacing Ascaris Lumbricoides dan Ascaridia Galii secara In Vitro. Pharmacon jurnal ilmiah farmasi UNSRAT.2(2): 79-80.
Tjay, T.H., dan Rahardja, K. (2002). Obat Obat Penting Khasiat, Penggunaan dan Efek-Efek Sampingnya. Edisi keempat. Jakarta.PT Elexmedia komputindo kelompok gramedia. Halaman 196 – 205.
Tjahyanto, A. Dan Salim, C. (eds). (2013). Farmakologi Ulasan Bergambar. Jakarta: EGC. Halaman 513-520.
Tjokropranoto, R., Rosnaeni, Nathania. M.Y. (2011). Anthelmintic Effect of Ethanol Extract of Pare Leaf (Momordica charantia L.) Against Female
Ascaris suum Worm In Vitro, Jurnal Medika Planta. 1(4): 1334-1336. Tyler , V.E. (1976). Pharmacognosy. Lea & Febiger, Philadelphia. Halaman
87-89.
Urban, J., Kokoska, L., Langrova, I., and Matejkova, J. (2015). In Vitro
Anthelmintic Effects of Medicinal Plants Used in Czech Republic. 46(10-11): 808-813.
Vennila V and Nivetha R. (2015). Screening The In vitro anthelmintic activity of
Alternanthera sessilis Leaves. Wrld J Pharm Pharm Sci. 4(04): 1402-1415.
Vercruysse, J., Behnke, J.M., Albonico, M., Ame, S.M., Angebault, C., Bethony, J.M., Engels, D., Guillard, B., Hoa, N.T., Kang, G., Kattula, D., Kotze, A.C., McCarthy, J.S., Mekonnen, Z., Montresor, A., Periago, M.V., Sumo, L., Tchuem Tchuenté, L.A., Thach, D.T., Zeynudin, A., Levecke, B. (2011). Assessment of The Anthelmintic Efficacy of Albendazole in School Children in Seven Countries Where Soiltransmitted Helminths Are Endemic.P Lo S Negl. Trop. Dis. Halaman 29, e948.
Vercruysse, J., Albonico, M., Behnke, J.M., Kotze, A.C., Prichard, R.K., McCarthy, J.S., Montresor, A., Levecke, B. (2011). Is Anthelmintic Resistance a Concern For The Control of Human Soil-Transmitted Helminths?. Int J Paras: Drug and Drug Resistance. 1(2011): 14-27. Vincent, S., Vijayamirtharaj, R., Wilson, P., Saravanan, B., Jeevantham, R.,
Ramesh, R. (2011). Anthelmintic potential of Aerial Part of Clerodendrum phlomidis Linn, Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2(2): 329-333.
Wang LS, Li SH, Zou JM, Guo YJ, Sun HD. (2006). Two New Terpenoids from
Picria fel-terrae. Journal of Asian Natural Product Research. 8(6): 491 -494.
World Health Organization. (2015). Soil-Transmitted Helminth Infections.
[Diakses 18 Juli 2015]; diambil dari http://www.who.int/media centre/factsheets/fs366/en/.
World Health Organization. (2011). Quality Control Methods For Medicinal Plant Material. Switzherland: WHO. Halaman 19-25.
Wink, M. (2012). Medical plants: A Source of Anti Parasitic Secondary Metabolites. Molecules. 17: 12771-12791.
Wynn, S.G., Fougere, B.J. (2007). Introduction: Why Use Herbal Medicine. Dalam: Wynn, S.G., Fougere, B.J. (Ed). Veterinary Herbal Medicine: Library of Congress Cataloging-in Publication Data. ISBN: 10:0-323-029981.
Zhong, S.Q., Zhang, B.N., dan Huang, F.X. (1979). An Anti-Tumor Herb Cucao. China: Chin Tradit Herb Drugs Lett 3. Halaman 45–46.
Zou JM, Wang LS, Ma XM, Shi RB, Guo YJ. (2004). Isolation and Identification of A New Cucurbitacin from Picria fel-terrae. Acta Pharmacutica Sinica. 39(11): 910-912.
Zou JM, Wang LS, Niu XM, Sun HD, Guo YJ. (2005). Phenylethanoid Glycosides from Picria felterrae Lour. Journal of Integrative Plant Biology. 47(5): 632-636.
BAB III
METODE PENELITIAN
Penelitian ini merupakan penelitian eksperimental untuk mengamati efek
ekstrak etanol daun pugun tanoh dalam berbagai konsentrasi terhadap waktu
paralisis dan waktu kematian cacing Pheretima posthuma. Penelitian dilakukan
dalam beberapa tahap meliputi penyiapan sampel, penyiapan hewan percobaan,
pembuatan simplisia dan ekstrak etanol daun pugun tanoh beserta karakterisasi
dan skrining fitokimia, uji aktivitas antelmintik ekstrak etanol daun pugun tanoh
dan analisis data.
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi blender
(Panasonik), timbangan (Vibra AJ), mikroskop (Olympus), cawan datar (Coors),
erlenmeyer, beaker glass, corong, alat destil, alat soklet, labu tentukur (Pyrex),
tabung reaksi, pipet ukur (Iwaki Pyrex), oven (Dynamica), heating mentle
(Boeco), labu alas bulat 500 ml (Duran), rotary evaporator (Stuart), cawan petri
(CMSI), stopwatch (Croos), desikator (Iaswerk werti), bola karet (D&N),
lumpang dan alu, lemari pengering, penangas air, krus porselin, spatula dan cawan
alas bulat.
3.1.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian adalah daun pugun tanoh,
etanol 96% (Rudang Jaya) berkualitas teknis, bahan kimia lainnya berkualitas pro
0,5 N, kalium iodida, α-naftol, asam sulfat pekat (Merck), kristal natrium
hidroksida (Univar), timbal (II) asetat, besi (III) klorida, asam asetat anhidrida,
toluen, kloroform, asam klorida 2 N, asam klorida pekat, asam klorida encer,
serbuk magnesium, serbuk seng, iodium, metanol, etil asetat, kloroform,
isopropanol, eter, kloralhidrat, air suling, Tween 80, natrium klorida 0,9%
(Widatarabakti) dan baku albendazole (PT. Indofarma).
3.2 Penyiapan Sampel
Penyiapan sampel meliputi pengambilan sampel dan identifikasi sampel.
3.2.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif, yaitu tanpa
membandingkan dengan bahan yang sama dari daerah lain. Tumbuhan pugun
tanoh diambil dari Pajak Pancur Batu, Deli Serdang, Provinsi Sumatera Utara
Bagian tanaman yang digunakan adalah daun. Hewan percobaan (cacing tanah)
diambil dari Taman Obat Tradisional, Fakultas Farmasi, Jl. Tri Dharma, Pintu 4
Kampus USU, Medan, Provinsi Sumatera Utara.
3.2.2 Identifikasi sampel
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense Bidang Botani
Pusat Penelitian Biologi LIPI Bogor (Ramadhani, 2014). Spesimen hewan
percobaan diidentifikasi oleh Laboratorium Taksonomi Hewan Departemen
Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam USU.
3.3 Pembuatan Simplisia Daun Pugun Tanoh
Daun pugun tanoh dipetik dan disortir kemudian dicuci hingga bersih,
pada suhu 30-35ºC untuk memperoleh simplisia. Simplisia yang telah kering
ditimbang kemudian diblender menjadi serbuk hingga agak halus lalu dimasukkan
ke dalam wadah tertutup dan disimpan pada suhu kamar.
3.4 Pembuatan Pereaksi 3.4.1 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml.
Pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam
10lml air suling. Kedua larutan dicampurkan dan ditambahkan air suling hingga
100 ml (Ditjen POM., 1995).
3.4.2 Pereaksi Dragendorff
Sebanyak 0,8 g bismut (III) dilarutkan dalam 20 ml asam nitrat pekat. Pada
wadah lain, sebanyak 27,2 g kalium iodida dilarutkan dalam 50 ml air suling.
Kedua larutan kemudian dicampurkan dan didiamkan sampai memisah sempurna.
Larutan yang jernih diambil dan diencerkan dengan air suling hingga volume
larutan 100 ml (Ditjen POM., 1995).
3.4.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam air suling secukupnya, lalu
ditambahkan 2 g iodium kemudian ditambahkan air suling hingga larutan 100 ml
(Ditjen POM., 1995).
3.4.4 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50
bagian volume etanol 96%. Kemudian ditambahkan dengan hati-hati 5 bagian
volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan (Ditjen
3.4.5 Pereaksi Molisch
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N dan dicukupkan
hingga 100 ml (Ditjen POM, 1995).
3.4.6 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat diencerkan dengan air suling
hingga 100 ml (Ditjen POM., 1995).
3.4.7 Pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat diencerkan dengan air suling
sampai 100 ml (Ditjen POM., 1995).
3.4.8 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling
sebanyak 100 ml (Ditjen POM., 1995).
3.4.9 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas
karbon dioksida sebanyak 100 ml (Ditjen POM., 1995).
3.4.10 Pereaksi besi (III) klorida 1% (b/v)
Sebanyak 1 g besi (III) klorida dilarutkan dalam air secukupnya dan
diencerkan hingga 100 ml (Ditjen POM., 1995).
3.5 Karakterisasi Simplisia Daun Pugun Tanoh
Karakterisasi simplisia meliputi pemeriksaan organoleptik, mikroskopik,
penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari
larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut
3.5.1 Pemeriksaan organoleptik
Pemeriksaan organoleptik dilakukan dengan mengamati bentuk luar dari
simplisia dan ekstrak etanol daun pugun tanoh, yaitu warna, bau, bentuk dan rasa.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia daun pugun
tanoh. Serbuk simplisia daun pugun tanoh ditaburkan diatas kaca objek yang telah
ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian
diamati di bawah mikroskop.
3.5.3 Penetapan kadar air
Sebanyak 200 ml toluen dimasukkan ke dalam labu alas bulat, lalu
ditambahkan 2 ml air suling, setelah alat dipasang, kemudian didestilasi selama 2
jam. Destilasi dihentikan dan dibiarkan dingin selama ± 30 menit, kemudian
volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
Labu berisi toluen tersebut dimasukkan 5 g serbuk simplisia yang telah
ditimbang seksama lalu dipanaskan hati-hati selama 15 menit kemudian setelah
toluen mendidih, kecepatan toluen diatur 2 tetes per detik sampai sebagian besar
air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik.
Air terdestilasi seluruhnya, bagian dalam pendingin dibilas dengan toluen.
Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan
mendingin pada suhu kamar, setelah air dan toluen memisah sempurna, volume
air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai
dengan kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung
3.5.4 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dimasukkan ke dalam krus
porselin yang telah dipijar dan ditara, kemudian diratakan. Krus porselin dipijar
perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 500-600°C
selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap.
Kadar abu dihitung terhadap bahan yang telah dikeringkan (WHO., 2011).
3.5.5 Penetapan kadar abu tidak larut dalam asam
Abu yang telah diperoleh dalam penetapan kadar abu dididihkan dalam
25lml asam klorida encer selama 5 menit. Bagian yang tidak larut asam
dikumpulkan, disaring melalui kertas saring dan dipijar sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang dikeringkan (WHO., 2011).
3.5.6 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia daun pugun tanoh, dimaserasi selama 24
jam dalam 100 ml air-kloroform (2,5 ml kloroform dilarutkan di dalam 1 L air
suling) dalam labu tersumbat sambil sesekali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama
diuapkan sampai kering dalam cawan penguap berdasar rata yang telah
dipanaskan dan ditara. Sisa dipanaskan pada suhu 105°C sampai bobot tetap.
Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan
(Depkes RI., 1995).
3.5.7 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama
selama 6 jam pertama dan kemudian dibiarkan selama 18 jam dan disaring.
Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan dangkal
berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC
sampai diperoleh bobot konstan. Kadar sari yang larut dalam etanol dihitung
terhadap bahan yang telah dikeringkan di udara (Ditjen POM., 1995).
3.6 Skrining Fitokimia Simplisia Daun Pugun Tanoh
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa
golongan alkaloid, flavonoid, tanin, glikosida, saponin dan steroid/triterpenoid.
3.6.1 Pemeriksaan alkaloida
Sebanyak 0,5 g serbuk simplisia ditambahkan 1 ml asam klorida 2 N dan
9oml air suling, dipanaskan di atas penangas air selama 2 menit. Setelah dingin
lalu disaring dan filtrat digunakan untuk percobaan berikut:
a. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereaksi Mayer akan
terbentuk endapan berwarna putih atau kuning menunjukkan reaksi positif;
b. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Bouchardat akan
terbentuk endapan berwarna coklat-hitam menunjukkan reaksi positif;
c. filtrat sebanyak 3 tetes ditambahkan 2 tetes larutan pereksi Dragendorff akan
terbentuk endapan berwarna merah atau jingga menunjukkan reaksi positif.
Alkaloida dinyatakan positif jika terjadi endapan atau paling sedikit dua
atau tiga dari percobaan di atas (Ditjen POM., 1995).
3.6.2 Pemeriksaan flavonoida
Larutan Percobaan:
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml metanol lalu
filtrat diencerkan dengan 10 ml air suling. Setelah dingin ditambah 5 ml eter
minyak tanah, dikocok hati-hati, didiamkan. Lapisan metanol diambil, diuapkan
pada temperatur 40oC. Sisa dilarutkan dalam 5 ml etil asetat, disaring.
Cara Percobaan :
a. 1 ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam 1-2
ml etanol 96%, ditambahkan 0,5 g serbuk seng dan 2 ml asam klorida 2 N,
didiamkan selama satu menit. Ditambahkan 10 ml asam klorida pekat, jika
dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan adanya
flavonoida (glikosida-3-flavonol).
b. 1 ml larutan percobaan diuapkan hingga kering, sisanya dilarutkan dalam
1lml etanol 96%, ditambahkan 0,1 g magnesium dan 10 ml asam klorida
pekat, terjadi warna merah jingga sampai merah ungu menunjukkan adanya
flavonoida (Ditjen POM., 1995).
3.6.3 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu
disaring. Filtratnya diencerkan dengan air suling sampai tidak berwarna. Ke dalam
2 ml filtrat ditambahkan 1-2 tetes larutan besi (III) klorida. Jika terjadi warna biru
atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.4 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia disari dengan 30 ml campuran 7 bagian
volume etanol 96% dan 3 bagian volume air suling. Selanjutnya ditambahkan
10lml HCl 2 N, direfluks selama 10 menit, didinginkan dan disaring. Pada 30 ml
filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok,
didiamkan selama 5 menit lalu disaring. Filtrat disari sebanyak 3 kali, tiap kali
isopropanol. Lapisan air diambil kemudian ditambahkan 2 ml air dan 5 tetes
pereaksi Molisch, ditambahkan hati-hati 2 ml asam sulfat pekat. Jika terbentuk
cincin warna ungu pada batas kedua cairan menunjukkan adanya ikatan gula
(Ditjen POM., 1995).
3.6.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan ke dalam tabung reaksi dan
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik. Timbulnya busa yang mantap setinggi 1-10 cm tidak kurang dari
10 menit yang tidak hilang dengan penambahan 1 tetes larutan asam klorida 2 N
menunjukkan adanya saponin (Ditjen POM., 1995).
3.6.6 Pemeriksaan steroida/ triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam,
lalu disaring. Filtrat diuapkan dalam cawan penguap. Sisa dalam cawan penguap
ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat.
Timbulnya warna ungu atau merah kemudian berubah menjadi hijau biru
menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.7 Pembuatan Ekstrak Etanol Daun Pugun Tanoh
Serbuk simplisia diekstraksi secara sokletasi dengan menggunakan pelarut
etanol 96%. Alat sokletasi dipasang, kemudian sebanyak 40 g serbuk simplisia
daun pugun tanoh [Curanga fel-terrae (Lour.) Merr.] dibungkus dengan kertas
saring kemudian dimasukkan ke dalam alat soklet. Pelarut etanol 96% sebanyak
400 ml dimasukkan ke dalam labu alas bulat dan dipanaskan pada suhu 80°C
sampai tetesan siklus mendekati tidak berwarna/ tersari sempurna selama 18 jam.
diuapkan dengan penangas air kemudian dimasukkan ke dalam pendingin
sehingga diperoleh ekstrak etanol daun pugun tanoh.
3.8 Karakterisasi dan Skrining Fitokimia Ekstrak
Karakterisasi dan skrining fitokimia ekstrak dilakukan dengan prosedur
yang sama dengan karakterisasi dan skrining fitokimia pada simplisia daun pugun
tanoh.
3.9 Uji Aktivitas Antelmintik Ekstrak Etanol Daun Pugun Tanoh 3.9.1 Hewan percobaan
Hewan percobaan yang digunakan dalam penelitian ini adalah cacing
tanah dewasa (Pheretima posthuma) dengan ukuran seragam (panjang 14 – 14,5
cm dan lebar 0,1 – 0,2 cm). Pheretima posthuma dikumpulkan dari tanah yang
lembab, dicuci dengan air suling untuk menghilangkan pengotor dan diaklimasi
dalam larutan salin selama 60 menit (Joseph, et al., 2013).
3.9.2 Uji pengaruh etanol terhadap Pheretima posthuma
Larutan etanol 96% diencerkan dengan salin hingga 20 ml untuk
memperoleh larutan etanol 0,5; 1; 2; 4; 6; 8 dan 10%. Perhitungan pengenceran
larutan etanol dapat dilihat pada Lampiran 20 halaman 59. Pheretima posthuma
dimasukkan secara terpisah ke dalam cawan petri yang masing-masing berisi
larutan etanol dengan konsentrasi berbeda tersebut. Efek etanol terhadap
Pheretima posthuma diamati selama 5 jam.
3.9.3 Penyiapan sampel uji
Ditimbang 100, 200, 400 dan 600 mg ekstrak etanol daun pugun tanoh,
ml. Ekstrak dilarutkan dengan etanol 0,5% dan diencerkan sampai garis tanda.
Albendazole disiapkan dengan mensuspensikan 1200 mg serbuk albendazole
dalam lumpang yang berisi sejumlah larutan salin, lalu digerus. Sebanyak 0,3 ml
Tween 80 ditambahkan ke dalam lumpang, kemudian digerus sampai terbentuk
suspensi merata. Suspensi dipindahkan ke dalam labu erlenmeyer yang sudah
ditara, kemudian dicukupkan dengan larutan salin sampai 60 ml sehingga
diperoleh suspensi albendazole dengan konsentrasi 20 mg/ml. Perhitungan
penyiapan suspensi ekstrak dan albendazole dapat dilihat pada Lampiran 22
halaman 61.
3.9.4 Uji aktivitas antelmintik
Uji aktivitas antelmintik dilakukan berdasarkan prosedur Patilaya dan
Husori (2015). Hewan percobaan dibagi menjadi 7 kelompok yang
masing-masing terdiri dari 3 ekor cacing Pheretima posthuma dengan perlakuan seperti
pada Tabel 3.1.
Tabel 3.1. Perlakuan uji antelmintik ekstrak etanol daun pugun tanoh terhadap
Pheretima posthuma
Keterangan: EEDPT = ekstrak etanol daun pugun tanoh
Seluruh perlakuan dilakukan dalam cawan petri steril pada suhu kamar.
Aktivitas antelmintik ekstrak daun pugun tanoh ditentukan berdasarkan waktu
paralisis dan kematian melalui pengamatan terhadap motilitas dan morfologi
cacing Pheretima posthuma selama 5 jam. Cacing Pheretima posthuma
Kelompok Perlakuan
I Pemaparan dalam 20 ml larutan salin steril (kontrol negatif) II Pemaparan dalam 20 ml larutan etanol 0,5% (kontrol pelarut) III Pemaparan dalam 20 ml suspensi albendazole 20 mg/ml (kontrol
positif)
dipindahkan ke dalam cawan petri berisi larutan salin bersuhu 40-50 ºC untuk
memastikan hewan percobaan telah mati,.
3.10 Analisis Statistika
Data-data hasil penelitian disajikan dalam nilai rata-rata ± simpangan
baku. Analisis statistika dilakukan menggunakan perangkat lunak SPSS versi 22.0
dengan metode analisis variansi (Anava) satu arah, apabila terdapat perbedaan
signifikan, analisis dilanjutkan dengan uji Tukey. Analisis statistika dilakukan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan oleh Herbarium Bogoriense
Bidang Botani, Pusat Penelitian Biologi LIPI Bogor menyebutkan bahwa
tumbuhan yang digunakan adalah pugun tanoh [Curanga fel-terrae (Lour.) Merr.]
suku Scrophulariaceae (Lampiran 1 halaman 56).
Pada penelitian ini bagian tumbuhan pugun tanoh yang digunakan adalah
daun. Lampiran 4 halaman 62 menunjukkan bahwa secara visual daun pugun
tanoh yang segar berwarna hijau muda sampai hijau tua, berbentuk bulat telur
dengan tinggi 2-7 cm dan lebar 2-4 cm, ujung daun agak melancip, tepi daun
beringgit dan permukaan daun bertekstur kasar. Daun terasa sangat pahit di lidah
dan bila diremas daunnya tidak mengeluarkan bau. Hasil yang sama juga
dilaporkan oleh Patilaya dan Husori (2015), Ramadhani (2014), Harahap, dkk.
(2013), Fithra (2013) dan Juwita (2009).
4.2 Karakteristik Simplisia Daun Pugun tanoh
Hasil penelitian menunjukkan bahwa secara organoleptik simplisia daun
pugun tanoh berwarna hijau (Lampiran 5 halaman 61). Simplisia daun pugun
tanoh berasa pahit dan tidak berbau. Hasil yang sama juga dilaporkan oleh
Patilaya dan Husori (2015), Ramadhani (2014), Fithra (2013) dan Juwita (2009).
Hasil pemeriksaan mikroskopik simplisia daun pugun tanoh dapat dilihat
pada Lampiran 6 halaman 62. Daun pugun tanoh memiliki fragmen pengenal
kalsium oksalat bentuk prisma dan stomata dengan dua tipe yaitu diasitik dan
anomositik. Hasil yang sama juga dilaporkan oleh Ramadhani (2014), Fithra
(2013) dan Juwita (2009).
Pada penelitian ini simplisia daun pugun tanoh yang diperoleh memiliki
nilai rendemen 27,82%. Menurut hasil penelitian Patilaya dan Husori (2015),
rendemen simplisia daun pugun tanoh adalah 25,53%.
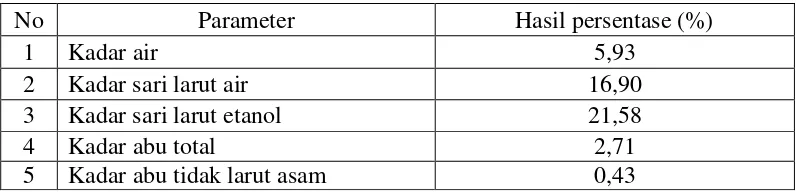
Hasil pemeriksaan kadar air, kadar sari larut dalam air dan etanol serta
kadar abu dari simplisia daun pugun tanoh dapat dilihat pada Tabel 4.1. dan
Lampiran 12–16 halaman 72-76. Kadar air simplisia daun pugun tanoh adalah
5,93%. Hal ini sesuai dengan persyaratan umum simplisia yaitu tidak lebih dari
10% (Depkes., 1995). Menurut Ramadhani (2014), kadar air simplisia daun pugun
tanoh adalah 5,96% sedangkan menurut Fithra (2013), kadar air simplisia daun
pugun tanoh mencapai 7,97%.
Tabel 4.1. Kadar air, kadar sari larut dalam air dan etanol serta kadar abu total dan tidak larut asam
Kadar sari larut air simplisia daun pugun tanoh mencapai 16,90%.
Menurut Ramadhani (2014) dan Fithra (2013), kadar sari larut dalam air simplisia
daun pugun tanoh masing-masing adalah 16,36% dan 16,18%.
Kadar sari larut dalam etanol simplisia daun pugun tanoh dalam penelitian
ini adalah 21,58%, lebih tinggi dibandingkan hasil yang diperoleh oleh
Ramadhani (2014) dan Fithra (2013) yaitu masing-masing 13,65% dan 14,54%.
No Parameter Hasil persentase (%)
1 Kadar air 5,93
2 Kadar sari larut air 16,90
3 Kadar sari larut etanol 21,58
4 Kadar abu total 2,71
Kadar abu total simplisia daun pugun tanoh adalah 2,71%. Menurut
Ramadhani (2014), kadar abu total simplisia daun pugun tanoh adalah 8,56%,
sedangkan menurut Fithra (2013), kadar abu total simplisia daun pugun tanoh
mencapai 9,80%. Kadar abu tidak larut asam simplisia daun pugun tanoh yang
diperoleh dalam penelitian ini adalah 0,43%. Menurut Ramadhani (2014) dan
Fithra (2013), kadar abu tidak larut asam simplisia daun pugun tanoh
masing-masing adalah 1,00% dan 0,98%.
4.3 Karakteristik Ekstrak Etanol Daun Pugun tanoh
Lampiran 8 halaman 64 menunjukkan bahwa secara organoleptik ekstrak
etanol daun pugun tanoh yang dibuat secara sokletasi berwarna coklat dan
konsistensinya kental, berasa pahit dan memiliki bau khas. Karakteristik tersebut
sama dengan karakteristik ekstrak etanol daun pugun tanoh yang diperoleh secara
maserasi oleh Patilaya dan Husori (2015) dan Fithra (2013).
Hasil penelitian menunjukkan bahwa rendemen ekstrak etanol daun pugun
tanoh dengan metode sokletasi adalah 39,21%. Menurut Patilaya dan Husori
(2015), rendemen ekstrak etanol daun pugun tanoh yang diperoleh dengan metode
maserasi mencapai 33,25%. Rendemen ekstrak etanol daun pugun tanoh dengan
metode sokletasi lebih tinggi dibandingkan metode maserasi. Hal tersebut
disebabkan karena pemanasan dapat meningkatkan kelarutan komponen kimia
tumbuhan dalam pelarut yang digunakan selama ekstraksi (Mokoginta, dkk., 2013;
Harbone, 1996).
Hasil pemeriksaan kadar air, kadar sari larut dalam air dan etanol serta
kadar abu ekstrak etanol daun pugun tanoh dapat dilihat pada Tabel 4.2. dan
pugun tanoh dalam penelitian ini adalah 3,99%. Hal ini sesuai dengan persyaratan
kadar air secara umum yaitu tidak lebih dari 10% (Depkes., 1995). Menurut Fitra
(2013), kadar air ekstrak etanol daun pugun tanoh yang diperoleh dengan metode
maserasi yaitu 10,63 %.
Tabel 4.2. Kadar air, kadar sari larut dalam air dan etanol serta kadar abu total
dan tidak larut asam
Kadar sari larut air ekstrak etanol daun pugun tanoh dalam penelitian ini
mencapai 58,67%. Menurut Fithra (2013), kadar sari larut dalam air simplisia
daun pugun tanoh adalah 59,06%. Kadar sari larut dalam etanol ekstrak etanol
daun pugun tanoh dalam penelitian ini adalah 70,98%, lebih tinggi dibandingkan
hasil yang diperoleh oleh Fithra (2013) yaitu 70,44%.
Kadar abu total dan kadar abu tidak larut asam ekstrak etanol daun pugun
tanoh masing-masing adalah 1,77% dan 0,32%. Menurut Fithra (2013) kadar abu
total dan kadar abu tidak larut asam ekstrak etanol daun pugun tanoh yang
diperoleh dengan metode maserasi yaitu 3,93% dan 0,35%.
4.4 Skrining Fitokimia Serbuk Simplisia dan Ekstrak
Hasil penelitian menunjukkan bahwa simplisia daun pugun tanoh dan
ekstrak etanolnya yang diperoleh dengan metode sokletasi mengandung flavonoid,
tanin, saponin, glikosida dan steroid/triterpenoid (Tabel 4.3). Kandungan
golongan metabolit sekunder tersebut juga terdapat dalam ekstrak etanol daun
No Karakteristik Hasil Persentase (%)
1 Kadar air 3,99
2 Kadar sari larut air 58,67
3 Kadar sari larut etanol 70,98
4 Kadar abu total 1,77
pugun tanoh yang diperoleh secara maserasi (Patilaya dan Husori, 2015; Fithra,
2013 dan Juwita, 2009) dan perkolasi (Harahap, dkk., 2013).
Tabel 4.3. Kandungan metabolit sekunder simplisia dan ekstrak etanol daun pugun tanoh
Keterangan: (+) : mengandung golongan senyawa (-) : tidak mengandung golongan senyawa
4.5 Aktivitas Antelmintik Ekstrak Etanol Daun Pugun tanoh 4.5.1 Hewan percobaan
Hasil identifikasi hewan percobaan yang dilakukan oleh Laboratorium
Taksonomi Hewan, Departemen Biologi FMIPA USU menyebutkan bahwa
hewan yang digunakan adalah cacing Pheretima posthuma (Lampiran 2 halaman
57). Cacing Pheretima posthuma memiliki warna tubuh bagian dorsal coklat
keunguan, bagian ventral abu-abu keputihan, panjang tubuh 143-176 mm,
diameter 3,5-6 mm dan jumlah segmen 125-137 (Lampiran 9 halaman 65).
Pheretima posthuma digunakan dalam penelitian ini karena memiliki
kemiripan struktur anatomi dan fisiologis dengan cacing yang menginfeksi
saluran cerna manusia (Vennila, et al., 2015; Nitave, et al, 2014; Borah, et al.,
2013; Subash, et al., 2012; Sharma, et al., 2011; Sharma, 2010).
4.5.2 Pengaruh etanol terhadap Pheretima posthuma
Pengaruh pemberian etanol dalam berbagai konsentrasi terhadap
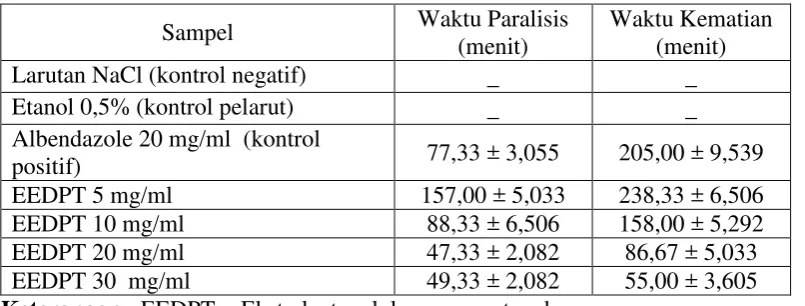
Pheretima posthuma dapat dilihat pada Tabel 4.4. dan Lampiran 10 halaman 66.
Hasil penelitian menunjukkan bahwa konsentrasi etanol yang tidak menyebabkan
No Golongan Metabolit Sekunder Simplisia Ekstrak
kematian Pheretima posthuma adalah tidak lebih dari 1%, namun etanol 1%
menimbulkan perubahan morfologis seperti perubahan warna dan bentuk tubuh
Pheretima posthuma. Maka konsentrasi etanol yang digunakan sebagai pelarut
dalam penelitian ini adalah 0,5%.
Tabel 4.4. Pengaruh etanol terhadap Pheretima posthuma
4.5.3 Aktivitas antelmintik
Aktivitas antelmintik ekstrak etanol daun pugun tanoh ditentukan
berdasarkan waktu paralisis dan waktu kematian terhadap cacing Pheretima
posthuma (Tabel 4.5. dan Lampiran 11 halaman 67). Tabel 4.5 menunjukkan
bahwa ekstrak etanol daun pugun tanoh (EEDPT) pada konsentrasi uji
menyebabkan paralisis Pheretima posthuma.
Tabel 4.5. Uji aktifitas antelmintik terhadap Pheretima posthuma (n = 3)
Keterangan : EEDPT = Ekstrak etanol daun pugun tanoh Konsentrasi
Etanol (%)
Pengamatan Terhadap Cacing Pheretima posthuma
Kondisi Waktu Kematian (menit)
0,5 Hidup 0
Larutan NaCl (kontrol negatif) _ _
Etanol 0,5% (kontrol pelarut) _ _
Albendazole 20 mg/ml (kontrol
positif) 77,33 ± 3,055 205,00 ± 9,539
EEDPT 5 mg/ml 157,00 ± 5,033 238,33 ± 6,506
EEDPT 10 mg/ml 88,33 ± 6,506 158,00 ± 5,292
EEDPT 20 mg/ml 47,33 ± 2,082 86,67 ± 5,033
Analisis statistika (Lampiran 25 halaman 85) menunjukkan bahwa efek
paralisis EEDPT 20 mg/ml dan 30 mg/ml > EEDPT 10 mg/ml dan albendazole 20
mg/ml > EEDPT 5 mg/ml. Efek paralisis EEDPT terhadap Pheretima posthuma
dipengaruhi oleh konsentrasi. Semakin tinggi konsentrasi EEDPT, waktu paralisis
semakin cepat.
Efek paralisis EEDPT yang diperoleh dengan metode sokletasi lebih
lemah dibandingkan efek paralisis EEDPT hasil maserasi. Menurut Patilaya dan
Husori (2015), efek paralisis pemberian EEDPT yang diperoleh dengan metode
maserasi konsentrasi 10, 20 dan 30 mg/ml masing-masing terlihat pada 41,28;
23,27 dan 12,18 menit. Terdapat perbedaan waktu paralisis Pheretima posthuma
yang terpapar EEDPT yang diperoleh dengan metode maserasi dan EEDPT yang
diperoleh dengan metode sokletasi, hal tersebut mungkin disebabkan oleh
bedanya metode ekstraksi, konsentrasi pelarut yang digunakan, sumber tanaman,
ukuran tubuh Pheretima posthuma dan waktu melakukan penelitian.
Tabel 4.5. juga menunjukkan bahwa EEDPT menyebabkan kematian
Pheretima posthuma. Efek kematian Pheretima posthuma dipengaruhi oleh
konsentrasi EEDPT. Semakin tinggi konsetrasi EEDPT, waktu kematian
Pheretima posthuma semakin cepat. Analisis statistika (Lampiran 26 halaman 89)
menunjukkan bahwa efek EEDPT 5, 10, 20 ,30 mg/ml dan albendazole 20 mg/ml
berbeda secara signifikan (p < 0,05). Efek kematian EEDPT 30 mg/ml terhadap
Pheretima posthuma > EEDPT 20 mg/ml > EEDPT 10 mg/ml > albendazole 20
mg/ml > EEDPT 5 mg/ml.
Efek kematian EEDPT yang diperoleh dengan metode sokletasi lebih
lemah dibandingkan efek kematian EEDPT hasil maserasi. Menurut Patilaya dan
maserasi konsentrasi 10, 20 dan 30 mg/ml masing-masing terlihat pada 47,09;
27,41 dan 16,66 menit. Terdapat perbedaan waktu kematian Pheretima posthuma
yang terpapar EEDPT yang diperoleh dengan metode maserasi dan EEDPT yang
diperoleh dengan metode sokletasi, hal tersebut mungkin disebabkan oleh
bedanya metoda ekstraksi, konsentrasi pelarut yang digunakan, sumber tanaman,
ukuran tubuh Pheretima posthuma dan waktu melakukan penelitian.
Secara umum, hasil penelitian menunjukkan bahwa EEDPT memiliki
aktivitas antelmintik terhadap Pheretima posthuma. Aktivitas antelmintik EEDPT
kemungkinan disebabkan oleh adanya senyawa tanin, saponin, flavonoid,
steroid/terpenoid dan glikosida. Metabolit sekunder dapat bekerja sendiri atau
dalam kombinasi sehingga menyebabkan paralisis (kelumpuhan) atau
menyebabkan kematian cacing. Interaksi sinergis dari beberapa metabolit telah
terbukti lebih efektif daripada metabolit tunggal (Mukherjee dan Houghton, 2009).
Metabolit-metabolit tersebut dapat bertindak di satu atau beberapa lokasi target
pada cacing (Wynn dan Fougere, 2007).
Tanin merupakan salah satu senyawa aktif yang mempunyai kemampuan
mengendapkan protein dengan membentuk kompleks yang kuat (Makkar, 1993).
Kemampuan tanin tersebut akan menyebabkan terjadinya penghambatan enzim
dan kerusakan membran (Shahidi dan Naczk, 1995). Terhambatnya kerja enzim
dapat menyebabkan proses metabolisme pencernaan terganggu sehingga cacing
akan kekurangan nutrisi pada akhirnya cacing akan mati karena kekurangan
tenaga. Membran cacing yang rusak karena tanin menyebabkan cacing paralisis
yang akhirnya mati. Tanin dapat mengikat protein bebas pada saluran pencernaan
cacing atau glikoprotein pada kutikula cacing sehingga mengganggu fungsi
Githiori, et al., 2006). Tanin juga memiliki aktivitas ovisidal, yang dapat mengikat
telur cacing yang lapisan luarnya terdiri atas protein sehingga pembelahan sel di
dalam telur tidak akan berlangsung pada akhirnya larva tidak terbentuk (Tiwow,
et al., 2013).
Saponin dapat menurunkan tegangan permukaan membran sel serta
menghambat enzim asetil kolin sehingga dapat menimbulkan paralisis pada
cacing (Tyler, 1976). Saponin juga mampu merusak membran mukosa pencernaan
cacing sehingga mengganggu penyerapan makanan (Tjokropranoto, et al., 2011;
Tyler, 1976) sehingga cacing akan kekurangan energi dan mengalami kematian
(Mukherjee dan Houghton, 2009). Flavonoid menyebabkan degenerasi neuron
pada tubuh cacing sehingga mengakibatkan kematian (Tjokropranoto, et al., 2011).
Steroid mampu menginhibisi motilitas spontan cacing Pheretima posthuma
sehingga menyebabkan paralisis (Tjokropranoto, et al., 2011). Cara kerja
glikosida adalah dengan mengganggu pembentukan energi pada cacing melalui
fosforilasi oksidatif atau berikatan dengan glikoprotein pada kutikula cacing yang
menyebabkan kematian cacing (Choudhary, 2013). Mekanisme kerja antelmintik
senyawa metabolit sekunder telah diketahui, tetapi mekanisme efek antelmintik
ekstrak etanol daun pugun tanoh masih belum jelas. Maka penelitian lanjutan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penelitian ini dapat disimpulkan bahwa :
a. Karakteristik simplisia daun pugun tanoh yang meliputi kadar air, kadar sari
larut air, kadar sari larut etanol, kadar abu total dan kadar abu tidak larut asam
masing-masing adalah 5,93; 16,90; 21,58; 2,71 dan 0,43%. Karakteristik
ekstrak etanol daun pugun tanoh yang meliputi kadar air, kadar sari larut air,
kadar sari larut etanol, kadar abu total dan kadar abu tidak larut asam
masing-masing adalah 3,99; 58,67; 70,98; 1,77 dan 0,32%.
b. Simplisia dan ekstrak etanol daun pugun tanoh mengandung golongan senyawa
flavonoida, tanin, glikosida, saponin dan steroid/triterpenoid.
c. Ekstrak etanol daun pugun tanoh memiliki aktivitas antelmintik terhadap cacing
Pheretima posthuma.
5.2 Saran
Berdasarkan hasil penelitian ini, peneliti selanjutnya disarankan untuk
BAB II
TINJAUAN PUSTAKA
2.1 Epidemiologi Kecacingan
Kecacingan merupakan penyakit endemik dan kronik yang diakibatkan
oleh cacing parasit (Zulkoni, 2009). Infeksi cacing tidak hanya terjadi di negara
tropis dan subtropis tetapi juga di berbagai daerah yang tingkat kebersihan
lingkungannya rendah (Pagariya, et al., 2013). Badan Kesehatan Dunia
memperkirakan lebih dari 1,5 miliar (24%) dari penduduk dunia terinfeksi cacing
parasit dengan jumlah terbesar di wilayah Afrika, Amerika, Cina dan Asia
Tenggara (WHO., 2015). Angka kecacingan mencapai 28% (Kemenkes., 2015)
dan diperkirakan lebih dari 60% anak-anak terinfeksi cacing parasit di Indonesia
(Tjay dan Rahardja, 2002).
Prevalensi infeksi cacing yang tinggi berdampak buruk bagi kesehatan,
walaupun jarang menyebabkan kematian, namun infeksi cacing menyebabkan
penderita khususnya anak-anak mengalami kekurangan gizi, kemunduran
pertumbuhan fisik, mental, kognitif dan intelektual (Tiwow, dkk., 2013), pada
orang dewasa menyebabkan menurunnya produktivitas kerja. Kecacingan dapat
mengakibatkan menurunnya kualitas sumber daya manusia dalam jangka panjang
(Zulkoni, 2010).
2.2 Penyebab Kecacingan
Filum utama cacing yang mempengaruhi kesehatan manusia yaitu filum
Platyhelminthes dan filum Nemathelminthes. Filum Platyhelminthes terdapat 2
yang penting adalah kelas Nematoda (Soedarto, 2008). Nematoda atau cacing
bundar berbentuk bulat, tidak bersegmen, memiliki rongga tubuh dengan saluran
pencernaan dan kelamin terpisah (Zulkoni, 2010). Nematoda menyebabkan
infeksi pada usus, darah dan jaringan. Trematoda atau cacing pipih berbentuk
seperti daun dan bersifat hermaphrodit kecuali cacing hati (Zulkoni, 2010).
Cestoda atau cacing pita secara khas berbentuk pita yang besegmen, bersifat
hermaphrodit, tidak memiliki saluran pencernaan (Zulkoni, 2010) dan menempel
pada usus (Tjahyanto dan Salim, 2013).
Infeksi cacing umumnya masuk melalui mulut atau luka di kulit atau lewat
telur (kista) atau larvanya yang ada di atas tanah dan pembuangan kotoran yang
dilakukan dengan sembarangan yang tidak memenuhi syarat kebersihan (Zulkoni,
2010; Tjay dan Rahardja, 2002). Kebiasaan penggunaan kotoran sebagai pupuk
tanaman menyebabkan semakin luasnya pengotoran tanah. Persediaan air rumah
tangga dan makanan tertentu, misalnya sayuran yang tidak dicuci bersih,
kebiasaan makan masyarakat mengkonsumsi makanan mentah atau setengah
matang sepeti ikan, kerang, daging atau sayuran akan meningkatkan penderita
kecacingan, bila dalam makanan tersebut terdapat kista atau larva cacing maka
dapat mengakibatkan kecacingan pada manusia (Entjang, 2003).
Tergantung dari jenisnya, cacing tetap bermukim dalam saluran cerna atau
berpenetrasi ke jaringan. Cacing menyerap nutrisi dari tubuh manusia yang
ditumpanginya, penyerapan ini akan menyebabkan kelemahan tubuh dan penyakit,
dalam saluran pencernaan jika terdapat 20 ekor cacing dewasa, cacing-cacing
tersebut bisa menyedot 2,8 g karbohidrat dan 0,7 g protein dalam sehari (Zulkoni,
2009; Tjay dan Rahardja, 2002). Gejala dan keluhan kecacingan dapat disebabkan
penting bagi tubuh. Sering kali gejala tidak begitu nyata dan hanya berupa
gangguan lambung-usus, seperti mual, muntah, mulas, kejang-kejang dan diare
berkala dengan hilangnya nafsu makan. Tuan rumah dapat menderita kekurangan
darah akibat terinfeksi sejumlah cacing yang menghisap darah, misalnya
disebabkan oleh cacing tambang, pita dan cambuk (Tjay dan Rahardja, 2002).
2.2.1 Infeksi nematoda
Infeksi nematoda yang sering dijumpai adalah:
a. Onkoserkiasis (river blindness)
Penyakit ini disebabkan oleh Onchocerca volvulus yang ditandai dengan adanya
benjolan dibawah kulit, ruam kulit yang terasa gatal dan lesi okular yang sering
menyebabkan kebutaan (Tjahyanto dan Salim, 2013).
b. Enterobiasis (penyakit cacing kremi)
Penyebab penyakit ini adalah infeksi dari Enterobius vermicularis (Tjahyanto dan
Salim, 2013). Cacing kremi biasanya menimbulkan gatal di sekitar dubur (anus)
dan kejang hebat pada anak-anak. Infeksi ini dapat menyebabkan radang
umbai-usus buntu akut (Tjay dan Rahardja, 2002). Gejala penyakit cacing kremi yaitu
gatal disekitar dubur terutama pada malam hari pada saat cacing betina
meletakkan telurnya, gelisah dan sukar tidur (Irianto, 2013).
c. Askariasis (penyakit cacing gelang)
Penyebab penyakit ini adalah Ascaris lumbricoides. Panjangnya 10-15 cm dan
biasanya bermukim pada usus halus. Cacing betina mengeluarkan telur dalam
jumlah sangat banyak, sampai 200.000 telur dalam sehari yang dikeluarkan dalam
tinja (Tjay dan Rahardja, 2002). Gejala penyakit cacing gelang yaitu adanya rasa
tidak enak pada perut (gangguan lambung), kejang perut, diselingi diare,
d. Trikuriasis (penyakit cacing cambuk)
Agen penyebab penyakit ini adalah Trichuris trichiura. Umumnya terdapat di
negara beriklim panas dan lembab. Cacing cambuk bermukim di mukosa usus
halus dan usus besar dalam tubuh manusia, biasanya dengan menimbulkan
kerusakan dan peradangan (Tjay dan Rahardja, 2002). Gejala penyakit cacing
cambuk yaitu nyeri di ulu hati, kehilangan nafsu makan, diare dan anemia (Irianto,
2013).
e. Ankilostomiasis (penyakit cacing tambang)
Penyakit ini disebabkan oleh infeksi Ancylostoma duodenale dan Necator
americanus. Cacing ini disebut cacing tambang atau cacing terowongan karena
terdapat di daerah tambang dan terowongan di gunung. Penularannya terjadi oleh
larva yang memasuki kulit kaki yang terluka. Setelah memasuki vena, larva
menuju ke paru-paru dan bronki, akhirnya masuk ke saluran cerna (Tjay dan
Rahardja, 2002). Cacing menempel pada mukosa usus dan menyebabkan
anoreksia dengan gejala adanya luka mengakibatkan pendarahan usus kronis yang
menyebabkan anemia, selain itu gejala penyakit ini adalah gangguan pencernaan
berupa mual, muntah, diare, nyeri ulu hati, pusing, nyeri kepala, lemas, lelah dan
gatal di daerah masuknya cacing (Irianto, 2013).
f. Trikinosis (cacing rambut)
Agen penyebab penyakit ini adalah Trichinella spiralis, biasanya disebabkan oleh
konsumsi daging yang tidak cukup matang, khususnya babi (Tjahyanto dan Salim,
2013).
g. Strongiloidiasis (penyakit cacing benang)
Penyebab penyakit ini adalah Strongyloides stercoralis (Tjahyanto dan Salim,
Cacing dapat bertahan puluhan tahun lamanya di mukosa bagian atas usus halus,
ditempat ini cacing merusak jaringan dan menimbulkan reaksi radang (Tjay dan
Rahardja, 2002).
2.2.2 Infeksi trematoda
Infeksi trematoda yang sering dijumpai adalah:
a. Skistosomiasis
Penyakit ini disebabkan oleh Schistosoma mansoni dan Schistosoma japonicum
yang merupakan cacing pipih. Penyakit ini ditularkan melalui sejenis keong
sebagai pembawa larva. Parasit ini menembus kulit manusia dan memasuki
peredaran darah. Skistosomiasis merupakan masalah kesehatan masyarakat yang
disebarkan melalui air yang terinfeksi di beberapa bagian dunia (Tjay dan
Rahardja, 2002). Lokasi infeksi utama adalah traktus gastrointestinal. Kerusakan
pada dinding usus disebabkan oleh respons inflamasi terhadap telur-telur yang
disimpan dalam daerah tersebut. Telur-telur tersebut juga mensekresikan enzim
proteolitik yang menambah kerusakan jaringan. Gambaran klinis berupa
pendarahan GI, diare dan kerusakan hati (Tjahyanto dan Salim, 2013). Penyakit
ini juga disebabkan oleh Schistosoma haematobium, lokasi infeksi utama adalah
vena kandung kemih. Penyakit ini ditularkan melalui penetrasi pada kulit secara
langsung. Bentuk skistomiasis ini didiagnosa dengan menemukan telur yang khas
dalam urin atau dinding kantung kemih (Tjahyanto dan Salim, 2013).
b. Paragonimiasis
Penyakit ini disebabkan oleh Paragonisum westermani (trematoda paru).