SINTESIS ETANOLAMIDA DAN DIETANOLAMIDA CAMPURAN
DARI METIL ESTER ASAMLEMAK BEBAS
MINYAK KELAPA DENGAN SENYAWA
ETANOLAMINA DAN DIETANOLAMINA
MENGGUNAKAN KATALIS
NATRIUM METOKSIDA
SKRIPSI
CRISTY HALOMOAN GINTING
070802054
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTA
SINTESIS ETANOLAMIDA DAN DIETANOLAMIDA CAMPURAN DARI METIL ESTER ASAMLEMAK BEBAS
MINYAK KELAPA DENGAN SENYAWA ETANOLAMINA DAN DIETANOLAMINA
MENGGUNAKAN KATALIS NATRIUM METOKSIDA
SKRIPSI
Diajukan untuk melengkapi tugas akhir dan memenuhi syarat mencapai gelar Sarjana Sains
CRISTY HALOMOAN GINTING O70802054
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : SINTESIS ETANOLAMIDA DAN
DIETANOLAMIDA CAMPURAN DARI METIL ESTER ASAM LEMAK BEBAS MINYAK KELAPA
DENGAN SENYAWA ETANOLAMINA DAN
DIETANOLAMINA MENGGUNAKAN KATALIS NATRIUM METOKSIDA
Kategori : SKRIPSI
Nama : CRISTY HALOMOAN GINTING
Nomor Induk Mahasiswa : 070802054
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM UNIVERSITAS SUMATERA UTARA
Diluluskan di :
Medan, Juli 2012
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Mimpin Ginting, MS Juliati Br Tarigan,S. Si, M.Si
NIP : 195510131986011001 NIP : 197205031999032001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
SINTESIS ETANOLAMIDA DAN DIETANOLAMIDA CAMPURAN DARI METIL ESTER ASAMLEMAK BEBAS
MINYAK KELAPA DENGAN SENYAWA ETANOLAMINA DAN DIETANOLAMINA
MENGGUNAKAN KATALIS NATRIUM METOKSIDA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan namanya.
Medan, Juli 2012
PENGHARGAAN
Segala Puji dan Syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala kasih karunia dan berkatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
Dalam pelaksanaan penelitian hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, motivasi dan dukungan dari berbagai pihak. Untuk itu pada kesempatan ini penulis menyampaikan terima kasih kepada Ibu Juliati Br Tarigan S.Si,M.Si sebagai pembimbing I dan Bapak Dr. Mimpin Ginting MS sebagai pembimbing 2 yang dengan sabar telah memberikan dorongan, bimbingan dan saran sehingga skripsi ini dapat diselesaikan dan sekaligus sebagai Kepala Laboratorium Kimia Organik yang telah memberikan fasilitas untuk laboratorium. Ibu Dr. Rumondang Bulan Nst. MS dan Drs. Bapak Albert Pasaribu, M.Sc sebagai ketua dan sekretaris Departemen Kimia FMIPA USU. Bapak Prof. Dr. Jamaran Kaban, M.Sc sebagai ketua bidang Kimia Organik FMIPA USU dan kepada bapak/ibu dosen Organik Bapak Drs. Adil Ginting M.Sc, Bapak Drs. Darwis Surbakti MS, Ibu Dra. Herlince Sihotang, M.Si, Ibu Cut Fatimah Zuhra, S.Si, M.Si dan Ibu Helmina br Sembiring, S.Si, M.Si atas segala dorongan dan waktu diskusinya. Seluruh dosen Departemen Kimia FMIPA USU terkhusus Ibu Helmina Br Sembiring, S.Si, M.Si selaku dosen wali yang telah memberikan waktunya untuk memberikan bimbingan selama penulis mengikuti kuliah di Departemen Kimia. Sahabat-sahabat terbaikku (Candra, Sahat, Burton, Hamdan, Bahtiar, Grand, Ferri, Stevanus) dan seluruh angkatan 2007 dan seluruh anggota IMK. Teman-teman Asisten Laboratorium Kimia Organik (Bg Daus, Bg Robijanto, Bg Aspriadi, Kak Yemima, Kak Merry, Silorida, Denny, Bayu, Samuel, Mutiara, Sion, Damenta, Egi, Despita, Naomi, Rimenda). Bapak Ronistra Ginting S.P beserta Sekeluarga. Seluruh anggota IMKA Merga Silima FMIPA USU Medan. Pihak-pihak yang tidak disebutkan namun tulus membantu penulis dalam penyelesaian skripsi ini.
Akhirnya saya mengucapkan terima kasih yang setinggi-tingginya kepada kedua orangtua saya (T.Ginting dan M. Br Perangin-Angin) yang telah memberikan seluruh dukungan saran dan prasarana dan semangat bahkan dengan setia terus membantu penulis dalam Doa dan kepada saudara-saudaraku (Eva & Sekeluarga, Herbin, Sry Devi).
ABSTRAK
Senyawa alkanolamida dari asam lemak bebas yang merupakan surfaktan bukan ionik telah banyak dimanfaatkan dalam berbagai keperluan terutama dalam kosmetik, detergen dan tekstil. Dalam penilitian ini dilakukan sintesis etanolamida dan dietanolamida yang diperoleh dari amidasi metil ester asam lemak bebas minyak kelapa dengan etanolamina maupun dengan dietanolamina. Metil ester asam lemak bebas dihasilkan dari reaksi esterifikasi asam lemak bebas minyak kelapa dengan metanol menggunakan katalis asam sulfat dalam pelarut benzena pada kondisi refluks dengan rendemen reaksi sebesar 91,66%. Selanjutnya amidasi metil ester asam lemak bebas dengan etanolamina menggunakan katalis natrium metoksida pada suhu 80-90 o
SYNTETIC OF MIXING ETHANOLAMIDE AND DYETHANOLAMIDE AS MIXING FROM FREE FATTY ACID METHYL ESTER COCONOUT OIL
AND COMPOUNDS ETHANOLAMIDE AND DIETHANOLAMIDE USING CATALYST NATRIUM METHOXIDE
ABSTRACT
DAFTAR ISI
BAB 1. PENDAHULUAN
1.1. LatarBelakang 1
1.2. Permasalahan 2
1.3. Pembatasan Masalah 3
1.4. Tujuan Penelitian 3
1.5. Manfaat Penelitian 4
1.6. Lokasi Penelitian 4
1.7. Metodologi Penelitian 4
BAB 2. TINJAUAN PUSTAKA
2.1. Oleokimia 5
2.1.1. Ester 6
2.1.2. Amida 7
2.1.3. Alkanolamida 8
2.1.4. Reaksi pembuatan alkanolamida
2.1.5. Etanolamida 14
2.1.6. Dietanolamida 14
2.2. Lemak dan Minyak 15
2.2.1. Minyak Kelapa 16
2.3.2. Proses pengolahan asam lemak bebas minyak kelapa 19
2.3 Surfaktan 20
2.4. Kritikal misel konsentrasi dengan Cincin Dunoy dari Suatu Surfaktan 23
2.5. Katalis 24
BAB 3. METODE PENELITIAN
3.1. Alat 26
3.2. Bahan 27
3.3. Prosedur Penelitian 28
3.3.1.Pembuatan Metil Ester Asam Lemak Bebas Dari Minyak Kelapa 28 3.3.2. Amidasi Metil Ester Asam Lemak Dengan Etanolamin 28 3.3.3. Amidasi Metil Ester Asam Lemak Dengan Dietanolamin 29 3.3.4. Analisa Hasil Reaksi
a. Analisa Metil Ester Asam Lemak minyak Kelapa
Dengan KG 29
c. Penentuan Titik Lebur 30
d. Penentuan HLB dengan Metode Cincin Dunoy 30
3.4. Bagan Penelitian 31
3.4.1.Pembuatan Metil Ester Asam Lemak Bebas Dari Minyak Kelapa 31 3.4.2. Amidasi Metil Ester Asam Lemak Dengan Etanolamin 32 3.4.3. Amidasi Metil Ester Asam Lemak Dengan Dietanolamin 33
BAB 4. HASIL DAN PEMBAHASAN
4.1. Hasil 34
4.1.1. Hasil Analisa Komposisi Asam Lemak Pada Minyak Kelapa 34 4.1.2. Hasil Analisis Spektroskopi FT-IR Metil Ester Asam Lemak
Bebas Minyak Kelapa 35
4.1.3.Etanolamida Dari Hasil Amidasi Metil Ester Asam Lemak
Minyak Kelapa Dengan Etanolamina 36
4.1.4. Ditanolamida Dari Hasil Amidasi Metil Ester Asam Lemak
Minyak Kelapa Dengan Dietanolamina 37
4.1.5. Hasil Penentuan Titik Lebur Etanolamida dan Dietanolamida
Campuran Asam Lemak Bebas Minyak Kelapa 38
4.1.6. Hasill Uji CMC Etanolamida Dan Dietanolamida dengan
Menggunakan Metode Cincin Dunoy 39
4.2. Pembahasan 40
4.2.1. Pembuatan Metil Ester Asam Lemak Bebas Minyak Kelapa 40 4.2.2 Pembuatan Etanolamida Dari meti Ester Asam Lemak Bebas
Minyak Kelapa Dengan Menggunakan Etanolamida 42
4.2.3. Pembuatan Dietanolamida Dari meti Ester Asam Lemak Bebas Minyak Kelapa Dengan Menggunakan Dietanolamina 43 4.2.4.Hasil Uji Titik Lebur Etanolamida dan Dietanolamida 45 4.2.5.Hasil uji CMC Dengan Menggunakan Alat Tensiometer 45
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 47
5.2. Saran 47
DAFTAR TABEL
Halaman
Tabel 2.1. Diagram Alur Oleokimia 5
Tabel 2.2. Komposisi Asam Lemak Minyak Kelapa 17
Tabel 4.1. Komposisi Asam Lemak Bebas Minyak Kelapa 34
Tabel 4.2. Hasil Pengukuran Tegangan Permukaan Air Etanolamda
Dengan Alat Tensiometer 39
Tabel 4.4. Hasil Pengukuran Tegangan Permukaan Air Dietanolamida
DAFTAR GAMBAR
Halaman
Gambar 2.1. Reaksi Pembentukan Amida 8
Gambar 2.2. Reaksi Pembentukan Alkanolamida Menggunakan Asam Berlebih 9 Gambar 2.3. Reaksi Pembentukan alkanolamida menjadi etnaloamida berlebih 10 Gambar 2.4. Reaksi Pembentukan alkanolamida rantai panjang dari trigliserida 11 Gambar 2.5. Reaksi Pembentukan Alkanolamida rantai panjang dari
reaksi alkanolamida dengan etilen oksida 11
Gambar 2.6. Reaksi Pembentukan Amida primer 12
Gambar 2.7. Reaksi Pembentukan Amida sekunder 12
Gambar 2.8. Proses pengolahan minyak kelapa sawit 20
Gambar 2.9. Proses pengolahan minyak kelapa 20
Gambar 2.10. Suatu skala menunjukkan harga HLB surfaktan 23
Gambar 4.1. Kromatogram Metil Ester Asam Lemak Minyak Kelapa 34
Gambar 4.2. Spektrum FT-IR Metil Ester Asam Lemak Bebas Minyak Kelapa 36 Gambar 4.3. Spektrum FT-IR Etanolamida Dari Hasil Amidasi Metil 37
Ester Asam Lemak Bebas Minyak Kelapa
Gambar 4.4. Spektrum FT-IR Dietanolamida Dari Metil Ester Asam 38 Lemak Bebas Minyak Kelapa
Gambar 4.5. Mekanisme Reaksi Pembuatan Metil Ester Asam lemak Campuran 41
Gambar 4.6. Mekanisme Reaksi Pembuatan Etanolamida Dari
Metil Ester Asam Lemak Bebas Minyak Kelapa Dengan
Menggunkan Etanolamin 43
Gambar 4.7. Mekanisme Reaksi Pembuatan Dietanolamida Dari Metil Ester Asam Lemak Bebas Minyak Kelapa
ABSTRAK
Senyawa alkanolamida dari asam lemak bebas yang merupakan surfaktan bukan ionik telah banyak dimanfaatkan dalam berbagai keperluan terutama dalam kosmetik, detergen dan tekstil. Dalam penilitian ini dilakukan sintesis etanolamida dan dietanolamida yang diperoleh dari amidasi metil ester asam lemak bebas minyak kelapa dengan etanolamina maupun dengan dietanolamina. Metil ester asam lemak bebas dihasilkan dari reaksi esterifikasi asam lemak bebas minyak kelapa dengan metanol menggunakan katalis asam sulfat dalam pelarut benzena pada kondisi refluks dengan rendemen reaksi sebesar 91,66%. Selanjutnya amidasi metil ester asam lemak bebas dengan etanolamina menggunakan katalis natrium metoksida pada suhu 80-90 o
SYNTETIC OF MIXING ETHANOLAMIDE AND DYETHANOLAMIDE AS MIXING FROM FREE FATTY ACID METHYL ESTER COCONOUT OIL
AND COMPOUNDS ETHANOLAMIDE AND DIETHANOLAMIDE USING CATALYST NATRIUM METHOXIDE
ABSTRACT
BAB I
PENDAHULUAN
1.1 Latar Belakang
Amida adalah turunan asam karboksilat yang paling tidak reaktif, karena itu golongan senyawa ini banyak terdapat di alam. Penggunaan yang luas senyawa amida tersebut, seperti halnya amida asam lemak banyak digunakan sebagai pelumas dalam pembuatan resin internal maupun eksternal.
Sintesis senyawa alkanolamida yang telah dilakukan adalah melalui reaksi antara asam lemak dengan etanolamina ataupun dietanolamina dengan asam lemak dimana dalam hal ini sering terjadi persaingan antara terbentuknya amida dan ester apabila kondisi reaksi tidak diatur dengan baik. Turunan asam lemak alkanolamida banyak digunakan pada kosmetik, detergen (bentuk bubuk maupun cairan), pelunak pada pembuatan tekstil dan pencegah korosif. Pembuatan senyawa alkanolamida ini dilakukan dengan mereaksikan asam lemak amina pada suhu tinggi pada suhu 120-180oC (Maag, 1984).
Destilat asam lemak minyak kelapa (asam lemak bebas minyak kelapa) merupakan hasil samping proses deodorizing pada pengolahan minyak kelapa menjadi minyak goreng. Pemanfaatan asam lemak bebas minyak kelapa dalam industri saat ini hanya digunakan sebagai bahan dasar pembuatan sabun cuci jenis batangan. Untuk meningkatkan nilai tambah dari asam lemak bebas tersebut maka akan di transformasi menjadi senyawa alkanolamida.
Berdasarkan hal diatas peniliti tertarik untuk mensintesis senyawa etanolamida dan dietanolamida campuran dari metil ester asam lemak bebas minyak kelapa dengan senyawa etanolamina dan dietanolamina menggunakan katalis Natrium Metoksida, dimana metil ester asam lemak bebas minyak kelapa diperoleh dari reaksi esterifikasi antara asam lemak bebas minyak kelapa dengan metanol menggunakan katalis H2SO4(p). Senyawa etanolamida dan dietanolamida yang diperoleh di uji titik lebur, perubahan gugus fungsi dengan FT-IR dan CMC dengan menggunakan metode
cincin dunoy.
1.2 Permasalahan
Untuk meningkatkan nilai ekonomi asam lemak bebas minyak kelapa yang berasal dari hasil samping pada industri pembuatan minyak goreng, maka asam lemak tersebut akan ditransformasi menjadi senyawa alkanolamida. Sebagai permasalahan pada penelitian ini adalah
1. Apakah senyawa etanolamida dan dietanoalamida campuran dapat disintesis melalui reaksi amidasi metil ester asam lemak bebas minyak kelapa dengan senyawa etanolamina dan dietanolamida menggunakan katalis Natrium Metoksida. Dimana metil ester asam lemak campuran minyak kelapa diperoleh dari reaksi esterifikasi antara asam lemak bebas minyak kelapa dengan metanol menggunakan katalis H2SO4(p).
1.3 Pembatasan Masalah
Dibatasi pada :
1. Asam lemak bebas minyak kelapa diperoleh dari salah satu industri pengolahan minyak goreng di Medan yang merupakan hasil samping deodorizing pengolahan minyak kelapa menjadi minyak goreng
2. Metil ester asam lemak bebas minyak kelapa yang diperoleh dari reaksi esterifikasi antara asam lemak bebas minyak kelapa dengan metanol dengan menggunakan katalis H2SO4(p)
3. Senyawa alkanolamida disintesis melalui reaksi amidasi metil ester asam lemak bebas minyak kelapa dengan menggunkan sumber amin yang berbeda yaitu etanolamin dan dietanolamina
4. Analisis hasil dilakukan melalui pemeriksaan gugus fungsi analisa FT-IR, titik lebur menggunakan melting point, dan nilai CMC dengan metode cincin dunoy
1.4 Tujuan Penilitian
1. Untuk menintesis senyawa etanolamida campuran dari reaksi amidasi antara metil ester asam lemak bebas minyak kelapa dengan etanolamina dan dietanolamina menggunakan katalis NaOMe, dimana metil ester asam lemak bebas minyak kelapa diperoleh melalui reaksi esterifikasi asam lemak bebas minyak kelapa dengan metanol menggunakan katalis H2 SO4(p).
2. Untuk mengetahui nilai CMC senyawa etanolamida dan dietanolamida campuran yng diperoleh.
1.5 Manfaat Penelitian
Memberikan informasi tentang sintesis senyawa organik dalam bidang oleokimia, khususnya senyawa etanolamida nantinya dapat dimanfaatkan sebagai surfaktan pada bidang industri pangan dan non pangan.
1.6 Lokasi penilitan
1.7 Metodologi Penelitian
BAB 2
TINJAUAN PUSTAKA 2.1. Oleokimia
Oleokimia merupakan cabang ilmu kimia yang mempelajari trigliserida yang berasal dari minyak dan lemak menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi, maupun sabun. Oleokimia merupakan turunan gliserol dengan asam lemak yang berubah dalam bentuk turunanya yang digunakan baik sebagai surfaktan, deterjen, polimer, aditif bahan bakar dan sebagainya. Diagram alur oleokimia digambarkan pada tabel 2.2.
Bahan dasar oleokimia seperti gliserol, asam lemak, alkil asam lemak, amina asam lemak dan alkohol asam lemak dapat diperoleh dengan mengubah lipida baik dari yang berasal dari hewan atau tumbuhan menjadi gliserol dan turunan asam lemak. (Rictler Knaut, 1984).
Asam lemak adalah asam karboksilat yang diperoleh dari hidrolisa suatu lemak atau minyak, umumnya memiliki rantai hidrokarbon panjang dan tidak bercabang. Dan kebanyakan trigliserida alami adalah trigliserida campuran, yaitu triester dengan komponen asam lemak yang berbeda (Wilbraham, 1992). Rantai hidrokarbon dalam suatu asam lemak dapat bersifat jenuh. Asam lemak yang tersebar paling merata dalam alam yaitu asam oleat, mengandung satu ikatan rangkap (Fessenden, 19
Metil ester merupakan zat antara yang sangat penting dalam industri oleokimia. Pembuatan metil ester asam lemak telah dikembangkan dengan cara pengadukan berkecepatan tinggi pada suhu kamar dengan waktu 15-30 menit, serta memberikan hasil reaksi pembentukan metil ester asam lemak sebesar 90-95 %. (Mittelbach dan Trihart, 1998).
2.1.1 Ester
Ester adalah turunan asam karboksilat yang dibentuk oleh gugus alkoksi dan asil merupakan salah satu dari kelas-kelas senyawa organik yang sangat berguna, dapat diubah melalui berbagai proses menjadi aneka ragam senyawa lain. Ester lazim dijumpai di alam (Fessenden & Fessenden, 1999). Ester diberi nama seperti penamaan pada garam. Ester-ester umumnya mempunyai bau yang enak, seperti rasa buah dan wangi buah-buahan (Hart, 1990).
Esterifikasi adalah proses reaksi antara asam lemak bebas (ALB/ FFA) dengan alkohol rantai pendek (metanol atau etanol) menghasilkan alkil ester asam lemak dan air. Katalis yang digunakan untuk reaksi esterifikasi adalah asam, biasanya asam sulfat (H2SO4) atau asam fosfat (H2PO4). Berdasarkan kandungan FFA dalam minyak nabati maka proses pembuatan biodiesel secara komersial dibedakan menjadi 2, yaitu: 1. Transesterifikasi dengan katalis basa (sebagian besar menggunakan kalium
2. Esterifikasi dengan katalis asam (umumnya menggunakan asam sulfat) untuk minyak nabati dengan kandungan FFA tinggi dilanjutkan dengan transesterifikasi dengan katalis basa (Maharani, 2010).
2.1.2 Amida
Suatu amida ialah senyawa yang mempunyai nitrogen trivalen terikat pada suatu gugus karbonil. Suatu amida diberi nama asam karboksilat induknya, dengan mengubah imbuhan asam…-oat (atau –at) menjadi amida.
H3C C O
NH2
IUPAC = etanamida TRIVIAL = asetamida
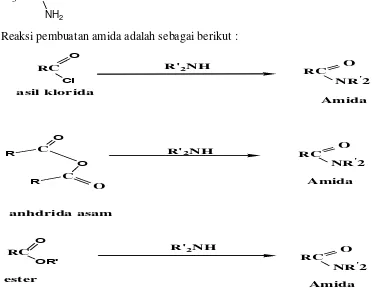
Reaksi pembuatan amida adalah sebagai berikut :
Gambar 2.1. Reaksi Pembentukan amida
Amida disintesis dari derivat asam karboksilat dan amonia atau amina yang sesuai (Fessenden and Fessenden,1999).
2.1.3 Alkanolamida
Alkanolamida adalah surfaktan bukan ionik dimana gugus hidroksil yang dimilikinya tidak cukup hidrofilik untuk membuat alkanolamida larut dalam air dengan sendirinya. Alkanolamida digunakan sebagai bahan pembusa (foam boosting) dalam pembuatan shampoo.
Jenis alkanolamida yang paling penting adalah dietanolamida. Senyawa N-etanol alkil amida adalah senyawa yang termasuk dalam golongan amida asam lemak yang dapat dimanfaatkan sebagai surfaktan dalam produk detergen, kosmetik dan tekstil. Senyawa ini dapat dibuat dengan mereaksikan asam lemak sawit destilat dengan senyawa yang mengandung gugus atau atom Nitrogen seperti alkanolamina (Nuryanto dkk, 2002).
Alkanolamida banyak digunakan sebagai bahan foam boosting dan dalam campuran bahan surfaktan lain berguna sebagai cairan pencuci piring dan juga dalam pembuatan shampo. Selain itu alkanolamida merupakan bahan pelembut rambut, penstabil busa, bahan perekat dan bersama sama dengan glikol stearat dapat mengkilaukan rambut ( Said dan Salimon, 2001). Amida digunakan sebagai bahan baku setengah jadi untuk produksi fatty nitril dan fatty amina serta amida juga diguanakan dalam industri obat-obatan. Palmitamida, steramida dan oleoamida digunakan sebagai bahan penyerasi pada penguatan karet alam dengan silika ( Suryani, 2008).
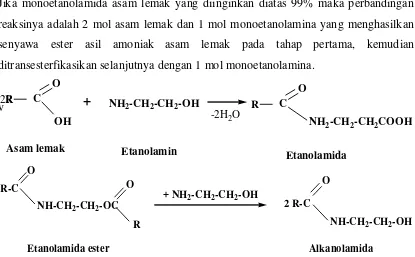
Senyawa alkanolamida dapat diperoleh melalui reaksi antara asam lemak dengan etanolamina dan dietanolamina bereaksi dengan asam lemak berlangsung biasanya diatas 1800C, reaksi dengan monoetanolamina akan melepaskan air dan terbentuk alkanolamida dan etanolamida ester asam lemak sebagai produk samping, seperti reaksi pada gambar 2.6.1. Kandungan amida pada suhu reaksi 180oC , rata-rata 94-95% (Mutter, dkk.1968).
Gambar 2.2. Reaksi Pembuatan Alkanolamida menggunakan asam berlebih
Jika monoetanolamida asam lemak yang diinginkan diatas 99% maka perbandingan reaksinya adalah 2 mol asam lemak dan 1 mol monoetanolamina yang menghasilkan senyawa ester asil amoniak asam lemak pada tahap pertama, kemudian ditransesterfikasikan selanjutnya dengan 1 mol monoetanolamina.
v
Gambar2.3. Reaksi pembentukan alkanolamida menjadi etanolamida berlebih
Gambar 2.4. Reaksi pembentukan alkanolamida dari trigliserida
Gliserol yang diperoleh dapat didestilasi pada suhu 180oC dan jika ada yang sisa tidak akan ada yang mengganggu aplikasinya. Dietanolamida yang dibuat dari minyak kelapa mengandung amida yang diinginkan 80%, gliserol 9%, garam asam lemak 7% dan dietanolamina bebas 2%.
R-C N
CH2-CH2-OH CH2-CH2-OH O
+ x CH2 O
CH2
R-C N
CH2-CH2-(-OCH2-CH2)x/2-OH O
CH2-CH2-(-OCH2-CH2)x/2-OH
Dietanolamida etilen oksida
Alkanolamida rantai panjang
Gambar 2.5. Reaksi pembentukan alkanolamida rantai panjang dari reaksi alkanolamida dengan etilen oksida
Reaksi alkanolamida dengan etilen oksida memberikan hasil yang memiliki pola sifat yang sama tetapi kelarutan airnya lebih besar dan biasanya menjadi amida, tergantung pada medan aplikasi pada gambar 2.6.
2.1.4. Reaksi Pembuatan Alkanolamida
Amida primer juga dibuat dengan mereaksikan ammonia dengan metil ester asam lemak. Reaksi ini mengikuti konsep HSAB dimana H+ dari ammonia merupakan
hard acid yang mudah berikatan untuk bereaksi dengan hard base CH3O- untuk membentuk metanol. Sebaliknya NH2- lebih soft-base dibandingkan dengan CH3O -akan terikat dengan R-CO+ yang lebih soft acid dibandingkan H+ membentuk amida.
R C
Metil ester asam lemak amoniak amida metanol
Gambar 2.6. Reaksi Pembentukan Amida Primer
Pembuatan amida sekunder dilakukan dengan mereaksikan asam lemak dengan amina. RCO2H + R'NH2 150-200
o
C RCONHR'
+ H2O
Asam karboksilat amina amida Air
Gambar 2.7. Reaksi Pembentukan Amida Sekunder
Senyawa amina yang digunakan untuk reaksi tersebut antara lain etanolamin dan dietanolamina, yang jika direaksikan dengan asam lemak pada suhu tinggi, 150oC - 200oC akan membentuk suatu amida dan melepaskan air. Reaksi aminasi antara alkil klorida lebih mudah dengan gugus amina dibandingkan dengan terjadinya reaksi esterifikasi dengan gugus hidroksil, juga sebelumnya telah teruji dengan adanya reaksi antara lauril anhidrida dengan propanolamin untuk membentuk senyawa N,N-dilauroil propanolamin (Cho dan Kim, 1985).
C12H21 Cl + C12H21NH(CH2)3OH + HCl
ester dengan bantuan katalis NaOCH3 baru dapat terjadi pada suhu 100o-120o C, sedangkan apabila tidak digunakan katalis maka reaksi baru dapat berjalan pada suhu 150o-250o C (Gabriel, 1984).
Seperti asam karboksilat, amida memiliki titik cair dan titik didih yang tinggi karena adanya pembentukan ikatan hidrogen. Amida mampu membentuk ikatan hidrogen intermolekul selama masih terdapat hidrogen yang terikat pada nitrogen. Senyawa ini juga sangat istimewa karena nitrogennya mampu melepaskan elektron
dan mampu membentuk sebuah ikatan π dengan karbon karbonil. Pelepasan elektron
ini menstabilkan hibrida resonansinya. Ikatan atom karbon dengan nitrogen pada amida jauh lebih lemah, kalau atom karbon ini juga disambungkan pada suatu oksigen dengan ikatan rangkap (Bresnick, 1996).
2.1.5. Etanolamina
Etanolamin (NH2-(CH2)2-OH) merupakan larutan yang tidak berwarna, larut dalam air dan bisa digunakan dalam pembuatan secrubbing (penghilangan) hidrogen H2S dan CO2 yang berasal dari minyak petroleum dan bisa juga digunakan sebagai dry
cleaning, dalam pembuatan cat dan bahan bidang farmasi (obat-obatan). Sifat-sifat dietanolamina adalah sebagai berikut :
a. Rumus molekul : C2H7NO b. Berat molekul : 61,08 g/mol c. Densitas : 1,02 gr/cm3
d. Kelarutan : air, metanol, dan aseton e. Viskositas 25 oC : 18,95 cps
f. Titik leleh : 25 oC
2.1.6. Dietanolamina
Dietanolamina adalah senyawa yang terdiri dari gugus amina dan dialkohol. Dialkohol menunjukkan adanya dua gugus hidroksil pada molekulnya. Dietanolamina juga dikenal dengan nama bis (hydroxyethyl)amine, diethylolamine, hydroxtdiethylamine, diolamine dan 2,2-iminodiethanol.
c. Densitas : 1,088 g/cm3 d. Titik leleh : 28ºC (1atm) e. Titik didih : 268,8ºC (1atm)
f. Kelarutan : air, metanol, dan aseton
g. Viskositas 30oC : 351,9 cp (Anonim II, 1976).
Dietanolamida pertama kali diperoleh dengan mereaksikan dua mol dietanolamina dengan satu mol asam lemak. Senyawa ini diberi nama Krichevsky
amida sesuai dengan nama penemunya. Bahan baku yang digunakan dalam produksi dietanolamida dapat berupa asam lemak, trigliserida atau metil ester. Dietanolamida biasanya diproduksi secara kimia konvensional pada temperatur 150ºC selama 6-12 jam (Herawan, dkk, 1999).
+
2.3. Lemak dan Minyak
Lemak dan minyak dapat juga dibedakan berdasarkan perbedaan titik leleh nya, pada suhu kamar lemak berwujud padat, sedangkan minyak berwujud cair (Wilbraham,1992). Lemak dan minyak adalah triester dari gliserol, yang dinamakan trigliserida. Lemak dan minyak sering dijumpai yaitu sebagai mentega dan lemak hewan. Minyak umumnya berasal dari tumbuhan, contohnya minyak jagung, minyak zaitun, minyak kacang dan lain-lain. Minyak dan lemak mempunyai struktur dasar yang sama (Hart, 1990).
Asam lemak yang mempunyai berat molekul yang paling besar di dalam molekul gliserida merupakan bagian yang reaktif. Sehingga asam lemak mempunyai pengaruh yang paling besar terhadap lemak dan minyak. Asam lemak ini masih dibedakan antara asam lemak yang jenuh dan tak jenuh. Asam-asam lemak jenuh yang telah dapat diidentifikasi sebagai bagian dari lemak mempunyai atom C4 hingga C26. Asam palmitat C16 terdapat paling banyak, senyawa tersebut merupakan bagian dari hampir semua lemak.
Asam-asam lemak yang rantai karbonya mengandung ikatan rangkap disebut asam lemak tak jenuh. Derajat ketidak jenuhan dari asam lemak tergantung pada jumlah rata-rata dari ikatan rangkap di dalam asam lemak. Pada asam lemak tak jenuh masih dibedakan antara asam yang mempunyai bentuk tunggal. Bentuk yang lain adalah asam conjugated dimana anatara atom-atom C yang tertentu terdapat ikatan tunggal dan ikatan rangkap berganti-ganti (Sastrohamidjojo, 2005).
2.3.1 Minyak Kelapa
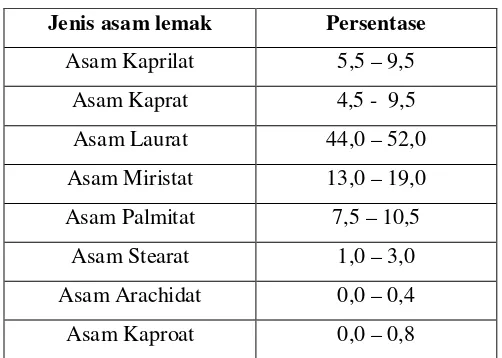
Minyak kelapa berdasarkan kandungan asam lemak digolongkan kedalam asam laurat, karena kandungan asam lauratnya paling besar jika dibandingkan dengan asam lemak lainya. Komposisi asam lemak minyak kelapa dalam tabel 2.1.
Tabel 2.2. Komposisi Asam Lemak Minyak Kelapa Asam lemak jenuh:
Asam Lemak Jenuh
Jenis asam lemak Persentase
Asam Kaprilat 5,5 – 9,5
Asam Kaprat 4,5 - 9,5
Asam Laurat 44,0 – 52,0
Asam Miristat 13,0 – 19,0
Asam Palmitat 7,5 – 10,5
Asam Stearat 1,0 – 3,0
Asam Arachidat 0,0 – 0,4
Asam Kaproat 0,0 – 0,8
Asam Lemak Tidak Jenuh
(Ketaren, 2008)
Asam lemak bentuk cis mempunyai titik cair yang lebih rendah dibandingkan dengan bentuk trans dengan panjang rantai yang sama. Panjang rantai karbon juga mempengaruhi titik cair. Pada asam lemak jenuh, titik cair semakin meningkat dengan semakin panjangnya rantai karbon. Pada asam lemak tidak jenuh, titik cair akan semakin menurun dengan bertambahnya ikatan rangkap, sehingga asam lemak jenuh mempunyai titik cair yang lebih tinggi dibandingkan dengan asam lemak tidak jenuh dengan jumlah karbon yang sama.
Sebagian besar minyak nabati berbentuk cair karena mengandung sejumlah asam lemak tidak jenuh, yaitu asam oleat, asam linoleat, dan linolenat dengan titik cair yang lebih rendah. Secara alamiah asam lemak jenuh yang mengandung atom karbon C8 berwujud cair,sedangkan jika lebih besar dari C8 akan berwujud padat (Ketaren, 2008).
Asam palmitoleat 0,0 – 1,3
Asam Oleat 5,0 – 8,0
Minyak kelapa berdasarkan kandungan asam lemak digolongkan kedalam asam laurat, karena kandungan asam lauratnya paling besar jika dibandingkan dengan asam lemak lainnya. Berdasarkan tingkat ketidakjenuhnya yang dinyatakan dengan bilangan iodine (iodine value), maka minyak kelapa dapat dimasukkan kedalam golongan non drying oils, karena bilangan iodine minyak tersebut bekisar antara 7,5- 10,5. Dari tabel 2.1 dapat dilihat bahwa asam lemak jenuh minyak kelapa lebih kurang 90 persen. Minyak kelapa mengandung 84% trigliserida dengan tiga molekul asam lemak jenuh, 12 persen trigliserida dengan dua asam lemak jenuh dan 4 persen trigliserida dengan satu asam lemak jenuh.
Minyak kelapa yang belum dimurnikan mengandung sejumlah kecil komponen bukan minyak, misalnya fosfatida, gum sterol (0,06- 0,08%), tokoferol (0,003 %) dan asam lemak bebas (kurang dari 5 %), sterol yang terdapat di dalam minyak nabati disebut phitosterol dan mempunyai dua isomer yaitu beta sitoterol (C29H50O) dan stigmasterol (C29 H48O). Sterol bersifat tidak berwarna, tidak berbau stabil dan berfungsi sebagai stabilizer dalam minyak. Tokoferol (titik cair 158-160oC), Beta tokoferol (titik cair 138-140oC) dan gamma-tokoferol.
Minyak kelapa mentah (crude coconut oil) sama seperti minyak inti sawit
(palm kernel oil) yang memilki kadar asam lemak bebas yang tinggi (1-6%). Kedua minyak nabati diatas sering disebut sebagai minyak (lauric oil) kaya akan asam lemak rantai pendek (> 50% C6:O-C12:O) (Young. 1983). Refining secara fisika dan kimia dapat diterapkan pada pengolahan minyak namun demikian untuk minyak kelapa yang dilakukan refining secara kimia,karena kandungan FFA awal yang tinggi sehingga
refining secara fisika untuk minyak yang kaya asam laurat lebih disukai. (Tandy, dkk. 1984). Adapun tahap pengolahan minyak untuk dapat dimakan adalah seperti Gambar 2.8 dan 2.9 (Morad, dkk. 2006).
Refining adalah suatu proses teknologi industri untuk memperoleh minyak
a. Degumming
Suatu tahap refining minyak dan lemak dengan penambahan asam pospat pada minyak mentah untuk memisahkan pospolipida.
b. Bleaching
Proses penghilangan warna, komponen yang teroksidan , gum,sabun, logam-logam melalui proses pencampuran minyak dengan adsorben (silika atau
bleaching earth). Adsorben yang mengandung pengotor kemudian dipisahkan
dengan penyaringan .
c. Deodoriting
Suatu proses penghilangan asam lemak , bau, rasa dan pengotor yang tidak stabil, dan juga beberapa komponen warna dengan cara destilasi pada suhu dan tekanan tinggi (Morad, dkk. 2006)
d. Netralisasi
Gambar 2.8 Proses pengolahan minyak kelapa Gambar 2.9. Proses pengolahan minyak kelapa
Sawit
Asam lemak bebas diperoleh dari proses hidrolisa, yaitu penguraian lemak atau trigliserida oleh molekul air yang menghasilkan asam lemak bebas dan gliserol. Asam lemak bebas terbentuk karena proses oksidasi dan hidrolisa enzim selama pengolahan dan penyimpanan. Dalam hal ini pemisahan asam lemak bebas minyak kelapa juga sama dengan proses pengolahan kelapa sawit, yakni seperti pada gambar 2.9. dimana pada bagan tertulis minyak kelapa sawit sama dengan proses pemisahan minyak kelapa. Dimana pangan, asam lemak dengan kadar lebih besar dari 0,2% dari berat lemak akan mengakibatkan rasa yang tidak diinginkan dan kadang-kadang dapat meracuni tubuh (Sudarmadji, 1989). Pada pengolahan minyak kelapa biasa atau minyak goreng secara tradisional dihasilkan minyak kelapa bermutu kurang baik. Hal tersebut ditandai dengan adanya kadar air dan asam lemak bebas yang cukup tinggi di dalam minyak kelapa. Bahkan warnanya agak kecoklatan sehingga cepat menjadi tengik.
Kontak yang terlalu lama dengan udara pada suhu tinggi harus dicegah karena akan mengurangi daya pucat akibat oksidasi. Asam lemak bebas juga meningkat bila klarifikasi terlalu lama. Kadar air pada minyak masih terlalu tinggi sehingga harus dikurangi sampai dibawah 0,1% untuk mencegah reaksi hidrolisis secara otokatalitik yang dapat menyebabkan peningkatan kadar Asam lemak bebas . Untuk itulah minyak harus dikeringkan dan pengeringan sebaiknya dilakukan dalam vakum. Sebelum penimbunan, minyak harus didinginkan lebih dahulu sampai dibawah suhu 50°C untuk mencegah terjadinya oksidasi pada waktu pemasukan minyak kedalam tangki timbun. Selain itu, pabrik harus bersih karena pabrik yang kotor dapat menaikkan asam lemak bebas.
2.3.3. Surfaktan
adalah surfaktan anionik, “benzalkonium” klorida (N-benzil amonium kuartener klorida) yang bersifat antibakteri adalah contoh surfaktan kationik. Surfaktan netral mengandung suatu gugus non-ion seperti suatu karboksilat yang dapat berikatan hidrogen dengan air.
Surfaktan merupakan zat aktif permukaan yang mempunyai peranan penting untuk menurunkan tegangan permukaan bahan yang dikenai. Aktivitas kerja suatu surfaktan karena sifat ganda dari molekul tersebut. Molekul surfaktan memilki bagian yang cinta akan lemak/ minyak. Bagian polar molekul surfaktan dapat bermuatan positif, negatif atau netral (Lehninger, 1988).
Seperti telah dibicarakan diatas telah dikenal surfaktan alami seperti monogliserida, diglesrida dan turunan asam fosfolipid seperti lesitin, termasuk turunan ester asam lemak dengan poliol yang dibuat secara sintesis seperti ester sorbitol, ester sukrosa, ester glikosa dan lainnya, maka dikenal juga surfaktan yang merupakan ester asam lemak yang teretoksilasi. Surfaktan ini biasanya dibuat dengan mereaksikannya metil ester asam lemak dengan epokisda seperti reaksi berikut (Hama, 1997).
RCOOCH3 +
O
RCO(EO)NOCH3
Metil ester asam lemak Etilen Oksida Metil Ester Etoksilat
Metil ester etoksilat juga dapat dibuat dari metil ester epoksida dengan menggunakan katalis yang bersifat basa melalui proses etoksilasi dan transesterifikasi (Cox dan Weerasooriya, 1997). Surfaktan menurunkan tegangan permukaan air dengan mematahkan ikatan-ikatan hidrogen pada permukaan. Surfaktan melakukan hal ini dengan menaruh kepala-kepala hidrofiliknya pada permukaan air dengan ekor-ekor hidrofobiknya terentang menjauhi permukaan air (Fessenden & Fessenden, 2006).
asam laurat pada minyak kelapa. Oleh karena itu,minyak sawit juga dapat dimanfaatkan dalam pembuatan surfaktan dietanolamida.
Sedangkan surfaktan yang memilki ikatan amida seperti N-lauril-β-alanin juga telah dikembangkan dengan mereaksikan amina dengan metil ester asam lemak dengan menggunakan enzim lipase (Izumi,1997). Surfaktan basa amina yang diturunkan dari gliserol untuk membentuk senyawa 1-O-(1-aminoasil)-3-O-miristoilgliserol juga telah dikembangkan (Valivety, 1997). Selanjutnya Griffin secara skematis memberikan hubungan antara HLB dengan penggunaan surfaktan sebagai bahan pemantap, weiting agent, detergen dan bahan pelarut seperti pada gambar berikut :
18
15
12
9
6
3
0
Zat-zat larutan
Detergen
O/W zat pengemulsi
W/O zat pengemulsi
Kebanyakan zat anti busa Zat pembasah dan penyebar
Klasifikasi kimia yang paling berguna dari surfaktan didasarkan pada sifat hidrofil dan lipofilnya. Dibawah ini ada empat klasifikasi dasar dari surfaktan yaitu :
1. Surfaktan anionik , memiliki gugus hidrofil yang bermuatan negatifseperti gugus karboksilat (RCOO-M+), sulfonasi (RSO3-M+), sulfat (ROSO3-M+) atau phospat (ROPO3-M+).
2. Surfaktan kationik, gugus hidrofil memiliki muatan positif. Sebagai contoh ammonium halida kwartener (R4N+X-).
3. Surfaktan nonionik, dimana gugus hidrofil tidak memiliki muatan tetapi turunannya memilki kelarutan yang besar terhadap air dibandingkan gugus polar tertinggi seperti senyawa (R-OCH2CH2O-)R adalah gugus poliol termasuk gula. 4. Surfaktan amfoter (zwitter ion) memliki muatan positif dan muatan negatife,
sebagai contoh sulfobetain RN+(CH3)2CH2CH2SO3- (Martin, N. A. 1989).
2.4. Konsentrasi Missel kritis
Bila penambahan surfaktan melebihi konsentrasi kritis tertentu, maka urfaktan akan mengalami agregasi dan membentuk struktur misel. Penambahan surfaktan tersebut tidak akan mempengaruhi tegangan permukaan walaupun konsentrasi surfaktan terus ditingkatkan. Konsentrasi kritis terbentuknya misel ini disebut sebagai critical micelle
concentration (CMC). Tegangan permukaan akan menurun hingga CMC tidak akan
menurunkan tegangan permukaan, yang menunjukkan bahwa permukaan cairan telah menjadi jenuh, dimana misel telah terbentuk dan berada dalam kesetimbangan dinamis dengan monomernya.
Tegangan permukaan (γ) suatu cairan dapat didefinisikaan sebagai
Tegangan permukaan dapat diukur dengan metode cincin Du Nuoy. Pengukuran tegangan permukaan dengan metode cincin Du Nouy didasarkan atas penentuan gaya yang dibutuhkan untuk mengangkat cincin dari permukaan cairan. Gaya ini diukur dengan jelas mencelupkan cincin yang digantung pada lengan neraca dan perlahan-lahan mengangkatnya sampai cincin tersebut meninggakan cairan. Metode ini tidak hanya dapat digunakan untuk mengukur tegangan antarmuka cairan-cairan seperti misalnya tegangan antarmuka (minyak-air atau kloroform-air) (Tang, 2011).
2.5. Katalis
Katalis adalah suatu zat yang mempercepat tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
Katalis dapat dibedakan ke dalam dua golongan utama: katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama.
Efek kelancaran reaksi dari katalis basa adalah yang paling besar, sehingga katalis inilah yang sekarang paling umum diterapkan dalam praktek. Larutan natrium metoksida ini dibuat dengan mencampurkan natrium hidroksida dan metanol. Natrium hidroksida larut dalam metanol. Reaksi antara semua natrium hidroksida dengan metanol merupakan reaksi eksoterm (menghasilkan panas) membentuk molekul polar (CH3O-Na+). Adanya kandungan air, asam lemak bebas dan hidroperoksida dapat memperlambat aktivitas katalis natrium metoksida.
BAB 3
METODE PENELITIAN
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah:
- Alat Vakum Fisons - Kertas Saring Biasa
- Neraca Analitis Mettler PM 480 - Gelas Erlenmeyer 250 ml Pyrex
- Gelas Ukur 100 ml Pyrex - Gelas Beaker 250 ml Pyrex - Spektrofotometer FT-IR Shimadzu - Tabung CaCl2 Pyrex
- Corong Pisah Pyrex - Corong Penetes Pyrex - Botol Akuades
- Magnetik Bar
- Labu leher tiga Pyrex - Termometer 110oC Fisons - Kondensor Bola Pyrex - Rotarievaporator Heidolph - Hotplate Stirer Fisons - Penyambung kondensor
- Labu leher dua Pyrex
- Labu Takar Pyrex - Corong Pyrex
- Melting point aparatus Gallenkamp
3.2 Bahan-Bahan
- Asam lemak bebas minyak kelapa
- Etanolamina p.a.(E.Merck)
- Dietanolamina p.a (E. Merk )
- Benzena p.a (E. Merk )
- Metanol p.a ( E. Merk )
- n-Heksana p.a ( E. Merk )
- Natrium klorida p.a ( E. Merk )
- Dietil eter p.a ( E. Merk )
- Air Suling
- Kalsium Klorida anhidrous p.a ( E. Merk )
- Natrium Metoksida p.a ( E. Merk )
- Natrium sulfat anhidrous p.a ( E. Merk )
- Asam sulfat 98% p.a ( E. Merk )
- Natrium Sulfat Anhidrous p.a.( E. Merck)
- Metanol p.a. ( E. Merck )
3.3 Prosedur Penelitian
3.3.1 Pembuatan metil ester asam lemak bebas dari minyak kelapa
3.3.2. Amidasi Metil Ester Esam Lemak Dengan Etanolamin
Ke dalam labu alas bulat leher dua volume 500 ml dimasukkan sebanyak 11,705 gram (0,05 mol) metil ester asam lemak campuran kemudian ditambahkan 3,018 ml (0,093mol) etanolamina dan diaduk. Dirangkai alat refluks, kemudian di tambahkan NaOMe sebanyak 5 gram dalam 20 ml metanol. kemudian dipanaskan pada suhu 80-90oC sambil diaduk selama 5 jam. Hasil reaksi diuapkan pelarutnya dengan alat rotarievaporator, residu yang diperoleh di ekstraksi dengan 100 ml dietil eter dan dicuci dengan larutan NaCl jenuh sebanyak 3 kali masing-masing 25 ml. Setelah itu lapisan atasnya ditambahkan Na2SO4 anhidrat dan didiamkan selama 45 menit setelah itu disaring. Filtrat yang diperoleh diuapkan dengan alat rotarievaporator. Residu yang diperoleh dianalisa (senyawa alkanolamida) dengan spektrofotometer FT-IR, titik lebur dan penentuan CMC denganmetode cincin dunoy.
3.3.3 Amidasi Metil Ester Asam Lemak Dengan Dietanolamin
3.3.4. Analisa Hasil Reaksi
a. Analisa Metil Ester Asam Lemak Minyak Kelapa dengan Kromatografi Gas Cair
Metil ester asam lemak bebas minyak kelapa disuntikkan ke tempat cuplikan yang selanjutnya dibawa oleh gas pengemban (Helium) kedalam kolom GC dengan panjang 30,0 m pada suhu 120oC, dimana tipe kolom GC yang dipakai Front Detektor, dan jenis detektor Front Ionition Detektor (FID).
b. Analisa dengan Spektroskopi FT-IR
Untuk masing-masing cuplikan yakni metil ester asam lemak bebas minyak kelapa, etanolamida dan dietanolamida dioleskan pada plat KBr hingga terbentuk lapisan tipis yang transparan. Dan diukur spektrumnya dengan alat spektofotometer FT-IR.
c. Penentuan titik lebur
Penentuan titik lebur ini dilakukan terhadap etanolamida dan dietanolamida dari hasil amidasi senyawa metil ester asam lemak minyak kelapa dengan etanolamin dan dietanolamin. Alkanolamida yang diperoleh dimasukkan kedalam pipa kapiler kemudian dimasukkan kedalam melting point aparatus dan dicatat perubahan titik leburnya.
d. Penentuan Konsentrasi Misel Kritis dengan Metode Cincin dunoy
3.4. Bagan Penelitian
3.4.1 Pembuatan Metil Ester Asam Lemak Bebas Minyak
89,9 gram ( 0,433 mol ) asam lemak bebas minyak kelapa
dimasukkan kedalam labu leher dua volume 500 ml ditambahkan 150 ml (3,75 mol ) metanol
ditambahkan 100 ml benzena sambil diaduk
dirangkai alat refluks yang dilengkapi dengan tabung CaCl2 ditambahkan 2 ml H2SO4(p) secara
perlahan dalam keadaan dingin melalui corong penetes
Campuran
Residu destilat
diekstraksi dalam 100 ml dietil eter
dicuci dengan larutan NaCl sebanyak tiga kali masing-masing 25 ml
Lapisan atas
ditambahkan dengan CaCl2 anhidrousselama 1 jam
disaring
Lapisan bawah
Filtrat Residu
diuapkan pelarutnya dengan alat rotarievaporator
Hasil
Analisa FT-IR
direfluks selama 5 jam pada suhu 80oC sambil di stirer
didinginkan pada suhu kamar
diuapkan kelebihan metanol dan pelarut dengan rotarievaporator
dikeringkan dengan Na2SO4 anhidrous selama 1 jam
disaring
Filtrat
3.4.2. Amidasi Metil Ester Asam Lemak Minyak Kelapa Menggunakan Etanolamin
0,05 mol Metil ester asam lemak Campuran
dimasukkan kedalam labu leher dua volume 500 ml ditambahkan 0,093 mol etanolamin
ditambahkan 0,093 mol CH3ONa (5 gr dalam 20 ml metanol) dirangkai alat refluks
dipanasakan pada suhu 80-90oC sambil diaduk selama 5 jam
Campuran
diuapkan pelarutnya dengan alat rotarievaporator
Residu Filtrat
diekstraksi dalam 100 ml dietil eter
dicuci dengan larutan NaCl sebanyak tiga kali masing-masing 25 ml
Lapisan atas
ditambahkan NaSO4 anhidrous
ditambahkan selama 45 menit disaring
Lapisan bawah
Filtrat Residu
diuapkan pelarutnya dengan alat rotarievaporator
Hasil
3.4.3. Amidasi Metil Ester Asam Lemak Minyak Kelapa Menggunakan Dietanolamina
0,05 mol Metil ester asam lemak Campuran
dimasukkan kedalam labu leher dua volume 500 ml ditambahkan 0,093 mol dietanolamin
ditambahkan 0,093 mol CH3ONa (5 gr dalam 20 ml metanol) dirangkai alat refluks
dipanasakan pada suhu 80-90oC sambil diaduk selama 5 jam
Campuran
diuapkan pelarutnya dengan alat rotarievaporator
Residu Filtrat
diekstraksi dalam 100 ml dietil eter
dicuci dengan larutan NaCl sebanyak tiga kali masing-masing 25 ml
Lapisan atas
ditambahkan NaSO4 anhidrous
ditambahkan selama 45 menit disaring
Lapisan bawah
Filtrat Residu
diuapkan pelarutnya dengan alat rotarievaporator
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil
4.1.1.Hasil analisis komposisi Asam Lemak pada Minyak Kelapa
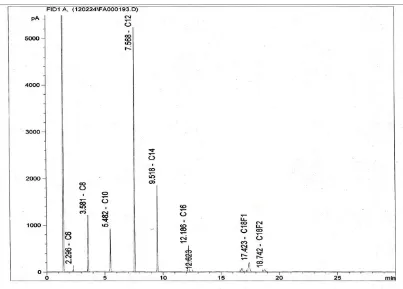
Hasil analisis metil ester asam lemak bebas minyak kelapa dengan kromatografi gas menghasilkan kromatogram seperti gambar 4.1. dengan komposisi senyawa seperti pada tabel 4.1
Tabel 4.1. Komposisi Asam Lemak Pada Minyak Kelapa
4.1.2 Hasil analisis spektroskopi FT-IR Metil Ester Asam Lemak Bebas Minyak Kelapa
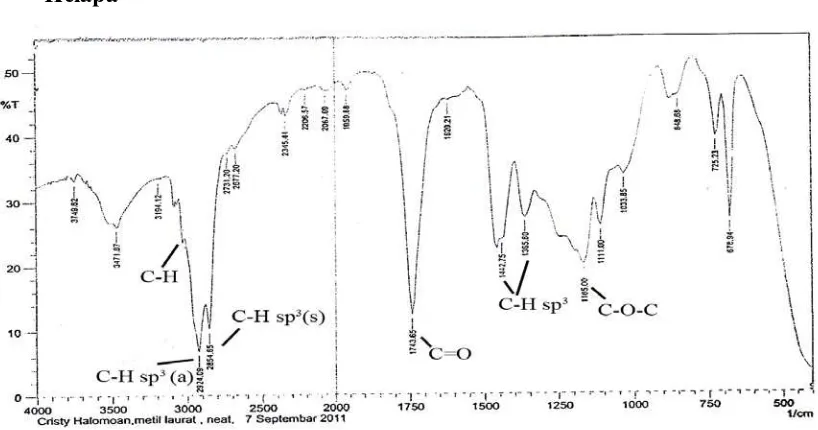
Pembuatan metil ester asam lemak minyak kelapa secara esterifikasi terhadap minyak kelapa dengan metanol dalam pelarut benzen dengan menggunakan katalis asam sulfat pekat pada suhu 70-80oC. Metil ester yang diperoleh sebanyak 91,66%. Hasil yang diperoleh dianalisis dengan alat spektrofotometer FT-IR memberikan spektrum dengan puncak serapan pada daerah bilangan gelombang 3004 cm-1, 2924 cm-1, 2854 cm-1, 1743 cm-1, 1442 cm-1, 1365 cm-1,1165 cm-1, dan 723 cm-1 (Gambar 4.2)
No Asam Lemak Jumlah atom C Kadar ( %)
1 Asam Kaproat C6 0,807
2 Asam Kaprilat C8 9,049
3 Asam Kaprat C10 1,729
4 Asam Laurat C12 49,477
5 Asam Meristat C14 16,824
6 Asam Palmitat C16 8,034
7 Asam Stearat C18 1,855
8 Asam Oleat C18:1 5,438
4.1.3 Etanolamida dari hasil Amidasi Metil Ester Asam Lemak Minyak Kelapa dengan Etanolamina
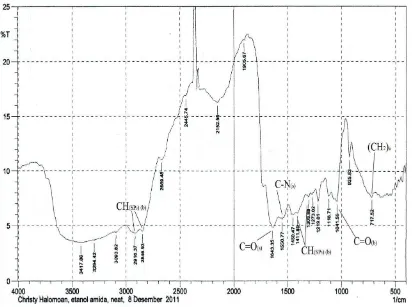
Etanolamida diperoleh melalui reaksi amidasi metil ester asam lemak bebas minyak kelapa dengan etanolamina menggunakan katalis natrium metoksida dalam pelarut metanol pada suhu 80-90oC. Senyawa etanolamida diperoleh dengan rendemen sebanyak 91,7%. Hasil yang diperoleh dianalisa spektroskopi FT-IR memberikan spektrum dengan puncak- puncak serapan pada daerah bilangan gelombang 3417 cm -1
- 3093 cm-1, 2916 cm-1, 2846 cm-1, 1643 cm-1, 1550 cm-1, 1450 cm-1, 1303 cm-1, 1178 cm-1, 1041 cm-1dan 717 cm-1 ( Gambar 4.3).
4.1.4 Dietanolamida dari Hasil Amidasi Metil Ester Asam Lemak Bebas Minyak Kelapa
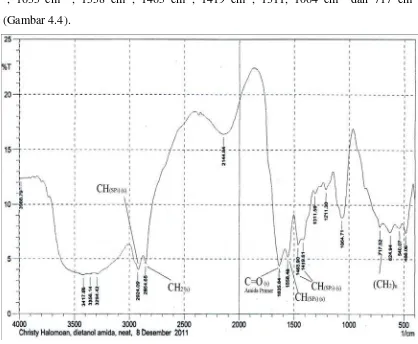
Dietanolamida campuran yang diperoleh melalui reaksi amidasi metil ester asam lemak bebas minyak kelapa dengan dietanolamina katalis natrium metoksida dalam pelarut metanol pada suhu 80-90oC. Senyawa dietanolamida yang diperoleh sebanyak 94,9% dan dianalisa dengan spektrofotometer memberikan spektrum dengan puncak-puncak serapan pada daerah bilangan gelombang 3417-3294 cm-1, 2924cm-1, 2854 cm -1
, 1635 cm-1 , 1558 cm-1, 1465 cm-1, 1419 cm-1, 1311, 1064 cm-1 dan 717 cm-1 (Gambar 4.4).
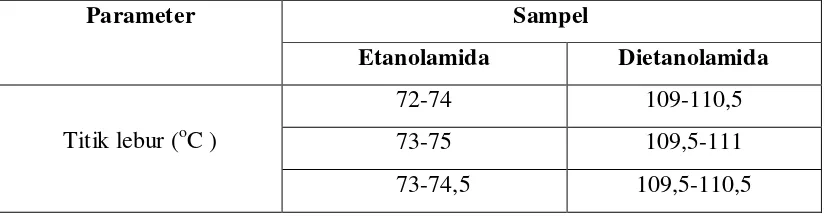
Tabel 4.1.5. Hasil Penentuan Titik Lebur Etanolamida dan Dietanolamida Campuran asam Lemak Bebas Minyak Kelapa
Penentuan titik lebur ini dilakukan terhadap etanolamida dan dietanolamida dari hasil amidasi senyawa metil ester asam lemak bebas minyak kelapa dengan etanolamain dan dietanolamin.
Parameter Sampel
Etanolamida Dietanolamida
Titik lebur (oC )
72-74 109-110,5
73-75 109,5-111
73-74,5 109,5-110,5
4.1.6. Hasil Uji CMC (Critical Misille Consentration) Etanolamida dan Dietanolamida dengan Menggunakan Metode Cincin Dunoy
Penentuan CMC ini dilakukan terhadap etanolamida dan dietanolamida dari hasil amidasi senyawa metil ester asam lemak bebas minyak kelapa dengan etanolamina dan dietanolamina, alkanolamida yang diperoleh diencerkan dengan variasi konsentrasi 1%-7%, kemudian diukur tegangan permukaan air etanolamida dan dietanolamida dengan tensiometer.
Tabel 4.2. Hasil pengukuran tegangan permukaan air Etanolamida dengan Tensiometer
Konsentrasi (C) Tegangan permukaan ( dyne/cm) Y x FK Log C
1% 48,7 54,54 0
2% 48 53,76 0,3
3% 47 52,64 0,47
4% 46,5 52,58 0,60
5% 45 50,4 0,7
6% 44,7 50,1 0,77
FK =
Tegangan permukaan praktek
Tegangan permukaan aquadest ( 29oC )
= 72,75 60,5
` = 1,12
Y = Tegangan permukaan ( dyne/cm)
Tabel 4.3. Hasil pengukuran tegangan permukaan air Dietanolamida dengan alat Tensiometer
Konsentrasi ( C ) Tegangan permukaan ( dyne/cm) Y x FK Log C
1% 47,1 52,75 0
2% 46 51,52 0,3
3% 45 50,96 0,47
4% 43,5 48,16 0,60
5% 42 47,04 0,7
6% 41,7 47,04 0,77
7% 42,01 47,06 0,84
Keterangan :
FK =
Tegangan permukaan praktek
Tegangan permukaan aquadest ( 29oC )
= 72,75 60,5
` = 1,12
4.2. Pembahasan
4.2.1. Pembuatan Metil Ester Asam Lemak Bebas Minyak Kelapa
Pembuatan metil ester asam lemak minyak kelapa secara esterifikasi terhadap minyak kelapa dengan metanol dalam pelarut benzen menggunakan katalis asam sulfat pekat pada suhu 70-80oC. Hasil yang diperoleh dianalisis dengan spektrofotometer FT-IR memberikan puncak-puncak serapan pada daerah bilangan gelombang 3004 cm-1 yang merupakan vibrasi stretching C-H sp2 (=CH-) yang menunjukkan bahwa pada komposisi asam lemak minyak kelapa terdapat asam lemak tidak jenuh. Hal ini sesuai dengan hasil kromatografi Gas Cair (Gambar 4.1) yang menunjukkan adanya asam lemak tidak jenuh yang didukung oleh puncak serapan pada bilangan gelombang 1165 cm-1, untuk-CH2- yang didukung oleh vibrasi bending C-H sp3 pada bilangan gelombang 1743 cm-1 merupakan serapan khas gugus karbonil (C=O) ester dimana ada 3 puncak yang melebar dan yang paling tinggi terdapat pada puncak bilangan gelombang yang kecil atau sebelah kanan. Puncak bilangan gelombang 725 cm-1 menunjukkan adanya alkil rantai panjang (n ≥ 4).
Adapun mekanisme reaksi dari pembuatan metil ester asam lemak campuran minyak kelapa adalah seperti skema berikut.
( Scundder,1992 )
Gambar 4.5. Mekanisme Reaksi Pembuatan Metil Ester Asam lemak Campuran
Dalam media asam, pasangan elektron bebas atom oksigen karbonil dapat terprotonasi menghasilkan atom oksigen karbonil bermuatan positif, sehingga dengan demikian atom karbon karbonil dapat diserang oleh nukleofil yang lemah seperti metanol. Kemudian HSO4(-) mengabsorbsi proton pada atom O metanol . Kemudian terjadi transfer proton pada salah satu OH yang merupakan gugus pergi membentuk
O H H
yang merupakan gugus pergi yang lebih baik sehingga terbentuk metil ester. (Scudder, 1992).
4.2.2. Pembuatan Etanolamida Dari Metil Eter Asam Lemak Bebas Minyak Kelapa Dengan Menggunkan Etanolamin
Adapun tahapan reaksi secara hipotesa yang terjadi adalah seperti skema dibawah ini.
Gambar 4.6. Mekanisme Reaksi Pembuatan Etanolamida Dari Metil Eter Asam
Lemak Bebas Minyak Kelapa Dengan Menggunkan Etanolamin
4.2.3. Pembuatan Dietanolamida Dari Metil Ester Asam Lemak Bebas Minyak Kelapa Dengan Menggunakan Dietanolamin
Pembuatan etanolamida dari metil ester asam lemak bebas minyak kelapa dengan menggunakan dietanolamin mengunakan katalis natrium metoksida suhu 80-90oC. Hasil yang diperoleh dengan spektroskopi FT-IR memberikan sepktrum dengan puncak pita serapan pada daerah bilangan gelombang 3417-3294 cm-1 menunjukkan vibrasi streching gugus OH yang diperkuat oleh puncak serapan pada bilangan gelombang 1064 cm-1 yang menyebabkan vibrasi bending C-O dari C-OH. Puncak serapan pada bilangan gelombang 1649 cm-1 menunjukkan vibrasi streching C=O (karbonil) amida sekunder. Adanya gugus karbonil amida ini didukung oleh munculnya pita serapan pada bilangan gelombang 1558 cm-1 menjadi vibrasi stretching C-N. Pada bilangan gelombang daerah 3356 menunjukkan vibrasi gugus OH yang diperkuat oleh puncak serapan pada bilangan gelombang 1069 yang merupakan vibrasi stretching C-O dan C-OH. Pada bilangan gelombang 717 merupakan –( CH2)n yang merupakan rantai hidrokarbon alkil rantai panjang.
Adapun tahapan reaksi secara hipotesa yang terjadi adalah seperti skema berkut ini.
Gambar 4.7. Mekanisme Reaksi Pembuatan Dietanolamida Dari Metil Ester Asam Lemak Bebas Minyak Kelapa Dengan Menggunakan Dietanolamin
4.2.4. Hasil Uji Titik Lebur Etanolamida dan Dietanolamida
Alkanolamida yang diperoleh dari hasil amidasi metil ester asam lemak bebas minyak kelapa dengan bantuan katalis Natrium Metoksida menghasilkan senyawa etanolamida yang mempunyai titik lebur rata-ratanya 72-75oC. Sedangkan dietanolamida mempunyai titik lebur 109-111oC.
4.2.5. Hasil Uji CMC dengan menggunakan alat Tensiometer
Grafik 1. Penentuan nilai CMC (Critcal Missle Consentration) Etanolamida dan Dietanolamida
Hasil Uji CMC ( Critical Missle Concentration ) Etanolamida dan Ditanolamida Menggunakan Metode Cincin Dunoy
Etanolamida
a. Harga CMC Etanolamida CMC = ant log 0,63
= 4,26 /100 ml 4,26
mol/ 100 ml 261
= 0,0163 mol/ 100 ml = 0,163 mol/L
b. Harga CMC Dietanolamida CMC = ant log 0,55
= 3,54 /100 ml 3,54
= mol/ 100 ml 305
= 0,0116 mol/ 100 ml = 0,116 mol/ L
Kebanyakan besar ampifier apakah ion atau mengion memilki daerah hidropobik yang terdiri atas rantai hidrokarbon. Untuk ampifier ionik meningkatnya jumlah atom carbon dalam rantai hidrokarbon yang tak bercabang maka harga CMC nya akan turun.
CMC = anti Log C
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Senyawa alkanolamida yakni etanolamida dan dietanolamida dapat disintesis melalui amidasi metil ester asam lemak bebas minyak kelapa masing-masing dengan etanolamina dan dietanolamina menggunakan katalis NaOCH3 dalam pelarut metanol pada kondisi refluks. Kedua senyawa alkanolamida yang diperoleh memiliki bentuk jenis yang berbeda dimana etanolamida berbentuk gel dengan titik leburnya 72-75oC dan dietanolamida berbentuk padat lunak diperoleh titik 109o-111oC
2. Metil ester yang diperoleh sebesar 91,66% dan hasil penentuan nilai Critical Mislle Consentration ( CMC ) dari senyawa alkanolamida yang diperoleh dari hasil amidasi metil ester asam lemak bebas minyak kelapa yaitu etanolamida 0,163 mol/L sedangkan dietanolamida 0,166 mol/L
5.2. Saran
Diharapkan peniliti berikutnya dapat mengembangkan lebih lanjut yang berhubungan dengan hasil penilitian terutama dalam hal.
1. Sintesis alkanolamida menggunakan metil ester asam lemak bebas minyak kelapa sawit
DAFTAR PUSTAKA
Alam, M, Alok R. Ray dan Ashraf., 2009. Synthesis Characterzation and
Performance Of Amine Modifield Linseed Oil Fatty Amide Coatings. .”
J.Am.Oil Chem.Soc.Vol 86: 573-580
Anonim I., 1987. Mc Graw Hill Encyclopedia Of Scince abd technologi. New York:: Mc graw Hill Book Co.
Anonim II., 1976. The Merck Index. New Jersey. USA: Merk and Co.,Inc
Attwood, D.1983. Surfactant System. New York: Chapman and Hall
Bangun, R., 2011. Amidasi Etil P-Metoksisinamat yang Diisolasi dari Kencur
(Kaemferia Galanga,Linn) Dengan Dietanolamine.Medan. Sekolah Sarjana
USU.
Brahmana, H. R., 1991. Amida Asam Lemak Sebagai Pemantap Lateks.Komunikasi Penilitian.Vol 4(1): 48
Bresnick , stephen, M. D., 1996. Intisari Kimia Organik. Jakarta: Hipokrates
Cho, I, Kim C.S.,1985. New Synthe Vesicles Formed by Polymeric Quanternary
Ammnium Bromide With Double Alkyl Chains Chem. Letf 10, 1543
Christie,W.,1992. The Fatty Acids Of the SpongeDysidea fragilis from the Black Sea.
Lipids 27: 640-644
Cox, F. M. dan Weerasooriya,U.,1997. ” Methyl Ester Ethoxylate.” J.Am.Oil Chem.Soc.vol 74
Echaristy, M., 2011. Sintesis Alkanolamida dari Minyak Jarak (Ricinus comummunis Linn) Sebagai Sumber Poliol dan Pemanfaatannya Untuk Pembuatan
Poliuretan. Medan. Skripsi Sekolah Sarjana USU.
Fassenden, R. J. Fassenden,J.S.,1999. Kimia Organik. Edisi ketiga.Jilid II. Jakarta. Erlangga
Gautam, K.K, & Tyagi,V.K.,2005. Microbial surfactant.jurnal Of Oleo Science.Vol 55.No.4
Hama, I. Sakai ,M. dan Sasamoto,H.,1997. ” Efects Of Ethoxylate Structure on
Surfactant Properties Of Ethoxylated Fatty Methyl Ester” J.Am.Oil
Chem.Soc.vol 56
Hart, H. 1990. Kimia organik. Edisi keenam. Jakarta: Erlangga
Ketaren, S .2008. Pengantar Teknologi Lemak dan Minyak Pangan. Jakarta: UI-Press
Lee, C. S, Ooi., Cuah, C.H dan Ahmad,S.2007. Rigid Polyurethane Foam Production
from Palm Oil-Based Epoxidized Dietanolamides,J.Am.Oil.Chem.Soc.84(12)
Lehninger, A. I. 1998. ” Dasar- Dasar Biokimia. Jakarta : Erlangga
Maag, H. 1984. Fatty Acid Derivatives: Important Surfactants for Household,
Cosmetic And Industrial Purposes. J.Am.Oil Chem.Soc. Vol 61,No.2
Martin,. N. A., Swarbirck, J. 1989. Physical Pharmacy. LEA & Febriger Phil.
Mutter, M., G., 1968 Galen dan P.W. hendrikse.Tenside . 5:34
Maharani, M., 2008. Sintesis Senyawa N-etanol-9,10,12-Trihidroksi Stearamida Melalui Amidasi Metil Trihidroksi Stearat dengan Etanolamin. Medan: Tesis Sekolah Pascasarjana USU.
Pavia; Donald, L., 1976. Introduction to Organic Laboratory Techniques. Philadelphia: W.B Sanders Company.
Paskaulina,Y., 2011. Sintesis senyawa 9,10 dihidroksi N,N-Bis (2-Hidroksietil)
stearamida campuran dari asam oleat. Medan:Skripsi Sekolah Sarjana USU.
Nuryanto, E. T. Haryati dan J. Elisabeth., 2002. Pembuatan Fatty amida dari ASLD
untuk produksi detergen cair dan shampo. Badan penilitian dan
pengembangan pertanian, Departemen Pertanian.
Richtler, H. J. dan Knaut, J., 1984. Challenges to A Inature Industry Marketing and economics of Oleochemicals in western eurape. J.Am.Oil Chem.Soc
Sastrohamidjojo, H., 2005. Kimia Organik. Cetakan Pertama. Yogjakarta. Gadjah Mada University Press
Scudder, P.H., 1992. Electron Flow In Organin Chemistry. New York. Jhon Wiley & Sons, Inc
Shinoda, K., 1986. Emulstion and Solubilization. Japan. Yokohama. Jhon Wiley and Sons.
Sudarmadji, S dan Haryono, B., 1989. Analisa bahan Makanan dan Pertanian. Yogjakarta: liberty yogjakarta.
Tandy, D.C. 1984. Physical refining Of Edible Oil, J.Am. Oil Chem.Soc.
Urata, K., 1998. Applications Of preteating Group in the Syntesis Of Surfactants Lipid,and related Compoonds.J.Sur& Det1(1).
Valivety, R., Jauregi, P. Gill, I. dan Vulfson, E., 1997. ” Chemo Enzimatic Syinthesis of Amino Acid Based Surfactants”. J.Am.Oil Chem. Soc. vol 74-879
Wilbraham, A. C. 1992. Pengantar Kimia organik dan hayati. Bandung: ITB-Press
Young., 1983. Palm Kernel and Coconat Oils: Analytical Characteristics Proses