Daftar Isi
Daftar Isi
Kata Pengantar
Pendahuluan
Bab 1 BILANGAN KUANTUM
Pengertian Bilangan Kuantum MacamMacam Bilangan Kuantum
Bab 2 KONFIGURASI ELEKTRON Konfigurasi Elektron
Bab4KESIMPULAN & SARAN
Daftar Pustaka
Puji dan syukur kehadirat Tuhan Yang Maha Esa, atas kasih dan
tuntunan-Nya sehingga saya dapat menyelesaikan pembuatan Makalah
ini dengan baik dan tepat waktu.
Makalah ini dibuat guna untuk memenuhi nilai tugas Kimia Teknik
dalam jangka waktu tertentu sehingga dapat dipertanggungjawabkan
hasil akhirnya.
Saya sadar bahwa laporan ini masih penuh dengan kekurangan,
karena itu diminta kritik dan saran dari para pembaca dan dosen Kimia
Teknik kami, agar nantinya saya bisa membuat laporan yang lebih baik
lagi.
Akhir kata saya mengucapkan banyak terima kasih dan harapan
saya agar Makalah ini dapat bermanfaat bagi kita semua.
Manado,Oktober 2015
Penulis
Pada tahun 1913 Neils Bohr pertama kali mengajukan teori kuantum untuk atom hydrogen.Model ini merupakan transisi antara model mekanika klasik dan mekanika gelombang.Karena pada prinsip fisika klasik tidak sesuai dengan kemantapan hidrogen atom yang teramati. Pada saat sudah ada 4 evolusi model atom yang di kekemukaan oleh para ahli, yang pertama model atom Niels Bohr,model atom Dalton,model atom Thomson ,dan model atom Rutherford. Telah diketahui bahwa atom terdiri atas inti atom dan elektron-elektron yang beredar mengitarinya.
Reaksi kimia biasa (seperti reaksi pembakaran dan penggaraman), hanya menyangkut perubahan pada kulit atom, terutama elektron pada kulit terluar, sedangkan inti atom tidak berubah. Reaksi yang menyangkut perubahan pada inti disebut reaksi inti atau reaksinuklir (nukleus=inti).
Bilangan Kuantum
Bilangan kuantum adalah suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat orital dan elektron dalam orbital. Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
1.2
MacamMacam Bilangan Kuantum
Ada empat bilangan kuantum yang akan kita kenal, yaitu bilangan kuantum utama (n), bilangan kuantum Azimut (I), bilangan kuantum magnetik (m) dan bilangan kuantum spin (s).
1.Bilangan kuantum utama
Dalam model atom Bohr, elektron dikatakan berada di dalam lintasan stasioner dengan tingkat energi tertentu. Tingkat energi ini berkaitan dengan bilangan kuantum utama dari elektron. Bilangan kuantum utama dinyatakan dengan lambang n
sebagaimana tingkat energi elektron pada lintasan atau kulit ke-n.
Bisa dikatakan bahwa bilangan kuantum utama berkaitan dengan kulit elektron di dalam atom. Bilangan kuantum utama membatasi jumlah elektron yang dapat menempati satu lintasan atau kulit berdasarkan persamaan berikut.
Jumlah maksimum elektron pada kulit ke-n adalah 2n2.
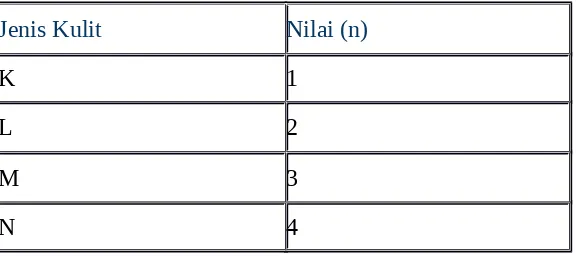
Tabel 1. Hubungan jenis kulit dan nilai bilangan kuantum utama.
Jenis Kulit Nilai (n)
K 1
L 2
M 3
2.Bilangan Kuantum Azimut (I)
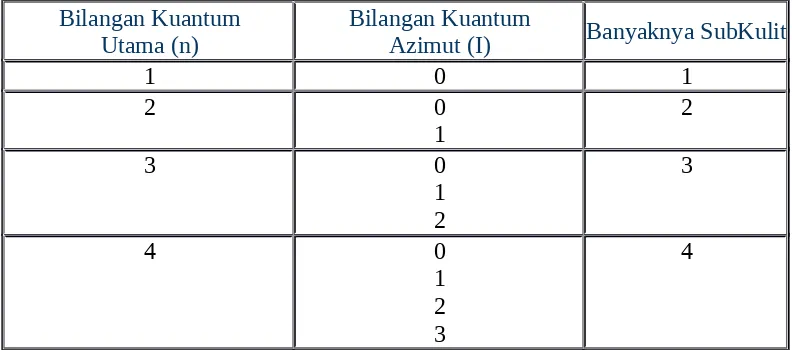
Elektron yang bergerak mengelilingi inti atom memiliki momentum sudut. Efek Zeeman yang teramati ketika atom berada di dalam medan magnet berkaitan dengan orientasi atau arah momentum sudut dari gerak elektron mengelilingi inti atom. Terpecahnya garis spektrum atomik menandakan orientasi momentum sudut elektron yang berbeda ketika elektron berada di dalam medan magnet. Bilangan kuantum azimut menyatakan sub kulit tempat elektron berada dan bentuk orbital, serta menentukan besarnya momentum sudut elektron terhadap inti. Banyaknya subkulit tempat elektron berada tergantung pada nilai bilangan kuantum utama (n). Nilai bilangan kuantum azimut dari 0 sampai dengan (n - 1). Bila n = 1, maka hanya ada satu subkulit yaitu l = 0. Sedangkan n = 2, maka ada dua subkulit yaitu l = 0 dan l = 1. Seandainya dibuat dalam tabel maka akan tampak sebagai berikut :
Tabel 2. Hubungan bilangan kuantum utama dan azimut serta subkulit.
Bilangan Kuantum
Utama (n) Bilangan KuantumAzimut (I) Banyaknya SubKulit
1 0 1
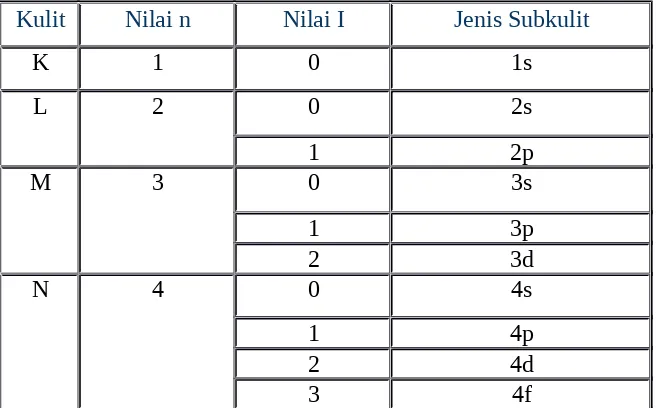
Sub kulit yang harganya berbeda-beda ini diberi nama khusus:
l
= 0 ; sesuai sub kulit s (s = sharp)
l
= 1 ; sesuai sub kulit p (p = principle)
l
=
2 ; sesuai sub kulit d (d = diffuse)
Tabel 3. Hubungan subkulit sejenis dalam kulit yang berbeda pada atom.
Kulit Nilai n Nilai I Jenis Subkulit
K 1 0 1s
Momentum sudut elektron L merupakan sebuah vektor. Jika vektor momentum sudut L diproyeksikan ke arah sumbu yang tegak atau sumbu-z secara tiga dimensi akan didapatkan besar komponen momentum sudut arah sumbu-z dinyatakan sebagai Lz. bilangan bulat yang berkaitan dengan besar Lz adalah m. bilangan ini
disebut bilangan kuantum magnetik. Karena besar Lz bergantung pada besar
momentum sudut elektron L, maka nilai m juga berkaitan dengan nilai l.
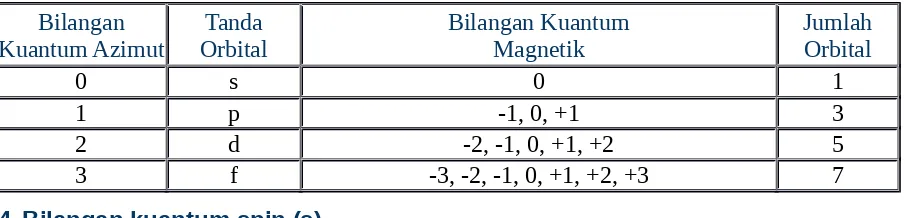
m = −l, … , 0, … , +l
misalnya, untuk nilai l = 1, nilai m yang diperbolehkan adalah −1, 0, +1.
Bilangan kuantum magnetik menyatakan orbital tempat ditemukannya elektron pada subkulit tertentu dan arah momentum sudut elektron terhadap inti. Sehingga nilai bilangan kuantum magnetik berhubungan dengan bilangan kuantum azimut. Nilai bilangan kuantum magnetik antara - l sampai + l.
Tabel 6. Hubungan bilangan kuantum azimut dengan bilangan kuantum magnetik.
4.Bilangan kuantum spin (s).
Bilangan kuantum spin diperlukan untuk menjelaskan efek Zeeman anomali. Anomali ini berupa terpecahnya garis spektrum menjadi lebih banyak garis dibanding yang diperkirakan. Jika efek Zeeman disebabkan oleh adanya medan magnet eksternal, maka efek Zeeman anomali disebabkan oleh rotasi dari elektron pada porosnya. Rotasi atau spin elektron menghasilkan momentum sudut intrinsik elektron. Momentum sudut spin juga mempunyai dua orientasi yang berbeda, yaitu spin atas dan spin bawah. Tiap orientasi spin elektron memiliki energi yang berbeda tipis sehingga terlihat sebagai garis spektrum yang terpisah.
Keempat bilangan kuantum n, l, m dan s. Memungkinkan kita untuk menandai elektron dalam orbital atom maupun secara lengkap. Dalam hal ini kita dapat menganggap keempat bilangan kuantum sebagai “alamat” elektron dalam atom. Konfigurasi elektron atom tersebut adalah bagaimana elektron tersebar diantara berbagai orbital atom, agar kita bisa mengetahui perilaku elektronnya.
Elektron dijumpai dalam keadaan tingkat energi paling rendah. Misalnya dalam hidrogen, elektronnya yag tinggal akan terletak pada subkulit 1s, karena dalam tingkat ini elektron mempunyai energi yang paling rendah. Untuk menunjukkan bahwa subkulit 1s mengandung 1 elektron, kita mengunakan (dalam keadaan ini 1) untuk menunjukkan subkulitnya. Jadi kita tulis 1s1 untuk konfigurasi elektron hidrogen. Salah satu metode yang banyak digunakan adalah dengan menggambarkan anak panah menunjuk keatas (↑) sebagai simbol untuk menunjukkan suatu elektron yang berputar dalam satu arah dan anak panah yang menunjuk kebawah (↓) untuk menunjukkan perputaran elektron yang berlawanan arah. Untuk memperlihatkan distribusi elektron diantara orbital suatu atom, kita tempatkan panah di atas batang yang menunjukkan orbital.
Ada tiga aturan atau prinsip yang harus dipertimbangkan dalam penentuan konfigurasi elektron suatu atom, dan prinsip ini berlaku untuk bermacam-macam unsur.
1) Elektron menempati orbital sedemikian rupa untuk meminimumkan energi atom tersebut.
Sebenarnya, energi atom tidak diminimumkan hanya dengan mengisi secara berurutan kulit-kulit elektron utamanya. Salah satu akibat pemisahan peringkat energi dalam atom berelektron banyak ialah adanya pertumpang tindihan peringkat-peringkat pada bilangan kuantum yang lebih tinggi, misalnya: pengisian 4s sebelum 3d pada unsur K dan Ca. Akibatnya, pengurutan pengisian orbital harus ditentukan dengan percobaan.
2) Tidak ada dua elektron dalam sebuah atom yang boleh memiliki keempat bilangan kuantum yang sama (prinsip larangan pauli)
3)Prinsip penggandaan makimum (aturan hund)
Jika terdapat orbital-orbital dengan energi yang sama, elektron menempatinya sendiri-sendiri sebelun ia menempatinya secara berpasangan. Akibatnya atom cenderung mempunyai sebanyak mungkin elektron tak berpasangan. Sifat ini dapat diterima, karena semua elektron membawa muatan listrik yang sama, sehingga mereka mencari orbital kosong yang energinya sama sebelum berpasangan dengan elektron yang telah mengisi orbital setengah terisi.
• Kesimpulan
Dengan membuat makalah ini, kita bisa mengetahui bilangan kuantum dan konfigurasi elektron serta kita juga bisa mengetahui macam-macam bilangan kuantum dan prinsip yang dtentukan dalam konfigursi elektron.
• Saran
Saya sebagai penyusun sadar bahwa makalah ini jauh dari kesempurnaan karena saya memiliki keterbatasan-keterbatasan yang tidak dapat saya
Daftar Pustaka
HTTP://WWW.ILMUKIMIA.ORG/2014/04/KONFIGURASI-ELEKTRON.HTML
HTTP://WWW.ILMUKIMIA.ORG/2013/05/BILANGAN-KUANTUM.HTML