ABSTRACT
ANGGRAITA PUTRA. The Use of Tris Soybean Extract for Etawah Cross Breed Liquid Semen Extender. Directed by R. IIS ARIFIANTINI and MUCHIDIN
NOORDIN.
This research was aimed to examine and find the best concentrations of soybean extract in Tris buffer (TS) for Etawah Cross Breed (ECB) semen extender. Three sexually mature and healthy ECB buck were used as a source of semen. The semen was collected using an artificial vagina and evaluate macro- and microscopically. Ejaculate having > 70% sperm motility, > 2500x106ml-1 sperm concentration and < 15% abnormal sperm were individually processed. Each ejaculate divided into five tubes. Four tubes were mixed with 2.50% TS (TS2.50), 3.75% TS (TS3.75), 5.00% TS (TS5.00), and 6.25% TS (TS6.25), one other tubes was diluted with Tris egg yolk extender (TEY) with the concentration of spermatozoa was 50x106ml-1. The semen stored at 3-5oC and observed its sperm motility and viability every 12 hours until 72 hours of storage. After 72 hours of storage result showed that TEY was the best sperm extender (p<0.05) on the sperm motility as well as sperm viability compared to TS in all concentration. TS2.50 (58.33 ± 2.50%) and TS3.75 (50.56 ± 4.46%) was the best TS concentration compared to TS5.00 orTS6.25. For artificial insemination purpose, sperm extender in TEY, TS2.50 and TS3.75 can be used until 72 hour of storage.
ABSTRAK
ANGGRAITA PUTRA. Pemanfaatan Tris Sari Kedelai Sebagai Bahan Pengencer Semen Cair Kambing Peranakan Etawah. Dibimbing oleh R. IIS ARIFIANTINI
dan MUCHIDIN NOORDIN.
Penelitian ini bertujuan untuk menguji dan mencari konsentrasi Tris sari kedelai (TS) yang tepat untuk pengencer semen cair kambing Peranakan Etawah (PE). Semen berasal dari tiga ekor kambing jantan. Semen ditampung menggunakan vagina buatan dan dievaluasi secara makro- dan mikroskopis. Ejakulat yang memiliki motilitas spermatozoa > 70%, konsentrasi spermatozoa > 2500 juta/ml, dan spermatozoa abnormal < 15% yang dapat diproses lebih lanjut. Masing-masing ejakulat bagi menjadi lima tabung. Empat tabung diencerkan dengan 2.50% TS (TS2.50), 3.75% TS (TS3.75), 5.00% TS (TS5.00), and 6.25% TS
(TS6.25), satu tabung lainnya diencerkan dengan Tris kuning telur (TKT) dengan
konsentrasi spermatozoa 50 juta/ml. Semen kemudian disimpan pada suhu 3-5oC dan diamati motilitas spermatozoa dan spermatozoa hidup setiap 12 jam hingga 72 jam penyimpanan. Setelah 72 jam penyimpanan, hasil menunjukkan bahwa TKT merupakan pengencer spermatozoa terbaik (p<0,05) dalam mempertahankan motilitas spermatozoa dan spermatozoa hidup dibandingkan TS dalam berbagai konsentrasi. TS2.50 (58.33 ± 2.50%) dan TS3.75 (50.56 ± 4.46%) merupakan
konsentrasi TS terbaik dibandingkan dengan TS5.00 atau TS6.25. Untuk tujuan
inseminasi buatan, pengencer TKT, TS2.50, dan TS3.75 dapat digunakan hingga 72
jam penyimpanan.
PEMANFAATAN TRIS SARI KEDELAI SEBAGAI
BAHAN PENGENCER SEMEN CAIR KAMBING
PERANAKAN ETAWAH
ANGGRAITA PUTRA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Denngan ini Saya menyatakan bahwa skripsi berjudul Pemanfaatan Tris Sari Kedelai Sebagai Bahan Pengencer Semen Cair Kambing Peranakan Etawah adalah benar karya saya dengan arahan dari Dosen Pembimbing Skripsi, dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2012 Yang membuat pernyataan
Anggraita Putra
ABSTRACT
ANGGRAITA PUTRA. The Use of Tris Soybean Extract for Etawah Cross Breed Liquid Semen Extender. Directed by R. IIS ARIFIANTINI and MUCHIDIN
NOORDIN.
This research was aimed to examine and find the best concentrations of soybean extract in Tris buffer (TS) for Etawah Cross Breed (ECB) semen extender. Three sexually mature and healthy ECB buck were used as a source of semen. The semen was collected using an artificial vagina and evaluate macro- and microscopically. Ejaculate having > 70% sperm motility, > 2500x106ml-1 sperm concentration and < 15% abnormal sperm were individually processed. Each ejaculate divided into five tubes. Four tubes were mixed with 2.50% TS (TS2.50), 3.75% TS (TS3.75), 5.00% TS (TS5.00), and 6.25% TS (TS6.25), one other tubes was diluted with Tris egg yolk extender (TEY) with the concentration of spermatozoa was 50x106ml-1. The semen stored at 3-5oC and observed its sperm motility and viability every 12 hours until 72 hours of storage. After 72 hours of storage result showed that TEY was the best sperm extender (p<0.05) on the sperm motility as well as sperm viability compared to TS in all concentration. TS2.50 (58.33 ± 2.50%) and TS3.75 (50.56 ± 4.46%) was the best TS concentration compared to TS5.00 orTS6.25. For artificial insemination purpose, sperm extender in TEY, TS2.50 and TS3.75 can be used until 72 hour of storage.
ABSTRAK
ANGGRAITA PUTRA. Pemanfaatan Tris Sari Kedelai Sebagai Bahan Pengencer Semen Cair Kambing Peranakan Etawah. Dibimbing oleh R. IIS ARIFIANTINI
dan MUCHIDIN NOORDIN.
Penelitian ini bertujuan untuk menguji dan mencari konsentrasi Tris sari kedelai (TS) yang tepat untuk pengencer semen cair kambing Peranakan Etawah (PE). Semen berasal dari tiga ekor kambing jantan. Semen ditampung menggunakan vagina buatan dan dievaluasi secara makro- dan mikroskopis. Ejakulat yang memiliki motilitas spermatozoa > 70%, konsentrasi spermatozoa > 2500 juta/ml, dan spermatozoa abnormal < 15% yang dapat diproses lebih lanjut. Masing-masing ejakulat bagi menjadi lima tabung. Empat tabung diencerkan dengan 2.50% TS (TS2.50), 3.75% TS (TS3.75), 5.00% TS (TS5.00), and 6.25% TS
(TS6.25), satu tabung lainnya diencerkan dengan Tris kuning telur (TKT) dengan
konsentrasi spermatozoa 50 juta/ml. Semen kemudian disimpan pada suhu 3-5oC dan diamati motilitas spermatozoa dan spermatozoa hidup setiap 12 jam hingga 72 jam penyimpanan. Setelah 72 jam penyimpanan, hasil menunjukkan bahwa TKT merupakan pengencer spermatozoa terbaik (p<0,05) dalam mempertahankan motilitas spermatozoa dan spermatozoa hidup dibandingkan TS dalam berbagai konsentrasi. TS2.50 (58.33 ± 2.50%) dan TS3.75 (50.56 ± 4.46%) merupakan
konsentrasi TS terbaik dibandingkan dengan TS5.00 atau TS6.25. Untuk tujuan
inseminasi buatan, pengencer TKT, TS2.50, dan TS3.75 dapat digunakan hingga 72
jam penyimpanan.
© Hak cipta milik IPB, tahun 2012
Hak cipta dilindungi Undang-Undang
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik
PEMANFAATAN TRIS SARI KEDELAI SEBAGAI
BAHAN PENGENCER SEMEN CAIR KAMBING
PERANAKAN ETAWAH
ANGGRAITA PUTRA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul : Pemanfaatan Tris Sari Kedelai Sebagai Bahan Pengencer Semen Cair Kambing Peranakan Etawah.
Nama : Anggraita Putra
NIM : B04080124
Program Studi : Kedokteran Hewan
Disetujui,
Diketahui,
Drh. H. Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
Tanggal lulus:
Drh. Muchidin Noordin Dosen Pembimbing II Prof. Dr. Dra. R. Iis Arifiantini, M.Si
KATA PENGANTAR
Penulis mengucapkan syukur kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian yang berjudul “Pemanfaatan Tris Sari Kedelai Sebagai Bahan Pengencer Semen Cair Kambing Peranakan Etawah”. Penelitian ini merupakan bagian dari proyek “Pemanfaatan Susu Kedelai sebagai Pengencer Semen dan Penentuan Waktu Optimal Kawin Untuk Meningkatkan Populasi Kambing Melalui Inseminasi Buatan”.
Pada kesempatan ini penulis ingin menyampaikan rasa terima kasih dan penghargaan kepada Prof. Dr. Dra. R. Iis Arifiantini, M.Si. dan Drh. Muchidin Noordin selaku dosen pembimbing skripsi atas segala bimbingan, nasihat dan kesabaran yang diberikan kepada penulis selama penyusunan skripsi; Dr. drh. Hj. Ita Djuwita, M. Phill, PAVet(K) dan drh. Chaerul Basri, M. Epid. sebagai dosen penguji; Dr. Drh. Adi Winarto, Ph. D. sebagai dosen Pembimbing Akademik.
Terima kasih juga penulis ucapkan kepada keluarga tercinta, bapak Agus Suprihadi, ibu Asmiatun, dan kakakku Gesti Widiarini yang selalu memberikan doa, semangat, dan dukungannya kepada penulis; Pak Heri, mas Yatna, mas Ucup dan abah yang membantu selama penelitian di peternakan kambing; Teman-teman satu penelitian yang tergabung dalam tim Program Unggulan Fakultas (PUF) yaitu mbak Ocha, Azmi, dan Vivit; Tim Aceh Development International Conference (ADIC) yaitu Ricko dan Andi atas kenangannya selama di Malaysia; Ines, Rizal, Rice, Iren, Miftah, dan seluruh teman-teman Avenzoar; Keluarga besar IKAPINDO yang telah menjadi keluarga selama di Bogor; Mas Purwo, mbak Yeni, dan para laboran terutama pak Bondan atas segala bantuannya selama penelitian dan semua pihak yang tidak dapat penulis sebutkan satu persatu.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan di bidang teknologi, terutama teknologi reproduksi dalam usaha untuk meningkatkan swasembada pangan khususnya yang berasal dari hewan ternak.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bondowoso pada tanggal 14 Januari 1990 sebagai anak kedua dari pasangan bapak Agus Suprihadi S.Sos dan ibu Asmiatun. Penulis Menempuh pendidikan dasarnya di SD Negeri Dabasah 3 Bondowoso hingga lulus pada tahun 2002. Penulis melanjutkan pendidikan di SMP Negeri 2 Bondowoso hingga lulus pada tahun 2005 kemudian penulis melanjutkan pendidikan di SMA Negeri 2 Bondowoso. Tahun 2008 penulis lulus dari SMA Negeri 2 Bondowoso dan pada tahun yang sama penulis diterima di Fakultas Kedokteran Hewan IPB melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama perkuliahan, penulis mendapat beasiswa Bantuan Belajar Mahasiswa (BBM) 2010/2011. Penulis juga menjadi asisten praktikum mata kuliah Ilmu Teknologi Reproduksi, Pengelolaan Kesehatan Ternak Tropis, Pengelolaan Kesehatan Hewan dan Lingkungan, dan Ektoparasit. Penulis juga pernah menjadi ketua IKAPINDO (Ikatan Putra-Putri Bondowoso), anggota Himpunan Profesi Satwaliar 2009/2011, dan kepala divisi I Dewan Perwakilan
i
Tinjauan Umum Kambing Peranakan Etawah (PE)...……… Klasifikasi……….…….. Kambing Peranakan Etawah (PE)………...……….. 4
Tempat dan Waktu Penelitian ………..………... 9
Materi Penelitian ………...……… Persiapan dan Koleksi Semen dengan Vagina Buatan………….. Persiapan Media Pengencer………
Karakterisrtik Semen Segar ... 15 Persentase Motilitas Spermatozoa Kambing Peranakan Etawah dalam Berbagai Bahan Pengencer pada Suhu 3-5oC………
15 Persentase Spermatozoa Hidup Kambing Peranakan Etawah dalam Berbagai Bahan Pengencer pada Suhu 3-5oC………
ii
SIMPULAN DAN SARAN ……….....………….. 20
Simpulan ………...………… 20
Saran ………..………… 20
DAFTAR PUSTAKA ………...….. 21
iii
DAFTAR TABEL
Halaman
1 Komposisi bahan pengencer semen cair ………...……. 11
2 Karakteristik semen segar kambing PE...……… 15
3 Persentase spermatozoa motil... ……… 16
iv
DAFTAR GAMBAR
Halaman
1 Kambing Peranakan Etawah……… 5
v
DAFTAR LAMPIRAN
Halaman
1 Hasil Sidik Ragam Uji Faktorial (5 x 7) pengaruh jenis pengencer dan waktu pengamatan terhadap persentase
spermatozoa motil……….
25
2 Hasil Sidik Ragam Uji Faktorial (5 x 7) pengaruh jenis pengencer dan waktu pengamatan terhadap persentase
spermatozoa hidup………
PENDAHULUAN
Latar Belakang
Teknologi reproduksi perlu diupayakan untuk meningkatkan populasi dan mutu genetik ternak. Berbagai teknologi reproduksi seperti inseminasi buatan (IB), fertilisasi in vitro, transfer embrio, sampai dengan teknik intra cytoplasmic sperm injection (ICSI) telah berkembang pesat (Foote 2000), tetapi untuk kondisi di Indonesia, IB adalah satu-satunya teknologi reproduksi yang paling aplikatif dan telah memasyarakat secara luas. Teknik IB adalah pemasukan atau penyampaian semen ke dalam saluran reproduksi betina dengan menggunakan alat-alat buatan manusia. Teknik IB dirasakan banyak memberikan manfaat bagi perkembangan dunia peternakan, antara lain dapat mengoptimalkan penggunaan pejantan-pejantan unggul (Campbell et al. 2003).
Inseminasi buatan (IB) adalah salah satu alat bantu dalam penerapan program pemuliabiakan ternak. Teknologi IB mempunyai peranan penting dalam sistem pemuliabiakan ternak kambing terutama untuk mengontrol reproduksi dan meningkatkan potensi genetik hasil persilangannya (produksi susu dan daging). Terdapat dua tujuan utama penerapan teknologi IB pada kambing, yaitu mengoptimalkan program seleksi dan merupakan sarana untuk mengontrol waktu kelahiran (Leboeuf et al. 1998).
Semen beku kambing telah diproduksi oleh beberapa balai inseminasi menggunakan pengencer Tris kuning telur. Kuning telur dan susu merupakan bahan yang berasal dari hewan dan mempunyai kemungkinan mengandung material biologi berbahaya yang dapat menular pada spermatozoa (Van Wagtendonk-de Leeuw et al. 2000). Pellicer-Rubio et al. (1997) melaporkan bahwa semen cair atau semen beku jika menggunakan bahan pengencer yang mengandung kuning telur ataupun susu memiliki kualitas yang rendah. Rendahnya kualitas semen diduga akibat sekresi kelenjar bulbouretralis [bulbourethral gland secretion (BUS)] yang terkandung dalam plasma semen kambing. Sekresi kelenjar bulbouretralis tersebut mengandung enzim
Phospholipase A yang disebut juga egg yolk coagulating enzyme. Enzim ini dapat menghidrolisis phospholipid dari kuning telur menjadi lysophospholipid seperti
2
susu mengandung phospholipid dalam pengencer yang sangat dibutuhkan karena dapat melindungi spermatozoa dari cold shock pada saat pendinginan ataupun pembekuan (Amirat et al. 2004).
Upaya penggunaan phospholipid dari bahan tanaman telah dilakukan sejak tahun 2000an. Perusahaan komersial yang bergerak dibidang IB memperkenalkan penggunaan lesitin yang berasal dari kedelai sebagai pengencer yang memiliki kemampuan sebagai krioprotektan (Aires et al. 2003; Gill et al.
2000). Produk tersebut telah dijual dipasaran dengan beberapa merek seperti Biociphos (IMV, L’Aigle, France) dan Andromed (Minitub, Germany). Kedua produk ini mengandung ekstrak kacang kedelai sebagai pengganti kuning telur pada saat preservasi. Dihilangkannya kandungan kuning telur dan susu diharapkan terhindar dari isu adanya bahaya biologis dan bakterial yang dapat mempengaruhi kualitas spermatozoa. Pengencer tersebut meskipun digunakan untuk pengencer semen sapi, tetapi dapat juga digunakan untuk pengencer semen kambing.
Pengencer Andromed telah digunakan di beberapa Balai Inseminasi Buatan (BIB) dengan hasil yang sangat memuaskan. Masalahnya adalah pengencer tersebut harus diimpor dari negara lain, sehingga tidak selalu tersedia pada saat dibutuhkan. Selain itu kandungan lesitin dalam pengencer tersebut memerlukan suhu penyimpanan 5ºC. Selama transportasi, kendala pengiriman dan masalah lainnya sering mengakibatkan pengencer tersebut tertahan di bandara yang diduga penyimpanannya tidak sesuai dengan prosedur, akibatnya kualitas semen beku yang dihasilkan menjadi terganggu. Hal ini mendorong pemikiran untuk membuat pengencer alternatif yang berasal dari susu kedelai untuk menggantikan pengencer komersial.
3
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji dan mencari konsentrasi sari kedelai yang tepat dalam buffer Tris untuk pengencer semen cair kambing Peranakan Etawah (PE).
Manfaat
Penelitian ini diharapkan dapat menghasilkan pengencer alternatif yang berasal dari susu kedelai sebagai pengganti pengencer komersial.
Rumusan Masalah
Serangkaian penelitian telah dilakukan dalam preservasi semen diantaranya adalah daya tahan semen cair kambing peranakan etawah dalam pengencer kuning telur dengan kemasan dan konsentrasi spermatozoa yang berbeda dan pengembangan pengencer Tris Soya pada sapi FH. Pada penelitian tersebut telah didapat sejumlah informasi diantaranya konsentrasi spermatozoa yang paling tepat dan kemasan semen beku yang paling baik. Pada penelitian kedua telah didapat konsentrasi susu kedelai yang paling tepat dalam pengencer Tris dan angka konsepsi dari hasil IB menggunakan pengencer Tris soya. Pada penelitian ini akan dilakukan menggunakan teknik yang sama seperti yang telah dilakukan sebelumnya. Konsentrasi sari kedelai yang digunakan adalah 2.5%, 3.75%, 5.00%, dan 6.25% berat dalam volume (w/v) berdasarkan dari hasil
TINJAUAN PUSTAKA
Tinjauan Umum Kambing Peranakan Etawah (PE)
Klasifikasi
Kambing merupakan hewan pertama yang didomestifikasi oleh manusia. Hewan ini awalnya hidup di daerah yang sulit dan berbatu. Pemburu sering membawa pulang hasil tangkapan berupa anak kambing liar yang kemudian dimanfaatkan susu, daging, dan kulitnya (Blakely & Bade 1998). Ensminger (2002) menyatakan kambing diklasifikasikan sebagai berikut:
Kerajaan : Animalia Subordo : Ruminansia Familia : Bovidae Subfamilia : Caprinae Genus : Capra
Spesies : Capra hircu
Kambing menyebar ke berbagai pelosok dunia dan beradaptasi menghasilkan nilai fungsional yang berbeda-beda, ada yang cocok sebagai kambing pedaging, kambing penghasil susu, penghasil bulu, maupun kambing penghasil susu sekaligus daging. Kambing Etawah adalah kambing unggul yang berasal dari India. Kambing ini merupakan kambing unggul dwiguna yaitu potensial penghasil susu dan daging (Kusuma & Irmansah 2009). Orang Belanda banyak membawa kambing ini ke daerah Yogyakarta karena daerah ini pernah menjadi pusat pemerintahan. Kambing Etawah saat ini berkembang baik di daerah Yogyakarta. Kambing ini juga sering dikenal dengan sebutan kambing Benggala atau kambing Jamnapari sesuai daerah asalnya di India (DEPTAN 2011).
Kambing Peranakan Etawah (PE)
5
Gambar 1 Kambing Peranakan Etawah
Ciri-ciri spesifik kambing PE antara lain panjang telinga berkisar antara 18-30 cm, bobot badan jantan dewasa 40 Kg sedangkan betina 35 Kg, tinggi pundak berkisar antara 76-100 cm, warna bulu bervariasi dari coklat sampai hitam (Kartinaty & Gufroni 2010). Kambing PE betina di Indonesia dapat menghasilkan susu rata-rata 2-3 liter per ekor per hari dengan masa laktasi lebih dari 150 hari (Direktorat Jenderal Bina Produksi Peternakan 2003). Kambing PE dapat beranak tiga kali dalam dua tahun dengan rataan jumlah kelahiran 1-3 ekor (Balai Penelitian Ternak 2001). Rataan bobot lahir kambing PE kelahiran tunggal betina dan jantan masing-masing 3.2 dan 3.7 kg (Setiadi & Sutama 1997)
Semen Cair
6
penyangga, komponen isotonis dan pelindung terhadap kejutan dingin (cold shock) yang terjadi selama penyimpanan pada suhu rendah.
Semen yang diperoleh dari pejantan harus diencerkan dengan pengencer tertentu agar dapat didistribusikan ke beberapa betina dalam rangkaian program IB. Selain untuk memperbanyak volume, pengencer tersebut harus memenuhi beberapa kriteria yaitu, 1) mengandung sumber energi untuk kelangsungan hidup spermatozoa seperti fruktosa, glukosa, dan laktosa. 2) mengandung anti kejutan dingin (cold shock) seperti lipoprotein dan lesitin. 3) mempunyai kemampuan sebagai larutan penyangga seperti sitrat, Tris, dan phosphate. 4) memiliki keseimbangan elektrolit. 5) mengandung antibiotika yang melindungi semen dari kontaminasi mikroba (Herdis et al. 2003).
Bahan Pengencer Semen
Buffer Tris
Salah satu media pengencer yang umum digunakan adalah Tris. Tris memiliki toksisitas rendah dan sistem penyanggah yang baik dengan mempertahankan pH, tekanan osmotik dan keseimbangan elektrolit (Affandhy et al. 1999). Sebagai pengencer semen cair, Tris sering dicampur dengan karbohidrat yang berfungsi sebagai sumber energi bagi spermatozoa. Beberapa penelitian
buffer spermatozoa yang dilakukan oleh Baran et al. (2004) menggunakan dalam bahan pengencer agar dapat melindungi spermatozoa pada saat perubahan suhu dari suhu ruang (28oC) pada saat pengolahan ke suhu ekulibrasi (5oC). Anti
7
susunan utama membran spermatozoa. Kedelai memiliki kecenderungan terkontaminasi bakterial lebih kecil daripada kuning telur. Lesitin dari kacang kedelai merupakan pilihan yang tepat sebagai sumber lesitin bahan pengencer semen dimasa yang akan datang (Aires et al. 2003). Kacang kedelai juga mampu menekan stres oksidatif (Ogbuewu et al. 2010). Kacang kedelai yang belum maupun yang sudah mengalami penyulingan memiliki kandungan phospholipid
antara lain phosphatidylcholine 17.50% dan 23.00%, phosphatidylethanolamine
15.00% dan 20.00%, glikolipid 13-16%, phospholipid lainnya 14-18% dan trigliserida 2-4% (Shurtleff & Aoyagi 2004).
Lesitin kacang kedelai memiliki bahan-bahan yang mirip dengan lesitin pada kuning telur yang digunakan untuk perlindungan terhadap cold shock pada saat kriopreservasi (Thun et al. 2002; Aires et al. 2003 ). Meskipun lesitin dari bahan nabati seperti lesitin dari kacang kedelai banyak tersedia, akan tetapi lesitin dari kuning telur masih banyak digunakan untuk pembekuan semen (Aires et al. 2003;Santiago-Moreno et al. 2008).
Pengencer Kuning telur
Kuning telur merupakan komponen yang paling umum digunakan pada bahan pengencer untuk kriopreservasi karena terbukti memiliki efek yang menguntungkan sebagai pelindung dari membran plasma dan akrosom terhadap
cold shock (Amirat et al. 2004). Kandungan phospholipid, kolesterol dan low-density lipoprotein pada kuning telur berfungsi melindungi spermatozoa dari kejutan dingin selama proses pembekuan.
Kuning telur mempunyai sifat sebagai penyangga tekanan osmotik sehingga spermatozoa lebih toleran terhadap lingkungan yang hipotonik atau hipertonik (Khalifa dan El-Saidy, 2006). Kandungan beberapa senyawa dalam kuning telur penting untuk kelangsungan hidup spermatozoa selama penyimpanan. Komposisi phospholipid kuning telur menurut Juneja et al. (1994) terdiri atas
phosphatidylcholine (lesitin) 80.8%, phosphatidylethanolamine 11.7%,
lysophosphatidylcholine 1.9%, sphingomyelin 1.9%, serta lemak netral (nonpolar) dan bahan lain 3.7%. Menurut Dong et al. (2006), komposisi phospholipid kuning telur terdiri atas 77% phosphatidylcholine (lesitin), 3% sphingomyelin, dan 18%
8
MATERI DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Unit Rehabilitasi Reproduksi (URR), Reproduksi dan Kebidanan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penampungan semen dilakukan di Koperasi Kambing Perah, Cikarawang, Bogor. Penelitian dilaksanakan pada bulan Mei – Agustus 2011.
Materi Penelitian
Sumber Semen
Hewan yang dipergunakan sebagai sumber semen adalah tiga ekor kambing Peranakan Etawah (PE) yaitu pejantan dengan nomor ear tag 27, 30, dan B5. Kambing PE yang digunakan merupakan jantan dewasa kelamin yang ditempatkan dalam kandang individual yang dilengkapi dengan tempat pakan dan minum. Pakan yang diberikan berupa hijauan segar 10% per bobot badan dan konsentrat 10% dari pakan rumput, serta air minum yang diberikan secara ad libitum.
Pejantan unggul yang digunakan, yakni berumur antara 2 – 3.5 tahun dengan bobot badan antara 65 – 95 kg, serta memiliki kualitas semen yang baik, yakni motilitas lebih dari 70%, konsentrasi lebih dari 2500 juta/mL, dan abnormalitas tidak lebih dari 15% yang digunakan untuk pengolahan semen selanjutnya.
Alat dan Bahan
Peralatan yang digunakan adalah satu unit vagina buatan, mikroskop,
sentrifuge, inkubator, perlengkapan pengenceran, dan lemari pendingin dengan suhu 3-5oC.
Bahan yang digunakan adalah Tris (hydroxymethyl aminomethane) (Merck KgaA, Darmstadt, Germany), asam sitrat monohidrat(Merck KgaA, Darmstadt, Germany), susu kedelai (PT. Melilea internasional Indonesia), dimethilformamide
10
Indonesia), pewarna eosin negrosin (Merck KgaA, Darmstadt, Germany), miliq water, KY Jelly, dan alkohol.
Metode Penelitian
Persiapan dan Koleksi Semen dengan Vagina Buatan
Disiapkan outer layer, inner liner, air hangat, termometer, tabung penampung, KY Jelly, dan karet. Inner liner dimasukkan ke dalam outer layer dan diikat pada kedua ujungnya menggunakan karet. Tabung penampung kemudian dipasangkan pada salah satu ujung inner liner. Melalui lubang kecil pada outer layer, dimasukkan air hangat dengan memasang corong hingga inner layer
mengembang. KY Jelly dioleskan pada ujung yang besar dan suhu diukur menggunakan termometer hingga suhunya mencapai 42oC.
Koleksi semen dilakukan dengan cara memancing pejantan dengan betina yang telah di handling terlebih dahulu. Pejantan yang mulai mendekati betina dan akan menaiki betina, diputar di sekitar betina 2-3 kali (false mount) agar menghasilkan jumlah semen maksimal. Pejantan kemudian siap dikoleksi semennya dengan vagina buatan. Koleksi semen dilakukan dua kali dalam satu minggu.
Persiapan Media Pengencer
Pengencer Tris dibuat dengan cara mencampurkan 2.98 g Tris
-hydroxymethyl-aminomethane dengan 1.65 g asam sitrat monohidrat dan 2g D-fruktosa (Tambing et al. 2000), kemudian dilarutkan dalam 100 ml miliq water. Pengencer Tris soya terdiri atas 2.50%, 3.75%, 5.00% dan 6.75% susu kedelai (Melilea) dilarutkan dalam buffer Tris (Arifiantini & Yusuf 2010) (Tabel 1).
11
Tabel 1 Komposisi bahan pengencer semen cair*
Komposisi Pengencer
Penisilin (IU/mL) 10.000 10.000 10.000 10.000 10.000
Streptomisin (mg/mL) 10 10 10 10 10
Keterangan : * untuk 10 ml bahan pengencer; TKT = Tris Kuning Telur; TS2.50 = Tris Soya 2.50%;
TS3.75= Tris Soya 3.75%; TS5.00 = Tris Soya 5.00%; TS6.25= Tris Soya 6.25%.
Evaluasi Semen
Evaluasi semen dilakukan secara makroskopis dan mikroskopis. Evaluasi semen secara makroskopis meliputi pemeriksaan volume, pH, konsistensi, serta warna. Evaluasi secara mikroskopis meliputi pemeriksaan gerakan massa, motilitas dan skor individu, konsentrasi, spermatozoa hidup, serta spermatozoa abnormal (Yusuf et al. 2005).
Evaluasi secara makroskopis dapat dilakukan dengan cara:
1. Volume dapat dilihat langsung dari skala yang ditunjukkan pada tabung penampung.
2. Nilai pH semen dapat diketahui dari hasil kertas pH meter yang dicelupkan pada semen.
3. Konsistensi didapatkan dengan cara menggoyangkan tabung berisi semen, akan diperoleh hasil encer, sedang, atau kental.
4. Warna dapat dinilai langsung dengan menggunakan indra penglihatan, akan diperoleh warna putih, krem, atau kuning.
Evaluasi secara mikroskopis dapat dilakukan dengan cara: 1. Gerakan Massa
12
2. Motilitas dan Skor Individu
Gerakan individu dan motilitas dinilai dengan bantuan cairan isotonis NaCl 0.9%. Satu tetes semen dicampurkan dengan empat tetes NaCl 0.9% dan ditutup cover glass, lalu diamati dibawah mikroskop dengan pembesaran 400X. Gerakan individu spermatozoa dinilai berdasarkan kecepatan pergerakan spermatozoa tersebut dengan skala 1-5, sedangkan motilitas dinilai berdasarkan banyaknya spermatozoa yang bergerak dan dinyatakan dalam persen (%). Pemeriksaan harus dilakukan minimal pada lima lapang pandang yang berbeda. 3. Jumlah Spermatozoa Hidup
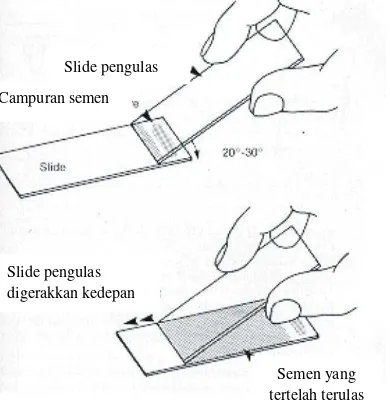
Jumlah Spermatozoa hidup dinilai menggunakan pewarnaan nigrosin. Satu tetes spermatozoa dicampur dengan empat tetes pewarna eosin-nigrosin lalu dibuat preparat ulas dan difiksasi di atas meja pemanas dan diamati dibawah mikroskop dengan pembesaran 400X. Sebanyak sepuluh lapang pandang spermatozoa dihitung. Spermatozoa hidup akan berwarna putih, sedangkan spermatozoa mati akan berwarna merah. Persentase spermatozoa hidup adalah jumlah spermatozoa hidup dibagi dengan jumlah spermatozoa hidup dan mati lalu dikalikan dengan 100%.
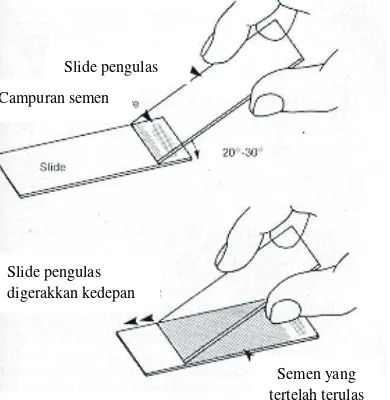
Gambar 2 Proses pewarnaan eosin-nigrosin.
Slide pengulas
Campuran semen
Slide pengulas digerakkan kedepan
13
4. Konsentrasi Spermatozoa
Sebanyak 5 mikroliter semen dicampurkan dengan 95 mikroliter formol salin. Kemudian campuran tersebut diteteskan pada counting chamber dan dihitung jumlah spermatozoa yang berada pada counting chamber tersebut. Konsentrasi spermatozoa adalah jumlah sperma dalam counting chamber x 106 dengan satuan spermatozoa per milliliter.
.
Gambar 3 Kamar hitung Neubauer dan bidang hitungnya.
Pengolahan semen cair
Semen kemudian diolah secara individual. Masing-masing ejakulat dibagi ke dalam lima tabung. Masing-masing tabung dicampur dengan pengencer TKT dan modifikasi Tris soya yaitu dengan komposisi 2.50%, 3.75%, 5.00%, dan 6.25% dengan konsentrasi spermatozoa yang digunakan adalah 50x106/mL. Semen yang telah diencerkan kemudian disimpan pada suhu 3-5ºC dan ditransportasi ke unit rehabilitasi reproduksi (URR) FKH IPB, untuk pengamatan lebih lanjut. Persentase motilitas progresif dan persentase spermatozoa hidup dievaluasi setiap 12 jam.
Pengamatan Semen Cair
14
bergerak maju ke depan dibandingkan dengan semua spermatozoa yang teramati dalam satu lapang pandang. Pengamatan persentase motilitas tersebut dilakukan dengan memberikan nilai 0 sampai dengan 100.
Persentase spermatozoa hidup akan dinilai menggunakan pewarnaan eosin-nigrosin. Satu tetes spermatozoa dicampur dengan empat tetes pewarna eosin-nigrosin lalu dibuat preparat ulas dan difiksasi di atas meja pemanas. Preparat kemudian diamati dibawah mikroskop dengan perbesaran 400X. Spermatozoa dihitung sebanyak 10 lapang pandang. Spermatozoa hidup akan berwarna putih, sedangkan spermatozoa mati akan berwarna merah. Persentase spermatozoa hidup adalah jumlah spermatozoa hidup dibagi dengan jumlah spermatozoa hidup dan mati lalu dikalikan dengan 100 .
Rancangan Percobaan
Penilaian ini dirancang dengan menggunakan rancangan acak lengkap (RAL) menggunakan tiga ekor kambing dengan tiga kali ulangan. Data yang didapat diolah menggunakan uji Anova dan jika terdapat perbedaan dilanjutkan
HASIL DAN PEMBAHASAN
Karakteristik Semen Segar
Semen yang digunakan adalah semen ejakulat pertama. Secara makroskopis volume semen yang diperoleh pada penelitian ini adalah 1.45 mL, warna krem, konsistensi kental dengan pH 6.57±0.16. Sedangkan secara mikroskopis diperoleh nilai gerakan massa +++ dengan motilitas spermatozoa dengan skor individu 4.56±0.53 (skala 1-5) dan motilitas keseluruhan adalah 79.44±1.67%. Spermatozoa hidup yang diperoleh adalah 82.25±2.58%. Konsentrasi spermatozoa adalah 3430.67±729.07 juta sel/mL, dengan spermatozoa yang abnormal sebesar 5.18±1.63% (Tabel 2).
Tabel 2 Karakteristik semen segar kambing PE
Karakteristik Semen Segar Nilai rataan
Volume (mL) 1.45±0.31
Spermatozoa Abnormal (%) 5.18±1.63
Keterangan: Gerakan massa: + (jelek) = Terlihat gelombang lemah (hampir tidak terlihat); ++ diproses lebih lanjut menjadi semen cair.
Persentase Motilitas Spermatozoa Kambing Peranakan Etawah dalam Berbagai Bahan Pengencer Pada Suhu 3-5oC
16
gerakan melingkar disebut sebagai non progressive motility (Elia et al. 2010). Motilitas spermatozoa yang progresif mempunyai peranan penting dalam pembuahan atau fertilisasi sehingga motilitas spermatozoa bisa digunakan sebagai indikator untuk fertilitas.
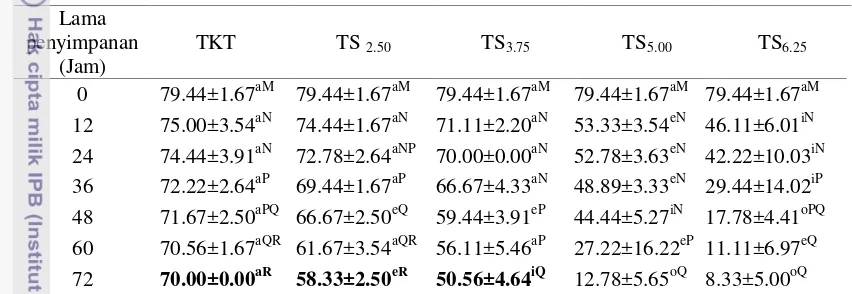
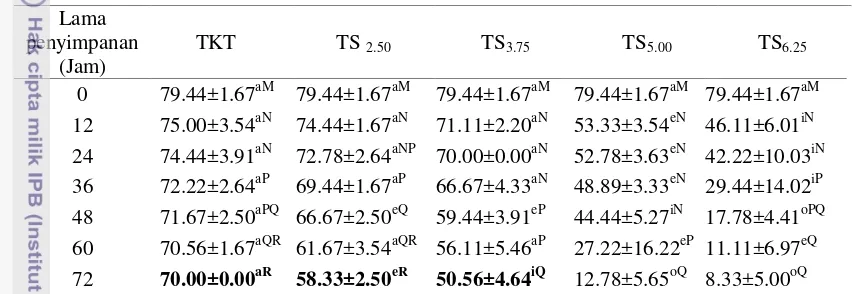
Tabel 3 Persentase motilitas spermatozoa semen cair kambing pada pengencer Tris kuning telur dan Tris Soya 12 75.00±3.54aN 74.44±1.67aN 71.11±2.20aN 53.33±3.54eN 46.11±6.01iN 24 74.44±3.91aN 72.78±2.64aNP 70.00±0.00aN 52.78±3.63eN 42.22±10.03iN 36 72.22±2.64aP 69.44±1.67aP 66.67±4.33aN 48.89±3.33eN 29.44±14.02iP 48 71.67±2.50aPQ 66.67±2.50eQ 59.44±3.91eP 44.44±5.27iN 17.78±4.41oPQ 60 70.56±1.67aQR 61.67±3.54aQR 56.11±5.46aP 27.22±16.22eP 11.11±6.97eQ 72 70.00±0.00aR 58.33±2.50eR 50.56±4.64iQ 12.78±5.65oQ 8.33±5.00oQ Huruf vokal (a, i, u, e, o) berbeda yang mengikuti angka pada baris yang sama dan Huruf konsonan (M, N, P, Q, R, S, T) berbeda yang mengikuti angka pada kolom yang sama menunjukkan berbeda nyata (P<0.05).
Spermatozoa dalam semen cair yang disimpan pada suhu 3-5oC akan mengalami penurunan sejalan dengan waktu penyimpanan. Penurunan motilitas spermatozoa berbeda nyata (p<0.05) antar pengencer ataupun antar waktu penyimpanan. Penurunan motilitas spermatozoa pada jam ke-12 penyimpanan merupakan yang tertinggi yaitu antara 4.44% pada semen dalam pengencer TKT hingga 33.33% pada pengencer TS6.25. Penurunan motilitas untuk setiap 12 jam
selanjutnya berkisar antara 0.55% (TKT) hingga 17.22% (TS5.00) (Tabel 3).
Tingginya penurunan diawal penyimpanan dapat dipahami mengingat terjadinya perubahan suhu dari suhu ruangan (28oC) ke suhu lemari es (3-5oC). Perubahan suhu tersebut akan mengakibatkan terjadinya cold shock pada spermatozoa sehingga akan merubah konfigurasi membran plasma spermatozoa (Rizal et al.
2006).
Motilitas spermatozoa pada jam ke-12 pengencer TKT, TS2.50 dan TS3.75
secara statistik menunjukkan kualitas yang sama (p>0.05), lebih tinggi dibandingkan persentase motilitas spermatozoa dalam pengencer TS5.00 dan TS6.25
17
yaitu TS2.50, TS3.75, TS5.00, dan TS6.25 menunjukkan pengencer TS2.50 dan TS3.75
mempunyai kualitas yang baik.
Penurunan motilitas spermatozoa pada waktu penyimpanan selanjutnya semakin rendah. Hal ini karena suhu rendah dapat menghambat metabolisme spermatozoa. Metabolisme spermatozoa yang terhambat menyebabkan umur spermatozoa dapat diperpanjang. Setiap 10oC penurunan suhu maka metabolisme akan dihambat 50% (Mc. Kinnon 1999). Dari empat konsentrasi sari kedelai yang diuji, hanya dua konsentrasi yang menunjukkan hasil yang cukup baik yaitu TS2.50
dan TS3.75, meskipun berbeda dengan TKT yang memiliki persentase motilitas
yang tinggi sampai penyimpanan jam ke 72.
Persentase Spermatozoa Hidup Kambing Etawah dalam Berbagai Bahan Pengencer pada Suhu 3-5oC
Spermatozoa hidup akan ditandai dengan tidak menyerap warna, sedangkan spermatozoa mati akan menyerap warna pada saat dipaparkan dengan pewarna eosin-nigrosin (Rizal 2006). Penyerapan warna terjadi akibat rusaknya membran plasma pada spermatozoa sehingga pompa sodium tidak lagi berfungsi dengan baik untuk mengatur sirkulasi zat-zat dari dan keluar sel. Spermatozoa yang masih hidup memiliki membran plasma yang utuh sehingga pompa sodium dapat berfungsi dengan baik. Enzim Na+, K+, dan ATP-ase yang terdapat pada membran plasma akan memompa kembali ion Na yang berikatan dengan pewarna eosin-nigrosin ke luar sel (Fitriani et al. 2010).
18
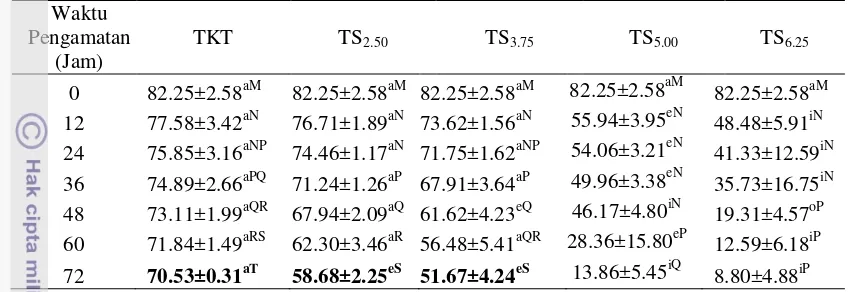
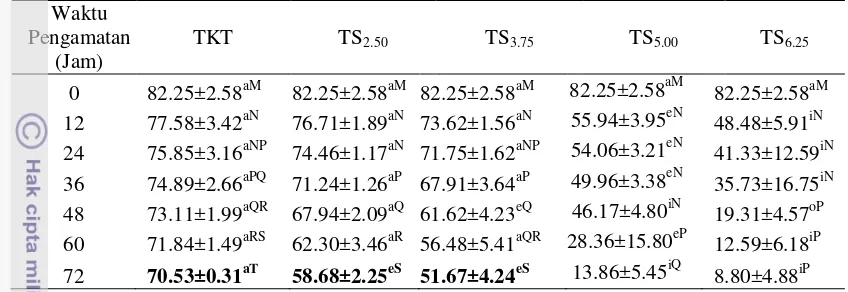
Tabel 4 Persentase spermatozoa hidup semen cair kambing pada pengencer Tris kuning telur dan Tris soya
Waktu Pengamatan
(Jam)
TKT TS2.50 TS3.75 TS5.00 TS6.25
0 82.25±2.58aM 82.25±2.58aM 82.25±2.58aM 82.25±2.58aM 82.25±2.58aM 12 77.58±3.42aN 76.71±1.89aN 73.62±1.56aN 55.94±3.95eN 48.48±5.91iN 24 75.85±3.16aNP 74.46±1.17aN 71.75±1.62aNP 54.06±3.21eN 41.33±12.59iN 36 74.89±2.66aPQ 71.24±1.26aP 67.91±3.64aP 49.96±3.38eN 35.73±16.75iN 48 73.11±1.99aQR 67.94±2.09aQ 61.62±4.23eQ 46.17±4.80iN 19.31±4.57oP 60 71.84±1.49aRS 62.30±3.46aR 56.48±5.41aQR 28.36±15.80eP 12.59±6.18iP 72 70.53±0.31aT 58.68±2.25eS 51.67±4.24eS 13.86±5.45iQ 8.80±4.88iP Huruf vokal (a, i, u, e, o) berbeda yang mengikuti angka pada baris yang sama dan Huruf konsonan (M, N, P, Q, R, S, T) berbeda yang mengikuti angka pada kolom yang sama menunjukkan berbeda nyata (P<0.05).
Konsentrasi TS2.50 dan TS3.75 merupakan pengencer terbaik antara empat
konsentrasi sari kedelai. Hal ini disebabkan karena tekanan osmotik TS2.50 dan
TS3.75 mendekati tekanan osmotik semen kambing PE. Semen kambing PE B5, 30
dan 27 mempunyai tekanan osmotik dengan rataan sebesar 237.67±5.69 mosmol/kg H2O sedangkan pengencer TKT, TS2.50, TS3.75, TS5.00, dan TS6.25
memiliki tekanan osmotik sebesar 273; 307; 358; 386; 410 mosmol/kg H2O.
Pengencer TKT, TS2,50 dan TS3,75 mempunyai tekanan osmotik yang
mendekati tekanan osmotik semen segar. Pengencer TS5.00 dan TS6.25 mempunyai
tekanan osmotik yang lebih hipertonik. Pengencer yang hipertonik menandakan bahwa molekul-molekul atau partikel-partikel diluar sel lebih banyak daripada di dalam sel. Akibatnya terjadi pengeluaran air dari dalam sel untuk mengencerkan molekul-molekul diluar sel, sehingga sel akan mengerut. Efek yang ditimbulkan adalah muncul gejala osmotic-shock pada spermatozoa yang menyebabkan kerusakan pada organel-organel intraseluler. Kerusakan organel intraseluler menyebabkan metabolisme terganggu dan pada akhirnya terjadi penurunan motilitas dan penurunan spermatozoa hidup (Tambing et al. 2003).
19
Low Density Lipoprotein (LDL) tidak mengendap. Kuning telur mengandung LDL yang dapat melindungi spermatozoa dari cold shock (Moussa et al. 2002). Selain itu, dilakukannya false mount berkali-kali diduga dapat mengurangi sekresi kelenjar bulbourethralis sehingga semen yang tertampung hanya mengandung cairan yang berasal dari kelenjar vesikularis dan kelenjar prostat.
Pengencer TKT lebih baik dibandingkan dengan pengencer TS, kemungkinan lesitin dari kuning telur lebih mampu melindungi cold shock
dibandingkan dengan lesitin dari sari kedelai. Berdasarkan komposisi kuning telur, terdapat karbohidrat sebesar 0.7-1.0%. Sekitar 0.3% karbohidrat bebas adalah glukosa dan sisanya akan berikatan pada glikoprotein dan glikolipid (Mine 2008). Pada sari kedelai tidak ditemukan adanya karbohidrat, sehingga masih dibutuhkan penelitian mengenai penambahan karbohidrat sebagai sumber energi, waktu sentrifugasi, dan kecepatan yang optimal agar tidak terjadi pengendapan lesitin yang berlebihan sehingga fungsinya dalam melindungi cold shock tidak optimal.
Secara umum hasil penelitian menunjukkan bahwa kualitas semen cair hingga jam ke-72 yang diencerkan dengan menggunakan pengencer TKT, TS2.50,
dan TS3.75 masih dapat diinseminasikan karena nilai motilitas minimal
KESIMPULAN DAN SARAN
Kesimpulan
Hasil penelitian ini dapat disimpulkan bahwa
1. Pengencer Tris kuning telur merupakan pengencer terbaik dalam mempertahankan motilitas spermatozoa dan spermatozoa hidup kambing Peranakan Etawah dibandingkan Tris soya dalam berbagai konsentrasi yang dipreservasi pada suhu 3-5oC.
2. Pengencer Tris soya dengan konsentrasi 2.50% dan 3.75% lebih baik dibandingkan dengan konsentrasi pengencer Tris soya lainnya
Saran
DAFTAR PUSTAKA
Aboalga EM, Terada T. 2004. Effect of yolk during the freezing step preservativon the viability of goat spermatozoa. Theriogenology 62:1160– 1172.
Affandhy LU, Umiyasih, Ma’sum K. 1999. Evaluasi kualitas semen beku sapi Madura dengan berbagai diluter dan kandungan kuning telur yang berbeda. Pros. Seminar Nasional Peternakan dan Veteriner. Bogor, 1 – 2 Desember 1998. Puslitbang Peternakan 233–239.
Aires et al. 2003. In vitro and in vivo comparison of egg yolk-based and soybean lecithin-based extenders for cryopreservation of bovine semen.
Theriogenology 60:269-279.
Amirat L, Tainturier D, Jeanneau L, Thorin C, Gerard O, Courtens JL, Anton M. 2004. Bull semen in vitro fertility after cryopreservation using egg yolk LDL: a comparison with optidyl, a commercial egg yolk extender.
Theriogenology 61:895-907.
Arifiantini RI, Yusuf TL. 2010. Developing of Tris soy milk diluent for Frisian Holstein bull frozen semen. Hayati 17(2):91-94.
Axnér E, Hermansson U, Linde-Forsberg C. 2004. The effect of equex STM paste and sperm morphology on post thaw survival of cat epididymal spermatozoa.
Anim Reprod Sci 84:179-191.
Axnér E, Linde-Forsberg C. 2002. Semen collection and assessment and artificial insemination in the cat. Uppsala: Department of Obstetrics and Gynecology, Swedish University of Agricultural Sciences.
Balai Penelitian Ternak. 2001. Kambing PE penghasil daging sekaligus susu. Warta penelitian dan pengembangan pertanian 23(4).
Baran et al. 2004. Freezing of cat semen in straw with different glycerol levels containing Tris extender. Turk J Vet Anim Sci 28:545-552.
Blakely J, Bade DH. 1998. Ilmu Peternakan. Edisi ke Lima. Terjemahan: B. Srigandono. Yogyakarta: Gajah Mada University Press.
Campbell JR, Kenealy MD, Campbell KL. 2003. Animal Science. 4th Ed. New York: Mc Graw-Hill.
[DEPTAN] Departemen Pertanian. 2011. Ciri-ciri dan informasi mengenai kambing Peranakan Etawa (PE). http://www.deptan.go.id/dinakkeswan_ jateng/detaildata.php?id=284 [25 Februari 2012]
22
Dong UA, Sang HL, Haribabu S, Eun JL, Jae CK. 2006. Sequential separation of main component from chicken egg yolk. Food Sci and Biotechnol
12(2):189–195.
Elia et al. 2010. The importance of sperm motility classes – Future directions. The Open Andrology Journal 2.
Ensminger ME. 2002. Sheep and Goat Science. 6th edit. Illionis: Interstate Publisher, Inc.
Erlankgha M. 2009. Kambing Etawa. http://www.infoternak.com/kambing-etawa [26 Februari 2012]
Fitriani, Eriani K, Sari W. 2010. The effect of cigarettes smoke exposured cause fertility of male mice (Mus musculus). J Natural 10(2). Rodriguez Martinez H. 2000. Functional sperm parameters and fertility of bovine semen extended in biociphos plus and triladyl. Reprod Dom Anim
35:69-77.
Herdis, Yulnawati, Setiadi MA. 2003. Pemanfaatan sari buah melon sebagai media pengencer semen cair alternatif spermatozoa domba Garut. J Sains dan Teknologi Indonesia 5(5):126-131.
Holt WV. 2000. Basic aspects of frozen storage of semen. Anim Reprod Sci 62:3– 22.
Junaidi A. 2006. Reproduksi dan Obstetri pada Anjing. Yogyakarta: Gajah Mada University Press.
Juneja LR, Sugino H, Fujiki M, Kim M, Yamamoto T. 1994. Preparation of Pure Phospholipid from Egg Yolk. Di dalam : Sim SJ, Nakai S, editor. Egg Uses and Processing Technologies (New Developments). Wallingford, UK: CAB International.
Kartinaty T dan Gufroni LM. 2010. Budidaya kambing peranakan etawa. Kalimantan Barat: Balai Pengkajian Teknologi Pertanian.
Khalifa TAA, El-Saidy BE. 2006. Pellet-freezing of Damascus goat semen in a chemically defined extender. Anim Reprod Sci 93:303–315
Kusuma BD dan Irmansah. 2009. Menghasilkan Kambing Peranakan Etawa Jawara Kontes. Tangerang: Agromedia Pustaka.
Leboeuf B, Restall B, Salamon S. 2000. Production and storage of goat semen for artificial insemination. Anim Reprod Sci 62:113-141.
23
Mayes PA. 1999. Struktur dan Fungsi Vitamin yang Larut dalam Lemak. Dalam : Biokimia Harper. lipoprotein extracted from hen egg yolk by an easy method : cryoprotective effect on frozen-thawed bull semen. Theriogenology 57:1591–1762.
Ogbuewu IP, Aladi NO, Etuk IF, Opara MN, Uchegbu MC, Okoli IC, Iloeje MU. 2010. Relevance of oxygen free radicals and antioxidants in sperm production and function. Research J of Vet Sci 3(3):138-164.
Pellicer-Rubio MT, Magallon T, Combarnous Y, 1997. Deterioration of goat sperm viability in milk extenders is due to a bulbourethral 60-kilodalton glycoprotein with triglyceride lipase activity. Biol Reprod 57:1023–1031. Rizal M. 2006. Pengaruh penambahan laktosa di dalam pengencer tris terhadap
kualitas semen cair. J Indon Trop Anim Agic 31(4).
Rizal M, Surachman M, Herdis, Aku AS. 2006. Peranan plasma semen dalam mempertahankan kualitas spermatozoa asal epididimis domba yang disimpan pada suhu rendah (3-50C). JITV 11:287-294.
Rusdin. 2006. Karakteristik semen segar pejantan kambing peranakan Etawa (PE) di balai pembibitan ternak dan hijauan makanan ternak garahan, Silo-Jember.
J Agrisains 7(2):121-127.
[SNI] Standar Nasional Indonesia 01-4869.1-2005. Semen Beku Sapi. Badan Standardisasi Nasional.
Santiago-Moreno et al. 2008. A comparison of the protective action of chicken and quail egg yolk in the cryopreservation of Spanish ibex epididymal spermatozoa. Cryobiol 57:25–29.
Setiadi B, Sutama IK. 1997. Kambing PE, Kambing Perah Indonesia. Bogor: Balai Penelitian Ternak.
Shurtleff W, Aoyagi A. 2004. Soyfoods Center : A chapter from the unpublished manuscript, history of soybeans and soyfoods. 110 B.C. to the 1980s. Lafayette, California.
Souhoka FD, Matatula MJ, Mesang-Nalley WM, Rizal M. 2009. Laktosa mempertahankan daya hidup spermatozoa kambing Peranakan Etawah yang di preserfasi dengan plasma semen domba Priangan. J Veteriner 10(3). Tambing SN, Sutama IK, Arifiantini RI. 2003. Efektifitas konsentrasi laktosa
dalam pengencer Tris terhadap viabilitas semen cair kambing Seanen. JITV
8(2):84-90.
24
Tambing SN, Toeelihere MR, Yusuf TL, Sutama IK. 2000. Pengaruh gliserol dalam pengencer tris terhadap kualitas semen beku kambing Peranakan Etawah. JITV 5(2).
Thun R, Hurtado M, Janet F. 2002. Comparison of Biochipos-Plus® and tris egg yolkextender for cryopreservation of bull semen. Theriogenology 57:1087– 1094.
Van Wagtendonk-Leeuw AM, Haring RM, Kaal-Landsbergen LMTE, den Daas JHG. 2000. Fertility results using bovine semen cryopreserved with extenders based on egg yolk and soybean extract. Theriogenology 54:57-67.
LAMPIRAN
Lampiran 1. Hasil Sidik Ragam Uji Faktorial (5 x 7) pengaruh jenis pengencer dan waktu pengamatan terhadap persentase spermatozoa motil
Sumber Keragaman Derajat
Lampiran 2. Hasil Sidik Ragam Uji Faktorial (5 x 7) pengaruh jenis pengencer dan waktu pengamatan terhadap persentase spermatozoa hidup
PENDAHULUAN
Latar Belakang
Teknologi reproduksi perlu diupayakan untuk meningkatkan populasi dan mutu genetik ternak. Berbagai teknologi reproduksi seperti inseminasi buatan (IB), fertilisasi in vitro, transfer embrio, sampai dengan teknik intra cytoplasmic sperm injection (ICSI) telah berkembang pesat (Foote 2000), tetapi untuk kondisi di Indonesia, IB adalah satu-satunya teknologi reproduksi yang paling aplikatif dan telah memasyarakat secara luas. Teknik IB adalah pemasukan atau penyampaian semen ke dalam saluran reproduksi betina dengan menggunakan alat-alat buatan manusia. Teknik IB dirasakan banyak memberikan manfaat bagi perkembangan dunia peternakan, antara lain dapat mengoptimalkan penggunaan pejantan-pejantan unggul (Campbell et al. 2003).
Inseminasi buatan (IB) adalah salah satu alat bantu dalam penerapan program pemuliabiakan ternak. Teknologi IB mempunyai peranan penting dalam sistem pemuliabiakan ternak kambing terutama untuk mengontrol reproduksi dan meningkatkan potensi genetik hasil persilangannya (produksi susu dan daging). Terdapat dua tujuan utama penerapan teknologi IB pada kambing, yaitu mengoptimalkan program seleksi dan merupakan sarana untuk mengontrol waktu kelahiran (Leboeuf et al. 1998).
Semen beku kambing telah diproduksi oleh beberapa balai inseminasi menggunakan pengencer Tris kuning telur. Kuning telur dan susu merupakan bahan yang berasal dari hewan dan mempunyai kemungkinan mengandung material biologi berbahaya yang dapat menular pada spermatozoa (Van Wagtendonk-de Leeuw et al. 2000). Pellicer-Rubio et al. (1997) melaporkan bahwa semen cair atau semen beku jika menggunakan bahan pengencer yang mengandung kuning telur ataupun susu memiliki kualitas yang rendah. Rendahnya kualitas semen diduga akibat sekresi kelenjar bulbouretralis [bulbourethral gland secretion (BUS)] yang terkandung dalam plasma semen kambing. Sekresi kelenjar bulbouretralis tersebut mengandung enzim
Phospholipase A yang disebut juga egg yolk coagulating enzyme. Enzim ini dapat menghidrolisis phospholipid dari kuning telur menjadi lysophospholipid seperti
2
susu mengandung phospholipid dalam pengencer yang sangat dibutuhkan karena dapat melindungi spermatozoa dari cold shock pada saat pendinginan ataupun pembekuan (Amirat et al. 2004).
Upaya penggunaan phospholipid dari bahan tanaman telah dilakukan sejak tahun 2000an. Perusahaan komersial yang bergerak dibidang IB memperkenalkan penggunaan lesitin yang berasal dari kedelai sebagai pengencer yang memiliki kemampuan sebagai krioprotektan (Aires et al. 2003; Gill et al.
2000). Produk tersebut telah dijual dipasaran dengan beberapa merek seperti Biociphos (IMV, L’Aigle, France) dan Andromed (Minitub, Germany). Kedua produk ini mengandung ekstrak kacang kedelai sebagai pengganti kuning telur pada saat preservasi. Dihilangkannya kandungan kuning telur dan susu diharapkan terhindar dari isu adanya bahaya biologis dan bakterial yang dapat mempengaruhi kualitas spermatozoa. Pengencer tersebut meskipun digunakan untuk pengencer semen sapi, tetapi dapat juga digunakan untuk pengencer semen kambing.
Pengencer Andromed telah digunakan di beberapa Balai Inseminasi Buatan (BIB) dengan hasil yang sangat memuaskan. Masalahnya adalah pengencer tersebut harus diimpor dari negara lain, sehingga tidak selalu tersedia pada saat dibutuhkan. Selain itu kandungan lesitin dalam pengencer tersebut memerlukan suhu penyimpanan 5ºC. Selama transportasi, kendala pengiriman dan masalah lainnya sering mengakibatkan pengencer tersebut tertahan di bandara yang diduga penyimpanannya tidak sesuai dengan prosedur, akibatnya kualitas semen beku yang dihasilkan menjadi terganggu. Hal ini mendorong pemikiran untuk membuat pengencer alternatif yang berasal dari susu kedelai untuk menggantikan pengencer komersial.
3
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji dan mencari konsentrasi sari kedelai yang tepat dalam buffer Tris untuk pengencer semen cair kambing Peranakan Etawah (PE).
Manfaat
Penelitian ini diharapkan dapat menghasilkan pengencer alternatif yang berasal dari susu kedelai sebagai pengganti pengencer komersial.
Rumusan Masalah
Serangkaian penelitian telah dilakukan dalam preservasi semen diantaranya adalah daya tahan semen cair kambing peranakan etawah dalam pengencer kuning telur dengan kemasan dan konsentrasi spermatozoa yang berbeda dan pengembangan pengencer Tris Soya pada sapi FH. Pada penelitian tersebut telah didapat sejumlah informasi diantaranya konsentrasi spermatozoa yang paling tepat dan kemasan semen beku yang paling baik. Pada penelitian kedua telah didapat konsentrasi susu kedelai yang paling tepat dalam pengencer Tris dan angka konsepsi dari hasil IB menggunakan pengencer Tris soya. Pada penelitian ini akan dilakukan menggunakan teknik yang sama seperti yang telah dilakukan sebelumnya. Konsentrasi sari kedelai yang digunakan adalah 2.5%, 3.75%, 5.00%, dan 6.25% berat dalam volume (w/v) berdasarkan dari hasil
TINJAUAN PUSTAKA
Tinjauan Umum Kambing Peranakan Etawah (PE)
Klasifikasi
Kambing merupakan hewan pertama yang didomestifikasi oleh manusia. Hewan ini awalnya hidup di daerah yang sulit dan berbatu. Pemburu sering membawa pulang hasil tangkapan berupa anak kambing liar yang kemudian dimanfaatkan susu, daging, dan kulitnya (Blakely & Bade 1998). Ensminger (2002) menyatakan kambing diklasifikasikan sebagai berikut:
Kerajaan : Animalia Subordo : Ruminansia Familia : Bovidae Subfamilia : Caprinae Genus : Capra
Spesies : Capra hircu
Kambing menyebar ke berbagai pelosok dunia dan beradaptasi menghasilkan nilai fungsional yang berbeda-beda, ada yang cocok sebagai kambing pedaging, kambing penghasil susu, penghasil bulu, maupun kambing penghasil susu sekaligus daging. Kambing Etawah adalah kambing unggul yang berasal dari India. Kambing ini merupakan kambing unggul dwiguna yaitu potensial penghasil susu dan daging (Kusuma & Irmansah 2009). Orang Belanda banyak membawa kambing ini ke daerah Yogyakarta karena daerah ini pernah menjadi pusat pemerintahan. Kambing Etawah saat ini berkembang baik di daerah Yogyakarta. Kambing ini juga sering dikenal dengan sebutan kambing Benggala atau kambing Jamnapari sesuai daerah asalnya di India (DEPTAN 2011).
Kambing Peranakan Etawah (PE)
5
Gambar 1 Kambing Peranakan Etawah
Ciri-ciri spesifik kambing PE antara lain panjang telinga berkisar antara 18-30 cm, bobot badan jantan dewasa 40 Kg sedangkan betina 35 Kg, tinggi pundak berkisar antara 76-100 cm, warna bulu bervariasi dari coklat sampai hitam (Kartinaty & Gufroni 2010). Kambing PE betina di Indonesia dapat menghasilkan susu rata-rata 2-3 liter per ekor per hari dengan masa laktasi lebih dari 150 hari (Direktorat Jenderal Bina Produksi Peternakan 2003). Kambing PE dapat beranak tiga kali dalam dua tahun dengan rataan jumlah kelahiran 1-3 ekor (Balai Penelitian Ternak 2001). Rataan bobot lahir kambing PE kelahiran tunggal betina dan jantan masing-masing 3.2 dan 3.7 kg (Setiadi & Sutama 1997)
Semen Cair
6
penyangga, komponen isotonis dan pelindung terhadap kejutan dingin (cold shock) yang terjadi selama penyimpanan pada suhu rendah.
Semen yang diperoleh dari pejantan harus diencerkan dengan pengencer tertentu agar dapat didistribusikan ke beberapa betina dalam rangkaian program IB. Selain untuk memperbanyak volume, pengencer tersebut harus memenuhi beberapa kriteria yaitu, 1) mengandung sumber energi untuk kelangsungan hidup spermatozoa seperti fruktosa, glukosa, dan laktosa. 2) mengandung anti kejutan dingin (cold shock) seperti lipoprotein dan lesitin. 3) mempunyai kemampuan sebagai larutan penyangga seperti sitrat, Tris, dan phosphate. 4) memiliki keseimbangan elektrolit. 5) mengandung antibiotika yang melindungi semen dari kontaminasi mikroba (Herdis et al. 2003).
Bahan Pengencer Semen
Buffer Tris
Salah satu media pengencer yang umum digunakan adalah Tris. Tris memiliki toksisitas rendah dan sistem penyanggah yang baik dengan mempertahankan pH, tekanan osmotik dan keseimbangan elektrolit (Affandhy et al. 1999). Sebagai pengencer semen cair, Tris sering dicampur dengan karbohidrat yang berfungsi sebagai sumber energi bagi spermatozoa. Beberapa penelitian
buffer spermatozoa yang dilakukan oleh Baran et al. (2004) menggunakan dalam bahan pengencer agar dapat melindungi spermatozoa pada saat perubahan suhu dari suhu ruang (28oC) pada saat pengolahan ke suhu ekulibrasi (5oC). Anti
7
susunan utama membran spermatozoa. Kedelai memiliki kecenderungan terkontaminasi bakterial lebih kecil daripada kuning telur. Lesitin dari kacang kedelai merupakan pilihan yang tepat sebagai sumber lesitin bahan pengencer semen dimasa yang akan datang (Aires et al. 2003). Kacang kedelai juga mampu menekan stres oksidatif (Ogbuewu et al. 2010). Kacang kedelai yang belum maupun yang sudah mengalami penyulingan memiliki kandungan phospholipid
antara lain phosphatidylcholine 17.50% dan 23.00%, phosphatidylethanolamine
15.00% dan 20.00%, glikolipid 13-16%, phospholipid lainnya 14-18% dan trigliserida 2-4% (Shurtleff & Aoyagi 2004).
Lesitin kacang kedelai memiliki bahan-bahan yang mirip dengan lesitin pada kuning telur yang digunakan untuk perlindungan terhadap cold shock pada saat kriopreservasi (Thun et al. 2002; Aires et al. 2003 ). Meskipun lesitin dari bahan nabati seperti lesitin dari kacang kedelai banyak tersedia, akan tetapi lesitin dari kuning telur masih banyak digunakan untuk pembekuan semen (Aires et al. 2003;Santiago-Moreno et al. 2008).
Pengencer Kuning telur
Kuning telur merupakan komponen yang paling umum digunakan pada bahan pengencer untuk kriopreservasi karena terbukti memiliki efek yang menguntungkan sebagai pelindung dari membran plasma dan akrosom terhadap
cold shock (Amirat et al. 2004). Kandungan phospholipid, kolesterol dan low-density lipoprotein pada kuning telur berfungsi melindungi spermatozoa dari kejutan dingin selama proses pembekuan.
Kuning telur mempunyai sifat sebagai penyangga tekanan osmotik sehingga spermatozoa lebih toleran terhadap lingkungan yang hipotonik atau hipertonik (Khalifa dan El-Saidy, 2006). Kandungan beberapa senyawa dalam kuning telur penting untuk kelangsungan hidup spermatozoa selama penyimpanan. Komposisi phospholipid kuning telur menurut Juneja et al. (1994) terdiri atas
phosphatidylcholine (lesitin) 80.8%, phosphatidylethanolamine 11.7%,
lysophosphatidylcholine 1.9%, sphingomyelin 1.9%, serta lemak netral (nonpolar) dan bahan lain 3.7%. Menurut Dong et al. (2006), komposisi phospholipid kuning telur terdiri atas 77% phosphatidylcholine (lesitin), 3% sphingomyelin, dan 18%
8
MATERI DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Unit Rehabilitasi Reproduksi (URR), Reproduksi dan Kebidanan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penampungan semen dilakukan di Koperasi Kambing Perah, Cikarawang, Bogor. Penelitian dilaksanakan pada bulan Mei – Agustus 2011.
Materi Penelitian
Sumber Semen
Hewan yang dipergunakan sebagai sumber semen adalah tiga ekor kambing Peranakan Etawah (PE) yaitu pejantan dengan nomor ear tag 27, 30, dan B5. Kambing PE yang digunakan merupakan jantan dewasa kelamin yang ditempatkan dalam kandang individual yang dilengkapi dengan tempat pakan dan minum. Pakan yang diberikan berupa hijauan segar 10% per bobot badan dan konsentrat 10% dari pakan rumput, serta air minum yang diberikan secara ad libitum.
Pejantan unggul yang digunakan, yakni berumur antara 2 – 3.5 tahun dengan bobot badan antara 65 – 95 kg, serta memiliki kualitas semen yang baik, yakni motilitas lebih dari 70%, konsentrasi lebih dari 2500 juta/mL, dan abnormalitas tidak lebih dari 15% yang digunakan untuk pengolahan semen selanjutnya.
Alat dan Bahan
Peralatan yang digunakan adalah satu unit vagina buatan, mikroskop,
sentrifuge, inkubator, perlengkapan pengenceran, dan lemari pendingin dengan suhu 3-5oC.
Bahan yang digunakan adalah Tris (hydroxymethyl aminomethane) (Merck KgaA, Darmstadt, Germany), asam sitrat monohidrat(Merck KgaA, Darmstadt, Germany), susu kedelai (PT. Melilea internasional Indonesia), dimethilformamide
10
Indonesia), pewarna eosin negrosin (Merck KgaA, Darmstadt, Germany), miliq water, KY Jelly, dan alkohol.
Metode Penelitian
Persiapan dan Koleksi Semen dengan Vagina Buatan
Disiapkan outer layer, inner liner, air hangat, termometer, tabung penampung, KY Jelly, dan karet. Inner liner dimasukkan ke dalam outer layer dan diikat pada kedua ujungnya menggunakan karet. Tabung penampung kemudian dipasangkan pada salah satu ujung inner liner. Melalui lubang kecil pada outer layer, dimasukkan air hangat dengan memasang corong hingga inner layer
mengembang. KY Jelly dioleskan pada ujung yang besar dan suhu diukur menggunakan termometer hingga suhunya mencapai 42oC.
Koleksi semen dilakukan dengan cara memancing pejantan dengan betina yang telah di handling terlebih dahulu. Pejantan yang mulai mendekati betina dan akan menaiki betina, diputar di sekitar betina 2-3 kali (false mount) agar menghasilkan jumlah semen maksimal. Pejantan kemudian siap dikoleksi semennya dengan vagina buatan. Koleksi semen dilakukan dua kali dalam satu minggu.
Persiapan Media Pengencer
Pengencer Tris dibuat dengan cara mencampurkan 2.98 g Tris
-hydroxymethyl-aminomethane dengan 1.65 g asam sitrat monohidrat dan 2g D-fruktosa (Tambing et al. 2000), kemudian dilarutkan dalam 100 ml miliq water. Pengencer Tris soya terdiri atas 2.50%, 3.75%, 5.00% dan 6.75% susu kedelai (Melilea) dilarutkan dalam buffer Tris (Arifiantini & Yusuf 2010) (Tabel 1).
11
Tabel 1 Komposisi bahan pengencer semen cair*
Komposisi Pengencer
Penisilin (IU/mL) 10.000 10.000 10.000 10.000 10.000
Streptomisin (mg/mL) 10 10 10 10 10
Keterangan : * untuk 10 ml bahan pengencer; TKT = Tris Kuning Telur; TS2.50 = Tris Soya 2.50%;
TS3.75= Tris Soya 3.75%; TS5.00 = Tris Soya 5.00%; TS6.25= Tris Soya 6.25%.
Evaluasi Semen
Evaluasi semen dilakukan secara makroskopis dan mikroskopis. Evaluasi semen secara makroskopis meliputi pemeriksaan volume, pH, konsistensi, serta warna. Evaluasi secara mikroskopis meliputi pemeriksaan gerakan massa, motilitas dan skor individu, konsentrasi, spermatozoa hidup, serta spermatozoa abnormal (Yusuf et al. 2005).
Evaluasi secara makroskopis dapat dilakukan dengan cara:
1. Volume dapat dilihat langsung dari skala yang ditunjukkan pada tabung penampung.
2. Nilai pH semen dapat diketahui dari hasil kertas pH meter yang dicelupkan pada semen.
3. Konsistensi didapatkan dengan cara menggoyangkan tabung berisi semen, akan diperoleh hasil encer, sedang, atau kental.
4. Warna dapat dinilai langsung dengan menggunakan indra penglihatan, akan diperoleh warna putih, krem, atau kuning.
Evaluasi secara mikroskopis dapat dilakukan dengan cara: 1. Gerakan Massa
12
2. Motilitas dan Skor Individu
Gerakan individu dan motilitas dinilai dengan bantuan cairan isotonis NaCl 0.9%. Satu tetes semen dicampurkan dengan empat tetes NaCl 0.9% dan ditutup cover glass, lalu diamati dibawah mikroskop dengan pembesaran 400X. Gerakan individu spermatozoa dinilai berdasarkan kecepatan pergerakan spermatozoa tersebut dengan skala 1-5, sedangkan motilitas dinilai berdasarkan banyaknya spermatozoa yang bergerak dan dinyatakan dalam persen (%). Pemeriksaan harus dilakukan minimal pada lima lapang pandang yang berbeda. 3. Jumlah Spermatozoa Hidup
Jumlah Spermatozoa hidup dinilai menggunakan pewarnaan nigrosin. Satu tetes spermatozoa dicampur dengan empat tetes pewarna eosin-nigrosin lalu dibuat preparat ulas dan difiksasi di atas meja pemanas dan diamati dibawah mikroskop dengan pembesaran 400X. Sebanyak sepuluh lapang pandang spermatozoa dihitung. Spermatozoa hidup akan berwarna putih, sedangkan spermatozoa mati akan berwarna merah. Persentase spermatozoa hidup adalah jumlah spermatozoa hidup dibagi dengan jumlah spermatozoa hidup dan mati lalu dikalikan dengan 100%.
Gambar 2 Proses pewarnaan eosin-nigrosin.
Slide pengulas
Campuran semen
Slide pengulas digerakkan kedepan
13
4. Konsentrasi Spermatozoa
Sebanyak 5 mikroliter semen dicampurkan dengan 95 mikroliter formol salin. Kemudian campuran tersebut diteteskan pada counting chamber dan dihitung jumlah spermatozoa yang berada pada counting chamber tersebut. Konsentrasi spermatozoa adalah jumlah sperma dalam counting chamber x 106 dengan satuan spermatozoa per milliliter.
.
Gambar 3 Kamar hitung Neubauer dan bidang hitungnya.
Pengolahan semen cair
Semen kemudian diolah secara individual. Masing-masing ejakulat dibagi ke dalam lima tabung. Masing-masing tabung dicampur dengan pengencer TKT dan modifikasi Tris soya yaitu dengan komposisi 2.50%, 3.75%, 5.00%, dan 6.25% dengan konsentrasi spermatozoa yang digunakan adalah 50x106/mL. Semen yang telah diencerkan kemudian disimpan pada suhu 3-5ºC dan ditransportasi ke unit rehabilitasi reproduksi (URR) FKH IPB, untuk pengamatan lebih lanjut. Persentase motilitas progresif dan persentase spermatozoa hidup dievaluasi setiap 12 jam.
Pengamatan Semen Cair
14
bergerak maju ke depan dibandingkan dengan semua spermatozoa yang teramati dalam satu lapang pandang. Pengamatan persentase motilitas tersebut dilakukan dengan memberikan nilai 0 sampai dengan 100.
Persentase spermatozoa hidup akan dinilai menggunakan pewarnaan eosin-nigrosin. Satu tetes spermatozoa dicampur dengan empat tetes pewarna eosin-nigrosin lalu dibuat preparat ulas dan difiksasi di atas meja pemanas. Preparat kemudian diamati dibawah mikroskop dengan perbesaran 400X. Spermatozoa dihitung sebanyak 10 lapang pandang. Spermatozoa hidup akan berwarna putih, sedangkan spermatozoa mati akan berwarna merah. Persentase spermatozoa hidup adalah jumlah spermatozoa hidup dibagi dengan jumlah spermatozoa hidup dan mati lalu dikalikan dengan 100 .
Rancangan Percobaan
Penilaian ini dirancang dengan menggunakan rancangan acak lengkap (RAL) menggunakan tiga ekor kambing dengan tiga kali ulangan. Data yang didapat diolah menggunakan uji Anova dan jika terdapat perbedaan dilanjutkan